INDUKSI MUTAGENESIS DAN APLIKASI PENANDA PCR MEMPERCEPAT PENEMUAN CALON VARIETAS UNGGUL
JERUK BARU
(Induce Mutagenesis and Application of PCR Marker to Accelerate the Invention of New Superior Citrus Variety)
1 2
Dita Agisimanto dan Ismiyati Sutarto 1
BALAI PENELITIAN TANAMAN JERUK DAN BUAH SUBTROPIKA
2
PPPTIR - BATAN
ABSTRAK
Induksi mutagenesis dikombinasi dengan penanda molekular telah digunakan secara luas untuk mengembangkan tanaman yang dibiakkan secara vegetatif dalam waktu yang relatif lebih cepat dibanding cara-cara konvensional. Perbaikan varietas jeruk difokuskan untuk mengembangkan variasi genetik baru terutama untuk memperbaiki kualitas buah seperti berbiji sedikit, kemudahan mengelupas kulit buah dan memiliki tipe buah mandarin, ketahanan terhadap penyakit melalui teknologi radiasi, fusi protoplasma dan persilangan. Kebanyakan varietas jeruk memiliki kekerabatan yang dekat, akibat mutasi yang menambah sifat yang spesifik. Kemajuan metode bioteknologi memberikan kontribusi yang besar dalam aplikasi metode induksi mutasi seperti radiasi dan senyawa kimia untuk penciptaan dan penambahan variasi pada suatu varietas dibandingkan mutasi spontan yang frekuensinya sangat rendah. Kombinasi teknik mutasi dan metode kultur jaringan dalam pembentukan variasi, seleksi dan multiplikasi varian baru, dapat mempercepat program pemuliaan tanaman jeruk. Bukti telah ditunjukkan oleh berbagai hasil penelitian di berbagai jenis tanaman. Variasi tersebut disebabkan oleh perubahan jumlah atau struktur kromosom, mutasi tunggal, rekombinasi mitosis, delesi, transposisi atau metilasi sekuen DNA, mikondria atau kloroplas. Jika menggunakan variabel morfologi, pembedaan diantara varietas baik tetua maupun turunannya menjadi sulit. Penanda molekuler berbasis PCR sudah banyak digunakan seperti RAPD, SSR, AFLP and Transposon. Introduksi penanda DNA akan membuka peluang baru bagi identifikasi variasi akibat induksi mutasi.
Kata kunci : Jeruk, mutagenesis, penanda DNA.
ABSTRACT
Induce mutagenesis combined with molecular markers was equipped to improve vegetative propagated plants crops faster than conventional methods. Breeding for citrus was focused on to improve new variant having high qualities of fruit, earlier maturity and diseases resistance through radiation, protoplasm fusion and cross-hybridization. Most of citrus has close relatedness due to natural mutagenesis which is increasing their variation. The advanced of biotechnology methods provided high contribution in induced mutagenesis
methods such as radiation and chemical mutagen application in creating new variation of commercial lines. Combination of mutagenesis techniques and tissue culture and also integrated molecular from inducing variation, plant development and selection have accelerated breeding program of such citrus characters. New variants were detected due to chromosomal re-arrangement, point mutation, mitosis recombination, deletion, transposition or methylation of DNA sequences, mitochondria and chloroplast. It is difficulty to use morphological characters on mutant's selection. PCR based markers was frequently used to select mutants such as RAPD SSR, AFLP and also retrotransposons. Introduction this markers for mutants selection would increase the chance to get new mutant; earlier, faster, accurate, stable and accountable.
Keywords : Citrus, molecular marker, mutagenesis.
PENDAHULUAN
Peningkatan kualitas buah jeruk manis, grapefruit dan mandarin (keprok/siam) yang berbiji sedikit (seedless) dengan kulit yang mudah dikupas (easy-peeling), dan tipe buah mandarin merupakan kebutuhan penting untuk perdagangan buah segar (Spiegel-Roy dan Goldschmidt, 1996; Varoquaux et al., 2000). Jeruk tradisional Indonesia yang komersial seperti Manis Pacitan, Siam Pontianak, Siam Madu, Keprok Garut, keprok Batu55, Pamelo Nambangan, perlu dikembangkan untuk mendapatkan varietas baru yang memiliki kualitas buah yang lebih baik.
Varietas baru jeruk umumnya muncul dari hasil perpindahan benih antar lokasi dan mutasi cabang. Hanya sedikit varietas baru yang diperoleh dari program pemuliaan. Varietas-varietas jeruk terpenting di dunia pun seperti Washington Navel, Satsuma, Clementines juga berasal dari mutasi sel somatic (tunas) (Spiegel-Roy dan Goldschmidt 1996). Fenomena ini hampir selalu terjadi di dalam berbagai spesies dan genus. Proses ini terjadi diluar kontrol manusia, hanya ditemukan karena peluang kejadian dan ketajaman 'petani' yang mengusahakan dalam melihat potensi tanaman dan produk sehingga mendapatkan hasil 'genotipe' baru yang baik.
Sementara perbaikan genetik Citrus spp melalui hibridisasi dihambat dan dibatasi oleh sifat heterozigositas yang tinggi, tipe reproduktif melalui embrio nuselar dan juga juvenilitas, yang berujung kepada kebutuhan seleksi yang besar. Kebanyakan sifat adalah poligenik, sehingga dikontrol oleh banyak gen. Probabilitas gen-gen yang berekombinasi pada hibrida untuk menyusun kembali karakter-karakter penting dari varietas tradisional terdahulu sangat rendah. Pemuliaan jeruk juga dihambat dengan tingginya juvenilitas pada bibit nuselar dan zigot. Berbagai kesulitan yang muncul dari penyerbukan silang konvensional untuk perakitan varietas baru sebagian dapat diatasi dengan strategi baru
program pemuliaan jeruk melalui radiasi matatunas (Spiegel-Roy dan Goldschmidt, 1996), fusi protoplas (Grosser dan Gmitter, 1990), produksi tanaman jeruk transgenik (Vardi et al., 1990).
Tipe mutasi tunas umumnya berbeda dengan induknya yang sebagian bisa dijelaskan menggunakan fenomena mutasi alami chimera dan sebagian tidak bisa dijelaskan (Assin, et al., 1999). Mutasi tunas pada jeruk juga semakin menarik karena adanya peristiwa mutasi paralel (parallel mutation) yaitu kejadian mutasi yang sama di dalam sejumlah spesies dan varietas seperti daun variegata, daun-daun sempit (willow leaves), daging buah berwarna pink (pink-flesh fruit), penggandaan navel, dan atau buah yang bergelombang (corrugated fruit). Fenomena ini pada akhirnya menjadi topik diskusi dan pertanyaan sejumlah peneliti seperti Assin et al. (1999), apakah mutasi tunas ini karena keterlibatan gen-gen yang sama atau aberasi somatik atau perubahan pola metilasi DNA pada genom atau aktivasi elemen transposable?
Induksi Mutagenesis Pada Jeruk
Secara umum, radiasi seperti sinar gamma paling banyak digunakan untuk menghasilkan karakter yang diinginkan untuk pemuliaan tanaman. Teknik ini sudah banyak digunakan diberbagai spesies tanaman, termasuk yang memiliki variasi genetik yang sempit, untuk memperbaiki karakter spesifik di dalam kultivar lokal yang adaptif pada lingkungan spesifik. Induksi keragaman genetik itu dapat melalui aplikasi mutagen (fisik dan kimia) atau kultur jaringan. Radiasi pengion seperti sinar gamma merupakan agen radiasi yang paling efektif untuk pemuliaan tanaman buah, karena menginduksi perubahan lebih banyak secara kimia karena kemampuan penetrasinya lebih jauh ke dalam jaringan. Perubahan dapat terjadi pada level gen, kromosom, dan genom, termasuk inversi, duplikasi, translokasi dan point mutasi (Britt, 1996). Colchicine adalah mutagen yang berperan sebagai antimitotik telah banyak digunakan untuk menginduksi mutasi atau poliploidi tanaman (Van Harten, 1998; Gmitter et al., 1991). Mutagen fisik dan kimia dapat digunakan selama periode kultur jaringan sehingga dapat menambah keragaman somaklonal (Predieri, 2001).
Pemuliaan tanaman melalui mutasi sudah banyak dilakukan pada berbagai jenis buah-buahan termasuk jeruk. Induksi mutasi hanya merubah satu atau beberapa sifat spesifik kultivar penting. Mutagenesis pada tanaman buah diarahkan untuk merubah sifat tertentu yang bermanfaat seperti ukuran tanaman, saat berbunga buah masak, warna buah, kompatibilitas antara batang atas dengan batang bawah dan ketahanan terhadap penyakit (Predieri, 2001). Ploidisasi menyebabkan perubahan ukuran, vigor tanaman, kualitas dan jumlah biji buah (Gmitter dan Ling, 1991).
Berbagai induksi mutasi pada spesies- spesies jeruk telah dilakukan dengan dosis 10-100 grays (Sanada dan Amano, 1998; Froneman et al., 1996). Mata tunas grapefruit diradiasi dengan sinar gamma pada dosis 30-50 Gy dan diperoleh mutan jeruk seedless dan nonjuvenil (Hearn, 1985), sementara Wu et al. (1986) meradiasi tunas jeruk dengan sinar gamma pada dosis 80 Gy dan memperoleh mutan jeruk yang seedless. Mata tunas Pamelo, Mandarin, dan Navel Orange yang diradiasi dengan sinar gamma dengan dosis berkisar 30 75 Gy menunjukkan sensitivitas yang tinggi pada dosis sinar tinggi, sementara Valencia dan Grapefruit menghasilkan frekuensi cabang buah seedles yang lebih tinggi (Froneman et al., 1996). Perlakuan sinar gamma pada tahap proliferasi kultur in-vitro jeruk dengan dosis 10-60 Gy menyebabkan tingkat mortalitas tinggi pada dosis 10-60 Gy (Predieri, 2001).
Teknologi mutasi dikombinasi dengan kultur jaringan dan genetika molekular berpotensi untuk meningkatkan perbaikan tanaman. Keberhasilan aplikasi teknik mutasi dalam perakitan tanaman telah dilaporkan diberbagai publikasi (Broertjes dan Van Harten, 1988). Mutagen seperti radiasi dikombinasi dengan kultur jaringan telah terbukti menjadi metode yang penting untuk menghasilkan keragaman baru dan penggandaan yang cepat dengan perubahan genom tanaman induk yang terbatas. Metode in vitro yang efisien dapat memfasilitasi teknik-teknik mutasi untuk perakitan tanaman yang diperbanyak dari biji dan vegetatif. Pada beberapa tanaman vegetatif kombinasi teknik ini menjadi sangat ideal dan efektif sekali untuk perbaikan varietas tanaman (Maluszynski et al., 1995). Beberapa keterbatasan dalam teknologi mutasi seperti seleksi, populasi yang besar, kalkulasi frekuensi mutasi karakter yang diharapkan, dan waktu menghasilkan mutan-mutan baru dapat diatasi oleh teknik in vitro dan genetika molekular (Maluszynski et al., 1995).
Kultur jaringan menyediakan populasi sel-sel dan jaringan yang relatif seragam dan banyak untuk radiasi dan memisahkan sektor-sektor yang termutasi dalam waktu yang relatif singkat. Kemungkinan untuk mendapatkan mutan solid setelah proses embriogenesis somatik juga lebih besar dibanding regenerasi tunas. Induksi mutasi selama periode kultur in vitro dan siklus multiplikasi (2-3 kali) sangat bermanfaat dalam memisahkan sektor-sektor yang termutasi dari jaringan chimera terutama pada tanaman yang diperbanyak secara vegetatif (Maluszynski et al., 1995). Seleksi pendahuluan sel-sel dan jaringan yang mengalami mutasi dapat dilakukan selama periode kultur in vitro, pada level sel atau pada fase tanaman, diikuti dengan seleksi konvensional di lapang. Kultur jaringan memungkinkan proses seleksi populasi mutan dilakukan pada ruang kecil yang terkendali (Duncan dan Widholm, 1990).
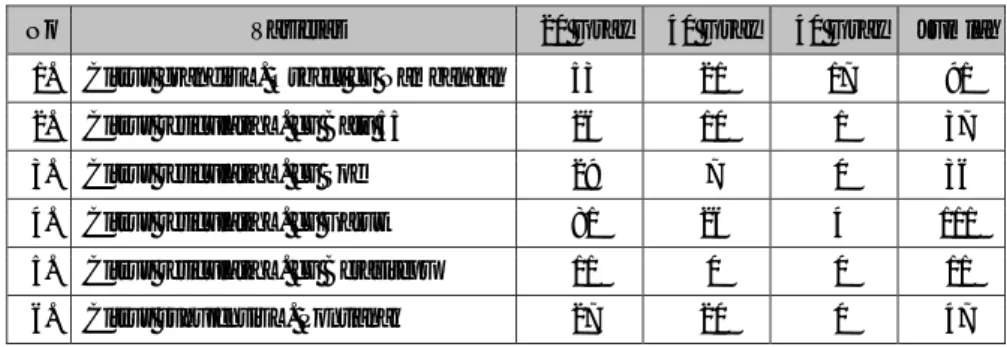
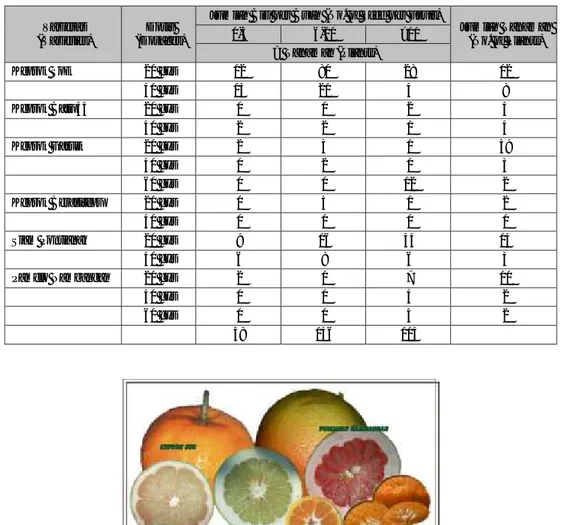
Aktivitas induksi mutagenesis telah dilakukan di Balai Penelitian Tanaman Jeruk dan Buah Subtropika. Tiga (3) level dosis sinar gamma telah dipaparkan pada mata tunas 6 jenis jeruk dan diokulasikan pada batang bawah JC (Tabel 1). Hasil pengamatan terhadap buah jeruk mengasilkan data seperti Tabel 2 dibawah ini. beberapa cabang berpotensi menghasilkan buah seedless telah diokulasi kembali kepada batang bawah JC untuk diamati lebih lanjut. Penampilan buah jeruk varian baru yang seedless dapat dilihat pada Gambar 1.
Tabel 1. Daftar Tanaman Mutan Hasil Perlakuan Sinar Gamma. (List of Mutan Plant Resulted from Gamma Ray Treatment)
No Varietas 20 Gray 40 Gray 40 Gray Jumlah
1. Citrus grandis L. Osbect cv Nambangan 53 21 17 91
2. Citrus reticulata L. cv Batu 55 26 10 1 37
3. Citrus reticulata L. cv Soe 29 7 0 36
4. Citrus reticulata L. cv Garut 81 26 4 111
5. Citrus reticulata L. cv Berasitepu 11 0 0 11
Tabel 2. Keragaman Cabang Potensial Jeruk Pamelo Nambangan Mutan dengan karakter Jumlah Biji.
(Potential Branch Diversities of Mutant Pummelo Nambangan with Seed Number Character)
Varietas (Varieties)
Dosis (Dosages)
Jumlah Biji per Buah (No. of Seed per Fruit)
Jumlah Tanaman (No. of Plants)
0-5 6-10 >11
? Tanaman (Plants)
Keprok SoE 20 gys 12 80 28 12
40 gys 15 21 4 8
Keprok Batu 55 20 gys 0 0 2 5
40 gys 2 2 1 4
Keprok Garut 20 gys 2 3 1 39
40 gys 0 2 0 3
60 gys 0 0 12 2
Keprok Berasitepu 20 gys 0 3 1 2
40 gys 0 0 0 0
Siam Pontianak 20 gys 9 16 44 14
40 gys 6 9 6 3
Pamelo Nambangan 20 gys 2 0 7 10
40 gys 0 0 4 2
60 gys 0 0 5 2
48 136 103
Gambar 1. Buah Keprok SoE dan Garut Seedless yang Dihasilkan dari Cabang Seedless dan Pamelo Nambangan Seedless dan Variasi Warna Juring Pamelo Nambangan dari Hasil Radiasi Sinar Gamma.
(SoE and Garut Seedless Fruit Resulted from Seedless Branch, Seedless Pummelo Nambangan and Flesh Color Variation Resulted from Gamma Ray Treatment)
Aplikasi Penanda DNA Berbasis Retrotransposon dalam Seleksi Mutan
Transposon atau “mobile element” atau “transposable element” merupakan sekuen genetik yang ditemukan dalam seluruh genom eukariotik. Transposon memiliki kemampuan untuk bergerak dari satu lokasi ke lokasi di sepanjang genom, menghasilkan ”target site duplication” (TSD). Retrotransposon adalah kelas transposon eukariotik yang paling umum ditemukan. Elemen ini tersebar dimana-mana di dalam genom hewan, jamur, dan tanaman dari alga bersel tunggal, bryophyta, gymnospermae, dan angyospermae (Flavell et al., 1992). Organisasi pengelompokan dan struktur retrotransposon seperti pada Gambar 2 dan 3.
Gambar 2. Retroelemen Memiliki Tiga Kelompok Retrotransposon yang Terpenting yaitu Long Terminal Repeats (LTRs), Non-LTR Retrotransposons or LINE Elements dan retrovirus. LTR Retrotransposon Dibagi Lagi Menjadi 2 Kelompok yaitu Kelompok Ty1-Copia dan Ty3-Gypsy, yang Memiliki Perbedaan yang Jelas dalam Sekuen dan Gen Yang Diekspresikan (Xiong and Eickbush, 1990), Sementara Kelompok Non-LTR yang Terpenting Lainnya adalah Kelompok LINEs dan SINEs (Wessler et al., 1995). Kelompok LTR Retrotransposons yang Paling Banyak Diteliti adalah Ty1-Copia. (Retroelemen Has Three Important Groups of Retrotransposon Which are Long Terminal Repeats (LTRs), Non-LTR Retrotransposons or LINE Elements and Retrovirus. LTR Retrotransposon Divides to Two Groups: Ty1-Copia and Ty3-Gypsy, Which Have Obvious Differences in Sequences and Expressed Genes (Xiong and Eickbush, 1990), While Non-LTR Main Groups are LINEs and SINEs (Wessler et al., 1995). LTR Retrotransposons Group Which Mostly Observed is Ty1-Copia)
Retrotransposon dikelompokkan ke dalam kelompok long terminal repeats (LTR) (seperti copia dan gypsy) dan non-LTR (seperti LINEs dan SINEs) (Kumar, 1996). Kelompok yang paling banyak dipelajari hingga saat ini adalah Ty1-copia. Retrotransposon dari group ty1-copia memiliki beberapa keuntungan yaitu tersebar hampir diseluruh kingdom tanaman, hadir dalam jumlah kopi yang melimpah, memiliki derajad heterogenitas sekuen yang tinggi, menyebar di dalam seluruh kromosom dan polimorfisme di dalam dan diantara spesies (Wessler et al., 1995; Bennetzen, 1996; Kumar et al., 1997).
Transposisi retrotransposon diatur sendiri oleh tanaman dan atau dari luar. Promotor aktivasi diinduksi oleh cekaman biotik dan abiotik. Copia-like retrotransposon pada tanaman yang tumbuh pada kondisi normal ditranskripsi pada level yang rendah. Beberapa kondisi stress seperti kultur jaringan, pembentukan protoplasma, pembentukan tumor yang diinduksi oleh Agrobacterium tumefaciens, infeksi patogen dan faktor-faktor abiotik lainnya dilaporkan mengaktifkannya melalui aktivasi transkripsi (Hirochika, 1995). Pada kondisi normal promotor tidak aktif (Moreau et al., 1996). Inaktivasi dapat terjadi pula karena metilasi sekuennya (Wessler et al., 1995), re-insert sesamanya (SanMiguel et al., 1996), stop codon dan frame shift mengalami mutasi (Flavell et al., 1992).
Retrotransposon eukariotik umumnya bergerak sporadis di dalam genom inangnya. Ada indikasi bahwa retrotransposon mempunyai hubungan erat dengan mutasi di dalam tanaman. Keaktifan retroelemen menyebabkan terjadinya akumulasi elemen ini. jumlahnya
Gambar 3. Struktur Kelompok Kelas Retrotransposons, Copia dan Gypsy Selalu Diapit oleh Long Terminal Repeats (LTRs) di Kedua Sisi Rantai Sekuen. Daerah Pengkode Protein 'Protein-Coding Region' Diapit oleh Primer Binding Site (PBS) dan Polypurine Tract (PPT) Priming Sites untuk Aktivitas Reverse Transcription. Protein-Coding Region Dipisahkan oleh 2 Domain yaitu Capsid Protein [GAG] dan Aspartic Proteinase [AP]. Kelompok Copia dan Gypsy Dibedakan oleh Letak Susunan Integrase (IN), Reverse Transcriptase (RT), dan RNase H (RH).
(Retrotransposon, Copia and Gypsy Groups Structure Always be Flanked by Long Terminal Repeats (LTRs) in Two Chain Sequence Sides. Protein-Coding Region Flanked by Primer Binding Site (PBS) and Polypurine Tract (PPT) Priming Sites for Reverse Transcription Activation. Protein-Coding Region Separated by 2 Domains: Capsid Protein (GAG) and Aspartic Proteinase (AP). Copia dan Gypsy Distinguished by the Order of the Integrase (IN), Reverse Transcriptase (RT), and RNase H (RH) Location)
bertambah secara siknifikan di dalam genom sekaligus menyebabkan mutasi gen inangnya. Ada indikasi yang kuat bahwa retrotransposon bertanggungjawab terhadap mutasi spontan yang terjadi pada tanaman karena insersinya pada region gen (Hirochika, 1995).
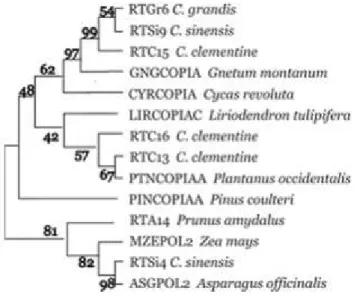
Pada tanaman jeruk, tanaman umumnya dipangkas setiap tahun dan varietas-varietas popular seperti jeruk manis dan mandarin umunya telah terinfeksi berbagai virus, yang dapat menyebabkan mutasi gen terjadi lebih sering di dalam sel-sel somatik yang menghasilkan mutasi tunas yang mempengaruhi pertumbuhan vegetatif dan berakhir kepada potensi produksi tipe-tipe buah baru (Assin et al., 1999). Assin juga menyelidiki keberadaan retrotransposos seperti copia di dalam genom jeruk. Elemen ini banyak tersebar disepanjang genom dan sangat heterogen dalam hal dominan rt. Polimorfisme diantara Citrus sinensis (Assin et al., 1999), Citrus clementina (Bret et al., 2001) dan Citrus limon (Bernet et al., 2003) dapat diidentifikasi dengan primer yang dibuat berdasarkan copi-like retrotranposon. Karena sebarannya yang luas pada eukariotik, retrotransposon based-marker ini dapat digunakan untuk mendeteksi berbagai jenis tanaman dari berbagai famili dan genus (Gambar 4)
Gambar 1. Pengelompokan Berbagai Jenis Tanaman Buah oleh Penanda DNA Berbasis Copia-Like Retrotransposons (Asins et al., 1999).
(Grouping of Some Kind of Fruits by DNA Marker Based on Copia Like Retrotransposon (Asins et al., 1999))
Penyebaran (Katsiotis et al., 1996), keberadaan (Flavell et al., 1992) dan frekuensi (Suoniemi et al., 1996) retrotransposon di dalam genom memberikan potensi dasar penting untuk penggunaannya sebagai marker DNA. Struktur sekuen panjang, terdefinisi dan lestari yang dapat digunakan untuk kloning marker spesifik. Keaktifan dalam replikasi menghasilkan insersi-insersi baru menuju polimorfisme (Kalendar et al., 1999) yang dapat dideteksi untuk membangun rumpun filogeni (Shimamura et al., 1997) diantara tanaman mutan, sehingga dapat memisahkan berbagai variasi-variasi baru. Aplikasi marker DNA berbasis retrotransposon ini pada populasi mutan memiliki potensi yang besar untuk mempercepat proses penemuan variasi genetik yang disebabkan agen mutagenik pada level pertumbuhan yang lebih awal.
KESIMPULAN
Induksi mutagenesis dengan sinar gamma telah banyak digunakan untuk mendapatkan dan mendeteksi mutan yang bermanfaat dalam program perbaikan varietas jeruk. Perbaikan varietas jeruk difokuskan untuk memperoleh variasi genetik baru terutama untuk memperbaiki kualitas buah. Stabilitas gen hasil induksi mutagenesis dengan sinar gamma masih harus dibuktikan. Variasi morfologi dan buah dapat dipengaruhi oleh lingkungan sehingga akurasinya rendah. Penggunaan penanda molekular dari sekuen retrotransposon berpotensi untuk digunakan dalam studi keragaman untuk mendapatkan variasi genetik yang stabil.
DAFTAR PUSTAKA
Agisimanto, D., N.F. Devy, C. Martasari, A. Supriyanto, I. Sutarto, E. Budiati, Jati 2003. Perbaikan jeruk keprok dan pamelo melalui induksi mutasi. Laporan akhir penelitian Loka Penelitian tanaman jeruk dan buah subtropika tahun 2003.
Agisimanto, D., C. Martasari, A. Supriyanto, I. Sutarto. 2004. Perbaikan jeruk keprok dan pamelo melalui induksi mutasi. Laporan akhir penelitian Loka Penelitian tanaman jeruk dan buah subtropika tahun 2004.
Agisimanto, D., C. Martasari, A. Supriyanto, I. Sutarto. 2005. Perbaikan jeruk keprok dan pamelo melalui induksi mutasi. Laporan akhir penelitian Loka Penelitian tanaman jeruk dan buah subtropika tahun 2005.
Agisimanto, D., C. Martasari, A. Supriyanto, I. Sutarto. 2006. Perbaikan Varietas Jeruk Lokal Komersial melalui Induksi Mutasi. Laporan akhir penelitian Balai Penelitian tanaman jeruk dan buah subtropika tahun 2006.
Agisimanto, D., C. Martasari, A. Supriyanto, I. Sutarto. 2007. Perbaikan Varietas Jeruk Lokal Komersial melalui Induksi Mutasi. Laporan tengah tahun penelitian Balai Penelitian tanaman jeruk dan buah subtropika tahun 2007.
Asíns, M.J., A.J. Monforte, P.F. Mestre, E.A.Carbonell. 1999. Citrus and Prunus copia-like retrotransposons. Theoretical Applied Genetics 99: 503-510
Bennetzen, J.L., 1996. The contribution of retroelements to plant genome organization, function, and evolution. Trends in MicrobioloGy 4: 347-353
Bernet, G.P., M.J. Asíns. 2003. Identification and genomic distribution of Gypsy like retrotransposons in Citrus and Poncirus. TAG Theoretical and Applied Genetics 108 (1): 121-130
Breto, M.P., C. Ruiz, J.A. Pina, M.J. Asins. 2001. The diversification of Citrus clementina Hort. ex Tan., a vegetatively propagated crop species. Mol Phylog Evol 21: 285-293
Britt, AB. 1996. DNA damage and repair in plants. Annu. Rev.Plant Mol. Biol. 47:75-100
Broertjes, C., A.M. van Harten. 1988. Applied mutation breeding for vegetatively propagated crops. Elsevier Amsterdam.
Doolittle, R.F., D.F. Feng, M.S. Johnson, and M.A. Mclure, 1989. Origins and evolutionary relationships of retrovirus. Quarterly Rev. Biol. 64: 1-30.
Duncan, D.R., J.M. Widholm. 1990. Techniques for selecting mutants from plant tissue cultures. P. 443-453. In: J.W. Pollard, J.M. Walker. Eds. Methods in Molecular BioloGy Vol 6. Plant Cell and Tissue Culture. The Humana Press. Clifton.
Flavell, A. J., E. Dunbar, R. Anderson, S. R. Pearce, R. Hartley et al., 1992 Ty1-copia group retrotransposons are ubiquitous and heterogeneous in higher plants. Nucleic Acids Res. 20: 3639-3644.
Froneman, I.J., H.J. Breedt, P.J.J. Koekemoer, P.J.J. Van Rensburg. 1996. Producing seedless Citrus cultivars with gamma irradiation. Proc Int. Soc. Citriculture 159-163
Gmitter, F.G., Jr., X. Ling, 1991. Embryogenesis in itro and nonchimeric tetraploid plant recoveryfrom undeveloped Citrus ovules treated with colchicine. J. Amer. Soc. Hort. Sci 116: 317-321
Gmitter, F.G., X. Ling, C. Cai, and J.W. Grosser. 1991. Colchicine-induced polyploidy in Citrus embryogenic cultures, somatic embryos, and regenerated plantlets. Plant science 74: 135-141 Grosser,, J.W. dan FG. Gmitter, 1990. Protoplast fusion and citrus improvement. Plant breeding rev.
8: 339-374
Hearn, C.J., 1985. Development of seedless grafefruit cultivars through budwood irradiation. Hortscience 20: 84
Hirochika H (1995) Regulation of plant retrotransposons and their use for genome analysis. Gamma Field Symp 34:77-91
Kalendar, R., T. Grob, M. Regina, A. Suoniemi, A. Schulman. 1999. IRAP and REMAP: two new retrotransposon-based DNA fingerprinting techniques. Theoretical Applied Genetics 98: 704-711 Kotsias, A., T. Schmidt, and J.S. Heslop Herison. 1996. Chrosomal and genoic organization of
Kumar, A., S.R. Pearce, K. McLean, G. Harrison, J.S. Heslop-Harrison, R. Waugh, A. J. Flavell. 1997. The Ty1-copia group of retrotransposons in plants: genomic organisation, evolution, and use as molecular markers. Genetica 100: 205-217
Maluszynski, M., B.S. Ahloowalia, B. Sigurbjorsson. 1995. Application of in itro mutation techniques for crop improvement. Euphytica 85: 303-315
Moreau-Mhiri, C., J.B. Morel, C. Audeon, M. Ferault, M.A. Grandbastien, H. Lucas. 1996. Regulation of expression of the tobacco Tnt1 retrotransposon in heterologous species following pathogen-related stresses. Plant Journ 9: 409-419
Predieri, S. 2001. Mutation induction and tissue culture in improving fruits. Plant Cell, Tissue and Organ Culture. 64: 185-210
Sanada, T., E. Amano. 1998. Induced mutation in fruit trees. In S.M. Jain, D.S. Brar, B.S. Ahloowalia. Somaclonal variation and induced mutations in crop improvement. Kluwer Academic Publisers. England. P401-419
Sanmiguel, P., A. Tikhonov, Y.K. Jin, N. Mothoulskaia, D. Zakharov, A. Melake-Berhan, P.S. Springer, K.J. Edwards, M. Lee, Z. Avramova, J.L. Bennetzen. 1996. Nested retrotransposons in the intergenig regions of the maize genom. Science 274: 765-768
Shimamura, M., H. Yasue, K. Ohshima, H. Abe, H. Kato, T. Kishiro, M. Goto, I. Munechika, N. Okada. 1997. Molecular evidence from retroposons that whales form a clade within even-toed ungulates. Nature 388: 666-670
Spiegel-Roy, P. dan Goldschmidt, E.E. 1996. BioloGy of citrus. Cambridge University press. 230 p. Suoniemi, A., K. Anamthawat-Johansson, T. Arna, A.H. Schulman. 1996 Retrotransposon BARE-1 is
a major, dispersed component of the barley (Hordeum vulgare L.) genome. Plant Mol Biol 30 : 1321-1329
Van Harten, A.M. 1998. Mutation Breeding: Teory and practical applications. Cambridge University press. Cambridge.
Vardi, A., S. Bleichmen, D. Aviv. 1990. Genetic transformation of Citrus protoplasts and regeneration of transgenic plant. Plant sci. 69: 199-206
Varoquaux, F., R. Blanvillain, M. Delseny, P. Gallois. 2000. Less is better: New approaches for seedless fruit production. Trends in BiotechnoloGy 18: 233-242
Voytas, D. F., A. Konieczny, M.P. Cummingst, F. M. Ausubel. 1990. The Structure, Distribution and Evolution of the Tal Retrotransposable Element Family of Arabidopsis thaliana. Genetics 126 713-721
Wessler, S.R., T.E. Bureau, and S.E. White. 1995. LTR-retrotransposons and MITEs: important players in the evolution of plant genomes. Current oppinion in Genetics and Development 5: 814-821
Wu, S., J. Liang, Z. Lin, X. Tang, S. Zeng. 1986. Using gamma rays to induce mutations for seedlessness in citrus. Mutation Breeding Newsletter 27: 14.