HASIL DAN PEMBAHASAN
Morfologi dan Histopatologi Penyakit Layu Kelapa Gejala Morfologi Penyakit Layu Kelapa di Pulau Derawan
Gejala penyakit layu kelapa yang berasal dari Pulau Derawan terlihat umumnya pada tanaman di atas umur 15 tahun. Daun-daun kelapa menguning mulai dari bagian bawah (tua) ke bagian atas (muda). Menguningnya daun juga dimulai pada bagian ujung daun ke bagian yang dekat dengan pelepah. Pelepah-pelepah maupun daun kelapa yang muncul terlihat lebih pendek daripada tanaman kelapa yang sehat. Pemendekan pelepah dan daun kelapa ini mengakibatkan tanaman terlihat kerdil dan sedikit pelepah (Gambar 3).
Gambar 3 Gejala penyakit layu kelapa di Pulau Derawan. Daun tanaman kelapa menguning dan memendek (A); Perbesaran gambar gejala penyakit kelapa (B)
Pada kasus penyakit yang mirip dengan penyakit layu kelapa, yakni penyakit lethal yellowing, konduktansi stomata menurun pada kedua sisi atas daun, tengah dan pangkal pelepah saat stadia perkembangan awal penyakit. Perilaku stomata ini mempengaruhi pertukaran gas dan berbagai proses yang lain pada tanaman seperti fotosintesis dan transportasi air. Akibatnya daun-daun kelapa menjadi menguning dengan penurunan laju fotosintesis serta penurunan pada kandungan protein, klorofil, dan karotenoid (Leon et al. 1996). Anguilar et al. (2009) juga berpendapat bahwa terjadi penurunan kandungan sitokinin yang drastis pada daun yang bergejala awal penyakit lethal yellowing, bahkan pada
daun dengan gejala penyakit yang berat, beberapa jenis sitokinin tidak terdeteksi. Penurunan jumlah sitokinin ini mengakibatkan perilaku stomata cenderung menutup. Namun demikian, kandungan sitokinin pada akar tanaman yang bergejala penyakit cenderung mengalami kenaikan.
Perubahan fisiologi juga terjadi terutama di dalam daun dan akar yang akan memperlihatkan gejala secara visual seperti yang diteliti oleh Maust et al. (2003). Konduktansi stomata, fotosintesis dan respirasi akar menurun pada stadia perkembangan penyakit. Jumlah pusat-pusat reaksi fotosistem II (PSII) yang aktif akan menurun mulai stadia awal gejala penyakit, namun maksimum penggunaan efisiensi PSII akan sama sampai stadia pertengahan perkembangan penyakit sebelum mengalami penurunan. Konsentrasi gula dan pati pada daun-daun bagian tengah (daun ke-14) dan daun-daun atas (daun ke-4) mengalami peningkatan selama perkembangan penyakit, sedangkan konsentrasi karbohidrat akar mengalami penurunan yang sangat cepat selama masa inkubasi fitoplasma. Meskipun laju fotosintesis dan konsentrasi karbohidrat akar menurun, konsentrasi karbohidrat daun meningkat. Hal ini membuktikan bahwa terjadinya penghambatan transportasi gula di dalam floem yang memicu pada cekaman jaringan pengangkutan dan menyebabkan perkembangan gejala lethal yellowing menjadi tampak secara visual.
Struktur batang tanaman kelapa sakit umumnya lebih licin dibandingkan batang tanaman sehat. Tekstur kulit batang tetap bergelombang karena adanya bekas tumpuan pelepah yang telah terlepas, tetapi ketika dipanjat akan terasa lebih licin. Batang kelapa yang bergejala penyakit ini semakin ke bagian atas, akan terasa semakin licin. Untuk waktu normal, dengan lingkar batang dan ketinggian tanaman yang sama (sekitar 12 meter), seorang pemanen kelapa akan membutuhkan waktu memanjat pada tanaman yang sakit dan bergejala berturut-turut sekitar 1 menit dan 4 menit. Diameter batang tanaman yang sakit juga lebih kecil daripada tanaman yang masih sehat, namun hanya pada bagian atas, pada bagian bawah relatif sama.
Pelepah daun tanaman kelapa sakit akan lebih mudah sengkleh (jawa: lunglai pada bagian pangkal pelepah) sehingga menyulitkan bagi pemanen kelapa yang memanjat tanaman ini. Pelepah daun yang telah menguning total biasanya
tidak dapat diduduki pemanen yang hanya memiliki berat tubuh sekitar 60 kg. Selain karena jumlah buah yang sangat sedikit dengan ketinggian tanaman yang cukup tinggi, kondisi seperti ini mengakibatkan tanaman ini jarang tersentuh.
Gejala penyakit layu kelapa di Pulau Derawan yang sudah lanjut adalah mengeringnya daun (klorosis) yang dimulai dari bagian daun yang tua (bawah) dan bagian ujung daun. Pelepah-pelepah tua mudah sengkleh, terjadinya penguguran buah kelapa yang masih muda atau jika masih ada buah kelapa yang tersisa sampai besar dan masak, biasanya hanya 1 atau 2 biji saja. Gejala akhir penyakit ini adalah mengeringnya seluruh pelepah dan daun kelapa, rontok dan terlihat hanya seperti tonggak batang kayu (Gambar 4).
Gambar 4 Gejala lanjut penyakit layu kelapa di Pulau Derawan. Daun kelapa mengalami nekorsis dari daun bagian bawah (A), daun dan buah berguguran hingga tertinggal hanya tonggak batang (B)
Gejala lanjut penyakit layu kelapa seperti daun yang mengalami klorosis, pelepah sengkleh, gugurnya buah muda mirip dengan tanaman kelapa yang memperlihatkan gejala penyakit lethal yellowing stadia lanjut. Menurut Leon et al. (1996), tanaman yang sakit akan menghasilkan asam absisat dan etilen yang sangat tinggi. Akibatnya tanaman terjadi ketidakseimbangan hormon. Hormon-hormon ini akan memacu penuaan daun dan mengakibatkan sengkleh-nya pelepah serta gugurnya buah yang masih muda (Musetti 2010).
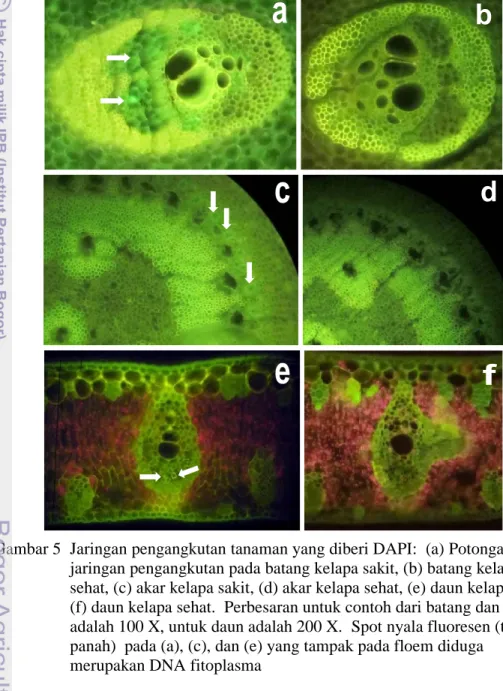
Pengamatan Jaringan Pengangkutan Tanaman dengan Pewarnaan DAPI Pewarna DAPI digunakan untuk menduga keberadaan fitoplasma pada jaringan pengangkutan floem tanaman. Pengamatan dengan mikroskop fluoresesn
terhadap jaringan batang, akar, dan daun seperti terlihat seperti pada Gambar 5 menunjukkan bahwa pada jaringan floem dari tanaman sakit (bergejala layu) terdapat spot nyala fluoresensi yang lebih terang dibandingkan dengan floem dari tanaman sehat. Spot nyala fluoresensi pada sel floem yang lebih terang ini diduga merupakan akumulasi DNA fitoplasma. Adanya DNA suatu mikroorganisme di dalam jaringan tanaman akan terwarnai dengan pewarna DAPI.
Gambar 5 Jaringan pengangkutan tanaman yang diberi DAPI: (a) Potongan jaringan pengangkutan pada batang kelapa sakit, (b) batang kelapa sehat, (c) akar kelapa sakit, (d) akar kelapa sehat, (e) daun kelapa sakit, (f) daun kelapa sehat. Perbesaran untuk contoh dari batang dan akar adalah 100 X, untuk daun adalah 200 X. Spot nyala fluoresen (tanda panah) pada (a), (c), dan (e) yang tampak pada floem diduga
merupakan DNA fitoplasma
Pewarnaan DAPI merupakan metode deteksi fitoplasma yang relatif cepat, mudah dan murah. Namun demikian, metode ini kurang kuat untuk membedakan
antara sel mikroorganisme lain atau komponen sel (mitokondria, kloroplas) dari fitoplasma (Schaad et al. 2001). Sebagai contoh, pada kasus tanaman wortel, daerah fluorosen (berpendar) biru dan putih terlihat di bawah lensa pandang mikroskop fluoresen pada sel jaringan pengangkutan tanaman yang bergejala penyakit, tetapi pengamatan dengan transmission electron microscope (TEM) memperlihatkan bahwa yang sebenarnya berpendar tersebut berturut-turut adalah ricketsia-like organisms dan partikel rhabdovirus (Franova et al. 2007). Karena itu, teknik ini hanya digunakan sebagai alat deteksi awal dari deteksi utama dengan pendekatan polymerase chain reaction (PCR) (Arismendi et al. 2009).
Sebenarnya jaringan tanaman akan berpendar secara alami (contoh dinding sel xilem) atau karena akumulasi produksi substansi tertentu (misal senyawa fenol) sebagai respon terhadap berbagai keadaan yang kurang mendukung seperti tekanan lingkungan abiotik dan biotik (penyakit). Oleh karena itu, tanpa pewarnaan tertentu, penglihatan langsung jaringan ini menggunakan mikroskop cahaya tidak dapat dijadikan sebagai metode deteksi fitoplasma. Pewarnaan 4’-6-diamidino-2-phenylindole (DAPI) yang mengikat DNA mengakibatkan sel-sel floem menjadi sangat berpendar, lebih berpendar dari nukleus sel parenkim (Musetti & Favali 2004). Jika terdapat fitoplasma, maka spot-spot pada sel floem akan sangat berpendar yang akan membedakan dengan ketiadaan fitoplasma pada jaringan tanaman sehat. Teknik pewarnaan DAPI ini dapat digunakan untuk contoh tanaman basah maupun kering, dan juga tidak hanya untuk jaringan daun dan batang, tetapi juga untuk akar, bunga dan petiole.
Pengamatan Jaringan Pengangkutan Floem dengan SEM
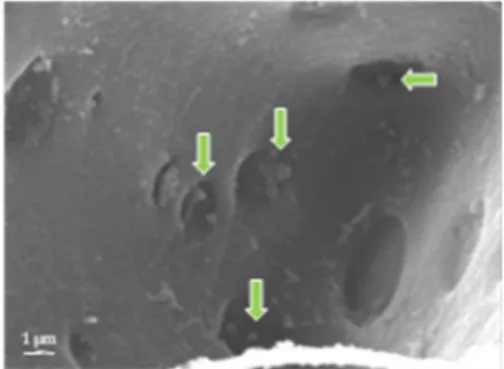
Sel-sel yang diduga fitoplasma dari tanaman kelapa sakit tampak melekat pada dinding-dinding sel floem, walaupun tidak terlihat menggerombol (Gambar 6). Bentuk sel fitoplasma beraneka ragam, ada yang membulat, lonjong, bahkan memanjang seperti gada. Hasil pengamatan dengan SEM ini memperlihatkan bahwa sel yang diduga fitoplasma hanya terlihat pada jaringan batang tanaman bergejala layu, dan tidak pada jaringan tanaman yang sehat. Ukuran sel-sel yang diduga fitoplasma ini berkisar antara 0,5 – 0,9 μm.
Gambar 6 Sel floem batang kelapa bergejala layu yang diamati menggunakan SEM. Panah hijau menunjukkan sel fitoplasma
Konsentrasi fitoplasma yang terlihat pada jaringan atau sel floem dengan SEM cukup rendah. Menurut Marcone (2010), konsentrasi fitoplasma di dalam jaringan tanaman berkayu (tahunan) cenderung sangat sedikit dibandingkan dengan tanaman herbaceous (semusim).
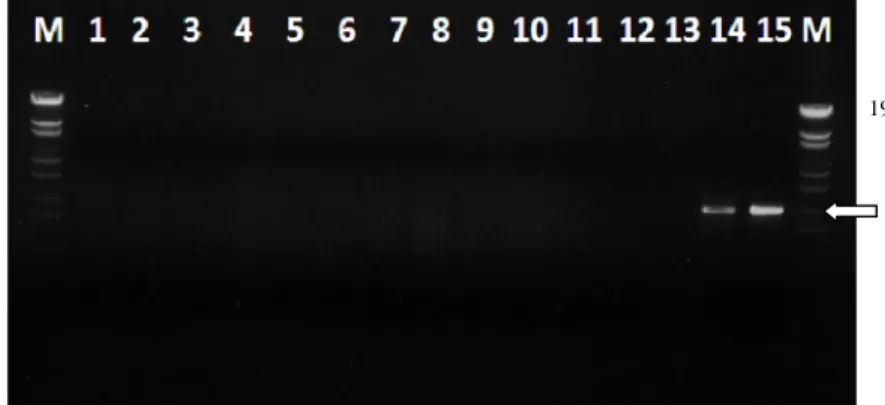
Deteksi Fitoplasma dengan Nested Polymerase Chain Reaction (nPCR) Amplifikasi DNA pada PCR yang pertama menggunakan primer P1/P7 hanya terjadi pada fitoplasma yang berasal dari kacang tanah dan kedelai pada gel agarosa. Produk amplifikasi yang dihasilkan adalah sekitar 1.8 kb. Tidak ada amplikon DNA fitoplasma dari semua contoh tanaman kelapa yang terlihat pada gel agarosa, termasuk contoh dari Sampit (Gambar 7).
Amplifikasi DNA pada metode nested PCR menggunakan pasangan primer kedua R16F2n/R16R2 (template DNA pada tahap ini adalah produk PCR yang pertama) memperlihatkan adanya amplikon DNA pada semua contoh, baik contoh kelapa dari Pulau Derawan, Sampit, maupun contoh dari kacang tanah dan kedelai. Ukuran amplikon DNA dari PCR yang kedua ini adalah sekitar 1.25 kb (Gambar 8). Jumlah contoh kelapa dari Pulau Derawan yang positif terdeteksi fitoplasma adalah 18 contoh tanaman bergejala layu sedang sampai berat (semua contoh terdeteksi), 13 contoh tanaman bergejala awal penyakit layu, dan 5 contoh tanaman tidak bergejala penyakit layu.
Gambar 7 Fragmen DNA fitoplasma hasil PCR menggunakan primer P1/P7 dari berbagai tanaman. Lajur 1-2: kelapa belum bergejala dari Pulau Derawan; Lajur 3-6: kelapa bergejala ringan dari Pulau Derawan; Lajur 7-10: kelapa bergejala berat dari Pulau Derawan; Lajur 11-13: kelapa dari Sampit; Lajur 14: kedelai; Lajur 15: kacang tanah; Lajur M: λEco T14I digest ladder
Gambar 8 Fragmen DNA hasil nPCR menggunakan primer R16F2n/R16R2 terhadap DNA fitoplasma dari berbagai tanaman. Lajur 1-2: kelapa belum bergejala dari Pulau Derawan; Lajur 3-6: kelapa bergejala ringan dari Pulau Derawan; Lajur 7-10: kelapa bergejala berat dari Pulau Derawan; Lajur 11-13: kelapa dari Sampit; Lajur 14: kedelai; Lajur 15: kacang tanah; Lajur M: λEco T14I digest ladder
Hasil deteksi gen 16S rRNA fitoplasma dari beberapa contoh yang digunakan menunjukkan beberapa hal. Pertama, PCR awal menggunakan pasangan primer P1/P7 tidak menghasilkan pita DNA yang terlihat pada gel agarosa dari contoh tanaman kelapa yang diuji, sedangkan dari contoh tanaman kacang-kacangan (kedelai dan kacang tanah), pita DNA tersebut dapat tervisualisasi. Ukuran fragmen DNA ini adalah sekitar 1.8 kb. Kedua, hasil nested PCR (nPCR) menggunakan produk PCR yang pertama dan pasangan
19329 bp
1882 bp
19329 bp
1882 bp 925 bp
primer R16F2n/R16R2 menunjukkan adanya fragmen DNA yang tervisualisasi pada gel agarosa pada ukuran sekitar 1.25 kb. Fragmen ini muncul dari contoh kelapa yang bergejala penyakit layu dan beberapa tanaman yang tidak menunjukkan gejala layu.
Tanaman kelapa termasuk ke dalam keluarga Palmae yang mempunyai struktur morfologi dan fisiologi tanaman berbeda dengan keluarga tanaman kacang-kacangan. Contoh yang diuji dalam penelitian ini berasal dari batang kelapa sehingga diperlukan kehati-hatian untuk mendapatkan jaringan floem yang masih segar dan mengandung patogen. Berbeda halnya dengan tanaman kacang-kacangan, jaringan floem tersebut lebih mudah untuk diperoleh. Menurut Marcone (2010), konsentrasi fitoplasma di dalam jaringan tanaman berkayu (tahunan) cenderung sangat sedikit dibandingkan dengan tanaman semusim. Oleh karena itu, diduga jumlah fitoplasma yang didapatkan dari tanaman kacang-kacangan lebih banyak dibandingan dengan contoh dari tanaman kelapa. Pada PCR awal, jumlah amplikon DNA fitoplasma yang dihasilkan dari tanaman kelapa belum cukup untuk tervisualisasi pada gel agarosa, sedangkan contoh dari kacang-kacangan, fragmen DNA tersebut sudah tampak.
Sedikitnya amplikon DNA dari contoh kelapa yang dihasilkan pada PCR pertama sehingga tidak mampu tervisualisasi pada gel agarosa kemungkinan juga disebabkan oleh banyaknya inhibitor yang terdapat pada jaringan tanaman berkayu tersebut. Inhibitor-inhibitor ini dapat mengganggu proses amplifikasi DNA. Menurut Yuwono (2006), konsentrasi garam yang tinggi pada reaksi PCR dapat menghambat laju aktivitas taq polymerase dalam mensintesis DNA.
Untuk mendapatkan hasil dengan nilai sensitivitas yang tinggi, maka digunakan nPCR dengan memanfaatkan produk hasil PCR awal. Pada Gambar 8 terlihat bahwa fragmen DNA telah muncul dari contoh tanaman kelapa. Hal ini membuktikan bahwa sebenarnya pada tahap PCR awal, fragmen DNA dengan ukuran 1.8 kb dari contoh kelapa telah teramplifikasi namun jumlahnya masih sangat sedikit. Gambar 8 juga menjelaskan adanya jumlah DNA fitoplasma dari contoh kelapa yang lebih sedikit dibandingkan dengan jumlah DNA dari contoh tanaman kacang-kacangan sebagai kontrol positif. Konsentrasi inhibitor akan berkurang pada reaksi PCR yang kedua sehingga proses amplifikasi DNA
fitoplasma lebih optimal.
Pengujian nPCR dirancang untuk meningkatkan sensitivitas dan spesifitas, khususnya untuk amplifikasi fitoplasma dari contoh yang mempunyai kelimpahan pada jaringan yang rendah yang dapat mengganggu keberhasilan PCR. Pengujian nPCR dilakukan dengan amplifikasi awal menggunakan pasangan primer universal dan diikuti dengan PCR yang kedua menggunakan pasangan primer spesifik yang mengarah pada grup fitoplasma tertentu. Pengujian nPCR juga mampu mendeteksi fitoplasma yang memiliki strain yang berbeda (fitoplasma ganda) yang dapat menginfeksi jaringan tanaman dengan infeksi ganda (Arocha & Jones 2006).
Penelitian ini menunjukkan bahwa fitoplasma terbukti berasosiasi dengan penyakit layu kelapa di Pulau Derawan. Hasil keseluruhan contoh dengan gejala penyakit layu kelapa adalah positif terdeteksi fitoplasma melalui nPCR. Namun demikian, hasil deteksi fitoplasma dari beberapa tanaman kelapa yang masih tampak sehat secara visual juga menunjukkan hasil yang positif. Ada dua kemungkinan yang terjadi. Pertama, fitoplasma tersebut telah berada dalam jaringan tanaman tetapi belum dapat menimbulkan penyakit yang berarti periode inkubasi penyakit yang sangat lama pada tanaman kelapa. Kedua, fragmen DNA yang terlihat pada gel agarosa bukan merupakan fitoplasma melainkan berupa DNA spesies lain seperti Bacillus spp seperti yang pernah ditemukan oleh beberapa peneliti sebelumnya (Warokka et al. 2006, Nejat et al. 2009). Hal ini mungkin terjadi karena fitoplasma erat berhubungan dengan bakteri Gram Positif khususnya grup Bacillus dan Clostridium yang menjadi nenek moyang fitoplasma (Bai et al. 2006).
PCR merupakan sistem deteksi yang paling sensitif, spesifik dan cepat. Sayangnya, beberapa kerancuan juga dapat dijumpai pada proses PCR untuk fitoplasma, diantaranya adalah munculnya pita DNA yang tidak spesifik dan false positive atau negative DNA. Oleh karena itu, konfirmasi hasil PCR menggunakan primer berikutnya melalui nPCR dilanjutkan dengan pemotongan DNA hasil PCR tersebut menggunakan beberapa enzim restriksi melalui RFLP dan sequencing produk PCR sepertinya menjadi cara yang tepat untuk mengidentifikasi fitoplasma dengan tepat dari contoh yang diperiksa (Franova et al. 2007).
Pengujian PCR menggunakan banyak pasangan primer universal yang telah menjadi rutinitas diagnosis fitoplama hanya digunakan sebagai deteksi awal akan kemungkinan keberadaan penyakit.
Identifikasi dan Karakterisasi Molekuler Fitoplasma dari Kelapa Bergejala Layu di Pulau Derawan Sequencing Produk nPCR
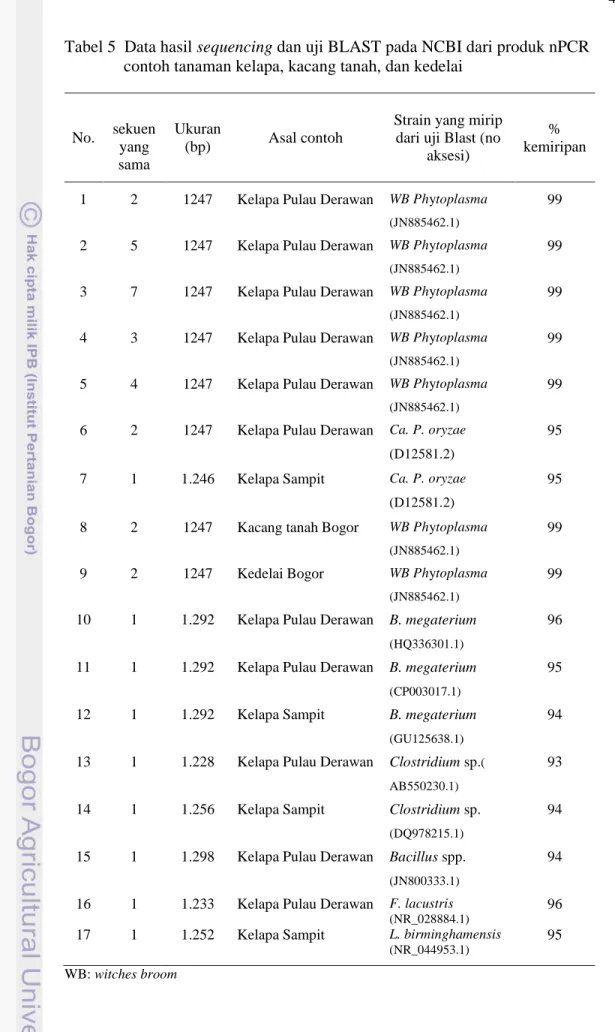
Hasil perakitan data sequencing dari semua contoh yang diuji menunjukkan adanya beberapa ukuran basa sekuen yang berbeda. Dari total 36 produk nPCR, 28 sekuen dari tanaman kelapa di Pulau Derawan, 4 sekuen dari tanaman kelapa Sampit serta masing-masing 2 produk nPCR dari tanaman kedelai dan kacang tanah menghasilkan ukuran sekuen DNA berkisar antara 1228 – 1298 bp (Tabel 5, Lampiran 1). Setelah dilakukan uji BLAST dari NCBI diperoleh bahwa 77,78% sangat mirip dengan beberapa strain fitoplasma dan 23,22% bukan merupakan fitoplasma.
Untuk contoh tanaman kelapa dari Pulau Derawan, 75% hasil BLAST termasuk ke dalam fitoplasma kelompok witches broom phytoplasma, 17% tergolong ke dalam Ca. Phytoplasma oryzae, dan 18% sisanya bukan merupakan fitoplasma melainkan Bacillus megaterium, Bacillus sp., Clostridium sp., dan Friedmaniella lacustris. Sekuen DNA fitoplasma yang berasal dari Pulau Derawan terdiri dari 6 sekuen yang berbeda meskipun ukurannya tetap sama, yaitu 1247 bp.
Karakterisasi gen 16S rRNA fitoplasma sering dilakukan dengan metode PCR dapat dikategorikan menjadi tiga tahap: ekstraksi DNA total dari tanaman bergejala, amplifikasi DNA spesifik fitoplasma melalui PCR, karakterisasi amplikon DNA dengan sequencing, analisis RFLP atau nPCR menggunakan primer spesifik untuk grup fitoplasma tertentu (Marzachi 2004). Kesuksesan tahapan ini tergantung dari persiapan ekstraksi DNA total dengan baik yang memungkinkan konsentrasi DNA fitoplasma yang terisolasi paling tinggi. Konsentrasi sel fitoplasma di dalam jaringan pengangkutan floem bervariasi tergantung dari lingkungan, bagian tanaman, dan spesies tanaman, yang sering dijumpai sangat rendah pada tanaman berkayu (Firrao et al. 2007).
Tabel 5 Data hasil sequencing dan uji BLAST pada NCBI dari produk nPCR contoh tanaman kelapa, kacang tanah, dan kedelai
No. ∑ sekuen yang sama Ukuran (bp) Asal contoh
Strain yang mirip dari uji Blast (no
aksesi)
% kemiripan
1 2 1247 Kelapa Pulau Derawan WB Phytoplasma (JN885462.1)
99
2 5 1247 Kelapa Pulau Derawan WB Phytoplasma (JN885462.1)
99
3 7 1247 Kelapa Pulau Derawan WB Phytoplasma (JN885462.1)
99
4 3 1247 Kelapa Pulau Derawan WB Phytoplasma (JN885462.1)
99
5 4 1247 Kelapa Pulau Derawan WB Phytoplasma (JN885462.1)
99
6 2 1247 Kelapa Pulau Derawan Ca. P. oryzae (D12581.2)
95
7 1 1.246 Kelapa Sampit Ca. P. oryzae (D12581.2)
95
8 2 1247 Kacang tanah Bogor WB Phytoplasma (JN885462.1)
99
9 2 1247 Kedelai Bogor WB Phytoplasma
(JN885462.1)
99
10 1 1.292 Kelapa Pulau Derawan B. megaterium (HQ336301.1)
96
11 1 1.292 Kelapa Pulau Derawan B. megaterium (CP003017.1)
95
12 1 1.292 Kelapa Sampit B. megaterium (GU125638.1)
94
13 1 1.228 Kelapa Pulau Derawan Clostridium sp.( AB550230.1)
93
14 1 1.256 Kelapa Sampit Clostridium sp. (DQ978215.1)
94
15 1 1.298 Kelapa Pulau Derawan Bacillus spp. (JN800333.1)
94
16 1 1.233 Kelapa Pulau Derawan F. lacustris (NR_028884.1)
96 17 1 1.252 Kelapa Sampit L. birminghamensis
(NR_044953.1)
95 WB: witches broom
Berdasarkan hasil analisis sequencing, fitoplasma yang terdapat pada tanaman kelapa dengan gejala layu di Pulau Derawan digolongkan ke dalam dua grup, yakni sebagian besar grup witches broom phytoplasma dan bagian kecil lainnya adalah rice yellow dwarf phytoplasma. Kelompok fitoplasma witches broom phytoplasma sebelumnya diketahui banyak menyebabkan penyakit pada tanaman kacang-kacangan dan termasuk dalam grup 16SrII, sedangkan kelompok fitoplasma rice yellow dwarf phytoplasma sudah pernah dilaporkan oleh Warokka et al. (2006) sebagai kandidat penyebab penyakit layu Kalimantan di daerah Sampit Kalimantan Tengah dan termasuk ke dalam grup 16SrXI. Strain fitoplasma grup 16SrII dari tanaman kelapa ini adalah yang pertama kali dilaporkan setelah sebelumnya hanya dilaporkan fitoplasma grup 16SrIV, 16SrXI, 16SrXII, dan 16SrXIV yang berasosiasi kuat sebagai penyebab penyakit pada tanaman kelapa (Tabel 6, Tabel 7).
Hasil sequencing terhadap fitoplasma yang berasal dari contoh kelapa asal Sampit Kalimantan Tengah menunjukkan bahwa patogen tersebut tergolong ke ca. Phytoplasma oryzae (rice yellow dwarf phytoplasma) sama dengan strain yang ditemukan oleh Warokka et al. (2006). Hasil deteksi ini diperoleh dari contoh tanaman yang bergejala layu Kalimantan maupun yang belum bergejala. Hal ini membuktikan bahwa epidemi penyakit ini sudah meluas setelah sebelumnya dilakukan eradikasi tanaman kelapa yang terserang cukup banyak.
Tanaman kacang-kacangan bergejala sapu yang digunakan sebagai kontrol positif, memperlihatkan hasil sekuen berupa gen 16S rRNA fitoplasma yang termasuk ke dalam grup peanut witches broom phytoplasma. Hasil ini didapatkan dari contoh tanaman kacang tanah dan kedelai yang berasal dari Dramaga Bogor Jawa Barat. Strain fitoplasma dari tanaman kacang-kacangan ini memiliki hubungan kekerabatan yang paling dekat dengan strain fitoplasma grup 16SrII yang telah terdeposit di GenBank dibandingkan dengan strain fitoplasma yang berasal dari tanaman kelapa bergejala layu di Pulau Derawan.
Fitoplasma tidak hanya terdeteksi pada tanaman kelapa yang bergejala penyakit berat maupun ringan, tetapi juga terdeteksi pada tanaman yang masih tampak sehat secara visual. Hal ini diduga bahwa fitoplasma telah berasosiasi di dalam jaringan tanaman namun belum mampu memunculkan gejala penyakit.
Selain itu, kemungkinan faktor lingkungan dan tanaman inang juga dapat menghambat laju perkembangan penyakit (Firrao et al. 2007). Periode inkubasi penyakit layu kelapa di lapangan diduga membutuhkan waktu lebih dari 7 tahun.
Tabel 6. Penyakit layu pada tanaman kelapa yang berasosiasi dengan fitoplasma
Nama penyakit (Negara)
No aksesi GenBank
Grup fitoplasma Referensi
Nigerian Awka disease (Nigeria)
Y14175 ca. Phytoplasma palmae (16SrIV)
Tymon et al. (1998) Tanzanian lethal disease
(Tanzania)
X80117 ca. Phytoplasma palmae (16SrIV)
Tymon et al. (1998) Lethal yellowing
(Meksiko)
AF500329 ca. Phytoplasma palmae (16SrIV-A, B)
Harrison et al. (2002a,b) Coconut lethal yellowing
(Jamaika)
DQ384863 ca. Phytoplasma palmae (16SrIV) Myrie et al. (2006) Kalimantan wilt (Indonesia)
-ca. Phytoplasma oryzae (16SrXI) Mexican periwinkle virescence (16SrXII) Warokka et al. (2006) Kerala wilt (India)
AY158660 ca. Phytoplasma palmae (16SrIV-C)
Edwin & Mohankumar
(2007) Coconut yellow decline
(Malaysia)
EU328159 ca. Phytoplasma cynodontis (16SrXIV)
Nejat et al. (2009) Root wilt disease
(India)
GQ850122 ca. Phytoplasma oryzae (16SrXI)
Manimekalai et al. (2010)
Tabel 7 Fitoplasma grup witches broom phytoplasma (16SrII) yang pernah dilaporkan pada beberapa tanaman inang
Negara (No aksesi GenBank)
Nama penyakit Tanaman inang Referensi
Australia ( HQ404357) (HM583346) (Y08173) (JF340080) Bituminaria WB Stunting & necrosis Australian die back Coneflower WB Bituminaria bituminosa Pelargonium capitatum Carica papaya Echinacea pallida Aryamanesh et al.(2011)
Lee & Jones (2010) Gibb et al (1998) Pearce et al. (2011) Iran (GQ861500) (FJ788514) Cucumber phyllody WB disease Spinacia oleracea, Elaeagnus angustifolia Tazehkhan et al. (2010) Rashidi et al. (2010) Taiwan (L33765) (L33770) (EF193157) Peanut WB Sweet potato WB Pear decline Arachis hypogea Ipomoea batatas Pyrus pyrifolia Gundersen et al (1994) Gundersen et al (1994) Liu et al. (2007) Serbia
(JF799094) WB disease Picris hieracioides Mitrovic et al. (2011) Thailand (GU004373) (EF193353) -Sesame phyllody Soybean phyllody Sesamum indicum Glycine max Lee et al (2007) Martini et al.(2007) China (EU099561) (EF656453) Cactus WB Crotalaria WB Opuntia species Crotalaria sp. Cai et al (2008) Wang et al. (2008) Italia
(Y16393) Phyllody Picris echioides Lee et al (2007) Ethiopia
(EU137845) Napier grass stunt Pennisetum purpureum Arocha et al. (2009) Arab Saudi
(EU119389) Decline disease Chenopodium morale Alhudaib et al. (2009) Inggris
(FJ008924) Stunting Fallopia japonica Reeder et al. (2010) Jepang
(AB247462) Virescence Dendranthema grandiflorum
Naito et al. (2007) Oman
(HQ423156) Phyllody Solanum melongena Al-Subhi et al. (2011) WB: witches broom; Semua koleksi strain fitoplasma yang termasuk ke dalam grup peanut witches broom phytoplasma dapat diakses di
http://www.ncbi.nlm.nih.gov/Taxonomy/Browser/wwwtax.cgi?mode=Undef&id=85621&lvl=3&k eep=1&srchmode=1&unlock
Hasil penelitian ini juga menunjukkan adanya amplikon DNA dari hasil nPCR menggunakan primer R16F2n/R16R2 yang bukan merupakan fragmen DNA fitoplasma setelah dilakukan pencocokan dengan data sekuen gen di GenBank. Dari 8 sekuen DNA yang bukan fitoplasma, 3 sekuen berupa berupa Bacillus megaterium, 2 sekuen berupa Clostridium sp., 3 sekuen sisa berupa Bacillus sp., Friedmanniella lacustris dan Lagionella birminghamensis. Persentase kesamaan sekuen amplikon nPCR ini dengan data sekuen di GenBank adalah 93-96% (Tabel 4). Amplikon DNA bukan fitoplasma ini diperoleh dari contoh tanaman kelapa yang tidak memperlihatkan gejala penyakit layu kelapa, memiliki gejala penyakit ringan, dan berat.
Menurut Bai et al. (2006), fitoplasma erat berhubungan dengan bakteri Gram Positif khususnya grup Bacillus dan Clostridium yang menjadi nenek moyang fitoplasma. Hal ini berarti banyak sekuen gen fitoplasma dan bakteri Gram Positif yang akan memiliki kesamaan. Fitoplasma merupakan kelompok mollicute yang dalam sejarahnya berasal dari bakteri Gram Positif yang kehilangan dinding sel selama proses evolusinya. Friedmanniella lacustris juga termasuk ke dalam bakteri Gram positif dan mempunyai kesamaan 96% dengan sekuen gen F. lacustris yang telah didepositkan oleh Lawson et al. (2000) dan bukan merupakan patogen terhadap tanaman. Lain halnya dengan L. birminghamensis yang mempunyai persentase kesamaan 95% dengan strain yang didepositkan oleh Hockey et al (1995) dan Wilkinson et al. (1987), merupakan bakteri yang patogenik terhadap manusia.
Terdeteksinya berbagai strain bakteri Gram Positif ini mengindikasikan bahwa primer fitoplasma yang digunakan belum benar-benar spesifik. Untuk membedakan amplikon DNA produk primer R16F2n/R16R2 sebagai fitoplasma atau bukan fitoplasma tidak cukup hanya dengan nPCR karena ukuran yang dihasilkan relatif sama yakni sekitar 1.25 kb. Amplikon DNA masih memerlukan sequencing dan analisis RFLP untuk memperjelas klasifikasi dan karakterisasinya. Isolasi terhadap berbagai bakteri Gram Positif yang bersifat endofit telah dilakukan dalam penelitian ini yang juga dilanjutkan dengan ekstraksi DNA biakan murni, deteksi dengan nPCR, dan sequencing. Hasilnya menunjukkan bahwa 9 bakteri yang diperoleh secara acak merupakan Bacillus spp., B.
megaterium, dan Clostridium spp. Bakteri ini juga telah melalui uji reaksi hipersensitif pada daun tembakau dan menunjukkan hasil yang negatif. Hal ini membuktikan bahwa bakteri-bakteri ini bukan merupakan patogen pada tanaman.
Analisis Filogenetik
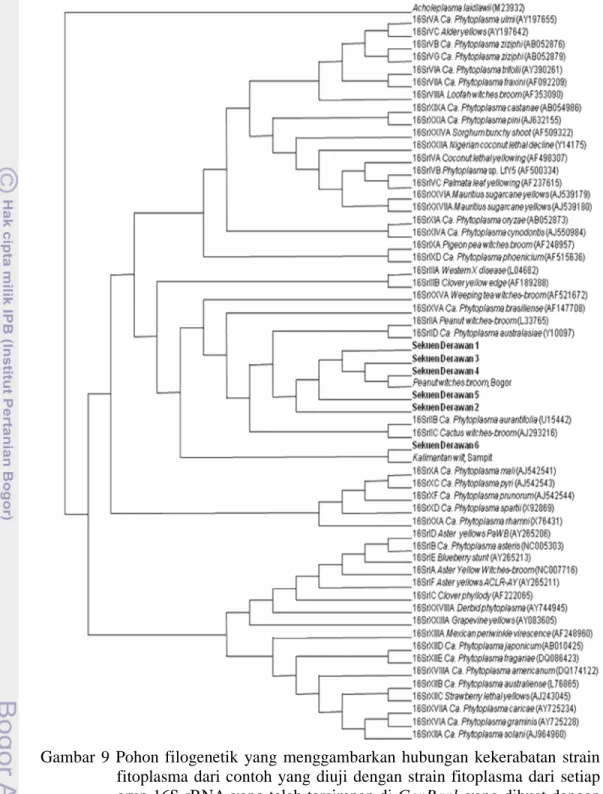
Analisis hasil sequencing dengan uji filogenetik menggunakan metode analisis bootstrap neighbor-joining dengan program PAUP 4.0 menunjukkan bahwa lima sekuen DNA fitoplasma (Sekuen Derawan 1 – 5, Gambar 9) memiliki kekerabatan yang tinggi dengan kelompok witches broom phytoplasma (grup 16SrIIA-D), sama halnya dengan sekuen kontrol dari kacang tanah dan kedelai (peanut witches broom Bogor). Hal ini memperkuat hasil BLAST dari NCBI. Sekuen Derawan 6 dan sekuen DNA Kalimantan wilt dari Sampit mempunyai hubungan kekerabatan yang tinggi, tetapi relatif jauh dari Ca. Phytoplasma oryzae. Dua sekuen tersebut justru lebih dekat dengan kelompok witches broom phytoplasma. Hasil penggambaran pohon filogenetik ini berbeda dengan hasil BLAST dari NCBI yang menyatakan bahwa Sekuen Derawan 6 dan sekuen kalimantan wilt dekat dengan Ca. Phytoplasma oryzae. Berbagai strain fitoplasma yang digunakan dalam analisis ini diambil dari GenBank berdasarkan Hodgetts & Dickinson (2010).
Hasil analisis filogenetik menggunakan perangkat lunak Bioedit dan Clustel X juga menunjukkan grafik yang sama dengan PAUP 4.0 (gambar tidak ditampilkan). Keenam sekuen Derawan mempunyai hubungan kekerabatan yang tinggi dengan kelompok witches broom phytoplasma (grup 16SrII) khususnya grup 16SrIIA (peanut witches broom phytoplasma) dengan sekuen Derawan 6 terpisah dengan 5 sekuen Derawan yang lain. Sekuen Derawan 6 sangat dekat dengan sekuen DNA Kalimantan wilt.
Gambar 9 Pohon filogenetik yang menggambarkan hubungan kekerabatan strain fitoplasma dari contoh yang diuji dengan strain fitoplasma dari setiap grup 16S rRNA yang telah tersimpan di GenBank yang dibuat dengan analisis bootstrap neighbor-joining program PAUP 4.0
Restriction Fragment Length Polymorphisms (RFLP) In Silico
Hasil simulasi analisis RFLP menggunakan komputer (in silico) oleh Wei et al. (2007) diperoleh 6 pola pita DNA pada gel agarosa yang berbeda sama
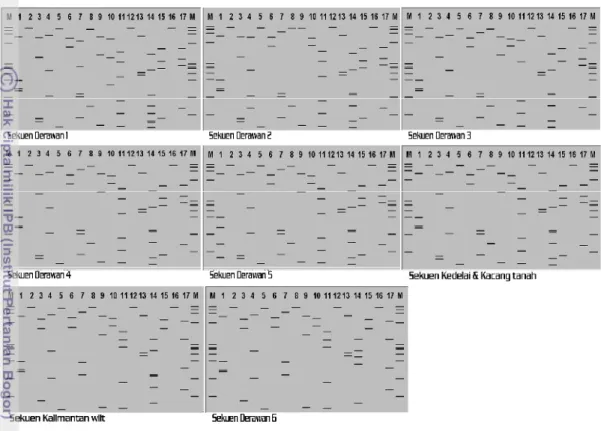
seperti yang ditunjukkan pada Tabel 5 dengan sekuen fitoplasma yang juga berbeda. Sekuen Derawan 1 – 5 mempunyai pola fragmentasi yang mirip dengan sekuen Kedelai & Kacang tanah (Gambar 10).
Gambar 10 Ploting hasil analisis RFLP in silico menggunakan 17 enzim restriksi. Lajur 1-17 berturut-turut AluI, BamHI, BfaI, BstUI, DraI, EcoRI, HaeIII, HhaI, HinfI, HpaI, HpaII, KpnI, Sau3AI, MseI, RsaI, SspI, dan TaqI) terhadap 6 sekuen DNA yang berbeda dari Pulau Derawan, sekuen kedelai dan kacang tanah, serta sekuen Kalimantan wilt pada 3% gel agarosa. M, markerϕX174DNA-HaeIII digestion
Bila sekuen-sekuen ini dibandingkan dengan masing-masing kelompok fitoplasma yang telah diteliti oleh Wei et al. (2007), maka sekuen-sekuen ini memiliki kemiripan yang tinggi dengan kelompok 16SrII-A, yaitu peanut witches broom phytoplasma. Sekuen Derawan 6 memiliki pola fragmentasi RFLP yang mirip dengan sekuen Kalimantan wilt. Kedua sekuen ini memiliki kesamaan dengan kelompok fitoplasma 16SrII (witches broom phytoplasma ) dan 16SrXI-A atau Ca. Phytoplasma oryzae (Wei et al. 2007). Pola fragmentasi dari kelompok fitoplasma witches broom phytoplasma dan Ca. Phytoplasma oryzae yang diteliti oleh Wei et al. (2007) diperlihatkan pada Lampiran 2.
Tabel 8 Koefisien kesamaan yang diperoleh dari analisis pola RFLP in silico gen 16S rRNA dari 6 sekuen DNA asal Pulau Derawan
Sekuen
fitoplasma 1 2 3 4 5 6 kw p s IIA XIA
Derawan 1 1,00 Derawan 2 0,88 1,00 Derawan 3 0,88 0,86 1,00 Derawan 4 0,92 0,94 0,98 1,00 Derawan 5 0,93 0,92 0,93 0,98 1,00 Derawan 6 0,74 0,72 0,79 0,75 0,76 1,00 Kalimantan wilt 0,76 0,81 0,76 0,75 0,77 0,95 1,00 Peanut 0,92 0,90 0,97 0,99 0,97 0,74 0,75 1,00 Soybean 0,92 0,90 0,97 0,99 0,97 0,74 0,75 1,00 1,00 16SrIIA 0,95 0,95 0,98 0,98 0,96 0,84 0,84 0,99 0,99 1,00 16SrXIA 0,71 0,70 0,72 0,73 0,73 0,74 0,74 0,68 0,68 0,61 1,00 No 1 – 6: Sekuen Derawan 1 – 6 dari kelapa Pulau Derawan, kw: sekuen Kalimantan wilt dari kelapa Sampit, p: sekuen dari kacang tanah Bogor, s: sekuen dari kedelai Bogor, 16SrIIA – 16SrXIA (Wei et al. 2007).
Pola RFLP yang tampak pada gel agarosa bisa dibandingkan dengan perangkat lunak Adobe Photoshop menggunakan fungsi layer ganda. Koefisien kesamaannya (F) kemudian dihitung untuk masing-masing pasangan strain fitoplasma berdasarkan rumus F = (Nx + Ny)/2Nxy, dengan x dan y merupakan dua strain fitoplasma yang berbeda, Nx dan Ny adalah total jumlah fragmen DNA yang dihasilkan dari pemotongan menggunakan 17 enzim restriksi, berturut-turut dari strain fitoplasma x dan y, serta Nxy ialah jumlah fragmen DNA dari kedua strain fitoplasma (Lee et al. 1998, Wei et al. 2007). Hasil penghitungan koefisien kesamaan antar strain fitoplasma tertera pada Tabel 8. Sekuen Derawan 1 – 5, sekuen kacang tanah (peanut), dan sekuen kedelai (soybean) memiliki tingkat kemiripan yang tinggi mulai 0,88 hingga 1, sedangkan sekuen Derawan 6 mempunyai tingkat kemiripan 0,95 dengan sekuen Kalimantan wilt. Sekuen Derawan 1 – 6 mempunyai nilai koefisiensi kesamaan 0,84 – 0,98 dengan grup 16SrIIA (peanut witches broom phytoplasma), sedangkan sekuen kacang tanah dan kedelai memiliki nilai koefisiensi kesamaan 0,99 dengan grup 16SrIIA.
Hasil sequencing dan analisis hasil sequencing membuktikan adanya perbedaan strain fitoplasma yang berasosiasi dengan tanaman kelapa pada penyakit layu kelapa di Pulau Derawan dan penyakit lethal yellowing. Penyakit lethal yellowing disebabkan oleh Ca. Phytoplasma palmae yang termasuk ke dalam grup 16SrIV sedangkan hasil penelitian ini menunjukkan bahwa strain fitoplasma asal penyakit layu kelapa Pulau Derawan memiliki hubungan kekerabatan yang tinggi dengan kelompok witches broom phytoplasma (grup 16SrII). Dengan demikian fitoplasma penyakit layu kelapa di Pulau Derawan berbeda dengan fitoplasma lethal yellowing. Status penyebab penyakit lethal yellowing masih tetap sebagai OPTK A1 di Badan Karantina Pertanian Indonesia.
Namun demikian, penyakit ini perlu menjadi perhatian yang serius khususnya kekhawatiran penyebaran ke tempat yang lain maupun penularan dari tanaman kelapa ke tanaman kelapa sawit. Pulau yang berdekatan dengan Pulau Derawan adalah Pulau Sangalaki, Pulau Maratua, Pulau Kakaban, dan Pulau Samama yang selain juga sebagai daerah objek wisata pantai juga terdapat tanaman kelapa yang dibudidayakan. Wilayah Pulau Kalimantan yang terdekat adalah daerah Tanjung Batu di Kab. Berau yang saat ini sudah mulai ditanami dengan tanaman kelapa sawit walaupun masih tanaman belum menghasilkan dan masih berumur 2 tahun (TBM2). Pemantauan yang optimal dapat membantu pengetahuan tentang penyebaran penyakit ini.
Strain fitoplasma yang berasosisasi dengan penyakit layu kelapa di Pulau Derawan belum dapat dikatakan sebagai penyebab primer penyakit. Hal ini karena belum dilakukannya uji postulat Koch. Secara artifisial, penyebab penyakit perlu ditularkan ke tanaman kelapa sehat dan kemudian tanaman tersebut menunjukkan gejala penyakit layu.
Deteksi dan Sequencing Fitoplasma pada Wereng Daun dan Tumbuhan Cassytha filiformis
Serangga yang paling umum menjadi vektor fitoplasma adalah wereng-werengan. Hasil tangkapan menggunakan jaring serangga diperoleh empat jenis wereng yang secara visual termasuk ke dalam spesies wereng daun (Homoptera: Cicadelidae). Masing-masing wereng tersebut berbeda berdasarkan morfologi
baik warna, corak, maupun ukuran tubuh (Gambar 11). Wereng ini diperoleh dari gulma-gulma yang tumbuh di sekitar tanaman kelapa yang terserang penyakit layu.
Berdasarkan karakter morfologi, baik kepala, torak, abdomen maupun tungkai, wereng-wereng ini termasuk ke dalam famili Cicadellidae (Carver et al. 1991) dan termasuk kelompok wereng daun. Karakter yang dapat membedakan dengan wereng batang adalah tidak dimilikinya taji pada tungkai. Wereng daun masuk ke dalam sub ordo Homoptera ordo Hemiptera.
Gambar 11 Beberapa jenis wereng daun yang ditemukan di sekitar tanaman kelapa bergejala penyakit layu: (a) warna sayap hijau, mata gelap; (b) warna sayap kecoklatan, mata agak gelap; (c) warna sayap coklat muda, mata coklat muda/terang; (d) warna sayap hijau tua dengan ujung bercorak hitam, mata gelap
Beberapa jenis vektor dari kelompok wereng daun yang pernah dilaporkan menjadi agen penyebaran penyakit pada tanaman kelapa diantaranya adalah Stephanitis typica (Mitchell 2004), Myndus crudus (Ogle & Harries 2005), Cedusa sp. (Brown et al. 2006), Proutista moesta (Edwin & Mohankumar 2007). Myndus crudus merupakan vektor yang paling banyak ditemukan sebagai agen penularan penyakit layu pada tanaman kelapa.
Uji penularan penyakit secara in vitro maupun in vivo sangat diperlukan untuk mengkaji kebenaran serangga tersebut sebagai vektor penyakit. Tanpa adanya uji ini, serangga tersebut belum bisa dikatakan sebagai vektor penyakit. Hal ini dikarenakan fitoplasma yang hidup pada jaringan pengangkutan floem
akan terhisap oleh vektor ketika stiletnya mengambil makanan dari jaringan tersebut. Fitoplasma pada tubuh serangga kemudian bisa mati atau berkembang biak. Menurut Hogenhout et al. (2008), fitoplasma harus masuk ke dalam peredaran darah dan dikeluarkan melalui kelenjar ludah serangga. Fitoplasma juga harus tetap menjaga virulensinya sebagai penyebab penyakit setelah mampu berpindah dari tubuh serangga ke tanaman yang masih sehat.
Tumbuhan yang diduga dapat menjadi reservoir dan agen penularan fitoplasma di Pulau Derawan adalah tali cinta Cassytha filiformis L. yang tumbuh lebat di sepanjang pantai. Pertumbuhan tanaman ini mirip dengan tanaman tali putri (dodder) Cuscuta spp. yakni terlihat hanya seperti batang tanaman yang tumbuh menjalar, melilit dan menyelimuti hampir seluruh permukaan tanaman inang (Gambar 12). Tanaman ini menghasilkan bunga dan buah yang tampak bergerombol seperti pada tanaman kacang-kacangan. Terdapat dua warna tanaman yang tumbuh di Pulau Derawan, ialah warna jingga dan hijau.
Gambar 12 Morfologi tanaman Cassytha filiformis yang hampir menutupi seluruh permukaan tanaman inang: (a) buah, (b) tanaman berwarna jingga, (c) tanaman berwarna hijau
Tali cinta C. filiformis terlihat memarasit sejumlah gulma baik gulma rumputan maupun gulma berdaun lebar yang hidup di sekitar tanaman kelapa. Bahkan pada tanaman kelapa yang masih muda, mulai dari bibit hingga tanaman berumur sekitar 5 tahun, tanaman ini terlihat menancapkan haustoriumnya untuk mencari makanan pada daun dan pelepah tanaman kelapa ini (Gambar 13).
Gambar 13 Tanaman C. filiformis pada beberapa tanaman inang: (a) pada tanaman kelapa, (b) pada gulma rumputan, dan (c) pada gulma berdaun lebar. Tanda panah merupakan haustorium tanaman tali cinta yang menempel pada daun dan pelepah tanaman kelapa muda
Tumbuhan C. filliformis sebenarnya lebih banyak dikenal dalam bidang farmakologi sebagai obat anti kanker yang merupakan tanaman asli Hawai. Walaupun morfologi bentuk, cara hidup dan perkembangan yang relatif mirip dengan tanaman tali putri (Cuscuta sp.), tetapi tanaman C. filiformis tidak satu keluarga dengan Cuscuta sp. Tanaman C. filiformis tergolong ke dalam famili Lauraceae, sedangkan Cuscuta sp. termasuk ke dalam famili Convolvuraceae (Nelson 2008). Perbedaan antara C. filiformis dan Cuccuta sp. dijelaskan pada Tabel 9.
Tabel 9 Perbandingan karakteristik spesies C. filiformis dan Cuscuta sp. (Nelson 2008)
Uraian C. filiformis Cuscuta sp.
Batang Hijau sampai jingga Kuning terang sampai
jingga
Bunga Spicate inflorescence Globose clusters atau cymose cluster
Habitat pertumbuhan Memanjat, menyebar Utamanya hanya menyebar Pemilihan inang Banyak pada tanaman
berkayu walaupun
ditemukan juga pada gulma
tanaman herbaceous atau gulma
Tanaman tali cinta ini diduga menjadi vektor penularan penyakit pada tanaman kelapa yang disebabkan oleh fitoplasma seperti yang telah dilaporkan
oleh Oropeza et al. (2009). Namun demikian, belum ada penelitian yang mengkaji tentang efektivitas tanaman ini sebagai agen penularan penyakit. Studi penelitian yang ada hanya sebatas pendeteksian fitoplasma pada tanaman tali cinta yang berada di sekitar tanaman kelapa yang sakit.
Hasil amplifikasi DNA menggunakan metode nPCR dengan primer R16F2n/R16R2 menunjukkan bahwa baik pada wereng daun maupun pada tanaman tali cinta terdapat amplikon DNA dengan ukuran sekitar 1.25 kb (Gambar 14). Amplikon DNA ini diduga merupakan fragmen DNA 16S rRNA fitoplasma, walaupun masih harus dibuktikan dengan sequencing.
Sama halnya seperti pada tanaman, amplifikasi DNA pertama kali menggunakan primer P1/P7 juga tidak memperlihatkan adanya pita DNA. Amplikon DNA baru terlihat setelah produk PCR pertama yang diamplifikasi kembali dengan primer R16F2n/R16R2.
Gambar 14 Fragmen DNA fitoplasma hasil nPCR menggunakan primer R16F2n/R16R2 dari tanaman Cassytha filiformis dan berbagai wereng daun. Lajur t1, t2, dan t3 adalah berturut-turut untuk buah, tanaman jingga, dan tanaman hijau C. filiformis; Lajur M, 100 bp DNA ladder; Lajur w1, w2, w3, dan w4 berturut-turut adalah wereng dengan kode a, b, c, dan d pada Gambar 11
Hasil sequencing menunjukkan bahwa sekuen DNA dari tanaman C. filiformis, baik yang berwarna jingga maupun yang berwarna hijau mempunyai urutan basa yang sama dengan sekuen Derawan 2 dan 5 dari contoh tanaman kelapa Pulau Derawan sehingga hasil BLAST di NCBI menunjukkan bahwa sekuen-sekuen ini memiliki nilai homologi 99% dengan sekuen gen 16S rRNA 'Echinacea purpurea' witches'-broom phytoplasma isolat T4 dari Taiwan
1250 bp
(JN885462.1). Namun demikian, pada buah C. filiformis tidak ditemukan adanya strain fitoplasma, melainkan bakteri B. megaterium. Hasil sequencing DNA dari contoh wereng daun menghasilkan 3 sekuen yang sama dengan sekuen Derawan 3, 5, dan 6 dari contoh tanaman kelapa Pulau Derawan. Data selengkapnya ditunjukkan pada Tabel 10. Dua sekuen wereng daun (w1, w3, w4) dan w2 memiliki nilai homologi 99% dengan kelompok witches broom phytoplasma (JN885462.1), sedangkan satu sekuen w3 mempunyai nilai homologi 96% dengan sekuen gen 16S rRNA 'Psammotettix cephalotes' flower stunt phytoplasma strain BVK (HQ589192).
Tabel 10 Data hasil sequencing dan uji BLAST pada NCBI dari produk nPCR contoh wereng daun dan tanaman tali cinta di Pulau Derawan
No ∑ sekuen yang sama Ukuran (bp) Asal contoh (kode)
Strain yang mirip dari uji Blast (no aksesi)
% kemiripan 1 2 1.292 t1 B. megaterium(CP003017.1) 96 2 1 1247 t2 WB Phytoplasma(JN885462.1) 99 3 1 1247 t3 WB Phytoplasma(JN885462.1) 99 4 2 1247 t3 WB Phytoplasma(JN885462.1) 99 5 1 1247 w1 WB Phytoplasma(JN885462.1) 99 6 2 1247 w2 WB Phytoplasma(JN885462.1) 99
7 1 1247 w3 Ca. Phytoplasma oryzae 96
8 1 1247 w3 WB Phytoplasma(JN885462.1) 99
9 1 1247 w4 WB Phytoplasma(JN885462.1) 99
WB: witches broom. t1, t2, dan t3, berturut-turut adalah buah, tanaman jingga, dan tanaman hijau C. filiformis. w1, w2, w3, dan w4, berturut-turut adalah wereng daun dengan kode a, b, c, dan d pada Gambar 10
Wereng daun dan tanaman tali cinta yang positif mengandung fitoplasma ini belum dapat dikatakan sebagai vektor patogen. Secara artifisial, kandidat vektor tersebut perlu diujikan pada tanaman kelapa sehat dan kemudian tanaman memperlihatkan gejala penyakit layu.
Oleh karena fitoplasma termasuk patogen yang obligat, maka kajian menarik yang dapat dilakukan selanjutnya adalah mengetahui adanya interaksi antara inang, patogen dan vektor yang dapat dideteksi dini secara molekuler.
Gen-gen tertentu yang menyandi kemungkinan adanya hubungan dari ketiga faktor segitiga penyakit ini mulai diteliti, diantaranya adalah Suzuki et al. (2006) dengan mengetahui interaksi antara protein membran fitoplasma dan kompleks mikrofilamen serangga vektor, Bai et al. (2007) yang menduga adanya protein efektor yang dikeluarkan dan diakumulasikan oleh fitoplasma pada sel tanaman inang dan vektornya, Arashida et al. (2008) dan Kakizawa et al. (2009) yang meneliti interaksi fitoplasma dan tanaman inang melalui protein immunodominant membrane.