5 BAB II
TINJAUAN PUSTAKA
2.1Proses Aterosklerosis
Dalam beberapa dekade terakhir, teori mengenai patogenesis
aterosklerosis memprediksi bahwa proliferasi sel otot polos (SMCs) menjadi
penyebab terbentuknya lesi fibrous yang mengelilingi “inti nekrosis” akibat
deposit kolesterol dan kolesteril-ester. Sel endotel normal (EC) akan menghambat
interaksi adhesif dengan leukosit dalam darah, sedangkan EC yang distimulasi
oleh ekspresi sitokin proinflamasi akan mengekspresikan molekul adhesif untuk
menangkap dan mengikat leukosit pada permukaan endotel. Pada uji coba hewani,
setelah inisiasi dengan diet hiperkolesterol, arteri menunjukkan ekspresi
bermacam-macam molekul adhesif leukosit yang meningkat, termasuk vascular
cell adhesion molecule-1 (VCAM-1) dan selektin-P. VCAM-1 hanya berikatan dengan sel darah putih yang ditemukan pada lesi aterosklerosis awal seperti
mononuklear fagosit dan limfosit T. Jadi transisi arteri normal menjadi lesi
aterosklerosis bergantung pada jumlah leukosit yang menginisiasi dan kemudian
melanjutkan proses inflamasi secara terus menerus.
Sesaat setelah berikatan dengan permukaan endotel, leukosit memerlukan
sinyal kemotraktan untuk dapat langsung bermigrasi ke lapisan intima
subendotelial. Sitokin proinflamasi yang multipel berpartisipasi dalam proses ini.
Monocyte chemoattractant protein-1 (MCP-1) menyebabkan transmigrasi monosit. Sel dinding vaskular intrinsik, endotelium, dan otot polos dapat
memproduksi MCP-1. Sitokin kemotraktan yang lain seperti fraktalkin dan
interleukin (IL-8) juga dapat menyebabkan migrasi leukosit adheren selama
Fagosit mononuklear mengalami perubahan ciri dan membentuk foam cell
setelah masuk ke intima arteri. Monosit juga akan mengekspresikan reseptor
scavenger, yang menangkap lipoprotein sehingga berakumulasi pada ruang subendokardium. Kemampuan menangkap lipoprotein ini menyebabkan
pembentukan kompleks makrofag-lipid yang disebut foam cell, tanda khas lesi
aterosklerosis awal, yang disebut fatty streak (Libby, 2006)
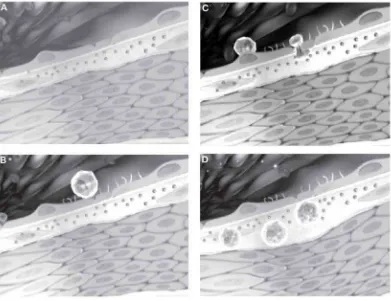
Gambar 2.1. Proses pembentukan foam cell (A) Artery normal, meliputi lumen yang
dilapisi endotelium, lapisan intima, dan tunika media. (B) Sel endotelium yang terekspos
dengan mediator inflamasi mengekspresikan molekul adhesif pada permukaan lumen.
Molekul adhesi ini berikatan dengan reseptor pada leukosit, menyebabkan perlengketan
pada permukaan endotelium. (C) Sitokin kemotraktan seperti MCP-1, fraktalkin, dan IL-8
memberi sinyal kepada leukosit untuk menetrasi lapisan endotelium ke intima dengan
diapedesis. (D) Monosit akan mengekspresikan reseptor scavenger dan menjadi foam cell,
plak juga bereplikasi. Mediator inflamasi seperti M-CSF dapat memproduksi reseptor
scavenger dan proliferasi makrofag pada ateromata (Libby, 2006).
2.2Inflamasi pada Aterosklerosis
Hiperkolesterolemia menyebabkan aktivasi endotelium pada arteri sedang
dan besar. Infiltrasi dan retensi LDL pada intima menginisiasi respon inflamasi
pada dinding arteri. Trombosit adalah sel darah pertama yang tiba pada lokasi
endotelium yang teraktivasi. Glikoprotein Ib dan IIb/IIIa akan berikatan dengan
permukaan molekul sel endotelium, yang berkontribusi pada aktivasi endotel. Sel
endotel yang teraktivasi mengekpresikan berbagai tipe molekul adhesif leukosit,
yang menyebabkan sel darah akan berikatan pada tempat aktivasi (Gambar 2.2).
Sitokin yang diproduksi pada intima yang mengalami inflamasi yaitu
macrophage colony-stimulating factor, menginduksi monosit yang masuk ke dalam plak dan berdiferensiasi menjadi makrofag. Hal ini penting dalam
perkembangan aterosklerosis dan berhubungan dengan regulasi reseptor untuk
imunitas bawaan, termasuk reseptor scavenger dan reseptor toll-like.
Reseptor scavenger menangkap dan menghancurkan sejumlah molekul dan
partikel yang memiliki pola seperti patogen meliputi endotoxin bakteri, fragmen
sel apoptosis, dan LDL yang teroksidasi. Reseptor toll-like juga berikatan dengan
molekul dengan pola molekul seperti patogen, tetapi berbeda dengan reseptor
scavenger, reseptor ini menginisiasi kaskade sinyal yang menyebabkan aktivasi
sel.
Sel imun (termasuk sel T, sel dendritik yang mempresentasikan antigen,
monosit, makrofag, dan sel mast) dan patrol tissue (termasuk arteri yang
mengalami aterosklerosis) akan mencari antigen. Infiltrasi sel T selalu dijumpai
pada lesi aterosklerosis. Ketika reseptor antigen sel T berikatan dengan antigen,
dan enzim. Respon T-helper tipe 1 (Th1) mengaktivasi makrofag, menginisiasi
respon inflamasi yang mirip dengan hipersensitivitas dan berfungsi melawan
patogen intraseluler, sedangkan respon T-helper tipe 2 (Th2) berupa inflamasi
alergi. Lesi aterosklerosis mengandung sitokin yang merangsang respon Th1. Sel
T yang teraktivasi kemudian berdiferensiasi menjadi sel efektor Th1 dan mulai menghasilkan sitokin interferon γ oleh makrofag. Interferon γ meningkatkan efisiensi presentasi antigen dan sintesis sitokin inflamasi berupa tumor necrosis
factor dan interleukin-1 (Gambar 2.3).
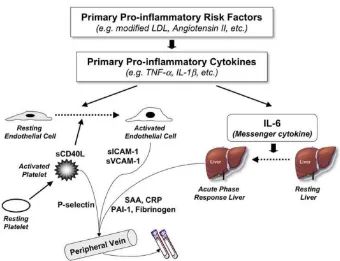
Sitokin sel T menyebabkan produksi sejumlah besar molekul pada kaskade
sitokin. Peningkatan jumlah interleukin-6 dan C-reactive protein dapat terdeteksi
di sirkulasi perifer (Hansson, 2005) (Gambar 2.4).
. .
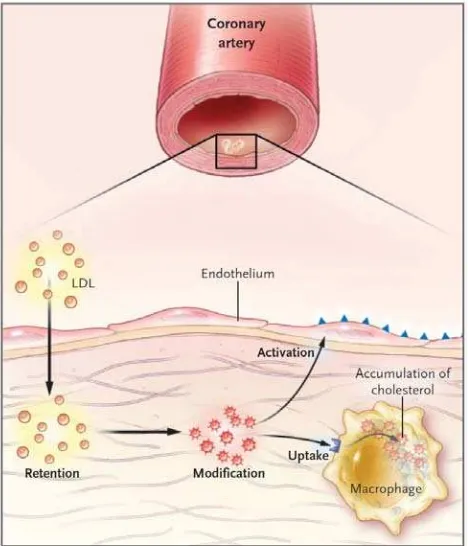
Gambar 2.2. Efek aktivasi infiltrasi LDL pada arteri yang terinflamasi (Hansson,
2005). Pada pasien hiperkolesterol, kelebihan LDL akan berinfiltrasi pada arteri dan
tertahan pada intima. Proses oksidatif dan enzimatik menyebabkan pelepasan lemak
terinflamasi yang menginduksi sel endotel untuk mengekspresikan molekul adhesif
leukosit. Partikel LDL termodifikasi akan ditangkap oleh reseptor scavenger yang
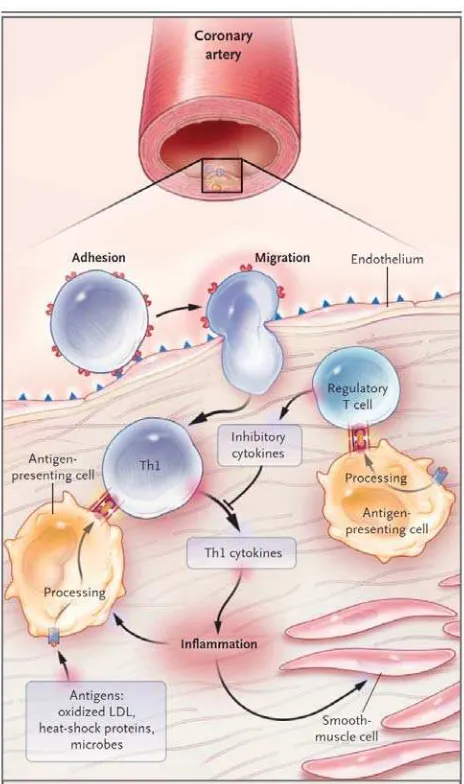
Gambar 2.3. Efek aktivasi sel T pada plak yang terinflamasi (Hansson, 2005).
Antigen yang dipresentasikan oleh makrofag dan sel dendritik akan merangsang aktivasi
sel T pada arteri. Kebanyakan sel T yang teraktivasi akan memproduksi sitokin Th1
(interferon γ), yang mengaktivasi sel makrofag dan vaskuler, menyebabkan inflamasi. Sel
T akan memodulasi proses dengan mensekresi sitokin antiinflamasi (seperti
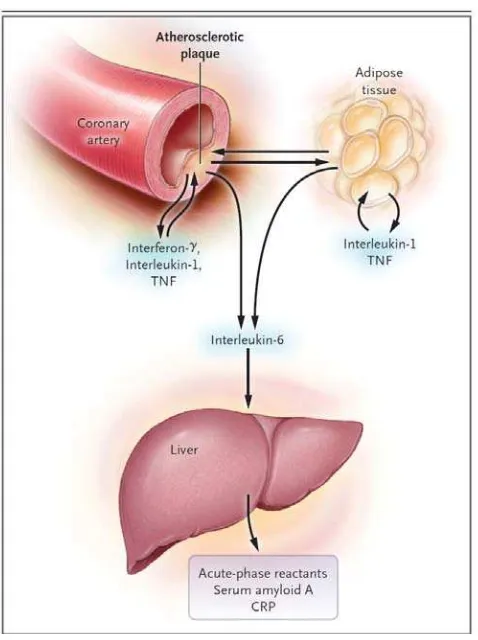
Gambar 2.4. Kaskade Sitokin (Hansson, 2005). Sel imun yang teraktivasi pada plak
memproduksi sitokin inflamasi (interferon γ, interleukin-1, dan tumor necrosis factor
[TNF]), yang menginduksi produksi sejumlah interleukin-6. Sitokin ini juga diproduksi
oleh berbagai jaringan sebagai respon infeksi dan jaringan lemak pada sindroma
metabolik. Interleukin-6 juga akan kembali menstimulasi produksi sejumlah besar reaktan
fase akut, termasuk CRP, serum amiloid A, dan fibrinogen, terutama di hati.
2.3Respon Inflamasi pada Intervensi Koroner Perkutan
Respon inflamasi berkorelasi dengan tingkat cedera arteri, karena reaksi
inflamasi merangsang kaskade sekuele trombosis dan hiperplasi. Dilatasi balon
pada dinding arteri akan memprovokasi deendotelialisasi dan deposit sejumlah
trombosit dan fibrin pada tempat yang mengalami cedera. Pembentukan kompleks
trombosit-trombosit, trombosit-leukosit, dan leukosit-sel endotel akan dimediasi
oleh molekul adhesif. Selektin P memediasi adhesi trombosit yang teraktivasi
Terdapat perbedaan antara stenting dan angioplasti pada mekanisme
patofisiologi terhadap perkembangan hiperplasi intima, karena reaksi inflamasi
pasca stenting lebih menonjol. Pada angioplasti hanya diikuti dengan infiltrasi
neutrofil awal, sedangkan pada stenting, infiltrasi neutrofil diikuti dengan
akumulasi makrofag secara terus menerus. Pada arteri yang dilakukan
pemasangan stenting, terdapat keterlibatan makrofag yang berlebihan dalam
neointima, sementara pada arteri yang dilakukan angioplasti tidak dijumpai
keterlibatan makrofag.
Pada fase awal implantasi stent, trombus mural akan terbentuk diikuti
dengan invasi SMCs, limfosit T dan makrofag, kemudian neointima yang
menutupi daerah stent secara lengkap setelah 4 minggu ini akan mengandung
sedikit matriks ekstraseluler yang semakin lama semakin banyak dan membentuk
segmen lengkap. Terdapat hubungan antara penetrasi stent dengan kepadatan sel
inflamasi dan ketebalan neointima. Neointima dari sel inflamasi lebih tebal 2-4
kali pada segmen dengan restenosis, dan inflamasi dihubungkan dengan
neoangiogenesis. Stenting dapat disertai dengan cedera bagian medial atau
penetrasi stent ke dalam inti lipid menginduksi peningkatan inflamasi arteri yang
berkorelasi dengan peningkatan pertumbuhan neointima (Toutouzas dkk, 2004).
2.4Penanda Inflamasi
Rangsangan inflamasi yang disebabkan oleh sitokin proinflamasi dapat
meningkat melalui produksi interleukin-6. Berbagai tipe sel seperti SMCs dan EC
dapat menghasilkan sejumlah besar interleukin-6 ketika terekspos dengan
interleukin-1β atau TNF-α. Interleukin-6 adalah mediator yang mengontrol respon
fase akut di hati. Ketika terkespos dengan interleukin-6, hepatosit akan
meningkatkan ekspresi protein fase akut, termasuk fibrinogen, PAI-1, serum
Gambar 2.5. Jalur inflamasi selama aterosklerosis yang dapat meningkatkan
konsentrasi penanda inflamasi pada darah (Libby, 2006).
Hubungan antara fibrinogen, serum amiloid A (SAA), dan CRP dengan
penyakit jantung koroner telah terbukti. Fibrinogen dan SAA dapat diukur di
laboratorium klinik, namun parameter dan nilai batas normal belum terstandarisasi
oleh FDA. CRP adalah protein yang sangat stabil dan telah diukur di berbagai
laboratorium selama beberapa dekade terakhir untuk menilai proses infeksi aktif
atau inflamasi. Metode yang sedang berkembang adalah high-sensitivity CRP
(hsCRP) karena dapat mengukur nilai CRP pada konsentrasi ≤0,3 mg/L.
CRP tersusun dari 5 subunit identik dan nonkovalen, masing-masing
terdiri dari 206 residu asam amino dengan berat molekul 23,017 kDa, sehingga
total berat molekul CRP sekitar 118,000 kDa dan merupakan mekanisme
pertahanan nonspesifik. CRP merupakan protein yang meningkat secara konsisten
dan protein fase akut yang paling cepat bereaksi (waktu paruh 19 jam),
menunjukkan CRP bagian dari respon imunitas bawaan. Konsentrasi CRP akan
meningkat sampai 1000 kali atau lebih dalam waktu 24-48 jam setelah cedera
kardiovaskular adalah: < 1mg/L dianggap risiko rendah, 1-3 mg/L risiko sedang,
>3 mg/L risiko tinggi. Usia dan etnik tidak mempengaruhi nilai CRP, tetapi
kondisi fisik dan kebiasaan hidup seperti aktivitas fisik, obesitas, merokok dan
konsumsi alkohol mempengaruhi konsentrasi CRP (Rifai, 2006).
HsCRP adalah penanda inflamasi yang dapat memprediksi insidensi infark
miokardium, stroke, penyakit arteri perifer, dan kematian jantung mendadak
diantara orang normal tanpa riwayat penyakit jantung, CRP juga memprediksi
insidensi serupa pada penderita sindroma koroner akut ataupun penyakit koroner
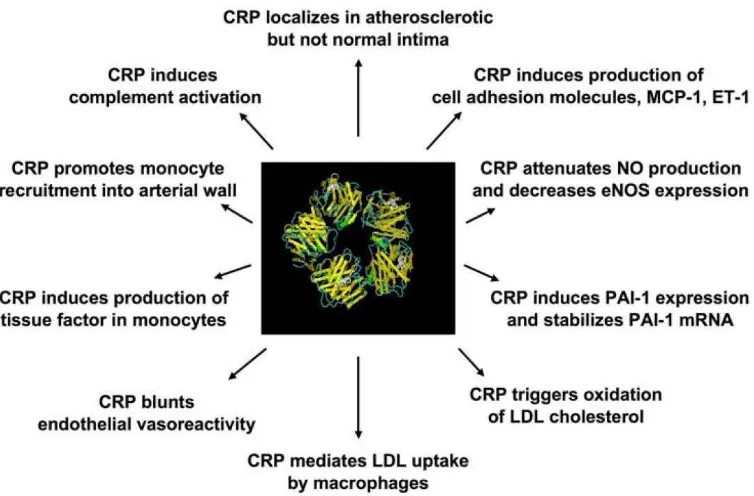
stabil. CRP tidak hanya disintesis oleh hati akibat respon terhadap interleukin-6
tetapi juga dihasilkan oleh sel otot polos dalam arteri koroner. Penelitian
menunjukkan CRP dapat mempengaruhi kerentanan vaskuler secara langsung
melalui banyak mekanisme, termasuk peningkatan ekspresi molekul adhesif pada
permukaan sel endotel, MCP-1, endotelin-1, dan PAI-1; menurunkan bioaktivitas
nitrit oksida (NO); peningkatan induksi faktor jaringan pada monosit; peningkatan
serapan LDL oleh makrofag; dan kolonisasi dengan kompleks membran
komplemen dalam lesi aterosklerosis (Bassuk dkk, 2006).
Gambar 2.6. Mekanisme terkait CRP terhadap perkembangan dan progresi
Liuzzo dkk menunjukkan pada 31 pasien dengan angina tidak stabil berat
dan tidak ada bukti nekrosis miokardium yang ditandai dengan tidak adanya
peningkatan troponin T, konsentrasi hsCRP > 3mg/L pada saat masuk
dihubungkan dengan peningkatan angina rekuren, revaskularisasi koroner, infark
miokardium, dan kematian kardiovaskuler. Data dari European Concerted Action
on Thrombosis and Disabilities (ECAT) Angina Pectoris Study Group, studi dari 2121 pria dan wanita dengan angina stabil dan tidak stabil menunjukkan setiap
peningkatan 1 standar deviasi hsCRP dihubungkan dengan peningkatan risiko
relatif sekitar 45% terhadap infark miokardium atau kematian jantung mendadak
(Haverkate dkk, 1997).
Peningkatan CRP juga berhubungan bermakna dengan peningkatan risiko
trombosis stent, kematian dan infark miokardium pada pasien yang mendapat
drug-eluting stent. Hal ini menunjukkan kegunaan dari penilaian risiko inflamasi dengan CRP (Park dkk, 2009). Inoue dkk menunjukkan CRP adalah penanda
unggulan untuk ketidakstabilan plak atau status inflamasi, dan sumbernya
kemungkinan besar berasal dari plak yang mengalami inflamasi atau dinding
arteri koroner yang cedera akibat stent (Inoue dkk, 2005). Studi menunjukkan
nilai CRP sebelum prosedur angioplasti merupakan prediktor kuat terhadap
kejadian komplikasi dini dan restenosis dari pasien yang menjalani angioplasti
pada satu pembuluh darah (Buffon dkk, 1999). hsCRP merupakan penanda baru
yang menjanjikan untuk prediksi penyakit koroner pertama ataupun rekuren (Rifai
dan Paul, 2001).
Kralisz dkk menunjukkan terdapat perbedaan antara nilai hsCRP sebelum
dan 24 jam setelah IKP (1.36±0.93 mg/L and 4.34±3.3 mg/L, p <0.0001), respon
inflamasi yang dipresentasikan oleh hsCRP lebih tinggi pada pasien dengan
intervensi koroner multivaskular dengan total segmen stent yang lebih panjang.
Nyandak dkk juga menunjukkan nilai hsCRP yang lebih tinggi pada pasien
dengan derajat stenosis yang lebih berat dan berhubungan dengan beban penyakit
2.5Kekuatan Bekuan Fibrin ( Fibrin Clot Strength)
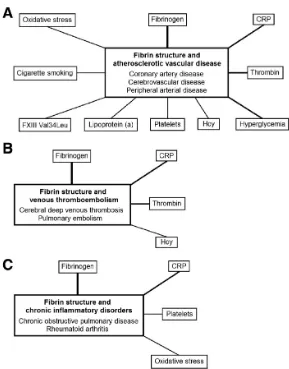
Pembentukan bekuan fibrin yang relatif resisten terhadap lisis
mempresentasikan hasil akhir dari koagulasi. Perubahan pada struktur fibrin telah
dilaporkan pada pasien dengan penyakit tromboemboli seperti riwayat infark
miokard atau infark miokard akut, stroke iskemik, dan tromboemboli vena.
Kebanyakan pasien dengan infark miokard atau tromboemboli vena menunjukkan
abnormalitas fibrin. Sejumlah faktor genetik dan lingkungan berkorelasi dengan
Gambar 2.7. Struktur bekuan fibrin dan penyakit tromboemboli (Undas, 2011).
Beberapa penyakit dilaporkan berhubungan dengan perubahan abnormal dari struktur dan
fungsi bekuan fibrin, terutama penurunan permeabilitas bekuan dan kerentanan terhadap
lisis, serta perubahan karakter bekuan fibrin.
Perubahan struktur bekuan pertama sekali didemonstrasikan pada pasien
dengan PJK berat pada tahun 1992. Peningkatan permeabilitas bekuan dan waktu
lisis juga diobservasi pada pasien dengan PJK berat di atas usia 60 tahun. Fibrin
merupakan komponen pada plak aterosklerosis dan keberadaannya dapat
menyebabkan pertumbuhan plak (Undas, 2007)
Implikasi bekuan fibrin dapat terjadi pada dua komplikasi yang
mengancam jiwa yaitu trombosis stent dan fenomena tanpa aliran darah (no-flow
endotelialisasi lengkap dan trombus fibrin yang menetap sebagai penyebab utama
pada trombosis stent. Pasien dengan trombosis stent menunjukkan struktur fibrin
yang lebih padat dan sedikit rongga (Undas, 2010). Perubahan ini menyebabkan
keberadaan fibrin yang lebih lama pada lumen vaskuler. Penemuan ini
mengindikasikan adanya faktor lain yang berhubungan dengan trombosis stent
(termasuk prosedur itu sendiri, karakteristik pasien dan lesi, desain stent, dan
penghentian dini obat antitrombosit). Struktur fibrin abnormal juga diamati pada
pasien dengan riwayat fenomena tanpa aliran darah, yang didefinisikan sebagai
tidak adanya perfusi miokardium lengkap meskipun arteri yang mengalami infark
telah sukses dibuka (Zalewski, 2007).
Struktur fibrin akan mempengaruhi tingkat fibrinolisis secara langsung.
Longstaff dkk menunjukkan akses bekuan terhadap protein fibrinolitik dan
perubahan ikatan tissue plasminogen activator (tPA) dan plasminogen, keduanya
diregulasi oleh struktur fibrin. Proses fibrinolisis cepat terjadi pada bekuan yang
mengandung sedikit trombosit, sedangkan area yang kaya akan trombosit relatif
tidak dapat lisis. Jaringan fibrin yang terdiri dari jaringan yang tipis, sangat
bercabang akan lebih kaku, kurang permeabilitas dan lebih sulit mengalami lisis
(Undas, 2011).
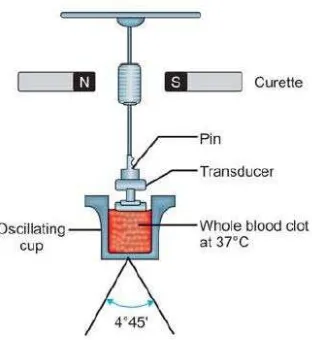
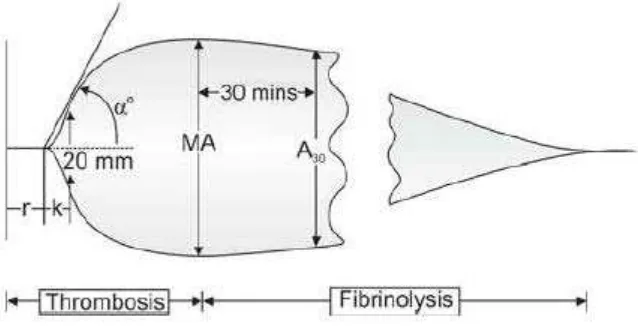
Tromboelastografi (TEG) adalah metode pengujian efisiensi koagulasi
dalam darah. Pertama kali dikembangkan oleh dr Hellmut Hartert di Universitas
Heidelberg, tahun 1948. TEG ditunjukkan sebagai suatu metode untuk mengatasi
keterbatasan tes koagulasi konvensional. TEG menghasilkan pengawasan
koagulasi darah keseluruhan yang efektif dan tepat. Alat ini mengevaluasi sifat
elastis dari darah dan memberikan taksiran global dari fungsi hemostasis.
Maximal clot strength atau fibrin clot strength pada tromboelstografi terdiri dari kontribusi pembentukan fibrin plasma dan agregasi trombosit secara
bersamaan untuk membentuk trombus yang stabil. Pada tromboelastografi,
parameter ini ditunjukkan dengan nilai G. Risiko yang berkorelasi dengan
trombosit yang tinggi dan pembentukan trombin pada permukaan trombosit yang
teraktivasi pada pasien dengan terapi dual antiplatelet (Kreutz, 2013).
Gambar 2.8. Tromboelastografi (Thakur, 2012)
Parameter perhitungan pada TEG terdiri dari:
- Waktu r: menunjukkan periode waktu laten dari awal tes sampai
pembentukan fibrin inisial. Hal ini merepresentasikan studi pembekuan
darah standar. Nilai normal 15-23 menit (pada darah natif), 5-7 menit
(pada darah yang bercampur dengan kaolin).
- Waktu k: menunjukkan waktu untuk mencapai tingkat kekuatan bekuan
(dimana waktu r = nol) dengan amplitudo 20 mm. Nilai normal 5-10 menit
(pada darah natif), 1-3 menit (pada darah yang bercampur dengan kaolin).
- Sudut α: mengukur kecepatan fibrin terbentuk dan jembatan-jembatan
fibrin bekerja (penguatan bekuan) dan menilai laju pembentukan bekuan.
Nilai normal: 22-38 (pada darah natif), 53-67 (pada darah yang bercampur
dengan kaolin).
- Amplitudo maksimal (MA): fungsi langsung dari ikatan trombosit dan
fibrin maksimal melalui Gp IIb/IIIa dan merepresentasikan kekuatan
terakhir dari bekuan fibrin yang berkorelasi dengan fungsi trombosit: 80%
trombosit, 20% fibrinogen. Nilai normal: 47-58 mm (pada darah natif),
- Nilai G: merupakan fibrin clot strength yang menunjukkan fungsi
hemostasis secara global dan dihitung dengan rumus G=(5000 x
MA)/(100- MA). Nilai normal: 4.500 – 11.000 dyne/s
- Coagulation Index: indikator koagulasi secara menyeluruh dengan
menggunakan formula yang ditentukan oleh produsen alat untuk
menentukan nilai normal, hipo atau hiperkoagulasi. Nilai normal: 3-3mm.
- LY30: persentase yang menurun dalam ampitudo 30 menit setelah MA
dan memberi perhitungan tingkat fibrinolisis. Nilai normal <7,5% (pada
darah natif).
- LY60: persentase yang menurun dalam amplitudo 60 menit setelah MA.
- A30: amplitudo saat 30 menit setelah MA
- A60: amplitudo saat 60 menit setelah MA
- EPL: merepresentasikan prediksi komputer pada 30 menit proses lisis
yang berdasarkan pada laju aktual penurunan amplitudo yang terhitung 30
detik setelah MA dan merupakan indikator paling awal dari lisis abnormal.
EPL awal > LY30 (30 menit EPL = LY30), EPL normal < 15%,
fibrinolisis menyebabkan peningkatan LY30, LY60, EPL dan penurunan
A30 dan A60.
Interpretasi klinis dari berbagai tahap koagulasi yang diukur dengan TEG:
- Pembentukan bekuan: faktor pembekuan (waktu r dan k)
- Kinetik bekuan: faktor pembekuan (waktu r dan k), trombosit (MA)
- Kekuatan/ stabilitas bekuan: trombosit (MA), fibrinogen (reopro-mod
MA)
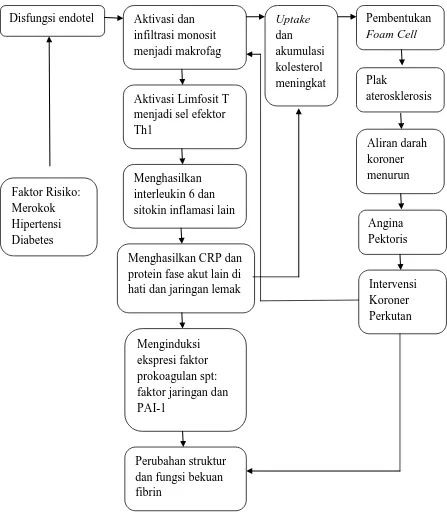
2.6Kerangka Teori
Gambar 2.10. Kerangka Teori (Libby, 2006; Hansson, 2005; Bassuk, 2006;
Undas, 2007; Undas, 2011) Disfungsi endotel Aktivasi dan
infiltrasi monosit sitokin inflamasi lain
Menghasilkan CRP dan protein fase akut lain di hati dan jaringan lemak
2.7Kerangka Konsep
Gambar 2.11. Kerangka Konsep Pasien dengan Penyakit Jantung Koroner
(Angina Pektoris Stabil atau Infark Miokardium > 30 hari)
hsCRP
Intervensi Koroner Perkutan (IKP) Elektif
Fibrin Clot Strength
Tertile 1 Tertile 2 Tertile 3
Faktor Risiko: Merokok Hipertensi