Lampiran 1. Gambar Sampel Aksesi Andaliman
Gambar Andaliman Dairi
Lampiran 2. Pembuatan Larutan Stok dan Buffer
A. Pembuatan Larutan Stok
•
CTAB 5 % (100 ml):
Timbang NaCl sebanyak 2.0 gram dan CTAB sebanyak
5.0 gram. Masukkan bahan kimia ke dalam erlenmeyer dan ditambahkan 100 ml
aquades. Aduk campuran larutan dengan menggunakan stirrer kemudian
diletakkan diatas hote plate.
•
Tris HCl 1 M pH 8.0 (100 ml):
Timbang Tris sebanyak 12.114 gram.
Masukkan Tris ke dalam erlenmeyer dan ditambahkan 80 ml aquades. Aduk
campuran larutan dengan menggunakan stirrer kemudian diletakkan diatas hote
plate. Selanjutnya, ditambahkan 4.2 ml HCl pekat sedikit demi sedikit sampai pH
mencapai 8. Masukkan ke dalam gelas ukur, kemudian volume ditepatkan
dengan aquades hingga volume larutan menjadi 100 ml.
•
Tris HCl 1 M pH 7.4 (50 m):
Timbang Tris sebanyak 6.057 gram. Masukkan
Tris ke dalam erlenmeyer dan ditambahkan 30 ml aquades. Aduk campuran
larutan dengan menggunakan stirrer kemudian diletakkan diatas hote plate.
Selanjutnya, ditambahkan NaOH 2.5 M sedikit demi sedikit sampai pH mencapai
7.4. Masukkan ke dalam gelas ukur, kemudian volume ditepatkan dengan
aquades hingga volume larutan menjadi 50 ml.
•
EDTA O.5 M pH 8.0 (100 ml):
Timbang EDTA sebanyak 18.612 gram dan
•
NaCl 5 M (l00 ml):
Timbang NaCl sebanyak 29.22 gram. Masukkan ke dalam
erlenmeyer dan ditambahkan 80 ml aquades. Aduk campuran larutan dengan
menggunakan stirrer kemudian diletakkan diatas hote plate. Masukkan ke dalam
gelas ukur, kemudian volume ditepatkan dengan aquades hingga volume larutan
menjadi 100 ml.
**Semua bahan di atas disterilkan dengan menggunakan autoklaf kecuali CTAB 5%.
B. Pembuatan Larutan Buffer
•
Buffer Ekstraksi/CTAB (100 ml):
Campurkan
40 ml CTAB 5%, 25.1 ml NaCl
5 M, 4 ml EDTA 0.5 M pH 8.0, 10 ml Tris HCl 1 M pH 8.0 dan 20.8 ml aquades.
•
Buffer TAE 50 X (100 ml):
Campurkan 24.2 ml Tris HCl 1 M pH 7.4, 5.7 ml
Asam Asetat Glasial, 10 ml EDTA 0.5 M PH 8.0, dan aquades hingga volume
larutan menjadi 100 ml.
•
Buffer TAE 1X (500 ml):
Campurkan 10 ml Buffer TAE 50 X dan 490 ml
aquades.
•
Buffer TE (50 ml):
Campurkan 0.5 ml Tris HCl 1 M PH 8.0, 0.1 ml EDTA 0.5
M PH 8.0 dan 49.4 ml aquades.
•
Kloroform Isoamilalkohol 24 : 1 (50 ml):
Campurkan 48 ml Kloroform dan 2
ml Isoamilalkohol.
Lampiran 3. Alur Penelitian
Sampel DNA Andaliman
Isolasi DNA
Uji Kualitas
Uji Kuantitas
Proses PCR-RAPD
Elektroforesis
Lampiran 4. Proses Isolasi DNA
Sampel daun andaliman ditimbang 0.2 gram dan digerus sambil
ditambahkan nitrogen cair dan PVPP
Sampel dimasukkan ke dalam tabung yang bberisi 1 ml buffer
ekstraksi dan 10 µl β-mercaptoetanol
Tabung di vortex dan diinkubasi dalam waterbath selama 30
menit pada suhu 65
0C
Supernatan ditambahkan 1 ml KIAA (24:1) dan disentrifus
dengan kecepatan 13.000 rpm selama 10 menit
Supernatan ditambahkan 1 ml KIAA (24:1) dan disentrifus
dengan kecepatan 13.000 rpm selama 10 menit
Supernatan ditambahkan 1 ml isopropanol dan diinkubasi pada
suhu 4
0C selama semalama
Tabung disentrifus pada pada kecepatan 13.000 rpm selama 10
menit dan dikeringkan
Pelet dilarutkan dengan buffer TE 100µl
Campuran ditambahkan dengan etanol absolute dingin dan
diinkubasi dalam freezer (-20
0C) selama 30 menit
Campuran disentrifus dengan kecepatan 13.000 rpm selama 10 menit
Pelet dicuci dengan etanol 70% dan dikeringkan
Pelet dilarutkan dengan 100 µl buffer TE
Lampiran 4. Proses PCR-RAPD
Komposisi Master Mix volume 25 µl :
Go Taq PCR 12.5 µl
Nuclease free water 9.5 µl
Primer 1 µl
DNA sampel 2 µl
Running PCR sebanyak 45 siklus :
Denaturasi awal 94
0C 2 menit
Denaturai 94
0C 1 menit
Annealing 36
0C 1 menit
Extension 72
0C 2 menit
Post extension 72
0C 10 menit
Kondisi akhir PCR 4
0C tak terbatas
Lampiran 5. Proses elektroforesis hasil PCR-RAPD
Agar rose 2.6 gram ditambahkan
dengan 130 ml buffer TAE 1 x
Campuran dipanaskan dengan hot
plate
Campuran ditambahkan 1.5 µl EtBr
Larutan gel dituang kedalam cetakan
yang telah dipasang sisir
Gel yang telah mengeras
dipindahkan ke dalam chamber
berisi buffer TAE 1 x
Sampel hasil PCR, marker dan
loading dye dimasukkan ke dalam
sumur gel dengan perbandingan
(8:5:2)
Alat elektroforesis dihubungkan
dengan power supply 80 volt
Lampiran 6. Foto Uji Kuantitas
Gambar 10. Alat spektrofotometer
Lampiran 8. Hasil Fotosintesis
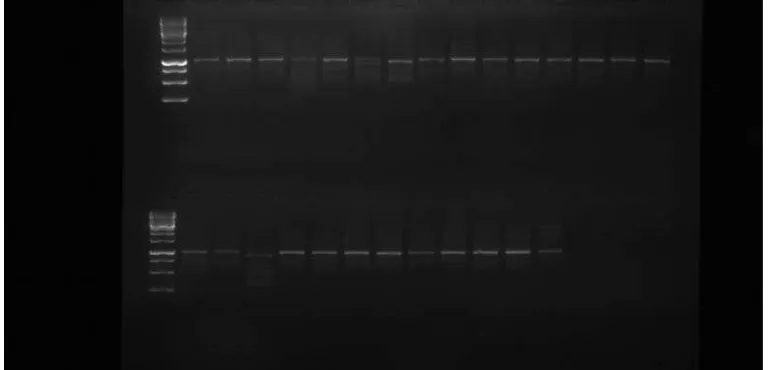
Gambar 12. Hasil elektoroforesis dengan Primer OPD-13
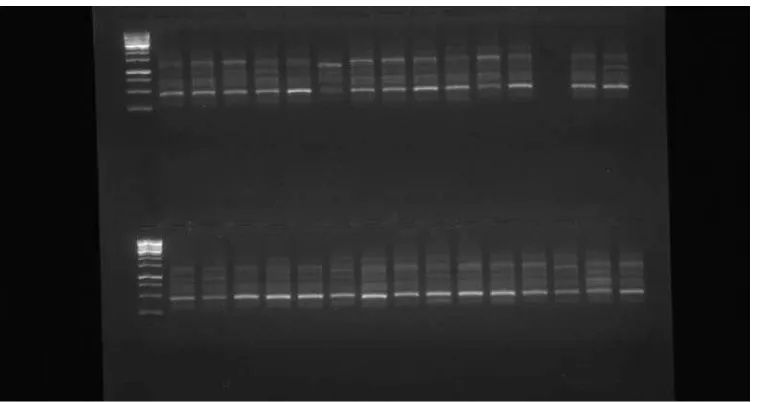
Gambar 13. Hasil elektroforesis dengan Primer OPI-20
Gambar 14. Hasil elektoforesis dengan Primer OPN-10
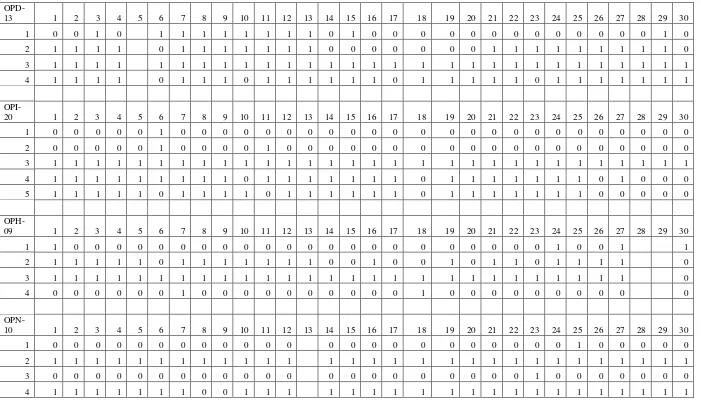
Lampiran 9. Hasil Skoring Pita 30 Individu Pada Kelima Primer
Tabel 5. Hasil scoring pita andaliman pada kelima primer
5 0 1 0 1 0 1 1 0 1 1 0 1 0 0 1 1 0 1 0 0 0 0 0 0 0 0 0 0 0
6 1 1 1 1 1 1 1 1 0 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
OPM-
01 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30
1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0 0 0 1 1 1 1 1 1 1 1 1 1
3 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0 1 1 1 1 1 1 1 1 1
4 1 1 1 1 1 0 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0 1 1 1 1 1 1
5 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 0 1 1 1 1 1 1
6 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 1 0 0 0 0
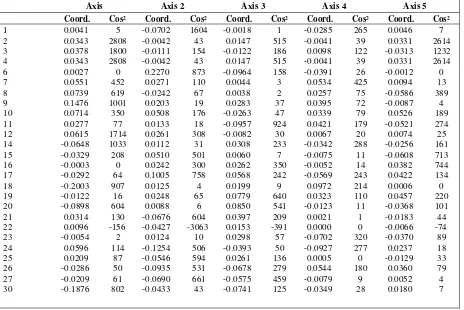
Lampiran 11. Faktorial Koordinat
Tabel 13. Faktorial Analisis (PCoA)
Axis Axis 2 Axis 3 Axis 4 Axis 5