BAB 1
PENDAHULUAN
1. 1 Latar Belakang
Intracytoplasmic Sperm Injection (ICSI) merupakan metode reproduksi terbantu yang efisien karena hanya membutuhkan satu buah sel telur dan satu buah sel sperma yang telah matang untuk memulai proses pembentukan individu baru (Okada et al. 1999,De Vos, 2000 dan Yanagida, 2009). Metode ini pertama kali ditemukan oleh Hiramoto (1966) untuk membuktikan bahwa peristiwa dekondensasi spermatozoa dan pembentukan pronukleus jantan tidak akan terjadi sebelum spermatozoa masuk ke dalam sel telur. Pada tahun 1976, Uehara dan Yamaguchi melanjutkan penelitian Hiramoto untuk menguji kelayakan penggunaan metode ICSI pada manusia (Said et al., 2006). Hasil penelitian mereka memperlihatkan bahwa sperma manusia yang dibekukan dalam media isotonik tanpa krioprotektan mampu terkondensasi dan membentuk pronukleus setelah disuntikkan ke dalam sel telur.
Catatan ilmiah mengenai ICSI dimulai sejak adanya laporan keberhasilan penerapan metode In-Vitro Vertilization (IVF) dan Embryo Transfer (ET) pada pasangan yang sulit mendapatkan keturunan oleh Edwards et al. (1980). Sejak saat itu, para ilmuwan berlomba-lomba mengembangkan berbagai metode fertilisasi terbantu berupa metode Zona Thinning (ZT), Zona Drilling (ZD), Sub-Zonal Insemination (SUZI) dan ICSI tingkat lanjut untuk memberikan solusi terhadap berbagai kegagalan fertilisasi yang tidak dapat diselesaikan menggunakan metode IVF. Dari serangkaian teknik yang dikembangkan, hanya
metode ICSI yang terbukti secara nyata memberikan pengaruh signifikan terhadap kesuksesan fertilisasi terbantu (Palermo et al., 1992).
Penemuan metode ICSI telah mengantarkan manusia pada era revolusi reproduksi terbantu secara radikal melalui penggunaan sperma tunggal untuk menghasilkan kehamilan pada manusia (Okada et al., 1999) serta hewan (Yanagimachi, 2001). Saili et al. (2005) melaporkan bahwa penggunaan metode ICSI telah berhasil dilakukan pada kelinci (Hosoi et al., 1988; dan Iritani, 1989), mencit (Kimura dan Yanagimachi, 1995), kucing (pope et al., 1998), kuda (Cochran et al., 1998), domba (Gomez et al., 1998), sapi (Hamano et al., 1999), kera (Hewitson et al., 1999), babi (Martin, 2000) dan tikus (Said et al., 2003).
Dalam perkembangannya, sperma yang digunakan untuk ICSI dapat berasal dari sperma ejakulat (Saili et al., 2005), pembedahan mikro epididimis (Silber et al., 1994), aspirasi menggunakan jarum mikro pada epididimis (Craft et al., 1995) dan aspirasi pada testis (Saili et al., 2005). Sebelum sel sperma diinjeksikan secara mekanis ke dalam sel telur di bawah mikroskop inverted, perlu dilakukan imobilisasi pada sel sperma untuk mendukung proses dekondensasi (Boediono, 2001) dengan cara menekan ekor sperma sampai ke dasar petri (Dozortzev et al., 1995) atau dengan memisahkan kepala dan ekor sperma menggunakan ultrasonikasi (Kuretake et al., 1996).
Sejarah mengenai usaha pemilihan sel sperma unggul untuk keperluan ICSI dilakukan pertama kali oleh Van Steirteghem et al. (1993). Dalam percobaannya Van Steirteghem et al. menggunakan metode seleksi gradien densitas percoll dengan tambahan 2-Deoxy-Adenosin (2DA) dan pentoxyfillyne
untuk merangsang motilitas spermatozoa. Namun perlakuan tersebut justru meningkatkan potensi kegagalan pembelahan sel pada fase embrionik lanjut
akibat sifat toksik dari senyawa 2DA yang digunakan. Sejak penelitian Van Steirteghem et al. tersebut, berbagai macam metode seleksi sperma dikembangkan pada berbagai jenis spesies untuk mencapai kesuksesan fertilisasi yang tinggi.
Penelitian mengenai penggunaan metode ICSI untuk meningkatkan produksi hewan ternak di Indonesia juga telah dilakukan oleh Saili et al. (2005), Kaiin et al. (2008) dan Gunawan et al. (2014) namun penelitian tersebut belum mampu mencapai tingkat fertilitas yang diharapkan untuk penerapan ICSI pada skala industri. Merujuk pada penelitian Karpuz et al. (2007), Fauque et al. (2007), Javed dan Michael (2012) dapat disimpulkan bahwa kualitas sel sperma yang diinjeksikan ke dalam sel telur memiliki peran yang besar dalam menentukan kesuksesan fertilisasi dengan metode ICSI.
1. 2 Rumusan Masalah
Menurut penelitian Bartoov et al. (2001), Berkovits et al. (2006), Brito (2007), Darin et al. (2010) dan Vanderzwalmen et al. (2012), kecacatan morfologi sperma berkorelasi positif terhadap tingkat kegagalan perkembangan sel pada fase embrionik. Fertilisasi memang dapat dimulai menggunakan sperma yang memiliki kecacatan morfologis tinggi namun pertumbuhan embrio akan terhenti pada tahap perkembangan awal. Sehingga diperlukan mekanisme seleksi kualitas sperma berdasar morfologi untuk menekan potensi kegagalan perkembangan embrio. Sayangnya, berbagai metode pengukuran kualitas sperma yang tersedia hingga saat ini seperti Analisis Sperma Konvensional,
Computer Assisted Sperm Analysis (CASA), Automated Sperm-Head Morphometry Analysis (ASMA), Sperm Motility Analysis System (SMAS),
Computer-Aided Sperm Morphometric Assessment (CASMA) hingga
Copenhagen Rigshospitalet Image House Sperm Motility Analysis System
(CRISMAS) masih berorientasi pada analisis statistik terhadap populasi sperma sampel dan tidak memprioritaskan analisis secara spesifik terhadap morfologi individu sperma (Wang et al., 2011; Amann dan Waberski, 2014). Oleh karena itu diperlukan sebuah metode pendekatan baru dalam melakukan analisis sperma individual secara spesifik menggunakan model sperma ideal.
1. 3 Batasan Masalah
Penelitian ini terbatas pada rancang bangun:
1. Persamaan morfologi secara umum untuk memprediksi nilai potensi fertilitas sel sperma secara individu
2. Piranti lunak analisis morfologi yang diturunkan dari (1) serta perangkat keras pendukung
Seluruh analisis morfologi akan ditujukan pada sampel semen sapi hasil
thawing yang diamati menggunakan sebuah mikroskop cahaya. Semen sapi sampel dianggap telah diberi perlakuan awal dan telah memiliki sperma matang yang siap diinjeksikan ke dalam sel telur untuk memulai proses fertilisasi. Selama proses seleksi berlangsung, seluruh keputusan seleksi diambil secara otomatis oleh piranti lunak berdasarkan parameter visual yang tertangkap oleh kamera mikroskop yang akan diterjemahkan menjadi aksi fisis oleh piranti keras pendukung. Aspirasi sperma yang telah immotil dilakukan sesuai dengan prosedur ICSI yang diusulkan oleh Liu et al. (2013).
1. 4 Keaslian Penelitian
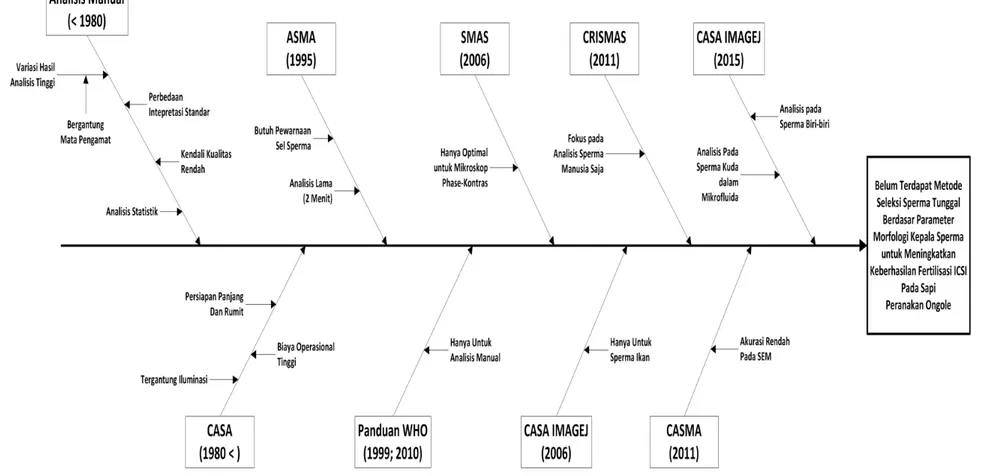
Analisis sperma menggunakan bantuan komputer telah menjadi bagian yang penting dalam prosedur penentuan kesuburan individu jantan secara modern (Gravance et al., 1995). Hingga saat ini terdapat berbagai metode untuk menganalisis kualitas spermatozoa dari semen sampel. Berbagai rancangan piranti lunak, piranti keras, algoritma dan proses analisis telah dikembangkan oleh para ilmuwan untuk menghasilkan prosedur dan mekanisme analisis sel spermatozoa dengan kehandalan, akurasi dan kepresisian yang tinggi. Dari berbagai metode yang tersedia, metode analisis sperma konvensional merupakan metode yang paling banyak digunakan karena alasan kesederhanaan serta biaya yang rendah. Metode analisis sperma konvensional dilakukan menggunakan mikroskop cahaya dan sebuah hemocytometer atau
counting chamber sesuai dengan kriteria standar analisis spermatozoa dari
World Health Organization (WHO).
Metode analisis sperma konvensional merupakan metode yang memiliki hasil analisis dengan nilai keluaran yang paling variatif apabila dibandingkan dengan metode analisis terbantu komputer (Komori et al., 2006). Walaupun metode analisis sperma konvensional telah memiliki standar internasional dari WHO, perbedaan intepretasi prosedur analisis standar WHO di tingkat laboratorium seringkali menjadi faktor utama yang menyebabkan data hasil analisis keluaran berbagai laboratorium memiliki angka divergensi yang tinggi. Metode analisis sperma konvensional juga masih menyisakan permasalahan dalam prediksi reproduktivitas secara detil, kendali kualitas produk yang rendah serta berbagai permasalahan kompleks yang berantai apabila diterapkan pada tingkat industri. Lebih jauh lagi, metode analisis sperma konvensional hanya
mampu menganalisis motilitas sperma secara umum namun tidak dapat menganalisis karakteristik gerak sperma tingkat individu seluler seperti halnya kecepatan gerak dan linieritas gerak spermatozoa.
Computer Assisted Sperm Analysis (CASA) merupakan metode analisis spermatozoa pertama yang menggunakan bantuan piranti lunak untuk mengatasi kendala yang muncul dalam metode analisis sperma konvensional (Komori et al., 2006). CASA diperkenalkan pada pertengahan 1980-an dan telah menjadi salah satu mekanisme standar untuk menganalisis kualitas spermatozoa dari suatu spesies (Shi et al., 2008 dan Wang et al., 2011). CASA mengkuantisasi parameter kualitas spermatozoa yang berada di dalam semen sampel menggunakan algoritma pengolahan citra digital secara detil dan objektif. Adanya CASA telah meningkatkan kehandalan dan presisi penilaian terhadap kualitas spermatozoa yang ditentukan berdasar parameter visual yang tertangkap oleh sistem optiknya. CASA juga mampu meningkatkan independensi hasil analisis sperma terhadap respon mata pengamat secara signifikan. Kesuksesan CASA dalam memprediksi dan menganalisis pembuahan in-vitro dan in-vivo telah teruji dan telah dituangkan dalam berbagai jurnal ilmiah. Namun CASA masih memiliki kelemahan dalam hal biaya kerja yang tinggi serta membutuhkan persiapan preparat yang rumit agar mampu mencapai kinerja optimumnya. Faktor-faktor tersebut otomatis membatasi penggunaan CASA untuk keperluan klinis dalam skala besar (Komori et al., 2006).
Automated Sperm-Head Morphometry Analysis (ASMA) merupakan salah satu bentuk perangkat CASA yang dikembangkan secara spesifik untuk menganalisis morfologi kepala sperma kambing (Gravance et al., 1995). ASMA memiliki derajat kesalahan pengenalan morfologi sebesar 1%. ASMA
membutuhkan setidak-tidaknya 100 sel sperma kambing yang telah diwarnai menggunakan hematoxylin dan diamati menggunakan lensa objektif 20X agar dapat mencapai kemampuan optimalnya. Dalam pengujian yang telah dilakukan, ASMA mampu mengenali 96% objek sperma yang telah diwarnai. Pewarnaan tersebut bertujuan untuk meningkatkan perbedaan warna dan kontras objek sperma kambing yang masih aktif dengan objek-objek lainnya. Lama pewarnaan ideal berlangsung selama 20 menit. ASMA membutuhkan waktu kerja rata-rata sebesar 2 menit untuk menyelesaikan satu kali proses analisis semen standar.
Sperm Motility Analysis System (SMAS) merupakan kesatuan piranti lunak dan piranti keras yang dirancang sebagai alternatif pengganti sistem CASA. Perangkat sistem SMAS terdiri dari sebuah kamera digital pemindai beresolusi tinggi, sebuah monitor komputer serta sebuah komputer personal yang berisi piranti lunak pencuplik citra dan piranti lunak pengolah citra digital. SMAS mampu menganalisis 200 sel sperma spesies tertentu secara simultan berdasarkan parameter visual yang terdeteksi oleh kamera pemindai. SMAS menawarkan keunggulan dalam hal kesederhanaan proses, kemudahan persiapan preparat, biaya operasional yang lebih rendah dari sistem CASA dan visualisasi hasil analisis yang dapat digabungkan (blending) dengan tampilan citra utama sehingga pengguna dapat meninjau ulang dan mengoreksi hasil analisis piranti lunak SMAS secara waktu-nyata (Komori et al., 2006).
Secara umum, keluaran hasil analisis SMAS berupa data statistik yang divisualisasikan lebih lanjut menggunakan serangkaian simbol, bentuk geometri, angka dan warna. Parameter analisis sperma fundamental seperti persen motilitas, konsentrasi spermatozoa, kecepatan kurvilenear, kecepatan gerak lurus, besar pergeseran herakan kepala sperma, linieritas dan frekuensi
tumbukan silang telah diintegrasikan dalam fitur standar SMAS. Jejak aktifitas gerakan sel-sel sperma divisualisasikan menyerupai sistem CASA sehingga mempermudah pengguna lama dalam bermigrasi ke sistem baru. SMAS mampu bekerja secara optimum pada penggunaan mikroskop phase-kontras negatif yang menghasilkan tampilan citra cerah pada objek kepala dan ekor sperma dan menghasilkan tampilan redup keabuan pada seluruh bidang latar belakang.
Computer-Aided Sperm Morphometric Assessment (CASMA) merupakan bentuk lain dari perangkat CASA dan ASMA yang digunakan secara khusus untuk menganalisis morfologi sel sperma. CASMA mampu mengukur 8 (delapan) parameter sperma secara bersamaan. Penggunaan CASMA pada mikroskop cahaya terbukti memberikan prediksi analisis fertilitas yang lebih akurat daripada penggunaan CASMA pada Scanning Electron Microscopy (SEM) (de Paz et al., 2011).
Copenhagen Rigshospitalet Image House Sperm Motility Analysis System
(CRISMAS) adalah sistem analisis spermatozoa manusia yang mampu mengidentifikasi konsentrasi sperma dan mengklasifikasi gerakan sperma dalam tiga kategori motilitas untuk memprediski kesuburan seorang pria. Hasil analisis piranti lunak CRISMAS memiliki kecenderungan estimasi yang lebih tinggi dibandingkan dengan metode analisis sperma konvensional. Selain tinjauan terhadap kedua hal tersebut, CRISMAS dan metode analisis sperma konvensional tidak menunjukkan tren keterkaitan analisis jenis apapun (Vested et al., 2011). Gambar 1.1 menunjukkan perkembangan metode analisis sperma yang tersedia hingga saat ini.
1. 4. 1 Nilai Kebaruan
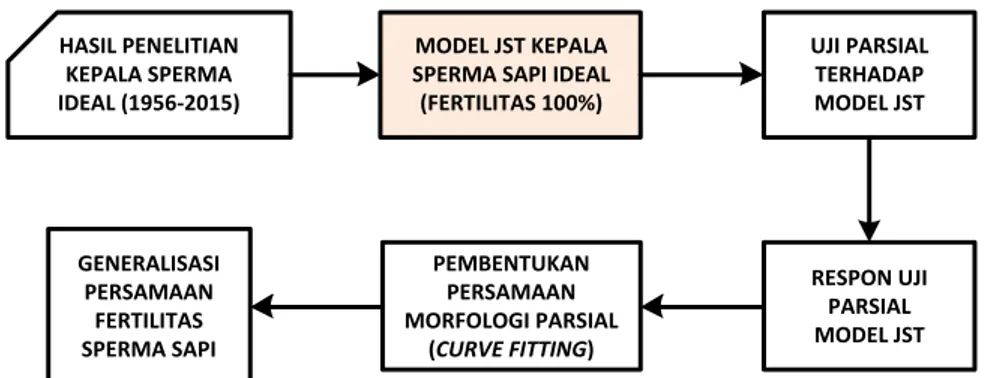
Dalam penelitian ini diusulkan sebuah model Jaringan Syaraf Tiruan (JST) kepala sperma ideal yang akan diturunkan menjadi sebuah persamaan polinomial untuk mengukur nilai fertilitas sel sperma berdasar masukan empat buah parameter Tygerberg (luas, keliling, panjang dan lebar kepala sperma). JST dibangun untuk merepresentasikan model kepala sperma ideal berdasar masukan dari berbagai hasil penelitian sejak tahun 1956 hingga 2015. Model kepala sperma ideal ini akan diuji secara parsial untuk mendapatkan persamaan fertilitas berdasar perubahan satu parameter spesifik untuk digeneralisasi guna
mendapatkan persamaan umum fertilitas spermatozoa. Gambar 1.2
menunjukkan model JST yang dibangun dalam penelitian ini.
MODEL JST KEPALA SPERMA SAPI IDEAL (FERTILITAS 100%) HASIL PENELITIAN KEPALA SPERMA IDEAL (1956-2015) UJI PARSIAL TERHADAP MODEL JST RESPON UJI PARSIAL MODEL JST PEMBENTUKAN PERSAMAAN MORFOLOGI PARSIAL (CURVE FITTING) GENERALISASI PERSAMAAN FERTILITAS SPERMA SAPI
Gambar 1.2 Model JST kepala sperma sapi ideal sebagai kebaruan penelitian
Aplikasi persamaan umum fertilitas spermatozoa akan diterapkan satu-persatu pada sperma yang akan diketahui nilai fertilitasnya. Proses pengukuran fertilitas sperma dilakukan secara otomatis dengan bantuan algoritma pengolahan citra digital untuk menganalisis seluruh sperma sapi Peranakan
Ongole (PO) yang tampak pada bidang pandang lensa objektif. Data yang didapatkan kemudian diurutkan untuk mendapatkan koordinat objek dengan nilai fertilitas tertinggi. Verifikasi terhadap viabilitas objek dengan skor tertinggi
dilakukan menggunakan algoritma deteksi gerak. Apabila objek target terdeteksi memiliki nilai gerak positif maka piranti lunak akan menetapkan objek tersebut menjadi target utama yang valid kemudian menandainya menggunakan sebuah penanda visual.
Proses penandaan visual akan dilakukan secara terus-menerus selama sperma target berada dalam bidang padang lensa objektif. Apabila sperma target bergerak keluar dari batas pengamatan visual maka penggerak mikroskopis akan menempatkan koordinat terakhir sperma target yang diketahui ke tengah bidang pandang kemudian melakukan pengukuran, validasi dan penandaan ulang lokasi sperma target. Selama proses pelacakan gerak dilakukan, temperatur preparat sperma ditahan pada suhu rendah yang berdekatan dengan titik beku air namun masih cukup aman terhadap organel sperma (Baust et al., 2009) hingga sperma target berhenti bergerak akibat paparan temperatur rendah dalam jangka panjang (Sukhato et al., 2001, Esfandiari et al., 2002, Varisli et al., 2009 dan Ledezma-Torres et al., 2014).
Keluaran metode seleksi kualitas sperma berupa informasi lokasi sel sperma yang memiliki nilai fertilitas maksimum diantara seluruh sel sperma yang teramati dalam bidang pandang lensa objektif. Berbeda dengan metode analisis sperma yang sudah ada (lihat Gambar 1.1), metode Analisis Morfologi (AM) yang dibangun dalam penelitian ini bekerja secara mandiri. Seluruh mekanisme pengolahan citra dan pelacakan gerak dilakukan secara otomatis tanpa campur tangan manusia guna memperoleh hasil yang lebih objektif. Tabel 1.1, Tabel 1.2 dan Tabel 1.3 menunjukkan perbandingan metode Analisis Morfologi (AM) yang dibangun dalam penelitian ini dengan metode analisis sperma konvensional standar WHO, CASA, ASMA, SMAS, CASMA dan CRISMAS.
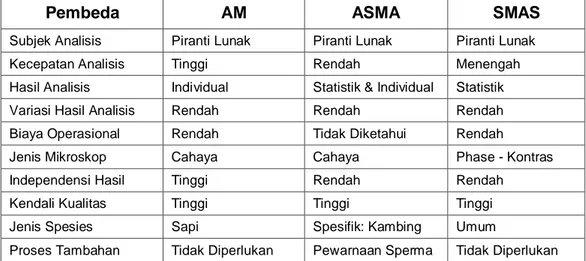
Tabel 1.1 Perbandingan metode Analisis Morfologi (AM) dengan metode Analisis Sperma Konvensional dan Computer Assisted Sperm Analysis (CASA)
Pembeda AM Konvensional CASA
Subjek Analisis Piranti Lunak Pengamat Profesional Piranti Lunak (& Keras)
Kecepatan Analisis Tinggi Menengah Tinggi
Hasil Analisis Individual Statistik Statistik (& Individual)
Variasi Hasil Analisis Rendah Tinggi Rendah
Biaya Operasional Rendah Rendah Tinggi
Jenis Mikroskop Cahaya Cahaya Cahaya ( Optik CASA)
Independensi Hasil Tinggi Rendah Tinggi
Kendali Kualitas Tinggi Rendah Tinggi
Jenis Spesies Sapi Umum Umum
Proses Tambahan Tidak Diperlukan Terkadang Diperlukan Tidak Diperlukan
Tabel 1.2 Perbandingan metode Analisis Morfologi (AM) dengan metode
AutomatedSperm-Head Morphometry Analysis (ASMA) dan metode Sperm Motility Analysis System (SMAS)
Pembeda AM ASMA SMAS
Subjek Analisis Piranti Lunak Piranti Lunak Piranti Lunak
Kecepatan Analisis Tinggi Rendah Menengah
Hasil Analisis Individual Statistik & Individual Statistik
Variasi Hasil Analisis Rendah Rendah Rendah
Biaya Operasional Rendah Tidak Diketahui Rendah
Jenis Mikroskop Cahaya Cahaya Phase - Kontras
Independensi Hasil Tinggi Rendah Rendah
Kendali Kualitas Tinggi Tinggi Tinggi
Jenis Spesies Sapi Spesifik: Kambing Umum
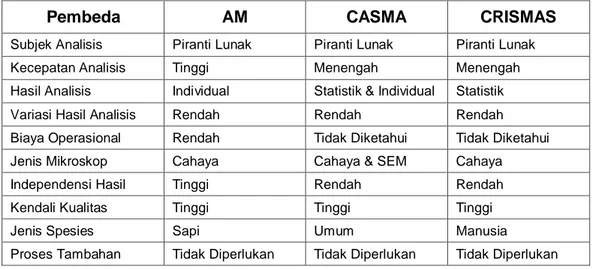
Tabel 1.3 Perbandingan metode Analisis Morfologi (AM) dengan metode
Computer-Aided Sperm Morphometric Assessment (CASMA) dan metode
Copenhagen Rigshospitalet Image House Sperm Motility Analysis System
(CRISMAS)
Pembeda AM CASMA CRISMAS
Subjek Analisis Piranti Lunak Piranti Lunak Piranti Lunak
Kecepatan Analisis Tinggi Menengah Menengah
Hasil Analisis Individual Statistik & Individual Statistik
Variasi Hasil Analisis Rendah Rendah Rendah
Biaya Operasional Rendah Tidak Diketahui Tidak Diketahui
Jenis Mikroskop Cahaya Cahaya & SEM Cahaya
Independensi Hasil Tinggi Rendah Rendah
Kendali Kualitas Tinggi Tinggi Tinggi
Jenis Spesies Sapi Umum Manusia
Proses Tambahan Tidak Diperlukan Tidak Diperlukan Tidak Diperlukan
1. 5 Tujuan Penelitian
Penelitian ini bertujuan merancang bangun algoritma penilaian fertilitas sel sperma sapi PO secara kuantitatif menggunakan model JST kepala sperma sapi ideal berdasarkan empat parameter morfologi dasar Tygerberg. Algoritma analisis morfologi tersebut akan digunakan untuk mendapatkan lokasi sel sperma fertil dengan kecacatan morfologis minimum agar dapat menekan potensi kegagalan perkembangan embrio sapi yang difertilisasi menggunakan metode ICSI.
1. 6 Manfaat Penelitian
Penelitian ini bermanfaat untuk:
a) meningkatkan efisiensi fertilisasi metode ICSI pada sapi PO
menggunakan sel sperma yang memiliki penyimpangan bentuk fisik minimum.
b) menurunkan kesalahan paralaks dan kesalahan tanggap warna mata pengamat
c) menyediakan salah satu metode seleksi sperma alternatif untuk sapi dan hewan ternak ruminansia lainnya