1
STUDI AKTIVITAS ANTIBAKTERI DAN IDENTIFIKASI GOLONGAN
SENYAWA EKSTRAK AKTIF ANTIBAKTERI BUAH GAMBAS
(Luffa acutangula Roxb.)
Disusun oleh: Tristiyanto M.0304068
SKRIPSI
Ditulis dan diajukan untuk memenuhi
sebagian persyaratan mendapatkan gelar Sarjana Sains Kimia
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SEBELAS MARET
SURAKARTA
HALAMAN PENGESAHAN
Skripsi ini dibimbing oleh :
Pembimbing I
Venty Suryanti, M. Phil. NIP. 19720817 199702 2001
Pembimbing II
Dr. Linar Zalinar Udin, MS. NIP. 19550120 198203 2001 Dipertahankan di depan TIM Penguji Skripsi pada :
Hari : Kamis Tanggal : 11 Juni 2009
Anggota TIM Penguji :
1. Dr. rer. nat. Fajar R. Wibowo, M. Si. NIP. 19730605 200003 1001
2. I. F. Nurcahyo, M. Si.
NIP. 19780617 200501 1001
1. ………
2. ………
Disahkan oleh
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret Surakarta
Ketua Jurusan Kimia,
Drs. Sentot Budi Rahardjo, Ph.D. NIP. 19560507 198601 1001
PERNYATAAN
Dengan ini saya menyatakan bahwa dalam skripsi saya yang berjudul “Studi aktivitas antibakteri dan identifikasi golongan senyawa ekstrak aktif antibakteri buah gambas (Luffa acutangula Roxb.)" adalah benar-benar hasil
penelitian sendiri dan tidak terdapat karya yang pernah diajukan untuk memperoleh gelar kesarjanaan di suatu perguruan tinggi dan sepanjang pengetahuan saya juga tidak terdapat kerja atau pendapat yang pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara tertulis diacu dalam naskah ini dan disebutkan dalam daftar pustaka.
Surakarta, 31 Agustus 2009
TRISTIYANTO
ABSTRAK
Tristiyanto, 2009. STUDI AKTIVITAS ANTIBAKTERI DAN IDENTIFIKASI GOLONGAN SENYAWA EKSTRAK AKTIF ANTIBAKTERI BUAH GAMBAS (Luffa acutangula Roxb.). Skripsi. Jurusan Kimia. Fakultas
Matematika dan Ilmu Pengetahuan Alam. Universitas Sebelas Maret.
Aktivitas antibakteri ekstrak buah gambas (Luffa acutangula Roxb.)
telah diuji terhadap beberapa bakteri patogen. Simplisia buah gambas dimaserasi menggunakan metanol, selanjutnya ekstrak metanol diekstraksi berturut-turut menggunakan heksana, kloroform, etil asetat dan butanol. Aktivitas antibakteri dievaluasi dengan metode difusi lubang. Ekstrak dengan aktivitas antibakteri tertinggi diidentifikasi golongan senyawanya menggunakan metode penapisan fitokimia dan Kromatografi Lapis Tipis (KLT). Aktivtas antibakteri dari ekstrak dengan aktivitas antibakteri tertinggi dibandingkan dengan ampisilin.
Ekstrak metanol menghambat pertumbuhan P. aeruginosa, E. coli, B. subtilis dan S. aureus, tetapi tidak menghambat pertumbuhan E. aerogenes, S. dysentriae dan S. thypi. Ekstrak etil asetat menunjukkan aktivitas antibakteri
tertinggi terhadap P. aeruginosa, E. coli, B. subtilis dan S. aureus, yang
berturut-turut diikuti ekstrak kloroform, butanol dan heksana. Ekstrak etil asetat mengandung fenolat, tanin terkondensasi, flavonoid, saponin dan terpenoid. Berdasarkan KHM dan nilai banding ekstrak etil asetat terhadap ampisilin, aktivitas antibakteri ekstrak etil asetat buah gambas lebih lemah jika dibandingkan dengan ampisilin
Kata kunci: buah gambas, Luffa acutangula Roxb., aktivitas antibakteri, difusi
lubang, ekstrak etil asetat.
ABSTRACT
Tristiyanto, 2009. STUDY OF ANTIBACTERIAL ACTIVITY AND CLASS OF COMPOUNDS IDENTIFICATION OF ANTIBACTERIAL ACTIVE EXTRACT OF ANGLED LOOFAH FRUIT (Luffa acutangula Roxb.). Thesis.
Department of Chemistry, Faculty of Mathematics and Sciences. Sebelas Maret University.
Antibacterial activity of fruit extract of Angled Loofah (Luffa acutangula Roxb.) has been assayed against some pathogenic bacterial. Fruit
powder of Angled Loofah was was macerated with methanol, and then methanol extract extracted sequentiallywith hexane, chloroform, ethyl acetate and buthanol.
Antibacterial activity was evaluated by well diffusion method. Extract which had the highest antibacterial activity was identified regarding their class of compounds using phytochemical screening and Thin Layer Chromathograpy (TLC) method. The antibacterial activity of extract which had the highest antibacterial activity was compared with that of the ampicillin used.
The methanol extract inhibited the growth of the P. aeruginosa, E. coli, B. subtilis and S. aureus, but did not inhibit the growth of the E. aerogenes, S. dysentriae and S. thypi. The ethyl acetate extract showed the highest antibacterial
activity against P. aeruginosa, E. coli, B. subtilis and S. aureus, followed by
chloroform, buthanol and hexane extract, respectively. The ethyl acetate extract possesed phenolics, condensed tannins, flavonoids, saponins dan terpenoids. Based on the MIC and the equivalent value of ethyl acetate extract compared with that of the ampisilin used, the antibacterial activity of ethyl acetate extract was lower than with that of the ampisilin used.
Key words: Angled Loofah fruit, Luffa acutangula Roxb., antibacterial activity,
well diffusion, ethyl acetate extract.
MOTTO
K adang Allah yang mengetahui yang terbaik, akan memberi kesusahan untuk menguji kit a K adang I a pun melukai hati, supaya hikmah-Nya bisa tertanam dalam.
Jika kita kehilangan sesuatu, maka pasti ada alasan di baliknya.
Alasan yang kadang sulit untuk dimengerti, namun kita tetap harus percaya bahwa ketika I a mengambil sesuatu, I a telah siap memberi yang lebih baik.
u
Masa depan yang cerah berdasarkan pada masa lalu yang telah dilupakan. Kamu tidak dapat melangkah dengan baik dalam kehidupan kamu sampai
kamu melupakan kegagalan kamu dan rasa sakit hati.
u
K etika kamu lahir, kamu menangis dan semua orang di sekeliling kamu tersenyum.
Hiduplah dengan hidupmu, jadi ketika kamu meninggal, kamu satu-satunya yang t ersenyum dan semua orang di sekeliling kamu menangis.
u
May t he PURE of LOVE always in our heart
u
This Thesis I dedicated to … .
Allah SWT, thanks for give me the life, I always try to justifies my life.
M y father, mother, grandma and both my big brother for given the prayer and spirit.
M y sweetgirl, hope that devotion always in our heart since we meet till the end.
Natural chemist past, now and future.
Friends, …
PERSEMBAHAN
KATA PENGANTAR
Puji syukur kepada Allah SWT atas segala limpahan nikmat dan karunia-Nya, sehingga penulis dapat menyelesaikan penulisan skripsi dengan judul “STUDI AKTIVITAS ANTIBAKTERI DAN IDENTIFIKASI GOLONGAN SENYAWA EKSTRAK AKTIF ANTIBAKTERI BUAH GAMBAS (Luffa acutangula Roxb.)". Sholawat dan salam senantiasa penulis sampaikan kepada
Rasulullah SAW sebagai pembimbing seluruh umat manusia.
Skripsi ini tidak akan selesai tanpa adanya bantuan dari banyak pihak, karena itu dengan kerendahan hati penulis menyampaikan terima kasih kepada : 1. Bapak Prof. Drs. Sutarno, M.Sc, PhD. selaku Dekan FMIPA UNS.
2. Bapak Drs. Sentot Budi Rahardjo, PhD. selaku Ketua Jurusan Kimia.
3. Ibu Venty Suryanti, M. Phil. selaku pembimbing pertama yang telah memberikan petunjuk, bimbingan, saran dan masukan untuk terselesaikannya skripsi ini.
4. Ibu Dr. Linar Zalinar Udin, M. S. dari LIPI, Bandung selaku pembimbing kedua yang telah memberikan petunjuk, bimbingan, saran dan masukan untuk terselesaikannya skripsi ini.
5. Bapak dan Ibu Dosen di Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sebelas Maret atas semua ilmu yang berguna dalam penyusunan skripsi ini.
6. Ibu Indah, Ibu Vina dan Seluruh staff dan karyawan Laboratorium Biokimia dan Kimia Organik, Lembaga Ilmu Pengetahuan Indonesia, Bandung.
7. Ibu Sholichatun, M.Si. selaku Ketua Sub Laboratorium Biologi Laboratorium Pusat FMIPA UNS, Bapak Susilo, Bapak Hartono, dan staff lainnya.
8. Bapak I.F. Nurcahyo, M.Si. selaku Pembimbing Akademis dan selaku Ketua Laboratorium Kimia Dasar FMIPA UNS beserta staffnya : Mbak Nanik dan Mas Anang.
9. Kepala Laboratorium Universitas Setya Budi Surakarta beserta teknisi. 10. Karyawan jurusan Kimia FMIPA UNS.
11. Teman-teman angkatan 2004.
12. Pihak-pihak yang tidak dapat penulis sebutkan satu persatu.
Semoga Allah SWT membalas jerih payah dan pengorbanan yaang telah diberikan dengan balasan yang lebih baik. Amin.
Penulis menyadari bahwa banyak kekurangan dalam penulisan skripsi ini. Oleh karena itu, penulis mengharapkan kritik dan saran untuk penyempurnaan skripsi ini. Namun demikian, penulis berharap semoga karya kecil ini bermanfaat bagi perkembangan ilmu pengetahuan dan kita semua. Amin.
Surakarta, 31 Agustus 2009
TRISTIYANTO
DAFTAR ISI
Halaman
HALAMAN JUDUL... i
HALAMAN PENGESAHAN... ii
HALAMAN PERNYATAAN... iii
ABSTRAK ... iv
ABSTRACT... v
HALAMAN MOTTO... vi
HALAMAN PERSEMBAHAN... vii
KATA PENGANTAR ... viii
DAFTAR ISI ... x
DAFTAR TABEL... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN... xv
BAB I. PENDAHULUAN ... 1
A. Latar Belakang Masalah... 1
B. Rumusan Masalah... 2
1. Identifikasi Masalah ... 2
2. Batasan masalah... 3
3. Rumusan Masalah... 4
C. Tujuan Penelitian . ... 4
D. Manfaat Penelitian. ... 5
BAB II. LANDASAN TEORI ... 6
A. Tinjauan Pustaka ... 6
1. Suku Curcubitacae ... 6
2. Tanaman gambas (Luffa acutangula) ... 7
3. Bakteri dan Klasifikasi Bakteri Uji... 9
4. Pengertian Antibakteri ... 14
5. Obat Antibakteri Ampisilin dan Senyawa-Senyawa Metabolit Sekunder yang Diduga Mempunyai
Aktivitas Antibakteri ... 16
6. Metode Pengujian Aktivitas Antibakteri... 24
7. Ekstraksi Maserasi dan Ekstraksi Bertingkat ... 26
8. Penapisan Fitokimia ... 27
9. Kromatografi Lapis Tipis (KLT) ... 31
10. Konsentrasi Hambat Minimum (KHM), Konsentrasi Bakterisidal Minimum (KBM) dan Uji Banding... 32
B. Kerangka Pemikiran... 33
C. Hipotesis... 35
BAB III. METODOLOGI PENELITIAN ... 36
A. Metode Penelitian ... 36
B. Tempat dan Waktu Penelitian ... 36
C. Alat dan Bahan ... 36
D. Bagan Alir Penelitian... 37
E. Prosedur Penelitian ... 37
F. Teknik Pengumpulan dan Analisa Data... 44
BAB IV. HASIL PENELITIAN DAN PEMBAHASAN ... 45
BAB V. KESIMPULAN DAN SARAN... 63
A. Kesimpulan ... 63
B. Saran ... 63
DAFTAR PUSTAKA ... 64
LAMPIRAN-LAMPIRAN ... 70
DAFTAR TABEL
Halaman Tabel 1. Beberapa ciri bakteri gram positif dan gram negatif. ... 10 Tabel 2. Pengujian Aktivitas Antibakteri Ekstrak Metanol Buah gambas 47 Tabel 3. Hasil Ekstraksi Bertingkat Ekstrak Metanol ... 50 Tabel 4. Hasil Pengujian Golongan Senyawa Antibakteri yang Terdapat
pada Ekstrak Metanol, Heksana, Kloroform, Etil Asetat dan
Butanol ... 53 Tabel 5. Hasil Uji Golongan Senyawa yang Terdapat pada Ekstrak Etil
Asetat dengan Panapisan Fitokimia (PF) dan Kromatografi Lapis Tipis (KLT) ... 54 Tabel 6. Hasil Pengujian KHM Ekstrak Etil Asetat (Uji ke-2)... 58 Tabel 7. Hasil Uji Aktivitas Antibakteri Ampisilin ... 60 Tabel 8. Hasil Penentapan Nilai Banding Ekstrak Etil Asetat Terhadap
Ampisilin ... 62
DAFTAR GAMBAR
Halaman Gambar 1. Tanaman gambas (Luffa acutangula)... 7
Gambar 2. Anatomi Umum dari Bakteri ... 9 Gambar 3. Ikatan Kovalen antara Ampisilin dengan Enzim
Transpeptidase (Soekardjo dan Siswandono, 2000) ... 17 Gambar 4 Senyawa-Senyawa Golongan Tanin (Shimamura et al.,
2007)... 18 Gambar 5. Senyawa-Senyawa Golongan Flavonoid (Achmad, 1986)... 19 Gambar 6. Senyawa Steroid-Sapogenin (Wagner, 1984)... 21 Gambar 7. Senyawa-Senyawa Terpenoid yang Bersifat Antibakteri
(Cowan, 1999; Daisy et al., 2008) ... 22
Gambar 8. Golongan Senyawa Alkaloid Berdasarkan Penyusun Asam
Amino (Achmad, 1986)... 23 Gambar 9. Senyawa-Senyawa Alkaloid yang Bersifat Antibakteri
(Cowan, 1999)... 23 Gambar 10. Senyawa-Senyawa Golongan Fenol (Cowan, 1999)... 24 Gambar 11. Perkiraan Reaksi Uji Wagner (Marliana dkk., 2005)... 28 Gambar 12. Perkiraan Reaksi Uji Tanin dengan FeCl3 (Syarifuddin,
1994)... 29 Gambar 13. Reaksi Uji Flavonoid (Achmad, 1986)... 29
Gambar 14. Reaksi Hidrolisis Saponin dalam Air (Marliana dkk., 2005). 30 Gambar 15. Reaksi Uji Terpenoid dengan vanillin – H2SO4 (Jork et al.,
1990)... 30 Gambar 16. Reaksi Uji KLT Flavonoid dengan AlCl3 (Jork et al., 1990) 32
Gambar 17. Reaksi Uji saponin dengan SbCl3 (Jork et al., 1990)... 32
Gambar 18. Hasil Uji Aktivitas Antibakteri Ekstrak Metanol Terhadap Bakteri S. aureus, P. aeruginosa, E. coli, B. subtilis dan S.
thypi... 48
Gambar 19. Hasil Uji Aktivitas Antibakteri Ekstrak-ekstrak Hasil
Ekstraksi Bertingkat Terhadap Bakteri E. coli, B. subtilis, S. aureus dan P. aeruginosa dengan Berat Ekstrak
15mg/lubang ... 51 Gambar 20. Hasil Pengujian KHM Ekstrak Etil Asetat (Uji Ke-1) ... 57
DAFTAR LAMPIRAN
Halaman Lampiran 1. Bagan Alir Penelitian ... 70 Lampiran 2. Hasil Determinasi buah gambas (Luffa acutangula Roxb.) 72
Lampiran 3. Perhitungan Rendemen Ekstrak Metanol, Konversi
Konsentrasi Sampel dan Perhitungan Jumlah Bakteri Uji .. 73 Lampiran 4. Hasil Uji Aktivitas Antibakteri Ekstrak Metanol... 75 Lampiran 5. Analisa One Way ANOVA Pengaruh Variasi Bakteri Pada
Masing-Masing Berat Sampel Ekstrak Metanol. ... 79 Lampiran 6. Analisa One Way ANOVA Pengaruh Variasi Berat
Sampel Ekstrak Metanol Pada Masing-Masing Bakteri ... 83 Lampiran 7. Hasil Uji Aktivitas Antibakteri Ekstrak-Ekstrak Hasil
Ekstraksi Bertingkat. ... 85 Lampiran 8. Analisa One Way-ANOVA Pengaruh Variasi Ekstrak
pada Masing-Masing Bakteri pada Uji Aktivitas
Antibakteri Ekstrak-Ekstrak Hasil Ekstraksi Bertingkat... 88 Lampiran 9. Hasil Skrining Fitokimia terhadap Ekstrak Buah gambas... 92 Lampiran 10. Hasil KLT Ekstrak Etil Asetat ... 93 Lampiran 11. Hasil Uji KHM Ekstrak Etil Asetat ... 97 Lampiran 12. Analisa One Way ANOVA Pengaruh Variasi Bakteri pada
Masing-Masing Konsentrasi ekstrak pada Penentuan
KHM Ekstrak Etil Asetat... 100 Lampiran 13. Analisa One Way ANOVA Pengaruh Variasi Konsentrasi
ekstrak pada Masing-Masing Bakteri pada Penentuan
KHM Ekstrak Etil Asetat... 103 Lampiran 14. Hasil Uji KHM dan Penentuan Nilai Banding Ekstrak
Etil Asetat terhadap Ampisilin ... 107 Lampiran 15. Penentuan KHM Ampisilin ... 110 Lampiran 16. Analisa One Way ANOVA Pengaruh Variasi Konsentrasi
Ampisilin pada Masing-Masing Bakteri pada Uji Aktivitas
Antibakteri Ampisilin... 111
Lampiran 17. Analisa One Way ANOVA Pengaruh Variasi Bakteri Ampisilin pada Masing-Masing Konsentrasi pada Uji
Aktivitas Antibakteri Ampisilin... 117 Lampiran 18. Perhitungan Nilai Banding ... 123
1
BAB I
PENDAHULUAN
A. Latar Belakang Masalah
Penyakit infeksi pada manusia salah satunya disebabkan oleh infeksi bakteri patogen. Beberapa tahun terakhir ini, bakteri patogen yang resisten terhadap obat semakin banyak dikarenakan pemakaian obat antimikroba komersil yang tidak tepat pada pengobatan penyakit infeksi. Situasi tersebut ditambah dengan efek samping yang tidak diinginkan dari beberapa obat antibiotik dan kebutuhan yang mendesak untuk penyembuhan penyakit infeksi. Masalah-masalah di atas merupakan problem yang serius dalam dunia kesehatan, sehingga mendesak para ilmuwan untuk mencari obat antibakteri yang baru yang berasal dari tanaman (Merchese and Shito, 2001; Karaman et al., 2003 dalam Aliero et al., 2008).
Metode pengujian secara in-vitro untuk memilih ekstrak kasar tanaman
yang memiliki potensi antibakteri sangat berguna untuk penelitian lebih lanjut tentang struktur kimia dan efek farmakologi dari senyawa-senyawa yang terdapat pada ekstrak kasar tanaman (Aliero et al., 2008). Senyawa-senyawa metabolit
sekunder yang terdapat pada tanaman yang mempunyai aktivitas antibakteri antara lain fenol dan persenyawaan fenolat (Soekardjo dan Siswandono, 2000; Cowan, 1999), saponin (Cheeke, 2000), beberapa senyawa dari golongan senyawa
flavonoid, alkaloid (Cowan,1999), tanin (Shimamura et al., 2007), triterpenoid,
terpenoid dan minyak atsiri (Cowan, 1999).
Tanaman suku Curcubitaceae yang telah dilakukan pengujian aktivitas antibakteri antara lain spesies Luffa cylindrica (Belustru) dan Benincasa hispida
(Beligo). Ekstrak metanol, kloroform dan etanol, daun dan biji buah belustru mampu menghambat pertumbuhan bakteri E. coli, S. aureus, S. thypi dan B. subtilis. Daun dan biji buah belustru mengandung senyawa antibakteri alkaloid
dan saponin (Oyetayo et al., 2007). Ekstrak metanol buah beligo yang
Tanaman gambas merupakan salah satu spesies suku Curcubitaceae dan buah gambas (Luffa acutangula Roxb.) selain digunakan masyarakat sebagai
sayuran juga sebagai obat. Buah gambas mempunyai efek pembersih darah, mendinginkan perut, memperbanyak Air Susu Ibu (ASI), mengobati penyakit wasir (Rukmana, 2000), anthelmintik, stomakik dan antipiretik (Grewal, et al.,
1943 dalam Tsuneatsu, et al., 1991). Biji buah gambas juga digunakkan sebagai
ekspektoran (Grewal, et al., 1943 dalam Tsuneatsu, et al., 1991).
Senyawa-senyawa metabolit sekunder yang terdapat pada buah gambas adalah golongan flavonoid (Miean et al., 2008), golongan alkaloid, golongan
terpenoid (saponin dan karotenoid), senyawa 3,5-Dihidroksi-6-metil-2,3-dihidro-piran-4-one dan kolesterol (Astuti, 2005). Buah gambas juga mengandung protein chitotetrose spesifik lectin (Anantharam et al., 1985) dan biji buah gambas
mengandung protein luffaculin (Min et al., 2006), curcubitacin B dan asam
oleanolat saponin (Barua et al., 1958 dalam Tsuneatsu et al., 1991)
Penelitian aktivitas antibakteri bagian tanaman spesies-spesies suku Curcubitaceae telah dilakukan. Buah gambas merupakan salah satu suku Curcubitaceae yang mengandung golongan senyawa flavonoid, alkaloid, terpenoid dan saponin. Beberapa senyawa dari golongan senyawa flavonoid, alkaloid, terpenoid dan saponin mempunyai aktivitas antibakteri (Cowan, 1999). Dalam rangka pencarian obat antibakteri baru yang berasal dari tanaman, pemanfaatan buah gambas sebagai antibakteri belum dilakukan penelitian secara ilmiah. Maka perlu dilakukan pengujian secara ilmiah aktivitas antibakteri ekstrak buah gambas.
B. Perumusan Masalah
1. Identifikasi Masalah
Penelitian studi aktivitas antibakteri dan identifikasi golongan senyawa ekstrak aktif antibakteri buah gambas terdapat masalah sebagai berikut :
polar dapat diisolasi dengan menggunakan pelarut heksana, petroleum eter, benzena dan toluen dan senyawa yang lebih polar dapat diperoleh dengan pelarut etil asetat, butanol, metanol dan air. Hasil isolasi dengan pelarut yang berbeda akan menghasilkan ekstrak dengan senyawa yang berbeda sehingga akan mempengaruhi aktivitas antibakteri dari ekstrak. Dari hal di atas perlu diperhatikan cara isolasi senyawa buah gambas dengan pelarut yang tepat.
Aktivitas antibakteri buah gambas dapat diketahui dengan pengujian secara in-vitro dan in-vivo ekstrak buah gambas. Pengujian secara in-vitro dapat
dilakukan dengan metode difusi (metode silinder, metode lubang dan metode cakram kertas) dan metode pengenceran (pengenceran tabung dan pengenceran agar). Dari hal di atas perlu diperhatikan cara pengujian aktivitas antibakteri secara in-vitro terhadap ekstrak hasil isolasi senyawa buah gambas terhadap
bakteri uji untuk mengetahui aktivitas antibakteri dari ekstrak buah gambas. Aktivitas antibakteri ekstrak aktif antibakteri buah gambas tergantung dari golongan senyawa yang terdapat pada ekstrak. Untuk mengetahuai golongan senyawa yang terdapat ekstrak, maka perlu dilakukan pengujian golongan senyawa dengan metode penapisan fitokimia dan kromatografi lapis tipis (KLT).
Aktivitas antibakteri ekstrak aktif antibakteri tertinggi jika dibandingkan dengan ampisilin dapat diketahui dengan mencari dan membandingkan konsentrasi hambat minimum (KHM), konsentrasi bakterisidal minimum (KBM) dan nilai banding ekstrak terhadap ampisilin. Untuk mengetahui perbandingan aktivitas antibakteri ekstrak aktif antibakteri tertinggi buah gambas dengan ampisilin, perlu dilakukan uji ekstrak aktif antibakteri tertinggi dan ampisilin.
2.Batasan Masalah
Berdasarkan identifikasi masalah di atas, maka masalah dalam penelitian ini dibatasi pada :
b. Pengujian aktivitas antibakteri ekstrak buah gambas dilakukan secara in-vitro
dengan metode difusi lubang.
c. Bakteri yang digunakan untuk pengujian aktivitas antibakteri adalah
E. coli, B. subtilis, S. aureus, P. aeruginosa, E. aerogenes, S. dysentriae dan
atau S. thypi.
d. Golongan senyawa yang diuji adalah golongan alkaloid, saponin, tanin, fenolat, terpenoid dan flavonoid.
e. Metode yang digunakan untuk mengetahui perbandingan aktivitas antibakteri dari ekstrak aktif antibakteri tertinggi buah gambas dengan ampisilin adalah dengan mencari dan membandingkan KHM dan nilai banding ekstrak terhadap ampisilin.
3.Rumusan Masalah
Berdasarkan batasan masalah diatas, maka perumusan masalah dalam penelitian ini adalah sebagai berikut :
a. Apakah ekstrak metanol buah gambas mempunyai aktivitas antibakteri ? b. Apakah ekstrak heksana, kloroform, etil asetat dan butanol buah gambas
mempunyai aktivitas antibakteri?
c. Apakah golongan senyawa alkaloid, saponin, tanin, fenolat, terpenoid dan atau flavonoid terdapat pada ekstrak aktif antibakteri buah gambas ?
d. Bagaimana aktivitas antibakteri ekstrak aktif antibakteri tertinggi jika dibandingkan dengan ampisilin?
C. Tujuan Penelitian
Penelitian ini bertujuan untuk :
1. Mengetahui aktivitas antibakteri ekstrak metanol buah gambas.
2. Mengetahui aktivitas antibakteri ekstrak heksana, kloroform, etil asetat dan butanol.
4. Mengetahui aktivitas antibakteri ekstrak aktif antibakteri tertinggi buah gambas jika dibandingkan dengan ampisilin.
D. Manfaat Penelitian
Manfaat yang diperoleh dari penelitian ini adalah :
1. Segi praktis, memberikan informasi ilmiah untuk bidang farmasi dan dunia kesehatan mengenai aktivitas antibakteri ekstrak buah gambas beserta golongan-golongan senyawanya.
6
BAB II
LANDASAN TEORI
A. Tinjauan Pustaka
1. Suku Curcubitaceae
Salah satu tanaman yang terdapat di Indonesia adalah suku Curcubitaceae. Curcubitaceae merupakan suku tanaman yang kebanyakan berupa tanaman banyak air yang bersulur dan jarang yang bersemak belukar. Curcubitaceae dapat dikenali dengan batang yang bersudut 5 dan sulur-sulur yang bergulung. Daun biasanya berlekuk lima atau terbagi, tidak ada penopang, terdapat banyak hidatoda dan stomata terdapat pada satu permukaan atau dua permukaan. Bunga bersifat aktinomorf dan hampir semua berumah satu. Buahnya bertipe beri yang disebut labu (Watson, 1992).
Spesies-spesies suku Curcubitaceae yang telah diuji aktivitas antibakterinya antara lain spesies Citrullus colocynthis L. Schrad, Luffa cylindrica (belustru), Lagenaria breviflora, Coccinia grandis L. dan Benincasa hispida (beligo). Ekstrak metanol, kloroform dan etanol, daun dan biji belustru
masing-masing mampu menghambat pertumbuhan bakteri E. coli, S. aureus, S. thypi dan B. subtilis. Daun dan biji belustru mengandung senyawa antibakteri
alkaloid dan saponin (Oyetayo et al., 2007). Ekstrak metanol beligo yang
mengandung senyawa triterpenoid dan flavanoid mampu menghambat pertumbuhan bakteri P. acnes dan S. epidermidis (Kumar et al., 2006). Ekstrak
daun C. colocynthis L. Schrad menghambat pertumbuhan yang kuat terhadap
bakteri E. coli, P. aeruginosa, B. subtilis dan P. vulgaris dan menghambat dengan
lemah bakteri S. aureus, K. pneumoniae dan S. typhi(Peter Paul, 2008). Ekstrak
etanol buah L. breviflora menghambat pertumbuhan bakteri E. coli, B. subtilis, S. aureus dan P. aeruginosa. (Tomori et al., 2007). Ekstrak daun dan batang C. grandis L. menghambat pertumbuhan bakteri B. cereus, C. diptheriae, S. aureus, S. pyogenes, E. coli, K. pneumonia, P. mirabilis, P. aeruginosa, S. typhi dan S. boydii. Ekstrak air daun dan ekstrak etanol batang C. grandis L. menghambat
2. Tanaman gambas (Luffa acutangula)
Tanaman gambas yang dikenal dengan nama latin Luffa acutangula
banyak dibudidayakan sebagai tanaman sela perkarangan, pematang sawah dan di sawah setelah tanaman padi. Pemanfaatan buah gambas dapat dipakai sebagai sayuran untuk dibuat masakan dan daun tanaman gambas dipakai sebagai sayuran lalapan (Sutarya dkk., 1995). Nama lain dari tanaman ini adalah angled loofah
(Inggris), ketola sagi (Malaysia) dan sze kwa (Cina) (Rukmana, R, 2000). Buah
gambas di Indonesia dikenal dalam berbagai nama antara lain timput (Palembang), emes/kimput (Sunda), kacur/oyong (Jawa) (Hyne, 1987). Daerah-daerah di Indonesia yang membudidayakan tanaman gambas antara lain Kabupaten Tanjung Barat, Provinsi Jambi (Maslian) dan Kabupaten Sumbawa Barat, NTB (Anonim, 2006). Tanaman gambas dapat dilihat pada Gambar 1.
Gambar 1. Tanaman gambas (Luffa acutangula)
.
a. Klasifikasi tanaman
marga Luffa dan spesies Luffa acutangula Roxb. (Rukmana, 2000; Anonim,
2008).
b. Deskripsi tanaman
Tanaman gambas termasuk tumbuhan tahunan yang bersifat merambat dan menjalar. Tanaman gambas berbatang lunak dengan bentuk segi lima, serta bersulur sebagai alat untuk merambat. Sulur dahan muncul dari sisi tangkai daun yang berbentuk spiral dan berbulu lebih panjang dari bulu-bulu batang. Daun berbentuk lonjong (silindris) dengan pangkal mirip bentuk jantung, ujung daun runcing dan berwarna hijau tua. Daun berukuran panjang 10–25 cm, lebar 10–25 cm dan bertangkai sepanjang 5–10 cm (Rukmana, 2000). Bunga tanaman gambas termasuk bunga berumah satu (monococus), yaitu bunga jantan dan betina terdapat dalam satu tanaman.
Bunga berwarna kuning, umumnya mekar pada sore hari, serta dapat menyerbuk sendiri dan menyerbuk silang. Buah gambas berbentuk bulat panjang dengan bagian pangkal kecil. Buah berukuran panjang 15–60 cm, lebar 5–12 cm dengan diameter 5–8 cm, bergeligir 10 mm dan tiap buah berbiji banyak. Biji yang tua berwarna hitam dan berukuran 11–13 mm atau 7–9 mm dengan struktur kulit agak keras (Rukmana, 2000).
c. Kandungan senyawa kimia buah gambas
Senyawa-senyawa metabolit sekunder yang terdapat pada buah gambas adalah golongan flavonoid (Miean et al., 2008), golongan alkaloid, golongan
terpenoid (saponin dan karotenoid) dan senyawa 3,5-Dihidroksi-6-metil-2,3-dihidro-piran-4-one dan kolesterol (Astuti, 2005). Buah gambas juga mengandung protein chitotetrose spesifik lectin (Anantharam et al., 1985) dan
biji buah gambas mengandung protein luffaculin (Min. et al., 2006),
curcubitacin B dan asam oleanolat saponin (Barua et al., 1958 dalam
Tsuneatsu et al., 1991).
d. Manfaat tanaman
dan antipiretik (Grewal et al., 1943 dalam Tsuneatsu et al., 1991). Biji buah
gambas juga digunakkan sebagai ekspektoran (Grewal et al., 1943 dalam
Tsuneatsu et al., 1991). Daun dan buah muda digunakan sebagai bahan sayur
dan lalapan, juga berkhasiat sebagai obat penyakit wasir (Rukmana, 2000).
3. Bakteri dan Klasifikasi Bakteri Uji
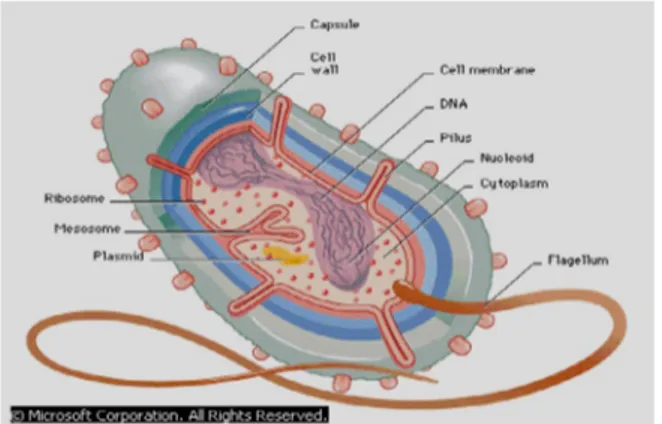
Bakteri termasuk golongan prokariota dan tidak memiliki nukleus, mitokondria dan plastid. Golongan prokariota hanya memiliki satu kromosom dan tidak memiliki histon yang bergabung dengan kromosom tersebut. Prokariota tidak mempunyai mikrotubula (mungkin ada satu perkecualian) dan kerena itu tidak terdapat sentriol, gelendong dan badan basal. Beberapa prokariota mempunyai flagela, tetapi strukturnya tidak dibangun dari mikrotubula sebagaimana flagela dan silia pada eukariota. Ribosom pada prokariota berbeda dari ribosom pada eukariota dalam strukturnya (Kimbal, 1990). Anatomi umum dari bakteri dapat dilihat pada Gambar 2.
Gambar 2. Anatomi Umum dari Bakteri. Dikutip dari : Microsoft Encarta
Reference Library Premium, 2005.
peptidoglikan akan menjerat warna violet. Bakteri gram negatif memiliki lebih sedikit peptidoglikan, yang terletak di suatu gel periplasmik antara membran plasma dan suatu membran bagian luar. Zat warna violet yang digunakan dalam pewarnaan gram sangat mudah dibilas oleh alkohol pada bakteri gram negatif, tetapi selnya tetap menahan zat warna merah (Campbell et al., 2003).
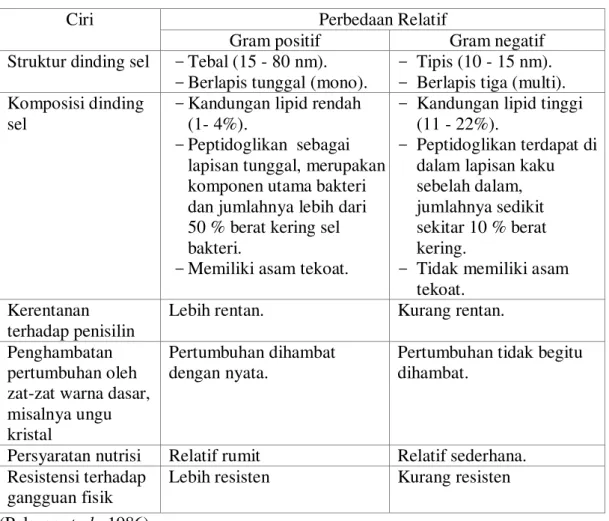
Tabel 1. Beberapa ciri bakteri gram positif dan gram negatif. Perbedaan Relatif Ciri
Gram positif Gram negatif
Struktur dinding sel -Tebal (15 - 80 nm).
-Berlapis tunggal (mono).
- Tipis (10 - 15 nm). - Berlapis tiga (multi).
Komposisi dinding
sel
-Kandungan lipid rendah (1- 4%).
-Peptidoglikan sebagai
lapisan tunggal, merupakan komponen utama bakteri dan jumlahnya lebih dari 50 % berat kering sel bakteri.
-Memiliki asam tekoat.
- Kandungan lipid tinggi
(11 - 22%).
- Peptidoglikan terdapat di
dalam lapisan kaku sebelah dalam, jumlahnya sedikit sekitar 10 % berat kering.
- Tidak memiliki asam
tekoat. Kerentanan
terhadap penisilin Lebih rentan. Kurang rentan. Penghambatan
dengan nyata. Pertumbuhan tidak begitu dihambat.
Persyaratan nutrisi Relatif rumit Relatif sederhana. Resistensi terhadap
gangguan fisik Lebih resisten Kurang resisten (Pelczar et al., 1986)
Bakteri uji yang digunakan dalam penelitian ini adalah sebagai berikut:
a. Bacillus subtilis
Kasifikasi:
Morfologi :
Genus bacillus termasuk batang besar, gram positif, aerob dan membentuk rantai. Umumnya bergerak, membentuk spora yang terletak di tengah basil yang tidak bergerak dan tahan panas. Diameter sel 0,7-0,8 μ m dengan panjang 2-3 μ m, sedangkan sporanya berdiameter 0,6-0,9 μ m dengan panjang 1-1,5 μ m (Salle, 1961). Kebanyakan anggota genus ini adalah organisme saprofit yang lazim terdapat dalam tanah, air, udara dan tumbuh-tumbuhan. Beberapa diantaranya patogen bagi insekta, yaitu dapat menyebabkan infeksi saluran usus dan menghasilkan enterotoksin yang menyebabkan keracunan makanan (Jawetz et al., 1980). ‘
b. Escherichia coli
Klasifikasi :
Termasuk kedalam divisi Protophyta, kelas Schizomycetes, ordo Eubacteriales, famili Enterobacteriaceae dan genus Escherichia (Salle, 1961).
Morfologi:
Merupakan bakteri gram negatif, berbentuk batang lurus dan pendek dan bergerak dengan flagel peritik atau tidak dapat bergerak. Ukuran sel umumnya berdiameter 0,5 μ m dan panjang 1-3 μ m (Salle, 1961).
E. coli merupakan flora normal yang terdapat dalam usus (Jawetz et al.,
2005). E. coli adalah penyebab yang paling lazim dari infeksi saluran kemih
dan merupakan penyebab infeksi saluran kemih pertama wanita muda. Selain itu, dapat menyebabkan infeksi saluran empedu, hati, cystitis, meningitis dan penyakit infeksi lainnya (Jawetz et al., 1980).
c. Staphylococcus aureus
Klasifikasi:
Termasuk kedalam divisi Protophyta, kelas Schizomycetes, ordo Eubacteriales, Famili Micrococcaceae dan genus Staphylococcus (Salle,
1961). Morfologi:
S. aureus adalah bakteri gram positif yang berbentuk bola dengan
media cair terlihat tunggal, berpasangan, tetrad dan membentuk rantai.
S. aureus biasanya membentuk koloni abu–abu hingga kuning emas. Bakteri
ini tumbuh dengan cepat pada temperatur 37°C. Sebagian besar galur
S. aureus mempunyai koagulase atau faktor penggumpalan dinding sel dan
ikatan koagulase secara non enzimatik pada fibrinogen (Jawetz et al., 2005). S. aureus bersifat invasif, penyebab hemolisis, membentuk enterotoksin yang
bisa menyebabkan keracunan makanan (Syahrurachman dkk., 1994). S. aureus
sering menghuni kulit, saluran pernapasan dan saluran pencernakan, kecuali jerawat yang menjengkelkan dan sesekali muncul bintil kecil meradang, kita dapat hidup harmonis dengan organisme ini. Akan tetapi, jika mereka masuk kebawah kulit karena luka, terbakar dan lain-lainnya dapat menyebabkan bisul bernanah (Kimball, 1990).
d. Pseudomonas aeruginosa
Klasifikasi:
Termasuk kedalam devisi Protophyta, kelas Schizomycetes, ordo Eubacteriales, famili Pseudomonaceae dan genus Pseudomonas (Salle, 1961).
Morfologi:
P. aeruginosa bergerak, berbentuk batang dan berukuran sekitar 0,6 x 2
μ m. Bakteri ini gram negatif, terlihat sebagai bakteri tunggal, berpasangan, dan kadang-kadang membentuk rantai yang pendek. P. aeruginosa tumbuh
dengan baik pada suhu 37-42°C, pertumbuhannya pada suhu 42°C membantu membedakan spesies ini dari spesies Pseudomonas yang lain. Bakteri ini
oksidase positif dan tidak meragikan karbohidrat, tetapi banyak strain mengoksidasi glukosa. Pengenalan biasanya berdasarkan morfologi, sifat oksidase positif, adanya pigmen yang khas dan pertumbuhan pada suhu 42°C (Jawetz et al., 1980). P. aeruginosa merupakan penyebab penyakit pada
luka bakar pada pasien sering di infeksi dengan serius oleh bakteri ini (Anonim, 2008).
e. Salmonella thypi.
Klasifikasi:
Termasuk kedalam devisi Protophyta, kelas Schizomycetes, ordo Eubacteriales, famili Enterobacteriaceae dan genus Salmonellae (Salle, 1961).
Morfologi:
S. thypi merupakan bakteri gram negatif, berflagel, tidak berspora dan
sangat panjang. S. typhi memiliki 3 macam antigen yaitu antigen O (somatik
berupa kompleks polisakarida), antigen H (flagel), dan antigen Vi. Serum penderita demam tifoid akan terbentuk antibodi terhadap ketiga macam antigen tersebut. Penyakit yang disebabkan oleh S. typhi adalah demam tifoid,
Demam tifoid (tifus abdominalis, enteric fever) adalah penyakit infeksi akut
yang biasanya terdapat pada saluran pencernaan dengan gejala demam yang lebih dari 7 hari dan gangguan pada saluran pencernaan dengan atau tanpa gangguan kesadaran (Jawetz et al., 1980).
f. Shigella dysentriae
Klasifikasi:
S. dysentriae termasuk kedalam devisi Protophyta, kelas Schizomycetes,
ordo Eubacteriales, famili Enterobacteriaceae dan genus Shigella (Salle,
1961). Morfologi :
Shigella merupakan bakteri gram negatif, aerob, batang ramping, tidak
berkapsul, tidak bergerak dan tidak membentuk spora. Penyakit yang disebabkan oleh bakteri S. dysentriae adalah Shigellosis disebut juga desentri
basiler. Habitat alamiah kuman disentri adalah usus besar manusia, dimana kuman tersebut dapat menyebabkan disentri basiler. Disentri sendiri artinya gangguan yang ditandai dengan peradangan usus, terutama kolon yang disertai nyeri perut dan buang air besar yang sering mengandung darah dan lendir. Infeksi Shigella praktis selalu terbatas pada saluran pencernaan dan invasi
g. Entrobacter aerogenes
Klasifikasi:
Termasuk kedalam divisi Protophyta, kelas Schizomycetes, ordo Eubacteriales, famili Enterobacteriaceae dan genus Entrobacter (Salle, 1961).
Morfologi :
E. aerogenes biasanya motil, memperlihatkan pertumbuhan mukoid
yang sedikit, mempunyai kapsul kecil, terdapat pada lingkungan luar dan saluran pencernakan. E. aerogenes terdapat dalam usus, tetapi jika diluar
saluran pencernaan akan menyebabkan penyakitinfeksi saluran kemih (Jawetz
et al., 1980).
4. Pengertian Antibakteri
Antibiotika adalah senyawa kimia yang khas yang dihasilkan oleh mikroorganisme hidup termasuk turunan senyawa dan struktur analognya yang dibuat secara sintetik dan dalam kadar yang rendah mampu menghambat proses penting dalam kehidupan suatu mikroorganisme. Pada awalnya antibiotik diisolasi dari mikrooorganisme, tetapi sekarang beberapa antiboitik didapatkan dari tumbuhan tingkat tinggi dan binatang (Soekardjo dan Siswandono, 2000). Salah satu contoh antiboitik adalah obat antibakteri. Antibakteri adalah zat yang membunuh atau menekan pertumbuhan atau reproduksi bakteri. Suatu zat antibakteri yang ideal harus memiliki sifat toksisitas selektif, artinya bahwa suatu obat berbahaya terhadap parasit tetapi tidak membahayakan tuan rumah (hopses). Zat antibakteri dibagi menjadi dua kelompok, yaitu antibakteri yang dapat menghambat pertumbuhan bakteri (bakteriostatik) dan antibakteri yang dapat membunuh bakteri (bakteriosid) (Talaro, 2008). Berdasarkan daya menghambat atau membunuhnya, antibakteri dibedakan menjadi dua kelompok, yaitu berspektrum sempit (narrow spectrum) dan berspektrum luas (broad spectrum).
Berdasarkan mekanisme kerjanya, antibakteri dapat dibagi menjadi empat cara, yaitu :
a. Penghambatan terhadap sintesis dinding sel.
Bakteri mempunyai lapisan luar yang kaku yaitu dinding sel yang mengelilingi secara lengkap sitoplasma membran sel. Dinding sel berisi polimer mucopeptida kompleks (peptidoglikan) yang secara kimia berisi polisakarida dan campuran rantai polipeptida yang tinggi, polisakarida ini berisi gula amino N-acetylglucosamine dan asam acetylmuramic (hanya
ditemui pada bakteri) (Jawetz et al., 2005). Dinding ini mempertahankan
bentuk mikroorganisme dan pelindung sel bakteri dari perbedaan tekanan osmotik di dalam dan di luar sel yang tinggi. Dinding sel bakteri terdiri dari peptidoglikan dan komponen yang lain. Sel yang aktif secara kontiyu mensintesis peptidoglikan yang baru dan menempatkannya pada posisi yang tepat pada amplop sel. Antibakteri bereaksi dengan satu atau banyak enzim yang dibutuhkan pada proses sintesis, sehingga menyebabkan pembentukan dinding sel yang lemah dan menyebabkan pemecahan osmotik (Talaro, 2008).
b. Penghambatan terhadap fungsi membran sel.
Sitoplasma semua sel hidup dibatasi oleh membran sitoplasma, yang berperan sebagai barrier permeabilitas selektif, memiliki fungsi transport aktif, dan kemudian mengontrol komposisi internal sel. Jika fungsi integritas dari membran sitoplasma dirusak akan menyebabkan keluarnya makromolekul dan ion dari sel, kemudian sel rusak atau terjadi kematian (Jawetz et al., 2005).
Sitoplasma semua sel hidup dibatasi oleh membran sitoplasma yang berperan sebagai barrier permeabilitas selektif dan mengontrol komposisi internal sel. Antibakteri (polymyxins) berikatan dengan membran fospolipid yang menyebabkan pemecahan protein dan basa nitrogen sehingga membran bakteri pecah yang menyebabkan kematian bakteri (Talaro, 2008).
DNA, RNA dan protein memegang peranan sangat penting di dalam proses kehidupan normal sel. Hal ini berarti bahwa gangguan apapun yang terjadi pada pembentukan atau pada fungsi zat-zat tersebut dapat mengakibatkan kerusakan total pada sel (Pelczar et al., 1986). Kebanyakan
obat menghambat translasi atau sintesis protein, bereaksi dengan ribosom-mRNA. Mekanisme kerjanya antara lain dengan menghalangi terikatnya RNA pada tempat spesifik ribosom, selama pemanjangan rantai peptida (Pelczar et al., 1986). Ribosom eukariotik berbeda dalam ukuran dan struktur dari
prokariotik, sehingga menyebabkan aksi yang selektif terhadap bakteri. Bakteri mempunyai 70S ribosom, sedangkan sel mamalia mempunyai 80S ribosom. Subunit masing-masing tipe ribosom, komposisi kimia dan spesifikasi fungsinya berbeda. Perbedaan tersebut dapat untuk menerangkan mengapa antibakteri dapat menghambat sintesis protein dalam ribosom bakteri tanpa berpengaruh pada ribosom mamalia (Talaro, 2008; Jawetz et al., 2005).
d. Penghambatan terhadap sintesis asam nukleat.
Pembentukan DNA dan RNA bakteri merupakan perjalanan yang panjang dan membutuhkan enzim di beberapa proses. Pembentukan DNA dan RNA sangat penting dan berefek dalam metabolisme protein. Antibakteri menginteferensi sintesis asam nukleat dengan menghambat sintesis nukleitida, menghambat replikasi, atau menghentikan transkripsi. Obat berikatan sangat kuat pada enzim DNA Dependent RNA Polymerase bakteri, sehingga
menghambat sintesis RNA bakteri. Resistensi pada obat-obat ini terjadi akibat perubahan pada RNA polymerase akibat mutasi kromosom yang sangat sering
terjadi (Talaro, 2008; Jawetz et al., 2005)
5. Obat Antibakteri Ampisilin dan Senyawa-Senyawa Metabolit Sekunder yang Diduga Mempunyai Aktivitas Antibakteri
a. Obat Antibakteri Ampisilin
tipoid. Ampisilin adalah turunan penisilin yang tahan terhadap asam tetapi tidak tahan terhadap enzim penisilinase. Absorpsi obat dalam saluran cerna kurang baik (±30-40%) dan obat terikat oleh protein plasma ± 20 % (Soekardjo dan Siswandono, 2000).
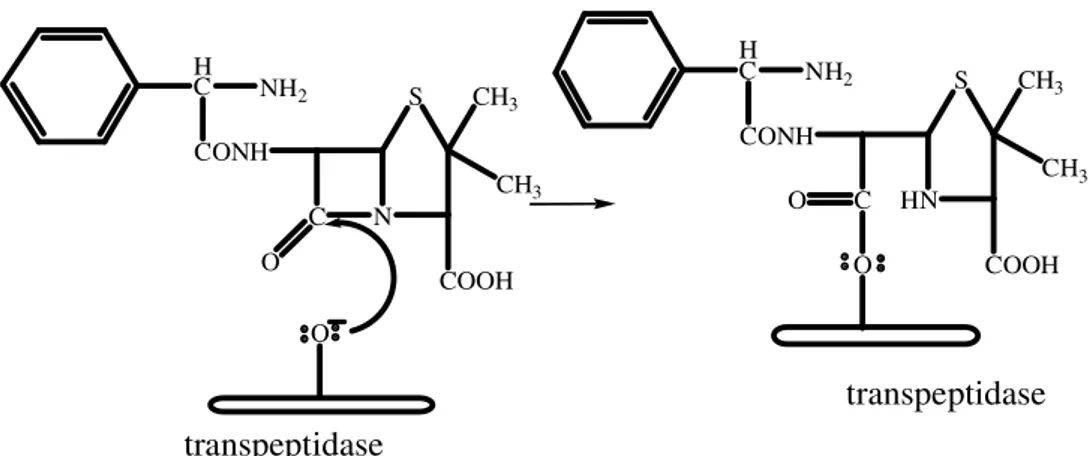
Ampisilin dapat menghambat kerja enzim transpeptidase dengan cara mengikat enzim melalui ikatan kovalen sehingga mencegah pembentukan dinding sel bakteri. Pada tingkat molekul, mekanisme kerjanya ditunjukkan oleh serangan nukleofil dari gugus hidroksil serin enzim transpeptidase pada karbonil karbon cincin β-laktam yang bermuatan positif, sehingga terjadi hambatan biosintesis peptidoglikan. Ikatan kovalen antara ampisilin dengan enzim transpeptidase ditunjukkan pada Gambar 3. Akibatnya dinding sel menjadi lemah dan karena adanya tekanan turgor dari dalam, dinding sel pecah atau lisis sehingga bakteri mati. Ampisiln dapat diinaktivasi dengan adanya enzim β- laktamase/penisilinase yang dihasilkan oleh bakteri (Soekardjo dan Siswandono, 2000).
H C
CONH
C N
O
S
CH3 CH3
O
H C
CONH
C S
CH3 CH3
HN O
NH2 NH2
COOH COOH
transpeptidase
transpeptidase O
Gambar 3. Ikatan Kovalen antara Ampisilin dengan Enzim Transpeptidase (Soekardjo dan Siswandono, 2000)
b. Senyawa-senyawa dari Golongan Senyawa Metabolit Sekunder yang diduga Mempunyai Aktivitas Antibakteri.
1. Tanin.
Tanin merupakan penggambaran secara umum untuk golongan polimer fenolik (Cowan, 1999). Tanin merupakan bahan yang dapat merubah kulit mentah menjadi kulit siap pakai karena kemampuannya menyambung silangkan protein (Harborne, 1996) dan mengendapkan gelatin dalam larutan (Cowan, 1999). Berat molekulnya antara 500 sampai 28000 dan ditemukan pada bagian tanaman kuncup, batang, daun, buah dan akar (Cowan, 1999). Tanin dibagi menjadi 2 yaitu tanin terkondensasi dan tanin terhidrolisa. Tanin terkondensasi contohnya epigallocatechin (EGC), epicatechin (EC) dan catechin. Tanin terhidrolisa contohnya (-)-epigallocatechin gallate (EGCg) dan (-)-epicatechin gallate (EGg) (Harborne, 1996; Shimamura et
Gambar 4 Senyawa-Senyawa Golongan Tanin (Shimamura et al., 2007)
Tanin mempunyai aktivitas antibakteri melalui aksi molekulernya yaitu membentuk kompleks dengan protein melalui ikatan hidrogen dan ikatan hidrofobik (Cowan, 1999). Tanin dari daun teh (Camellia sinesis),
(-)-epigallocatechin gallate dan (-)-epicatechin gallate mempunyai aktivitas antibakteri terhadap Multidrug-Resistent Stapylococcus aureus (MRSA),
dan jika salah satu dari senyawa tersebut digabung dengan antibiotik β -Laktam (pinisilin, ampisilin, metisilin) mempunyai efek sinergik yaitu bersama-sama berikatan dengan peptidogikan yang menyebabkan bakteri mati dan senyawa EGCg atau EGg menghambat aktivitas enzim penisilinase yang merupakan enzim perusak antibiotik β –Laktam, sehingga melindungi antibiotik tersebut dalam bekerja (Shimamura et al., 2007).
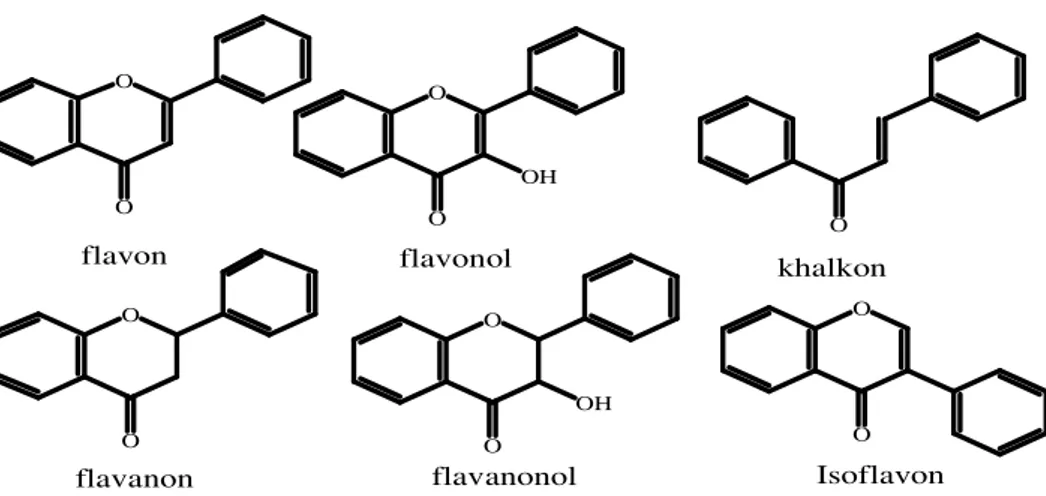
2. Flavonoid
Salah satu kelas yang banyak tersebar dari senyawa fenolat adalah flavonoid. Golongan senyawa ini memberikan warna pada buah dan bunga. Flavonoid telah banyak dikarakterisasi dan digolongkan berdasarkan struktur kimianya (Bylka and Pilewski, 2004). Flavonoid adalah senyawa fenolat terhidroksilasi (Cowan, 1999) dan merupakan senyawa C6-C3-C6
dimana C6 diganti dengan cincin benzen dan C3 adalah rantai alifatik yang
terdiri dari cincin piran. Flavonoid dibagi menjadi 7 tipe yaitu flavon, flavonol, flavonon, khalkon, xanton, isoflavon dan biflavon (Bylka and Pilewski, 2004). Contoh golongan senyawa flavonoid dapat dilihat pada Gambar 5.
O O
flavon
O O
flavonol OH
O O
flavanon
O O
flavanonol OH
O O
Isoflavon O
khalkon
Gambar 5. Senyawa-Senyawa Golongan Flavonoid (Achmad, 1986)
kemampuan flavonoid untuk bekerja sebagai antioksidan yang kuat dan penangkap radikal bebas, membentuk khelat dengan logam dan berinteraksi dengan enzim (Bylka, M. and Pilewski, 2004). Flavonoid disintesis oleh tanaman sebagai respon terhadap infeksi mikroba, jadi secara in vitro
flavonoid efektif sebagai substansi antimikroba yang membunuh banyak mikroorganisme. Kemungkinan aktivitasnya dikarenakan kemampuan flavonoid membentuk ikatan dengan protein terlarut (Cowan, 1999). Flavonoid yang diisolasi dari Artemisia, yaitu 6-methoxylapigenin atau
methoxy-6 trihydroxy-5,7,4’ flavone (6MAPI) dan 6-methoxyluteolin atau methoxy-6 tetrahydroxy-5,7,3’,4’ flavone (6MLU) dapat berinteraksi dengan enzim dihydrofolate reductase (DHFR) pada E. coli. Enzim DHFR
berperan dalam mensintesis basa nitrogen inti sel bakteri. Hal ini menyebabkan inti sel bakteri tidak terbentuk sehingga bakteri akan mati (Bensegueni et al.).
3. Saponin
Pembentukan busa yang lama pada waktu ekstraksi atau ekstrak tanaman yang pekat menunjukkan adanya saponin (Poither, 2000). Saponin mempunyai bagian utama berupa turunan triterpen dengan sedikit steroid. Residu gula dihubungkan oleh satu gugus –OH biasanya C3-OH dari aglikon
(monodesmoside saponin) dan jarang dengan dua gugus OH atau satu gugus
OH dan gugus karboksil (bis-desmiside saponin) (Wagner, 1984). Contoh
senyawa steroid sapogenin dapat dilihat pada Gambar 6.
O O
CH2OH
HO
Nautigenin
Gambar 6. Senyawa Steroid-Sapogenin (Wagner, 1984) 4. Terpenoid
Terpenoid adalah senyawa yang mengandung karbon dan hidrogen, atau karbon, hidrogen dan oksigen yang tidak bersifat aromatis. Terpenoid merupakan senyawa-senyawa yang mudah menguap terdiri 10 atom C dan penyusun minyak atsiri (Achmad, 1986). Terpenoid dengan titik didih yang lebih tinggi disusun oleh diterpen (C20), triterpen (C30), dan tetraterpen (C40)
dengan penambahan atom oksigen (Achmad, 1986; Cowan, 1999). Mekanisme dari terpenoid sebagai antibakteri tidak begitu jelas kemungkinan berhubungan dengan perusakan membran sel oleh senyawa lipofilik (Cowan, 1999). Senyawa terpenoid yang terdapat pada cabai, Capsaicin mempunyai banyak aktivitas biologi pada manusia yaitu bekerja pada saraf, kardiovaskuler, saluran pencernakan dan digunakan sebagai analgesik. Capsaisin menghambat pertumbuhan beberapa bakteri yang tidak diinginkan (Cowan, 1999).
Terpenoid dari Elephantopus scaber menunjukkan penghambatan
terhadap pertumbuhan bakteri S. aureus dengan menghambat enzim
(Daisy et al., 2008). Contoh senyawa terpenoid yang mempunyai aktivitas
antibakteri dapat dilihat pada Gambar 7.
H3CO
6-[1-(10,13-dymethyl-4, 5, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 dodecahydro-1H-cyclopenta [alpha] phenan thren-17-yl) ethyl]-3-methyl-3,6-dihidro-2H-2-pyranone. dari tanaman
Elephantopus scaber
Gambar 7. Senyawa-Senyawa Terpenoid yang Bersifat Antibakteri (Cowan, 1999 and Daisy et al., 2008)
5. Alkaloid
Alkaloid dari tanaman kebanyakan amina tersier dan yang lainnya terdiri dari nitrogen primer, sekunder, dan quarterner (Poither, 2000). Semua alkaloid mengandung paling sedikit satu atom nitrogen yang biasanya bersifat basa dan sebagian besar atom nitrogen ini merupakan cincin aromatis (Achmad, 1986).
Berdasarkan penyusun asam aminonya alkaloid dibedakan menjadi alkaloid asiklis yang berasal dari asam amino ornitin dan lisin. Alkaloid aromatis jenis fenilalanin berasal dari fenilalanin, tirosin dan 3,4-dihidroksifenilalanin. Alkalod jenis indol yang berasal dari triptofan (Achmad., 1986). Contoh senyawa alkaloid berdasarkan penyusun asam aminonya dapat dilihat pada Gambar 8.
N O
CH3
N H3CO
H3CO
OCH3
CH3
CH3
N H
N OPO3H2
CH3
CH3
Alkaloid Alisiklis
Higrin
Alkaloid fenilalanin
Mezkalin Alkaloid Indol
Philosobin
Gambar 8. Golongan Senyawa Alkaloid Berdasarkan Penyusun Asam Aminonya (Achmad, 1986)
N+
O O
H3CO
OCH3
H N
N CH3
Barberine
harmane
Gambar 9. Senyawa-Senyawa Alkaloid yang Bersifat Antibakteri (Cowan, 1999)
6. Senyawa fenolat
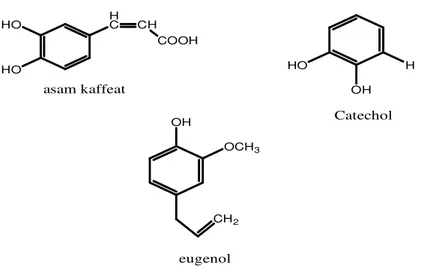
Senyawa tumbuhan yang aktif terdiri dari sebuah cincin fenol tersubstitusi. Asam sinnamat dan asam kaffeat biasanya mewakili kelompok besar dari turunan senyawa fenilpropan yang mempunyai tingkat oksidasi tinggi. Tumbuhan Terragon dan Thyme keduanya mengandung asam kaffeat yang efektif membunuh virus, bakteri dan jamur (Cowan, 1999).
Tingkatan dan banyaknya gugus fungsi hidroksil pada golongan fenol berhubungan dengan toksisitas pada mikroorganisme dengan bukti bahwa bertambahnya hidroksilasi menghasilkan penambahan toksisitas (Cowan, 1999). Semakin tinggi fenol teroksidasi semakin kuat menghambat pertumbuhan organisme. Mekanisme yang berhubungan dengan toksisitas fenol terhadap mikroorganisme adalah penghambatan enzim oleh senyawa teroksidasi kemungkinan lewat reaksi dengan gugus sulfihidril atau dengan interaksi yang tidak spesifik oleh protein (Cowan, 1999). Contoh senyawa fenol dapat dilihat pada Gambar 10.
Senyawa fenol dapat menyebabkan denaturasi protein melalui proses adsorpsi yang melibatkan ikatan hidrogen. Pada kadar rendah, terbentuk kompleks protein-fenol dengan ikatan lemah dan segera mengalami peruraian, diikuti penetrasi fenol ke dalam sel dan menyebabkan presipitasi serta denaturasi protein. Pada kadar tinggi, fenol menyebabkan koagulasi protein dan sel membran mengalami lisis, mengubah permeabilitas membran bakteri (Soekardjo dan Siswandono, 2000).
HO HO
HO
OH H H
C CH COOH
OH
OCH3
CH2 asam kaffeat
Catechol
eugenol
Gambar 10. Senyawa-Senyawa Golongan Fenol (Cowan, 1999) 6. Metode Pengujian Aktivitas Antibakteri
dari hasil fermentasi, sintetik dan dapat diperoleh dari hasil isolasi dari tanaman (Kristanti dkk., 2008).
Pengujian aktivitas antibakteri suatu zat antibakteri yang biasanya dilakukan dengan metode sebagai berikut :
a. Metode Penyebaran (Diffusion Method)
1. Metode silinder atau cairan dalam cincin (ring diffusion method)
Penelitian Sabir (2005) menggunakan metode silinder dengan proses sebagai berikut, medium agar dimasukkan ke dalam cawan petri steril dan dibuat menjadi 2 lapisan dengan ketebalan yang hampir sama (± 0,5 cm). Lapisan pertama dibiarkan memadat, setelah itu dibuat lapisan kedua yang telah dicampurkan dengan biakan bakteri sebanyak 1 ml dan dimasukkan dalam cawan petri. Sebelum lapisan kedua memadat, ditempatkan silinder
stainless steel (diameter luar 8 mm dan diameter dalam 6 mm) pada cawan
petri. Pada silinder tersebut kemudian diisi dengan larutan sampel. Pengukuran diameter dari setiap zone inhibisi pertumbuhan bakteri setelah
masa inkubasi 24 jam. Zone inhibisi adalah jarak terdekat (mm) dari tepi
luar selinder hingga mulai terjadinya pertumbuhan bakteri. 2. Metode lubang (well diffusion method)
Penelitian Yuliani (2001); Pambayun dkk. (2007); Yuharmen dkk. (2002) mengunakkan metode lubang dengan cara kerja sebagai berikut : Bakteri uji yang umurnya 18-24 jam disuspensikan ke dalam media agar pada suhu sekitar 45°C. Media agar yang telah tersuspensi bakteri dituangkan ke dalam cawan petri steril. Setelah agar memadat, dibuat lubang-lubang dengan diameter 6-8 mm. Lubang tersebut dimasukkan larutan zat yang diuji aktivitasnya, kemudian diinkubasi pada suhu 37°C selama 18-24 jam. Aktivitas antibakteri dapat dilihat dari daerah bening yang mengelilingi lubang.
3. Metode cakram kertas (disk diffusion method)
permukaan agar padat yang telah diolesi bakteri, diinkubasi selama 18-24 jam pada suhu 37°C. Aktivitas antibakteri dapat dilihat dari diameter hambat disekeliling cakram kertas. Metode cakram kertas telah dilakukan dalam penelitian Ayo and Amupitan (2004); El-Rahiem et al. (2005).
b. Metode Pengenceran (Dilution Method)
1. Metode pengenceran tabung (tube dilution method)
Antibakteri disuspensikan dalam agar kemudian dilakukan pengenceran dengan menggunakan beberapa tabung reaksi. Selanjutnya dilakukan inokulasi bakteri uji, setelah diinkubasi pada suhu 37°C selama 18-29 jam. Tabung yang keruh menunjukkan adanya pertumbuhan bakteri, sedangkan tabung yang jernih menunjukkan zat antibakteri yang bekerja. Metode pengenceran tabung telah dilakukan pada penelitian Shanab et al. (2006).
2. Metode pengenceran agar (agar dilution method)
Zat antibakteri dicampur sampai homogen pada agar steril yang masih cair dengan suhu serendah mungkin (± 45°C) dengan menggunakan berbagai konsentrasi zat aktif. Larutan tersebut dituangkan kedalam cawan petri steril, kemudian setelah memadat dioleskan bakteri uji pada permukaannya. Penentuan penghambatan dilihat dengan tidak adanya bakteri yang tumbuh pada permukaan (Collins, 1976 dalam Yuliani, 2001).
7. Ekstraksi Maserasi dan Ekstraksi Cair-Cair Bertahap
pelarut polar yang mudah menguap seperti metanol dan etanol. Penelitian Pambayun dkk. (2007) menunjukkan bahwa dalam mengekstrak Gambir (Uncaria gambir Roxb) hasil menunjukkan makin polar pelarut, berat bahan
terekstrak yang dihasilkan tidak berbeda antara ekstraksi menggunakan cara maserasi dengan shoxletasi.
Setelah diperoleh larutan hasil ekstraksi, untuk memperoleh ekstrak biasanya dilakukan pengupan dengan penguap vakum putar. Ekstraksi dapat dilanjutkan dengan ekstraksi cair-cair menggunakan pelarut yang semakin meningkat kepolarannya seperti heksana, kloroform, etil asetat dan butanol untuk memisahkan senyawa yang terdapat pada ekstrak kasar berdasarkan perbedaan kepolarannya dan larutan hasil ekstraksi diuapkan lagi untuk mendapatkan ekstrak hasil ekstraksi bertahap. Metode pemisahan senyawa dari ekstrak kasar melalui ekstraksi bertahap telah dilakukan pada penelitian Swantara (2005); Yuliani (2001); Ćetković et al. (2007).
8. Penapisan Fitokimia
Fitokimia atau kimia tumbuhan merupakan disiplin ilmu mempelajari aneka ragam senyawa organik pada tumbuhan, yaitu mengenai struktur kimia, biosintesis, metabolisme, penyebaran secara ilmiah dan fungsi biologinya. Pendekatan secara penapisan fitokimia meliputi analisis kualitatif kandungan kimia dalam tumbuhan atau bagian tumbuhan (akar, batang, daun, bunga, buah dan biji) terutama kandungan metabolit sekunder yang bioaktif seperti alkaloid, antrakinon, flavonoid, glikosida jantung, kumarin, saponin (steroid dan triterpenoid), tanin, polifenol dan minyak atsiri. Adapun tujuan utama dari penapisan fitokimia adalah menganalisis tumbuhan untuk mengetahui kandungan bioaktif atau kandungan yang berguna untuk pengobatan (Pedrosa, et al., 1978).
Uji penapisan fitokimia biasanya menggunakan reagen-reagen pendeteksi antara lain untuk mengetahui senyawa alkaloid menggunakan reagen Wagner, tanin menggunakan larutan gelatin dan FeCl3, flavonoid dengan penambahan HCl,
saponin dengan penambahan air dan terpenoid menggunakan vanillin-H2SO4.
Hasil positif uji alkaloid pada uji Wagner ditandai dengan terbentuknya endapan. Endapan tersebut diperkirakan adalah kalium-alkaloid. Pada pembuatan pereaksi Wagner, iodine bereaksi dengan I- dari kalium iodida menghasilkan ion I3- yang berwarna coklat. Pada uji Wagner, ion logam K+ akan membentuk ikatan
kovalen koordinat dengan nitrogen pada alkaloid membentuk kompleks kalium-alkaloid yang mengendap (Marliana dkk., 2005). Perkiraan reaksi yang terjadi pada uji Wagner ditunjukkan pada Gambar 11.
I2 + I- I3
-coklat
N
KI I2
+ +
N K
+ I3
-Kalium - Alkaloid endapan
Perkiraan reaksi uji wagner quinoline
Gambar 11. Perkiraan Reaksi Uji Wagner (Marliana dkk., 2005)
Perubahan warna yang terjadi pada penambahan FeCl3 karena
terbentuknya kompleks Fe3+-tanin dan Fe3+-polifenol. Atom oksigen pada tanin dan polifenol mempunyai pasangan elektron yang mampu mendonorkan elektronnya pada Fe3+ yang mempunyai orbital d kosong membentuk ikatan kovalen koordinat sehingga menjadi suatu kompleks (Syarifuddin, 1994). Perkiraan reaksi uji tanin dengan FeCl3 dapat dilihat pada Gambar 12.
Uji saponin timbulnya busa menunjukkan adanya glikosida yang mempunyai kemampuan membentuk buih dalam air. Senyawa glikosida terhidrolisis menjadi glukosa dan aglikon (Rusdi, 1990 dalam Marliana dkk., 2005). Perkiraan reaksi yang terjadi pada uji saponin ditunjukkan pada
Gambar 12. Perkiraan Reaksi Uji Tanin dengan FeCl3 (Syarifuddin, 1994)
O
Gambar 13. Reaksi Uji Flavonoid (Achmad, 1986)
Uji terpenoid menggunakan reagen vanillin-H2SO4 menghasilkan warna
CO
Arabinopiriosil-3β-asetil oleanolat Aglikon
glukosa +
Gambar 14. Reaksi Hidrolisis Saponin dalam Air (Marliana dkk., 2005)
OH
Gambar 15. Reaksi Uji Terpenoid dengan vanillin – H2SO4
9. Kromatografi Lapis Tipis (KLT)
Kromatografi Lapis Tipis (KLT) merupakan pemisahan komponen kimia berdasarkan prinsip adsorbsi dan partisi, yang ditentukan oleh fase diam (adsorben) dan fase gerak (eluen). Komponen kimia bergerak naik mengikuti fase gerak karena daya serap adsorben terhadap komponen-komponen kimia yang berbeda sehingga komponen kimia dapat bergerak dengan kecepatan yang berbeda berdasarkan tingkat kepolarannya, hal inilah yang menyebabkan terjadinya pemisahan (Rohman, 2007).
Fase diam yang digunakan dalam KLT berupa zat padat silika atau alumina yang mempunyai kemampuan mengabsorbsi bahan-bahan yang akan dipisahkan (sebagai absorben) (Kristanti dkk., 2008). Fase gerak yang dipakai adalah pelarut tunggal atau campuran pelarut dengan perbandingan tertentu. Pemisahan yang bagus dapat dicari dengan mencoba-coba mengelusi dengan berbagai perbandingan campuran pelarut. Penelitian Hayani (2007) menggunakan berbagai perbandingan campuran pelarut untuk memisahkan komponen yang terdapat pada rimpang Temu Kunci dan didapatkan perbandingan campuran pelarut heksana : etil asetat 8,5 : 1,5 memberikan pemisahan yang bagus ditandai banyaknya noda yang dipisahkan.
Pendeteksian senyawa dapat dilakukan dengan pengamatan langsung, dibawah sinar UV dan disemprot dengan reagen spesifik. Reagen spesifik yang dipakai antara lain pada uji flavonoid menggunakan penyemprot AlCl3 1%, uji
fenolat dan tanin menggunakan penyemprot FeCl3 1%, saponin menggunakan
penyemprot SbCl3 20 % dalam kloroform dan uji terpenoid menggunakan
penyemprot vanillin-H2SO4. Uji KLT fenolat dan tanin menggunakan penyemprot
FeCl3 1%. Fenolat dan tanin akan berwarna warna hijau, merah ungu, biru dan
atau hitam (Harborne, 1996). Uji KLT flavonoid menggunakan penyemprot AlCl3
1% berwarna coklat muda pada sinar tampak dan biru pada UV 365 nm (Wagner, 1984). Flavonoid setelah disemprot dengan AlCl3 dapat memberikan warna
O
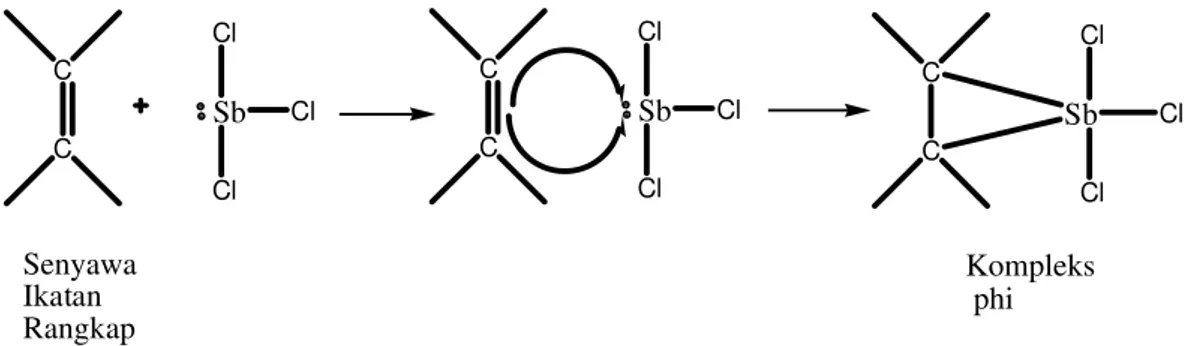
Reagen penyemprot pendeteksi saponin, SbCl3 20% dalam kloroform
akan memberikan noda berwarna merah violet dibawah sinar tampak dan merah violet, biru dan hijau berflourensi dibawah sinar UV 365 nm (Wagner, 1984). SbCl3 membentuk kompleks-π yang berwarna dengan ikatan rangkap dua (Jork et al., 1990). Reaksi uji KLT saponin dapat dilihat pada Gambar 17.
C
Gambar 17. Reaksi Uji saponin dengan SbCl3 (Jork et al., 1990)
10. Konsentrasi Hambat Minimum (KHM), Konsentrasi Bakterisidal Minimum (KBM) dan Uji Banding
Konsentrasi hambat minimum (KHM) adalah konsentrasi terkecil (pengenceran terbesar) suatu obat yang masih menghambat pertumbuhan bakteri. KHM sangat penting untuk menentukan dosis efektif terkecil dari obat dan memberikan indek perbandingan dengan obat yang lain (Talaro, 2008). Konsentrasi Bakterisidal Minimum (KBM) adalah konsentrasi terkecil suatu obat dimana obat masih dapat membunuh bakteri. Penelitian Shanab et al. (2006)
suspensi dengan menggunakan ose dari tabung-tabung yang digunakan untuk menentukan nilai KHM dan menyebarkannya pada cawan agar yang bebas dari zat antibakteri lalu diinkubasi selama 24 jam pada suhu 37°C. Konsentrasi terendah yang tidak menunjukkan pertumbuhan bakteri adalah nilai KBM.
Uji banding suatu sampel (zat antibakteri) bertujuan untuk mengetahui sejauh mana kekuatan atau daya aktivitas antibakteri sampel tersebut bila dibandingkan terhadap suatu zat pembanding. Metode yang digunakan adalah dengan cara membandingkan respon yang dihasilkan oleh zat antibakteri yang diperiksa terhadap respon suatu zat antibakteri pembanding. Respon tersebut berupa hambatan terhadap pertumbuhan bakteri uji (Yuliani, 2001). Uji banding suatu sampel dapat dilakukan dengan cara membuat suatu grafik atau kurva standart dari zat pembanding, dimana logaritma konsentrasi diplotkan terhadap sumbu-x dan diameter hambatan diplotkan terhadap sumbu-y. Berdasarkan kurva tersebut dapat diperoleh konsentrasi sampel pada diameter hambatan yang dihasilkan dan nilai diameter hambatan sampel pada konsentrasi yang ditetapkan, sehingga dapat ditetapkan nilai uji banding sampel terhadap zat pembanding, yaitu dengan menggunakan rumus sebagai berikut.
% 100
x sebenarnya sampel
i Konsentras
kurva dari sampel i
Konsentras banding
uji
Nilai =
(Yuliani, 2001)
B. Kerangka Pemikiran
sebagai tanaman obat antibakteri belum dilakukan penelitian secara ilmiah aktivitas antibakterinya, oleh karena itu perlu dilakukan penelitian secara ilmiah aktivitas antibakteri ekstrak buah gambas.
Senyawa-senyawa antibakteri yang terdapat pada buah gambas dapat diisolasi dengan ekstraksi maserasi menggunakan pelarut metanol. Ekstraksi bertahap terhadap ekstrak metanol berturut-turut dengan pelarut heksana, kloroform, etil asetat dan butanol merupakan ekstraksi pemisahan senyawa-senyawa yang terdapat pada buah gambas berdasarkan perbedaan kepolaran. Metode pengujian aktivitas antibakteri difusi lubang dapat digunakan untuk mengetahui aktivitas antibakteri ekstrak buah gambas dengan menghitung panjang diameter hambat yang terbentuk disekitar lubang, oleh karena itu perlu pengujian aktivtas antibakteri ekstrak buah gambas untuk mengetahui aktivitas antibakteri buah gambas.
Ekstraksi bertahap dengan kepolaran pelarut yang meningkat akan memisahkan golongan senyawa/senyawa yang terdapat pada ekstrak metanol berdasarkan perbedaan kepolaran antara lain golongan senyawa flavonoid, alkaloid, terpenoid dan atau saponin. Pengujian golongan senyawa dengan metode penapisan fitokimia dan kromatografi lapis tipis (KLT) dapat digunakan untuk mengetahui adanya golongan senyawa yang terdapat pada masing-masing ekstrak.
Ekstraksi bertahap menyebabkan senyawa-senyawa yang terdapat pada ekstrak metanol terpisah ke dalam masing-masing ekstrak hasil ekstraksi bertahap yang mempengaruhi aktivitas antibakteri masing-masing ekstrak. Golongan senyawa/senyawa yang terkandung dalam ekstrak-ekstrak buah gambas berbeda-beda dengan kadar yang berberbeda-beda pula, sehingga panjang diameter hambat yang terbentuk berbeda-beda. Penentuan aktivitas antibakteri ekstrak aktif antibakteri tertinggi buah gambas dapat dilakukan dengan membandingkan panjang diameter hambat yang terbentuk.
pertumbuhan bakteri oleh senyawa-senyawa yang terkandung dalam ekstrak belum diketahui dengan pasti. Ampisilin merupakan senyawa tunggal dan antibakteri yang berspektrum luas. Mekanisme penghambatan pertumbuhan bakteri oleh ampisilin sudah diketahui yaitu dengan menghambat enzim transpeptidase yang terdapat pada peptidoglikan dinding sel bakteri, sehingga aktivitas antibakteri ekstrak aktif antibakteri tertinggi lebih lemah jika dibandingkan dengan ampisilin. Aktivitas antibakteri ekstrak aktif antibakteri tertinggi jika dibandingkan dengan ampisilin dapat diketahui dengan mencari dan membandingkan konsentrasi hambat minimum (KHM) dan nilai banding ekstrak terhadap ampisilin.
C. Hipotesis
Berdasarkan kerangka pemikiran dapat diajukan hipotesis sebagai berikut :
1. Ekstrak metanol mempunyai aktivitas antibakteri
2. Ekstrak hasil ekstraksi bertahap ekstrak metanol yaitu ekstrak heksana, kloroform, etil asetat dan butanol mempunyai aktivitas antibakteri.
3. Golongan senyawa flavonoid, alkaloid, terpenoid dan atau saponin terdapat pada ekstrak aktif antibakteri buah gambas.