UJI PENDAHULUAN SIMPLISIA DAN UJI AKTIVITAS
ANTIBAKTERI EKSTRAK ETANOL KULIT BUAH
TANAMAN JENGKOL (Pithecellobium lobatum Benth.)
TERHADAP BAKTERI Staphylococcus aureus,
Staphylococcus epidermidis, DAN
Propionibacter acne
SKRIPSI
OLEH :
WILSON WITARSA
NIM 060804045
FAKULTAS FARMASI
UJI PENDAHULUAN SIMPLISIA DAN UJI AKTIVITAS
ANTIBAKTERI EKSTRAK ETANOL KULIT BUAH
TANAMAN JENGKOL (Pithecellobium lobatum Benth.)
TERHADAP BAKTERI Staphylococcus aureus,
Staphylococcus epidermidis, DAN
Propionibacter acne
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh
gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH :
WILSON WITARSA
NIM 060804045
FAKULTAS FARMASI
PENGESAHAN SKRIPSI
UJI PENDAHULUAN SIMPLISIA DAN UJI AKTIVITAS
ANTIBAKTERI EKSTRAK ETANOL KULIT BUAH
TANAMAN JENGKOL (Pithecellobium lobatum Benth.)
TERHADAP BAKTERI Staphylococcus aureus,
Staphylococcus epidermidis, DAN
Propionibacter acne
OLEH:
WILSON WITARSA
NIM 060804045
Dipertahankan di hadapan Panitia Penguji Fakultas Farmasi
Universitas Sumatera Utara Pada tanggal : Mei 2011
Pembimbing I, Panitia Penguji,
Dr. M Pandapotan Nasution MPS., Apt. Dr. Marline Nainggolan, M.S., Apt. NIP 194908111976031001 NIP 195709091985112001
Dr. M Pandapotan Nasution MPS., Apt.
Pembimbing II, NIP 194908111976031001
Drs. Awaluddin Saragih, M.Si., Apt. Drs. Suryadi Achmad, M.Sc., Apt. NIP 195008221974121002 NIP 195109081985031002
Dra. Herawaty Ginting, M.Si., Apt. NIP 195112231980032002
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Kuasa yang telah
melimpahkan rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan
skripsi yang berjudul ” Karakterisasi dan Skrining Fitokimia serta Uji Aktivitas
Antibakteri Ekstrak Etanol Kulit Buah Tanaman Jengkol (Pithecellobium lobatum
Benth.) Terhadap Beberapa Bakteri”. Skripsi ini diajukan sebagai salah satu syarat
untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas
Sumatera Utara.
Pada kesempatan ini penulis ingin mempersembahkan skripsi ini sebagai
rasa terima kasih kepada Ayah dan Ibu tercinta, Oei Bun Tjeng dan Enny serta
Kakak, Fenny Widola atas doa, dorongan dan pengorbanan baik moril maupun
material selama menempuh pendidikan Strata I Farmasi.
Pada kesempatan ini penulis menyampaikan terima kasih yang sebesar –
besarnya kepada Bapak Dr. M. Pandapotan Nasution, MPS., Apt., dan Bapak Drs.
Awaluddin Saragih, M.Si., Apt., yang telah membimbing dengan penuh kesabaran,
tulus, dan ikhlas selama penelitian dan penulisan skripsi ini berlangsung.
Pada kesempatan ini penulis juga menyampaikan ucapan terima kasih
kepada :
1. Dekan Fakultas Farmasi Universitas Sumatera Utara, Prof. Dr. Sumadio
Hadisahputra, Apt., yang telah memberikan bantuan dan fasilitas selama
masa pendidikan.
2. Bapak Prof. Dr. Erman Munir, M.Sc., selaku Kepala Laboratorium
Mikrobiologi Fakultas MIPA USU, Bapak Drs. Awaluddin Saragih, M.Si.,
Apt. selaku Kepala Laboratorium Obat Tradisional Fakultas Farmasi USU
yang telah memberikan fasilitas dan bantuan selama penelitian.
3. Ibu Dr. Marline Nainggolan, M.S., Apt., Bapak Drs. Suryadi Achmad,
M.Si., Apt., dan Ibu Drs. Herawaty Ginting, M.Si., Apt. selaku dosen
penguji serta Ibu Drs. Salbiah, M.Si., Apt. sebagai dosen penasehat
akademik yang telah memberikan saran dan kritikan kepada penulis hingga
4. Sahabat – sahabat penulis : Haki Sukta, Handi Hendra, Yanti Yunita, Steffi,
Hendra Agustian, Jenny, dan rekan – rekan mahasiswa Farmasi Stambuk
2006 atas bantuan, dukungan, serta semangat selama masa perkuliahan
sampai penyusunan skripsi ini.
5. Seluruh Staf Pengajar, Pegawai Tata Usaha, abang – abang, kakak – kakak
serta adik – adik yang telah membantu selama penelitian.
Penulis menyadari bahwa tulisan ini masih memiliki banyak kekurangan,
oleh karena itu dengan segala kerendahan hati penulis bersedia menerima kritikan
dan saran yang membangun pada skripsi ini. Semoga skripsi ini bermanfaat bagi
kita semua.
Medan, Mei 2011
Penulis,
UJI PENDAHULUAN SIMPLISIA DAN UJI AKTIVITAS
ANTIBAKTERI EKSTRAK ETANOL KULIT BUAH
TANAMAN JENGKOL (Pithecellobium lobatum Benth.)
TERHADAP BAKTERI Staphylococcus aureus,
Staphylococcus epidermidis, DAN
Propionibacter acne
ABSTRAK
Tanaman Jengkol (Pithecellobium lobatum Benth.) suku Mimosaceae merupakan salah satu tanaman yang memiliki berbagai manfaat misalnya secara tradisional kulit buah jengkol digunakan sebagai obat kumur, pencegah karies, infeksi pada kulit, dan infeksi saluran perncernaan. Kulit buah jengkol merupakan limbah organik yang tidak mempunyai nilai ekonomis, oleh karena itu perlu dilakukan penelitian mengenai pemanfaatan kulit buah jengkol tersebut, sehingga lebih berhasil guna.
Penelitian ini mencakup karakterisasi simplisia, pemeriksaan golongan senyawa kimia pada simplisia dan ekstrak kulit buah jengkol serta menguji aktivitas antibakteri ekstrak kulit buah jengkol terhadap bakteri penyebab infeksi kulit yaitu Staphylococcus aureus, Staphylococcus epidermidis, dan Propionibacter acne.
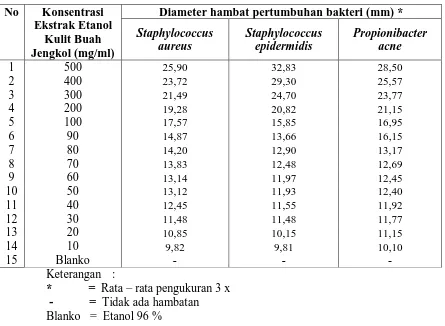
Karakterisasi simplisia kulit buah jengkol memberikan hasil kadar air 6,00%, kadar abu total 2,79%, kadar abu tidak larut asam 0,26%, kadar sari larut dalam air 13,45%, dan kadar sari larut dalam etanol 10,64%. Pemeriksaan skrinning fitokimia dari simplisia dan ekstrak kulit buah jengkol ini menunjukkan adanya senyawa golongan alkaloida, flavonoida, tanin, glikosida, saponin, dan steroida/triterpenoida. Hasil uji aktivitas antibakteri dari ekstrak kulit buah jengkol dengan menggunakan metode difusi agar menunjukkan ekstrak kulit buah jengkol mempunyai aktivitas antibakteri dengan daya hambat yang efektif terhadap Staphylococcus aureus pada konsentrasi 80 mg/ml dengan diameter hambat sebesar 14,20 mm, daya hambat efektif terhadap Staphylococcus epidermidis pada konsentrasi 100 mg/ml dengan diameter hambat sebesar 15,85 mg/ml, dan daya hambat yang efektif terhadap Propionibacter acne pada konsentrasi 90 mg/ml dengan diameter hambat sebesar 16,15 mm.
SIMPLEX PRE-ELIMINARY TEST AND ANTIBACTERIAL
ACTIVITY TEST FROM ETHANOLIC EXTRACT OF
JENGKOL PLANT PERICARP (Pithecellobium lobatum Benth.)
AGAINS Staphylococcus aureus, Staphylococcus epidermidis,
AND Propionibacter acne
ABSTRACT
Jengkol (Pithecellobium lobatum Benth.) of the family Mimosaceae is one of the plants that had many uses such as the jengkol pericarp traditionally used as mouthwasher, dental caries preventing agent, skin infection, and gastrointestinal tract infections. Moreover, jengkol pericarp is an organic waste that does not have economic value, that is why a research is needed to investigate more about the uses of jengkol pericarp, in order to achieve a greater benefits.
The research conducted included simplex characterization, phytochemical screening of chemical compounds that present in simplex and extract of jengkol pericarp, also to determine antibacterial activity against skin infection bacteria, i.e. Staphylococcus aureus, Staphylococcus epidermidis, and Propionibacter acne.
The characterization results of jengkol pericarp simplex gave water content 6.00%, total ash value 2.79%, acid insoluble ash value 0.26%, water soluble extract value 13.45%, and ethanol soluble extract 10.64%. The phytochemical screening of both jengkol pericarp simplex and extract of jengkol pericarp shows the presence of alkaloid, flavonoid, tannin, glycoside, saponin, and steroid/triterpenoid compounds. The antibacterial activity test using agar diffusion method of jengkol pericarp extract showed that it has an antibacterial activity with effective inhibitory concentration against Staphylococcus aureus growth was 80 mg/ml with a diameter of inhibition zone about 14.20 mm, the effective inhibitory concentration against Staphylococcus epidermidis growth was 100 mg/ml with a diameter of inhibition zone about 15.85 mg/ml, and the effective inhibitory concentration against Propionibacter acne growth was 90 mg/ml with a diameter of inhibition zone about 16.15 mm.
DAFTAR ISI
Halaman
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1Latar Belakang ... 1
1.2Perumusan Masalah ... 3
1.3Hipotesis ... 3
1.4Tujuan Penelitian ... 4
1.5Manfaat Penelitian ... 4
1.6Kerangka Pikir Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Uraian Tanaman ... 6
2.1.1 Sistematikan Tanaman Jengkol ... 6
2.1.2 Nama Daerah ... 6
2.1.3 Habitat dan Morfologi Tanaman Jengkol... 6
2.1.4 Kandungan Kimia dan Khasiat Tanaman... 7
2.2 Ekstraksi ... 8
2.3 Uraian Kandungan Kimia Tanaman ... 10
2.3.2 Flavonoid ... 11
2.3.3 Tanin ... 12
2.3.4 Saponin ... 13
2.3.5 Glikosida ... 14
2.3.6 Triterpenoid dan Steroid... 15
2.4 Uraian Bakteri ... 16
2.4.1 Perkembangbiakan Bakteri ... 17
2.4.2 Media Pertumbuhan Bakteri ... 19
2.4.3 Bakteri Staphylococcus aureus ... 20
2.4.3.1 Sistematika Bakteri Staphylococcus aureus ... 20
2.4.3.2 Uraian Bakteri Staphylococcus aureus ... 21
2.4.4 Bakteri Staphylococcus epidermidis ... 21
2.4.4.1 Sistematika Bakteri Staphylococcus epidermidis ... 21
2.4.4.2 Uraian Bakteri Staphylococcus epidermidis ... 22
2.4.5 Bakteri Propionibacter acne ... 23
2.4.5.1 Sistematika Bakteri Propionibacter acne... 23
2.4.5.2 Uraian Bakteri Propionibacter acne ... 23
2.4.6 Uji Aktivitas Antibakteri ... 24
BAB III METODOLOGI PENELITIAN... 26
3.1 Alat dan Bahan ... 26
3.1.1 Alat - Alat ... 26
3.1.2 Bahan - Bahan ... 26
3.2.2 Larutan Pereaksi Dragendorff ... 27
3.2.3 Larutan Pereaksi Bourchardat ... 27
3.2.4 Larutan Pereaksi Molish... 28
3.2.5 Larutan Pereaksi Besi (III) Klorida 1% ... 28
3.2.6 Larutan Pereaksi Timbal (II) Asetat ... 28
3.2.7 Larutan Pereaksi Natrium Hidroksida 2N ... 28
3.2.8 Larutan Pereaksi Asam Klorida 2N ... 28
3.2.9 Larutan Pereaksi Kloralhidrat ... 28
3.2.10 Larutan Etanol 70% ... 28
3.3 Pengambilan dan Pengolahan Bahan Tanaman ... 28
3.3.1 Pengambilan Bahan Tanaman ... 28
3.3.2 Identifikasi Tanaman... 29
3.3.3 Pengolahan Bahan Tanaman ... 29
3.4 Pemeriksaan Karakterisasi Simplisia... 29
3.4.1 Pemeriksaan Makroskopik ... 29
3.4.2 Pemeriksaan Mikroskopik ... 30
3.4.3 Pemeriksaan Kadar Air ... 30
3.4.4 Pemeriksaan Kadar Abu Total ... 31
3.4.5 Pemeriksaan Kadar Abu Tidak Larut Asam ... 31
3.4.6 Pemeriksaan Kadar Sari Larut Dalam Air ... 31
3.4.7 Pemeriksaan Kadar Sari Larut Dalam Etanol ... 32
3.5 Skrining Fitokimia ... 32
3.5.1 Pemeriksaan Alkaloida... 32
3.5.3 Pemeriksaan Tanin ... 33
3.5.4 Pemeriksaan Saponin ... 33
3.5.5 Pemeriksaan Glikosida ... 34
3.5.5.1 Pemeriksaan Glikosida Antrakinon ... 34
3.5.5.2 Pemeriksaan Glikosida Sianogenik ... 35
3.5.6 Pemeriksaan Steroida/Triterpenoida ... 35
3.6 Pembuatan Ekstrak Etanol Kulit Buah Jengkol ... 35
3.7 Uji Aktivitas Antibakteri Ekstrak Kulit Buah Jengkol ... 36
3.7.1 Sterilisasi Alat ... 36
3.7.2 Pembuatan Media ... 36
3.7.2.1 Nutrien Agar (NA) ... 36
3.7.2.2 Larutan Natrium Klorida 0,9 % ... 37
3.7.3 Pembuatan Suspensi Standar Mc. Farland ... 37
3.7.4 Pembuatan Stok Kultur ... 37
3.7.4.1 Bakteri Staphylococcus aureus ATCC 29737 ... 37
3.7.4.2 Bakteri Staphylococcus epidermidis ATCC 12228 ... 37
3.7.4.3 Bakteri Propionibacter acne ATCC 6919 ... 38
3.7.5 Penyiapan Inokulum ... 38
3.7.5.1 Bakteri Staphylococcus aureus ATCC 29737 ... 38
3.7.5.2 Bakteri Staphylococcus epidermidis ATCC 12228 ... 38
3.7.5.3 Bakteri Propionibacter acne ATCC 6919 ... 38
3.8 Pembuatan Larutan Uji Ekstrak Kulit Buah Jengkol dengan Berbagai Konsentrasi ... 39
BAB IV HASIL DAN PEMBAHASAN ... 41
4.1 Hasil Identifikasi Tanaman ... 41
4.2 Hasil Pemeriksaaan Karakterisasi ... 41
4.2.1 Hasil Pemeriksaan Makroskopik dan Mikroskopik ... 41
4.2.2 Hasil Pemeriksaan Karakterisasi Simplisia ... 42
4.3 Hasil Skrining Fitokimia ... 42
4.4 Hasil Pembuatan Ekstrak Etanol Kulit Buah Tanaman Jengkol . 43 BAB V KESIMPULAN DAN SARAN... 47
5.1 Kesimpulan ... 47
5.2 Saran ... 47
DAFTAR PUSTAKA ... 48
DAFTAR TABEL
Tabel Halaman
4.1Hasil Pemeriksaan Karakterisasi Simplisia Kulit Buah Tanaman Jengkol... 42
4.2 Hasil Skrining Fitokimia Dari Kulit Buah Jengkol ... 42
DAFTAR LAMPIRAN
Lampiran Halaman
1. Hasil Identifikasi Tanaman Jengkol ... 51
2. Karakteristik Tanaman Jengkol... 52
3. Mikroskopik Penampang Melintang dan Simplisia Kulit Buah Jengkol (Pithecellobium lobatum Benth.)………. 54
4. Perhitungan Hasil Pemeriksaan Karakteristik Simplisia ... 55
5. Bagan Penelitian ... 60
6. Bagan Pengolahan Bahan Tanaman ... 61
7. Bagan Pembuatan Ekstrak Etanol Simplisia Kulit Buah Jengkol . 62
8. Bagan Uji Aktivitas Antibakteri Ekstrak Etanol Kulit Buah Jengkol ... 63
9. Hasil Uji Aktivitas Antibakteri Ekstrak Etanol Kulit Buah Jengkol ... 64
10. Zona Hambat Ekstrak Etanol Kulit Buah Jengkol terhadap Bakteri Staphylococcus aureus ... 65
11. Zona Hambat Ekstrak Etanol Kulit Buah Jengkol terhadap Bakteri Staphylococcus epidermidis ... 66
UJI PENDAHULUAN SIMPLISIA DAN UJI AKTIVITAS
ANTIBAKTERI EKSTRAK ETANOL KULIT BUAH
TANAMAN JENGKOL (Pithecellobium lobatum Benth.)
TERHADAP BAKTERI Staphylococcus aureus,
Staphylococcus epidermidis, DAN
Propionibacter acne
ABSTRAK
Tanaman Jengkol (Pithecellobium lobatum Benth.) suku Mimosaceae merupakan salah satu tanaman yang memiliki berbagai manfaat misalnya secara tradisional kulit buah jengkol digunakan sebagai obat kumur, pencegah karies, infeksi pada kulit, dan infeksi saluran perncernaan. Kulit buah jengkol merupakan limbah organik yang tidak mempunyai nilai ekonomis, oleh karena itu perlu dilakukan penelitian mengenai pemanfaatan kulit buah jengkol tersebut, sehingga lebih berhasil guna.
Penelitian ini mencakup karakterisasi simplisia, pemeriksaan golongan senyawa kimia pada simplisia dan ekstrak kulit buah jengkol serta menguji aktivitas antibakteri ekstrak kulit buah jengkol terhadap bakteri penyebab infeksi kulit yaitu Staphylococcus aureus, Staphylococcus epidermidis, dan Propionibacter acne.
Karakterisasi simplisia kulit buah jengkol memberikan hasil kadar air 6,00%, kadar abu total 2,79%, kadar abu tidak larut asam 0,26%, kadar sari larut dalam air 13,45%, dan kadar sari larut dalam etanol 10,64%. Pemeriksaan skrinning fitokimia dari simplisia dan ekstrak kulit buah jengkol ini menunjukkan adanya senyawa golongan alkaloida, flavonoida, tanin, glikosida, saponin, dan steroida/triterpenoida. Hasil uji aktivitas antibakteri dari ekstrak kulit buah jengkol dengan menggunakan metode difusi agar menunjukkan ekstrak kulit buah jengkol mempunyai aktivitas antibakteri dengan daya hambat yang efektif terhadap Staphylococcus aureus pada konsentrasi 80 mg/ml dengan diameter hambat sebesar 14,20 mm, daya hambat efektif terhadap Staphylococcus epidermidis pada konsentrasi 100 mg/ml dengan diameter hambat sebesar 15,85 mg/ml, dan daya hambat yang efektif terhadap Propionibacter acne pada konsentrasi 90 mg/ml dengan diameter hambat sebesar 16,15 mm.
SIMPLEX PRE-ELIMINARY TEST AND ANTIBACTERIAL
ACTIVITY TEST FROM ETHANOLIC EXTRACT OF
JENGKOL PLANT PERICARP (Pithecellobium lobatum Benth.)
AGAINS Staphylococcus aureus, Staphylococcus epidermidis,
AND Propionibacter acne
ABSTRACT
Jengkol (Pithecellobium lobatum Benth.) of the family Mimosaceae is one of the plants that had many uses such as the jengkol pericarp traditionally used as mouthwasher, dental caries preventing agent, skin infection, and gastrointestinal tract infections. Moreover, jengkol pericarp is an organic waste that does not have economic value, that is why a research is needed to investigate more about the uses of jengkol pericarp, in order to achieve a greater benefits.
The research conducted included simplex characterization, phytochemical screening of chemical compounds that present in simplex and extract of jengkol pericarp, also to determine antibacterial activity against skin infection bacteria, i.e. Staphylococcus aureus, Staphylococcus epidermidis, and Propionibacter acne.
The characterization results of jengkol pericarp simplex gave water content 6.00%, total ash value 2.79%, acid insoluble ash value 0.26%, water soluble extract value 13.45%, and ethanol soluble extract 10.64%. The phytochemical screening of both jengkol pericarp simplex and extract of jengkol pericarp shows the presence of alkaloid, flavonoid, tannin, glycoside, saponin, and steroid/triterpenoid compounds. The antibacterial activity test using agar diffusion method of jengkol pericarp extract showed that it has an antibacterial activity with effective inhibitory concentration against Staphylococcus aureus growth was 80 mg/ml with a diameter of inhibition zone about 14.20 mm, the effective inhibitory concentration against Staphylococcus epidermidis growth was 100 mg/ml with a diameter of inhibition zone about 15.85 mg/ml, and the effective inhibitory concentration against Propionibacter acne growth was 90 mg/ml with a diameter of inhibition zone about 16.15 mm.
BAB I
PENDAHULUAN
1.1.Latar Belakang
Obat herbal dipakai secara luas di hampir seluruh negara di dunia. Menurut
WHO, negara – negara di Asia dan Amerika Latin menggunakan obat herbal
sebagai pelengkap pengobatan primer yang mereka terima. Bahkan di Afrika,
sebanyak 80% dari populasi menggunakan obat herbal untuk pengobatan primer
(WHO, 2003).
Indonesia mempunyai keragaman hayati yang sangat tinggi dan berada pada
urutan terkaya kedua setelah Brazilia. Indonesia yang terdiri dari banyak suku
bangsa yang mencapai sekitar 400 etnis memiliki kekayaan pengetahuan tradisional
tentang pemanfaatan tumbuhan untuk pemeliharaan kesehatan dan pengobatan
berbagai penyakit (Depkes, 2007).
Kulit buah tanaman jengkol (Pithecellobium lobatum Benth.) merupakan
limbah pasar tradisional yang tidak mempunyai manfaat. Pemilihan sampel tersebut
berdasarkan pengamatan dimana kulit buah jengkol yang dikupas menggunakan
pisau besi akan menimbulkan warna biru, perubahan warna tersebut menandakan
adanya tanin. Selain tanin juga terdapat flavonoid. Tanin dan flavonoid merupakan
senyawa polifenol yang diketahui bersifat antibakteri (Samaranayake, 2002;
Robinson, 1995).
Kulit merupakan tempat terjangkitnya beberapa jenis penyakit infeksi
akibat penyumbatan pada folikel rambut oleh produksi sebum yang selanjutnya
akan menjadi media bagi pertumbuhan bakteri khususnya Propionibacter acne dan
bakteri sekunder lainnya seperti Staphylococcus epidermidis dan Staphylococcus
aureus (Tony, B., 2004).
Staphylococcus aureus merupakan bakteri patogen oportunistik dan
penyebab infeksi pada kulit hingga keracunan darah yang dapat menyebabkan
kematian. Ekologi alami dari spesies bakteri ini adalah rongga hidung dan kulit
pada hewan berdarah panas (Kluytmans dan Wertheim, 2005). Staphylococcus
epidermidis merupakan organisme dengan tingkat keganasan rendah yang berkoloni
diberbagai tempat pada membran mukosa dan kulit manusia (McCann, 2008; Otto,
2009; Vadyvaloo, 2005). Pronibacterium acne termasuk ke dalam kelompok
bakteri gram positif dan kebanyakan ditemukan pada area yang kaya akan kelenjar
sebaceus pada kulit orang dewasa. Walaupun pada awalnya diperkirakan sebagai
kelompok bakteri yang relatif non-patogen pada tubuh manusia, penelitian terbaru
menunjukkan bahwa Propionibacter acne bertindak sebagai bakteri yang
bertanggung jawab dalam berbagai infeksi dan kondisi klinis terutama pada
inflamasi acne (Eady dan Ingham, 1994).
Berdasarkan uraian di atas perlu dilakukan uji aktivitas antibakteri dari
ekstrak etanol kulit buah tanaman jengkol terhadap Staphylococcus aureus,
Staphylococcus epidermidis, dan Propionibacter acne. Penelitian ini mencakup
karakterisasi simplisia meliputi : pemeriksaan makroskopik simplisia, mikroskopik
serbuk simplisia, penetapan kadar abu total, kadar abu tidak larut asam, kadar air,
kadar sari larut dalam air dan kadar sari larut dalam etanol, skrining fitokimia, dan
Selanjutnya ekstrak etanol kulit buah tanaman jengkol diuji aktivitas
antibakteri dengan metode difusi agar menggunakan silinder logam.
1.2 Perumusan Masalah
Adapun perumusan masalah penelitian ini adalah:
a. Bagaimana karakteristik dari simplisia kulit buah tanaman jengkol?
b. Apakah golongan senyawa kimia yang terdapat pada simplisia dan ekstrak
etanol kulit buah tanaman jengkol?
c. Apakah ekstrak etanol kulit buah tanaman jengkol mempunyai aktivitas
antibakteri terhadap bakteri Staphylococcus aureus, Staphylococcus
epidermidis, dan Propionibacter acne.
1.3 Hipotesis
Berdasarkan perumusan masalah, maka hipotesis penelitian adalah:
a. Karakteristik simplisia kulit buah tanaman jengkol dapat diperoleh dengan
menggunakan prosedur dalam Materia Medika Indonesia.
b. Simplisia kulit buah tanaman jengkol dan ekstrak etanol kulit buah tanaman
jengkol mengandung beberapa senyawa sekunder.
c. Ekstrak etanol kulit buah tanaman jengkol mempunyai aktivitas antibakteri
terhadap bakteri Staphylococcus aureus, Staphylococcus epidermidis, dan
1.4 Tujuan Penelitian
Adapun tujuan penelitian ini adalah sebagai berikut:
a. Untuk mengetahui karakteristik dari simplisia kulit buah tanaman jengkol.
b. Untuk mengetahui golongan senyawa kimia pada simplisia dan ekstrak
etanol kulit buah tanaman jengkol.
c. Untuk mengetahui aktivitas antibakteri dari ekstrak etanol kulit buah
tanaman jengkol terhadap bakteri Staphylococcus aureus, Staphylococcus
epidermidis, dan Propionibacter acne.
1.5Manfaat Penelitian
Adapun manfaat dari penelitian ini adalah sebagai berikut:
a. Memperoleh informasi tentang karakteristik simplisia dan golongan
senyawa kimia pada simplisia dan ekstrak etanol kulit buah tanaman jengkol
b. Memperoleh informasi tentang aktivitas antibakteri dari ektrak etanol kulit
buah tanaman jengkol terhadap bakteri Staphylococcus aureus,
Staphylococcus epidermidis, dan Propionibacter acne.
c. Dengan penelitian dan pengembangan selanjutnya, dapat memanfaatkan
kulit buah tanaman jengkol dari limbah pasar tradisional yang tidak
1.6 Kerangka Pikir Penelitian
Penelitian ini dilaksanakan dengan kerangka konsep seperti ditunjukkan
berikut ini :
Variabel bebas Variabel terikat Parameter
BAB II
Pertumbuhan Staphylococcus aureus,
Staphylococcus epidermidis, dan Propionibacter acne
yang diukur dengan metode difusi agar Simplisia kulit
buah jengkol
Ekstrak kulit buah jengkol
Makroskopik
Mikroskopik
Kadar air
Kadar sari larut dalam etanol
Kadar sari larut dalam air
Kadar abu total
Kadar abu tidak larut dalam asam
Karakteristik Simplisia
Diameter Zona Penghambatan
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tanaman
2.1.1 Sistematika Tanaman Jengkol
Sistematika tanaman jengkol (Pandey B.P., 2003):
Divisi : Magnoliophyta
Kelas : Magnoliopsida
Bangsa : Fabales
Suku : Mimosaceae
Marga : Pithecellobium
Spesies : Pithecellobium lobatum Benth.
2.1.2 Nama Daerah
Jawa: Jengkol, Sumatera Barat: Jaring, Lampung: Jaawi, Sunda: kicaang,
Sulawesi Utara : lubi, dan Bali: blandingan (Anonim,2007).
2.1.3 Habitat dan Morfologi Tanaman Jengkol
Tanaman jengkol merupakan tumbuhan tahunan berupa pohon yang
tingginya dapat mencapai 10-26 meter. Jengkol banyak ditanam di kebun atau
pekarangan rumah masyarakat dan tumbuh pada daerah dengan musim kemarau
yang tidak terlalu panjang (Anonim, 2007).
Tanaman jengkol mempunyai batang tegak, bulat, berkayu dengan
percabangan simpodial, dan berwarna coklat gelap. Tipe daun majemuk, berbentuk
lonjong dengan tepi rata, ujung runcing, pangkal membulat, memiliki pertulangan
yang terletak pada ujung batang dan ketiak daun, kelopak berbentuk mangkok,
benang sari dan putik berwarna kuning, mahkota berbentuk lonjong dengan warna
putih kekuningan(Hutapea, 1994).
Buah jengkol berupa polong berbentuk pipih. Warna buahnya lembayung
tua. Setelah tua, bentuk polong buahnya menjadi cembung dan di tempat yang
mengandung biji ukurannya membesar. Tiap polong dapat berisi 5-7 biji. Bijinya
berkulit ari tipis dan berwarna cokelat mengilap (Anonim, 2009).
2.1.4. Kandungan Kimia dan Khasiat Tanaman
Meskipun sering dianggap sebagai makanan yang menimbulkan bau yang
tidak sedap, hasil penelitian menunjukkan bahwa biji jengkol juga kaya akan
karbohidrat, protein, vitamin A, vitamin B, fosfor, kalsium, alkaloid, minyak atsiri,
steroid, glikosida, tanin, dan saponin (Anonim, 2007).
Adapun khasiat dari biji jengkol menurut para ahli kesehatan antara lain :
dapat memperlancar proses buang air besar. Hal ini disebabkan oleh biji jengkol
mengandung serat yang tinggi. Biji jengkol juga dapat mencegah penyakit diabetes,
mungkin karena kandungan asam dan mineralnya (Anonim, 2007).
Biji jengkol cukup kaya akan zat besi, yaitu 4.7 gram per 100 gram.
Kandungan fosfor pada biji jengkol ( 166.7 mg/100 gram ) juga sangat penting
untuk pembentukan tulang dan gigi, serta untuk penyimpanan dan pengeluaran
energi. Dengan demikian, sesungguhnya banyak manfaat yang diperoleh dari
mengonsumsi biji jengkol. Hanya saja, konsumsi biji jengkol dapat memberikan
efek bau tak sedap, baik pada saat bernafas maupun pada saat buang air besar dan
Saat dicerna biji jengkol akan menyisakan zat yang disebut asam jengkolat
(Jencolic acid) yang dibuang keginjal, disinilah efek yang sering ditakuti
masyarakat yaitu jengkoleun atau jengkolan. Jengkolan terjadi saat asam jengkolat
yang sukar larut dalam air akhirnya mengendap dalam ginjal, membentuk kristal
padat hingga bisa berakibat sulit membuang air seni. Jika pH darah netral, asam
jengkolat tidak menimbulkan bahaya tetapi jika cenderung asam (pH kurang dari 7)
asam jengkolat membentuk kristal yang tidak larut (Anonim, 2009).
Kulit buah jengkol dapat dimanfaatkan untuk mengendalikan pertumbuhan
gulma pada lahan pertanian padi. Kulit jengkol tersebut diiris melintang dan disebar
pada sawah yang tergenang air dengan ketinggian 5 cm. Sifat herbisida ini
disebabkan oleh adanya kandungan berbagai macam asam lemak panjang dan
fenolat pada kulit jengkol yang dapat menghambat pertumbuhan tumbuhan lain
(Enni dan Krispinus, 1995).
2.2 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair.
Ekstrak adalah sediaan kental yang diperoleh dengan mengekstraksi
senyawa aktif dari simplisia nabati atau simplisia hewani mengggunakan pelarut
yang sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau
serbuk yang tersisa diperlakukan sedemikian hingga memenuhi baku yang telah
Metode ekstraksi terdiri atas dua cara (Depkes, 2000), yaitu:
1. Cara Dingin
a. Maserasi adalah proses pengekstrakan simplisia dengan menggunakan
pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur
ruangan (kamar).
b. Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai sempurna
(Exhaustive extraction) yang umumnya dilakukan pada temperatur ruangan.
Prosesnya terdiri dari tahapan pengembangan bahan, tahapan maserasi
antara, tahap perkolasi sebenarnya (penetesan/penemapungan ekstrak), terus
menerus sampai diperoleh ekstrak ( perkolat) yang umumnya 1-5 kali
bahan.
2. Cara Panas
a. Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya,
selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan
dengan adanya pendingin balik.
b. Soxhlet adalah ekstraksi menggunakan pelarut yang selalu baru yang
umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu
dengan jumlah pelarut yang relatif konstan dengan adanya pendingin balik.
c. Digesti adalah maserasi kinetik (dengn pengadukan kontinu) pada
temperatur yang lebih tinggi dari temperatur ruangan (kamar), yaitu secara
umum dilakukan pada temperatur 40-50oC.
d. Infus adalah ekstraksi dengan pelarut air pada temperatur penangas air
96-e. Dekok adalah infus pada waktu yang lebih lama (≥30 oC) dan temperatur
sampai titik didih air.
2.3 Uraian Kandungan Kimia Tanaman
2.3.1 Alkaloid
Alkaloid merupakan golongan zat tumbuhan sekunder yang terbesar, pada
umumnya alkaloid mencakup ssenyawa bersifat basa yang mengandung satu atau
lebih atom nitrogen, biasanya sebagai bagian dari sistem siklik. Alkaloid sering
bersifat racun bagi manusia dan banyak yang mempunyai kegiatan fisiologis yang
menonjol, sehingga digunakan secara luas dalam bidang pengobatan. Alkaloid
biasanya tidak berwarna, sering bersifat optis aktif, kebanyakan berbentuk kristal
tetapi ada beberapa yang berupa cairan (misalnya nikotin) pada suhu kamar
(Harborne, 1987).
Sistem klasifikasi menurut Hegnaure, alkaloid dikelompokan sebagai :
a. Alkaloid sesungguhnya (true alkaloids; typical alkaloids)
Senyawa tersebut menunjukan aktivitas fisiologi yang luas, hampir tanpa
terkecuali bersifat basa, lazim mengandung nitrogen dalam cincin heterosiklis.
Diturunkan dari asam amino, biasanya terdapat dalam tanaman sebagai garam
organik (dengan asam sitrat, malat dan tartrat).
Misalnya : atropine, nicotine, dan morphine.
b. Protoalkaloid
Merupakan amin yang relatif sederhana dimana atom nitrogen tidak terdapat
berdasarkan biosintesis dari asam amino yang bersifat basa. Kelompok ini
disebut juga amin biologis.
Misalnya : mescaline, adrenaline, dan ephedrine
c. Pseudoalkaloid
Golongan ini tidak diturunkan dari prekosor asam amino. Biasanya bersifat
basa. Ada 2 seri alkaloid yang penting dalam kelas ini, yaitu alkaloid steroidal
dan purin.
Misalnya : solasodine, solanidine, veralkamine (menyerupai struktur
terpen/steroid), caffeine, theobromine, dan theophylline (menyerupai struktur
purin).
2.3.2 Flavonoid
Menurut perkiraan, kira-kira 2% dari seluruh karbon yang difosintesis oleh
tetumbuhan diubah menjadi flavonoid atau senyawa yang berkaitan erat dengannya.
Berdasarkan struktur kimianya sebagian tanin adalah flavonoid. Jadi flavonoid
merupakan salah satu golongan fenol alam yang terbesar (Markham, 1988).
Flavonoid mengandung 15 atom karbon dalam inti dasarnya yang
mempunyai struktur C6-C3-C6 yaitu dua cincin aromatik yang dihubungkan oleh
satuan tiga karbon yang dapat atau tidak dapat membentuk cincin ketiga (Markham,
1988).
Flavanoida merupakan salah satu golongan fenol alam terbesar. Flavonoida
mencakup banyak pigmen dan terdapat pada seluruh dunia tumbuhan. Sebagai
pigmen bunga, flavonoida berperan untuk menarik perhatian burung dan serangga
karena penyebaran masing-masing kelas ini terbatas terdapat sccara sporadik
(misalnya flavonon) atau terbatas pada sangat sedikit taksa tumbuhan misalnya
isovflavon pada leguminosae dan iridaceae (Harborne,1987).
2.3.3 Tanin
Tanin terdapat luas dalam tumbuhan berpembuluh, dalam Angiospermae
terdapat khusus dalam jaringan kayu. Menurut batasannya, tanin dapat bereaksi
dengan protein membentuk kopolimer mantap yang tak larut dalam air. Reaksi ini
menjadi dasar untuk penyamakan kulit. Dalam industri, tanin adalah senyawa yang
berasal dari tumbuhan, yang mampu mengubah kulit hewan (hide) yang mentah
menjadi kulit (leather) yang awet karena kemampuannya menyambung silang
protein (Harborne, 1987).
Di dalam tumbuhan letak tannin terpisah dari protein dan enzim sitoplasma,
tetapi bila jaringan rusak, misalnya bila hewan memakannya, maka reaksi
penyamakan dapat terjadi. Umumnya tumbuhan yang banyak mengandung tanin
dihindari oleh hewan pemakan tumbuhan karena rasanya yang sepat. Fungsi utama
tanin dalam tumbuhan ialah sebagai penolak hewan pemakan tumbuhan disamping
antimikroba (Harborne, 1987).
Secara kimia terdapat dua jenis utama tanin yang tersebar tidak merata dalam
dunia tumbuhan yaitu :
1. Tanin terkondensasi
Tanin terkondensasi terbentuk dengan cara kondensasi katekin tunggal yang
membentuk senyawa dimer dan oligomer yang lebih tinggi. Ikatan karbon –
karbon menghubungkan satu satuan flavon dengan satuan berikutnya
satuan flavon. Tanin terkondensasi disebut juga dengan proantosianidin
karena bila direaksikan dengan asam panas, beberapa ikatan karbon –
karbon penghubung satuan terputus dan dibebaskanlah monomer
antosianidin. Kebanyakan proantosianidin adalah prosianidin, ini berarti bila
direaksikan dengan asam akan menghasilkan sianidin.
2. Tanin terhidrolisis
Terdiri atas dua kelas yaitu :
a. Depsida galoilglukosa
Senyawa ini mempunyai inti yang berupa molekul glukosa yang
dikelilingi oleh lima gugus ester galoil atau lebih.
b. Dimer asam galat
Inti molekul senyawa ini berupa senyawa dimer asam galat yaitu asam
heksahidroksidifenat yang berikatan dengan glukosa. Tanin terhidrolisis
disebut juga elagitanin yang pada hidrolisis menghasilkan asam galat
(Harborne, 1987).
2.3.4 Saponin
Saponin adalah glikosida yang terdapat pada lebih dari 90 suku tumbuhan
.Saponin merupakan senyawa aktif permukaan dan bersifat seperti sabun , serta
dapat dideteksi berdasarkan kemampuanya membentuk busa dan menghemolisis sel
darah .Saponin diberi nama demikian karena sifatnya yang seperti sabun (bahasa
Latin ”sapo” berarti sabun). Dalam larutan yang sangat encer saponin sangat
beracun untuk ikan dan tumbuhan yang mengandung saponin telah digunakan
baku untuk sintesis hormon steroid yang digunakan dalam bidang kesehatan
(Robinson, 1995).
Pembentukan busa yang mantap sewaktu mengekstraksi tumbuhan atau
pada waktu memekatkan ekstrak tumbuhan merupakan indikasi akan adanya
saponin (Harborne, 1987).
2.3.5 Glikosida
Glikosida adalah senyawa yang terdiri atas gabungan dua bagian, yaitu
bagian gula dan bukan gula. Keduanya dihubungkan oleh ikatan berupa jembatan
oksigen, jembatan nitrogen, jembatan sulfur, maupun jembatan karbon. Bagian gula
disebut glikon sementara bagian bukan gula disebut bagian aglikon atau genin.
Apabila glikon dan aglikon saling terikat maka senyawa ini disebut sebagai
glikosida. Jembatan oksigen yang menghubungkaan glikon-aglikon ini sangat
mudah terurai oleh pengaruh asam, basa, enzim, air, dan panas. Semakin pekat
kadar asam atau basa maupun semakin panas lingkungannya maka glikosida akan
semakin mudah dan cepat terhidrolis. Saat terhidrolis maka molekul akan pecah
menjadi dua bagian, yaitu gula dan bukan gula (Gunawan, 2004).
Menurut Farnsworth (1966), pembagian glikosida berdasarkan ikatan yang
menghubungkan bagian gula dan bukan gula adalah :
1. C-glikosida, jika atom C menghubungkan bagian gula dan bukan gula.
Contoh: aloin.
2. O-Glikosida, jika atom O menghubungkan bagian gula dan bukan gula.
3. N-Glikosida, Jika atom N menghubungkan bagian gula dan bukan gula.
Golongan ini sebagian gulanya buka gula sebenarnya tetapi derivarnya.
Contoh: vidarabin.
4. S-Glikosida, jika thiol (SH) yang menghubungkan bagian gula dan bagian
bukan gula. Contoh: sinigrin.
2.3.6 Triterpenoid dan Steroid
Triterpenoid adalah senyawa yang kerangka karbonnya berasal dari enam
satuan isoprena dan secara biosintesis diturunkan dari hidrokarbon C30 asiklik,
yaitu skualena. Senyawa triterpenoid dan steroid berstruktur siklik dengan berbagai
gugus fungsi yang melekat padanya, seperti gugus alkohol, aldehid atau asam
karboksilat. Mereka berupa senyawa tidak berwarna, berbentuk kristal, sering kali
memiliki titik leleh tinggi dan bersifat aktif optik.
Triterpenoid dapat dipilah menjadi sekurang-kurangnya empat golongan
senyawa: triterpena sebenarnya, steroid, saponin, dan glikosida jantung. Triterpena
tertentu terkenal karena rasanya, terutama kepahitannya.
Steroid adalah triterpena yang kerangka dasarnya sistem cincin siklo
pentana perhidrofenantren. Uji yang biasa digunakan adalah reaksi
Liebermann-Burchard yang dengan kebanyakan triterpen dan steroida memberikan warna
Steroid
2.4 Uraian Bakteri
Nama bakteri berasal dari kata “bakterion” (bahasa Yunani) yang berarti
tongkat atau batang. Sekarang nama itu dipakai untuk menyebut kelompok
mikroorganisme yang bersel satu, tidak berklorofil (meskipun ada kecualinya),
berbiak dengan pembelahan diri, serta demikian kecilnya sehingga hanya dapat
dilihat dengan mikroskop (Dwijoseputro1982).
Ukuran bakteri bervariasi baik penampang maupun panjangnya, tetapi
pada umumnya ukuran bakteri adalah sekitar 0,7-1,5 µm dengan panjang sekitar
1-6 µm (Mikrobiologi FKU, 2003).
Berdasarkan bentuk morfologinya, maka bakteri dapat dibagi atas tiga
golongan, yaitu golongan basil (berbentuk batang), golongan kokus (berbentuk
bulat), dan golongan spiral (berbentuk bengkok) (Dwijoseputro1982). Walaupun
bentuknya bermacam-macam, tetapi pada dasarnya strukturnya terdiri atas dinding
sel, sitoplasma serta inti sel. Selain struktur dasar tersebut, bakteri juga memiliki
struktur tambahan misalnya pili, kapsul, flagela, serta spora yang tidak selalu
dimiliki oleh setiap bakteri (Mikrobiologi FKU, 2003).
Bakteri Gram positif menyerap zat warna pertama yaitu kristal violet yang
menyebabkan berwarna ungu, sedangkan bakteri Gram negatif menyerap zat warna
kedua yaitu safranin dan menyebabkannya berwarna merah muda
(Dwijoseputro,1982).
Bakteri Gram positif memiliki kandungan peptidoglikan yang tinggi (dapat
mencapai 50%) dibandingkan bakteri Gram negatif (sekitar 10%). Sebaliknya
kandungan lipida dinding sel bakteri Gram positif rendah sedangkan pada dinding
sel bakteri Gram negatif tinggi yaitu sekitar 11-22% (Lay,1992).
2.4.1 Perkembangbiakan Bakteri
Pertumbuhan dan perkembangbiakan bakteri dipengaruhi oleh:
1. Suhu
Setiap spesies bakteri tumbuh pada suatu kisaran suhu tertentu. Atas
dasar ini maka bakteri dapat diklasifikasikan sebagai: psikrofil, yang
tumbuh pada 0 sampai 30oC; mesofil, yang tumbuh pada 25 sampai 40oC;
dan termofil, yang tumbuh pada suhu 50oC atau lebih (Pelczar,1988).
Suhu terendah dimana bakteri dapat tumbuh disebut minimum
growth temperature. Sedangkan suhu tertinggi dimana bakteri dapat tumbuh
dengan baik disebut maximum growth temperature. Suhu dimana bakteri
dapat tumbuh dengan sempurna diantara kedua suhu tersebut disebut suhu
optimum (Mikrobiologi FKU, 2003).
2. Derajat Keasaman
pH optimum pertumbuhan bagi kebanyakan bakteri terletak antara
minimum dan maksimum ialah antara 4 dan 9. Bila bakteri dibiakkan dalam
suatu medium yang mula-mula disesuaikan pHnya maka mungkin sekali pH
ini berubah karena adanya senyawa asam atau basa yang dihasilkan selama
pertumbuhan (Pelczar,1988).
3. Oksigen
Berdasarkan akan kebutuhan terhadap oksigen , bakteri dapat
digolongkan menjadi: Bakteri aerob mutlak, yaitu bakteri yang untuk
pertumbuhannya memerlukan adanya oksigen; Bakteri anaerob fakultatif,
yaitu bakteri yang dapat tumbuh, baik ada oksigen maupun tanpa adanya
oksigen; Bakteri anaerob aerotoleran, yaitu bakteri yang tidak
membutuhkan oksigen tetapi tidak mati dengan adanya oksigen; Bakteri
anaerob mutlak, yaitu bakteri yang hidup bila tidak ada oksigen; dan Bakteri
mikroaerofilik, yaitu bakteri yang kebutuhan oksigennya rendah
(Mikrobiologi FKU, 2003).
4. Nutrisi
Sumber zat makanan (nutrisi) bagi bakteri diperoleh dari senyawa
karbon, nitrogen, sulfur, fosfor, unsur logam (natrium, kalsium, magnesium,
mangan, besi, tembaga dan kobalt), vitamin dan air untuk fungsi-fungsi
metabolik dan pertumbuhannya (Dwijoseputro,1982).
5. Pengaruh Kelembapan dan Kekeringan
Bakteri sebenarnya adalah makhluk yang suka akan keadaan basah
atau lembab, bahkan dapat hidup didalam air, hanya didalam air yang
tertutup mereka tidak dapat hidup subur, hal ini disebabkan karena
bakteri yang mati, jika terkena udara kering. Bakteri yang tahan panas
disebut bakteri xerophyl (Dwijoseputro,1982).
6. Tekanan Osmosa
Medium yang paling cocok untuk kehidupan bakteri ialah medium
yang isotonik terhadap isi sel bakteri. Ada beberapa jenis bakteri dapat
hidup pada larutan garam yang disebut bakteri halophyl
(Dwijoseputro,1982).
2.4.2 Media Pertumbuhan Bakteri
Perkembangbiakan mikroorganisme membutuhkan media yang berisi zat
hara serta lingkungan pertumbuhan yang sesuai bagi mikroorganisme. Media dapat
dibagi berdasarkan (Lay, 1994):
1. Konsistensinya, media dapat dibagi menjadi tiga macam, yaitu:
a. Media padat
b. Media cair
c. Media semi padat
Media padat diperoleh dengan menambahkan agar. Agar berasal dari
ganggang merah. Agar digunakan sebagai bahan pemadat karena
tidak diuraikan oleh mikroorganisme dan membeku pada suhu di
bawah 45ºC. kandungan agar sebagai bahan pemadat dalam media
adalah 1,5 - 2 %.
2. Sumber bahan baku yang digunakan, media dapat dibagi menjadi dua
macam:
sintetik, kandungan dan isi bahan yang ditambahkan diketahui
secara terperinci.
b. Media Nonsintetik, menggunakan bahan yang terdapat di alam
biasanya tidak diketahui kandungan kimianya secara terperinci.
Contoh: ekstrak daging, pepton, ekstrak ragi, dan kaldu daging.
3. Berdasarkan fungsinya, media dapat dibagi menjadi:
a. Media selektif, yaitu media biakan yang mengandung paling sedikit
satu bahan yang dapat menghambat perkembangbiakan
mikroorganisme yang tidak diinginkan dan membolehkan
perkembangbiakan mikroorganisme tertentu yang ingin diisolasi.
b. Media differensial, yaitu media untuk membedakan kelompok
mikroorganisme tertentu yang tumbuh pada media biakan. Bila
berbagai kelompok mikroorganisme tumbuh pada media
differensial, maka dapat dibedakan kelompok mikrooganisme
berdasarkan perubahan pada media biakan atau penampilan
koloninya.
c. Media diperkaya, yaitu dengan menambahkan bahan – bahan
khusus pada media untuk menumbuhkan mikroba yang khusus.
2.4.3 Bakteri Staphylococcus aureus
2.4.3.1 Sistematika Bakteri Staphylococcus aureus
Sistematika Staphylococcus aureus (Tjitrosoepomo, 1994) adalah :
Divisi : Schizophyta
Kelas : Schizomycetes
Famili : Micrococcaceae
Marga : Staphylococcus
Species : Staphylococcus aureus
2.4.3.2 Uraian Bakteri Staphylococcus aureus
Staphylococcus aureus merupakan bakteri gram positif yang bersifat aerob
atau anaerob fakultatif, tes katalase positif dan tahan hidup dalam lingkungan yang
mengandung garam dengan konsentrasi tinggi (halofilik), misalnya NaCl 10%.
Hasil pewarnaan yang berasal dari perbenihanpadat akan memperlihatkan susunan
bakteri yang bergerombol seperti buah anggur. Untuk membiakkan bakteri
Staphylococcus aureus diperlukan suhu optimal sekitar 35oC dan pH optimal untuk
pertumbuhan Staphylococcus aureus adalah 7,4 (Mikrobiologi FKU, 2003).
Infeksi yang disebabkan oleh bakteri Staphylococcus aureus pada
permukaan kulit tampak sebagai jerawat dan abses. Acne / jerawat terjadi sebagian
besar pada usia remaja (Dzen S.M., 2003).
2.4.4 Bakteri Staphylococcus epidermidis
2.4.4.1 Sistematika Bakteri Staphylococcus epidermidis
Sistematika Staphylococcus epidermidis (Lindsay J.A., 2008):
Divisi : Firmicutes
Kelas : Bacilli
Bangsa : Bacillales
Famili : Staphylococcaceae
Marga : Staphylococcus
2.4.4.2 Uraian Bakteri Staphylococcus epidermidis
Bakteri ini merupakan gram positif, berbentuk kokus, berdiameter 0,5-1,5
µ m.Berkoloni mengerombol menyerupai buah anggur. Koloni biasanya berwarna
putih atau krem. Hidup dipermukaan kulit dan membrane mukosa manusia maupun
hewan sebagai flora normal. Bakteri ini merupakan flora normal dalam keadaan
manusia atau hewan sehat. Bakteri ini menjadi patogen atau oportunistik. Bakteri
ini mempunyai sifat – sifat sebagai berikut :
1. Koagulase Negatif.
Koagulase merupakan protein ekstraseluler yang mengikat prothrombin
hospes dan membentuk komplek yang disebut staphylothrombin.
Karakteristik aktifitas protease pada thrombin diaktifasi dalam komplek
tersebut, menghasilkan konversi fibrinogen menjadi fibrin. Bakteri S.
epidermidis tidak dapat membentuk kompleks tersebut sehingga darah darah
dari hospes tidak mengumpal.
2. Katalase positif
Uji katalase digunakan untuk mengetahui aktivitas katalase pada bakteri.
Bakteri ini memproduksi enzim katalase yang dapat memecah H2O2 menjadi
H2O dan O2. Karena H2O2 dapat menjadi racun bagi bakteri ini selain itu
proses tersebut merupakan mekanisme pernafasan dari bakteri ini.
3. Non hemolitik. Bakteri ini tidak dapat menghemolisis darah pada media.
4. Anaerob fakultatif pada respirasi atau fermentasi. Bakteri ini dapat hidup dan
bermetabolisme dalam lingkungan yang mengandung sedikit oksigen terlarut
5. Uji Reduksi Nitrat Positif Lemah. Bakteri ini dapat mengubah senyawa nitrat
menjadi dinitrit dengan bantuan enzim nitrat reduktase dalam
metabolismenya.
6. Positif Produksi Urease. Bakteri ini dapat menguraikan urea menjadi amonia
dan karbon dioksida dengan bantuan enzim urease.
7. Bakteri ini dapat memanfaatkan glukosa, sukrosa, laktosa menjadi asam dalam
proses metabolisme.
8. Tidak memiliki enzim gelatinase sehingga tidak dapat menghidrolisis gelatin
(Salyers A.A., 2002).
2.4.5 Bakteri Propionibacter acne
2.4.5.1 Sistematika Propionibacter acne
Sistematika Propionibacter acne (Brook, G.F., 2005):
Divisi : Actinobacteria
Kelas : Actinobacteridae
Bangsa : Actinomycetales
Famili : Propionibacteriaceae
Marga : Propionibacter
Species : Propionibacter acne
2.4.5.2 Uraian Bakteri Propionibacter acne
Propionibacter acne termasuk dalam kelompok bakteri Corynebacteria.
Bakteri ini termasuk flora normal kulit. Propionibacterium acnes berperan pada
patogenesis jerawat dengan menghasilkan lipase yang memecah asam lemak bebas
Propionibacter acnes termasuk bakteri yang tumbuh relatif lambat. Bakteri
ini tipikal bakteri anaerob gram positif yang toleran terhadap udara. Genome dari
bakteri ini telah dirangkai dan sebuah penelitian menunjukkan beberapa gen yang
dapat menghasilkan enzim untuk meluruhkan kulit dan protein, yang mungkin
immunogenic (mengaktifkan sistem kekebalan tubuh). Ciri-ciri penting dari bakteri
Propionibacterium acnes adalah berbentuk batang tak. Propionibacter
acnes termasuk dalam kelompok bakteri Corynebacteria. Bakteri ini termasuk flora
normal kulit. Propionibacter acnes berperan pada patogenesis jerawat dengan
menghasilkan lipase yang memecah asam lemak bebas dari lipid kulit. Asam lemak
ini dapat mengakibatkan inflamasi jaringan ketika berhubungan dengan sistem
imun dan mendukung terjadinya akne. Propionibacter acnes termasuk bakteri yang
tumbuh relatif lambat. Bakteri ini tipikal bakteri anaerob Gram positif yang toleran
terhadap udara.
Ciri-ciri penting dari bakteri Propionibacter acnes adalah berbentuk batang
tak teratur yang terlihat pada pewarnaan Gram positif. Bakteri ini juga dapat
berbentuk filamen bercabang atau campuran antara bentuk batang/filamen dengan
bentuk kokus. Propionibacterium acnes memerlukan oksigen mulai dari aerob atau
anaerob fakultatif sampai ke mikroaerofilik atau anaerob. Bakteri ini dapat bersifat
patogen untuk hewan dan tanaman (Brook, G.F., 2005).
2.4.6 Uji Aktivitas Antibakteri
Pengukuran aktivitas antibakteri dapat dilakukan dengan metode dilusi
a. Metode Dilusi
Zat antibakteri dengan konsentrasi yang berbeda-beda dimasukkan pada
media cair. Media tersebut langsung diinokulasi dengan bakteri dan
diinkubasi. Tujuan dari percobaan ini adalah menentukan konsentrasi terkecil
suatu zat antibakeri dapat menghambat pertumbuhan atau membunuh bakteri
uji. Metode dilusi agar membutuhkan waktu yang lama dalam pengerjaannya
sehingga jarang digunakan.
b. Metode Difusi
Metode yang paling sering digunakan adalah metode difusi agar dengan
menggunakan cakram kertas, cakram kaca, pencetak lubang. Prinsip metode
ini adalah mengukur zona hambatan pertumbuhan bakteri yang terjadi akibat
difusi zat yang bersifat sebagai antibakteri di dalam media padat melalui
pencadang. Daerah hambatan pertumbuhan bakteri adalah daerah jernih
disekitar cakram. Luas daerah berbanding lurus dengan aktivitas antibakteri,
semakin kuat daya aktivitas antibakteri maka semakin luas daerah
BAB III
METODE PENELITIAN
Penelitian ini menggunakan metode ekperimental meliputi pengumpulan
dan pengolahan sampel, karakterisasi simplisia, skrining fitokimia, pembuatan
ekstrak etanol serta uji aktivitas antibakteri terhadap bakteri Staphylococcus aureus,
Staphylococcus epidermidis, dan Propionibacter acne secara in vitro dengan
metode difusi agar.
3.1 Alat dan Bahan
3.1.1 Alat- alat
Alat- alat yang digunakan dalam penelitian ini meliputi alat- alat gelas,
blender (Philips), oven listrik (Fisher scientitic), neraca kasar (Ohaus), neraca listrik
(Vibra AJ), alat Stahl, cawan porselen berdasar rata, desikator, mortir, stamper,
cawan porselen, rotary evaporator (Buchi 461), freeze dryer (Edward), inkubator
(Fisher Scientific), oven (Gallenkam), autoclaf (Fison), jarum ose, cawan petri,
lampu bunsen, lemari pendingin (Karl Kolb), pinset, rubber pump, hot plate,
spatula, penangas air, pipet volum, jangka sorong, kain kasa, kertas saring,
aluminium foil, pencetak logam, spatula, mikroskop (Olympus), object glass, dan
cover glass.
3.1.2 Bahan-bahan
Bahan tumbuhan yang dipergunakan adalah kulit buah (pericarp) jengkol,
semua bahan yang digunakan berkualitas pro analisa yaitu; kloralhidrat, asam
klorida encer P., kloroform, besi (III) klorida, natrium hidroksida, timbal (II) asetat,
-naftol, asam nitrat, bismut nitrat, etil asetat, isopropanol, natrium sulfat anhidrat,
serbuk seng, serbuk magnesium, metanol, eter, kecuali etanol 70%, Nurtrien Agar
(Difco), suspensi standar Mc.Farland, NaCl 0,9%, dan air suling. Bakteri yang
digunakan yaitu bakteri Staphylococcus aureus ATCC 29737, Staphylococcus
epidermidis ATCC 12228 dan Propionibacter acne ATCC 6919.
3.2 Pembuatan Larutan Pereaksi
Pembuatan larutan pereaksi Bouchardat, Dragendorff, Mayer, Molish,
timbal (II) asetat 0,4 M, kloralhidrat, asam klorida 2 N, natrium hidroksida 2 N,
besi (III) klorida 1%.
3.2.1 Larutan Pereaksi Mayer
Sebanyak 5 g Kalium Iodida dalam 10 ml air suling kemudian ditambahkan
larutan 1,36 g merkuri (II) klorida dalm 60 ml air suling. Larutan dikocok dan
ditambahkan air suling hingga 100 ml.
3.2.2 Larutan Pereaksi Dragendroff
Sebanyak 8 g bismuth nitrat dilarutkan dalam asam nitrat 20 ml kemudian
dicampur dengan larutan kalium iodida sebanyak 27,2 g dalam 50 ml air suling.
Campuran didiamkan sampai memisah sempurna. Larutan jernih diambil dan
diencerkan dengan air secukupnya hingga 100 ml.
3.2.3 Larutan Pereaksi Bouchardat
Sebanyak 4 g kalium iodida dilarutkan dalam 20 ml air suling kemudian
ditambah 2 g iodium sambil diaduk sampai larut, lalu ditambah air suling hingga
3.2.4 Larutan Pereaksi Molish
Sebanyak 3 g α- naftol dilarutkan dalam asam nitrat 0,5 N hingga 100 ml.
3.2.5 Larutan Pereaksi Besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida dilarutkan dalam air suling hingga 100 ml
kemudian disaring.
3.2.6 Larutan Pereaksi Timbal (II) asetat 0,4 M
Sebanyak 15,17 g Timbal (II) asetat ditimbang, kemudian dilarutkan dalam
air hingga 100 ml.
3.2.7 Larutan Pereaksi Natrium hidroksida 2 N
Sebanyak 8 g kristal natrium hidroksida dilarutkan dalam air suling hingga
diperoleh larutan 100 ml.
3.2.8 Larutan Pereaksi Asam Klorida 2 N
Sebanyak 17 ml asam klorida pekat diencerkan dengan air suling sampai
100 ml.
3.2.9 Larutan Pereaksi Kloralhidrat
Sebanyak 50 g kloralhidrat dilarutkan dalam 20 ml air suling.
3.2.10 Larutan Etanol 70%
Sebanyak 0,73 L etanol 96% diencerkan dengan air suling hingga 1 L.
3.3 Pengambilan dan Pengolahan Bahan Tanaman
3.3.1 Pengambilan Bahan Tanaman
Pengambilan bahan dilakukan secara purposif, yaitu tanpa mengambil dari
langsung dari pasar tradisional di jalan Sei Kera, Pusat Pasar, Kecamatan Medan
Timur, Medan, Provinsi Sumatera Utara.
3.3.2 Identifikasi Tanaman
Identifikasi tanaman dilakukan di Laboratorium Taksonomi Tumbuhan,
Departemen Biologi FMIPA Universitas Sumatera Utara, Indonesia. Hasil
Identifikasi tanaman dapat dilihat pada lampiran 1 halaman 51.
3.3.3 Pengolahan Bahan Tanaman
Kulit buah jengkol terlebih dahulu dicuci, ditiriskan, dan dibuang bagian
yang tidak diperlukan, kemudian ditimbang berat basahnya. Kulit buah jengkol
selanjutnya dirajang, lalu dikeringkan di lemari pengering sampai kering, dan
ditimbang berat keringnya. Simplisia yang diperoleh dihaluskan menjadi serbuk.
Disimpan dalam wadah plastik yang tertutup rapat dan terlindung dari cahaya
matahari.
3.4 Pemeriksaan Karakterisasi Simplisia
Pemeriksaan karakterisasi simplisia meliputi pemeriksaan makroskopik dan
mikroskopik, penetapan kadar air, penetapan kadar abu total, penetapan kadar abu
tidak larut dalam asam, penetapan kadar sari larut dalam air, penetapan kadar sari
larut dalam etanol.
3.4.1 Pemeriksaan Makroskopik
Pemeriksaan makroskopik dilakukan dengan cara mengamati warna,
bentuk, ukuran dan tekstur dari simplisia. Gambar simplisia dapat dilihat pada
3.4.2.Pemeriksaan Mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap kulit buah segar dan simplisia
kulit buah jengkol. Kulit segar dipotong melintang lalu diletakkan di atas objek
glass yang telah ditetesi dengan larutan kloralhidrat kemudian dipanaskan, ditutup
dengan kaca penutup, dan selanjutnya diamati di bawah mikroskop. Hasil
pemeriksaan mikroskopik kulit segar dapat dilihat pada lampiran 3 halaman 54.
Simplisia ditaburkan di atas kaca objek yang telah ditetesi dengan larutan
kloralhidrat dan tutup dengan kaca penutup, kemudian diamati di bawah
mikroskop. Hasil pemeriksaan mikroskopik simplisia dapat dilihat pada lampiran 3
halaman 54.
3.4.3 Penetapan Kadar Air
Penetapan kadar air dilakukan dengan metode Azeotropi (Destilasi
Toluena). Alat meliputi labu alas 500 ml, alat penampung, tabung penerima 5 ml
berskala 0,05 ml pendingin, tabung penyambung, pemanas.
Cara kerja: Ke dalam labu bulat dimasukkan 200 ml toluene dan 2 ml air suling,
didestilasi selama 2 jam. Toluen didinginkan selama 30 menit dan volume air pada
tabung penerima dibaca (Depkes, 1989). Kemudian ke dalam labu dimasukkan 5 g
serbuk yang telah ditimbang seksama, lalu dipanaskan hati- hati selam 15 menit.
Setelah toluene mulai mendidih, kecepatan tetesan diatur, kurang lebih 2 tetes tiap
detik, hingga sebagian besar air tersuling. Kemudian kecepatan penyulingan
dinaikkan hingga 4 tetes tiap detik. Setelah semua air tersuling, bagian dalam
pendingin dibilas dengan toluene yang telah dijenuhkan. Destilasi dilanjutkan
selama 5 menit kemudian tabung penerima dibiarkan mendingin sampai suhu
ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai dengan kandungan
air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen
(WHO, 1992).
3.4.4 Penetapan Kadar Abu Total
Sebanyak lebih kurang 2 g serbuk yang telah digerus dan ditimbang
seksama dimasukkan dalam krus porselin yang telah dipijar dan ditara, kemudian
diratakan. Krus dipijarkan pada suhu 600°C sampai arang habis, kemudian
didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu dihitung
terhadap simplisia (Ditjen POM, 1989).
3.4.5 Penetapan Kadar Abu Tidak Larut dalam Asam
Abu yang telah diperoleh dari penetapan kadar abu total dididihkan dengan
25 ml asam klorida 2N selama 5 menit, bagian yang tidak larut dalam asam
dikumpulkan, disaring melalui kertas saring bebas abu kemudian dicuci dengan air
panas. Residu dan kertas saring dipijarkan pada suhu 600oC sampai bobot tetap,
didinginkan kemudian ditimbang. Kadar abu yang tidak larut dalam asam dihitung
terhadap simplisia (Ditjen POM, 1989).
3.4.6 Penetapan Kadar Sari Larut Dalam Air
Sebanyak 5 g serbuk yang telah dikeringkan diudara dimaserasi selama 24
jam dalam 100 ml air kloroform (2,5 ml kloroform dalam air suling 1000 ml),
dalam labu bersumbat sambil sesekali dikocok selam 6 jam pertama kemudian
dibiarkan selama 18 jam. Disaring, sejumlah 20 ml filtrat pertama diuapkan sampai
kering dalam cawan dangkal berdasar rata yang telah ditara dan sisa dipanaskan
3.4.7 Penetapan Kadar Sari Larut Dalam Etanol
Sebanyak 5 g serbuk yang telah dikeringkan di udara dimaserasi selama 24
jam dalam 100 ml etanol 96 % dalam labu bersumbat sambil dikocok sesekali 6 jam
pertama dan dibiarkan selama 18 jam dan disaring. Sejumlah 20 ml filtrat pertama
diuapkan sampai kering dalam cawan dangkal berdasar rata yang telah ditara.
Sisanya dipanaskan dalam oven pada 105oc sampai diperoleh bobot konstan kadar
sari yang larut di dalam air dihitung terhadap bahan yang dikeringkan di udara
(Ditjen POM, 1989).
3.5 Skrining Fitokimia
Skrining fitokimia terhadap simplisia dan ekstrak kulit buah jengkol
meliputi pemeriksaan senyawa golongan alkaloida, flavonoida, glikosida, glikosida
antrakinon, saponin, tanin, glikosida sianogenik, dan steroida/ triterpenoida. Hasil
skrining fitokimia dapat dilihat pada Tabel 4.2 halaman 42.
3.5.1 Pemeriksaan Alkaloida
Simplisia ditimbang sebanyak 0,5 g kemudian ditambahkan 1 ml asam
klorida 2 N dan 9 ml air suling, dipanaskan air selama 2 menit, didinginkan lalu
disaring. Filtrat dipakai untuk percobaan berikut :
a. Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Mayer
b. Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Bouchardat
c. Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Dragendrof
Alkaloida dianggap positif jika terjadi endapan atau paling sedikit dua atau
3.5.2 Pemeriksaan Flavonoida
Simplisia ditimbang 0,5 g, lalu ditambahkan 10 ml metanol, direfluks
selama 10 menit, disaring panas-panas melalui kertas saring. Filtrat diencerkan
dengan 10 ml air suling, setelah dingin ditambahkan 5 ml petroleum eter, dikocok
hati-hati, lalu didiamkan sebentar. Lapisan metanol diambil, diuapkan pada
temperatur 40oC, sisanya dilarutkan dalam 5 ml etilasetat, disaring. Filtratnya
digunakan untuk uji flavonoida dengan cara berikut :
a. Sebanyak 1 ml filtrat diuapkan sampai kering, sisa dilarutkan dalam 2 ml etanol
96%, lalu ditambah 0,5 g serbuk Zn dan 2 ml asam klorida 2 N. Didiamkan
selama 1 menit. Kemudian ditambahkan 10 tetes asam klorida pekat. Jika dalam
waktu 2-5 menit terjadi warna merah intensif menunjukkan adanya flavonoida.
b. Sebanyak 1 ml filtrat diuapkan sampai kering, sisa dilarutkan dalam 1 ml etanol
96%, lalu ditambah 0,1 g serbuk Mg dan 10 tetes asam klorida pekat. Jika terjadi
warna merah jingga sampai warna merah ungu menunjukkan adanya flavonoida
(Ditjen POM, 1979).
3.5.3 Pemeriksaan Tanin
Sebanyak 0,5 g sampel disari dengan 10 ml air suling, disaring lalu
filtratnya diencerkan dengan air suling sampai tidak berwarna. Diambil 2 ml larutan
lalu ditambahkan 1 sampai 2 tetes pereaksi besi (III) klorida 1%. Terjadi warna biru
atau hijau kehitaman menunjukkan adanya tannin (Farnsworth, 1966).
3.5.4 Pemeriksaan Saponin
Simplisia ditimbang sebanyak 0,5 g dan dimasukkan ke dalam tabung
10 menit dan tidak hilang dengan penambahan 1 tetes asam klorida 2N
menunjukkan adanya saponin (Ditjen POM, 1979).
3.5.5 Pemeriksaan Glikosida
Serbuk simplisia sebanyak 3 g, dlalu disari dengan 30 mL campuran etanol
95% dengan air (7:3) dan 10 mL asam klorida 2N, direfluks selama 2 jam,
didinginkan dan disaring. Diambil 20 mL filtrat, ditambahkan 25 mL air suling dan
25 mL timbal (II) asetat 0,4 M, dikocok, didiamkan 5 menit lalu disaring. Filtrat
disari dengan 20 mL campuran isopropanol dan kloroform (2:3), dilakukan
berulang sebanyak 3 kali. Sari air dikumpulkan dan diuapkan pada temperatur tidak
lebih dari 50°C. Sisanya dilarutkan dalam 2 mL metanol. Larutan sisa digunakan
untuk percobaan berikut : 0,1 mL larutan percobaan dimasukkan dalam tabung
reaksi dan diuapkan di atas penangas air. Pada sisa ditambahkan 2 mL air dan 5
tetes pereaksi molish. Kemudian secara perlahan – lahan ditambahkan 2 mL asam
sulfat pekat melalui dinding tabung, terbentuknya cincin berwarna ungu pada batas
kedua cairan menunjukkan adanya glikosida (Ditjen POM, 1978).
3.5.5.1 Pemeriksaan Glikosida Antrakinon
Simplisia ditimbang sebanyak 0,2 g, kemudian ditambahkan 5 ml asam
sulfat 2 N, dipanaskan sebentar, setelah dingin ditambahkan 10 ml benzen, dikocok
dan didiamkan. Lapisan benzen dipisahkan, dikocok dengan 2 ml NaOH 2 N, lalu
didiamkan. Lapisan air berwarna merah dan lapisan benzen tidak berwarna
3.5.5.2 Pemeriksaan Glikosida Sianogenik
Simplisia dimasukkan ke dalam erlenmeyer dan dilembabkan dengan air.
Kertas saring yang telah dibasahi dengan larutan natrium pikrat diselipkan dengan
bantuan gabus pada mulut labu. Dibiarkan terkena sinar matahari, akan timbul
warna merah pada kertas saring yang menunjukkan adanya glikosida sianogenik
(Farnsworth, 1966).
3.5.6 Pemeriksaan Steroida/ Triterpenoida
Sebanyak 1 g sampel dimaserasi dengan 20 ml eter selama 2 jam, lalu
disaring. Filtrat diuapkan dalam cawan penguap. Pada sisa ditambahkan 2 tetes
asam asetat anhidrat dan 1 tetes asam sulfat pekat. Timbul warna ungu atau merah
kemudian berubah menjadi hijau biru menunjukkan adanya steroida triterpenoida
(Harborne, 1978).
3.6 Pembuatan Ekstrak Kulit Buah Jengkol
Sebanyak 500 g simplisia dimasukkan ke dalam wadah kaca dan dibasahi
dengan etanol 70 %, kemudian dimaserasi selama 3 jam. Massa dipindahkan sedikit
demi sedikit ke dalam perkolator sambil tiap kali ditekan dengan hati - hati,
kemudian cairan penyari dituangkan secukupnya sampai cairan mulai menetes dan
di atas simplisia masih terdapat selapis cairan penyari, perkolator ditutup dan
dibiarkan selama 24 jam. Cairan dibiarkan menetes dengan kecepatan 1 ml tiap
menit, cairan penyari ditambahkan berulang-ulang secukupnya dengan memasang
botol cairan penyari di atas perkolator dan diatur kecepatan penetesan cairan
cairan penyari di atas simplisia. Perkolasi dihentikan jika 500 mg perkolat yang
keluar terakhir diuapkan, tidak meninggalkan sisa (Depkes, 2000).
Perkolat yang diperoleh digabung, pelarut diuapkan pada tekanan rendah dan
suhu 40oC menggunakan rotary evaporator sehingga diperoleh ekstrak kental.
Ekstrak kental yang diperoleh dikeringkan dengan menggunakan freeze dryer dan
kemudian ditimbang.
3.7Uji Aktivitas Antibakteri Ekstrak etanol Kulit Buah Jengkol
3.7.1 Sterilisasi Alat
Alat - alat yang digunakan dalam penelitian uji aktivitas anti bakteri ini
disterilkan terlebih dahulu sebelum digunakan. Alat - alat gelas disterilkan di dalam
oven pada suhu 170oC selama 2 jam. Media disterilkan di autokaf pada suhu 121oC
selama 15 menit. Jarum ose dan pinset disterilkan dengan bunsen burner (Lay,
1994)
3.7.2 Pembuatan Media
3.7.2.1Nutrien Agar (NA)
Nutrien agar yang digunakan bermerek dagang Difco Nutrien Agar.
Komposisi : Bacto beef extract 3,0 g
Bacto peptone 5,0 g
Bacto Agar 15,0 g
Cara Pembuatan :
Sebanyak 23 g nutrien agar yang telah jadi dilarutkan dengan air suling dan
Larutan kemudian dimasukkan ke dalam erlenmeyer, selanjutnya ditutup dengan
kapas, lalu disterilkan di autoklaf pada suhu 121°C selama 15 menit (Difco, 1977).
3.7.2.2Larutan Natrium Klorida 0,9%
Sebanyak 9 g NaCl dilarutkan dengan air suling dan dicukupkan hingga
1000 ml, kemudian disterilkan.
3.7.3 Pembuatan Suspensi Standar Mc. Farland
Suspensi Standar Mc. Farland adalah suspensi yang menunjukkan
konsentrasi kekeruhan bakteri sama dengan 108 CFU/ml.
Komposisi :
Larutan Asam sulfat 1 % 9,5 ml
Larutan Barium klorida 0,5 ml
Cara Pembuatan :
Dicampur kedua larutan tersebut dalam tabung reaksi dikocok dan dihomogenkan.
Apabila kekeruhan suspensi bakteri uji adalah sama dengan kekeruhan suspensi
standar, berarti konsentrasi suspensi bakteri adalah 108 CFU/ml ( Power, 1988).
3.7.4 Pembuatan Stok Kultur
3.7.4.1Bakteri Staphylococcus aureus ATCC 29737
Koloni bakteri Staphylococcus aureus ATCC 29737 diambil dengan
menggunakan jarum ose steril, lalu ditanamkan pada media NA agar miring dengan
cara menggores. Setelah itu diinkubasi dalam inkubator pada suhu 36±1oC selama
18-24 jam
3.7.4.2Bakteri Staphylococcus epidermidis ATCC 12228
cara menggores. Setelah itu diinkubasi dalam inkubator pada suhu 36±1oC selama
18-24 jam
3.7.4.3Bakteri Propionibacter acne ATCC 6919
Koloni bakteri Propionibacter acne ATCC 6919 diambil dengan
menggunakan jarum ose steril, lalu ditanamkan pada media NA agar miring dengan
cara menggores. Setelah itu diinkubasi dalam inkubator pada suhu 36±1oC selama
18-24 jam
3.7.5 Penyiapan Inokulum
3.7.5.1Bakteri Staphylococcus aureus ATCC 29737
Stok kultur bakteri Staphylococcus aureus ATCC 29737 yang telah tumbuh
diambil dengan jarum ose steril lalu disuspensikan ke dalam tabung yang berisi 10