VIABILITAS EMBRIO MENCIT (Mus musculus albinus) SETELAH
KRIOPRESERVASI GANDA DENGAN METODE VITRIFIKASI PADA
TAHAP PEMBELAHAN DAN BLASTOSIS
RISKA SAFTIANY
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2011
ABSTRAK
RISKA SAFTIANY. Viabilitas Embrio Mencit (Mus musculus albinus) setelah Kriopreservasi Ganda dengan Metode Vitrifikasi pada Tahap Pembelahan dan Blastosis. Dibimbing oleh TRI HERU WIDARTO dan ARIEF BOEDIONO.
Teknik pembekuan embrio saat ini berkembang pesat sejalan dengan keberhasilan teknologi rekayasa embrio. Penelitian ini bertujuan untuk mengetahui ketahanan dan daya hidup embrio mencit setelah kriopreservasi ganda pada tahap 8 sel dan blastosis dengan metode vitrifikasi. Media yang digunakan yaitu: a) media ekuilibrasi (Phosphate Buffer Saline (PBS) + 20% serum + 10% etilen glikol), b) media vitrifikasi (PBS + 20% serum + 0.5 M sukrosa + 15% etilen glikol + 15% DMSO), c) media rehidrasi (PBS + 20% serum + larutan sukrosa bertingkat (0.5M, 0.25M, 0.1M sukrosa)), dan d) media kultur in vitro G2 (Vitrolife, Swedia). Hasil yang diperoleh menunjukan bahwa viabilitas embrio yang mencapai blastosis hatched setelah vitrifikasi ganda (42.11%) tidak berbeda (P>0.05) dengan viabilitas embrio setelah vitrifikasi tunggal baik pada tahap 8 sel, mencapai blastosis hatched (52.38%) atau vitrifikasi tunggal blastosis, mencapai blastosis hatched (51.72%) dan berbeda (P<0.05) dengan kontrol 94.87% embrionya mencapai blastosis hatched.
ABSTRACT
RISKA SAFTIANY. Viability of Mice (Mus musculus albinus) Embryo after Double Vitrification at the Cleavage and Blastocysts stage. Supervised by TRI HERU WIDARTO and ARIEF BOEDIONO.
Embryo freezing technique nowadays has developed rapidly in accordance with the success of embryo engineering technology. The objective of this research was to test the endurance and the survival rate of the mice embryos after double cryopreservation of 8 cells and blastocysts stages by vitrification method. The media used for this study were: a) equilibrium media (Phosphate Buffer Saline, (PBS)) + 20% serum + 10% ethylene glycol), b) vitrification media (PBS + 20% serum + 0.5 M sucrose + 15% ethylene glycol + 15% DMSO), c) rehydration media (PBS + 20% serum + different concentration of sucrose solution (0.5M, 0.25M, 0.1M sucrose)), and d) in vitro culture media (G2, Vitrolife, Swedia). The results showed that the viability of mice embryos developed to hatched blastocysts after double vitrification (42.11%) were similar (P>0.05) to embryo viability after single vitrification of 8 cells or blastocysts stages. However, it was different (P<0.05) with the control (94.87%) of the embryo reached hatched blastocysts stages.
VIABILITAS EMBRIO MENCIT (Mus musculus albinus) SETELAH
KRIOPRESERVASI GANDA DENGAN METODE VITRIFIKASI PADA
TAHAP PEMBELAHAN DAN BLASTOSIS
RISKA SAFTIANY
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2011
Judul Skripsi : Viabilitas Embrio Mencit (Mus musculus albinus) Setelah
Kriopreservasi Ganda dengan Metode Vitrifikasi pada Tahap
Pembelahan dan Blastosis
Nama
: Riska Saftiany
NIM
: G34061506
Disetujui
Ir. Tri Heru Widarto, M,Sc Prof. drh. Arief Boediono, Ph.D, PAVet (K)
NIP: 19620513 198703 1 002 NIP: 19640305 198803 1 002
Diketahui
Dr. Ir. Ence Darmo Jaya Supena, M.Si
NIP. 19641002 198903 1 002
PRAKATA
Puji dan syukur penulis panjatkan atas segala kebesaran Allah SWT, karena atas rahmat dan karunia-Nya sehingga karya ilmiah ini dapat diselesaikan. Tema yang dipilih dalam penelitian ini adalah pembekuan embrio mencit, dengan judul Viabilitas Embrio Mencit (Mus musculus albinus) Setelah Kriopreservasi Ganda dengan Metode Vitrifikasi pada Tahap Pembelahan dan Blastosis, yang dilaksanakan sejak bulan Maret sampai Oktober 2010.
Pada kesempatan ini, penulis menyampaikan ucapan terima kasih kepada Bapak Ir. Tri Heru Widarto, M.Sc dan bapak Prof. drh. Arief Boediono, Ph.D, PAVet (K) selaku dosen pembimbing yang telah memberikan bimbingan, saran, dan kritik yang membangun sehingga karya ilmiah ini dapat diselesaikan serta Ibu Dr. Ir. Dorly. M.Si selaku dosen penguji atas saran yang membangun. Ungkapan terimakasih juga disampaikan kepada mamah dan bapak serta seluruh keluarga kami, atas cinta, pengorbanan, dukungan, kesabaran, dan doa tulusnya untuk mendukung penulis lebih giat belajar. Dzulfaqor atas cinta, dukungan dan bantuan sehingga penulis lebih semangat dalam melaksanakan penelitian dan menyelesaikan skripsi, seluruh staf dan pegawai Laboratorium Embriologi, Departemen Anatomi Farmakologi Fisiologi (AFF), FKH, IPB. Serta teman-teman Bio 43, Rani, Ka amin, Adhil, dan Vin atas dukungan dan bantuannya
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2011
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 15 September 1988 dari ayah Kusnadi dan ibu Teti Susilowati. Penulis merupakan putri kedua dari tiga bersaudara .
Tahun 2006 penulis lulus dari SMU Negeri 59 Jakarta dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) di Departemen Biologi, Fakultas Matematika Dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis menjadi anggota UKM “Gentra Kaheman” divisi tari periode 2006-2007, penulis menjadi anggota Himpunan Mahasiswa Biologi (HIMABIO) divisi Pengembangan Sumber Daya Manusia (PSDM) periode 2007-2008. Pada tahun 2008, penulis melaksanakan Studi Lapangan di Situ Gunung, Sukabumi, Jawa Barat. Pada tahun 2009, penulis melaksanakan Praktik Lapangan di Laboratorium Andrologi, Bunda International Clinic, Jakarta dengan tema “Analisa dan preparasi sperma manusia”. Pada tahun 2010 penulis menjadi asisten praktikum Perkembangan Hewan.
DAFTAR ISI
Halaman
DAFTAR TABEL ...viii
DAFTAR GAMBAR ...viii
PENDAHULUAN Latar Belakang ... 1
Tujuan Penelitian ... 2
BAHAN DAN METODE Waktu dan Tempat ... 2
Metode Penelitian ... 2
Superovulasi ... 2
Koleksi Embrio ... 2
Pembekuan dengan Metode Vitrifikasi ... 2
Penghangatan (Warming) ... 3
Rancangan Penelitian ... 3
Analisis Data ... 3
HASIL Perbandingan Viabilitas Embrio Setelah Vitrifikasi Tunggal dengan Vitrifikasi Ganda ... 3
Viabilitas Blastomer dalam Embrio Setelah Vitrifikasi pada Tahap 8 Sel ... 5
PEMBAHASAN ... 6
SIMPULAN ... 8
SARAN ... 8
DAFTAR TABEL
Halaman 1 Perbandingan viabilitas embrio mencit setelah vitrifikasi tunggal dan vitrifikasi ganda ... 5 2 Viabilitas blastomer setelah vitrifikasi pada tahap 8 sel... 5
DAFTAR GAMBAR
Halaman
1 Perkembangan embrio mencit tahap praimplantasi pada saluran reproduksi betina. ... 2 2 Teknik pemaparan embrio di atas straw 0.25ml yang telah disayat ujungnya. ... 3 3 Viabilitas embrio setelah vitrifikasi pada tahap 8 sel. ... 4 4 Viabilitas embrio setelah vitrifikasi dua kali (ganda) tahap 8 sel dan blastosis pada embrio yang sama ... 4 5 Viabilitas blastomer setelah vitrifikasi pada tahap 8 sel... 6
1
PENDAHULUAN
Latar Belakang
Tiga dekade terakhir ini perkembangan rekayasa bioteknologi embrio berkembang pesat, yang bermanfaat untuk meningkatkan kualitas hasil produk. Teknik rekayasa bioteknologi embrio yang sedang berkembang saat ini antara lain pengembangan fertilisasi in-vitro (IVF), manipulasi embrio dan transfer embrio (Madihah et al. 2006). Transfer embrio merupakan tindakan mentransfer embrio dari satu induk ke dalam rahim induk titipan (resipien). Tetapi produksi embrio dalam jumlah besar mengalami kendala yaitu terbatasnya jumlah resipien untuk menerima embrio dan lokasi ternak resipien yang jauh. Hal tersebut dapat diatasi dengan teknik pembekuan embrio.
Teknik pembekuan pada embrio (kriopreservasi) pertama kali dilaporkan oleh Whittingham (1971). Pembekuan embrio adalah proses penghentian sementara metabolisme suatu sel tanpa mematikan fungsi sel, dimana proses metabolisme sel dapat berlangsung kembali setelah pembekuan dihentikan (Boediono1995). Pembekuan embrio ini bermanfaat agar embrio dapat digunakan kembali dimasa yang akan datang (Boediono 2005).
Secara umum metode pembekuan embrio yang dilakukan saat ini adalah kriopreservasi konvensional dan vitrifikasi. Kriopreservasi konvensional merupakan proses pembekuan embrio yang disertai dengan terbentuknya kristal es pada suhu rendah menggunakan alat terprogram dan memerlukan waktu relatif lama (Mochida 2010). Sedangkan vitrifikasi merupakan teknik pembekuan embrio secara cepat pada suhu rendah (-196ºC) dengan krioprotektan konsentrasi tinggi sehingga dapat menghidari terbentuknya kristal es yang dapat mengganggu dan merusak sel saat pembekuan (Arav et al. 1993). Vitrifikasi selain dapat dilakukan satu kali juga dapat dilakukan lebih dari satu kali, yang disebut vitrifikasi ganda.
Pada vitrifikasi ganda proses pembekuan dilakukan pada embrio yang sama dan mampu hidup setelah penghangatan atau setelah periode kultur in vitro. Vitrifikasi ganda memiliki fungsi yang berkaitan dengan waktu perkembangan embrio yang sesuai untuk ditransfer terutama pada program bayi tabung pada manusia (Isachenko et al. 2003).
Krioprotektan adalah substansi (zat) kimia yang di tambahkan ke dalam larutan pembekuan dan akan mempertahankan hidup sel yang dibekukan, dapat mencegah dan mengubah kristalisasi es serta menstabilkan membran sel sehingga dapat mengurangi kerusakan sel selama proses pembekuan (Nawawi 1997). Berdasarkan sifat krioprotektan terhadap permeabilitas sel yang dibekukan, krioprotektan dikelompokkan menjadi dua yaitu: 1) krioprotektan ekstraseluler, yang tidak dapat masuk ke dalam sel dan ukuran molekul yang cukup besar contohnya sukrosa, rafinosa, protein, lipoprotein, serum, kuning telur dan PVP, 2) krioprotektan intraseluler, dapat masuk kedalam membran sel dan ukuran molekul yang lebih kecil contohnya gliserol, dimetilsulfoksida (DMSO), etilen glikol (EG), 1.2-propanadiol (PROH), dan 1.3-butanadiol.
Pembekuan embrio pertama kali yang dilakukan oleh Whittingham menggunakan embrio mencit. Mencit (Mus musculus albinus) yang memiliki ukuran tubuh kecil, termasuk ke dalam kingdom Animalia, filum Chordata, kelas Mamalia, ordo Rodentia, famili Muridae, sub-famili Murinae, genus Mus, dan spesies Mus musculus. Mencit sebagian besar digunakan sebagai hewan uji coba, sebanyak 70% mencit digunakan untuk penelitian biomedis. Karena mencit memiliki daya reproduksi tinggi, umur relatif singkat, variasi genetik cukup besar, dan siklus estrus yang pendek dengan fase siklus yang jelas.
Mencit memiliki siklus estrus yang terdiri atas proestrus, estrus, mesestrus dan diestrus. Secara umum siklus estrus terbagi menjadi a) phase folikel (fase pertumbuhan, yang ditandai dengan tingkat estrogen tinggi, dan b) fase luteal memiliki waktu yang cukup panjang ditandai dengan perkembangan corpus luteum dan kadar progesteron tinggi) sekresi FSH (Follicle stimulating hormone) terjadi secara ritmis selama 4 sampai 5 hari sebelum birahi, menjelang fase luteal berakhir konsentrasi FSH dalam plasma meningkat dan secara sinergis dengan LH (Luteinizing hormone), akan merangsang pertumbuhan folikel. Folikel akan mencapai stadium folikel tersier yang matang (Wilson 1962).
Estrus mencit terjadi pada malam hari selama 12 jam. Perkawinan mencit terjadi pada saat fase estrus. Mencit tergolong hewan multipara, mampu menghasilkan beberapa sel telur (oosit) dalam satu siklus birahi (Handayani 2006). Ovulasi pada mencit rata-rata menghasilkan 7-10 oosit melalui perkawinan normal dan mampu menghasilkan
2
20-30 embrio melalui superovulasi (Rianti 2005). Superovulasi pada dasarnya dilakukan untuk meningkatkan derajat ovulasi, sehingga dapat meningkatkan jumlah sel telur atau embrio. Superovulasi dilakukan dengan menyuntikkan hormon Preagnant Mare’s Serum Gonadotropin (PMSG) dan Human Chorionic Gonadotropin (HCG) secara bertahap. PMSG berfungsi untuk merangsang pematangan folikel, menunjang produksi estrogen, pembentukkan hormon untuk proses ovulasi, dan merangsang sintesis progesteron pada hewan yang dihipofasektomi sedangkan HCG untuk menginduksi ovulasi (Hernawan 2003).
Keberhasilan pembekuan embrio tergantung dari jenis embrio, konsentrasi krioprotektan, percepatan derajat pembekuan, pengaturan suhu selama pemaparan, pendinginan, pencairan, dan penyimpanan (Takagi et al. 1994). Embrio yang telah dibekukan dapat ditumbuhkan kembali dengan cara in vitro melalui kultur embrio maupun in vivo melalui transfer embrio. Kultur embrio dilakukan menggunakan media yang sesuai dengan kondisi asli saluran reproduksi agar embrio tetap hidup dengan baik (Lisanti 1998).
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui ketahanan dan daya hidup embrio mencit setelah kriopreservasi ganda pada tahap 8 sel dan blastosis dengan metode vitrifikasi.
BAHAN DAN METODE
Waktu dan TempatPenelitian ini dilaksanakan pada bulan Maret sampai Oktober 2010 di Laboratorium Embriologi, Departemen Anatomi, Fisiologi dan Farmakologi FKH, IPB.
Metode Superovulasi
Mencit betina yang telah dewasa kelamin (umur 8-12 minggu) sebanyak 95 ekor, disuperovulasi dengan disuntikkan hormon PMSG 5IU per ekor, 48 jam kemudian disuntik hormon HCG 5IU per ekor secara intraperitonial. Kemudian mencit betina yang telah disuntik hormon tersebut dikawinkan dengan pejantan dengan perbandingan 1:1. Pemeriksaan sumbat vagina (vaginal plug) dilakukan hari berikutnya pada pagi hari, adanya plug di vagina mencit menandakan
mencit telah kawin. Mencit betina yang telah positif kawin dipisahkan dalam kandang individu dan ditetapkan sebagai hari pertama kebuntingan mencit.
Koleksi Embrio
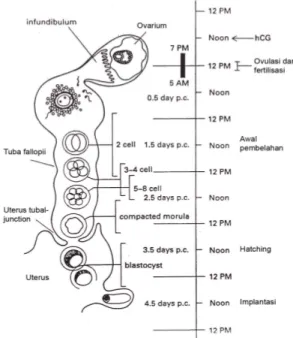
Embrio dikoleksi saat embrio berumur dua setengah hari (4-8 sel), dikoleksi dengan menoreh tuba fallopii di daerah kantung fertilisasi (Gambar 1) dan membilas uterus menggunakan media flushing berupa phosphate buffered saline (PBS) yang ditambahkan 20% serum dan selanjutnya disebut modified phosphate buffered saline (mPBS). Embrio dikoleksi secara aseptik menggunakan jarum suntik 26 Gauge yang terhubung dengan spuit 1cc. Embrio dikoleksi dibawah mikroskop stereo binokuler (Nikon SMZ-2T) dengan perbesaran 40x.
Gambar 1 Perkembangan embrio mencit tahap praimplantasi pada saluran reproduksi betina (Hogan et al. 1994).
Pembekuan dengan Metode Vitrifikasi Vitrifikasi dilakukan dua tahap yaitu vitrifikasi tunggal dan vitrifikasi ganda. Vitrifikasi tunggal dilakukan hanya pada tahap pembelahan 8 sel atau tahap blastosis saja. Sedangkan vitrifikasi ganda dilakukan dua kali pada tahap 8 sel setelah penghangatan dan kultur in vitro mencapai tahap blastosis, dilakukan vitrifikasi yang kedua pada tahap blastosis. Embrio hasil koleksi dipapar dalam medium mPBS selama 1-2 menit. Selanjutnya embrio dipapar kedalam medium ekuilibrasi
3
(PBS + 20% serum + 10% etilen glikol) selama 10-15 menit. Lalu embrio dipindahkan kedalam medium vitrifikasi (PBS + 20% serum + 0.5 M sukrosa + 15% etilen glikol + 15% DMSO) selama 30 detik, kemudian embrio diteteskan di atas straw 0.25 ml yang telah disayat ujungnya dengan medium vitrifikasi kurang dari 5µl. Terakhir straw dengan embrio diuapi nitrogen cair selama 5 detik dan langsung dimasukkan dalam nitrogen cair -196°C (Vanderzwalmen et al. 2003).
Straw 0.25ml Medium V3+ embrio
Gambar 2 Teknik pemaparan embrio di atas straw 0.25ml yang telah disayat ujungnya.
Penghangatan (Warming)
Straw berisi embrio yang telah dibekukan dianginudarakan selama 10 detik kemudian rehidrasi secara berturut-turut dalam media warming yang terdiri dari : 1) PBS + 20% serum + 0.5M sukrosa selama 1.5 menit; 2) PBS + 20% serum + 0.25M sukrosa selama 2.5 menit; dan 3) PBS + 20% serum + 0.1M sukrosa selama 7 menit. Embrio yang telah direhidrasi kemudian dikultur dalam cawan petri berisi tetesan (drop) media G2 (Vitro Life, Swedia) yang telah ditutupi minyak mineral dan diinkubasi dalam inkubator CO2 5% pada suhu 37ºC. Selanjutnya viabilitas blastomer dan embrio diamati.
Rancangan Penelitian
Penelitian ini terbagi menjadi dua kelompok perlakuan, yaitu 1) membandingkan viabilitas embrio pada setiap tahap perkembangan (8 sel, morula, dan blastosis) setelah vitrifikasi tunggal, vitrifikasi ganda dengan yang tidak divitrifikasi (kontrol), 2) Mengamati viabilitas blastomer dalam embrio yang telah di vitrifikasi pada tahap 8 sel dalam kultur in vitro.
Percobaan pertama yaitu mengamati perkembangan embrio setelah 24 jam kultur untuk mengetahui kemampuan embrio bertahan hidup setelah divitrifikasi. Hasil dari pengamatan kemudian dibandingkan antara kontrol dengan vitrifikasi pada tahap 8 sel, membandingkan antara vitrifikasi tunggal tahap blastosis dengan vitrifikasi ganda (vitrifikasi tahap 8 sel dan tahap blastosis pada embrio yang sama) pada tahap blastosis setelah vitrifikasi, dan membandingkan antara
kontrol, vitrifikasi tunggal tahap 8 sel, vitrifikasi tunggal tahap blastosis dengan vitrifikasi ganda saat tahap blastosis ekspan sampai blastosis hatched. Percobaan kedua mengamati rasio hidup dan mati blastomer dalam embrio yang telah divitrifikasi pada tahap 8 sel.
Analisis Data
Data viabilitas dan perkembangan embrio yang dihasilkan, disajikan dalam bentuk persentase. Hasil yang didapatkan diolah menggunakan rancangan acak lengkap dengan tiga kali ulangan menggunakan uji Duncan pada tingkat kepercayaan 95%.
HASIL
Perbandingan Viabilitas Embrio Setelah Vitrifikasi Tunggal dengan Vitrifikasi Ganda
Viabilitas embrio yang baik setelah vitrifikasi ditandai morfologi embrio yang sempurna yaitu masih adanya zona pellusida (ZP), plasma membran, sitoplasma, blastomer, fragmentasi < 10% (Gambar 3). Pada perlakuan vitrifikasi tunggal, perkembangan embrio secara in vitro setelah vitrifikasi tahap 8 sel mampu berkembang sebanyak 77.50% dan untuk vitrivikasi ganda pada pembekuan pertama tahap 8 sel mampu berkembang 80.00% (pada pengamatan satu jam setelah vitrifikasi).
Perbandingan perkembangan embrio yang berhasil mencapai tahap blastosis antara kontrol dengan vitrifikasi tunggal 8 sel, vitrifikasi tunggal blastosis sebelum divitrifikasi dan vitrifikasi ganda yang mencapai tahap blastosis setelah vitrifikasi pertama (tahap 8 sel) tidak berbeda nyata (P>0.05). Pada perlakuan vitrifikasi tunggal tahap blastosis embrio mampu berkembang sebanyak 82.86% tidak berbeda (P>0.05) dengan vitrifikasi ganda, embrio berkembang pada tahap blastosis sebanyak 79.17% (pada pengamatan tiga jam setelah vitrifikasi). Kecepatan berkembang embrio yang divitrifikasi lebih lambat daripada yang tidak divitrifikasi (Tabel 1).
Embrio mampu bertahan hidup setelah divitrifikasi baik vitrifikasi tunggal pada tahap 8 sel saja atau tahap blastosis saja atau vitrifikasi ganda pada embrio yang sama. Pada pengamatan 48 jam saat tahap blastosis ekspan, viabilitas embrio setelah vitrifikasi ganda mencapai 63.16% tidak berbeda (P>0.05) dengan vitrifikasi tunggal blastosis
4
zp
bl
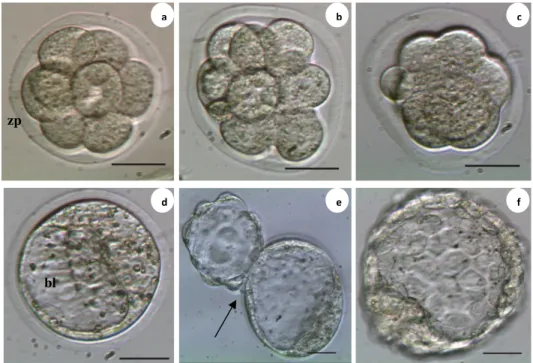
Gambar 3 Viabilitas dan perkembangan embrio setelah vitrifikasi pada tahap 8 sel: a. viabilitas embrio tahap 8 sel sebelum vitrifikasi, b. viabilitas embrio tahap 8 sel setelah vitrifikasi c. morula, d. blastosis, e. blastosis hatching , ditandai pecahnya zona pellusida (tanda panah), f. blastosis hatched; blastosul (bl), zona pellusida (zp), a-f skala: 50µm.
Gambar 4 Viabilitas embrio setelah vitrifikasi ganda tahap 8 sel dan blastosis pada embrio yang sama: a. embrio tahap 8 sel sebelum vitrifikasi, b. viabilitas embrio setelah vitrifikasi pada tahap 8 sel, c. viabilitas embrio setelah vitrifikasi ganda tahap blastosis, d. blastosis hatching, a-d skala: 50µm.
a f e d b c c b d a
5
Keterangan : - Angka dalam kurung adalah persentase jumlah embrio
- Huruf yang berbeda pada baris yang sama menunjukkan hasil yang berbeda nyata (a-b, P< 0.05)
- * Jumlah embrio setelah vitrifikasi tunggal dan vitrifikasi ganda yang berkembang mencapai tahap blastosis (79.31%), vitrifikasi tunggal 8 sel (85.71%),
dan kontrol (97.44%).
Perkembangan dan ketahanan embrio setelah vitrifikasi ganda mampu berkembang hingga tahap blastosis hatching (52.63%) tidak berbeda (P>0.05) terhadap vitrifikasi tunggal 8 sel (66.67%) dan vitrifikasi tunggal blastosis (62.06%), akan tetapi embrio hasil vitrifikasi ganda (52.63%) yang berkembang hingga tahap blastosis hatching ini berbeda nyata (P<0.05) terhadap kontrol (94.87%). Sedangkan embrio yang berkembang dan baik viabilitasnya sampai tahap blastosis hatched untuk vitrifikasi ganda (42.11%), vitrifikasi tunggal 8 sel (51.72%), dan vitrifikasi tunggal blastosis (52.38%) berbeda (P<0.05) terhadap kontrol yang mampu berkembang mencapai blastosis hatched sebanyak 94.87% (pada pengamatan 69 jam). Hal ini dapat disebabkan terjadinya penurunan tingkat perkembangan embrio setelah vitrifikasi, selain itu dapat disebabkan terbentuknya zona hardening (pengerasan zona pellusida) pada embrio yang divitrifikasi (Gambar 4, Tabel 1).
Viabilitas Blastomer dalam Embrio Setelah Vitrifikasi pada Tahap 8 Sel
Embrio dikatakan baik jika jumlah blastomer yang hidup lebih dari setengah jumlah blastomer awal sebelum embrio divitrifikasi. Dari hasil perlakuan vitrifikasi embrio tahap 8 sel, embrio dengan seluruh blastomer (8/8) yang masih hidup sebanyak 27.50%. Embrio yang telah divitrifikasi tidak semuanya memiliki blastomer yang hidup, sebanyak 7.50% embrio hanya memiliki empat blastomer hidup (Tabel 2).
Embrio yang memilki lima sampai delapan blastomer hidup setelah vitrifikasi mampu berkembang ke tahap morula sampai tahap blastosis sebanyak 67.74%. Blastomer dalam embrio hasil vitrifikasi juga dapat mengalami kerusakan (degenerasi), yang ditandai dengan bentuk blastomer tidak simetris, terdapat banyak fragmentasi, warna blastomer gelap, sitoplasma tidak ada dan blastomer lisis (Gambar 5).
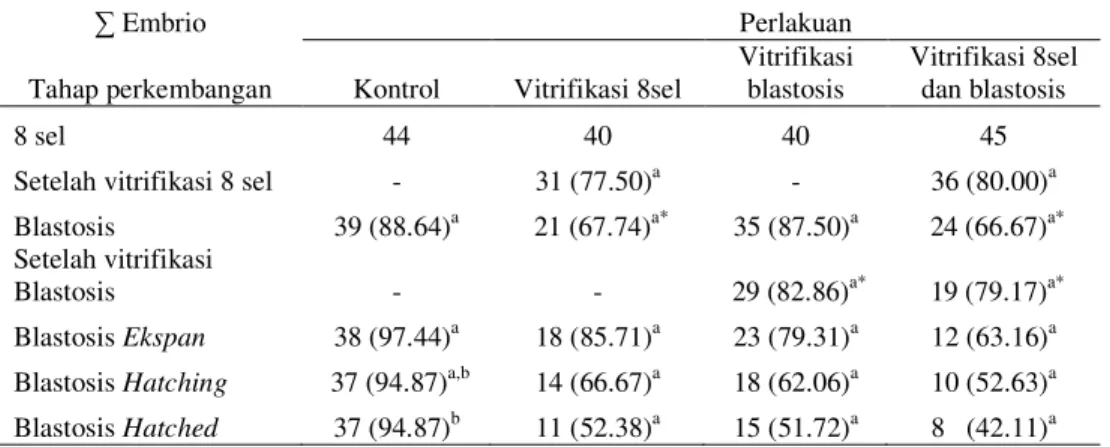
Tabel 1. Perbandingan viabilitas embrio mencit setelah vitrifikasi tunggal dan vitrifikasi ganda
∑ Embrio Perlakuan
Tahap perkembangan Kontrol Vitrifikasi 8sel
Vitrifikasi blastosis
Vitrifikasi 8sel dan blastosis
8 sel 44 40 40 45
Setelah vitrifikasi 8 sel - 31 (77.50)a - 36 (80.00)a Blastosis 39 (88.64)a 21 (67.74)a* 35 (87.50)a 24 (66.67)a* Setelah vitrifikasi
Blastosis - - 29 (82.86)a* 19 (79.17)a*
Blastosis Ekspan 38 (97.44)a 18 (85.71)a 23 (79.31)a 12 (63.16)a Blastosis Hatching 37 (94.87)a,b 14 (66.67)a 18 (62.06)a 10 (52.63)a Blastosis Hatched 37 (94.87)b 11 (52.38)a 15 (51.72)a 8 (42.11)a
Tabel 2. Viabilitas blastomer dalam embrio setelah vitrifikasi pada tahap 8 sel Jumlah embrio awal ∑ blastomer Jumlah embrio (Blastomer dalam embrio
(8/8)) hidup/total setelah vitrifikasi (%)
40 8/8 11 27.50 7/8 8 20.00 6/8 6 15.00 5/8 3 07.50 4/8 3 07.50 < 4/8 9 22.50 40 40 100.00
6
Pada vitrifikasi tahap 8 sel embrio yang mengalami degenerasi sebanyak 22.50%. Degenerasi embrio hasil vitrifikasi tahap 8 sel ditandai dengan jumlah blstomer kurang dari setengah jumlah blastomer awal sebelum embrio divitrifikasi. Dari data blastomer yang hidup, memberikan hasil yang sama dengan perkembangan embrio setelah vitrifikasi pada tahap 8 sel sebanyak 77.50% pada (Tabel 1).
blst
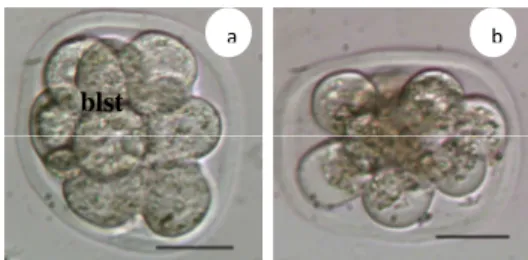
Gambar 5 Viabilitas blastomer setelah vitrifikasi pada tahap 8 sel : a. delapan blastomer hidup dari embrio tahap 8 sel, b. degenerasi (blastomer < 4/8); blastomer (blst), a-b skala: 50 µm.
PEMBAHASAN
Prinsip utama pembekuan embrio menggunakan prinsip dehidrasi, dimana air harus dikeluarkan sebanyak mungkin dari dalam sel, untuk mencegah pembentukan es selama pembekuan dan pemanasan. Karena dalam sel memiliki konsentrasi air 80%, jika dehidrasi tidak terjadi secara sempurna akan terbentuk kristal-kristal es intraseluler yang dapat merusak sel (Renard et al. 1984). Menurut Mukaida et al. (2003) pada proses vitrifikasi dan penghangatan mengalami penyesuaian terlebih dahulu terhadap media kultur, efek toksik krioprotektan, terjadi kerusakan fisik akibat pembentukan kristal es selama pembekuan, stress osmotik selama pengeluaran krioprotektan dari sel saat warming, dan kualitas embrio yang kurang baik.
Pembekuan embrio saat ini lebih banyak menggunakan metode vitifikasi karena lebih sederhana, cepat, dan ekonomis dibandingkan pembekuan konvensional (Saha et al. 1994). Pembekuan embrio menggunakan metode vitrifikasi dilakukan untuk menghindari terbentuknya kristal es saat pembekuan embrio. Kristal es yang terjadi selama pembekuan dapat menyebabkan kerusakan pada sel trofektoderm (TE) dan juga inner cell mass (ICM), penurunan jumlah mikrofili di krista mitokondria dalam sel, kehilangan integritas membran plasma, perubahan
mitokondria, pembengkakan retikulum endoplasma kasar, dan pembentukan vesikula kecil. Beberapa perubahan sel akibat kristal es dapat menyebabkan kematian sel pada embrio (Kaidi et al. 2001). Vitrifikasi banyak digunakan untuk pembekuan embrio mamalia seperti domba, sapi, murine, kuda, dan babi pada berbagai tahap perkembangan embrio termasuk tahap blastosis (Kuleshova 2002). Pada penelitian ini dilakukan vitrifikasi pada embrio mencit tahap 8 sel, tahap blastosis, serta vitrifikasi ganda tahap 8 sel dan blastosis pada embrio yang sama. Untuk vitrifikasi pada tahap 8 sel, embrio yang telah divitrifikasi tidak berbeda (P>0.05) dengan embrio yang tidak divitrifikasi (kontrol) mulai dari tahap 8 sel hingga tahap blastosis hatching, akan tetapi setelah embrio berkembang menjadi blastosis hatched hasil menunjukan berbeda nyata (P<0.05) terhadap kontrol. Dari hasil penelitian ini, embrio yang telah divitrifikasi pada tahap 8 sel dapat tumbuh secara in vitro sampai tahap blastosis sebanyak 67.74% hingga tahap blastosis hatced sebanyak 52.38% (Tabel 1), hasil penelitian ini sejalan dengan hasil penelitian sebelumnya yang dilakukan oleh Supriatna (2005), embrio yang divitrifikasi pada tahap cleavage mampu bertahan sampai tahap blastosis sebanyak 60.61% hingga tahap blastosis hatched sebanyak 21.21% menggunakan metode Hemi-straw.
Hasil pada tahap blastosis yang menunjukan berbeda nyata terhadap kontrol, disebabkan karena embrio saat tahap 8 sel (cleavage) belum memiliki sel (blastomer) yang kompak sehingga blastomer mudah mati dan lisis saat proses vitrifikasi, sehingga tidak mampu berkembang menjadi blastosis. Sel blastomer yang tidak simetris, lisis, bahkan mati dapat disebabkan oleh lamanya pemaparan dalam krioprotektan saat proses vitrifikasi, kerusakan zona pellusida, dan kualitas embrio itu sendiri. Menurut Abbeel dan Steirteghem (1999) kerusakan sel blastomer dapat dilihat baik sebelum pembekuan, setelah warming, atau setelah beberapa jam dalam kultur.
Meskipun demikian, blastomer yang masih tetap utuh dan hidup setelah vitrifikasi masih mampu berkembang membentuk sel yang kompak hingga mencapai tahap selanjutnya. Embrio dikatakan baik saat tahap 8 sel ini jika sel blastomer simetris, inti tunggal, dan fragmentasi <10% (Toukhy et al. 2003). Dari pengamatan viabilitas blastomer dalam embrio yang telah divitrifikasi pada penelitian ini, blastomer dalam embrio yang dapat
7
bertehan ≥ 50% jumlah blastomer sebelum vitrifikasi sebanyak 77.50%, ini setara dengan jumlah embrio setelah vitrifikasi tahap 8 sel. Akan tetapi embrio yang berkembang sampai tahap blastosis hanya 67.74% dan blastosis hatched 52.38%, hal tersebut disebabkan karena blastomer yang lisis dapat bersifat racun terhadap blastomer yang masih utuh, kerusakan blastomer secara signifikan mengurangi kapasitas embrio hasil vitrifikasi untuk membelah dan membentuk sel yang kompak (morula) dalam kultur in vitro. Terjadinya kerusakan zona pellusida dan blastomer dapat diatasi dengan hati-hati menggunakan prosedur vitrifikasi yang optimal, diantaranya dengan pengoptimalan proses vitrifikasi dan warming, konsentrasi krioprotektan yang sesuai, serta penggunaan mini-straw sebagai wadah penyimpanan.
Pada vitrifikasi ganda, embrio dari vitrifikasi ganda setelah tahap blastosis tidak berbeda dengan jumlah embrio dari vitrifikasi tunggal tahap 8 sel dan vitrifikasi tunggal tahap blastosis (Tabel 1). Hasil yang diperoleh pada penelitian ini tidak berbeda dengan yang dilaporkan oleh Isachenko et al. (2003) yang melakukan vitrifikasi ganda pada tahap morula dan blastosis tikus dengan survival rate blastosis awal 82.60%. Vitrifikasi ganda bermanfaat sebagai tes resistensi stres, mengetahui kualitas fungsional secara umum, dan membantu mngembangkan prosedur kriopreserfasi yang lebih baik. Manfaat dan penerapan vitrifikasi ganda yang terpenting adalah berkaitan dengan waktu perkembangan embrio yang cocok untuk ditransfer pada resipien. Pada kasus program bayi tabung manusia, bila didapatkan tiga embrio setelah warming tahap perkembangan (8 sel) dan berkembang mencapai tahap blastosis dengan kualitas yang bagus, sementara embrio transfer hanya diperlukan satu atau dua embrio, maka sisa embrio yang telah diwarming dan tidak ditransfer dapat divitrifikasi kembali agar dapat digunakan dan ditransfer dimasa datang (Isachenko et al. 2003).
Meskipun demikian, embrio hasil vitrifikasi baik satu kali atau dua kali vitrifikasi tidak semuanya berkembang dengan baik dan mecapai blastosis hatched. Hal ini karena terjadi penurunan tingkat perkembangan embrio setelah vitrifikasi, selain itu dapat disebabkan terbentuknya zona hardening (pengerasan zona pellusida) pada embrio yang divitrifikasi. Menurut Vincent et al. (1990) pengerasan zona pellusida disebabkan oleh lamanya pemaparan dalam
krioprotektan yang menyebabkan menipisnya jumlah butiran kortikal yang mendasari permukaan embrio. Pengerasan zona pellusida akibat lamanya pemaparan dapat diatasi dengan menyayat zona pellusida sehingga sel mudah keluar, dan mengurangi konsentrasi kalsium pada krioprotektan (Larman et al. 2006).
Krioprotektan dapat mempengaruhi efektifitas embrio setelah vitrifikasi, agar vitrifikasi dapat ditingkatkan efektifitasnya digunakan krioprotektan yang memiliki tingkat toksiksitas rendah dan mengkombinasikan larutan krioprotektan intraseluler dengan menambahkan larutan krioprotektan ekstraseluler. Syarat dari krioprotektan yang digunakan untuk kriopreservasi sel embrio harus tidak beracun, murah, memiliki daya preservasi tinggi, menjamin kehidupan sel dari pengaruh cold-shock, harus mempertahankan tekanan osmotik dan keseimbangan elektrolit yang sesuai, serta mampu mencegah timbulnya kuman.
Krioprotektan memiliki fungsi untuk menurunkan titik beku, mengurangi efek dehidrasi akibat konsentrasi molekul tinggi, mengikat air sehingga tekanan mekanis akibat kristal es dapat teratasi (Nawawi 1997). Krioprotektan intraseluler yang umum digunakan dalam kriopreservasi antara lain gliserol, etilen glikol (EG), dan dimetilsulfoksida (DMSO), dengan berat molekul yang relatif kecil (Saha et al. 1996), sedangkan krioprotektan ekstraseluler mempunyai berat molekul yang relatif besar misalnya sukrosa, rafinosa dan protein.
Krioprotektan ini dapat dikombinasikan untuk mengurangi efek toksik tanpa mempengaruhi viabilitas embrio setelah pembekuan. Krioprotektan yang umum digunakan untuk mamalia biasanya menggunakan etilen glikol (EG), etilen glikol telah berhasil digunakan untuk pembekuan cepat dan vitrifikasi embrio tikus tahap morula dan embrio Drosophila. Etilen glikol mampu melindungi protoplas dari dehidrasi selama vitrifikasi, mempunyai daya permeabilitas tinggi terhadap embrio, mampu melewati membran sel embrio dengan mudah selama proses pemaparan dan mudah dihilangkan selama proses pembilasan, dapat meningkatkan viabilitas embrio, mampu mereduksi pengaruh toksik, dan cepat keluar dari dalam sel sewaktu rehidrasi tanpa merusak sel (Valdez et al. 1992).
Suplementasi jenis krioprotektan yang bersifat non-permeabel seperti sukrosa dan
8
trehalose membantu kebutuhan sel-sel selama proses pembekuan, sehingga proses dehidrasi dapat berlangsung dengan baik. Proses dehidrasi yang baik tergantung dari penggunaan krioprotektan ekstraseluler (non-permeabel) yang tepat, dan penambahannya dalam larutan vitrifikasi mampu mengurangi toksiksitas. Krioprotektan ekstraseluler yang mampu mengurangi toksiksitas salah satunya adalah sukrosa, sukrosa juga berguna untuk mengatasi pembengkakan sel saat proses warming karena sukrosa mampu menghilangkan krioprotektan intraseluler selama warming (Kasai et al. 1990).
Embrio memiliki kemampuan untuk beradaptasi yang tinggi terhadap lingkungannya dengan memilih alternatif substrat energi yang tersedia dan adanya hubungan antara kebutuhan embrio dengan aktivitas genom embrio. Setelah proses warming embrio dibilas pada larutan hipertonik untuk mengeluarkan krioprotektan sebelum embrio dibilas ke medium kultur yang bersifat isotonis. Menurut Biggers dan McGinnis (2001) medium kultur yang baik digunakan untuk mendukung perkembangan embrio mulai dari tahap pembelahan sampai tahap blastosis salah satunya adalah kalium simplex optimized medium (KSOM).
Pada penelitan ini medium yang digunakan adalah medium G2 (Vitrolife, Swedia), medium G2 baik digunakan untuk mendukung perkembangan embrio mulai tahap 8 sel sampai blastosis karena memiliki kondisi yang sesuai dengan kondisi asli saluran reproduksi. Kondisi kandungan medium yang digunakan sebagai kultur yang terpenting harus memiliki fungsi menyediakan suatu penyangga (buffer) untuk mencegah perubahan pH akibat pembentukan asam laktat dari hasil metabolisme sel, sebagai sumber nutrisi yang menyediakan zat-zat makanan untuk energi bagi embrio. Keberhasilan dan efektifitas vitrifikasi dapat dipengaruhi oleh banyak variabel, diantaranya: temperatur, jenis dan konsentrasi krioprotektan, volume larutan, lama waktu pemaparan sel pada krioprotektan, pendinginan, pencairan, penyimpanan, dan kualitas sel yang digunakan sebagai sampel vitrifikasi (Cremades et al. 2004; Takagi et al. 1993).
SIMPULAN
Viabilitas embrio setelah vitrifikasi ganda tidak berbeda dengan viabilitas embrio setelah vitrifikasi tunggal baik pada tahap 8 sel atau vitrifikasi blastosis. Viabilitas blastomer
setelah vitrifikasi tahap 8 sel, blastomer masih dapat berkembang dengan baik membentuk sel yang kompak (morula).
SARAN
Perlu dilakukan penelitian lebih lanjut dengan mentransfer embrio hasil pembekun ganda ke resipien, untuk mengetahui tingkat keberhasilan implantasi embrio hasil pembekuan ganda menggunakan metode vitrifikasi.
DAFTAR PUSTAKA
Abbeel EV, Steirteghem AV. 1999. Zonapellucid damage to human embryos after cryopresrvation and consequences for their blastomere survival and in-vitro viability. Hum Reprod 15: 373-378.
Arav A, Shebu D, Mattioli M. 1993. Osmotic and cytotoxic study of vitrification of immature bovine oocytes. J Reprod 99: 353-358.
Biggers JD, Mc Ginnis LK. 2001. Evidence that glocose is not always an inhibitor of mouse preimplantation development in-vitro. Hum Reprod 16: 153-163.
Boediono A. 2005. Kriopreservasi embrio. Bogor: Konferensi Nasional II PERMI dan Temu Ilmiah FER.
Boediono A. 1995. Use of the recent animal reproduction biotechnology for improvement of animal production and quality. Inovasi 6: 26-33.
Cremades N, Sousa M, Silva J. 2004. Experimental vitrification of human compacted morulae and early blastocysts using fine diameter plastic micropipettes. Hum Reprod 19: 300-305.
Handayani N. 2006. Efektifitas Metode Cryoloop dalam Vitrifikasi Blastosis Mencit (Mus musculus albinus) [skripsi]. Bogor: Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Hernawan E. 2003. Peningkatan Kinerja Reproduksi pada Fase Kebuntingan Melalui Teknik Superovulasi pada Ternak Domba [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Hogan B, Beddington R, Costantini F, Lacy E. 1994. Manipulating the mouse embryos a laboratory manual. New York: Cold Spring Harbor Laboratory Press.
Isachenko V, Folch J. 2003. Double vitrification of rat embryos at different
9
development stages using an identical protocol. Theriogenology 60: 445-452. Kasai M, Komi JH, Takakamo A, Tsudera A,
Sakurai T. 1990. A simple method for mouse embryo cryopreservation in a low toxicity vitrification Solution without appreciable loss of viability. Reprod Fertil 89: 91-97.
Kaidi S, Bernard S, Lambert P, Massip A, Dessy F, Donnay I. Effect of conventional controlled-rate freezing and vitrification on morphology and metabolism of bovine blastocysts produced in vitro. Biol Reprod 65: 1127-1134.
Kulesova LL, Lopata A. 2002. Vitrification can be more favorable than slow cooling. Fertil Steril 78: 449-454.
Larman MG, Sheehan CB, Gardner DK. 2006. Calsium-free vitrification reduces cryoprotectant-induced zona pellucida hardening and increases fertilization rates in mouse oocytes. Reprod Fertil 131: 53-61. Lisanti E. 1998. Seplementasi Piruvat dan
Laktat dalam Medium Kultur Modifikasi M-16 Guna Meningkatkan Perkembangan Embrio Mencit (Mus musculus albinus) In-Vitro [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Madihah, Kusumaningtyas H, Boediono A, Sumarsono SH. 2006. The quality, implantation rate and in-vivo viability of the swiss webster mouse (Mus musculus albinus) embryo after vitrification. Biota 11: 72-79.
Mochida K, Ogura A, Kobayashi Y, Egawa G. 2010. Equlibrium vitrification of mouse embryos. Biol Reprod 82: 444-450.
Mukaida T, Nakamura S, Tomiyama T, Wada S, Oka C, Kasai M, Takahashi K. 2003. Vitrification of human blastocysts using cryoloops: clinical outcome of 223 cycles. Hum Reprod 18: 384-391.
Nawawi. 1997. Kriopreservasi Embrio Ikan Mas (Cyprinus corpio linn) dengan Menggunakan Krioprotektan Etilen Glikol [tesis]. Bogor. Institut Pertanian Bogor. Renard JP, Nguyen BX, Garnier V.1984.
Two-step freezing of two-cell rabbit embryos after partial dehydration at room temperature. Reprod Fertil 71: 573-580. Rianti P. 2005. Perkembangan Embrio Mencit
Tahap Pra Implantasi pada Kultur In-Vitro [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Saha S, Boediono A, Takagi M, Suzuki T. 1994. Direct rehydration of in-vitro
fertilised bovine embryos after vitrification. Vet Record 134: 276-277.
Saha S, Boediono A, Rajamahendra R. 1996. Viability of bovine blastocysts obtained after 7, 8, or 9 days of culture in-vitro following vitrification and one-step rehydration. Theriogenology 46: 331-343 Supriatna E. 2005. Viabilitas Embrio Mencit
Setelah Pembekuan Pada Berbagai Tahap Perkembangan [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Takagi M, Otoi T, Boediono A, Saha S, Suzuki T. 1993. Viability of frozen-thawed bovine IVM/IVF embryos in relation to aging using various cryoprotectants. Theriogenology 41: 915-921.
Toukhy TEI, Khalaf Y, Wharf E, Taylor A, Braude P. 2003. Cryo-thawed embryos obtained from conception cycles have double the implantation and pregnancy potential of those from unsuccesful cycles. Hum Reprod 18: 1313-1318.
Valdez CA, Mazni OA, Takahashi Y. 1992. Succesful cryopreservation of mouse blastocysts using a new vitrification solution. Reprod Fertil 96: 793-802. Vanderzwalmen P, Bertin G, Debauche CH,
Standaert V, Bollen N. 2003. Vitrification of human blastocysts with the Hemi-Straw carrier: application of assisted hatching after
thawing. Hum Reprod 18: 1504-1511. Vincent C, Pickering SJ, Johnson MH. 1990.
The hardening effect dimethylsulphoxide on the mouse zona pellucida requires the presence of an oocyte and is associated with a reduction in the number of cortical granules present. Reprod Fertil 89: 253-259.
Wilson ED, Zarrow MX. 1962. Comparison of superovulation in the immature mouse and rat. Reprod Fertil 3: 148-158.
Whittingham DG. 1971. Survival of mouse embryos after freezing and thawing. Nature (London) 233: 125-126.