EFEK PENAMBAHAN KITOSAN MOLEKUL TINGGI NANOPARTIKEL PADA ABU SEKAM PADI
NANOPARTIKEL TERHADAP
VIABILITAS SEL PULPA (In Vitro)
TESIS
Oleh
PRETTY FARIDA SINTA SILALAHI 117028004
PROGRAM STUDI MAGISTER (S2) ILMU KEDOKTERAN GIGI FAKULTAS KEDOKTERAN GIGI
UNIVERSITAS SUMATERA UTARA MEDAN
2014
EFEK PENAMBAHAN KITOSAN MOLEKUL TINGGI NANOPARTIKEL PADA ABU SEKAM PADI
NANOPARTIKEL TERHADAP
VIABILITAS SEL PULPA (In Vitro)
TESIS
Diajukan Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Magister (MDSc)
Dalam Bidang Ilmu Kedokteran Gigi
Pada Fakultas Kedokteran Gigi Universitas Sumatera Utara
Oleh
PRETTY FARIDA SINTA SILALAHI 117028004
PROGRAM STUDI MAGISTER (S2) ILMU KEDOKTERAN GIGI FAKULTAS KEDOKTERAN GIGI
UNIVERSITAS SUMATERA UTARA MEDAN
2014
Judul Proposal : EFEK PENAMBAHAN KITOSAN MOLEKUL TINGGI NANOPARTIKEL PADA ABU SEKAM PADI
NANOPARTIKEL TERHADAP VIABILITAS SEL PULPA (In Vitro).
Nama Mahasiswa : Pretty Farida Sinta Silalahi
NIM : 117028004
Program Studi : Magister (S2) Ilmu Kedokteran Gigi
Menyetujui Pembimbing :
Prof. Trimurni Abidin, drg.,M.Kes.,Sp KG(K) Prof.Dr. Harry Agusnar,MSc.,M.Phil
Ketua Program Studi, Dekan,
Dr. Ameta Primasari, drg., MDSc Prof. H. Nazruddin, drg., C. Ort., Ph.D., Sp. Ort
Tanggal Lulus : 20 Juni 2014
Telah diuji :
Pada Tanggal : 20 Juni 2014
PANITIA PENGUJI TESIS
Ketua : Prof. Trimurni Abidin, drg., M.Kes., Sp KG (K).
Anggota :1. Prof. Dr. Harry Agusnar, MSc., M.Phil.
2. Prof. Dr. Rasinta Tarigan, drg., Sp KG (K) 3. Dr. Ameta Primasari, drg., MDSc
4. Drg. Lasminda M.Kes 5. Drg. Sumadhi S, Ph.D
PERNYATAAN
EFEK PENAMBAHAN KITOSAN MOLEKUL TINGGI NANOPARTIKEL PADA ABU SEKAM PADI
NANOPARTIKEL TERHADAP
VIABILITAS SEL PULPA (In Vitro)
TESIS
Dengan ini saya menyatakan bahwa dalam tesis ini tidak terdapat karya yang pernah diajukan untuk memperoleh gelar kesarjanaan di suatu perguruan tinggi, dan sepanjang pengetahuan saya juga tidak terdapat karya atau pendapat yang pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara tertulis diacu dalam naskah ini dan disebutkan dalam daftar pustaka.
Medan, 20 Juni 2014
Pretty Farida Sinta Silalahi
DAFTAR ISTILAH
ASPn = Abu Sekam Padi Nanopartikel DMEM = Dulbecco’s Modified Eagle Medium.
FAS = Fluoro alumino silica.
FBS = Fetal Bovine Serum.
HEMA = Hydroxy-ethyl methacrylate.
HMCn = High Molecule Chitosan nanoparticle MDPC = Mouse odontoblast like cell line.
MTA = Mineral Trioxide Aggregate MTT = Methythiazol Tetrazolium Mv = Molekul volume.
PAA = Polyacrilic acid.
RHAn = Rice Husk Ash nanoparticle
RMGIC = Resin Modified Glass Ionomer Cement SIK = Semen ionomer kaca.
SIKMR = Semen ionomer kaca modifikasi resin.
TEGDMA = Triethylene glycol dimethacrylate.
ABSTRAK
Pemeliharaan jaringan pulpa yang sehat penting bagi fungsi dan vitalitas gigi.
Bahan kaping pulpa direk dan indirek yang sering digunakan untuk memelihara jaringan pulpa adalah kalsium hidroksida, Mineral Trioxide Aggregate (MTA), dan SIKMR (Semen Ionomer Kaca Modifikasi Resin). Namun bahan-bahan ini mempunyai kekurangan, seperti arsen pada MTA dan HEMA pada SIKMR.
Penelitian sebelumnya menunjukkan Kitosan Molekul Tinggi Nanopartikel (KMTn) dapat menstimulasi viabilitas sel karena mengandung glukosaminoglikan dan Abu Sekam Padi Nanopartikel (ASPn) bersifat osteoinduksi karena adanya silika (SiO2) dan kalsium hidroksida. Penggunaan kitosan berperan sebagai scaffold dan ASPn sebagai bahan hidroksiapatit. Penelitian ini bertujuan untuk melihat efek penambahan KMTn pada ASPn untuk meningkatkan viabilitas sel pulpa. Penelitian ini terdiri dari tujuh kelompok yaitu ASPn (K1), ASPn+KMTn sebelum setting (K2), ASPn+KMTn setelah setting (K3), MTA sebelum setting (K4), MTA sesudah setting (K5), SIKMR (K6), dan kelompok tanpa perlakuan (K7). Bahan-bahan uji dipaparkan pada kultur mouse dental pulp cell lines (MDPC) secara in vitro selama 1, 3, dan 7 hari.
Viabilitas sel dihitung dengan menggunakan MTT (3-[4,5-dimethylthiazol-2-yl]-2,5 diphenyltetrazoliumbromide) assay. Data diuji dengan uji ANOVA satu arah dan diikuti uji T-test dan uji Bonferroni. Uji statistik menunjukkan terdapat perbedaan bermakna antara ASPn+KMTn sebelum setting dengan MTA sebelum setting (p=0,000) dan pada kelompok ASPn+KMTn sesudah setting dengan MTA sesudah setting tidak ada perbedaan baik hari ke-1, ke-3, dan ke-7 (p> 0,05), nilai viabilitas sel pada paparan MTA sebelum dan sesudah setting lebih tinggi dibanding ASPn+KMTn sebelum dan sesudah setting, namun nilai viabilitas sel pada paparan ASPn+KMTn sebelum dan sesudah setting lebih tinggi dibanding ASPn, SIKMR, dan kontrol. Hasil penelitian menunjukkan secara in vitro terjadi peningkatan viabilitas sel MDPC dengan penambahan KMTn pada ASPn, menunjukkan bahan biomaterial uji cukup biokompatibel terhadap sel pulpa.
Kata kunci: Kitosan Molekul Tinggi nanopartikel (KMTn), scaffold, Abu Sekam Padi nanopartikel (ASPn), viabilitas sel
ABSTRACT
Maintenance of a healthy pulp tissue is important for the function and vitality of teeth. Direct and indirect pulp capping materials which is often used to maintain the pulp tissue are calcium hydroxide, Mineral Trioxide Aggregate (MTA), and RMGIC (Resin Modified Glass Ionomer Cement). However, these materials have disadvantages, such as arsenic relase in MTA and HEMA from RMGIC. Previous research indicates High Molecular Chitosan Nanoparticles (HMCn) could stimulate cell proliferation because it contains glycosaminoglycan and Rice Husk Ash Nanoparticles (RHAn) is osteoinductive because of silica (SiO2) and calcium hydroxide containt. The use of chitosan acts as a scaffold and RHAn as hydroxyapatite material. This study aims to look at the effects of adding HMCn+RHAn pulp to improve cell viability. The study consisted of six groups: RHAn (K1), RHAn + HMCn before setting (K2), RHAn + HMCn after setting (K3), MTA before setting (K4), MTA after setting (K5), RMGIC (K6) , and the untreated group (K7). Test materials were applied to cultured mouse dental pulp cell lines (MDPC) in vitro for 1, 3, and 7 days.
Cell viability was calculated using the MTT ( 3 - [4,5 - dimethylthiazol - 2 - yl ] -2,5 diphenyltetrazoliumbromide ) assay. Data were tested by One Way ANOVA followed by Bonferroni test. The statistical test showed that there were significant differences between RHAn+HMCn before setting and MTA before setting (p = 0.000) and in group RHAn +HMCn after setting and MTA after setting, there were no differences in 1st, 3rd, and 7th days (p> 0.05). Value of cell viability in group of MTA exposure before and after setting was higher than RHAn + HMCn before and after setting, but the value of cell viability in group RHAn+HMCn before and after setting was higher than RHAn, RMGIC, and control. The results of this study showed there was increase in cell viability with the addition HMCn in RHAn on MDPC, thus these materials are quite biocompatible on dental pulp cells.
Keywords: High Molecule Chitosan nanoparticle (HMCn), scaffold, Rice Husk Ash nanoparticle (RHAn), cell viability
KATA PENGANTAR
Puji dan syukur penulis ucapkan kepada Tuhan Yesus karena berkat, rahmat, karunia dan kasih sayang-Nya sehingga tesis ini telah selesai disusun sebagai salah satu syarat untuk mendapatkan gelar Magister Kedokteran Gigi pada Fakultas Kedokteran Gigi Universitas Sumatera Utara.
Dengan segala kerendahan hati, penulis ingin mengucapkan terima kasih kepada:
1. Prof. Nazruddin, drg., C.Ort., Ph.D., Sp Ort. selaku Dekan Fakultas Kedokteran Gigi Universitas Sumatera Utara.
2. Dr. Ameta Primasari, drg., MDSc., M.Kes. selaku Ketua Panitia Penguji dan Ketua Program Studi Magister Fakultas Kedokteran Gigi Universitas Sumatera Utara yang telah banyak memberikan bimbingan, masukan dan dorongan semangat kepada penulis.
3. Prof. Trimurni Abidin, drg., M.Kes., Sp.KG (K) selaku Ketua Program Studi dan pembimbing utama yang telah memberikan judul tesis ini dan banyak meluangkan waktu, memberikan tunjuk ajar, arahan, semangat serta dukungan kepada penulis sehingga tesis ini dapat selesai.
4. Prof. Harry Agusnar, M.Sc., M.Phil., selaku pembimbing kedua penulis yang telah banyak meluangkan waktu untuk membimbing, memberikan tunjuk ajar serta bimbingan, arahan dan dukungan pada penulis sehingga tesis ini dapat diselesikan dengan baik.
5. Prof. Dr. Rasinta Tarigan drg., Sp KG (K) selaku panitia penguji dan dosen Program Spesialis Ilmu Konservasi Gigi Universitas Sumatera Utara yang telah memberi dukungan, saran, dan bantuan kepada penulis..
6. Drg. Lasminda Syafiar M.Kes., selaku anggota panitia penguji dan dosen Ilmu Material Kedokteran Gigi Universitas Sumatera Utara yang telah banyak memberikan bimbingan dan masukan kepada penulis.
7. Drg. Sumadhi S, Ph.D selaku anggota panitia penguji dan dosen Ilmu Material Kedokteran Gigi Universitas Sumatera Utara yang telah banyak memberikan bimbingan dan masukan kepada penulis.
8. Prof. drg. Boy M Bachtiar, MS, Ph.D selaku staff Biologi Oral Universitas Indonesia yang telah memberikan izin dan bimbingan, serta masukan kepada penulis.
9. Drg. Endang W Bahctiar, Biomed, Ph.D selaku staff Biologi Oral Universitas Indonesia yang telah memberikan izin dan bimbingan, serta masukan kepada penulis.
10. Drg. Lisa Rinanda Amir, Ph.D selaku staff Biologi Oral Universitas Indonesia yang telah memberikan banyak bantuan kepada penulis.
11. Maysaroh S.Si dan Desi S.Si selaku staff Laboratorium Biologi Oral Universitas Indonesia atas bantuannya dalam pelaksanaan penelitian.
12. Maya Fitria, SKM., M.Kes. selaku staff Fakultas Kesehatan Masyarakat USU atas bantuannya dalam analisis statistik hasil penelitian.
Teman-teman terbaik yang penulis cintai, sahabat dalam suka duka, yang sangat mendukung, membantu, dan memberi semangat kepada penulis dalam menjalani Program Magister Kedokteran Gigi dan membantu penulis dalam menyelesaikan tesis ini. Terimakasih setulus-tulusnya buat: Dennis, kak Ponty, Henny, kak Nani, Gita, kak Yumi, dan Veronika.
Dalam penulisan tesis ini penulis ingin mengucapkan terima kasih kepada kedua orang tua tersayang, Bapak Manginar Silalahi dan Mama Minta H Hutabalian atas segala pengorbanan, doa, dukungan dan kasih sayang kepada penulis. Terima kasih kepada kakak dan abang penulis dr. Maria Uli Silalahi dan Adri Silalahi, SE, yang selalu memberikan dorongan, doa, dan semangat kepada penulis. Terima kasih kepada bapak dan ibu mertua penulis dr. Talupan Simanungkalit Sp.An dan Lili Julia Tarihoran atas kasih sayang, dukungan, dan doa buat penulis.
Terima kasih setulus-tulusnya kepada suami penulis tercinta dr. Martin Ramses Simanungkalit Sp.An, yang sangat membantu dan mendukung penulis dalam segala hal. Terima kasih atas kasih sayang, perhatiaan, doa, dukungan dan materi yang diberikan kepada penulis. Terima kasih buat putra putri tersayang Kefas Maity Simanungkalit dan Calista Maity Simanungkalit atas kasih sayang, dukungan, dan doanya bagi penulis dalam meniti karier sampai kepada jenjang magister. Tiada yang lebih penting dan berharga dalam hidup ini, selain keberadaan kalian. Terima kasih untuk kebersamaan dan keceriaan serta dorongan semangat yang luar biasa bagi mama untuk dapat menyelesaikan tugas tesis ini.
Penulis menyadari bahwa tesis ini masih terdapat banyak kekurangan, oleh karena itu, penulis memohon maaf yang sebesar-besarnya. Penulis berharap semoga tesis ini dapat bermanfaat bagi perkembangan ilmu pengetahuan dan pemecahan masalah praktis.
Medan, 20 Juni 2014 Penulis,
(Pretty Farida Sinta Silalahi) NIM: 107028004
RIWAYAT HIDUP
Keterangan Pribadi
Nama : Pretty Farida Sinta Silalahi
Alamat Tempat Tinggal : Jl. Wijaya no.17 Sukajadi, Pekanbaru-Riau Jenis Kelamin : Perempuan
Agama : Kristen Protestan
No.Kontak : 08117521282
Nama Ayah : Manginar Silalahi
Nama Ibu : Minta H Hutabalian
Pekerjaan : Dokter gigi
Pendidikan Formal
Sekolah Dasar : SD ST. Maria Pekanbaru Sekolah Menengah : SMP ST. Maria Pekanbaru Sekolah Menengah Atas : SMA ST. Maria Pekanbaru Fakultas Kedokteran Gigi : Universitas Trisakti Jakarta
Program Spesialis : Ilmu Konservasi Kedokteran Gigi Universitas Sumatera Utara Medan
Publikasi
1. Short Lecture: “ The Addition of Natural Product Rice Ash Hush with Chitosan Scaffold as Dental Cement for Dentinogenesis : A literature Riview” pada Seminar The 8th FDI-IDA Joint Meeting & Medan International Dental Exhibition, November 2012 di Medan, Indonesia.
2. Short lecture “Taurodontism with Endodontic Treatment : A Case Report” pada Seminar Ilmiah Nasional IKORGI 2013 (SINI 2013), November 2013 di Bali, Indonesia.
3. Short Lecture “Emergency Endodontic Treatment in Complex Case: A Case Report “ pada Seminar The 2nd RIAU SCIENTIFIC – EXPO, April 2013 di Pekanbaru, Indonesia.
4. Poster: “Direct Composite Veneer Techniques to Correct the Midline Shifting Caused by Failured Orthodontic Treatment: A Case Report” Medan Esthetic Dentistry II, Februari 2014 di Medan, Indonesia.
DAFTAR ISI
Halaman
DAFTAR ISTILAH ... i
ABSTRAK ... ii
ABSTRACT ... iii
KATA PENGANTAR ... iv
RIWAYAT HIDUP ... viii
DAFTAR ISI ... x
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xvi
BAB 1. PENDAHULUAN ... 1
1.1. Latar Belakang... 1
1.2. Rumusan Masalah ... 7
1.3. Tujuan Penelitian ... 7
1.4. Manfaat Penelitian ... 8
BAB 2. .TINJAUAN PUSTAKA ... 10
2.1 Regenerasi Pulpodentinal Kompleks ... 13
2.2 Efek Bahan Restorasi terhadap Jaringan Pulpodentinal Kompleks ... 16
2.2.1 Mineral Trioxide Aggregate ... 16
2.2.2 Semen Ionomer Kaca Modifikasi Resin (SIKMR) ... 19
2.2.3 Abu Sekam Padi Nanopartikel (ASPn) ... 20
2.2.4 Kitosan Molekul Tinggi Nanopartikel (KMTn) ... 24
2.3 Mekanisme Pertahanan Pulpodentinal Kompleks ... 29
2.3.1 Reaktifitas Odontoblas ... 29
2.3.2 Matriks Metaloprotein ... 30
2.4 Uji Biokompatibilitas ... 31
2.5 Viabilitas Sel sebagai Indikator Sitotoksisitas ... 33
2.6 Landasan Teori ... 35
2.7 Kerangka Konsep ... 38
2.8 Hipotesis Penelitian ... 38
BAB 3. METODE PENELITIAN... 39
3.1 Desain Penelitian ... 39
3.2 Tempat dan Waktu ... 39
3.3 Sampel dan Besar Sampel Penelitian ... 39
3.3.1. Sampel Penelitian ... 39
3.3.2. Besar Sampel Penelitian ... 40
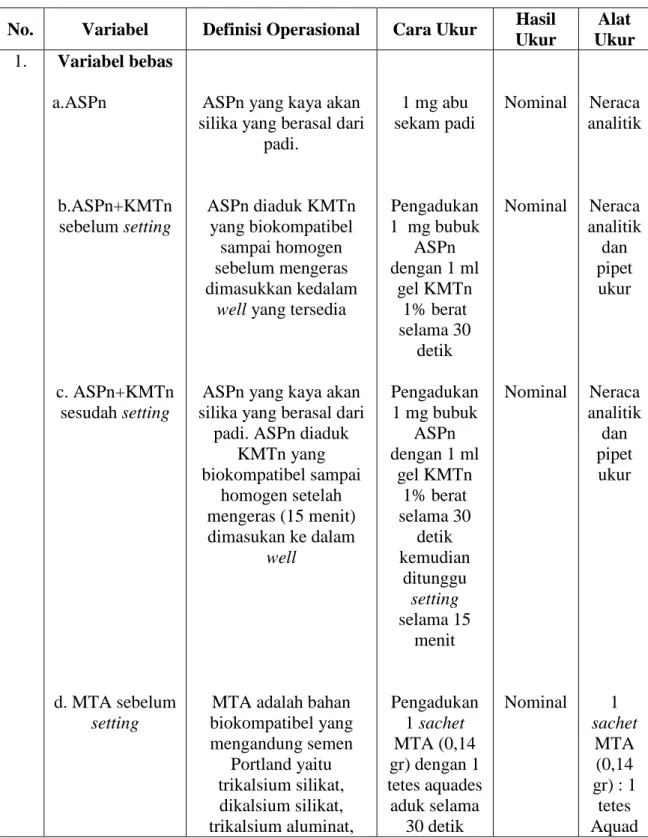
3.4 Variabel dan Definisi Operasional ... 41
3.4.1 Variabel Penelitian ... 41
3.4.1.1 Variabel Bebas ... 41
3.4.1.2 Variabel Terikat ... 41
3.4.1.3 Variabel Terkendali ... 41
3.4.1.4 Variabel Tidak Terkendali ... 42
3.4.2 Definisi Operasional ... 42
3.5 Alat dan Bahan Penelitian ... 45
3.5.1 Alat Penelitian ... 45
3.5.2 Bahan Penelitian ... 46
3.6 Prosedur Penelitian ... 48
3.6.1 Pembuatan Bubuk Abu Sekam Padi Nanopartikel ... 48
3.6.2 Pembuatan Gel Kitosan ... 49
3.6.3 Persiapan Mould Cetakan SIKMR ... 50
3.6.4 Pembuatan Bahan Uji ... 51
3.6.5 Sterilisasi Bahan Uji ... 52
3.6.6 Pembuatan Medium Kultur Lengkap ... 52
3.6.7 Kultur Sel... 52
3.6.8 Pengaplikasian Bahan ... 53
3.6.9 Uji Viabilitas Sel dengan MTT assay ... 54
3.7 Analisis Statistik ... 55
BAB 4 HASIL PENELITIAN ... 56
4.1 Pertumbuhan Sel-Sel Pulpa Gigi (MDPC) ... 57
4.2 Viabilitas Sel pada ASPn, ASPn Sebelum dan Sesudah Setting, Kontrol selama 1, 3, dan 7 Hari ... 58
4.3 Viabilitas Sel pada ASPn Sebelum dan Sesudah Setting, selama 1, 3, dan 7 Hari 60 4.4 Viabilitas Sel pada MTA Sebelum dan Sesudah Setting Selama 1, 3 dan 7 Hari ... 61
4.5 Viabiliti Sel pada Paparan ASPn+KMTn Sebelum Setting Vs MTA Sebelum Setting dan Perbedaan ASPn+KMTn Sesudah Setting Vs MTA Sesudah Setting Selama 1, 3, dan 7 Hari ... 62
4.6 . Viabilitas Sel antar Kelompok Sampel selama 1, 3 dan 7 Hari ... 62
BAB 5. PEMBAHASAN ... 65
5.1 Perbedaan Viabilitas sel ASPn, ASPn sebelum dan sesudah setting, selama 1, 3, dan 7 hari ... 67
5.2 Viabilitas sel pada ASPn + KMTn sebelum setting dengan ASPn + KMTn setelah setting selama 1, 3, dan 7 hari ... 69
5.3 Viabilitas Sel pada MTA Sebelum dan Sesudah Setting Selama selama 1 Hari, 3 Hari, dan 7 Hari... 70 5.4 Viabilitas Sel pada ASPn + KMTn sebelum dan sesudah setting,
MTA Sebelum dan Sesudah Setting, SIKMR Selama 1, 3, dan, 7
Hari ... 71
BAB 6. KESIMPULAN DAN SARAN ... 78
6.1 Kesimpulan ... 78
6.2 Saran ... 79
DAFTAR PUSTAKA ... 81
DAFTAR TABEL
No Judul Halaman
2.1 Pengaruh Sisa Ketebalan Dentin terhadap Kelangsungan Hidup Sel Odontoblas, Aktifitas Dentin Reaksioner, dan Inflamasi Pulpa ... 15 3.1 Definisi Operasional, Cara, Hasil, dan Alat Ukur dari Variabel Bebas dan
Tergantung dari Penelitian ... 43 4.1 Nilai Viabilitas Sel dan Perbedaan ASPn dengan ASPn+KMTn Sebelum
Setting Selama 1, 3 dan 7 Hari dengan Uji T-Test ... 58 4.2 Nilai Viabilitas Sel dan Perbedaan ASPn dengan ASPn+KMTn Sesudah
Setting Selama 1, 3 dan 7 hari dengan uji T-Test... 59 4.3 Nilai Viabilitas Sel dan Perbedaan ASPn+KMTn Sebelum dengan
Sesudah Setting selama 1, 3, dan 7 Hari dengan Uji Bonferroni... 60 4.4 Nilai Viabilitas Sel dan Perbedaan MTA Sebelum dengan Setelah Setting
Selama 1, 3 dan 7 Hari ... 61 4.5
4.6
Perbedaan ASPn+KMTn Sebelum dan Sesudah Setting dengan MTA Sebelum dan Sesudah Setting Melalui Uji Bonferroni...
Nilai Viabilitas Sel selama 1, 3, dan 7 Hari pada Semua Kelompok Uji...
62
63 4.7 Perbedaan Viabilitas Sel yang Dipaparkan Bahan Uji pada Kultur Sel
selama 1, 3, dan 7 Hari dengan Uji Bonferroni... 64
DAFTAR GAMBAR
No. Judul Halaman
2.1 Respon Odontoblas terhadap Stimulasi Patologis. ... 12
2.2 Dinamika Pembentukan Jaringan Keras oleh Pulpa Sebagai Respon Terhadap Stimulus Eksternal pada Berbagai Kedalaman Dentin ... 15
2.3 Lapisan Abu Sekam Padi ... 21
2.4 Hasil XRD Campuran Abu Sekam Padi Nanopartikel dengan Kitosan Molekul Tinggi Nanopartikel ... 23
2.5 2.6 Tag Like Structure ASPn+KMTn dengan Uji SEM... Kitosan Molekul Tinggi ... 24 25
2.7 Kombinasi Tiga Elemen yang Memungkinkan Terjadinya Regenerasi Jaringan atau Organ ... 28
2.8 Hipotesa Efek Matriks Protein Dentin yang Dilarutkan oleh Karies atau Bahan Kedokteran Gigi pada Odontoblas dan Sel Lain... 30
3.1 Bahan-bahan Penelitian; (a) ASP; (b) Gel KMTn; (c) MTA; (d) Vitre Bond 3M ESPE ... 48
\3.2 Alat ASP untuk menjadi Nanoparikel (a). Grinding Jar; (b). Planetary Ball Mills (PM 200) ... 49
3.3 Proses Pembuatan Gel Kitosan Nanopartikel ... 50
3.4 Syringe Insulin ... 50
3.5 Mould Tempat Pencetakan SIKMR ... 51
3.6 Neraca Analitik ... 51
3.7 (a) Perlakuan pada Tiap Bahan Uji; (b) Bahan Uji dalam 96 Well ... 54
3.8 (a) Viabilitas Sel Dibaca Melalui Komputerisasi; (b) MicroplateReader .. 55
4.1 Gambar Pertumbuhan MDPC... 57
4.2 Grafik Nilai Viabilitas Sel pada ASPn, ASPn+KMTn Sebelum Setting
(K1) dan Kontrol (K6) Selama 1, 3,dan 7 Hari ... 58 4.3 Grafik Nilai Viabilitas Sel pada ASPn, ASPn+KMTn Setelah Setting
(K2) dan Kontrol (K6) Selama 1, 3,dan 7 Hari ... 59 4.4 Grafik nilai viabilitas sel pada ASPn+KMTn Sebelum dan Setelah
Setting Selama 1, 3,dan 7 Hari 60
4.5
4.6
Grafik Nilai Viabiltas Sel pada Kelompok MTA Sebelum (K4) dan
Sesudah Setting (K5) selama 1, 3, dan 7 Hari ...
Rerata Nilai Viabilitas Sel pada semua kempok uji selama 1, 3, dan 7 hari...
61
63
DAFTAR LAMPIRAN
No. Judul Halaman
1 Alur Penelitian ... 87 2
3
4
5
6 7
Surat Keterangan Ethical Clearance ...
Surat Permohonan Izin di Laboratorium Biologi Oral FKG
Universitas Indonesia...
Surat Keterangan Selesai Melakukan Penelitian di Laboratorium Biologi Oral FKG Universitas Indonesia ...
Surat Keterangan Melakukan Penelitian di Laboratorium F-MIPA USU...
Hasil Uji Statistik...
Gambaran Mikroskopik Viabilitas Sel pada Setiap Kelompok...
88
89
90 91
92 111
ABSTRAK
Pemeliharaan jaringan pulpa yang sehat penting bagi fungsi dan vitalitas gigi.
Bahan kaping pulpa direk dan indirek yang sering digunakan untuk memelihara jaringan pulpa adalah kalsium hidroksida, Mineral Trioxide Aggregate (MTA), dan SIKMR (Semen Ionomer Kaca Modifikasi Resin). Namun bahan-bahan ini mempunyai kekurangan, seperti arsen pada MTA dan HEMA pada SIKMR.
Penelitian sebelumnya menunjukkan Kitosan Molekul Tinggi Nanopartikel (KMTn) dapat menstimulasi viabilitas sel karena mengandung glukosaminoglikan dan Abu Sekam Padi Nanopartikel (ASPn) bersifat osteoinduksi karena adanya silika (SiO2) dan kalsium hidroksida. Penggunaan kitosan berperan sebagai scaffold dan ASPn sebagai bahan hidroksiapatit. Penelitian ini bertujuan untuk melihat efek penambahan KMTn pada ASPn untuk meningkatkan viabilitas sel pulpa. Penelitian ini terdiri dari tujuh kelompok yaitu ASPn (K1), ASPn+KMTn sebelum setting (K2), ASPn+KMTn setelah setting (K3), MTA sebelum setting (K4), MTA sesudah setting (K5), SIKMR (K6), dan kelompok tanpa perlakuan (K7). Bahan-bahan uji dipaparkan pada kultur mouse dental pulp cell lines (MDPC) secara in vitro selama 1, 3, dan 7 hari.
Viabilitas sel dihitung dengan menggunakan MTT (3-[4,5-dimethylthiazol-2-yl]-2,5 diphenyltetrazoliumbromide) assay. Data diuji dengan uji ANOVA satu arah dan diikuti uji T-test dan uji Bonferroni. Uji statistik menunjukkan terdapat perbedaan bermakna antara ASPn+KMTn sebelum setting dengan MTA sebelum setting (p=0,000) dan pada kelompok ASPn+KMTn sesudah setting dengan MTA sesudah setting tidak ada perbedaan baik hari ke-1, ke-3, dan ke-7 (p> 0,05), nilai viabilitas sel pada paparan MTA sebelum dan sesudah setting lebih tinggi dibanding ASPn+KMTn sebelum dan sesudah setting, namun nilai viabilitas sel pada paparan ASPn+KMTn sebelum dan sesudah setting lebih tinggi dibanding ASPn, SIKMR, dan kontrol. Hasil penelitian menunjukkan secara in vitro terjadi peningkatan viabilitas sel MDPC dengan penambahan KMTn pada ASPn, menunjukkan bahan biomaterial uji cukup biokompatibel terhadap sel pulpa.
Kata kunci: Kitosan Molekul Tinggi nanopartikel (KMTn), scaffold, Abu Sekam Padi nanopartikel (ASPn), viabilitas sel
ABSTRACT
Maintenance of a healthy pulp tissue is important for the function and vitality of teeth. Direct and indirect pulp capping materials which is often used to maintain the pulp tissue are calcium hydroxide, Mineral Trioxide Aggregate (MTA), and RMGIC (Resin Modified Glass Ionomer Cement). However, these materials have disadvantages, such as arsenic relase in MTA and HEMA from RMGIC. Previous research indicates High Molecular Chitosan Nanoparticles (HMCn) could stimulate cell proliferation because it contains glycosaminoglycan and Rice Husk Ash Nanoparticles (RHAn) is osteoinductive because of silica (SiO2) and calcium hydroxide containt. The use of chitosan acts as a scaffold and RHAn as hydroxyapatite material. This study aims to look at the effects of adding HMCn+RHAn pulp to improve cell viability. The study consisted of six groups: RHAn (K1), RHAn + HMCn before setting (K2), RHAn + HMCn after setting (K3), MTA before setting (K4), MTA after setting (K5), RMGIC (K6) , and the untreated group (K7). Test materials were applied to cultured mouse dental pulp cell lines (MDPC) in vitro for 1, 3, and 7 days.
Cell viability was calculated using the MTT ( 3 - [4,5 - dimethylthiazol - 2 - yl ] -2,5 diphenyltetrazoliumbromide ) assay. Data were tested by One Way ANOVA followed by Bonferroni test. The statistical test showed that there were significant differences between RHAn+HMCn before setting and MTA before setting (p = 0.000) and in group RHAn +HMCn after setting and MTA after setting, there were no differences in 1st, 3rd, and 7th days (p> 0.05). Value of cell viability in group of MTA exposure before and after setting was higher than RHAn + HMCn before and after setting, but the value of cell viability in group RHAn+HMCn before and after setting was higher than RHAn, RMGIC, and control. The results of this study showed there was increase in cell viability with the addition HMCn in RHAn on MDPC, thus these materials are quite biocompatible on dental pulp cells.
Keywords: High Molecule Chitosan nanoparticle (HMCn), scaffold, Rice Husk Ash nanoparticle (RHAn), cell viability
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Proses karies gigi dapat dicegah dengan menggunakan bahan-bahan restorasi.
Perkembangan bahan restorasi terus berlanjut menghasilkan bahan-bahan kedokteran gigi yang beragam dengan sifat fisis dan mekanis yang meningkat serta biokompatibel untuk digunakan dalam aplikasi klinis. Penelitian in vitro telah menunjukkan bahwa penempatan bahan restorasi dalam dentin berpotensi toksik sehingga dapat merusak pulpa oleh karena itu biokompatibilitas bahan restorasi merupakan hal yang penting agar dapat digunakan dalam dunia kedokteran gigi.
(Dahl, Orstavik, 2010).
Perkembangan ilmu dan teknologi dalam kedokteran gigi harus tetap terjaga mutunya bahkan dapat ditingkatkan untuk memberikan pelayanan kesehatan gigi dan mulut, khususnya dalam perawatan konservasi gigi. Perawatan konservasi gigi bertujuan untuk mempertahankan gigi selama mungkin dalam kedudukannya agar dapat berfungsi lebih lama. Tujuan ini dapat dicapai dengan merawat jaringan keras atau jaringan lunak gigi sehingga struktur gigi normal kembali atau paling tidak mendekati normal (Hargreaves, Cohen, 2011).
Pemeliharaan jaringan pulpa yang sehat penting bagi fungsi dan kelangsungan gigi. Pada saat ini perawatan kerusakan gigi lebih diarahkan dengan mengutamakan aspek preventif. Mempertahankan jaringan pulpa tetap vital
merupakan hal yang paling utama harus dilakukan oleh dokter gigi, dengan melakukan restorasi dan membentuk atau memperbaiki kerusakan gigi (Smith dkk., 2003).
Produksi dentin sekunder dan tersier berguna untuk melindungi gigi dan rahang dari infeksi, karies dan terpaparnya dentin. Ketebalan dentin yang tersisa menentukan respon perbaikan pulpa setelah perawatan restoratif. Pengurangan ketebalan dentin cenderung mengurangi jumlah odontoblas di dasar kavitas. Beberapa peneliti telah melaporkan bahwa keparahan peradangan pulpa meningkat sebagai respon terhadap menipisnya dentin (Hebling dkk., 1999). Pulpitis dapat merusak populasi sel pulpa, dan berkaitan dengan hipersensitivitas dan nekrosis, dengan demikian penting untuk memahami efek ketebalan dentin terhadap penempatan bahan retorasi pada kavitas gigi (Murray dkk., 2002).
Khususnya di bidang konservasi gigi dalam mempertahankan jaringan pulpa tetap vital, dibutuhkan bahan-bahan seperti kalsium hidroksida, Mineral Trioxide Aggregate (MTA), dan Semen Ionomer Kaca Modifikasi Resin (SIKMR). Sampai saat ini kalsium hidroksida dan MTA masih merupakan bahan gold standard walaupun kalsium hidroksida lebih ekonomis dan banyak beredar, tetapi hasil akhir yang diharapkan tidak sebaik dibandingkan menggunakan MTA. MTA merupakan bahan kaping pulpa non biologi yang terbukti telah menjadi salah satu bahan yang serba guna dan biokompatibel pada saat ini, memiliki sifat fisik yang lebih baik dalam hal sealing ability dan biokompatibilitasnya dibandingkan dengan bahan lainnya seperti kalsium hidroksida (Queireoz dkk., 2005).
Mekanisme kerja MTA, pada saat sebelum dan sesudah mengeras/ setting terjadi pelepasan ion yang paling dominan adalah kalsium (Ca). Pelepasan Ca menyebabkan deposit kristalin pada permukaan MTA yang menginisiasi presipitasi hidroksiapatit. Proses hidrasi MTA adalah kalsium hidroksida (Ca(OH)2) yang dapat menstimulasi penyembuhan secara biologi membentuk jaringan fibrous maupun jaringan keras (Rao dkk., 2009). Namun menurut penelitian Bramante dkk., 2008 menunjukkan terdapatnya sedikit kandungan arsen pada MTA.
SIKMR dirancang untuk dapat menghasilkan sifat fisis seperti resin komposit dengan tetap mempertahankan sifat dasar dari SIK konvensional. Bila dibandingkan dengan SIK konvensional, semen ionomer kaca modifikasi resin memiliki waktu kerja yang lebih lama, pengerasan yang cepat, estetis serta translusensi dan kekuatan yang baik (Lohbauer, 2010). SIKMR berpolimerisasi dengan menggunakan penyinaran yang kemudian diikuti reaksi asam basa. Penelitian yang dilakukan Ghavamnasiri dkk., 2005 menyatakan bahwa SIKMR tidak menyebabkan sitotoksis pada sel pulpa. Selain itu, SIK hanya menyebabkan reaksi pada sel odontoblas dalam hal pembentukan dentin. Berbeda dengan penelitian lain menyatakan bahwa resin adhesif seperti resin komposit, kompomer, SIKMR dapat menyebabkan sitotoksisitas pada sel pulpa dan terhambatnya regenerasi dentin. Hal ini disebabkan karena pada dentin bahan bonding terdapat kandungan triethylene glycol dimethacrylate (TEGDMA) atau 2-hydroxy-ethyl methacrylate (HEMA). Bahkan setelah polimerisasi, sejumlah monomer sisa yang dilepaskan dari bahan berbasis resin dapat
menimbulkan kerusakan pada populasi sel di sekitarnya dan bersifat mutagenik (Tyas, 2006).
Penggunaan produk-produk alam dibidang kedokteran gigi saat ini semakin berkembang, Indonesia kaya dengan bahan alam seperti abu sekam padi dan kitosan.
Abu sekam padi (ASP) merupakan produk samping yang melimpah dari hasil penggilingan padi, dan selama ini masih mempunyai nilai ekonomis yang masih rendah dan dapat menimbulkan pencemaran lingkungan, sedangkan kandungan silikanya tinggi. Berdasarkan penelitian Indahyani dkk., 2011 mengatakan bahwa silika yang berasal dari ASP ini terbukti mempunyai sifat osteoinduktif yang mampu menyebabkan terjadinya proliferasi sel osteoblast dan mempunyai nilai absorbansi yang paling tinggi.
Aplikasi teknologi nano dibidang kedokteran gigi mulai digunakan. ASP dan kitosan nanopartikel dibuat dengan pedoman bahwapada prinsip rekayasa jaringan, ukuran partikel material dapat mempengaruhi efek biologi, yaitu makin kecil ukuran partikel, makin luas permukaannya, sehingga makin meningkat pula interaksi material dan jaringan sekitarnya (Fan Y, 2008 dan Kong Y, 2007 cit Suprastiwi, 2011).
Untuk memudahkan aplikasi ASP, maka bahan ini dapat dikombinasikan dengan kitosan sebagai perancah/ scaffold dimana kitosan [2-amino-2-deoxy-D- glucan] merupakan salah satu biomaterial yang memiliki banyak sifat istimewa.
Trimurni dkk., 2007 mengatakan bahwa kitosan blangkas dan kitosan komersil mampu menstimulasi pembentukan dentin reparatif dan jumlah sel-sel
inflamasi yang lebih sedikit dibandingkan dengan kalsium hidroksida sebagai kontrol.
Berdasarkan beberapa pernyataan bahwa dengan beberapa sifat istimewa dari kitosan, maka kitosan dimodifikasi dengan bahan lain dapat digunakan untuk aplikasi klinis sebagai biomaterial (Trimurni dkk., 2007). Berdasarkan Siregar, 2009 mengatakan penggunaan kitosan nanopartikel sangat baik, karena kitosan nanopartikel dapat meningkatkan luas permukaan sampai ratusan kali dibandingkan dengan partikel yang berukuran mikrometer, sehingga dapat meningkatkan efektifitas kitosan dalam hal mengikat gugus kimia lainnya, dan menurut Ningsih (2010), mengatakan bahwa kitosan nano juga dapat meningkatkan efisiensi proses fisika-kimia pada permukaan kitosan tersebut karena memungkinkan interaksi pada permukaan yang lebih besar.
Dari pernyataan-pernyataan tersebut terbukti bahwa ASP dan kitosan mempunyai sifat biomaterial, maka timbul pemikiran untuk mempelajari bahan ini yang akan dijadikan alternatif bahan pengganti MTA dan SIKMR sebagai kaping pulpa. Kitosan yang digunakan dalam penelitian ini adalah kitosan molekul tinggi nanopartikel (KMTn) dengan abu sekam padi nanopartikel (ASPn).
ASPn+KMTn belum boleh dipergunakan di dalam mulut sebagai bahan biomaterial, karena masih diperlukan banyak penelitian terutama mengenai keamanannya bila digunakan di dalam tubuh. Menurut evaluasi keselamatan khusus FDA (Food and Drug Administration) dan ISO (International Organization for Standardization) 1993 untuk bahan yang digunakan secara permanen atau lebih dari 30 hari di dalam tubuh, penelitian yang diperlukan terhadap bahan tersebut di
antaranya adalah sitotoksisitas, genotoksisitas, dan karsinogenitas (Assesing Biocompatibility, 2008 cit Diana, 2008).
Penggunaan sel pulpa untuk penelitian biokompatibitas suatu bahan kedokteran gigi, masih sangat jarang dilakukan terutama di Indonesia. Hal ini disebabkan karena faktor metoda kultur yang sulit, mudah terkontaminasi, ketidakstabilan genetik dan fenotip serta relatif lebih mahal (Freshney, 2000). Salah satu tes sitotoksisitas yang sering digunakan untuk menguji viabilitas sel adalah 3- (4,5-dimethythiazol-2-yl)-2,5-diphenyl tetrazoliun bromide (MTT) assay. Viabilitas sel adalah kemampuan sel untuk dapat bertahan hidup. Viabilitas sel menunjukkan adanya respon sel jangka pendek atau segera, seperti perubahan permeabilitas membran atau gangguan pada jalur metabolisme tertentu. Oleh karena itu, viabilitas sel dapat menjadi tanda sitotoksisitas suatu bahan (Camilleri, 2006).
Berdasarkan hal tersebut di atas, maka peneliti tertarik untuk menguji biokompatibilitas ASPn+KMTn sebelum dan sesudah setting dengan melihat efek toksiknya terhadap sel-sel pulpa, dan karena hal tersebut merupakan salah satu faktor yang menentukan suatu bahan dapat digunakan di dalam mulut. Efek toksik ditentukan berdasarkan viabilitas sel yang diukur dengan MTT assay. Sedangkan yang digunakan sebagai model sel adalah mouse dental pulp cell (MDPC).
1.2 Rumusan Masalah
Berdasarkan uraian tersebut, tema sentral penelitian ini adalah:
- Abu sekam padi merupakan bahan hidroksiapatit dengan kalisium hidroksida dan silika potensial yang dapat menyebabkan proliferasi sel odontoblas dan bersifat biokompatibel.
- Kitosan merupakan bahan biokompatibel yang terbukti dapat merangsang pembentukan dentin reparatif.
- Bahan biomaterial yang dapat merangsang proliferasi sel adalah biomaterial yang mempunyai sifat biokompatibel, biodegradable, dan bioaktivasi yang baik.
Oleh karena itu, masalah yang akan diteliti dalam penelitian ini adalah:
1. Apakah ASPn+KMTn dapat menstimulasi viabilitas sel sel MDPC?
2. Apakah terdapat perbedaan viabilitas sel MDPC pada pemaparan ASPn, ASPn+KMTn sebelum dan sesudah setting, MTA sebelum dan sesudah setting serta SIKMR?
1.3 Tujuan Penelitian Tujuan Umum
Mengetahui efek penambahan KMTn pada ASPn terhadap viabilitas sel pulpa secara in vitro dalam menginduksi proliferasi sel MDPC.
Tujuan Khusus
1. Mengetahui efek penambahan KMTn pada ASPn sebelum dan sesudah setting terhadap viabilitas sel pulpa secara in vitro.
2. Membandingkan efek penambahan KMTn pada ASPn sebelum dan sesudah setting dengan ASPn terhadap viabilitas sel pulpa secara in vitro.
3. Membandingkan efek penambahan KMTn pada ASPn sebelum dan sesudah setting dengan MTA sebelum dan sesudah setting terhadap viabilitas sel pulpa secara in vitro.
4. Membandingkan efek penambahan KMTn pada ASPn sebelum dan sesudah setting dengan SIKMR terhadap viabilitas sel pulpa secara in vitro.
5. Membandingkan efek penambahan KMTn pada ASPn sebelum dan sesudah setting dengan kontrol terhadap viabilitas sel pulpa secara in vitro.
1.4 Manfaat Penelitian
1. Secara teoritis, hasil penelitian ini akan memberikan pemahaman mengenai manfaat biomaterial yang merupakan gabungan abu sekam padi nanopartikel dengan kitosan molekul tinggi nanopartikel dalam viabilitas sel pulpa dan menambah data ilmiah mengenai bahan biomaterial yang merupakan gabungan abu sekam padi nanopartikel dengan kitosan molekul tinggi nanopartikel bagi perkembangan ilmu pengetahuan dalam khususnya bidang konservasi.
2. Secara metodologis, hasil penelitian ini dapat menjelaskan mekanisme ASPn+KMTn sebagai biomaterial yang cukup biokompatibel terhadap viabilitas sel.
3. Secara aplikatif, hasil penelitian ini didapatkan suatu biomaterial baru yang ekonomis dan diperoleh dari limbah alam di Indonesia yaitu ASPn+KMTn sehingga biomaterial ini dapat digunakan dalam bidang konservasi dalam mempertahankan jaringan pulpodentinal kompleks.
BAB 2
TINJAUAN PUSTAKA
Kerusakan gigi dapat berupa karies, keausan, trauma, penyakit periodontal, dan tindakan iatrogenik yang dapat menyebabkan terbukanya tubulus dentin terhadap mikroorganisme. Kerusakan gigi yang mencapai lebih dari setengah dentin atau bahkan telah mencapai pulpa dikategorikan sebagai karies profunda. Pulpa merupakan jaringan ikat yang memberi respon terhadap stimulus. Peradangan pulpa terdiri dari pulpitis reversibel dan pulpitis irreversibel. Pulpitis reversibel merupakan proses inflamasi ringan yang apabila penyebabnya dihilangkan maka inflamasi dapat hilang dan pulpa akan kembali normal sedangkan pulpitis irreversibel merupakan inflamasi yang tidak akan bisa pulih sendiri kecuali diberi bahan-bahan dentinogenesis (Murray dkk., 2002).
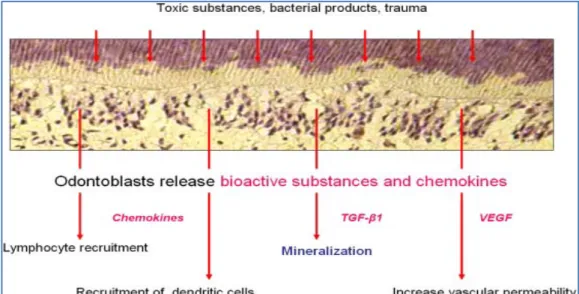
Peradangan pulpa mengalami neurogenik inflamasi, dimana serabut saraf afferent distimulasi oleh berbagai iritan yang menghasilkan neuropeptid-neuropeptid seperti substansi P dan CGRP dari serabut nosiseptif C di dalam inti pulpa. Peptid- peptid ini memiliki sifat vasodilatasi yakni dapat meningkatkan permeabilitas vaskuler dan edema. Neurogenik inflamasi mengeluarkan sel imun seperti makrofag, neurotrophil, sel mast, dan limphosit (Hargreaves, Cohen, 2011). Kerusakan odontoblas dan pelepasan molekul-molekul bioaktif sel dalam merangsang inflamatori pulpa (Gambar 2.1). Inflamasi pulpa tediri dari respon akut dan respon kronis bergantung pada besar dan durasi rangsangan. Perubahan permeabilitas
vaskuler terjadi saat inflamasi akut, mengakibatkan pembentukan eksudat karena ruang pulpa yang terbatas berekspansi menyebabkan tekanan intrapulpa meningkat dan mengakibatkan rasa sakit. Inflamasi kronis dapat bertahan selama bertahun- tahun, seringkali tanpa ada keluhan pasien. Apabila inflamasi ini tidak segera ditanggulangi dapat menyebabkan efek yang membahayakan bagi pulpa sehingga dapat menyebabkan nekrosis pulpa dan infeksi jaringan periradikuler (Murray dkk., 2002).
Inflamasi pulpa dapat dicegah dengan melakukan proteksi pulpodentinal kompleks berupa pengaplikasian bahan dentinogenesis atau bahan restoratif pada jaringan gigi yang rusak akibat prosedur operatif, toksisitas bahan restoratif serta penetrasi bakteri akibat terjadinya kebocoran mikro. Proteksi pulpodentinal kompleks juga berguna untuk memulihkan vitalitas pulpa (Ferracane dkk., 2010).
Menjaga vitalitas jaringan pulpa dan mencegah perubahan patologis jaringan periradikular maka daerah tubulus dentin harus ditutup. Produksi dentin sekunder dan tersier berguna untuk melindungi pulpa gigi dan jaringan periapikal dari infeksi (Murray dkk., 2002). Proses pembentukan dentin tersier bersifat reaksioner dan reparatif. Dentin reaksioner biasanya diproduksi oleh odontoblas yang telah ada sebagai respon terhadap bahan restorasi, sebaliknya dentin reparatif terbentuk oleh sel-sel odontoblas baru ketika odontoblas primer mengalami injuri secara irreversibel.
Dentinogenesis reparatif dianggap lebih kompleks dibanding dentin reaksioner (Murray dkk., 2002).
Banyak bahan yang telah digunakan untuk menutup tubulus dentin dengan merangsang terjadinya dentinogenesis. Proses dentinogenesis merupakan reaksi spesifik dari jaringan pulpa dan dianggap mekanisme perlindungan. Bahan yang sering digunakan adalah kalsium hidroksida dan MTA, walaupun kalsium hidroksida lebih ekonomis dan banyak beredar, peneliti-peneliti telah menunjukkan bahwa kalsium hidroksida kurang mampu menstimulasi dentinogenesis dan membentuk dentin reparatif dengan baik dan terlihat tidak dapat mengadakan deposisi dentin seperti yang diharapkan, sehingga hasil akhir yang diharapkan tidak sebaik dibandingkan menggunakan MTA (Eskandarizadeh dkk., 2006).
Gambar 2.1 Respons Odontoblas terhadap Stimulasi Patologis (Murray dkk., 2002)
Tujuan utama dari ilmu kedokteran gigi restoratif adalah mengembalikan dan mempertahankan kesehatan gigi melalui perawatan restoratif yang adekuat guna melindungi dan memperbaiki fungsi pulpa. Pulpa berperan penting dalam fungsi
formasi dan nutrisi bagi dentin serta fungsi inervasi dan pertahanan gigi (Smith dkk., 2003).
2.1 Regenerasi pada Pulpodentinal Kompleks
Anatomi mikroskopik dentin primer terdiri dari tubulus dentin, dengan mikrotubulus yang saling berhubungan, penyembuhan sel-sel odontoblas pulpa perifer terjadi pada dentin intertubular yang mengandung kolagen-hidroksiapatit.
Mineralisasi struktur peritubular berlanjut sejalan dengan bertambahnya usia, menghasilkan jaringan kurang permiabel dan kurang dinamis. Proses mineralisasi dapat dipercepat setelah penempatan bahan restorasi dalam kavitas yang dipreparasi. Dentin terdiri dari mineral hidroksiapatit, air, dan bahan organik. Sekitar 90% dari bahan organik adalah kolagen, dan kebanyakan kolagen tipe 1. Sekitar 10 % sisanya merupakan matrix ekstraseluler organik yang terdiri dari protein noncollagenous dan proteoglycans (Dahl, Orstavik, 2010).
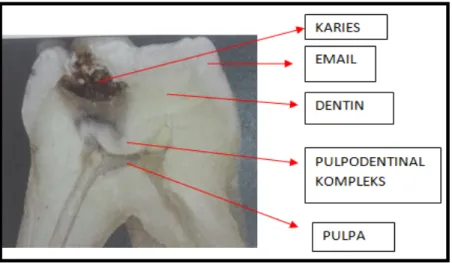
Secara anatomi dan fisiologi letak pulpa dan dentin sangat berdekatan sehingga dianggap merupakan suatu kesatuan dan disebut pulpodentinal kompleks.
Pulpodentinal kompleks secara seluler spesifik mampu merespon aplikasi terapi dalam membentuk jaringan keras. Hasil akhir dari proses penyembuhan apabila odontoblas teriritasi oleh trauma, infeksi bakteri, ataupun produk degradasi maka pada pulpodentinal kompleks terjadi penyusunan kembali susunan jaringan normal dengan terbentuknya dentin tersier atau pembentukan jaringan lunak atau parut yang menyerupai fibrodentin dalam waktu 4-6 minggu. Apabila iritasi tersebut dihilangkan
sebelum terjadi nekrosis pulpa, pembentukan dentin tersier menciptakan perisai antara pulpa dengan iritan. Pembentukan dentin tersier berlangsung lebih cepat dibandingkan pembentukan dentin sekunder dan merupakan mekanisme pertahanan yang penting terhadap iritan patologis maupun fisiologis di dalam pulpodentinal kompleks (Dahl, Orstavik, 2010).
Pola perbaikan pada pulpodentinal kompleks bergantung pada tiga kondisi patofisiologi batas dentin-pulpa yang berbeda yaitu luas dan jenis jaringan yang terluka, efek perlindungan dari struktur gigi dan integritas batas dentin-pulpa. Evolusi jangka panjang dan perawatan pulpodentinal kompleks merupakan pertimbangan utama dari kebanyakan prosedur restoratif gigi terutama pada pasien berusia lanjut dimana proses reparatif menjadi kurang efektif (Hargreaves, Cohen, 2011).
Kelangsungan hidup odontoblas sangat bergantung pada sisa ketebalan dentin.
Menurut Pameijer, Stanley dan Ecker (1991) melaporkan bahwa sisa ketebalan dentin adalah 1 mm atau lebih akan melindungi jaringan pulpa dari efek sitotoksik zinc phosphate dan Semen ionomer kaca modifikasi resin selama proses luting. Dalam satu tahun terakhir, telah diperkirakan bahwa estimasi yang benar terhadap sisa ketebalan dentin adalah 0,5 mm, dimana pada sisa ketebalan dentin 0,5 mm masih terdapat kelangsungan hidup odontoblas. Sisa ketebalan dentin dan sekresi dentin reaksioner saling berkaitan. Bagian terpenting dalam sekresi dentin reaksioner pada sisa ketebalan dentin antara 0,25 - 0,50 mm karena pada sisa ketebalan dentin 0,25 - 0,50 mm mempunyai molekul bioaktif untuk mendifusi sel odontoblas yang lebih banyak dibandingkan ketebalan di atas 0,5 mm. Dentin reaksioner tidak terjadi pada
sisa ketebalan dentin di bawah 0,25 mm, karena sisa ketebalan dentin di bawah 0,25 mm kehilangan sel odontoblas dalam jumlah banyak (Murray dkk., 2002) (Gambar 2.2). Aktivitas sisa ketebalan dentin memainkan peran utama dalam menentukan tingkat cedera pulpa dan respon perbaikan dari bahan kaping pulpa (Tabel 2.1).
Gambar 2.2 Daerah Pulpodentinal Kompleks (Hargreaves, 2012)
Tabel 2.1 Pengaruh Sisa Ketebalan Dentin terhadap Kelangsungan Hidup Sel Odontoblas, Aktifitas Dentin Reaksioner, dan Inflamasi Pulpa (Murray, 2002).
Sisa ketebalan
Dentin
Tipe Kavitas Kelangsungan hidup sel odontoblas (%)
Pembentukan dentin reaksioner
Aktifitas inflamasi pulpa
>1mm Dangkal 100 Sedikit Sedikit
0,5-1 mm Sedang 88,9 Sedikit Sedikit
0,25-5 mm
Dalam 82,5 Meningkat
secara signifikan sebanyak 292%
Makin tinggi
<0,25 mm Sangat dalam 68,3 Sedikit Banyak bakteri
2.2 Efek Bahan Restorasi terhadap Jaringan Pulpodentinal Kompleks
Tidak ada bahan yang dapat melindungi pulpa sebaik dentin. Dentin dapat berperan sebagai jaringan yang mampu mengadakan detoksifikasi dengan menyerap bahan yang sangat toksik ke dinding bagian dalam dari tubulus dentin.Keberhasilan kaping pulpa berkisar 44-97%, sedangkan keberhasilan kaping pulpa pada pulpa yang tak terbuka umumnya jauh lebih tinggi (Murray dkk., 2002).
Jenis bahan restoratif menjadi faktor penting yang mendasar terhadap kelangsungan hidup odontoblas, dikaitkan dengan sisa ketebalan dentin. Kalsium hidroksida sebagai dasar pengukuran kelangsungan hidup odontoblas, kemampuan bahan diuji untuk mempertahankan kelangsungan hidup odontoblas dengan sisa ketebalan dentin di bawah 0,5 mm. Penurunan kelangsungan hidup odontoblas tampaknya berkorelasi dengan aktifitas bahan kimia sebagai lining atau bahan restorasi, karena ada beberapa bahan yang lebih sitotoksik pada jaringan pulpa dibandingkan jaringan lain. Observasi ini menunjukkan bahwa pentingnya menghindari penempatan bahan sitotoksik pada preparasi kavitas yang sangat dalam dimana dapat terjadi kerusakan pulpa dan dapat mencegah jaringan pulpa nekrosis (Murray dkk., 2002).
2.2.1 Mineral Trioxide Aggregate (MTA)
MTA dikembangkan oleh Mahmoud Torabinejad di Loma Linda University tahun 1993. Penelitian menunjukkan bahwa bahan dasar MTA adalah semen Portland yaitu trikalsium silikat, dikalsium silikat, trikalsium aluminat, kalsium sulfat yang
merupakan bahan yang digunakan dalam bidang bangunan yang harganya murah dan mudah diperoleh (Camilleri, 2008).
Sifat-sifat biologis dan fisiologis MTA adalah menginduksi dentinogenesis reparatif, yang melibatkan peristiwa selular dan molekuler yang kompleks yang mengarah pada perbaikan sel lir odontoblas. Dibandingkan kalsium hidroksida, MTA lebih efisien dalam mendorong reparatif in vivo. Analisis fisika telah mengungkapkan bahwa MTA tidak hanya bertindak sebagai materi pelepas kalsium hidroksida, tetapi juga berinteraksi dengan fosfat yang mengandung cairan untuk membentuk presipitat apatit. MTA juga menunjukkan kemampuan yang lebih baik dalam sealing ability dan stabilitas struktural, tetapi aktivitas antimikroba kurang kuat dibandingkan dengan kalsium hidroksida (Queiroz dkk., 2005).
Sejak diperkenalkan, MTA merupakan bahan kedokteran gigi yang terbukti telah menjadi salah satu bahan yang serbaguna dan biokompatibel pada saat ini.
Kemampuannya yang tinggi dalam hal sealing ability dapat mengurangi masuknya bakteri sehingga hal tersebut dapat mencegah kontaminasi. Sedangkan daya biokompatabilitas yang tinggi menghasilkan reaksi penyembuhan jaringan yang sangat baik, sehingga seringkali menyebabkanya terjadinya proses regenerasi jaringan yang sempurna pada tempat berkontaknya bahan dan jaringan tersebut (Ferracane dkk., 2010; Lohbauer U, 2010; Nagaraja Upadhya and Kishore, 2005)
MTA dapat setting dalam keadaan lembab, dan menyebabkan penyembuhan jaringan, kemampuannya dalam menginduksi sementogenesis, maka bahan ini dapat digunakan untuk memperbaiki perforasi baik di akar maupun di daerah furkasi.
Bahan ini juga dapat dipergunakan sebagai kaping pulpa, pulpotomi, bahan penutup ujung akar, apeksifikasi, serta sebagai bahan pengisi saluran akar (Rao dkk., 2009;
Torabinejad dkk., 1995). Penelitian Tanomaru, 2012 mengatakan bahwa waktu setting MTA adalah 15 menit, hal ini berbeda dengan hasil yang dilaporkan oleh beberapa studi sebelumnya, perbedaan ini disebabkan jenis MTA yang digunakan.
Produk yang dilepaskan MTA mampu merangsang sel lir osteoblas dan fibroblas yang melibatkan protein dalam pembentukkan mineral, seperti osteopontin, osteonectin, dan osteokalsin. Kuratate dkk., 2008 menyatakan pembentukan jembatan dentin di atas pulpa yang terpapar pada tikus meningkatkan proliferasi sel, adanya protein nectin menunjukkan keberadaan odontoblas yang mampu mensekresi matriks dentin, dan terjadinya peningkatan osteopontin pada lapisan jaringan nekrotik dan pulpa. Dalam penelitian Koh dkk., 1997 menunjukkan bahwa osteoblast yang terekspos MTA memproduksi sitokin untuk perbaikan tulang seperti interleukin (IL)- 1α, IL-1β, dan IL-6, serta osteokalsin. MTA menstimulus pertumbuhan sel setelah 48 jam aplikasi (Tani-Ishii N, 2007).
Walaupun banyak penelitian menunjukkan hasil yang sangat baik dari MTA, namun penggunaan bahan ini relatif masih jarang karena harganya yang relatif mahal, manipulasi yang sulit, dan waktu pengerasan yang panjang (Camilleri dkk., 2008).
Dan berdasarkan penelitian Bramante dkk., 2008 menunjukkan terdapat sedikit kandungan arsen pada MTA.
2.2.2 Semen Ionomer Kaca Modifikasi Resin (SIKMR)
SIKMR dikembangkan untuk memperbaiki sifat fisik dan mengurangi sensitivitas air dari bahan ionomer kaca konvensional. SIKMR merupakan bahan hibrid yang lebih kuat dan tidak rapuh diperkenalkan dengan penambahan monomer seperti HEMA. Pada dasarnya SIKMR memiliki komposisi yang sama dengan semen ionomer kaca konvensional hanya saja komponen air diganti menjadi campuran air dengan HEMA. SIKMR dapat mengeras dengan dua cara, yaitu kombinasi asam dan basa serta reaksi polimerisasi (Modena dkk., 2009).
Bahan ini mengandung bubuk kaca yang mampu memindahkan ion dan asam polimer yang larut dalam air seperti asam akrilik. Bahan ini mengandung monomer organik (biasanya HEMA) dan sistem inisiator. Inisiator umumnya sensitif terhadap cahaya sehingga kebanyakan SIKMR mengeras dengan cara disinar dengan menggunakan lampu penyinaran biasa yang memancarkan sinar dengan panjang gelombang 470 nm (Goldberg, 2006; Modena dkk., 2009).
SIKMR memiliki tahap-tahap reaksi pengerasan yang terjadi melalui reaksi asam-basa antara bubuk alumino silikat dengan asam polikrilat, reaksi polimerisasi dari partikel-partikel resin yang ada di dalam semen; reaksi antara logam poliakrilat dengan resin hingga membentuk matriks semen yang lebih kuat. Dari ketiga reaksi tersebut, sebenarnya SIKMR mengeras dengan sistem “Dual Cure” yaitu reaksi penggaraman (asam-basa) yang terjadi secara kimia dan polimerisasi yang terjadi akibat penyinaran (Modena dkk., 2009; Nicholson, 2008).
Pada umumnya SIKMR dapat membentuk ikatan yang kuat ke dentin dan enamel serta dapat melepaskan fluoride. Selain itu, bahan ini juga melepaskan beberapa ion seperti Na, Ca, Sr, Al, P dan Si . Ion – ion tersebut juga dilepaskan oleh SIK konvensional namun kadar ion phosphat yang dilepaskan SIKMR lebih rendah dibandingkan dengan konvensional (Goldberg, 2008).
SIKMR ini terbukti bersifat sitotoksis terutama karena pelepasan HEMA dalam kadar tinggi dan bersifat mutagenik. Akan tetapi data mengenai mutagenitas sangat sedikit dan sulit diinterpretasi. SIKMR menunjukkan sifat biologis yang dapat diterima terhadap pulpa yang terpapar maupun tidak terpapar. SIKMR menimbulkan respon inflamasi persisten tingkat menengah hingga berat pada pulpa dan pembentukan zona nekrotik yang besar(Modena dkk., 2009).
2.2.3 Abu Sekam Padi Nanopartikel (ASPn)
Produk utama pertanian di negara-negara agraris, termasuk Indonesia adalah padi. Sekam padi merupakan bagian terluar (kulit) dari butir padi. Sekam padi dikategorikan sebagai biomassa yang dapat digunakan untuk berbagai kebutuhan tetapi mempunyai nilai ekonomis yang masih rendah sehingga perlunya dicari alternatif lain yang lebih bermanfaat dan penanganan sekam padi yang kurang tepat akan menimbulkan pencemaran lingkungan. Padahal abu sekam padi merupakan sumber silika potensial yang dapat digunakan sebagai bahan kedokteran (Indahyani dkk., 2011). Nilai paling umum kandungan silika (SiO2) dalam abu sekam padi
adalah 94 – 96 %.Abu sekam padi apabila dibakar secara terkontrol pada suhu tinggi (500–6000C) akan menghasilkan abu silika (Zakaria, 2002).
Warna abu sekam dapat diklasifikasikan menjadi 3 lapisan warna, yaitu abu- abu, putih dan merah jambu (Gambar 2.3). Berdasarkan hasil laboratorium, perbedaan warna ini mempunyai sifat permukaan dan kadar penghidrat yang berbeda.
Abu sekam padi berwarna merah jambu jauh lebih reaktif dan mampu memberikan sifat pengerasan yang lebih baik (Zakaria, 2002).
Gambar 2.3 Lapisan Abu Sekam Padi (Zakaria, 2002)
Abu sekam padi nanopartikel (ASPn) dibuat dengan tujuan agar dapat membantu absorpsi antara substrat dan membran sel. Ukuran partikel nanonya memiliki efektivitas yang lebih baik. Nanoteknologi pertama kali diperkenalkan oleh seorang ahli Fisika, Richard P. Feynman pada tahun 1959. Kata depan nano-berasal dari bahasa yunani yang berarti kecil dan satu nanometer sama dengan 10-9 m.
Nanopartikel merupakan produk yang dihasilkan dari nanoteknologi, sehingga nanopartikel dianggap suatu bahan yang mempunyai dimensi ukuran kurang dari 100
nm (Park, 2007). Alat yang digunakan untuk membuat abu sekam padi nanopartikel adalah Planetary Ball Mills (Retsch, PM 200).
Sekam padi mengandung senyawa organik berupa lignin dan kitin, selulosa, hemiselulosa, senyawa nitrogen, lipid, vitamin B, dan asam organik, sedangkan senyawa anorganik berupa silika (Ismunandji, 1988). Menurut BPPP (2001) silika yang terkandung dalam sekam padi sebanyak 16.98% dan berada dalam bentuk dasar (silika amorf). Komposisi kimiawi sekam padi dapat dilihat pada Tabel 2.2.
Komposisi lainnya dari sekam padi adalah selulosa. Senyawa ini tidak larut dalam air dan terdiri atas unit-unit β-D-glukopiranosa yang disatukan oleh ikatan β1→4 membentuk rantai lurus panjang yang diperkuat oleh ikatan hidrogen. Selulosa merupakan senyawa organik yang paling tinggi dalam sekam. Selulosa yang terdapat pada sekam padi sebanyak 34.34-43.80% (Ismunadji, 1988).
Silika merupakan bahan kimia yang pemanfaatan dan aplikasinya sangat luas.
Salah satu pemanfaatan serbuk silika yang cukup luas adalah sebagai penyerap kadar air di udara, (Harsono, 2002 cit Sitorus, 2009). Selain itu, silika juga digunakan sebagai penyaring molekuler, resin, pembantu peran katalis, dan pengisi dalam pembuatan polimer. Gugus -OH yang mampu membentuk ikatan hidrogen dengan gugus yang sama dari molekul lain yang mengakibatkan silika dapat digunakan sebagai pengering dan fasa diam pada kolom kromatografi (Sinulingga dkk., 2014).
Silika abu sekam padi terbukti mempengaruhi pembentukan tulang. Silika merupakan bahan semi konduktor yang mempunyai potensi untuk mencapai sifat- sifat mekanis, morfologis, biokompatibilitas dan biodegradasi. Makanan yang
mengandung silika dapat menstimulasi sel osteoblas dan osteo-blast-like cell untuk mensekresi kolagen tipe I dan marker bio-kimia lain pada maturasi sel tulang dan pembentukan tulang (Refitt dkk., 2003 cit Indahyani dkk., 2011).
Berdasarkan penelitian Indahyani dkk., 2011 menyatakan bahwa silika yang berasal dari sekam padi mempunyai kemampuan untuk menstimulasi proliferasi osteoblast dan mempunyai nilai absorbansi yang paling tinggi. Hasil X-ray Diffraction (XRD) abu sekam padi nano partikel terlihat bahwa kandungan silika (SiO2) paling tinggi (Gambar 2.4).
Gambar 2.4 Hasil XRD Abu Sekam Padi Nanopartikel (Pretty dkk., 2014)
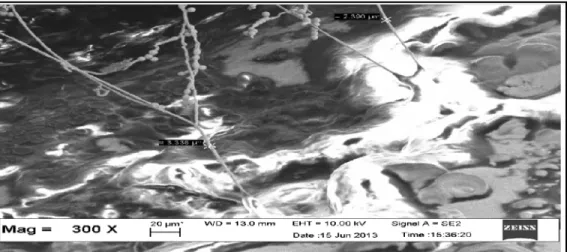
Penelitian Pretty dkk., 2014 memperlihatkan tag like structure pada permukaan dentin dengan bahan ASPn+KMTn, hal ini berarti ASPn+KMTn mempunyai kemampuan adhesi dengan adanya sealing ability yang baik dalam menjaga jaringan pulpodentinal kompleks (Gambar 2.5).
Gambar 2.5 Tag Like Structure ASPn+KMTn dengan Uji SEM (Pembesaran 300x) (Pretty dkk., 2014)
2.2.4 Kitosan Molekul Tinggi Nanopartikel (KMTn)
Kitosan (poly-β-1,4-glukosamin) pertama kali ditemukan oleh Routget (1859) yang merupakan biopolimer alami di alam setelah selulosa dan merupakan hasil N- diasetilisasi dari kitin. Berdasarkan viskositasnya, berat molekul kitosan terdiri atas tiga yaitu kitosan bermolekul rendah, kitosan bermolekul sedang dan kitosan bermolekul tinggi. Kitosan bermolekul rendah dengan berat molekul di bawah 400.000 Mv dan kitosan bermolekul sedang dengan berat molekul 400.000-800.000 Mv berasal dari hewan laut dengan cangkang atau kulit yang lunak misalnya udang, cumi-cumi dan rajungan. Kitosan dengan berat molekul 800.000-1.100.000 Mv biasanya berasal dari hewan laut bercangkang keras misalnya kepiting, kerang dan blangkas (Gambar 2.6) (Trimurni dkk., 2007).
Gambar 2.6 Kitosan Molekul Tinggi (Trimurni dkk., 2007)
Kitosan blangkas merupakan kitosan bermolekul tinggi yang diperoleh dari cangkang blangkas. Blangkas disebut juga dengan Horseshoe-crab.Kitosan blangkas yang diuji oleh Trimurni dkk., 2007 mempunyai derajat deastilisasi 84,20% dengan berat molekul 893.000 Mv. Dari penelitian tersebut diketahui bahwa kitosan blangkas mempunyai berat molekul yang tinggi. Pada penelitian tersebut juga dinyatakan bahwa kitosan blangkas yang mempunyai berat molekul tinggi dapat menstimulasi dentin reparatif dengan kemampuannya membentuk koagulum yang padat sebagai sub base membran yang memudahkan perlekatan sel-sel pulpa seperti dentinoblast untuk memudahkan migrasi dan proliferasi sel-sel pulpa dentinoblast. Berdasarkan penelitian Agusnar., 1997 mengatakan bahan ini tidak dapat dibiarkan terlalu lama pada suhu kamar karena larutan kitosan akan terhidrolisis sehingga konsentrasi berkurang.
Dalam perkembangannnya, kitosan dimodifikasi dalam bentuk nanopartikel.
Nanopartikel dibuat dengan reaksi gelatinasi yang berdasarkan reaksi antar muatan positif gugus amino kitosan dan muatan negatif natrium tripolifosfat. Rerata ukuran nanopartikel kitosan yang dihasilkan ialah 180 nm dengan polidispersitas 0,519 yang menunjukkan, bahwa ukuran nanopartikel hampir seragam. Adsorpsi dengan menggunakan nanopartikel kitosan memiliki kapasitas adsorpsinya yang lebih besar dibandingkan dengan manik kitosan dalam ukuran mikron karena bentuknya yang kecil, sehingga bidang sentuh dengan zat akan diserap semakin besar (Tiyaboonchai, 2003).
Siregar (2009) menyiapkan kitosan nanopartikel dengan melarutkan kitosan dalam larutan asam lemah ditambahkan larutan yang bersifat basa, seperti amoniak, NaOH, atau KOH distirer dengan kecepatan 300 rpm sehingga diperoleh gel kitosan putih dan dibilas dengan aquadest sampai netral kemudian ditempatkan dalam ultrasonic bath untuk memecah partikel-partikel gel kitosan menjadi lebih kecil.
Cheung cit Siregar (2009) menyiapkan kitosan nano dengan metode lain, yaitu dengan menambahkan larutan tripolipospat ke dalam larutan kitosan sehingga diperoleh emulsi kitosan sambil distirer dengan kecepatan 1200 rpm, dan ditambahkan asam asetat agar pH-nya 3,5 dengan hasil berupa suspen kitosan.Lu E- Shi cit Ningsih (2010) menyiapkan kitosan nanopartikel dengan menambahkan larutan tripolipospat (TPP) kedalam larutan suspensi kitosan yang dibuat dengan menambahkan asam asetat, kemudian distrier dengan kecepatan 1200 rpm terbentuk emulsi.
Kitosan blangkas yang diuji oleh Trimurni dkk., 2007 menunjukkan bahwa kitosan blangkas yang mempunyai berat molekul tinggi dapat menstimulasi dentin reparatif dengan kemampuannya membentuk koagulum yang padat sebagai sub base membran yang memudahkan perlekatan sel-sel pulpa seperti odontoblas untuk memudahkan migrasi dan proliferasi.
Henny dkk., 2013 melakukan penelitian dengan menambahkan kitosan molekul tinggi nano yang diperoleh dari blangkas (Tachypleus gigas) 0,15% berat kitosan pada SIKMR dan SIKMRn dan efeknya terhadap proliferasi sel. Hasil penelitian tersebut menunjukkan bahwa terjadi peningkatan viabilitas sel yang signifikan pada SIKMR dan SIKMRn yang ditambahkan 0,015% berat kitosan nano dari blangkas.
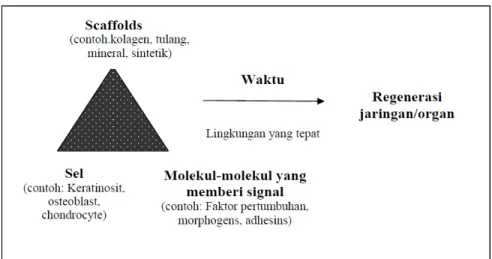
Dalam perkembangan bahan-bahan biomaterial dalam regenerasi pulpa diperlukan adanya sel, bahan perancah (scaffolds) untuk proliferasi dan diferensiasi sel serta faktor pertumbuhan (growth factor), ketiga faktor ini disebut tissue engineering triad (Trimurni, 2007) (Gambar 2.7).
Gambar 2.7 Kombinasi Tiga Elemen yang Memungkinkan Terjadinya Regenerasi Jaringan atau Organ (Trimurni, 2007)
Kitosan sebagai biomaterial scaffold dapat menggantikan fungsi biologis dan mekanis matriks ekstraselular jaringan di dalam tubuh dengan bertindak sebagai matriks ekstraseluler artifisial (Koh, Atala, 2004 cit Trimurni, 2007). Scaffold sintetis harus mempunyai sifat osteoinduktif, osteokonduktif, integritas mekanisnya tinggi, biodegradabilitas, biocompatibilitas (mudah diterima secara imun) dan porosita yang akan menyebabkan pertumbuhan jaringan. Selain itu, scaffold harus didegradasi ketika jaringan yang rusak telah diregenerasi. Sel-sel diimplantasi atau dimasukkan ke dalam struktur artifisial yang mampu mendukung pembentukan jaringan dalam tiga dimensi. Struktur ini disebut bahan perancah (scaffolds) yang memungkinkan sel-sel mempengaruhi lingkungan mikronya. Bahan perancah (scaffolds) paling sedikit memiliki tujuan sebagai berikut (Sun, 2007) :
1. Memungkinkan perlekatan dan migrasi sel.
2. Menghantarkan dan menahan sel-sel serta faktor-faktor biokhemis.
3. Memungkinkan difusi nutrisi bagi sel-sel yang vital dan produknya.
4. Menimbulkan pengaruh-pengaruh mekanis dan biologis untuk memodifikasi fase sel.
2.3 Mekanisme Pertahanan Pulpodentinal Kompleks 2.3.1 Reaktifitas Odontoblas
Serangan toksik ringan ke pulpa dapat mengakibatkan peningkatan dentinogenesis, yang dapat dianggap sebagai mekanisme pelindung. Peningkatan pembentukan dentin peritubular mempersempit tubulus dentin melalui pembentukan dentin sklerotik. Respon perbaikan yang umum terhadap cedera pulpa adalah pembentukan dentin tersier (Murray dkk., 2002). Tidak seperti dentin primer atau sekunder yang terbentuk di sepanjang perbatasan pulpo-dentino kompleks, dentin tersier diproduksi secara lokal sebagai respon terhadap injuri dentin atau produk toksis yang mencapai pulpo dentino kompleks. Proses pembentukan dentin tersier bersifat reaksioner atau reparatif (Smith dkk., 2003).
Dentin reaksioner biasanya diproduksi oleh odontoblas yang telah ada sebagai respon terhadap kavitas yang dipreparasi secara hati-hati atau bahan restoratif.
Sebaliknya dentin reparatif terbentuk oleh sel-sel odontoblas baru ketika odontoblas primer telah mengalami injuri secara ireversibel. Dentinogenesis reparatif dianggap lebih kompleks dibanding pembentukan dentin reaksioner, dan ditemukan pada gigi dengan preparasi kavitas yang dalam atau penyingkapan pulpa (Gambar 2.1).
Disebutkan bahwa faktor pertumbuhan, khususnya transforming growth factor- ß
(TGF-ß), menginisiasi perbedaan odontoblas dan menstimulasi pembentukan dentin.
Reseptor TGF-ß terlihat pada odontoblas dan growth factor ditemukan dalam matriks dentin. Pelepasan faktor pertumbuhan dapat terjadi saat serangan karies dan injuri lainnya ke jaringan, dan pada saat preparasi kavitas dan restorasi gigi (Murray dkk., 2002).
Odontoblas dirangsang untuk mengeluarkan matriks ekstraselular dan memicu terjadinya mineralisasi selama proses dentinogenesis reaksioner (Gambar 2.8). Pada saat dentinogenesis reaksioner menunjukkan sel lain dirangsang untuk berdiferensiasi menjadi sel lir-odontoblas yang kemudian akan dipicu untuk menghasilkan matriks ekstraselular dan terjadinya mineralisasi selama proses dentinogenesis reparatif (Murray dkk., 2002).
Gambar 2.8 Hipotesa Efek Matriks Protein Dentin yang Dilarutkan oleh Karies ataupun Bahan Kedokteran Gigi pada Odontoblas dan Sel Lain (Murray dkk., 2002)
2.3.2 Matriks Metaloprotein
Bahan restorasi yang diletakkan di dalam lingkungan jaringan pulpodentinal kompleks berpotensi menghasilkan spektrum luas dari fisikokimia dan efek biologis.
Beberapa efek memiliki pengaruh yang berbeda tergantung pada jaringan sehat atau karies, dikarenakan infeksi bakteri, inflamasi, dan respon sel pulpa. Dentin memiliki aktivitas enzim proteolitik dan saat ini diakui adanya beberapa matriks metaloproteinase (MMP-2,-8,-9,-13,dan -20) di dalam dentin. Aktivitas MMP pada permukaan antara material dan jaringan dapat menyebabkan degradasi dari permukaan (Pashley dkk., 2014).
2.4 Uji Biokompatibilitas
Biokompatibilitas adalah kemampuan suatu bahan untuk tidak menimbulkan respon biologis yang merugikan jika bahan tersebut digunakan didalam tubuh. Setiap bahan dapat dikategorikan sebagai bahan yang biokompatibel atau tidak, tergantung kepada fungsi fisik dan reaksi biologis yang diharapkan dari bahan tersebut. Suatu bahan tidak dapat digeneralisasikan sebagai bahan yang biokompatibel untuk semua penggunaannya di dalam tubuh, karena setiap jaringan hidup yang berinteraksi akan memberikan respon biologis yang berbeda. Sesuai dengan standard ISO 10993, semua bahan yang akan berkontak dengan jaringan memerlukan data biokompatabilitas. Tes biologis merupakan langkah yang paling penting dalam sebuah evaluasi biokompatibilitas. ISO 10993 membagi kategori matriks
biokampabilitas bahan menurut tipe dan durasi bahan tersebut berkontak dengan jaringan (Assesing Biocompatibility, 2008 cit Diana, 2008).
Biokompatibilitas suatu bahan dapat meliputi derajat sitotoksisitas, mutagenitas dan potensinya dalam menimbulkan keganasan. Uji biokompatibilitas dilakukan pada bahan yang akan diletakkan pada tubuh manusia. Reaksi jaringan tubuh terhadap bahan sangat bervariasi tergantung kepada tipe bahan. Bahan yang dapat berfungsi saat berkontak dengan cairan biologis atau jaringan hidup dengan menimbulkan reaksi penolakan yang minimal oleh tubuh disebut bahan yang biokompatibel. Pengujian biokompatibilitas suatu bahan dapat dilakukan secara in vivo dan in vitro. Pengujian yang dilakukan secara in vitro, yaitu tanpa melibatkan organ hidup, dilakukan pada sel, enzim, atau sistem biologis yang terisolasi. Uji bahan secara in vitro sebagian besar dibagi menjadi pengujian untuk mengetahui sitoksitas dan pertumbuhan sel, mengukur metabolisme dan fungsi sel serta mengukur efek mutagenitas bahan pada sel (Assesing Biocompatibility, 2008 cit Diana, 2008).
Saat ini kultur sel telah menjadi salah satu obyek utama dalam berbagai penelitian tentang kehidupan. Kultur sel adalah sel yang dikondisikan pada suatu lingkungan buatan yang kondusif untuk pertumbuhannya. Berbagai perilaku, karakteristik, dan bentuk sel dapat diamati pada kultur sel. Oleh karena itu, kultur sel memiliki kegunaan yang bervariasi, antara lain untuk pengamatan biokimia sel, uji toksisitas suatu bahan, penelitian kanker, diteksi dan isolasi suatu virus, serta terapi gen (Freshney, 2000).