STUDI PENGARUH DEALUMINASI PADA ADSORPSI ZEOLIT ALAM TERHADAP ION LOGAM Cd(II) DALAM MEDIUM AIR
1Pardoyo, 2Narsito, 3Nuryono
1Staf Pengajar Jurusan Kimia FMIPA UNDIP Semarang
2,3Staf Pengajar Jurusan Kimia FMIPA UGM Yogyakarta
ABSTRAK
Telah dilakukan penelitian untuk mempelajari pengaruh dealuminasi pada adsorpsi zeolit alam terhadap ion logam kadmium dalam medium air. Perlakuan terhadap zeolit alam dikerjakan dengan tiga cara yaitu pencucian dengan akuades(Z-11), perendaman dengan KMnO4 dan H2SO4 pada 800C(Z-22) serta perendaman dengan KMnO4, H2SO4 dan HCl pada 800C(Z-33). Perubahan karakter akibat perlakuan dideteksi dengan menentukan rasio Si/Al dan Analisis struktur menggunakan difraktometer sinar-X dan spektrofotometer FTIR. Kapasitas adsorpsi ditentukan dengan model adsorpsi isoterm Langmuir sedangkan laju adsorpsi dengan Langmuir-Hinshelwood. Hasil penelitian menunjukkan struktur Z-22 mengalami dealuminasi pada tingkat yang rendah dengan nilai rasio Si/Al 5,246 sedikit meningkat dari Z-11 3,432. Struktur Z-33 mengalami kerusakan akibat dealuminasi pada tingkat yang signifikan dengan nilai rasio Si/Al 16,295. Dealuminasi pada zeolit alam mempengaruhi nilai kapasitas dan laju adsorpsi. Nilai kapasitas adsorpsi Z-11, Z-22 dan Z-33 terhadap ion Cd(II) berturut-turut 9,98 mg/g, 5,87 mg/g dan 8,99 mg/g sedangkan tetapan laju adsorpsi masing-masing 37.
10-4 menit-1, 0,6.10-4 menit-1 dan 7,0.10-4 menit-1. Kata kunci : dealuminasi, zeolit, adsorpsi, ion kadmium
ABSTRACT
It has been intensively researched for investigating the influence of dealumination on the adsorption of natural zeolite for Cd(II) metal ions in aqueous medium. Three procedures were done to treat natural zeolite, viz., washing in aquadest to produce Z-11, soaking with KMnO4 and H2SO4 at 800C producing Z-22 and soaking with KMnO4, H2SO4 and HCl at 800C as Z-33. The changes of the characteristics due to the treatments were evaluated with determining of Si/Al ratio and identifying the structure using X-ray diffractometer and FTIR spectrophotometer. The capacity of adsorption established by Langmuir model for adsorption isotherm while the rate of adsorption calculated by Langmuir-Hinshelwood kinetics approach. Result showed that Z-22 and Z- 33 have been decreased in dealumination with Si/Al ratio 5,246 bigger than Z-11 3,432.
However, the structure of Z-33 was absolutely damaged because of dealumination with 16,295 in Si/Al ratio. The dealumination process seriously affected the capacity and rate of adsorption. The value of Cd(II) ion adsorption capacity on Z-11, Z-22 and Z-33 were 9,98 mg/g, 5,87 mg/g, 8,99 mg/g respectively whereas the value of adsorption rate were 37. 10-4 menit-1, 0,6.10-4 menit-1, 7,0.10-4 menit-1 in a row.
Keywords : dealumination, zeolite, adsorption, Cd(II) ion
PENDAHULUAN
Kadmium sebagai logam transisi banyak digunakan dalam industri baterai, plastik dan
solder, industri fotografi, industri electroplating dan industri pesawat terbang (Hartono, 1999).
Meskipun banyak dimanfaatkan kadmium
merupakan salah satu jenis logam berat yang sangat berbahaya dan perlu penanganan serius.
Efek racun kadmium antara lain menyebabkan tekanan darah tinggi, kerusakan sel darah merah, ginjal, pembuluh darah dan gangguan akut sistem pernafasan dan pencernaan (Stoeppler, 1992; Manahan, 1994; Noll, 2002).
Peranan metode adsorpsi dalam usaha perbaikan kualitas lingkungan telah lama dikenal.
Dalam pemanfaatannya metode ini selalu mengalami kemajuan perkembangan sehingga menjadi salah satu metode pemisahan yang digemari dan banyak dipilih. Keberhasilan dalam menggunakan metode adsorpsi sangat dipengaruhi oleh jenis adsorben dan kondisi fisis pada proses adsorpsi.Usaha untuk meningkatkan kualitas adsorben telah dilakukan misalnya dengan mengembankan zat organik (2-merkapto- benzotiazol) pada padatan pendukung lempung (Filho dkk.,1995) dan pada zeolit alam (Sriyanti, 2000). Pada adsorpsi Zn oleh tanah diperlukan pengaturan kondisi pengembunan memadai untuk meningkatkan kapasitas adsorpsi (Mandal, 1997).
Hampir dalam tujuh dasawarsa terakhir studi pemanfaatan zeolit alam sebagai adsorben terus dilakukan. Sameshima dan Hemmi dalam Sand dan Mumpton (1976) telah memanfaatkan zeolit alam jenis mordernit untuk menyerap NH3 dan CO2. Di Australia telah dikembangkan pemanfaatan zeolit alam untuk menarik bakteri untuk meningkatkan aktivitas biologisnya sehingga proses pengolahan limbah lumpur teraktivitasi menjadi lebih efektif dan efisien (Canning, 2000). Zeolit alam Indonesia merupakan komoditi yang sangat melimpah dan telah dicoba untuk dimanfaatkan pada berbagai bidang. Di bidang pertanian digunakan untuk
memperbaiki kondisi tanah dan pada pengolahan air digunakan sebagai penukar kation logam berbahaya. Zeolit alam cukup menjanjikan untuk dimanfaatkan pada bidang pengolahan limbah seperti limbah radioaktif, hidrogen sulfida dan limbah pabrik tekstil.
Zeolit alam yang telah dilakukan pengolahan dengan teknik pengasaman dan penambahan kalium permanganat baik dimaksudkan untuk menghilangkan zat organik maupun sekaligus dealuminasi dimungkinkan akan meningkatkan jumlah situs aktif yang ada.
Dalam penelitian ini dipelajari pengaruh dealuminasi pada sifat adsorpsi zeolit alam untuk ion logam transisi. Mengingat keterbatasan yang ada dalam kesempatan ini karakteristik adsorpsi zeolit alam dipelajari dengan menggunakan ion logam kadmium sebagai contoh ion logam transisi.
Penelitian ini diarahkan untuk mempelajari dua prosedur dealuminasi yang berbeda. Perendaman dalam H2SO4 dan pengasaman lanjut menggunakan H2SO4 dan HCl, seperti diusulkan Filho (1995). Dengan dua proses dealuminasi perendaman dengan asam ini memberikan dealuminasi berbeda pada zeolit alam yang memungkinkan studi tentang pengaruh dealuminasi pada karakteristik adsorpsi zeolit alam terhadap ion logam Cd(II).
METODE PENELITIAN
Perlakuan terhadap zeolit alam ada tiga, dimulai dengan mencuci 120 gram zeolit alam dengan akuabides dan dikeringkan pada 800C selama 12 jam. Zeolit ini digunakan sebagai adsorben pertama disebut Z-11. Perlakuan kedua, 120 gram zeolit alam dimasukkan dalam
campuran 200 mL H2SO4 6 mol/L dan 200 mL KMnO4 0,5 mol/Lselama 4 jam pada temperatur 80oC sambil diaduk pelan-pelan dalam waterbath. Campuran didiamkam semalam pada temperatur kamar dan dicuci berulang-ulang dengan akuades sampai netral. Hasil dikeringkan dengan oven pada suhu 800C selama 12 jam.
Zeolit ini digunakan sebagai adsorben kedua dan disebut Z-22. Perlakuan ketiga sama dengan perlakuan kedua namun setelah proses pengeringan dilakukan perendaman ke dalam 100 mL H2SO4 6 mol/L selama 5 jam pada 80oC dan diaduk pelan-pelan dalam waterbath. Hasil dicuci sampai netral dan dikeringkan pada suhu 80oC selama 12 jam. Perendaman selanjutnya dilakukan dengan 150 mL HCl 6 mol/L selama 3 jam pada 80oC sambil diaduk pelan-pelan dalam waterbath. Kemudian dicuci sampai netral dan dikeringkan pada suhu 80oC selama 12 jam.
Zeolit ini sebagai adsorben ketiga dan disebut zeolit Z-33.
Setelah diperoleh Z-11, Z-22, dan Z-33 dilakukan analisis struktur dengan difraktometer sinar-X dan spektrofotometer FTIR. Rasio Si/Al diukur dengan menggunakan spektrofotometer UV Vis sesuai metode analisa Kimia Unsur- Unsur Utama dalam Bahan Bumi oleh Priyana dkk.(1979).
Penentuan Laju Adsorpsi Ion Cd(II) dengan memasukkan 200 miligram Z-11 dalam botol yang berisi 10 mL larutan ion logam Cd 50 mg/L. Campuran ini digojog menggunakan shaker dengan variasi waktu : 5, 10, 15, 20, 30, 45, 60, dan 90 menit. Kemudian disaring dengan kertas saring whatman 42, filtrat ditampung untuk analisis kandungan ion logam Cd(II)
dengan AAS. Prosedur ini juga dilakukan untuk adsorben Z-22 maupun Z-33.
Penentuan Kapasitas Adsorpsi Ion Cd(II) diawali dengan membuat 10 mL seri larutan ion logam Cd(II) dengan konsentrasi 25, 50, 100, 250, 500, 1000, 2000 dan 3000 mg/L dengan mengencerkan larutan induk. Larutan ini dimasukkan dalam botol yang berisi 200 mg Z- 11 dan digojog selama 90 menit dan disaring untuk memisahkan filtrat dan endapan. Filtrat dianalisis kandungan ion logam Cd(II) dengan AAS. Metode ini juga dilakukan untuk adsorben Z-22 maupun Z-33.
HASIL DAN PEMBAHASAN Analisis Struktur
Metode analisis struktur dengan difraksi sinar-X dilakukan untuk mengetahui jenis zeolit alam yang digunakan dan kemungkinan perubahan struktur akibat perlakuan dengan asam. Disamping mengetahui gugus fungsi zeolit, FTIR digunakan untuk memperkuat dugaan telah terjadi dealuminasi akibat perlakuan asam.
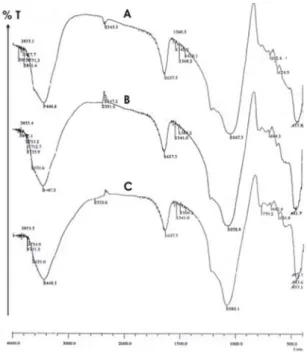
Sekilas pola spektra (gambar 1) antara Z- 11, Z-22 dan Z-33 terlihat sama, namun jika dicermati ada sedikit perbedaan berupa pergeseran puncak dari daerah bilangan gelombang 1047,3 cm-1 pada spektra Z-11 ke daerah bilangan gelombang 1058,8 cm-1 pada spektra Z-22 dan ke 1080,1 cm-1 untuk spektra Z- 33. Pergeseran ini menunjukkan terjadinya dealuminasi di mana pada Z-33 lebih nyata terlihat dibanding dengan Z-22. Bekkum dkk.
(1991) melaporkan bahwa dealuminasi mordernit akan teramati pada daerah bilangan gelombang 300 -1300 cm-1 berupa pergeseran puncak spektra
vibrasi Al-O dari bilangan gelombang 1055 cm-1 ke 1095 cm-1.
Pada difraktogram sinar-X Z-11, gambar 2.(A) muncul sebelas puncak karakteristik, lima di antaranya puncak-puncak dengan intensitas tinggi yang menunjukkan bahwa zeolit alam asal Tasik Malaya Jawa Barat pada pengambilan titik pertama saat eksplorasinya merupakan jenis mordernit dan mengandung sedikit klinoptilolit.
Puncak-puncak karakteristik mordernit muncul pada sudut-sudut 2 : 9,82 (9,98 A0); 14,53 (6,76 A0); 17,59 (5,59 A0); 19,71 (4,99 A0); 22,53 (4,37 A0); 23,00 (4,28 A0) dan 24,41 (4,04 A0) sedangkan puncak-puncak karakteristik klinoptilolit terlihat pada sudut-sudut 2 : 7,23 (13,55 A0); 12,88 (7,62 A0); 26,76 (3,69 A0) dan 30, 53 (3,24 A0) ( Ballmoos, 1984; Ebsworth, 1987; Jenkins, 1996).
Jika dibandingkan dengan difraktogram sinar-X Z-11, difraktogram sinar-X Z-22 memperlihatkan tidak ada perubahan nilai 2 dari puncak-puncak karakteristik. Puncak-puncak karakteristik makin terlihat jelas dan beberapa mengalami peningkatan intensitas yang ditunjukkan dengan bertambahnya tinggi puncak.
Hal ini disebabkan pada perlakuan dengan H2SO4 dan KMnO4 mampu menghilangkan pengotor-pengotor organik dalam kerangka struktur zeolit alam. Sinar-X datang yang mengenai bidang-bidang kristal pada struktur zeolit selanjutnya terdifraksikan dengan baik tanpa adanya bidang pengganggu yang berasal dari pengotor organik. Intensitas puncak yang tinggi pada sudut 2 = 26,76 (3,69 A0) mengindikasikan bahwa di samping mordernit sebagai mineral penyusun utama terdapat mineral klinoptilolit dalam zeolit alam ini.
Gambar 1 Spektra FTIR zeolit alam : (A) Pencucian dengan akuades, Z-11
(B) Perendaman dengan KMnO4, H2SO4 dan asam askorbat, Z-22
(C) Perendaman dengan KMnO4, H2SO4
dilanjutkan dengan H2SO4 dan HCl, Z-33
Gambar 2. Difraktogram sinar-X pada zeolit alam : (A) Pencucian dengan akuades, Z- 11 (B) Perendaman dengan KMnO4 dan H2SO4, Z-22 (C) Perendaman dengan KMnO4
H2SO4 dan HCl, Z-33.
Perbedaan mencolok terjadi antara difraktogram sinar-X Z-33 terhadap Z-11.
Intensitas puncak-puncak karakteristik pada sudut-sudut 2 mengalami penurunan yang signifikan. Jika puncak tertinggi pada difraktogram sinar-X Z-11 dianggap memiliki intensitas 100% maka penurunan intensitas puncak-puncak pada difraktogram sinar-X Z-33 sampai dengan 40% atau lebih terhadap intensitas puncak-puncak pada difraktogram sinar-X Z-11.
Penurunan intensitas dari interaksi sinar-X dengan padatan disebabkan oleh perubahan interferensi gelombang dari interferensi konstruktif kepada interferensi destruktif.
Interferensi konstruktif terjadi ketika gelombang- gelombang dalam ruang yang sama berinterferensi menghasilkan pergeseran lebih besar, dalam hal ini nilai amplitudonya yang sebanding dengan intensitas gelombang elektromagnetik (sinar-X). Interferensi destruktif terjadi jika gelombang-gelombang dalam ruang berinterferensi menghasilkan pergeseran lebih kecil (Atkins, 1990). Pengurangan intensitas yang drastis pada difraktogram sinar-X Z-33 dapat diakibatkan oleh perubahan kuantitas dari komponen satuan asimetris (ion, atom atau molekul) yang membentuk kristal zeolit alam.
Perubahan ini akan merubah pola yang dibentuk oleh titik yang merepresentasikan lokasi satuan asimetris (kisi ruang zeolit alam) akibat adanya perubahan dari interferensi konstruktif ke interferensi destruktif. Perubahan interferensi ini tidak terlepas dari proses perlakuan terhadap zeolit alam dengan H2SO4 dan KMnO4, diteruskan dengan H2SO4, serta diakhiri dengan HCl.
Mengingat tidak teramatinya penurunan intensitas puncak-puncak difraktogram akibat penambahan H2SO4 dan KMnO4 menunjukkan bahwa penurunan intensitas puncak-puncak pada difraktogram Z-33 karena penambahan HCl.
Penurunan intensitas dan hilangnya beberapa puncak karakteristik pada difraktogram Z-33 mengindikasikan adanya kerusakan kisi kristal berupa pemutusan ikatan molekul akibat penambahan asam klorida.
Rasio Si/Al
Untuk mengetahui jumlah Si dan Al dalam kerangka struktur zeolit alam dilakukan pengukuran menggunakan spektrofotometer UV- tampak. Besarnya kandungan Si dan Al diwakili oleh kadar SiO2 dan Al2O3.
Pada tabel 2 dapat dilihat bahwa dibanding Z-11, maka Z-22 maupun Z-33 memiliki kadar SiO2 lebih besar sedangkan kadar Al2O3 keduanya lebih kecil. Jika diasumsikan bahwa kenaikan kadar SiO2
sebanding dengan penurunan kadar Al2O3, dengan menghitung Al2O3 terkoreksi didapatkan harga rasio Si/Al.
Tabel 1 menunjukkan nilai rasio Si/Al dari Z-11 sampai Z-33 cenderung mengalami kenaikan. Kenaikan ini akibat perlakuan asam terhadap Z-22 maupun Z-33 menyebabkan AlO4
yang terletak di permukaan kerangka dan tidak terlindung dalam struktur zeolit terlepas atau terjadi proses dealuminasi.
Tabel 1. Kadar SiO2 dan Al2O3 serta rasio Si/Al
Zeolit
Kadar
SiO2 Kadar Al2O3 (%) rasio
alam* (%)
Analitis Koreksi Si/Al
Z-11 Z-22 Z-33
62,756 66,162 74,828
16,120 11,916 9,832
16,120 11,118 4,048
3,432 5,246 16,295
* Z-11 : Pencucian dengan akuades, Z-22 : Perendaman dengan KMnO4 dan H2SO4
Z-33 : Perendaman dengan KMnO4, H2SO4 dilanjutkan dengan H2SO4 dan HCl.
Tabel 1 juga menunjukkan kenaikan rasio Si/Al Z-33 jauh lebih tinggi dibanding Z-22 masing-masing 16,295 dan 5,246. Nilai rasio Si/Al yang besar ini akibat dari penggunaan asam mineral dengan kekuatan disosiasi berbeda.
Kekuatan disosiasi ini berhubungan dengan mudah dan tidaknya suatu asam menyumbangkan H+. Z-22 diperlakukan dengan asam sulfat dengan tetapan disosiasi asam Ka1 = 102 dan Ka2
= 1,2.10-2 sedangkan Z-33 disamping diperlakukan dengan asam sulfat, juga ditambah asam klorida yang mempunyai tetapan disosiasi asam Ka = 107. Ini berarti kekuatan disosiasi asam klorida jauh lebih besar dari asam sulfat sehingga kemampuan mendonorkan ion hidrogen lebih besar. Tentu saja perlakuan dengan asam klorida membuat proses dealuminasi menghasilkan lebih banyak gugus-gugus Si-OH (silanol) walaupun diikuti dengan perubahan kristalinitas (gambar 1) yang dimungkinkan akan mempengaruhi stabilitas fungsional.
Laju Adsorpsi
Laju adsorpsi ditentukan dengan membuat larutan ion kadmium pada konsentrasi tetap dan diinteraksikan dengan zeolit alam pada
setiap perlakuan dengan memvariasikan waktu adsorpsi. Laju adsorpsi dapat digunakan sebagai petunjuk awal apakah sistem adsorpsi berjalan secara fisis atau melibatkan ikatan kimia.
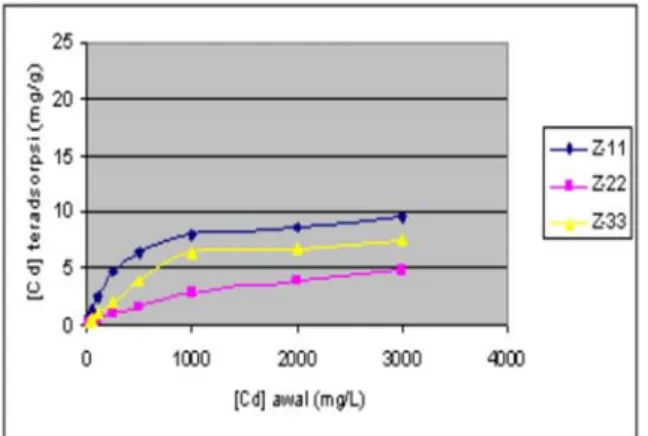
Umumnya adsorpsi kimia berlangsung lebih cepat dibanding adsorpsi fisika. Kurva yang menyatakan hubungan antara waktu adsorpsi dengan banyaknya ion kadmium teradsorpsi disajikan pada gambar 2.
Gambar 2. : Pengaruh waktu interaksi terhadap [Cd(II)] teradsorpsi pada zeolit alam : (Z-11) : Pencucian dengan akuades, (Z-22) Perendaman dengan KMnO4, H2SO4 dan asam askorbat, (Z- 33) Perendaman dengan KMnO4, H2SO4 dilanjutkan dengan H2SO4 dan HCl.
Pada gambar 2. terlihat bahwa adsorpsi ion cadmium mencapai kesetimbangan adsorpsi pada kisaran waktu interaksi 60 menit.
Selanjutnya bertambahnya waktu adsorpsi tidak signifikan mempengaruhi banyaknya konsentrasi ion Cd(II) teradsorpsi. Penentuan parameter kinetika adsorpsi ion Cd(II) pada zeolit alam berdasar pada persamaan laju adsorpsi yang dikemukakan oleh Langmuir-Hinshelwood, ln(C0/CA)/(C0–CA)+K = k1t/(C0–CA). C0 adalah konsentrasi ion Cd(II) mula-mula, CA merupakan
konsentrasi ion Cd(II) saat setimbang, K sebagai konstanta kesetimbangan, k1 adalah nilai konstanta laju adsorpsi dan t sebagai waktu adsorpsi. Dari persamaan ini plot antara ln(C0/CA)/( C0–CA) dengan t/(C0–CA) akan diperoleh intersep yang merupakan harga tetapan kesetimbangan adsorpsi (K) dan slop sebagai nilai tetapan laju adsorpsi (k1). Harga K dan k1 pada adsorpsi ion Cd(II) oleh zeolit alam pada setiap perlakuan disajikan dalam tabel 2.
Tabel 2. Harga parameter tetapan laju adsorpsi (k1) dan tetapan kesetimbangan adsorpsi (K) pada adsorpsi ion Cd(II) oleh zeolit alam.
Zeolit alam*
Parameter kinetika adsorpsi Tetapan laju
adsorpsi (menit-1)
Tetapan kesetimbangan adsorpsi(L/mol) Z-11
Z-22 Z-33
37 x 10-4 0,6 x 10-4 7,0 x 10-4
2,79 x 105 2,29 x 105 2,42 x 105
* Z-11: Pencucian dengan akuades, Z-22 : Perendaman dengan KMnO4, H2SO4 dan asam askorbat, Z-33 : Perendaman dengan KMnO4, H2SO4 dilanjutkan dengan H2SO4 dan HCl.
Pada tabel 2. menunjukkan bahwa dealuminasi zeolit yang terjadi justru menurunkan laju adsorpsi terlihat dari harga laju Z-22 dan Z-33 lebih kecil dari Z-11.
Dimungkinkan banyakknya gugus silanol(Si-OH) membuat zeolit berfungsi sebagai situs basa keras sementara Cd merupakan asam lunak. Untuk mendukung hipótesis ini selanjutnya dilakukan pengukuran kapasitas adsorpsi dalam sistem isoterm adsorpsi.
Isoterm adsorpsi
Jumlah adsorbat yang teradsorpsi pada suatu padatan tergantung pada temperatur, tekanan dan komposisi adsorbat. Sejumlah plot sebagai jumlah adsorbat gas yang teradsorpsi sebagai fungsi tekanan pada temperatur tetap disebut sebagai isoterm adsorpsi (Masel,1996).
Pada adsorpsi dalam fasa cair, fungsi tekanan dikonversi ke dalam fungsi konsentrasi. Pada proses isoterm adsorpsi terjadi keadaan kesetimbangan dimana tidak ada perubahan konsentrasi adsorbat pada permukaan padatan sedangkan laju adsorpsi dan desorpsinya sama.
Menurut Langmuir dalam Oscik (1982), Pada permukaan bahan penyerap terdapat jumlah tertentu situs aktif yang besarnya sebanding dengan luas permukaan adsorben. Ketika situs aktif bahan penyerap (adsorben) belum jenuh oleh bahan yang diserap (adsorbat), bertambahnya jumlah adsorbat dalam proses adsorpsinya akan meningkatkan jumlah adsorbat yang terserap. Pada keadaan adsorben telah jenuh oleh adsorbat maka penambahan jumlah adsorbat tidak meningkatkan jumlah adsorbat yang terserap. Jika digambarkan dalam suatu kurva, maka pernyataan Langmuir ini akan menghasilkan kurva lurus pada awalnya kemudian berangsur-angsur mendatar yang menunjukkan sistem adsorpsi telah berada pada keadaan kesetimbangan, seperti ditunjukkan pada gambar 3, pada adsorpsi ion Cd(II) oleh zeolit alam pada setiap perlakuan.
Pada gambar 3. terlihat bahwa pada adsorpsi ion Cd(II), bertambahnya konsentrasi ion Cd(II) dalam larutan akan meningkatkan jumlah konsentrasi ion Cd(II) yang teradsorpsi oleh zeolit alam pada setiap perlakuan.
Konsentrasi kesetimbangan dicapai pada kisaran 1000 mg/L, di atas konsentrasi ini, jumlah ion Cd(II) terserap relatif tetap.
Gambar 3. Kurva isoterm adsorpsi Cd(II) pada zeolit alam : (Z-11) Pencucian dengan akuades, (Z-22) Perendaman dengan KMnO4, H2SO4 dan asam askorbat, (Z-33) Perendaman dengan KMnO4, H2SO4 dilanjutkan dengan H2SO4 dan HCl.
Kapasitas Adsorpsi
Penentuan besarnya kapasitas adsorpsi ion Cd(II) oleh zeolit alam pada masing-masing perlakuan dilakukan dengan mengacu pada persamaan isoterm adsorpsi Langmuir, m = bKC/(1+KC). Pada kondisi tertentu persamaan ini dapat ditulis sebagai 1/(bK)+C/b = C/m, m adalah jumlah adsorbat tiap gram adsorben pada konsentrasi C, C merupakan konsentrasi adsorbat pada saat setimbang, K sebagai konstanta kesetimbangan adsorpsi dan b menyatakan jumlah adsorbat yang teradsorpsi pada keadaan jenuh, selanjutnya disebut sebagai nilai kapasitas adsorpsi. Plot antara C/m dengan C akan diperoleh nilai slop sebagai harga 1/b dan intersep yang merupakan nilai dari 1/(bK).
Dengan mengolah nilai intersep dan slop dari data isoterm adsorpsi pada gambar 3,
didapatkan harga kapasitas adsorpsi (b) dan tetapan afinitas adsorpsi (K) yang disajikan dalam tabel 3.
Tabel 3. Harga parameter kapasitas adsorpsi (b) dan tetapan kesetimbangan adsorpsi (K pada adsorpsi ion Cd(II) oleh zeolit alam.
Zeolit alam*
Parameter isoterm adsorpsi Langmuir Kapasitas adsorpsi Tetapan
kesetimbangan adsorpsi(L/mol) mg/g mol/g
Z-11 Z-22 Z-33
9,98 5,87 8,99
8,87 x 10-5 5,22 x 10-5 8,00 x 10-5
0,62 x 105 0,11 x 105 0,20 x 105
* Z-11: Pencucian dengan akuades, Z-22 : Perendaman dengan KMnO4, H2SO4 dan asam askorbat, Z-33 : Perendaman dengan KMnO4, H2SO4 dilanjutkan dengan H2SO4 dan HCl.
Pada tabel 3 terlihat nilai kapasitas adsorpsi Z-33 lebih besar dibanding Z-22.
Jumlah H+ protonik yang sedikit pada Z-33 meningkatkan kemampuan menyerap ion Cd(II).
Sebaliknya jumlah H+ protonik yang banyak pada Z-22 menurunkan kemampuan penyerapan terhadap ion Cd(II). Z-11 yang memiliki H+ paling sedikit mempunyai nilai kapasitas adsorpsi terhadap ion Cd(II) paling tinggi.
KESIMPULAN
Perlakuan dengan H2SO4 tanpa diikuti pengasaman dengan HCl mengakibatkan dealuminasi pada tingkat yang rendah, sedangkan perlakuan dengan H2SO4 diikuti pengasaman dengan HCl menimbulkan dealuminasi pada tingkat yang signifikan
Dealuminasi pada zeolit alam relatif menurunkan kapasitas adsorpsi zeolit alam terhadap ion Cd(II), kapasitas adsorpsi Z-11 ( b = 9,98 mg/g ) sedangkan kapasitas adsorpsi Z-22 ( b = 5,87 mg/g ) dan Z-33 (b = 8,99)
Dealuminasi pada zeolit alam relatif menurunkan laju adsorpsi ion Cd(II), laju adsorpsi Z-11 (k1 = 37. 10-4 menit-1) sedangkan laju adsorpsi Z-22 (k1 = 0,6. 10-4 menit-1). dan Z- 33 (k1 = 7,0.10-4 menit-1)
DAFTAR PUSTAKA
Atkins, P.W., 1990, Physical Chemistry, Oxford University Press, Tokyo.
Bekkum, H. V., E.M. Flanigen , J.C. Jansen, 1991, Introduction to Zeolite Science
and Practice, Elsevier Science Publishers B.V. Amsterdam, 247-269.
Ballmoos,R.V., 1984, Collection of Simulated XRD Powder Patterns for Zeolites, Mobile
Research and Delopment Corporation, Princeton, USA.
Canning, K., 2000, Novel Technology Enhances Activated Sludge Process, Pollution
Engineering, 10-11.
Ebsworth, E.A.V., Rankin, D.W.H. and Cradock, S., 1987, Structural Methods in
Inorganic Chemistry, Blackwell Scientific Publication, London.
Filho, N.L.D., Gushikem, Y. and Polito, W.L., 1995, 2-Mercaptobenzotiazol Clay as
Matrix for Sorption and Preconcentration of Heavy Metal from Aqueous Solution, Analytica Chimica Acta, 306.
Jenkins, R. and Snyder, R.L., 1996, Introduction to X-ray Powder Diffractometry, A
Series of Monographs on Analytical Chemistry and Its Applications, John Wiley & Sons, Inc, 138:47- 95.
Manahan Stanley, E., 1994, Environmental Chemistry, 6nd ed, Lewis Publishers, London.
Mandal, B., and Hazra, G.C., 1997, Zinc Adsorption in Soils as Influenced by
Different Soil Management Practices, Soil Science, 162:713-721.
Masel, R.I., 1996, Principle of Adsorption and Reaction on Solid Surfaces, John Wiley
& Sons, New York.
Noll Mark, R., 2002, Trace Elements in Environments, Journal of Environmental
Quality, 32:374
Oscik, J., 1982, Adsorption, John Wiley & Sons, Chicester.
Priyana, Mudjiran, Narsito dan Sayid Ahmad, 1979, Analisa Kimia Unsur-Unsur Utama
dalam Bahan-Bahan Bumi, FIPA, UGM, Yogyakarta.
Rachmawati, M.dan Sutarti, M., 1994, Zeolit, Pusat Dokumentasi dan Informasi LIPI.
Sand, L.B., and Mumpton, F.A., 1976, Natural Zeolites, Pergamon Press, Frankfurt.
Sriyanti, 2000, Impregnasi 2- Mercaptobenzotiazol pada Zeolit Alam dan
Pemanfaatannya pada Adsorpsi Selektif Kadmium(II) dan Besi(III) dalam Medium Air, Tesis-S2, FIPA, Universitas Gadjah Mada, Yogyakarta.
Stoeppler, M., 1992, Hazardous Metals in The Environment, Techniques and
Instrumentation in Analytical Chemistry, 12:76-77, Elsevier, Amsterdam.
![Gambar 2. : Pengaruh waktu interaksi terhadap [Cd(II)] teradsorpsi pada zeolit alam : (Z-11) : Pencucian dengan akuades, (Z-22) Perendaman dengan KMnO 4 , H 2 SO 4 dan asam askorbat, (Z-33) Perendaman dengan KMnO 4 , H 2 SO 4 dilanjutkan](https://thumb-ap.123doks.com/thumbv2/123dok/3723573.3919943/6.892.460.763.370.607/pengaruh-interaksi-teradsorpsi-pencucian-perendaman-askorbat-perendaman-dilanjutkan.webp)