UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL, FRAKSI N-HEKSAN DAN FRAKSI ETIL ASETAT DAUN SIBO (Leea indica (Burm. f.) Merr) DENGAN METODE DPPH
SKRIPSI
OLEH:
ENJELA PRESILYA SINAMO NIM 151501109
PROGRAM SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2020
UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL, FRAKSI N-HEKSAN DAN FRAKSI ETIL ASETAT DAUN SIBO (Leea indica (Burm. f.) Merr) DENGAN METODE DPPH
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara
OLEH:
ENJELA PRESILYA SINAMO NIM 151501109
PROGRAM SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2020
KATA PENGANTAR
Segala puji dan syukur kehadirat Tuhan Yang Maha Esa yang telah memberikan karunia yang berlimpah sehingga penulis dapat menyelesaikan penyusunan skripsi yang berjudul Uji Aktivitas Antioksidan Ekstrak Etanol, Fraksi n-Heksan dan Fraksi Etil Asetat Daun Sibo (Leea indica (Burm. F.) Merr) dengan Metode DPPH. Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini, penulis mengucapkan terima kasih kepada Bapak Drs. Nahitma Ginting, M.Si., Apt., selaku pembimbing I dan Ibu Dr. Marline Nainggolan, M.S., Apt., selaku pembimbing II yang telah membimbing penulis dengan penuh kesabaran dan tanggungjawab hingga selesainya penyusunan skripsi ini. Ucapan terima kasih juga penulis sampaikan kepada Prof Dr. Jansen Silalahi, M.App.Sc., Apt., selaku ketua penguji, Ibu Dra. Erly Sitompul, M.Si., Apt., selaku anggota penguji yang telah memberikan saran untuk penyempurnaan skripsi ini, dan kepada Ibu Dra. Sudarmi, M.Si., Apt., selaku dosen penasehat akademik serta Bapak dan Ibu staf pengajar Fakultas Farmasi USU yang telah banyak membimbing penulis selama masa perkuliahan. Penulis juga mengucapkan terima kasih kepada Ibu Prof. Dr. Masfria, M.S., Apt selaku Dekan Fakultas Farmasi yang telah menyediakan fasilitas kepada penulis selama perkuliahan di Fakultas Farmasi.
Penulis juga mengucapkan rasa terima kasih dan penghargaan yang tulus kepada kedua orangtua, Ayahanda Sahat MT Sinamo dan Ibunda Roslaini Tumanggor, serta abang dan kakak tercinta atas limpahan kasih sayang, semangat
dan doa yang tidak ternilai dengan apapun. Penulis juga mengucapkan terima kasih kepada para sahabat dan teman-teman tersayang Yolanda, Putri, Ija, Fatma, Paula, Devi yang selalu memberikan doa, dorongan dan pengorbanan baik moril maupun materil dalam penyelesaian skripsi ini.
Medan, 30 Januari 2020 Penulis,
Enjela Presilya Sinamo NIM 151501109
UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOL, FRAKSI
N
- HEKSAN DAN FRAKSI ETIL ASETAT DAUN SIBO (Leea indica(
Burm.f.) Merr.) DENGAN METODE DPPH ABSTRAK
Latar Belakang: Antioksidan merupakan suatu senyawa yang dapat menetralisir radikal bebas dan yang dapat menimbulkan berbagai macam penyakit. Sibo (Leea indica
(
Burm. f.) Merr.) termasuk famili Leeacea yang banyak digunakan dalam pengobatan penyakit diare, bisul, disentri, vertigo dan sakit kepala. Tanaman ini dapat digunakan sebagai sumber antioksidan alami karena mengandung senyawa aktif seperti flavonoid, alkaloid, tanin dan triterpenoid/steroid.Tujuan: Mengetahui aktivitas antioksidan dari ekstrak etanol, fraksi n-heksan dan fraksi etil asetat dari daun sibo dan sampel yang paling efektif sebagai antioksidan.
Metode: Pembuatan ekstrak etanol daun sibo dilakukan dengan cara maserasi menggunakan pelarut etanol 96%, kemudian difraksinasi dengan pelarut n-heksan dan etil asetat dan diuji aktivitas antioksidan dengan metode pemerangkapan radikal bebas DPPH (1,1-diphenyl-2-picrylhidrazyl) yang diukur menggunakan spektrofotometer visible.
Hasil: Hasil uji aktivitas antioksidan dari ekstrak etanol, fraksi n-heksan dan fraksi etil asetat daun sibo memiliki aktivitas antioksidan dengan nilai IC50 berturut-turut 10,80, 96,0 dan 8,16 μg/ml dengan pembanding vitamin C sebesar 4,80 μg/ml.
Kesimpulan: Berdasarkan hasil penelitian yang dilakukan dapat disimpulkan bahwa ekstrak etanol, fraksi n-heksan dan fraksi etil asetat dari daun sibo memiliki aktivitas antioksidan dimana ekstrak etanol dan fraksi etil asetat memiliki kekuatan yang sama dilihat dari nilai IC50 10,80 μg/ml (ekstrak etanol) dan 8,16 μg/ml (fraksi etil asetat).
Kata kunci: Antioksidan, Leea indica, ekstrak etanol dan fraksi daun sibo, DPPH
ANTIOXIDE ACTIVITY TEST OF ETHANOL EXTRACT,
n
-HEXANE FRACTION AND ETHYL ACETIC FRACTION OF SIBO LEAF (Leeaindica
(
Burm. f.) Merr.) USING DPPH ABSTRACTBackground: Antioxidants are compounds that can neutralize free radicals and can cause various diseases. Sibo (Leea indica (Burm. f.) Merr.) Includes the Leeacea family which is widely used in the treatment of diarrhea, boils, dysentery, vertigo and headaches. This plant can be used as a source of natural antioxidants because it contains active compounds such as flavonoids, alkaloids, tannins and triterpenoids/steroids.
Objective: Knowing the antioxidant activity of ethanol extract, n-hexane fraction and ethyl acetate fraction from sibo leaves and the most effective samples as antioxidants.
Method: Sibo leaf ethanol extract was made by maceration using 96% ethanol, then fractionated with n-hexane and ethyl acetate solvents and tested the antioxidant activity by DPPH free radical scavenger method (1,1-diphenyl-2- picrylhidrazyl) as measured using a spectrophotometer visible.
Results: The results of antioxidant activity tests of ethanol extract, n-hexane fraction and sibo leaf ethyl acetate fraction had antioxidant activity with IC50 values of 10.80, 96.0 and 8.16 μg/ml with a comparison of vitamins C was 4.80 μg/ml.
Conclusion: Based on the results of the research it could be concluded that the ethanol extract, n-hexane fraction and ethyl acetate fraction from sibo leaves had antioxidant activity, where ethanol extract and ethyl acetate fraction had the same strength seen from the IC50 value of 10.80 μg/ml (ethanol extract) and 8.16 μg/ml (ethyl acetate fraction).
Keywords: Antioxidant, Leea indica, ethanol extract and sibo leaf fraction, DPPH
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
SURAT PERNYATAAN TIDAK PLAGIAT ... vi
ABSTRAK ... vii
ABSTRACT ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 4
1.3 Hipotesis ... 4
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
1.6 Kerangka Pikir Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Radikal bebas ... 6
2.2 Antioksidan ... 6
2.3 Senyawa Fenol dan Flavonoid ... 8
2.3.1 Senyawa Fenol ... 8
2.3.2 Senyawa Flavonoid ... 9
2.4 Vitamin C ... 10
2.5 Uraian tumbuhan ... 10
2.5.1 Habitat dan daerah tumbuh ... 10
2.5.2 Morfologi Tumbuhan ... 11
2.5.3 Sistematika Tumbuhan ... 11
2.5.4 Nama Asing ... 12
2.5.5 Nama Daerah ... 12
2.5.6 Kandungan Kimia ... 12
2.5.7 Manfaat Tumbuhan Sibo ... 12
2.6 Ekstraksi ... 12
2.7 Fraksinasi (ekstraksi cair-cair) ... 14
2.8 Metode pemerangkapan radikal DPPH ... 15
2.8.1 Pelarut ... 17
2.8.2 Pengukuran absorbansi-panjang gelombang ... 17
2.8.3 Waktu Pengukuran ... 17
2.9 Spektrofotometer ... 17
BAB III METODE PENELITIAN ... 19
3.1 Alat dan bahan... 19
3.1.1 Alat ... 19
3.1.2 Bahan... 19
3.2 Pengumpulan dan Pengolahan Sampel ... 20
3.2.1 Pengumpulan Sampel ... 20
3.2.2 Identifikasi Tumbuhan ... 20
3.2.3 Pembuatan simplisia daun sibo ... 20
3.3 Pembuatan ekstrak dan fraksinasi ... 20
3.3.1 Pembuatan ekstrak etanol ... 20
3.3.2 Pembuatan fraksi ... 21
3.4 Pengujian aktivitas antioksidan dengan Spektrofotometer UV-Vis... 21
3.4.1 Prinsip metode penangkapan radikal bebas DPPH ... 21
3.4.2 Pembuatan larutan blanko DPPH ... 22
3.4.3 Pengukuran Kurva Absorbansi dan Operating Time ... 22
3.4.4 Pembuatan Larutan Uji ... 22
3.4.5 Pengukuran Kurva Kalibrasi Persen Peredaman DPPH oleh Larutan Uji Vitamin C ... 22
3.4.6 Pengukuran Kurva Kalibrasi Persen Peredaman DPPH oleh Larutan Uji ekstrak etanol dan fraksi etil asetat ... 23
3.4.7 Pengukuran Kurva Kalibrasi Persen Peredaman DPPH oleh Larutan Uji fraksi n-heksan ... 24
3.4.8 Analisis Aktivitas Antioksidan (IC50) ... 24
BAB IV HASIL DAN PEMBAHASAN ... 26
4.1 Identitas Tumbuhan ... 26
4.2 Ekstrak dan fraksi ... 26
4.3 Operating time ... 26
4.4 Pengujian antioksidan ... 27
4.4.1 Kurva absorbansi dari Larutan DPPH ... 27
4.4.2 Kurva Kalibrasi Persen Peredaman dan Persamaan Regresi ... 27
4.4.3 Persamaan regresi dan nilai IC50 Vitamin C dan sampel uji ... 30
BAB V KESIMPULAN DAN SARAN ... 32
5.1 Kesimpulan ... 32
5.2 Saran ... 32
DAFTAR PUSTAKA ... 33
LAMPIRAN ... 35
DAFTAR TABEL
Halaman 2.1 Kategori nilai IC50 sebagai antioksidan... 16 2.2 Spektrum Cahaya Tampak ... 18
DAFTAR GAMBAR
Halaman
1.1 Kerangka Pikir Penelitian ... 5
2.1 Struktur kimia Fenol ... 8
2.2 Struktur kimia tipe-tipe Flavonoid ... 9
2.3 Struktur kimia Vitamin C ... 10
2.4 Struktur kimia DPPH ... 15
2.5 Reaski antara DPPH dengan atom H netral yang berasal dari antioksidan ... 16
4.1 Kurva absorbansi larutan DPPH ... 27
4.2 Kurva kalibrasi % peredaman dari DPPH oleh Vitamin C ... 28
4.3 Kurva kalibrasi % peredaman dari DPPH oleh ekstrak etanol daun sibo ... 28
4.4 Kurva kalibrasi % peredaman dari DPPH oleh fraksi etil asetat daun sibo ... 29
4.5 Kurva kalibrasi % peredaman dari DPPH oleh n-heksan daun sibo ... 29
4.6 Diagram Aktivitas Antioksidan (IC50) Vitamin C dan Sampel Uji sibo ... 30
DAFTAR LAMPIRAN
` Halaman
1. Hasil identifikasi tumbuhan ... 35
2. Gambar tumbuhan dan daun sibo... 36
3. Gambar simplisia dan serbuk simplisia daun sibo ... 37
4. Bagan kerja penelitian ... 38
5. Bagan pembuatan ekstrak etanol daun sibo ... 39
6. Bagan pembuatan fraksi n-heksan dan fraksi etil asetat daun sibo ... 40
7. Tabel Data Hasil Pengukuran ... 41
8. Contoh perhitungan % peredaman DPPH oleh Sampel Uji ... 43
9. Contoh Perhitungan Nilai IC50 oleh sampel uji ... 44
10. Nilai IC50 Vitamin C dan Sampel uji ... 46
BAB I PENDAHULUAN
1.1 Latar Belakang
Pola kehidupan manusia sekarang telah mengalami perubahan seiring dengan perkembangan waktu. Ketidakseimbangan jumlah radikal bebas dengan jumlah antioksidan endogen yang diproduksi tubuh dapat menyebabkan terjadinya kerusakan sel yang disebut dengan stress oksidatif. Keadaan ini terjadi karena seringnya terpapar zat berbahaya ke dalam tubuh seperti asap rokok, asap kendaraan, makanan, sinar UV dan lain-lain yang dapat menimbulkan berbagai penyakit seperti kanker, jantung, katarak, penuaan dini, serta penyakit degeneratif lainnya (Yuslianti, 2018; Winarsi, 2007; Parwata, 2016).
Antioksidan adalah suatu senyawa yang dalam jumlah tertentu mampu menghambat atau menetralisir kerusakan akibat proses oksidasi yaitu dengan cara mengikat radikal bebas lalu mengubahnya menjadi senyawa yang tidak berbahaya bagi tubuh. Konsumsi aktioksidan dalam jumlah memadai dapat meningkatkan imunologis dan menurunkan penyakit degeneratif (Winarsi, 2007).
Antioksidan dapat diperoleh dari alam, baik yang berasal dari tumbuhan, hewan maupun bahan mineral. Senyawa antioksidan alami yang berasal dari tumbuhan umumnya adalah senyawa fenol atau polifenol yang dapat berupa golongan flavonoid yang terbukti mempunyai efek biologis yang kuat sebagai antioksidan (Yuslianti, 2018; Winarsi, 2007). Salah satu diantaranya adalah tanaman sibo (Leea indica) yang dapat menjadi sumber antioksidan alami dan dipercaya sebagai pengobatan berbagai jenis penyakit.
Sibo (Leea indica) merupakan tanaman yang banyak digunakan dalam
pengobatan tradisional di India dan negara lain seperti Thailand, Nepal, Indonesia, dan Malaysia (Kekuda, 2018). Di Indonesia, tanaman ini banyak terdapat di Sumatera, Jawa dan Borneo (Steenis, 1976). Menurut Bais (2013) daun dan akar dari tanaman ini dapat digunakan untuk mengobati diabetes, penyakit jantung, dan berbagai penyakit seperti demam, vertigo, sakit kepala, diare, dan disentri. Selain itu, rebusan daun sibo juga dapat digunakan selama kehamilan dan persalinan, mengobati keputihan, kanker usus, dan kanker rahim.
Ekstraksi merupakan suatu cara untuk menarik komponen kimia yang terdapat dalam bahan simplisia. Jenis ekstraksi dan cairan mana yang sebaiknya digunakan sangat tergantung dari kelarutan bahan kandungan serta stabilitasnya (Muchtaridi dkk., 2015). Metode ekstraksi yang digunakan pada penelitian ini yaitu maserasi atau bisa juga disebut perendaman. Maserasi merupakan cara ekstraksi yang paling sederhana (Muchtaridi dkk., 2015). Farmakope Indonesia edisi IV menetapkan bahwa sebagai cairan penyari adalah air, etanol, etanol-air, atau eter. Kemudian selanjutnya di fraksinasi untuk memisahkan golongan utama kandungan yang satu dari golongan utama yang lain. Fraksinasi merupakan metode pemisahan campuran menjadi beberapa fraksi yang berbeda susunannya.
Metode dari fraksinasi yang biasa digunakan adalah metode ekstraksi cair-cair.
Prosedur pemisahan senyawa dilakukan berdasarkan perbedaan kepolarannya, sehingga penelitian ini digunakan fraksinasi dengan n-heksan untuk menarik senyawa non polar seperti steroid/triterpenoid lalu difraksinasi kembali dengan etil asetat untuk menarik senyawa semi polar seperti flavonoid dan tanin (Muchtaridi dkk., 2015).
Vitamin C digunakan sebagai pembanding pada penelitian ini karena
diketahui memiliki antioksidan sangat kuat, dimana berperan sebagai reduktor untuk radikal bebas. Selain itu juga dapat meminimalkan terjadinya kerusakan yang disebabkan oleh stres oksidatif. (Lung, 2015).
Bangar (2018) telah melakukan penelitian terhadap daun sibo yang menyatakan bahwa fraksi n-heksan dan fraksi etil asetat daun sibo (leea indica) memiliki aktivitas antibakteri terhadap staphylococcus aureus dan escherichia coli. Hasil skrining dan karakterisasi serbuk simplisia dan ekstrak etanol yang telah dilakukan menunjukkan hasil positif pada senyawa alkaloid, flavonoid, glikosida, saponin, tanin dan triterpenoid/steroid dengan kadar air lebih kecil dari 10% yaitu 9,33%, kadar sari yang larut dalam air sebesar 11,32%, kadar sari yang larut dalam etanol sebesar 6,92%, kadar abu total sebesar 8,1% dan kadar abu tidak larut dalam asam sebesar 0,88%.
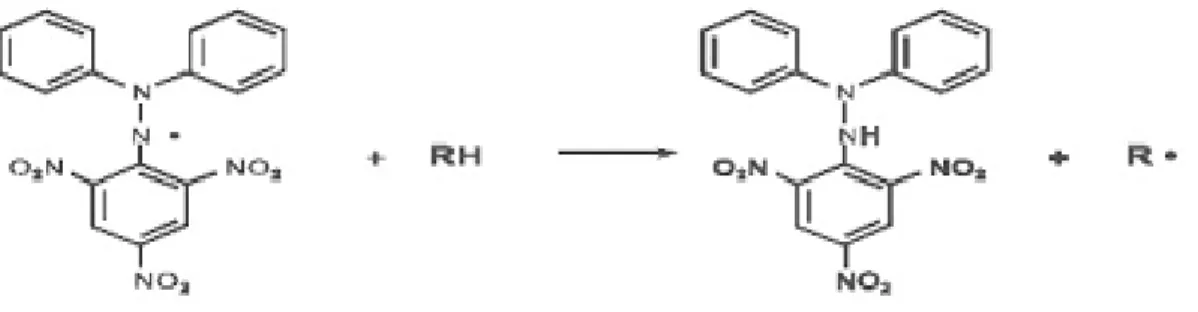
Salah satu uji yang dapat dilakukan untuk menentukan potensi antioksidan suatu senyawa adalah dengan menguji kemampuannya dalam meredam senyawa radikal DPPH (1,1-diphenyl-2-picrylhydrazyl). Metode DPPH merupakan metode in vitro yang sering dipilih dalam pengujian aktivitas antioksidan karena pengerjaannya yang sederhana, mudah, cepat, peka dan memerlukan sedikit sampel. Metode ini hanya membutuhkan senyawa DPPH yang bersifat stabil dan senyawa pembandingan seperti vitamin A, vitamin C dan vitamin E. Hasil dapat diamati dengan perubahan larutan dari violet menjadi kuning. Perubahan warna menunjukkan bahwa DPPH telah tereduksi oleh proses donasi hidrogen atau elektron dari senyawa antioksidan sehingga warnanya berubah dari violet ke kuning (Lung, 2015).
Berdasarkan uraian tersebut, maka dilakukan penelitian uji aktivitas
antioksidan ekstrak etanol, fraksi n-heksan dan fraksi etil asetat dari daun sibo dengan metode DPPH yang diukur menggunakan spektrofotometer visible.
1.2 Perumusan Masalah
Berdasarkan uraian pada latar belakang diatas, maka perumusan masalah penelitian adalah :
a. Apakah ekstrak etanol, fraksi n-heksan dan fraksi etil asetat dari daun sibo memiliki aktivitas antioksidan?
b. Manakah sampel yang paling efektif memberikan aktivitas antioksidan?
1.3 Hipotesis
Berdasarkan perumusan masalah tersebut, maka hipotesis penelitian ini adalah sebagai berikut:
a. Ekstrak etanol, fraksi n-heksan dan fraksi etil asetat dari daun sibo memiliki aktivitas antioksidan.
b. Fraksi etil asetat dari daun sibo memiliki aktivitas antioksidan paling efektif.
1.4 Tujuan Penelitian
Tujuan penelitian ini adalah sebagai berikut:
a. Untuk mengetahui aktivitas antioksidan ekstrak etanol, fraksi n-heksan dan fraksi etil asetat dari daun sibo
b. Untuk mengetahui sampel yang paling efektif sebagai antioksidan
1.5 Manfaat Penelitian
Diharapkan dari hasil penelitian ini, dapat diperoleh informasi tentang potensi aktivitas antioksidan ekstrak etanol, fraksi n-heksan dan fraksi etil asetat dari daun sibo.
1.6 Kerangka Pikir Penelitian
Gambar 1.1 Kerangka Pikir Penelitian Aktivitas
antioksidan
Inhibitory Concentration
(IC50) Variabel terikat Parameter
Ekstrak etanol, fraksi n-heksan dan fraksi etil asetat daun sibo Variabel bebas
BAB II
TINJAUAN PUSTAKA
2.1 Radikal Bebas
Radikal bebas adalah molekul, atom atau gugus yang memiliki 1 atau lebih elektron yang tidak berpasangan pada kulit terluarnya sehingga sangat reaktif.
Radikal bebas di dalam tubuh merupakan hasil samping dari proses oksidasi dan pembakaran sel yang berlangsung pada waktu bernafas, metabolisme sel, olahraga yang berlebihan, peradangan, dan terpapar polusi (asap kendaraan, asap rokok, makanan, logam berat, dan radiasi matahari). Radikal bebas akan bereaksi dengan molekul sel di sekitarnya untuk memperoleh pasangan elektron sehingga menjadi lebih stabil, tetapi molekul sel tubuh yang diambil elektronnya akan berubah menjadi radikal bebas. Reaksi ini akan berlangsung terus menerus dalam tubuh dan bila tidak dihentikan akan menimbulkan stress oksidatif yang menyebabkan suatu peradangan, kerusakan DNA atau sel dan berbagai penyakit seperti kanker, jantung, katarak, penuaan dini, serta penyakit degeneratif lainnya (Parwata, 2016;
Yuslianti, 2018).
2.2 Antioksidan
Antioksidan merupakan suatu senyawa yang dapat menyerap atau menetralisir radikal bebas sehingga mampu mencegah penyakit degeneratif seperti kardiovaskuler, karsinogenesis, dan penyakit lainnya. Senyawa antioksidan merupakan substansi yang diperlukan tubuh untuk menetralisir radikal bebas dan mencegah kerusakan yang ditimbulkan oleh radikal bebas terhadap sel normal, protein, dan lemak (Parwata, 2016). Antioksidan bekerja dengan cara
mendonorkan satu elektronnya kepada senyawa yang bersifat oksidan sehingga aktivitas senyawa oksidan tersebut dapat dihambat (Winarsi, 2007).
Zat aktif antioksidan dapat diekstrak dari sumber alami lingkungan kita baik yang berasal dari bahan tumbuhan, bahan hewan ataupun bahan mineral.
Senyawa antioksidan alami yang berasal dari tumbuhan umumnya adalah senyawa fenol atau polifenol yang dapat berupa golongan flavonoid, turunan asam sinamat, kumarin, tokoferol, dan asam-asam organic polifungsional. Golongan flavonoid memiliki antivitas antioksidan meliputi flavon, flavonol, isoflavon, katekin, flavonol, dan kalkon. Senyawa antioksidan alami ini dapat bereaksi sebagai pereduksi, penangkap radikal bebas dan pengkelat logam (Yuslianti, 2018).
Dalam melawan bahaya radikal bebas Anonim (2012) menggolongkan antioksidan menjadi 3 kelompok, yaitu:
1. Antioksidan Primer yaitu antioksidan yang berfungsi mencegah pembentukan radikal bebas selanjutnya (propagasi), seperti transferin, ferritin dan albumin.
2. Antioksidan Sekunder yaitu antioksidan yang berfungsi menangkap radikal bebas dan menghentikan pembentukan radikal bebas, seperti Superoxide Dismutase (SOD), Glutathion Peroxidase (GPx) dan katalase (Cat).
3. Antioksidan Tersier atau repair enzyme yaitu antioksidan yang berfungsi memperbaiki jaringan tubuh yang rusak oleh radikal bebas, seperti Metionin sulfosida reduktase, Metionin sulfosida reduktase, DNA repair enzymes, protease, transferase dan lipase.
Parwata (2016) membagi 3 kelompok antioksidan berdasarkan sumbernya, yaitu:
1. Antioksidan yang sudah diproduksi di dalam tubuh manusia yang dikenal
dengan antioksidan endogen atau enzim antioksidan (enzim Superoksida Dis- mutase (SOD), Glutation Peroksidase (GPx), dan Katalase (CAT).
2. Antioksidan sintetis yang banyak digunakan pada produk pangan seperti Butil Hidroksi Anisol (BHA), Butil Hidroksi Toluen (BHT), propil galat dan Tert- Butil Hidroksi Quinon (TBHQ).
3. Antioksidan alami yang diperoleh dari bagian-bagian tanaman seperti kayu, kulit kayu, akar, daun, buah, bunga, biji dan serbuk sari seperti vitamin A, vitamin C, vitamin E dan senyawa fenolik (flavonoid).
2.3 Senyawa Fenol dan Flavonoid 2.3.1 Senyawa Fenol
Senyawa fenol merupakan kelas utama antioksidan yang berada dalam tumbuh-tumbuhan. Senyawa ini diklasifikasikan dalam dua bagian yaitu fenol sederhana dan polifenol. Senyawa fenol meliputi aneka ragam senyawa yang berasal dari tumbuhan, yang mempunyai ciri sama yaitu cincin aromatis yang mengandung satu atau dua gugus hidroksil. Umumnya mudah larut dalam air karena sering kali berikatan dengan gula sebagai glikosida dan biasanya terdapat dalam vakuola sel, contohnya katekol, pirogalol dan asam galat. Sedangkan senyawa polifenol contohnya fenil propranolol, tanin, flavonoid dan beberapa terpenoid. Flavonoid merupakan golongan terbesar dari senyawa fenol (Harborne, 1987). Struktur kimia Fenol dapat dilihat pada Gambar 2.1 berikut.
Gambar 2.1 Struktur Kimia Fenol
2.3.2 Senyawa Flavonoid
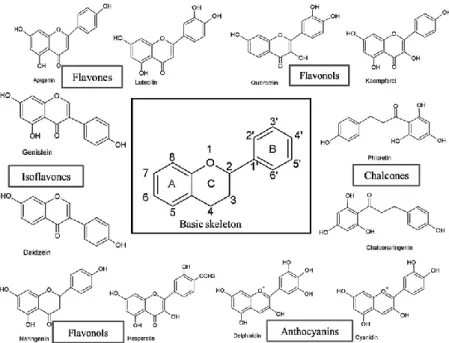
Flavonoid terdistribusi luas pada tanaman. Flavonoid merupakan kandungan khas tumbuhan yang terdapat hampir pada semua bagian tumbuhan seperti daun, akar, kayu, kulit, bunga dan biji. Flavonoid memiliki peranan yang cukup beragam pada tanaman, mulai dari memproduksi pigmen berwarna kuning, merah, atau biru pada bunga, hingga sebagai penangkal terhadap mikroba dan insekta (Andarwulan dan Faradilla, 2012).
Senyawa flavonoid merupakan salah satu senyawa polifenol yang memiliki struktur dasar terdiri atas 15 atom C (C6-C3-C6), dimana dua cincin aromatik yang dihubungkan oleh satuan karbon yang dapat atau tidak dapat membentuk cincin ketiga (Harborne, 1987). Berdasarkan perbedaan struktur C3 yang mengikat dua gugus benzen, flavonoid dapat dibagi menjadi tiga jenis.
Ketiga jenis tersebut adalah kalkon, auron, dan flavonoid (Andarwulan dan Faradilla, 2012). Struktur kimia tipe-tipe flavonoid dapat dilihat pada Gambar 2.2 berikut.
Gambar 2.2 Struktur Kimia tipe-tipe Flavonoid
2.4 Vitamin C
Vitamin C atau asam askorbat mempunyai berat molekul 176, 13 dengan rumus bangun C6H8O6 dan titik lebur ±190oC. Pemerian: serbuk atau hablur putih agak kuning, tidak berbau, rasa asam, oleh pengaruh cahaya lambat laun menjadi gelap, dalam larutan cepat teroksidasi. Kelarutan: mudah larut dalam air, agak sukar larut dalam etanol, tidak larut dalam kloroform, dalam eter dan dalam benzena. Penyimpanan dalam wadah tertutup rapat, terlindung dari cahaya (Depkes RI, 1995). Struktur kimia Vitamin C dapat dilihat pada Gambar 2.3 berikut.
Gambar 2.3 Struktur kimia Vitamin C
Vitamin C dikenal sebagai senyawa utama tubuh yang dibutuhkan dalam berbagai proses penting, mulai dari pembuatan kolagen (protein berserat yang membentuk jaringan tulang), pengangkut lemak, pengangkut elektron dari berbagai reaksi enzimatik, pemacu gusi yang sehat, pengatur tingkat kolesterol, serta pemacu imunitas (Sayuti, 2015).
1.1.
1.2.
2.5 Uraian Tumbuhan
2.5.1 Habitat dan daerah tumbuh
Leea indica banyak digunakan dalam pengobatan tradisional di India dan negara lain seperti Thailand, Nepal, Indonesia, dan Malaysia (Kekuda, 2018). Di Indonesia tanaman ini banyak terdapat di Sumatera, Jawa dan Borneo. Tanaman ini umumnya terdapat di hutan dan sering dijumpain sepanjang sungai, daerah bukit dan lereng-lereng (Steenis, 1976).
2.5.2 Morfologi Tumbuhan
Sibo (Leea indica) adalah tanaman perdu yang tinggi tanamannya kurang lebih 5 meter. Batang tanaman tegak, berkayu, bulat, bekas melekatnya daun nampak jelas dan batangnya berwarna hijau. Daun tanamannya majemuk, bentuk daunnya berseling lonjong, pertulangan daunnya menyirip, panjang daun 8-16 cm, lebar daun 3-7 cm, tangkai bulat dan daun berwarna hijau. Bunga dari tanaman ini majemuk, berkelamin dua, bunganya berbentuk payung, terdapat diketiak daun, kelopak bunga berbentuk bintang, mahkota bunga berbentuk torong, kepala sari berwarna putih. Buah berbentuk bulat dan berwarna hitam, bijinya berbentuk bulat dan berwarna putih dan akarnya tunggang dan berwarna coklat (Hutapea dkk., 1994).
2.5.3 Sistematika Tumbuhan
Menurut hasil identifikasi tumbuhan dari Herbarium Medanese Sumatera Utara, Sibo (Leea indica (Burm. f.) Merr)
Kindom : Plantae
Divisi : Spermatophyta Kelas : Dicotyledoneae Bangsa : Rhamnales
Suku : Leeacea Marga : Leea
Jenis : Leea indica (Burm. f.) Merr.
2.5.4 Nama Asing
Sibo (Leea indica) umumnya dikenal sebagai Bandicoot berry (Inggris), Chhatri (Sansekerta) dan Hastipalash (Hindi), Karkani (Marathi), Ottannalam (Tamil), Manipiranta (Malayalam), huo tong shu (Chinese) (Khare, 2007).
2.5.5 Nama Daerah
Tanaman sibo (Leea indica) di Indonesia memiliki berbagai macam nama daerah seperti malimali (melayu,borneo), kituwa (sunda), kayutuwa (jawa), ghirang (Madura), kolatada (Ternate), dan ngeteda (Halmahera), malimali hantu (palembang) (Hutapea dkk., 1994).
2.5.6 Kandungan Kimia
Sibo (Leea indica) mengandung senyawa alkaloid, flavonoid, saponin, tanin dan triteroenoid/steroid (Talha, dkk., 2012). Pada daun teridentifikasi setidaknya dua puluh tiga senyawa fitokimia termasuk sebelas hidrokarbon, asam ftalat, asam palmitat, Eicosanol, solanesol, farnesol, tiga ester, asam ftalat, asam galat, lupeol, sitosterol, dan asam ursolat (Srinivasan dkk, 2008).
2.5.7 Manfaat Tumbuhan Sibo
Tanaman ini banyak digunakan untuk mengobati diabetes, penyakit jantung, dan berbagai penyakit seperti demam, vertigo, pusing, sakit kepala, pegal, keseleo, kejang otot, diare, dan disentri. Selain itu, daun kering dikonsumsi sebagai minuman teh dan diyakini efektif melawan kanker sedangkan rebusan
daun sibo ini juga dapat digunakan selama kehamilan dan persalinan, mengobati keputihan, kanker usus, dan kanker Rahim (Bais, 2013).
2.6 Ekstraksi
Ekstraksi adalah suatu proses pemisahan bahan dari campurannya dengan menggunakan pelarut yang sesuai. Ekstrak adalah sediaan kering, kental atau cair dibuat dengan menyari simplisia menurut cara yang cocok, di luar pengaruh cahaya matahari langsung. Menurut Depkes RI (2000), ada beberapa metode ekstraksi yang sering digunakan antara lain yaitu:
A. Cara dingin 1. Maserasi
Maserasi adalah penyarian simplisia dengan cara perendaman menggunakan pelarut disertai sesekali pengadukan pada temperatur kamar.
Maserasi yang dilakukan pengadukan secara terus menerus disebut maserasikinetik, sedangkan yang dilakukan penambahan ulang pelarut setelah dilakukan penyaringan terhadap maserat pertama dan seterusnya disebut remaserasi.
2. Perkolasi
Perkolasi adalah proses penyarian simplisia menggunakan alat perkolator dengan pelarut yang selalu baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada temperatur kamar. Proses perkolasi terdiri dari tahap pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya terus menerus sampai diperoleh perkolat.
B. Cara Panas 1. Refluks
Refluks adalah proses penyarian simplisia pada temperatur titik didihnya menggunakan alat pendingin balik dalam waktu tertentu dimana pelarut
akan terkontaminasi menuju pendingin dan kembali ke labu.
2. Digesti
Digesti adalah proses penyarian dengan maserasi kinetik (pengadukan kontinu) pada temperatur lebih tinggi dari temperatur ruangan, yaitu secara umum dilakukan pada temperatur 40-50oC. Metode ini digunakan terhadap sampel yang mengandung komponen kimia yang tahan terhadap sedikit pemanasan.
3. Sokletasi
Sokletasi adalah proses penyarian menggunakan pelarut yang selalu baru, dilakukan dengan menggunakan alat khusus (soklet) dimana pelarut akan terkondensasi dari labu menuju pendingin, kemudian jatuh membasahi sampel.
4. Infundasi
Infundasi adalah proses penyarian dengan menggunakan pelarut air pada temperatur 90oC selama 15 menit.
5. Dekoktasi
Dekoktasi adalah proses penyarian dengan menggunakan pelarut air pada temperatur 90oC selama 30 menit.
2.7 Fraksinasi (Ekstraksi Cair-Cair)
Fraksinasi adalah suatu metode pemisahan senyawa organik berdasarkan kelarutan senyawa-senyawa tersebut dalam dua pelarut yang tidak saling bercampur, biasanya antara pelarut air dan pelarut organik (Dey dan Harborne, 1989).
Teknik pemisahan ekstraksi cair-cair ini biasanya dilakukan dengan menggunakan corong pisah. Kedua pelarut yang saling tidak bercampur tersebut dimasukkan ke dalam corong pisah, kemudian digojok dan didiamkan. Solut atau senyawa organik akan terdistribusi ke dalam fasenya masing-masing bergantung pada kelarutannya terhadap fase tersebut dan kemudian akan terbentuk dua lapisan, yaitu lapisan atas dan lapisan bawah (Odugbemi, 2008).
Ekstrak dipartisi dengan menggunakan peningkatan polaritas pelarut seperti petroleum eter, n-heksan, kloroform, dietil eter, etil asetat dan etanol.
Pemilihan pelarut pada ekstraksi umumnya bergantung pada sifat analitnya dimana pelarut dan analit harus memiliki sifat yang sama. Contohnya analit yang sifat lipofilitasnya tinggi akan terekstraksi pada pelarut yang relatif nonpolar seperti n-heksan sedangkan analit yang semipolar terlarut pada pelarut yang semipolar seperti etil asetat atau diklorometana (Venn, 2008).
1.3.
2.8 Metode pemerangkapan radikal DPPH
DPPH pertama kali ditemukan pada tahun 1992 oleh Goldschmidt dan Renn. DPPH mempunyai berat molekul 394,32 dengan rumus bangun C18H12N5O6, bubuk berwarna gelap dan penyimpanan dalam wadah tertutup baik pada suhu -20oC (Molyneux, 2004), larutan berwarna ungu pekat, bentuk
tereduksinya berwarna orange-kuning (Ionita, 2005) dan terdiri dari molekul radikal bebas yang stabil. Struktur kimia DPPH dapat dilihat pada Gambar 2.4 berikut.
Gambar 2.4 Struktur kimia DPPH
Metode pemerangkapan radikal bebas DPPH adalah metode in vitro yang sering dipilih dalam pengujian aktivitas antioksidan karena pengerjaannya yang sederhana, mudah, cepat, peka dan memerlukan sedikit sampel. Metode ini hanya membutuhkan senyawa DPPH yang bersifat stabil dan senyawa pembandingan seperti vitamin A, vitamin C dan vitamin E. Hasil dapat diamati dengan perubahan larutan dari violet menjadi kuning. Perubahan warna menunjukkan bahwa DPPH telah tereduksi oleh proses donasi hidrogen atau elektron dari senyawa antioksidan sehingga warnanya berubah dari violet ke kuning (Lung, 2015). Reaksi antara DPPH dengan atom H netral dapat dilihat pada Gambar 2.5 berikut.
(1,1-diphenyl-2-pikrilhidrazil) (1,1-diphenyl-2-pikrilhidrazine)
Gambar 2.5 Reaksi antara DPPH dengan atom H netral yang berasal dari Antioksidan
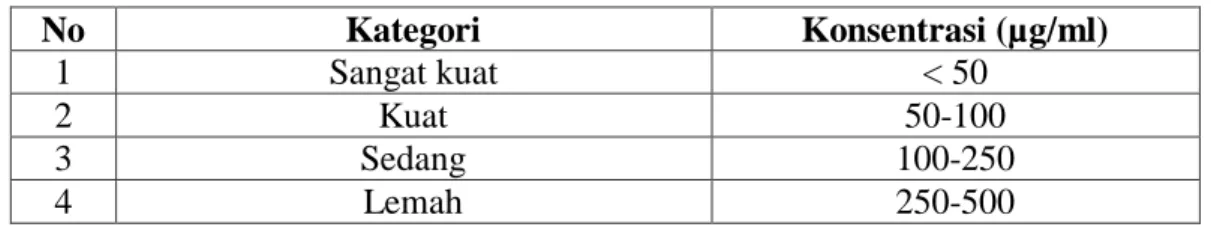
Parameter yang dipakai untuk menunjukkan aktivitas antioksidan adalah nilai Inhibitory Concentration (IC50) yaitu konsentrasi suatu zat antioksidan yang dapat menyebabkan 50% DPPH kehilangan karakter radikal atau konsentrasi suatu zat antioksidan yang memberikan persen perendaman sebesar 50%
(Molyneux, 2004). Kategori nilai IC50 sebagai antioksidan dapat dilihat pada Tabel 2.1 berikut.
Tabel 2.1 Kategori Nilai IC50 sebagai Antioksidan
No Kategori Konsentrasi (µg/ml)
1 Sangat kuat < 50
2 Kuat 50-100
3 Sedang 100-250
4 Lemah 250-500
(Putri dan Hidajati, 2015).
2.8.1 Pelarut
Metode ini akan bekerja dengan baik menggunakan pelarut metanol atau etanol karena pelarut ini tidak mempengaruhi reaksi antara sampel uji sebagai antioksidan dengan DPPH sebagai radikal bebas (Molynex, 2004).
2.8.2 Pengukuran absorbansi-panjang gelombang
Panjang gelombang maksimum yang digunakan dalam pengukuran sampel uji sangat bervariasi. Menurut beberapa literatur panjang maksimum untuk DPPH antara lain 515-520 nm. Apabila pengukuran menghasilkan tinggi puncak maksimum, maka itu merupakan panjang gelombangnya yaitu sekitar panjang gelombang yang disebutkan diatas (Molyneux, 2004).
2.8.3 Waktu pengukuran
Lama pengukuran metode DPPH dalam beberapa penelitian bervariasi yaitu 5 menit, 10 menit, 20 menit, 30 menit dan 60 menit (Molyneux, 2004).
Waktu reaksi yang tepat adalah ketika reaksi sudah mencapai kesetimbangannya.
Kecepatan reaksi dipengaruhi oleh sifat dari aktivitas antioksidan yang terdapat di dalam sampel (Rosidah dkk., 2008).
2.9 Spektrofotometer
Spektrofotometri merupakan salah satu metode dalam kimia analisis yang digunakan untuk menentukan komposisi suatu sampel baik secara kuantitatif dan kualitatif yang didasarkan pada interaksi antara materi dengan cahaya. Sedangkan peralatan yang digunakan dalam spektrofotometri disebut spektrofotometer.
Cahaya yang dimaksud dapat berupa cahaya visibel, UV dan inframerah.
Sedangkan materi dapat berupa atom dan molekul namun yang lebih berperan adalah elektron valensi (Hasibuan, 2015).
Prinsip kerja Spektrofotometri adalah bila cahaya (monokrommatik ataupun campuran) jatuh pada suatu medium homogen, sebagian dari sinar masuk akan dipantulkan sebagian diserap dalam medium itu dan sisanya diteruskan. Nilai yang keluar dari cahaya yang diteruskan dinyatakan dalam nilai absorbansi karena memiliki hubungan dengan konsentrasi sampel (Hasibuan, 2015).
Spektrofotometri ultraviolet dan spektrofotometri visible adalah salah satu metode analisis yang paling sering digunakan dalam industri farmasi. Metode ini dilakukan pengukuran penyerapan pada radiasi monokromatik dengan larutan komponen obat, sinar ultraviolet berada pada panjang gelombang 200-400 nm, sedangkan sinar tampak berada pada panjang gelombang 400-800 (Muchlisyam
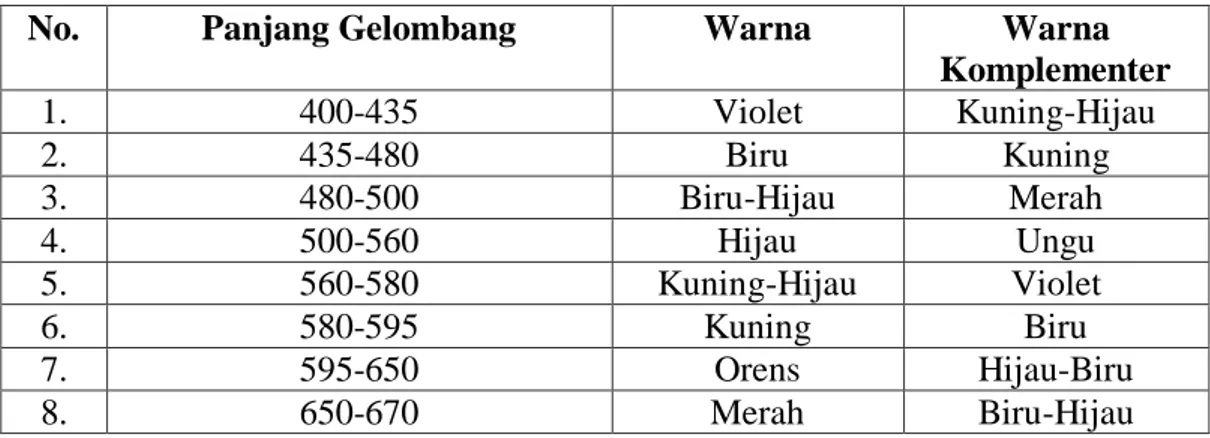
dan Pardede, 2017). Spektrum Cahaya Tampak dapat dilihat pada Tabel 2.2 berikut.
Tabel 2.2 Spektrum Cahaya Tampak
No. Panjang Gelombang Warna Warna
Komplementer
1. 400-435 Violet Kuning-Hijau
2. 435-480 Biru Kuning
3. 480-500 Biru-Hijau Merah
4. 500-560 Hijau Ungu
5. 560-580 Kuning-Hijau Violet
6. 580-595 Kuning Biru
7. 595-650 Orens Hijau-Biru
8. 650-670 Merah Biru-Hijau
(Gandjar dan Rohman, 2018).
BAB III
METODOLOGI PENELITIAN
Jenis penelitian yang dilakukan adalah eksperimental dengan variabel bebas menggunakan berbagai macam konsentrasi ekstrak etanol dan fraksi daun sibo serta variabel terikat adalah aktivitas antioksidan. Metodologi penelitian meliputi pembuatan ekstrak etanol dengan cara maserasi menggunakan pelarut etanol 96%, fraksinasi dengan pelarut n-heksan dan etil asetat serta uji aktivitas antioksidan menggunakan metode pemerangkapan radikal bebas DPPH (1,1- diphenyl-2-picrylhidrazyl) yang diukur secara spektrofotometer visible. Penelitian dilakukan di Laboratorium Fitokimia dan Laboratorium Penelitian, Fakultas Farmasi, Universitas Sumatera Utara.
3.1 Alat dan Bahan 3.1.1 Alat
Alat-alat yang digunakan pada penelitian ini yaitu: alat-alat gelas (Pyrex dan Oberoi), bola hisap, blender (Miyako), hot plate, kuvet, maat pipet, mikro pipet, neraca analitik (Vibra), neraca kasar (O’haus), pipet volume (Herma), rotary evaporator (Stuart) dan spektrofotometer UV-Vis (Shimadzu).
3.1.2. Bahan-Bahan
Bahan tumbuhan yang digunakan dalam penelitian ini adalah daun Sibo (Leea indica). Bahan kimia yang digunakan kecuali disebutkan adalah etanol 96%, DPPH (1,1-diphenyl-2-picrylhidrazyl) (Sigma-Aldrich), Vitamin C (CSPC Welsbeng Pharmaceutical CO., Ltd), akuades, metanol, n-heksana, dan etil asetat.
3.2 Pengumpulan dan Pengolahan Sampel 3.2.1 Pengumpulan Sampel
Pengambilan bahan tumbuhan dilakukan secara purposif, tanpa membandingkan dengan tumbuhan yang sama dari daerah lain. Sampel yang digunakan pada penelitian ini adalah daun sibo (Leea indica) yang diambil dari Jalan Bunga ester 2, Pasar VI Padang bulan, Kecamatan Medan Selayang, Sumatera Utara. Gambar tumbuhan dapat dilihat pada Lampiran 2, Halaman 36.
3.2.2 Identifikasi tumbuhan
Identifikasi tumbuhan dilakukan di Herbarium Medanense, Laboratorium Herbarium Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA) Universitas Sumatera Utara. Hasil identifikasi tumbuhan dapat dilihat pada Lampiran 1, Halaman 35.
3.2.3 Pembuatan simplisia daun sibo
Daun sibo (Leea indica) dibersihkan dari kotoran yang melekat, dicuci, ditiriskan, lalu dikeringkan di udara terbuka (diangin-anginkan) terlindung dari cahaya matahari. Selanjutnya dikeringkan di lemari pengering dengan suhu ± 40°C sampai kering. Sampel yang telah kering dan rapuh dihaluskan dengan blender. Serbuk simplisia sebelum digunakan disimpan dalam wadah plastik tertutup rapat dan terlindung dari cahaya matahari. Gambar simplisia dapat dilihat pada Lampiran 3, Halaman 37. Bagan kerja penelitian dapat dilihat pada Lampiran 4, Halaman 38.
3.3 Pembuatan Ekstrak dan fraksinasi 3.3.1 Pembuatan Ekstrak etanol
Pembuatan ekstrak dilakukan secara maserasi menggunakan pelarut etanol 96%. Masukkan 600 g simplisia ke dalam wadah, tambahkan 75 bagian cairan penyari, biarkan selama 5 hari terlindung dari cahaya sambil sering diaduk, cuci ampas dengan cairan penyari secukupnya hingga diperoleh 100 bagian. Pindahkan ke dalam bejana tertutup, terlindung dari cahaya, biarkan selama 2 hari, lalu disaring. Maserat diuapkan dengan rotary evaporator pada temperatur ±40oC sampai diperoleh ekstrak kental, kemudian dipekatkan dengan menggunakan penangas uap (Depkes RI, 1995). Bagan kerja pembuatan ekstrak etanol dapat dilihat pada Lampiran 5, Halaman 39.
3.3.2 Pembuatan fraksi
Pembuatan fraksi dilakukan secara ekstraksi cair-cair menggunakan pelarut n-heksan dan etil asetat. Sebanyak 10 g ekstrak etanol dilarutkan dengan etanol sedikit demi sedikit dan tambahkan akuades 40 ml, lalu dimasukkan ke dalam corong pisah. Kemudian ditambahkan 40 ml n-heksan, dikocok lalu
didiamkan sampai diperoleh 2 lapisan, n-heksan (lapisan atas) dipisahkan.
Difraksinasi dilakukan sampai warna lapisan n-heksan jernih. Sisanya (lapisan bawah) ditambahkan 50 ml etil asetat, dikocok lalu didiamkan sampai terdapat 2 lapisan, lapisan etil asetat (lapisan bawah) dipisahkan dan fraksinasi dilakukan sampai warna lapisan etil asetat jernih. Fraksi yang diperoleh diuapkan sampai kental. Bagan kerja pembuatan fraksi dapat dilihat pada Lampiran 6, Halaman 40.
3.4 Pengujian Aktivitas Antioksidan dengan Spektrofotometer UV-Vis 3.4.1 Prinsip metode penangkapan radikal bebas DPPH
Kemampuan sampel uji dalam meredam DPPH (1,1-diphenyl-2-picryl- hydrazil) sebagai radikal bebas dalam larutan metanol (sehingga terjadi perubahan warna DPPH dari ungu menjadi kuning), dengan nilai IC50 (konsentrasi sampel uji yang mampu meredam radikal bebas 50%), digunakan sebagai parameter untuk menentukan aktivitas antioksidan sampel uji tersebut (Molynex, 2004).
3.4.2 Pembuatan Larutan Blanko DPPH
Sebanyak 20 mg DPPH ditimbang, dimasukkan ke dalam labu tentukur 100 ml, dicukupkan dengan metanol sampai garis tanda (konsentrasi 200 µg/ml).
Larutan DPPH (konsentrasi 200 µg/ml) dipipet sebanyak 5 ml, kemudian dimasukkan ke dalam labu tentukur 25 ml, dicukupkan volumenya dengan metanol sampai garis tanda (konsentrasi 40 µg/mL) (Molyneux, 2004).
3.4.3 Pengukuran Kurva Absorbansi dan Operating Time
Larutan DPPH dengan konsentrasi 40 µg/ml dipindahkan ke dalam kuvet dan diukur absorbansinya dengan spektrofotometer menggunakan panjang gelombang 400-800 nm. Kemudian Larutan DPPH konsentrasi 40 µg/ml diukur
absorbansi larutan pada panjang gelombang 516 nm setiap 1 menit selama 60 menit dan diamati waktu larutan tersebut mulai menghasilkan absorbansi yang stabil, yang akan digunakan sebagai Operating Time.
3.4.4 Pembuatan Larutan Uji
Sebanyak 25 mg serbuk vitamin C, ekstrak etanol, fraksi n-heksan dan fraksi etil asetat ditimbang, dimasukkan masing-masing ke dalam labu tentukur 25 ml lalu volumenya dicukupkan dengan metanol sampai garis tanda (konsentrasi 1000 µg/ml) selanjutnya disebut larutan uji vitamin C, ekstrak etanol, fraksi n- heksan dan fraksi etil asetat.
3.4.5 Pengukuran Kurva Kalibrasi Persen Peredaman DPPH oleh Larutan Uji Vitamin C
Larutan uji vitamin C (konsentrasi 1000 μg/ml) dipipet sebanyak 0,01, 0,015, 0,02, 0,025 dan 0,03 ml. Masing-masing dimasukkan ke dalam labu tentukur 5 ml (untuk mendapatkan konsentrasi larutan uji 2, 3, 4, 5 dan 6 μg/ml), Ditambahkan 1 ml larutan induk baku DPPH (konsentrasi 200 µg/ml) ke dalam masing-masing labu tentukur, dicukupkan volumenya dengan metanol sampai garis tanda, didiamkan di tempat gelap selama 30 menit. Diukur absorbansinya dengan spektrofotometer UV-Vis pada panjang gelombang 516 nm.
Persen perendaman pada Vitamin C sebagai kontrol positif dihitung dengan rumus sebagai berikut :
Keterangan : A kontrol = Absorbansi tidak mengandung sampel A Sampel = Absorbansi sampel
Perhitungan % Perendaman
=
𝐴𝑘𝑜𝑛𝑡𝑟𝑜𝑙−𝐴𝑠𝑎𝑚𝑝𝑒𝑙𝐴𝑘𝑜𝑛𝑡𝑟𝑜𝑙
× 100%
3.4.6 Pengukuran Kurva Kalibrasi Persen Peredaman DPPH oleh Larutan Uji Ekstrak Etanol dan Fraksi Etil Asetat
Larutan uji ekstrak etanol dan fraksi etil asetat (konsentrasi 1000 μg/ml) dipipet masing-masing sebanyak 0,025, 0,0375, 0,05, 0,0625 dan 0,075 ml.
Masing-masing dimasukkan ke dalam labu tentukur 5 ml (untuk mendapatkan konsentrasi larutan uji 5, 7,5, 10, 12,5 dan 15 μg/ml). Ditambahkan 1 ml larutan induk baku DPPH (konsentrasi 200 µg/ml) kedalam masing-masing labu tentukur, dicukupkan volumenya dengan metanol sampai garis tanda, didiamkan di tempat gelap selama 30 menit. Diukur absorbansinya dengan spektrofotometer UV-Vis pada panjang gelombang 516 nm.
Persen perendaman pada ekstrak etanol dan fraksi etil asetat sebagai sampel uji dihitung dengan rumus sebagai berikut :
Keterangan : A kontrol = Absorbansi tidak mengandung sampel A Sampel = Absorbansi sampel
3.4.7 Pengukuran Kurva Kalibrasi Persen Peredaman DPPH oleh Larutan Uji Fraksi N-Heksan
Larutan uji fraksi n-heksan (konsentrasi 1000 μg/ml) sebanyak 0,2, 0,3, 0,4, 0,5 dan 0,6 ml. Masing-masing dimasukkan ke dalam labu tentukur 5 ml (untuk mendapatkan konsentrasi larutan uji 40, 60, 80, 100 dan 120 μg/ml).
Ditambahkan 1 ml larutan induk baku DPPH (konsentrasi 200 µg/ml) kedalam masing-masing labu tentukur, dicukupkan volumenya dengan metanol sampai garis tanda, didiamkan di tempat gelap selama 30 menit. Diukur absorbansinya dengan spektrofotometer UV-Vis pada panjang gelombang 516 nm.
Perhitungan % Perendaman
=
𝐴𝑘𝑜𝑛𝑡𝑟𝑜𝑙−𝐴𝑠𝑎𝑚𝑝𝑒𝑙𝐴𝑘𝑜𝑛𝑡𝑟𝑜𝑙
× 100%
Persen perendaman pada fraksi n-heksan sebagai sampel uji dihitung dengan rumus sebagai berikut :
Keterangan : A kontrol = Absorbansi tidak mengandung sampel A Sampel = Absorbansi sampel
3.4.8 Analisis Aktivitas Antioksidan (IC50)
Perhitungan yang digunakan dalam penentuan aktivitas pemerangkapan radikal bebas adalah nilai IC50 (Inhibitory Concentration 50%). Nilai IC50
merupakan bilangan yang menunjukkan konsentrasi (μg/ml)/volume efektif (ml) dari sampel uji dan vitamin C yang memberikan peredaman DPPH sebesar 50%, sehingga nilai 50 disubstitusikan untuk nilai y. Setelah mensubstitusikan nilai 50 pada nilai y, akan didapat nilai x sebagai nilai IC50. Rumus yang menentukan nilai IC50. Sebagai berikut :
Keterangan: y = 50 (% peredaman DPPH) x = Konsentrasi(μg/ml) /nilai IC50
a = slope
b = intersept/koefisien regresi
Perhitungan % Perendaman
=
𝐴𝑘𝑜𝑛𝑡𝑟𝑜𝑙−𝐴𝑠𝑎𝑚𝑝𝑒𝑙𝐴𝑘𝑜𝑛𝑡𝑟𝑜𝑙
× 100%
Y= ax+b
BAB IV
HASIL DAN PEMBAHASAN
4.1 Identitas Tumbuhan
Identifikasi tumbuhan dilakukan di Herbarium Medaneese, Fakultas Matematika dan Ilmu pengetahuan alam (FMIPA) Universitas Sumatera Utara Medan, hasilnya menunjukan sampel yang digunakan termasuk familia Leeaceae, spesies Leea indica. Hasil identifikasi tumbuhan dapat dilihat pada lampiran 1, halaman 35.
4.2 Ekstrak dan fraksi
Ekstraksi simplisia daun sibo digunakan pelarut etanol 96% hasilnya diperoleh ekstrak etanol daun sibo sebanyak 42,17 g dari 600 g simplisia.
Rendemen diperoleh sebesar 7,02 %. Penggunaan pelarut etanol 96% betujuan untuk menarik senyawa metabolit sekunder pada daun sibo.
Fraksinasi ekstrak etanol daun sibo dengan pelarut n-heksan diperoleh 1,8 g fraksi n-heksan dari 10 g dengan rendemennya 18%, dan fraksi etil asetat diperoleh 5,2 g dengan rendemen 52%.
4.3 Operating time
Penentuan operating time bertujuan untuk mengetahui waktu pengukuran yang stabil. Berdasarkan literatur operating time yang digunakan dan direkomendasikan yaitu 30 menit (Molyneux, 2004), tetapi dalam beberapa penelitian waktu yang digunakan bervariasi.
4.4 Pengujian antioksidan
4.4.1. Kurva absorbansi dari Larutan DPPH
Pengukuran panjang gelombang serapan maksimum larutan DPPH 40 µg/ml dalam metanol dengan menggunakan spektrofotometer UV-Vis menghasilkan serapan maksimum pada panjang gelombang 516 nm yang dapat dilihat pada Gambar 4.1.
Gambar 4.1 Kurva Absorbansi Larutan DPPH dalam Metanol (40 µg/ml) Menggunakan Spektrofotometer UV-Visible
Pada gambar diatas diperoleh hasil pengukuran yang menunjukkan bahwa larutan DPPH dalam metanol menghasilkan serapan maksimum sebesar 0,9677 pada panjang gelombang 516 nm dan termasuk dalam kisaran panjang gelombang sinar tampak (400-800 nm) serta termasuk dalam rentang panjang gelombang DPPH yang berkisar antara 515-520 nm (Molyneux, 2004).
4.3 Kurva Kalibrasi Persen Peredaman dan Persamaan Regresi
Kurva kalibrasi persen peredaman diperoleh menggunakan Microsoft Excel 2010, menghubungkan pengaruh konsentrasi sampel terhadap persen peredaman radikal bebas DPPH yang diperoleh dari perhitungan absorbansi pada sampel.
Data hasil pengukuran absorbansi Vitamin C dan sampel dapat dilihat pada Lampiran 7, Halaman 41. Dan contoh perhitungan persen peredaman untuk mendapatkan persamaan regresi dapat dilihat pada Lampiran 8, Halaman 43 serta kurva kalibrasi persen peredaman Vitamin C dan sampel dapat dilihat pada Gambar 4.2, 4.3, 4.4, 4.5 berikut.
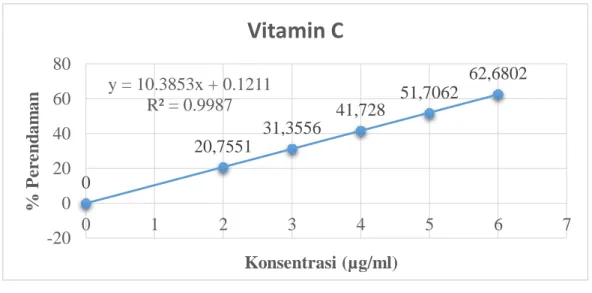
Gambar 4.2 Kurva Kalibrasi % Peredaman dari vitamin C
Gambar 4.3 Kurva Kalibrasi % Peredaman dari ekstrak etanol daun sibo 0
20,7551
31,3556
41,728
51,7062
62,6802 y = 10.3853x + 0.1211
R² = 0.9987
-20 0 20 40 60 80
0 1 2 3 4 5 6 7
% Perendaman
Konsentrasi (µg/ml)
Vitamin C
0
28,5032
37,8383 45,2338
56,3115
67,607 y = 4,3467x + 3,0409
R² = 0.9941
0 20 40 60 80
0 2 4 6 8 10 12 14 16
% Perendaman
Konsentrasi (µg/ml)
Ekstrak Etanol
0
41,6139 50,9905
63,0951 70,1172
82,2528 y = 5.2402x + 7.6941
R² = 0.9792
0 20 40 60 80 100
0 2 4 6 8 10 12 14 16
% Perendaman
Konsentrasi (µg/ml)
Fraksi Etil asetat
Gambar 4.4 Kurva Kalibrasi % Peredaman dari fraksi etil asetat daun sibo
Gambar 4.5 Kurva Kalibrasi % Peredaman dari fraksi n-heksan daun sibo Pada gambar di atas, terlihat bahwa terjadi peningkatan persentase peredaman dengan adanya peningkatan konsentrasi senyawa antioksidan. Hal ini disebabkan karena terjadinya penurunan absrobansi yang membuktikan adanya aktivitas pemerangkapan radikal bebas DPPH oleh larutan uji yaitu ekstrak etanol, fraksi n-heksan, fraksi etil asetat dan vitamin C.
Interaksi antioksidan dengan DPPH baik secara transfer elektron atau radikal hidrogen pada DPPH akan menetralkan radikal bebas dari DPPH. Warna larutan berubah dari ungu tua menjadi kuning terang dan absorbansi pada panjang gelombang 516 nm akan hilang jika semua elektron pada radikal bebas DPPH menjadi berpasangan (Molyneux, 2004).
4.4.3 Persamaan regresi dan nilai IC50 Vitamin C dan sampel uji
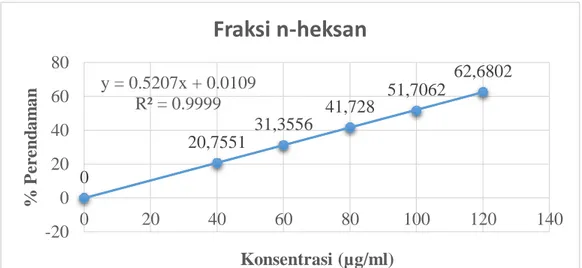
Nilai IC50 (Inhibitory Concentration) diperoleh berdasarkan persamaan regresi linier yang didapatkan dengan memplot konsentrasi larutan uji dan persen peredaman DPPH sebagai parameter aktivitas antioksidan dengan konsentrasi larutan uji (µg/ml) sebagai absis (X) dan nilai persen peredaman sebagai ordinat
0
20,7551
31,3556
41,728
51,7062
62,6802 y = 0.5207x + 0.0109
R² = 0.9999
-20 0 20 40 60 80
0 20 40 60 80 100 120 140
% Perendaman
Konsentrasi (µg/ml)
Fraksi n-heksan
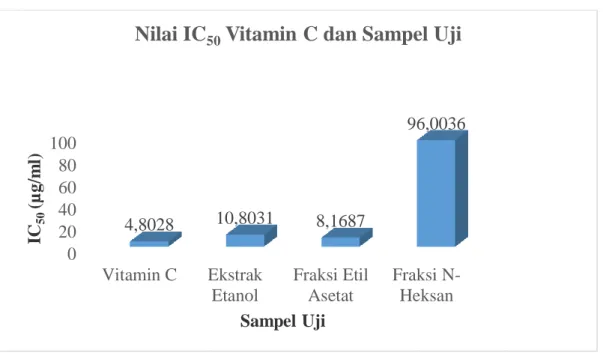
(Y). Contoh perhitungan aktivitas antioksidan (IC50) dari sampel uji dapat dilihat pada Lampiran 9, Halaman 44. Data aktivitas antioksidan Vitamin C dan sampel uji dapat dilihat pada Lampiran 10, Halaman 46 serta diagram aktivitas antioksidan (IC50) Vitamin C dan sampel uji dapat dilihat pada Gambar 4.6 berikut.
Gambar 4.6 Diagram aktivitas antioksidan (IC50) Vitamin C dan sampel uji Aktivitas antioksidan didasarkan pada besarnya IC50, diklasifikasikan ke dalam 4 kelompok yaitu sangat kuat (<50 μg/ml), kuat (50-100 μg/ml), sedang (100-250 μg/ml) dan lemah (250-500 μg/ml) (Putri dan Hidajati, 2015). Zat yang mempunyai aktivitas antioksidan yang tinggi, akan mempunyai nilai IC50 yang rendah (Molyneux, 2004).
Pada Gambar 4.6 diperoleh bahwa vitamin C, ekstrak etanol, fraksi n- heksan, fraksi etil asetat daun sibo memiliki aktivitas antioksidan yang berbeda satu dengan yang lain. Ekstrak etanol dan fraksi etil asetat memiliki aktivitas antioksidan yang sangat kuat dengan nilai IC50 10,80 dan 8,16 µg/ml yang sama kuatnya dan vitamin C sebagai pembanding dengan nilai IC50 4,80 µg/ml. Fraksi
0 20 40 60 80 100
Vitamin C Ekstrak Etanol
Fraksi Etil Asetat
Fraksi N- Heksan 4,8028 10,8031 8,1687
96,0036
IC50 (µg/ml)
Sampel Uji
Nilai IC
50Vitamin C dan Sampel Uji
n-heksan memiliki aktivitas antioksidan yang kuat dengan nilai IC50 96 µg/ml.
Nilai IC50 berbanding terbalik dengan aktivitas antioksidan, semakin tinggi aktivitas antioksidannya, maka nilai IC50 semakin rendah (Molyneux, 2004).
Pembanding yang digunakan pada penelitian ini adalah vitamin C, dimana jika nilai IC50 sampel sama atau mendekati nilai IC50 pembanding maka dapat dikatakan bahwa sampel berpotensi sebagai salah satu alternatif antioksidan yang sangat kuat (Ridho, 2013).
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan 1.
2.
3.
4.
a. Ekstrak etanol, fraksi n-heksan dan fraksi etil asetat daun sibo memiliki aktivitas antioksidan dengan IC50 sebesar 10,80 μg/ml, 96,0 μg/ml dan 8,16 μg/ml.
b. Fraksi etil asetat dari daun sibo memiliki aktivitas antioksidan paling efektif dengan nilai IC50 sebesar 8,16 μg/ml.
5.2 Saran
Disarankan kepada peneliti selanjutnya untuk menguji aktivitas antioksidan ekstrak daun sibo dengan metode berbeda seperti ABTS dan memformulasikannya dalam bentuk sediaan obat.
DAFTAR PUSTAKA
Andarwulan, N., dan Faradilla, RH. F. 2012. Sayuran Fenolik pada Beberapa Sayuran Indigenous Dari Indonesia. Bogor: SEAFAST Center, IPB.
Halaman 57-60.
Bais, S. 2013. A Phytopharmacological Review on an Important Medicinal Plant:
Leea indica. Inventi Rapid: Ethnopharmacology Vol 1:1-2.
Bangar, R.I. 2019. Uji Aktivitas Antibakteri Fraksi n-heksana dan Fraksi Etilasetat Daun Sibo (Leea indica F) Terhadap Staphylococcus aureus dan Escherichia coli. Skripsi. 2019. Fakultas Farmasi. Universitas Sumatera Utara: Medan. Halaman 40.
Depkes R. I. 1979. Farmakope Indonesia. Edisi Ketiga. Jakarta: Departemen Kesehatan RI. Halaman 733, 772.
Depkes RI. 1995. Materia Medika Indonesia. Jilid VI. Cetakan keenam. Jakarta:
Badan Penelitian dan Pengembangan Kesehatan. Halaman 297-307, 321, 325.
Depkes RI. 2000. Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta Depkes RI. Halaman 1, 9-12, 17.
Dey, P. M. dan Harborne, B. J. 1989. Methods in Plant Biochemistry. Volume I.
Plant Phenolics. London: Academic Press. Halaman 81-82.
Gandjar, I. G., dan Rohman, A. 2018. Kimia Farmasi Analisis. Yogyakarta:
Pustaka Pelajar. Halaman 222, 243, 252-256.
Harborne, J. B. 1987. Metode Fitokimia Penuntun Cara Modern Menganalisa Tumbuhan. Edisi Kedua. Diterjemahkan oleh Padmawinata, K., dan Soediro, I. Bandung: Penerbit ITB. Halaman 47-51.
Hasibuan, E. 2015. Pengenalan Spektrofotometri Pada Mahasiswa yang melakukan Penelitian Di Laboratorium Terpadu Fakultas Kedokteran USU. Karya Tulis Ilmiah. Halaman 8,14.
Hutapea, J. R., Soerahso., Sutjipto., Djumidi., Sugiarso, S., Widiastuti, Y., dkk.
1994. Inventaris Tanaman Obat Indonesia. Jilid 3. Jakarta: Direktorat Jenderal Pengawasan Obat dan Makanan Departemen Kesehatan Indonesia. Halaman 127..
Ionita, P. 2005. Is DPPH Stable Free Radical a Good Scavenger for Oxygen Active Species. Bucharest. Chemical Paper. Vol 59(1): 11-16.
Kekuda, T. R. P., Raghavendra, H. L., Bharadwaj, N A., Akhilesha, S. 2018.
Traditional Uses, Chemistry And Pharmacological Activities Of Leea Indica (Burm. F.) Merr.(Vitaceae): A Comprehensive Review.
International Journal Of Green Pharmacy. Vol 12 (1): 1-2.
Khare, C. P. 2007. Indian Medicinal Plants An Illustrated Dictionary. Verlag Berlin/Heidlberg: Springer Science + Business Media, LLC. Halaman 366.
Lung, J. K. S., dan Destiani, D. P. 2015. Uji aktivitas Antioksidan Vitamin A, C dan E dengan metode DPPH. Review Artikel. Vol15 (1). Halaman 54.
Molyneux, P. 2004. The Use of the Stabl e Free Radical Diphenylpicrylhydrazyl (DPPH) for Estimating Antioxidant Activity. Songklanakarin J. Sci.
Technol. Vol 26(2): 211-219.
Muchlisyam dan Pardede, T. R. 2017. Spektrofotometri dan Analisis Multikomponen Obat. Medan : USU Press. Halaman 7-13.
Muchtaridi, Hasanah, A. N., dan Musfiroh, I. 2015. Ekstraksi Fasa Padat:
Aplikasi Pada Persiapan Analisis. Cetakan pertama. Yogyakarta: Graha Ilmu. Halaman 3-4.
Odugbemi, T. 2008. A Textbook of Medicinal Plants from Nigeria. Nigeria:
University of Lagos Press. Hal 219-220.
Parwata, I M . 2016. Buku Ajar: Antioksidan. Kimia Terapan Program Pascasarjana Universitas Udayana. Halaman 4-6.
Putri, A.A.S dan Hidajati, N. 2015. Uji Aktivitas Antioksidan Senyawa Fenolik Ekstrak Metanol Kulit Batang Tumbuhan Nyiri Batu (Xylocarpus Moluccensis). UNESA Journal of Chemistry. Vol 4 (1): 5.
Ridho, E. A., Rafika, S., dan Sri, W. 2013. Uji Aktivitas Antioksidan Ekstrak Metanol Buah Lakum (Cayratia trifolia) dengan Metode DPPH (2,2- difenil-1-pikrilhidrazil). Fakultas Kedokteran. Universitas Tanjungpura Pontianak. Halaman 1-9.
Rosidah, Yam, M. F., Sadikun, A., Asmawi, M. Z. 2008. Antioxidant Potential of Gynura procumbens. Pharmaceutical Biology. 46(9): 616-625.
Sayuti, K., dan Yenrina, R. 2015. Antioksidan Alami dan Sintetik. Padang:
Andalas University Press. Halaman 25-16.
Silalahi, J. (2006). Makanan Fungsional. Yogyakarta: Kanisius. Halaman 40,47, dan 48.
Srinivasan, G. V. 2008. Identification of chemical compunds from the leaves of Leea indica. Acta Pharm. Vol 58(2008): 207-214.
Steenis, C. G. J.V. (1976). Flora Malesiana. Volume 7 part 4. Leyden:
Noordhoff international Publishing. Halaman 779-781.
Tahla, J., Priyanka, M. dan Akanksha, A. 2011. Hypertension and herbal plants.
International Research Journal of Pharmacy. Vol 2: 26-30
Venn, R . F. 2008. Principles and Practices of Bioanalysis. Edisi kedua. Prancis:
Taylor and Francis Group Ltd. Halaman 23-25.
Winarsi, H. 2007. Antioksidan Alami dan Radikal Bebas. Yogyakarta: Kanisius.
Halaman: 13, 18; 79-80.
Yuslianti, E.R. 2018. Pengantar Radikal Bebas dan Antioksidan. Yogyakarta:
Deepublish. Halaman 1-50.
Lampiran 1. Hasil identifikasi tumbuhan sibo (Leea indica)
Lampiran 2. Gambar tumbuhan dan daun sibo (Leea indica)
Tumbuhan sibo (Leea indica)
Daun sibo (Leea indica)
Lampiran 3. Simplisia dan serbuk simpisia daun sibo (Leea indica)
Simplisia daun sibo (Leea indica)
Serbuk simplisia daun sibo (Leea indica)
Lampiran 4. Bagan kerja penelitian
Simplisia kering
Ekstrak Etanol
Ditimbang berat kering Dihaluskan dengan blender Dimaserasi dengan etanol 96%
Daun sibo
Dicuci bersih lalu ditiriskan Dikeringkan dilemari pengering
Difraksinasi dengan n-heksan dan etil asetat
Fraksi n-heksan Fraksi etil asetat
Uji aktivitas anioksidan
Lampiran 5. Bagan pembuatan ekstrak etanol daun sibo (Leea indica)
Maserat II
Ditambahkan 25 bagian etanol 96%
hingga diperoleh 100 bagian, dibiarkan selama 2 hari sambil sesekali diaduk
Diserkai Serbuk simplisia
Dimaserasi dengan etanol 96% sebanyak 75 bagian pelarut ditutup rapat, dibiarkan selama 5 hari sambil sesekali diaduk Diserkai
Dipekatkan di rotary evaporator
Diuapkan di penangas Ekstrak kental
Ampas
Maserat I
Maserat
Digabung
Lampiran 6. Bagan pembuatan fraksi n-heksan dan fraksi etil asetat daun sibo (Leea indica)
Fraksi etil asetat
Difraksinasi dengan etil asetat
Dikocok dan di diamkan sampai terbentuk 2 lapisan Difraksinasi sampai tidak memberikan reaksi positif terhadap pereaksi FeCl3 Ekstrak etanol
Ditambahkan dengan etanol dan akuades Dimasukkan dalam corong pisah
Difraksinasi dengan n-heksan
Dikocok dan dibiarkan sampai terbentuk 2 lapisan
Difraksinasi sampai tidak memberikan reaksi positif terhadap pereaksi Lieberman- Bouchardat
Fraksi sisa Fraksi n-heksan
Fraksi n-heksan pekat
Dikumpulkan Dipekatkan di penangas air Fraksi etil asetat
pekat Dikumpulkan Dipekatkan di penangas air
Fraksi air
Lampiran 7. Tabel Data Hasil Pengukuran
Nama Sampel
Konsentrasi Absorba nsi
Rata-rata absorbansi
% Peredaman
I II III
Vitamin C
0 0, 9642 0,9641 0,9642 0,9641 0
2 0,7646 0,7640 0,7636 0,7640 20,7551
3 0,6619 0,6619 0,6617 0,6618 31,3556
4 0,5620 0,5618 0,5616 0,5618 41,7280
5 0,4660 0,4656 0,4652 0,4646 51,7062
6 0,3602 0,3599 0,3594 0,3598 62,6802
Nama Sampel
Konsentrasi Absorbansi
Rata-rata absorbansi
% Perendaman
I II III
Ekstrak Etanol
0 0,9642 0,9641 0,9642 0,9641 0
5 0,6896 0,6895 0,6890 0,6893 28,5032
7,5 0,6001 0,5990 0,5988 0,5993 37,8383
10 0,5349 0,5247 0,5246 0,5280 45,2338
12,5 0,4215 0,4213 0,4210 0,4212 56,3115
15 0,3126 0,3124 0,3120 0,3123 67,6070
Nama Sampel
Konsentrasi Absorbansi
Rata-rata absorbansi
% Perendaman
I II III
Fraksi Etil Asetat
0 0,9642 0,9641 0,9642 0,9641 0
5 0,5629 0,5630 0,5629 0,5629 41,6139
7,5 0,4727 0,4724 0,4724 0,4725 50,9905
10 0,3561 0,3559 0,3556 0,3558 63,0951
12,5 0,2885 0,2883 0,2876 0,2881 70,1172
15 0,1714 0,1712 0,1707 0,1711 82,2528
Lampiran 7. (Lanjutan)
Nama Sampel
Konsentrasi Absorbansi
Rata-rata absorbansi
% Perendaman
I II III
Fraksi n- heksan
0 0,9642 0,9641 0,9642 0,9641 0
40 0,7646 0,7640 0,7636 0,7640 20,7551
60 0,6619 0,6619 0,6617 0,6618 31,3556
80 0,5620 0,5618 0,5616 0,5618 41,7280
100 0,4660 0,4656 0,4652 0,4656 51,7062
120 0,3602 0,3599 0,3594 0,3598 62,6802
Lampiran 8. Contoh perhitungan % peredaman DPPH oleh sampel Uji 1. Ekstrak Etanol
Konsentrasi Absorbansi
Rata-rata absorbansi
% Perendaman
I II III
0 0, 9642 0,9641 0,9642 0,9641 0
5 0,6896 0,6895 0,6890 0,6893 28,5032
7,5 0,6001 0,5990 0,5988 0,5993 37,8383
10 0,5349 0,5247 0,5246 0,5280 45,2338
12,5 0,4215 0,4213 0,4210 0,4212 56,3115
15 0,3126 0,3124 0,3120 0,3123 67,6070
Keterangan : A Kontrol = Absorbansi tidak mengandung sampel A Sampel = Absorbansi sampel
a. Perhitungan % Peredaman ekstrak etanol
Konsentrasi 5 μg/ml% Peredaman
=
−
× 100%
= 28,5032%
Konsentrasi 7,5 μg/ml
% Peredaman = −
× 100%
= 37,8383%
Konsentrasi 10 μg/ml% Peredaman
=
−
× 100%
= 45,2338%
Konsentrasi 12,5 μg/ml
% Peredaman = −
× 100%
= 56,3115%
Konsentrasi 15 μg/ml% Peredaman
=
−
× 100%
= 67,6070%
Perhitungan % Peredaman
=
𝐴𝑘𝑜𝑛𝑡𝑟𝑜𝑙−𝐴𝑠𝑎𝑚𝑝𝑒𝑙𝐴𝑘𝑜𝑛𝑡𝑟𝑜𝑙