SINTESIS CAIRAN (IONIC LIQUID 1-ETIL-3- METILIMIDAZOLIUM ASETAT [EMIM] Ac
MENGGUNAKAN METODE ONE POT DENGAN VARIASI VOLUME DAN
JENIS SOLVEN
SKRIPSI
Oleh
ALVINA WIJAYA 140405107
DEPARTEMEN TEKNIK KIMIA FAKULTAS TEKNIK
UNIVERSITAS SUMATERA UTARA
OKTOBER 2018
SINTESIS CAIRAN (IONIC LIQUID 1-ETIL-3- METILIMIDAZOLIUM ASETAT [EMIM] Ac
MENGGUNAKAN METODE ONE POT DENGAN VARIASI VOLUME DAN
JENIS SOLVEN
SKRIPSI
Oleh
ALVINA WIJAYA 140405107
SKRIPSI INI DIAJUKAN UNTUK MELENGKAPI SEBAGIAN PERSYARATAN MENJADI SARJANA TEKNIK
DEPARTEMEN TEKNIK KIMIA FAKULTAS TEKNIK
UNIVERSITAS SUMATERA UTARA
PERNYATAAN KEASLIAN SKRIPSI
Saya menyatakan dengan sesungguhnya bahwa skripsi dengan judul:
Sintesis Cairan (Ionic Liquid) 1-Etil-3-Metilimidazolium Asetat [EMIM]Ac Menggunakan Metode One Pot dengan
Variasi Volume dan Jenis Solven
dibuat untuk melengkapi sebagian persyaratan menjadi Sarjana Teknik pada Departemen Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara. Skripsi ini adalah hasil karya saya kecuali kutipan-kutipan yang telah saya sebutkan sumbernya.
Demikian pernyataan ini diperbuat, apabila di kemudian hari terbukti bahwa karya ini bukan karya saya atau merupakan hasil jiplakan maka saya bersedia menerima sanksi sesuai dengan aturan yang berlaku.
Medan, Oktober 2018
Alvina Wijaya NIM: 140405107
PENGESAHAN SKRIPSI
Skripsi dengan judul:
Sintesis Cairan (Ionic Liquid) 1-Etil-3-Metilimidazolium Asetat [EMIM]Ac Menggunakan Metode One Pot dengan
Variasi Volume dan Jenis Solven
dibuat untuk melengkapi persyaratan menjadi Sarjana Teknik pada Departemen Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara. Skripsi ini telah diujikan pada sidang ujian skripsi tanggal 24 Oktober 2018 dan dinyatakan memenuhi syarat/sah sebagai skripsi pada Departemen Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara.
Medan, Oktober 2018
PRAKATA
Puji dan syukur penulis ucapkan kepada Tuhan yang Maha Esa, karena atas berkat dan rahmat-Nya sehingga skripsi ini dapat diselesaikan. Tulisan ini merupakan skripsi dengan judul “Sintesis Cairan (Ionic Liquid) 1-Etil-3- Metilimidazolium Asetat [EMIM]Ac Menggunakan Metode One Pot dengan Variasi Volume dan Jenis Solven”, berdasarkan hasil penelitian yang penulis lakukan di Departemen Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara. Skripsi ini merupakan salah satu syarat untuk mendapatkan gelar Sarjana Teknik.
Selama melakukan penelitian sampai penulisan skripsi ini, penulis banyak mendapat bantuan dari berbagai pihak, untuk itu penulis mengucapkan terima kasih dan penghargaan yang sebesar-besarnya kepada :
1. Ibu Dr. Ir. Iriany, M.Si dan Okta Bani ST., MT selaku dosen pembimbing yang telah banyak memberikan bimbingan dan arahan dalam menyelesaikan penelitian dan penulisan skripsi ini.
2. Bapak Ir. Bambang Trisakti, M.T dan Ibu Dra., Siswarni MZ., M.S selaku dosen penguji yang telah memberikan saran dan masukan untuk kesempurnaan skripsi ini.
3. Ibu Maya Sarah, S.T., M.T., Ph.D. selaku Ketua Departemen Teknik Kimia USU.
4. Ibu Dr. Erni Misran, S.T., M.T. selaku Sekretaris Departemen Teknik Kimia USU.
5. Bapak Ir. Bambang Trisakti, M.T. selaku Koordinator Penelitian Teknik Kimia USU.
6. Bapak Bode Haryanto Tarigan, S.T., M.T., Ph.D. selaku Dosen Pembimbing Akademik.
7. Seluruh dosen/staf pengajar dan pegawai administrasi Departemen Teknik Kimia yang telah memberikan banyak sekali ilmu yang sangat berharga kepada penulis.
8. Bu Feni dan Pak Mori yang telah banyak memberkan ilmu pada penelitian ini di
9. Marie Azalea selaku partner semua tugas akhir sekaligus sahabat baik penulis untuk kerja samanya yang baik selama proses penyelesaian semua tugas akhir, dan juga tempat penulis berbagi banyak hal.
10. Grup TRP : Marie Azalea, Sandro Nadeak, dan Regy Gintinguntuk kerja samanya yang baik, teman berdiskusi banyak hal, dan pemberi semangat dan masukan yang baik.
11. Rekan-rekan mahasiswa angkatan 2014, terutama Oktavianna Winda Pakpahan, Novita Wahyuni Daulay, Rizky Ambara Kana Maulina Maha, Jesselin Wijaya, Kelvin, Pittor Suherman, dan Dhany Haryanto .
12. Semua abang kakak senior dan adik-adik junior di Teknik Kimia USU, terutama abang kakak angkatan 2011 dan adik-adik angkatan 2017.
13. Semua pihak yang tidak dapat penulis sebutkan satu per satu untuk kontribusinya di dalam proses penyelesaian semua tugas akhir penulis.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna, oleh karena itu penulis mengharapkan kritik dan saran demi kesempurnaan skripsi ini. Semoga skripsi ini memberikan manfaat bagi pengembangan ilmu pengetahuan.
Medan, Oktober 2018 Penulis
Alvina Wijaya
DEDIKASI
Skripsi ini kupersembahkan untuk :
Bapak & Ibu tercinta
Bapak Ui Thin Siong dan Ibu Warsinah
Mereka adalah orang tua hebat yang telah membesarkan, mendidik, dan mendukungku dengan penuh kesabaran dan kasih sayang.
Terima kasih atas pengorbanan, nasehat dan doa yang tiada hentinya, yang telah bapak dan ibu berikan kepadaku selama ini.
Saudaraku tercinta
Kak Fetty, Alvin Wijaya dan Alden Cahaya Wijaya
Terima kasihku untuk segala motivasi, dukungan dan kasih sayangmu untuk adek dan kakakmu.
`
RIWAYAT HIDUP PENULIS
Nama: Alvina Wijaya
NIM: 140405107
Tempat/Tanggal Lahir:
Medan/19 Juli 1995 Email: wijaya.alvina@yahoo.com Nama Orang Tua: Ui Thin Siong dan Warsinah Alamat Orang Tua: Jl. Brigjend Katamso Gang Pertiwi
no. 5 Medan
Asal Sekolah:
TK Hang Kesturi (2001-2002)
SD Hang Kesturi (2002-2008)
SMP Hang Kesturi (2008-2011)
SMA Sutomo 1 (2011-2012)
SMA Swasta Cahaya Medan (2012-2014) Pengalaman Organisasi/Kerja:
1. Anggota Himpunan Mahasiswa Teknik Kimia Fakultas Teknik Universitas Sumatera Utara (HIMATEK FT USU): 2014 s/d 2018.
2. Anggota Keluarga Mahasiswa Buddhis (KMB USU): 2014 s/d 2017.
3. Kerja Praktek di PT Toba Pulp Lestari, Tbk, Desa Sosor Ladang, Kec.
Parmaksian, Kab. Toba Samosir, Sumatera Utara: Maret 2018 s/d April 2018.
Artikel yang Dipublikasikan dalam Jurnal/Pertemuan Ilmiah:
Sintesis Cairan Ionik (Ionic Liquid) 1-Etil-3-Metilimidazolium Asetat [EMIM]Ac Menggunakan Metode One Pot dengan Variasi Volume dan Jenis Solven
SINTESIS CAIRAN IONIK (IONIC LIQUID)1-ETIL-3- METILIMIDAZOLIUM ASETAT [EMIM]Ac
MENGGUNAKAN METODE ONE POT DENGAN VARIASI VOLUME DAN
JENIS SOLVEN
ABSTRAK
Cairan ionik adalah cairan yang dibentuk dari kation organik heterosiklik dan anion organik atau anorganik yang mempunyai sifat unik seperti tidak mudah menguap dan titik leleh yag rendah. Cairan ionik digunakan untuk pemisahan gas, distilasi dan ekstraksi. Salah satu cairan ionik adalah 1-Etil-3-Metilimidazolium Asetat [EMIM]Ac dapat digunakan dalam memisahkan selulosa dengan lignin pada biomassa lignoselulosa. Kelemahan cairan ionik yang digunkan untuk pretreatment biomassa adalah biaya yang mahal. Namun, penelitian ini bertujuan untuk menyintesis cairan ionik 1-etil-3-metilimidazolium asetat menggunakan metode one pot dan mengevaluasi pengaruh jenis dan volume solven. Di dalam penelitian ini, metode one pot diusulkan untuk menyintesis [EMIM]Ac menggunakan 1- metilimidazol, bromo etana, dan timbal asetat sebagai bahan awal. Produk dimurnikan oleh dicuci dengan etil asetat, suction filtration dan diuapkan secara vakum. Yield tertinggi diperoleh 0,86 g[EMIM]Ac/g[MIM] pada pelarut asetonitril sebanyak 25 ml.
Kata kunci : 1-Etil-3-Metilimidazolium Asetat, aseton, asetonitril, diklorometana, one pot,
SYNTHESIS IONIC LIQUID OF 1-ETHYL-3- METHYLIMIDAZOLE ACETATE [EMIM]Ac USED ONE POT METHOD WITH VARIATION
OF SOLVENT TYPE AND VOLUME
ABSTRACT
Ionic liquids are composed from heterocyclic organic cation and organic or anorganic anion and have unique properties such as non-volatility and low melting point. Ionic liquids are used for gas separation, extractive distillation, and extraction.
One of ionic liquids is1-ethyl-3-methylimidazole acetate [EMIM]Ac, which is used to separate cellulose from lignin in lignocellulosic biomass. A major disadvantage of ionic liquids is their relatively high cost. Therefore, this research aimed to produce 1- ethyl-3-methylimidazole acetate [EMIM]Ac by one pot method and evaluate effect of solvent type and volume on ionic liquid yield. In this research, a one pot method has been proposed to synthesize [EMIM]Ac using 1-methylimidazole, bromo ethane, and lead acetate as starting materials. Product was purified by washing with ethyl acetate, filtration and vacuum evaporation. Highest yield at 0.86 g[EMIM]Ac/g[MIM] was obtained by using 25 ml acetonitrile as solvent.
Keyword : 1-Ethyl-3-Methylimidazole Acetate, acetone, acetonitrile, one pot, dichloromethane,
DAFTAR ISI
PERNYATAAN KEASLIAN SKRIPSI i
PENGESAHAN ii
LEMBAR PERSETUJUAN iii
PRAKATA iv
DEDIKASI vi
RIWAYAT HIDUP vii
ABSTRAK viii
ABSTRACT ix
DAFTAR ISI x
DAFTAR GAMBAR xiii
DAFTAR TABEL xiv
DAFTAR LAMPIRAN xv
DAFTAR SINGKATAN xvi
BAB I PENDAHULUAN 1
1.1 LATAR BELAKANG 1
1.2 PERUMUSAN MASALAH 3
1.3 TUJUAN PENELITIAN 3
1.4 MANFAAT PENELITIAN 4
1.5 RUANG LINGKUP PENELITIAN 4
BAB II TINJAUAN PUSTAKA 6
2.1 CAIRAN IONIK 6
2.2 ION-ION YANG TERKANDUNG DALAM CAIRAN IONIK 6
2.2.1 Kation 6
2.2.2 Anion 7
2.3 TAHAP-TAHAP PEMBUATAN CAIRAN IONIK 7
2.3.1 Tahap Alkilasi 7
2.3.2 Tahap Penukaran Anion 8
2.4 PEMURNIAN CAIRAN IONIK 9
2.5 SIFAT-SIFAT BAHAN BAKU 9
2.5.2 Bromo Etana 10
2.5.3 Timbal Asetat 10
2.5.4 Aseton 11
2.5.5 Asetonitril 11
2.5.6 Diklorometana 12
2.5.7 Propanetriol 12
2.5.8 1-Etil-3-Metilimidazol Asetat 12
2.6 FAKTOR-FAKTOR PELARUT YANG MEMPENGARUHI
CAIRAN IONIK 13
BAB III METODOLOGI PERCOBAAN 15
3.1 LOKASI DAN WAKTU PENELITIAN 15
3.2 BAHAN DAN PERALATAN 15
3.2.1 Bahan Penelitian 15
3.2.2 Peralatan Penelitian 16
3.3 PELAKSANAAN PENELITIAN 17
3.4 RANCANGAN PERCOBAAN PENELITIAN 18
3.5 PROSEDUR PENELITIAN 19
3.5.1 Prosedur Proses Pembentukan 1-Etil-3-Metilimidazolium
Asetat 19
3.5.2 Prosedur Pemurnian 1-Etil-3-Metilimidazolium Asetat 19
3.6 FLOWCHART PENELITIAN 20
3.6.1 Flowchart Proses Pembentukan 1-Etil-3-Metilimidazolium
Asetat 20
3.6.2 Flowchart Pemurnian 1-Etil-3-Metilimidazolium Asetat 21
BAB IV HASIL DAN PEMBAHASAN 22
4.1 HASIL SINTESIS CAIRAN IONIK [EMIM]Ac 22
4.2 ANALISA KOMPONEN PADA CAIRAN IONIK [EMIM]Ac 23 4.3 PENENTUAN YIELD [EMIM]Ac BERDASARKAN JENIS
PELARUT 26
4.4 PENENTUAN KONSENTRASI [EMIM]Ac BERDASARKAN JENIS
PELARUT 28
BAB V KESIMPULAN DAN SARAN 30
5.1 KESIMPULAN 30
5.2 SARAN 30
DAFTAR PUSTAKA 31
DAFTAR GAMBAR
Gambar 2.1 Jenis Kation dalam Pembuatan Cairan Ionik 7
Gambar 2.2 Reaksi Alkilasi 8
Gambar 3.1 Rangkaian Peralatan Pembuatan 1-Etil-3-Metilimidazolium Asetat 17 Gambar 3.2 Rangkaian Peralatan Metode Suction Filtration 18 Gambar 3.3 Flowchart Proses Pembentukan 1-Etil-3-Metilimidazolium Asetat 20 Gambar 3.4 Flowchart Proses Pemurnian 1-Etil-3-Metilimidazolium Asetat 21
Gambar 4.1 Sintesis Cairan Ionik [EMIM]Ac 22
Gambar 4.2 Sintesis Ionic Liquid oleh Gurau, et al Sebelum Pemurniaan (a)
Setelah Pemurnian(b) 23
Gambar 4.3 Perbandingan Antara Cairan Ionik [EMIM]Sc Standar dengan
[EMIM]Ac Variasi Pelarut pada Analisa FTIR 23 Gambar 4.4 Penentuan Yield Berdasarkan Jenis Pelarut 26
Gambar LA.1 Tahap Pembuatan Ionic Liquid 35
Gambar LA.2 Tahap Filtrasi 36
Gambar LA.3 Tahap Evaporasi 36
Gambar LA.4 Produk Hasil 36
Gambar LA.5 Endapan Timbal Asetat 36
DAFTAR TABEL
Tabel 1.1 Pembuatan Cairan 1-Etil-3-Metilimidazolium Asetat 2 Tabel 2.1 Sifat Fisika dan Kimia 1-Metilimidazol 10 Tabel 2.2 Sifat Fisika dan Kimia Bromo Etana 10 Tabel 2.3 Sifat Fisika dan Kimia Timbal Asetat 10
Tabel 2.4 Sifat Fisika dan Kimia Aseton 11
Tabel 2.5 Sifat Fisika dan Kimia Asetonitril 11 Tabel 2.6 Sifat Fisika dan Kimia Diklorometana 12 Tabel 2.7 Sifat Fisika dan Kimia 1-Etil-3-Metilimidazol Asetat 13
Tabel 3.1 Rancangan Percobaan Penelitian 18
Tabel 4.1 Hasil Sintesis Cairan Ionik [EMIM]Ac dengan Variasi Jenis Solven Aseton, Asetonitril, Diklorometana, dan Propanetriol 22
Tabel 4.2 Gugus Fungsi [EMIM]Ac Menggunakan FTIR 25
Tabel B.1 Yield Hasil Cairan Ionik [EMIM]Ac 38
Tabel B.2 Konsentrasi Hasil Cairan Ionik [EMIM]Ac 39
DAFTAR LAMPIRAN
LAMPIRAN A DOKUMENTASI 35
LA.1 TAHAP PEMBUATAN IONIC LIQUID 35
LA.2 TAHAP FILTRASI 35
LA.3 TAHAP EVAPORASI 36
LA.4 PRODUK HASIL 36
LA.5 ENDAPAN TIMBAL ASETAT 36
LAMPIRAN B CONTOH PERHITUNGAN 37
LB.1 PERHITUNGAN YIELD [EMIM]Ac TEORITIS 37 LB.2 PERHITUNGAN YIELD [EMIM]Ac PRAKTEK 37
LB.3 PERHITUNGAN KONSENTRASI [EMIM]Ac 38
DAFTAR SINGKATAN
[EMIM]Ac 1-Etil-3-Metilimidazolium Asetat
GC Gas Chromatography
BF3 Boron trifluorida
AlCl3 Aluminium klorida
FeCl3 Besi(III) klorida TiCl4 Titanium tetraklorida
AgNO3 Perak nitrat
AgBF4 Perak tetrafluoroborat
FTIR Fourier Transform Infra Red [EMIM]Cl 1-Etil-3-Metilimizolium Klorida
BAB I
PENDAHULUAN
1.1 LATAR BELAKANG
Sejarah cairan ionik berhubungan dekat dengan molten salts yang dilakukan oleh Walden pada tahun 1914 menggunakan alkilammonium nitrat. Banyak peneliti yang melanjutkan penelitian mengenai cairan ionik dan menemukan kloro aluminat yang dapat dibentuk dari pencampuran kation heterosiklik kuarter dengan aluminium klorida. Cairan ionik menunjukkan potensi yang besar untuk digunakan dalam beberapa aplikasi, tetapi kelemahannya adalah sangat sensitif terhadap kelembaban.
Terobosan besar selanjutnya dibuat oleh Wilkes pada awal 1990-an, Wilkes berhasil membuat cairan ionik dengan kelembaban yang stabil melalui pertukaran aluminium klorida dengan anion lain, seperti tetrafluoborat atau hexafluorofosfat. Sejak laporan seminar oleh Wilkes dan rekannya, kelompok cairan ionik mengalami perkembangan yang pesat. Dimulai dengan kation imidazolium, komponen kation telah divariasikan termasuk jenis piridinium, amonium, posponium, tiazolium, dan triazolium (Handy, 2011).
Cairan ionik biasanya dibentuk dari kation organik heterosiklik dan anion yang berbeda dan mempunyai sifat unik seperti tidak mudah menguap, tidak mudah terbakar, dan rentang temperatur fasa cair yang besar. Cairan ionik bisa berwujud cair pada suhu di bawah -96°C dan beberapa melebihi 400°C. Cairan ionik temperatur kamar umumnya berwarna bening, bersifat fluida, dan mudah dirawat.
Dalam paten dan literatur akademik, sebutan cairan ionik sekarang disebut cairan tersusun dari ion-ion yang berwujud cairan di bawah 100°C. Peneliti dan ahli teknik telah bekerja untuk mengembangkan aplikasi cairan ionik siap pakai dalam industri bisa meminimalkan dampak lingkungan dari proses kimia dan biaya proses (Dharaskar, et al, 2013). Penggunaan cairan ionik sangat luas. Dalam bidang analisa, cairan ionik digunakan untuk kristalisasi protein dan pelarut GC-head-space. Cairan tersebut juga bisa digunakan untuk pemisahan gas, distilasi ekstraktif, dan ekstraksi.
Cairan ini juga digunakan dalam perminyakan, bahan elekroelastis, cairan kristal dan digunakan sebagai elektrolit (Karkkainen, 2007).
Cairan ionik dialkilimidazolium asetat mempunyai keistimewaan tertentu karena sifat kelarutan yang baik untuk zat dengan ikatan hidrogen yang kuat, seperti selulosa dan khitin. Sifat struktur sangat dipengaruhi oleh ikatan interaksi hidrogen antara kation dan anion. Karena kemampuan ikatan hidrogen, dialkilimidazolium asetat memiliki sifat higrokospis yang tinggi dan sering mengandung sedikit kelembaban (Thomas, et al, 2014).
Reaksi Friedel-Crafts adalah metode yang paling umum digunakan untuk sintesis senyawa aromatik substitusi. Alkilasi Friedel-Crafts dari senyawa hidrokarbon aromatik telah dipelajari secara luas menggunakan katalis asam Lewis, seperti BF3, AlCl3, FeCl3, TiCl4 dan asam proton seperti HF, H2SO4 [4]. Pada tahun 1992, Wilkes dan Zaworotko melaporkan pembuatan cairan ionik yang stabil terhadap air dan udara yang berdasarkan kation 1-alkil-3-metilimodazolium. Mereka menggunakan garam perak yang mahal, seperti AgNO3, AgBF4, dan Ag[CO2CH3], dan menghasilkan 1-etil-3-metilimodazolium iodin dalam metanol. Perak iodin difiltrasi setelah reaksi dan pelarut menguap, menghasilkan cairan ionik murni.
Kemudian, garam natrium, litium, dan kalium telah digunakan dalam reaksi metatesis. Diklorometana atau aseton selalu digunakan sebagai pelarut dalam metatesis. selain garam logam, asam Bronsted juga digunakan dalam reaksi metatesis (Karkkainen, 2007). One pot adalah meyusun reaksi multi tahap yang menjadi kepentingan peneltian dalam kimia organik, karena peningkatan produk yang diinginkan, efisiensi pembentukan ikatan jamak, penghematan waktu dan energi dan mengurangi sisa limabah dan polusi (Clough, et al, 2013). Kedua metode tersebut dijadikan sebagai one pot dalam pembuatan 1-etil-3-metilimidazolium asetat.
Banyak peneliti yang membuat cairan 1-etil-3-metilimidazolium asetat seperti pada tabel 1.1
Tabel 1.1 Pembuatan Cairan 1-Etil-3-Metilimidazolium Asetat 1. Johannes Kiefer,
Katharina Obert, Simone Himmler, Peter S. Schulz, Peter Wasserscheid, dan Alfred Leipertz
Spektrokopis
Infrared dari Katalis Wilkinson dalam Suhu Kamar Cairan Ionik
[EMIM][OH] dilarutkan dalam asam asetat yang menghasilkan [EMIM][OAc] dengan metode netralisasi. Setelah memisahkan air dengan rotary evaporator, cairan ionik dikeringkan pada suhu kamar yang menghasilkan kadar air di bawah 500 ppm dititrasi dengan metode Karl Fischer dan yield [EMIM][OAc]
sekitar 86% yang dianalisis dengan HNMR.
2. H.X. Zhu, J.S. Li,
R. Xu dan
S.Y.Yang [8]
Sintesis Cairan Ionik 1-Etil-3-
Metilimidazolium
Asetat dan
Kelarutan dalam 1, 3,
5-triamino-2, 4, 6- trinitrobenzena
Reaktan yang berupa 1- metilimidazol, bromo etana, dan timbal asetat dimasukkan dalam pelarut yang berupa propanetriol dalam labu leher tiga.
Sintesis [EMIM][OAc] dengan metode one pot yang dilarutkan dalam 60°C dalam temperatur konstan dalam water bath.
Setelah 20 jam, larutan didinginkan pada suhu kamar dan dipisahkan endapan putih dengan filtrasi hisap. Larutan yang keruh dicuci dengan etil asetat beberapa kali. Setelah itu menggunakan vacuum rotary evaporation pada suhu 60°C selama 2 jam. Yield yang dihasilkan 87%.
Berdasarkan penelitian-penelitian terdahulu, penelitian tentang sintesis 1-etil- 3-metilimidazolium asetat sudah pernah dilakukan, namun analisa pengaruh volume dan jenis solven terhadap yield 1-etil-3-metilimidazolium asetat belum pernah diteliti sebelumnya. Oleh karena itu, penelitian ini bertujuan untuk mengukur yield 1-etil-3- metilimidazolium asetat jika divariasikan oleh pengaruh volume dan jenis solven.
1.2 PERUMUSAN MASALAH
Cairan ionik memiliki banyak manfaat yang dapat diaplikasikan sebagian pabrik. Misalnya sebagai pemisah lignoselulosa dalam tandan kosong kelapa sawit.
Namun, penelitian pengaruh volume dan jenis solven terhadap yield pada sintesis 1- etil-3-metilimidazolium asetat belum pernah dilakukan. Penelitian ini menggunakan
metode one pot yang terdiri dari kuarternisasi dan metatesis yang dilakukan sekaligus dalam pembuatan cairan ionik.
1.3 TUJUAN PENELITIAN
Tujuan dilakukan penelitian ini adalah
1. Menyintesis 1-etil-3-metilimidazolium asetat menggunakan metode one pot.
2. Mengevaluasi hasil pengaruh variasi volume dan jenis solven dalam pembuatan cairan 1-etil-3-metilimidazolium asetat.
1.4 MANFAAT PENELITIAN
Manfaat dilakukan penelitian ini adalah:
1. Dapat memberikan informasi pembuatan 1-etil-3-metilimidazolium asetat menggunakan metode one pot.
2. Dapat pelarut yang terbaik dalam pembuatan 1-etil-3-metilimidazolium asetat.
1.5 RUANG LINGKUP PENELITIAN
Penelitian ini dilakukan di Laboratorium Lembaga Ilmu Pengetahuan Indonesia (LIPI), Serpong, Tangerang Selatan, Banten. Bahan baku utama yang digunakan adalah 1-Metilimidazol dan bromo etana. Penelitian ini dilaksanakan dengan metode one pot yang berupa gabungan 2 tahap yaitu tahap alkilasi Friedel- Craft dan tahap metatesis.
Adapun variabel-variabel yang digunakan dalam percobaan ini adalah:
Variabel terikat
- Suhu reaksi = 60 °C
- Perbandingan mol reaktan = 3,6 : 2 : 0,5 (Brometana : 1-metilimidazol : timbal asetat)
- Waktu Reaksi = 8 jam
Variabel bebas
- Volume solven = 10 ml, 15 ml, 20 ml, dan 25 ml - Solven = Aseton, Asetonitiril,
Diklorometana, Propanetriol
Analisa yang digunakan adalah analisa Fourier Transform Infra Red (FTIR) untuk menganalisis gugus yang terdapat dalam 1-etil-3-metilimidazolium asetat dalam percobaan.
BAB II
TINJAUAN PUSTAKA
2.1 CAIRAN IONIK
Cairan ionik telah dianalisa sebagai matriks konduktif seperti pelarut reaksi karena sifat fisik uniknya, konduktivitas ionik yang tinggi dan tidak mudah menguap. Jadi, cairan ionik telah menarik banyak perhatian sebagai alternatif yang menjanjikan ke sistem pelarut organik (Rios, et al., 2013).
Cairan ionik adalah garam organik, biasanya mengandung sebuah kation organik dan poliatomik anion anorganik, dimana berwujud cairan dibawah 100°C.
Sifat yang paling berhubungan dari cairan ionik adalah hampir tidak terjadi tekanan uap. Sifat fisik dan kimia diatur baik oleh pilihan media dari konstituen kation dan anion. Cairan ionik telah dikenal sebagai zat ramah lingkungan. Cairan ionik dapat juga dijadikan sebagai pengganti pelarut organik volatil. Aplikasi cairan ionik dalam proses kimia telah berkembang dalam 10 tahun terakhir. Cairan ionik ini telah digunakan dalam pertukaran pelarut organik volatil dalam jenis proses kimia yang luas, seperti pemisahan dan pemurnian dan reaksi dalam biokimia dan katalis kimia.
Cairan ionik secara garis besar dibuat dari ion dan sepasang ion jangka pendek.
Zat ini memiliki berbagai jenis sebutan yaitu cairan elektrolit, fluida ionik, pencampuran garam, garam cairan, atau kristal ionik. Ikatan ionik biasanya lebih kuat daripada gaya Van der Waals antara molekul cairan biasa (Sekar, et al., 2014).
2.2 ION-ION YANG TERKANDUNG DALAM CAIRAN IONIK 2.2.1 Kation
Ion yang bermuatan positif dinamakan ion positif atau kation (Rufiati, 2011).
Cairan ionik yang mengandung sebuah kation, biasanya berupa struktur organik dengan simetri yang rendah. Kation yang paling umum digunakan adalah amonia, sulfonia, fosfonium, imidazolium, piridin, pikolinium, dan sebagainya dengan substitusi yang berbeda (Singh dan Anil, 2008). Contoh kation dalam cairan ionik pada gambar 2.1.
Gambar 2.1 Jenis Kation dalam Pembuatan Cairan Ionik (Singh dan Anil, 2008) Kation imidazolium murni dapat digambarkan sebagai polimer ikatan hidrogen supramolekul. Dalam beberapa kasus bila dicampur dengan molekul yang lain, sebaiknya dianggap sebagai bahan yang tidak terstruktur polar dan non polar daripada pelarut homogen. Sifat kation imidazolium adalah bersifat stabil pada suhu 300°C, densitas dipengaruhi oleh suhu, viskositas dipengaruhi oleh panjang alkil dan konduktivitas berlawanan dengan viskositas (Azman, 2006).
2.2.2 Anion
Ion yang bermuatan negatif dinamakan anion (Rufiati, 2011). Anion pada cairan ionik dapat berupa organik atau anorganik, contoh boron tetrafluorat, antimon heksafluorat, fosfonium heksafluorat, alkil sulfat dan lain-lain (Singh dan Anil, 2008).
Sifat anion asetat adalah stabil terhadap udara dan air yang bereaksi dengan kation imidazolium, membentuk cairan ionik bersifat hidrofilik, dan kelarutan yang paling efisien dalam cairan ionik (Gonsior, 2010).
2.3 TAHAP-TAHAP PEMBUATAN CAIRAN IONIK 2.3.1 Tahap Alkilasi
Pembentukan kation dapat dilakukan baik melalui protonasi dengan asam protik atau via kuaternisasi dari amina, fosfin atau ternarisasi dari sulfida yang paling umum digunakan adalah alkil halida atau dialkilsulfat. Proses alkilasi memiliki keuntungan yaitu:
(i) berbagai macam alkil halida yang murah telah tersedia (ii) substitusi reaksi terjadi dengan lancar pada suhu yang wajar.
Beberapa jenis amina, fosfin, dan sulfida digunakan dalam persiapan cairan ionik (Ghavre, 2012). Langkah awalnya adalah reaksi kuaternisasi (reaksi SN2)
misalnya amina dengan zat alkilasi. Alkil yang digunakan adalah alkana halida (Gonsior, 2010).
Gambar 2.2 Reaksi Alkilasi (Gonsior, 2010)
2.3.2 Tahap Penukaran Anion
Ada dua tahap dalam penukaran anion yaitu:
1. Asam Lewis dan Garam Halida
Asam Lewis yang paling banyak dipelajari dan digunakan cairan ionik adalah garam berbasis AlCl3. Garam semacam itu pencampuran sederhana Asam Lewis dan garam halida yang menghasilkan pembentukan lebih dari satu spesies anionik tergantung pada perbandingan garam halida kuartener Q + X- dan Lewis acid MXn seperti yang digambarkan oleh reaksi antara [Emim] Cl dan AlCl3 (Ratti, 2014).
2. Metatesis Anion
Anion metatesis diperlukan karena anion halida yang diperoleh pada tahap pertama seringkali bersifat korosif dan garamnya pada umumnya berbentuk padat.
Oleh karena itu metatesis dilakukan untuk mendapatkan cairan ionik dengan anion inert. Anion dapat mempengaruhi sifat fisiokimia cairan ionik secara drastis.
Berbagai jenis anion telah diperkenalkan dan kombinasi dengan beberapa kation telah disintesis K (Ghavre, 2012).
Dimana : R = H atau alkil M = Logam X, Y = Anion
Gambar 2.2 Cara Pembuatan Cairan ionik (Ghavre, 2012)
2.4 PEMURNIAN CAIRAN IONIK
Sejumlah kecil zat pengotor bisa menukar sifat kimia dan fisika cairan ionik.
Zat pengotor terbanyak di dalam cairan ionik adalah anion halida yang terdapat pada tahap pertama, dihasilkan dari reaksi yang tidak sempurna atau pemisahan yang kurang sempurna dari hasil logam halida. Cara termudah untuk memisahkan zat pengotor halida adalah ekstraksi dengan ion air dalam kasus hidrophobik cairan ionik. Hal ini dapat dicapai dengan penggunaan ion sensitif elektroda atau dengan cara kimia seperti prosedur Vollhard untuk ion klorida.
Hal kedua yang paling penting pada cairan ionik adalah jumlah jejak air yang dapat menyebabkan perubahan pada sifat cairan ionik secara drastis. Oleh karena itu, direkomendasikan untuk mengeringkan cairan ionik sebelum menggunakannya minimal 70° C dengan pengadukan selama beberapa jam. Di sini, pengadukan sangat penting saat cairan ionik menaikkan suhu dan desorpsi air terjadi pada lapisan dangkal cairan ionik. Bahkancairan ionik-air tak bercampur seperti [BMIM] [PF6] dapat menyerap air saat terkena udara, lebih jauh lagi menyebabkan degradasi anion ke HF. Jumlah air dapat ditentukan dengan titrasi Karl-Fisher dan spektroskopi IR (Ghavre, 2012).
2.5 SIFAT-SIFAT BAHAN BAKU 2.5.1 1-Metilimidazol
1-Metilimidazol adalah turunan dari imidazol yang digunakan dalam pembuatan kelompok bahan seperti farmasi, pestisida, resin penukar ion, pewarna zat antara, bahan pembantu tekstil, fotografi bahan kimia, dan inhibitor korosi.
Senyawa ini juga digunakan sebagai katalis untuk pembuatan poliuretan dan sebagai curing agent untuk resin epoksi. 1-Metilimidazol telah digunakan dalam sintesis anorganik kompleks, cairan ionik, dan reagen deprotonasi katalitik (Sigma-Aldrich, 2017). 1-Metilimidazol berfungsi sebagai reaktan dalam penelitian.
Tabel 2.1 Sifat Fisika dan Sifat Kimia 1-Metilimidazol (Sciencelab (a), 2017)
No Sifat Fisika Sifat Kimia
1. Bersifat cairan Bersifat stabil 2. Berwarna bening ke kuning Larut dalam air
3. Titik didih : 196 °C Reaktif terhadap bahan oksidasi 4. Berbau piridin seperti amina Bersifat higrokospis
5. Densitas uap : 0,4 Reaktif dengan asam mineral
2.5.2 Bromo Etana
Bromo etil digunakan dalam pembuatan anorganik sebagai pelarut, pendingin dan anestesis (NIOSH, 1994). Bromo etil berfungsi sebagai reaktan dalam penelitian.
Tabel 2.2 Sifat Fisika dan Sifat Kimia Bromo Etana (Sciencelab (b), 2017)
No Sifat Fisika Sifat Kimia
1. Bersifat cairan Bersifat stabil
2. Berwarna bening Larut dalam metanol dan dietil eter
3. Titik didih : 38,04°C Reaktif terhadap bahan oksidasi, logam, alkali, dan kelembapan
4. Berbau eter Bersifat non korosif
5. Densitas uap : 3,76 Reaktif dengan air mrnhasilkan asap racun dan korosif
2.5.3 Timbal Asetat
Timbal asetat pernah digunakan sebagai pendingin dan lotion. Efek dari timbal dalam kesehatan manusia adalah menimbulkan efek yang berbahaya jika dipakai berlebihan. Walaupun efek timbal sangat bahaya tetapi telah diketahui manfaatnya pada zaman kuno yang digunakan untuk tujuan medis (ANNEX, 2018). Timbal asetat berfungsi sebagai reaktan dalam penelitian.
Tabel 2.3 Sifat Fisika dan Sifat Kimia Timbal Asetat (ANPEL, 2014)
No Sifat Fisika Sifat Kimia
1. Bersifat padat Bersifat stabil 2. Berwarna putih keabuan atau
bening
Larut dalam air
3. Titik didih : 200°C Reaktif terhadap bahan oksidasi 4. Berbau asam astat Reaktif terhadap asam sitrat 5. Densitas relatif : 2,55 Reaktif dengan alkali
2.5.4 Aseton
Penggunaan aseton terbesar dapat dibagi menjadi tiga kategori penggunaan. Ini termasuk penggunaan sebagai bahan baku kimia, pelarut formulasi untuk produk komersial, dan pelarut proses industri. Mayoritas produksi di seluruh dunia digunakan sebagai pakan untuk menyiapkan asam metil metakrilat dan bisfenol A.
Aseton memiliki banyak sifat menguntungkan yang membuatnya berguna sebagai pelarut formulasi untuk berbagai jenis cat, tinta, resin, pernis, lapisan permukaan, penghilang cat, dan produk perawatan otomotif. Sebagai pelarut proses industri, aseton biasa digunakan memproduksi benang selulosa asetat, busa poliuretan, vitamin C, dan bubuk tanpa asap (Hernandez, 1999). Aseton berfungsi sebagai pelarut dalam penelitian.
Tabel 2.4 Sifat Fisika dan Sifat Kimia Aseton (Sciencelab (c), 2017)
No Sifat Fisika Sifat Kimia
1. Bersifat cairan Bersifat stabil 2. Berwarna bening Larut dalam air
3. Titik didih : 56,2 °C Reaktif terhadap bahan oksidasi 4. Berbau eter Reaktif terhadap alkali
5. Densitas uap : 0,79 Reaktif dengan asam
2.5.5 Asetonitril
Asetonitril sebagian besar digunakan sebagai pelarut dalam pembuatan obat- obatan, untuk serat pemintal, untuk pengecoran dan pencetakan bahan plastik, baterai litium, untuk ekstraksi asam lemak dari minyak hewan dan nabati. Di laboratorium kimia, asetonitril digunakan untuk mendeteksi bahan seperti residu pestisida, untuk pewarnaan tekstil dan komposisi pelapis sebagai penstabil untuk pelarut klorinat dan dalam produksi parfum sebagai zat intermediet (EPA (a), 2016).
Asetonitril berfungsi sebagai pelarut dalam penelitian.
Tabel 2.5 Sifat Fisika dan Sifat Kimia Asetonitiril (Sciencelab (d), 2017)
No Sifat Fisika Sifat Kimia
1. Bersifat cairan Bersifat stabil 2. Berwarna bening Larut dalam air
3. Titik didih : 81,6°C Reaktif terhadap bahan oksidasi 4. Berbau eter Reaktif terhadap alkali
5. Densitas uap : 1,42 Reaktif dengan asam
2.5.6 Diklorometana
Metilen klorida sebagian besar digunakan sebagai pelarut pada pengupasan dan pelepas cat, Sebagai pelarut dalam pembuatan obat-obatan, farmasi, dan pelapis film;
sebagai pembersih logam dan pelarut finishing dalam manufaktur elektronik; sebagai propelan dalam aerosol untuk produk seperti cat, produk otomotif, dan semprotan serangga dan sebagai pelarut ekstraksi untuk rempah-rempah oleoresin, dan untuk menghilangkan kafein dari kopi (EPA (b), 2016). Diklorometana berfungsi sebagai pelarut dalam penelitian.
Tabel 2.6 Sifat Fisika dan Sifat Kimia Diklorometana (MEGS, 1999)
No Sifat Fisika Sifat Kimia
1. Bersifat cairan Bersifat stabil 2. Berwarna bening Larut dalam alkohol 3. Titik didih : 40°C Mudah terbakar
4. Berbau manis Reaktif terhadap bahan oksidasi 5. Densitas uap : 2,9 Reaktif dengan logam
2.5.7 Propanetriol
Propanetriol disebut pelarut ramah lingkungan dan biasa digunakan sebagai pelarut untuk pembuatan reaksi seperti reaksi transfer hidrogenasi dalam katalis logam (Diaz-Alvarez, et al., 2013) Propanetriol berfungsi sebagai pelarut dalam penelitian.
Tabel 2.7 Sifat Fisika dan Sifat Kimia Diklorometana (Sciencelab (e), 2017)
No Sifat Fisika Sifat Kimia
1. Bersifat cairan Bersifat stabil
2. Berwarna bening Kelarutan dalam etil asetat kecil 3. Titik didih : 290°C Mudah terbakar
4. Berbau manis Reaktif terhadap bahan oksidasi 5. Densitas uap : 3,17 Reaktif dengan asam asetat
anhidrida
2.5.8 1-Etil-3-Metilimidazol Asetat
Bahan lignoselulosa (yaitu residu kayu, pertanian atau hutan) terdapat paling banyak terdapat di bumi dan tersedia dengan biaya yang jauh lebih rendah daripada
dalam menggunakan bahan lignoselulosa adalah tidak tersedianya biaya hemat teknologi pretreatment untuk hidrolisis dan dekonstruksi terhadap produk yang mudah fermentasi. Metode pretreatment berbasis cairan ionik menunjukkan potensi yang besar untuk penghilangan selulosa dan dekonstruksi biomassa. Cairan ionik dengan anion klorida, asetat, dan fosfat menunjukkan kapasitas disolusi selulosa yang baik. Kemampuan pelarutan selulosa dari 1-etil-3-metilimidazolium asetat ([EMIM] [Ac]), 1-etil-3-metilimidazolium dimetilfosfat ([EMIM] [DEP]) dan 1- metil-3-metilmidazolium dimetilfosfat ([MMIM] [DMP]) masing-masing dilaporkan berada pada kisaran 8%, 10% dan 12 -14% (b / v) (Nanchariah dan A.J, 2015).
Tabel 2.8 Sifat Fisika dan Sifat Kimia 1-Etil-3-Metilimidazolium Asetat (Santa Cruz, 2010)
No Sifat Fisika Sifat Kimia
1. Bersifat cairan Bersifat stabil 2. Berwarna bening Larut dalam air 3. Titik didih : >212°F Mudah terbakar 4. Titik leleh : -4 Mudah korosif 5. Specific Gravity : 1,027 Bersifat racun
2.6 FAKTOR-FAKTOR PELARUT YANG MEMPENGARUHI CAIRAN IONIK
1. Konsentrasi
Sifat pelarut bisa dianalisa dengan parameter Kamlet Taft (KT) dimana berdasarkan keasaman pelarut (α), kebasaan (β), dan polaritas (π*).
Menggunakan hubungan energi pelarut linear (LSER) laju konstan dikorelasi dengan α, β, dan π* untuk setiap pelarut yang ditentukan dimana sifat pelarut diperlukan yang mengalami laju reaksi yang tinggi. Kinetika laju konstan ditentukan dari hilangnya reaktan (kemunculan cairan ionik) menggunakan persamaan 2.1 :
rIL = - rMimid = -rAlkilHalida = k [CMimid] [CAlkilHalida] (2.1) Dimana : rIL = laju reaksi cairan ionik
rMimid = laju reaksi metilimidazol rAlkilHalida = laju reaksi alkil halida k = konstanta kinetik
CMimid = konsentrasi metilimidazol CAlkilHalida = konsentrasi alkil halida
Parameter KT dalam campuran, polaritas bisa mentukan dalam laju reaksi [32].
2. Suhu
Dalam persamaan Arhenius, mengungkapkan hubungan laju konstan kinetik dengan pengaruh suhu. Dalam persamaan ini berdasarkan model tumbukan yang sederhana, dimana ketika dua molekul bertumbukan menghasilkan energi aktivasi dalam reaksi yang diproses. Jika energi dalam suatu sistem tidak cocok atau berlebih pada energi aktivasi, molekul yang tidak dapat melewati puncak energi dan tidak menghasilkan produk. Berlangsungnya reaksi mempengaruhi aktivasi energi yang dibutuhkan untuk sebuah sistem dalam temperatur. Pada suhu tinggi, moleku dalam larutan memiliki energi kinetik yang tinggi dan menimbulkan tumbukan yang lebih cepat dimana menurunkan energi aktivasi dalam sistem. Pengaruh suhu terhdap aktivasi energi menurut persamaan Arhenius dalam persamaan 2.2 :
k = ko exp(RTEa) (2.2)
Dimana : Ea = energi aktivasi R = konstanta gas T = suhu
ko = faktor frekuensi dimana frekuensi tumbukan antar molekul reaktan
(Schleicher, 2009)
BAB III
METODOLOGI PENELITIAN
3.1 LOKASI DAN WAKTU PENELITIAN
Proses pembuatan cairan ionik EMIM-Ac dilakukan di laboratorium Lembaga Ilmu Pengetahuan Indonesia (LIPI), Serpong, Tangerang Selatan, Banten.
3.2 BAHAN DAN PERALATAN 3.2.1 Bahan Penelitian
a. Bahan Utama
Bahan utama yang digunakan dalam penelitian:
1. 1-Metilimidazolium (C4H6N2) 2. Bromo Etana (CH3CH2Br) 3. Timbal Asetat (Pb(CH3COO)2) 4. Aseton (C3H6O)
5. Etil Asetat (C4H8O2) 6. Diklorometana (CH2Cl2) 7. Asetonitril (CH3CN) 8. Propanetriol (C3H5(OH)3)
b. Bahan Penunjang
Bahan penunjang yang digunakan dalam penelitian:
1. Sarung tangan 2. Masker 3. Spons 4. Sabun
5. Botol sampel 6. Penyikat
3.2.2 Peralatan Penelitian
Pada penelitian ini peralatan yang digunakan adalah : Peralatan Pembuatan cairan ionik EMIM-Ac:
1. Labu leher tiga 8. Pipet tetes
2. Refluks kondensor 9. Stirrer
3. Beaker glass 10. Water bath
4. Hot plate 11. Selang air
5. Neraca digital 12. Termometer
6. Corong gelas 7. Batang pengaduk
Peralatan Pencucian EMIM-Ac:
1. Vacuum Rotary Evaporator 2. Corong Buchner
3. Gelas ukur 4. Beaker glass
5. Kertas Whatman No.1 6. Gabus
7. Pompa Vakum 8. Erlenmeyer Buchner
3.3 PELAKSANAAN PENELITIAN
Berikut adalah rangkaian peralatan pembuatan 1-Etil-3-Metilimidazolium Asetat yang terdapat gambar 3.1.
Gambar 3.1 Rangkaian Peralatan Pembuatan 1-Etil-3-Metilimidazolium Asetat
Keterangan Gambar:
1. Statif dan Klem 4. Labu leher tiga
2. Stirrer 5. Hot plate
3. Termometer 6. Refluks kondensor
Batang Pengaduk 1
2
3 4
5
6
Berikut sketsa rangkaian alat metode suction filtration pada gambar 3.2.
Gambar 3.2 Rangkaian Peralatan Metode Suction Filtration
3.4 RANCANGAN PERCOBAAN PENELITIAN
Tabel 3.1 menampilkan rancangan percobaan yang akan dilakukan pada penelitian ini.
Tabel 3.1 Rancangan Percobaan Penelitian
Run Jenis Solven Volume Pelarut 1.
Aseton
10
2. 15
3. 20
4. 25
5.
Asetonitril
10
6. 15
7. 20
8. 25
9.
Diklorometana
10
10. 15
11. 20
12. 25
13.
Propanetriol
10
14. 15
15. 20
16 25
Buchner Funnel
Kertas saring di dasar
Dipompa
Labu Filter
3.5 PROSEDUR PENELITIAN
3.5.1 Prosedur Proses Pembentukan 1-Etil-3-Metilimidazolium Asetat
Adapun 3.5.1 Proses Pembentukan 1-Etil-3-Metilimidazolium Asetat adalah sebagai berikut:
1. Dimasukkan 2,2169 g (0,5 mmol) timbal asetat ke dalam labu leher tiga.
2. Ditambahkan aseton dengan volume 10 ml ke dalam labu leher tiga.
3. Ditambahkan 1,6422 g (20 mmol) 1-metilimidazolium dan 3,923 (36 mmol) bromo etana ke dalam labu leher tiga .
4. Labu leher tiga dipasang termometer, sebelah kiri dipasang refluks dan sebelah kanan ditutup dengan gabus.
5. Labu leher tiga diletakkan di atas hot plate pada suhu 60°C selama 8 jam.
6. Percobaan diulangi volume 15, 20, dan 25 ml dan pelarut asetonitiril, diklorometana dan propanetriol.
3.5.2 Prosedur Pemurnian 1-Etil-3-Metilimidazolium Asetat
Adapun prosedur Pemurnian 1-Etil-3-Metilimidazolium Asetat adalah sebagai berikut:
1. 1-Etil-3-Metilimidazolium Asetat yang dihasilkan didinginkan pada suhu ruangan .
2. Endapan putih dipisahkan dengan metode suction filtration.
3. Cairan keruh dicuci dengan 10 ml etil asetat beberapa kali hingga cairan tersebut bening. Etil asetat dipisahkan dengan corong pemisah.
4. Produk dikeringkan di vacuum rotary evaporator pada 60°C pada waktu 2 jam.
3.6 FLOWCHART PENELITIAN
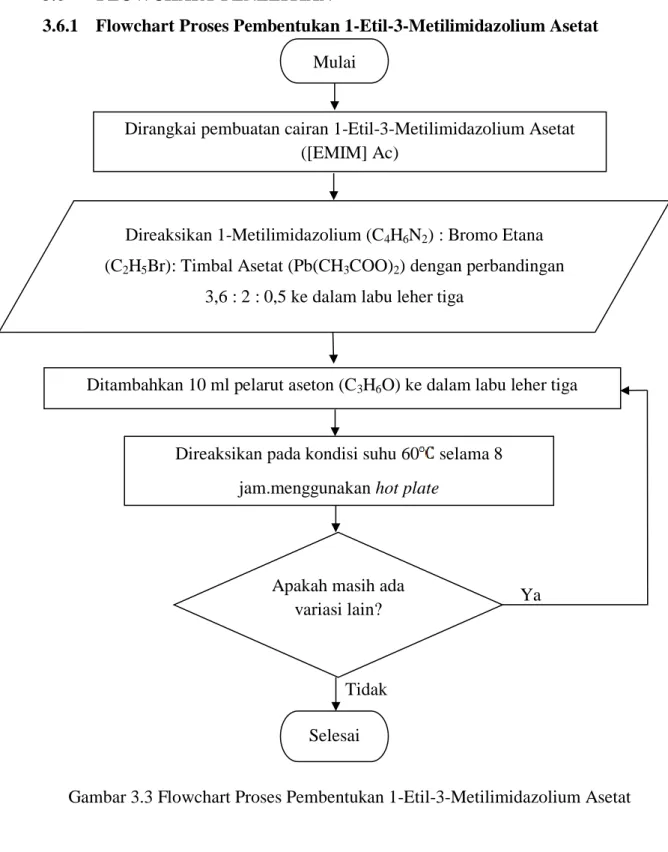
3.6.1 Flowchart Proses Pembentukan 1-Etil-3-Metilimidazolium Asetat
Gambar 3.3 Flowchart Proses Pembentukan 1-Etil-3-Metilimidazolium Asetat Mulai
Selesai
Dirangkai pembuatan cairan 1-Etil-3-Metilimidazolium Asetat ([EMIM] Ac)
Direaksikan 1-Metilimidazolium (C4H6N2) : Bromo Etana (C2H5Br): Timbal Asetat (Pb(CH3COO)2) dengan perbandingan
3,6 : 2 : 0,5 ke dalam labu leher tiga
Ditambahkan 10 ml pelarut aseton (C3H6O) ke dalam labu leher tiga
Direaksikan pada kondisi suhu 60 selama 8 jam.menggunakan hot plate
Apakah masih ada variasi lain?
Tidak
Ya
3.6.2 Flowchart Proses Pemurnian 1-Etil-3-Metilimidazolium Asetat
Gambar 3.4 Flowchart Proses Pemurnian 1-Etil-3-Metilimidazolium Asetat 1-Etil-3-Metilimidazolium Asetat ([EMIM]Ac)t
dipisahkan dengan metode suction filtration 1-Etil-3-Metilimidazolium Asetat yang dihasilkan
didinginkan pada suhu ruangan . Mulai
Selesai
Cairan keruh dicuci dengan Etil Asetat (C4H8O2) sebanyak 30 ml
Apakah terjadi endapan putih?
Dimasukkan ke dalam vacuum rotary evaporation pada suhu 60℃ dengan waktu 2 jam Endapan putih
Ya
Tidak
BAB IV
HASIL DAN PEMBAHASAN
4.1 HASIL SINTESIS CAIRAN IONIK [EMIM]Ac
Pada penelitian ini, dilakukan sintesis cairan ionik [EMIM]Ac yaitu menggunakan metode one pot yang merupakan penggabungan 2 tahap yaitu tahap kuartenisasi dan tahap metatesis anion. Sintesis cairan ionik [EMIM]Ac pada penelitian ini menggunakan empat jenis solven berbeda dengan volume solven yang divariasikan. Sintesis dilakukan pada suhu reaksi 60oC pada perbandingan mol reaktan (bromo etana : 1-metilimidazol : timbal asetat) 3,6 : 2 : 0,5 selama 8 jam.
Adapun keempat jenis solven yang digunakan adalah aseton, asetonitiril, diklorometana dan propanetriol dengan variasi volume solven adalah 10 ml, 15 ml, 20 ml dan 25 ml. Hasil sintesis cairan ionik [EMIM]Ac dapat dilihat pada tabel 4.1.
Tabel 4.1 Hasil Sintesis Cairan Ionik [EMIM]Ac dengan Variasi Jenis Solven Aseton, Asetonitril, Diklorometana, dan Propanetriol
No. Jenis Pelarut Hasil Sintesis Keterangan
1. Aseton
Warna : Coklat Kekuningan Wujud : Cairan
2. Asetonitril
Warna : Coklat Kekuningan Wujud : Cairan
3. Diklorometana
Warna : Hitam Wujud : Cairan
4. Propanetriol
Warna : Coklat tua dan Coklat muda Wujud : Terbentuk dua
Dari segi warna dan bentuk cairan yang dihasilkan terlihat bahwa cairan ionik [EMIM]Ac yang dihasilkan menggunakan jenis solven yang berbeda-beda memiliki karakteristik yang berbeda-beda pula. Adapun reaksi pembuatan cairan ionik [EMIM]Ac adalah sebagai berikut:
+ CH3CH2Br + (CH3COO)4Pb
Gambar 4.1 Sintesis Cairan Ionik [EMIM]Ac
Menurut Santacruz (2010), cairan ionik [EMIM]Ac tidak memiliki warna.
Menurut Zhu, et al (2012), cairan ionik [EMIM]Ac yang sudah dimurnikan akan berwarna jernih dan tidak mengandung impuritis. Namun, warna cairan yang dihasilkan pada penelitian ini tidak sesuai dengan hasil yang telah dilaporkan Zhu, et al, dimana cairan ionik [EMIM]Ac yang dihasilkan masih mengandung warna. Hal ini dapat disebabkan oleh masih adanya impuritis yang tertinggal pada produk.
Pada reaksi kuartenisasi, gugus etil pada senyawa bromo etana akan dialkilasi oleh senyawa 1-metilimidazolium sedangkan bromo menjadi ion bebas (Gonsior, 2010). Pada reaksi metatesis anion, anion yang berupa ion asetat akan terikat pada 1- metilimidazolium dan kation berupa timbal akan mengikat ion bromida menghasilkan timbal bromida (Ghavre, 2012). Bromo etana yang digunakan pada penelitian berlebih sehingga mengakibatkan adanya ion yang bebas Br- yang diketahui berwarna coklat kehitaman (PubChem, 2018). Menurut Gurau, et al (2012), proses sintesis one pot sangat kompleks dan impuritis (seperti bahan baku dan sisa pelarut organik yang digunakan untuk sintesis) masih terdapat dalam cairan ionik [EMIM]Ac meskipun telah dilakukan beberapa kali tahap permurnian. Hal inilah yang menyebabkan adanya impuritis pada cairan ionik yang telah disintesis.
Sehinga Gurau, et al menyarankan penggunaan arang aktif untuk menghilangkan N
CH3
N
Asetonitril
CH3
N N
+ OCOCH3 + PbBr4
CH2CH3
MIM Bromo Etana Timbal Asetat [EMIM]Ac Timbal
Bromo
kepekatan warna yang terdapat pada cairan ionik seperti yang ditampilkan pada Gambar 4.2 dibawah ini.
Gambar 4.2 Sintesis Ionic Liquid oleh Gurau, et al Sebelum Pemurniaan (a) Setelah Pemurnian (b) (Gurau, et al., 2012)
Dari Gambar 4.2 dapat dilihat bahwa meskipun sudah dilakukan pemurnian menggunakan arang aktif, cairan tetap berwarna kecoklatan.
4.2 ANALISA KOMPONEN PADA CAIRAN IONIK [EMIM]Ac
Hasil cairan ionik [EMIM] Ac akan diuji menggunakan analisa FTIR. Analisa FTIR digunakan untuk mengetahui gugus fungsi yang terdapat pada sampel uji.
Adapun hasil analisa FTIR pada cairan ionik [EMIM]Ac yang diperoleh ditampilkan pada gambar 4.3.
[EMIM]Ac Standar [EMIM]Ac dengan Pelarut Asetonitril
[EMIM]Ac dengan Pelarut Aseton [EMIM]Ac dengan Pelarut Diklorometana
Transmittance
Arang Aktif
(a) (b)
Gambar 4.3 Perbandingan Antara Cairan Ionik [EMIM]Ac Standar dengan [EMIM] Ac Variasi Pelarut pada Analisa FTIR
Dari Gambar 4.3, dapat dilihat bahwa spektrum [EMIM]Ac dengan pelarut asetonitril memiliki bentuk gelombang yang sama dengan [EMIM]Ac standar.
Sedangkan spektrum [EMIM]Ac pelarut aseton dan diklorometana, memiliki bentuk gelombang yang berbeda dengan [EMIM]Ac standar.
Panjang gelombang di atas 3000 cm-1 menyatakan jenis ikatan vibrasi C-H dari cincin imidazolium. Panjang gelombang diantara 2800-2900 cm-1 menyatakan ikatan vibrasi alipatik simetrik (C-H) stretch. Jenis stretch simetrik dan asimetrik dari CH2 dan CH3 yang berulang. Panjang gelombang pada 1700 cm-1 menyatakan ikatan kelompok karbonil ester (C=O). Panjang gelombang antara 1400 dan 1500 cm-1 menyatakan ikatan vibrasi C-C stretch. Panjang gelombang disekitar 1300 cm-1 menyatakan ikatan vibrasi C=C stretch. Panjang gelombang disekitar 1200 cm-1 menyatakan ikatan vibrasi C-N stretch. Panjang gelombang disekitar 1000-1100 cm-1 menyatakan ikatan vibrasi C-O stretch. Panjang gelombang disekitar 900 cm-1 menyatakan ikatan vibrasi C-H bend aromatik (Yesudass, et al., 2016).
Bacaan FTIR untuk sampel [EMIM]Ac standar, [EMIM]Ac dengan pelarut aseton, asetonitril, dan diklorometana ditabulasikan pada tabel 4.2.
Tabel 4.2 Gugus Fungsi [EMIM]Ac Menggunakan FTIR (CPB, 2015)
No
. Group Wavenum- ber (cm-1)
[EMIM]
Ac Stan- dard
[EMIM]
Ac + Aceton
[EMIM]Ac + Acetonitril
e
[EMIM]Ac + Dichlorometha
ne
1. C-H strecth 2850-2990 ada ada ada ada
2. C=O strecth 1715-1735 ada ada ada ada
3. C-H bend 680-900 ada ada ada ada
Dari Tabel 4.2, dapat disimpulkan bahwa dalam semua sampel yang diuji, terdapat cairan ionik [EMIM]Ac.
4.3 PENENTUAN YIELD [EMIM]Ac BERDASARKAN JENIS PELARUT
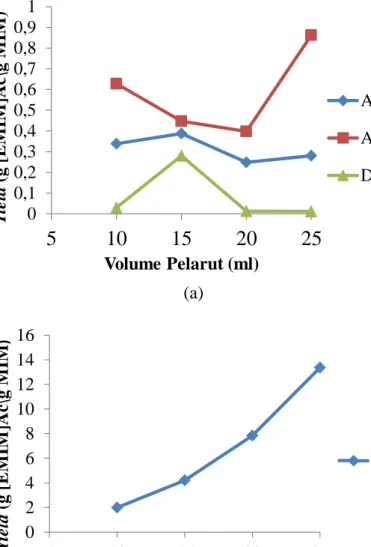
Gambar 4.4 Penentuan Yield Berdasarkan Jenis Pelarut
Gambar 4.4 menampilkan yield [EMIM]Ac yang diperoleh dari hasil percobaan berdasarkan pengaruh jumlah dan jenis pelarut. Yield pelarut aseton, asetonitril dan diklorometana ditunjukkan pada gambar 4.4 (a), dimana yield yang diperoleh berada di bawah yield teoritis. Yield pelarut propanetriol ditunjukkan pada gambar 4.4 (b), dimana yield yang diperoleh melewati yield teoritis. Yield teoritis yang didapatkan adalah 2,0732 g[EMIM]Ac/g[MIM]. Yield [EMIM]Ac pada pelarut
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1
5 10 15 20 25
Yield (g [EMIM]Ac\g MIM)
Volume Pelarut (ml)
Aseton Asetonitril Diklorometana
0 2 4 6 8 10 12 14 16
5 10 15 20 25
Yield (g [EMIM]Ac\g MIM)
Volume Pelarut (ml)
Propanetriol (a)
(b)
kemudian menurun. Yield [EMIM]Ac pada pelarut asetonitril mengalami penurunan kemudian meningkat pada volume pelarut 25 ml. Yield [EMIM]Ac pada pelarut propanetriol meningkat seiring bertambahnya volume pelarut yang digunakan.
Pemilihan pelarut yang akan digunakan pada reaksi dipengaruhi oleh kecocokan pelarut dengan reaksi (Levenspiel, 1999). Pelarut asetonitril merupakan pelarut ideal untuk memproduksi [EMIM]Ac, karena mempunyai nilai k (konstanta laju kinetik) yang tinggi dalam parameter Kamlet-Taft sehingga bisa mempercepat reaksi kuartenisasi. Pelarut aseton adalah pelarut yang berpotensial untuk skala laboratorium maupun skala industri. Energi panas yang dibutuhkan pelarut aseton untuk distilasi atau diuapkan lebih kecil daripada pelarut asetonitril (Schleicher dan Aaron, 2009).
Yield yang diperoleh pada penggunaan pelarut diklorometana sangat kecil karena disebabkan oleh pelarut diklorometana bereaksi dengan bromo etana seperi reaksi dibawah ini (Chang, 2005).
CH3CH2Br + CH2Cl2 CH3CH2Cl + CH2Br2 (Chang, 2005) Sintesis cairan ionik [EMIM]Ac menggunakan metode one pot mengalami reaksi eksotermis yakni reaksi yang menghasilkan panas ke lingkungan sehingga diperlukan proses pendinginan dengan pemilihan solven yang tepat. Solven berfungsi untuk menghilangkan dan mengontrol panas yang dikeluarkan selama sintesis cairan ionik (Schleicher dan Aaron, 2009).
Cairan ionik [EMIM]Ac yang menggunakan pelarut propanetriol memiliki yield yang lebih tinggi daripada yield teoritis. Hal ini dikarenakan proses penguapan pelarut menggunakan Rotary Vacuum Evaporator tidak dapat menghilangkan pelarut secara 100% karena propanetriol mempunyai titik didih sebesar 290 oC. Dari berbagai variasi pelarut, pelarut asetoniril merupakan pelarut terbaik untuk menghasilkan cairan ionik.
4.4 PENENTUAN KONSENTRASI [EMIM]Ac BERDASARKAN JENIS PELARUT
Gambar 4.5 Penentuan Konsentrasi Berdasarkan Jenis Pelarut
Gambar 4.5 menampilkan konsentrasi [EMIM]Ac yang diperoleh dari hasil percobaan berdasarkan pengaruh jumlah dan jenis pelarut. Konsentrasi [EMIM]Ac dalam pelarut aseton, asetonitril dan diklorometana ditunjukkan pada gambar 4.5 (a) dan konsentrasi [EMIM]Ac dalam pelarut propanetriol ditunjukkan pada gambar 4.5
-0,05 0,00 0,05 0,10 0,15 0,20 0,25 0,30 0,35 0,40
0 5 10 15 20 25
Konsentrasi (mmol/ml)
Volume Pelarut (ml)
Aseton Asetonitril Diklorometana
0,00 0,50 1,00 1,50 2,00 2,50 3,00 3,50 4,00 4,50
0 5 10 15 20 25
Konsentrasi (mmol/ml)
Volume Pelarut (ml)
Propanetriol (a)
(b)
bertambahnya volume pelarut yang digunakan. Konsentrasi [EMIM]Ac pada pelarut diklorometana mengalami kenaikan sampai volume pelarut 15 ml, kemudian menurun. Konsentrasi [EMIM]Ac pada pelarut asetonitril mengalami penurunan kemudian meningkat pada volume pelarut 25 ml. Konsentrasi [EMIM]Ac pada pelarut propanetriol meningkat seiring bertambahnya volume pelarut yang digunakan.
Berdasarkan definisi konsentrasi:
CA= NVA (Levenspiel, 1999) Maka semakin banyak pelarut yang digunakan, semakin rendah konsentrasi [EMIM]Ac yang diperoleh. Sementara pada gambar 4.5(b), konsentrasi [EMIM]Ac semakin meningkat ketika volume pelarut makjn banyak. Hal ini disebakan oleh pelarut yang tidak berhasil diuapkan karena titik didih propanetriol yang tinggi.
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Adapun kesimpulan yang dapat diperoleh dari penelitian ini adalah:
1. Cairan ionik [EMIM]Ac menggunakan pelarut aseton dan asetonitril berwarna coklat kekuningan dan berwujud cair, warna [EMIM]Ac dengan penggunaan pelarut diklorometana adalah hitam dan berwujud cairan, dan warna [EMIM]Ac dengan penggunaan pelarut propanetriol adalah pada bagian atas berwarna coklat tua dan pada bagian bawah berwarna coklat muda dan terbentuk dua lapisan cairan.
2. Hasil analisa dengan peralatan FTIR menunjukkan bahwa cairan ionik yang dihasilkan dalam percobaan terdapat [EMIM]Ac.
3. Dari hasil analisa FTIR, yield dan konsentrasi [EMIM]Ac yang didapatkan, pelarut asetonitril yang merupakan pelarut terbaik dalam pembuatan [EMIM]Ac
4. Yield paling tertinggi adalah 0,86 g[EMIM]Ac/g[MIM] pada penggunaan pelarut asetoniril dan volume pelarut 25 ml.
5. Konsentrasi [EMIM]Ac paling tertinggi adalah 0,00034 mol/ml pada penggunaan pelarut asetonitril dan volume 10 ml.
5.2 Saran
Adapun saran yang dapat diberikan dari penelitian ini adalah:
1. Disarankan untuk menggunakan reaktan lain seperti perak asetat.
2. Disarankan untuk menggunakan pelarut lain seperti metil etil keton.
3. Disarankan untuk melakukan pemurnian lain seperti penggunaan adsorben.
DAFTAR PUSTAKA
ANNEX. 2018. Historical Production and Uses of Lead. www.ila- lead.org/UserFiles/File/factbook/annex.pdf. 18 Juli 2017 (15:23).
ANPEL. 2014. Lead Acetate. ANPEL.com. ANPEL Laboratory Technologies Inc.
Shanghai.
Azman, Adam M. 2006. Ionic Liquids in Organic Synthesis.
www.unc.edu/depts/mtcgroup/litmeetings/ionicliquids.pdf. 17 Juli 2017 (20:23).
Chang, Raymond. 2005. Kimia Dasar : Konsep-Konsep Inti. Jilid Satu. Edisi Ketiga.
Jakarta : Penerbit Erlangga.
Clough, Matthew T., Karolin Geyer, Patricia A. Hunt, Jurgen Mertes dan Tom Welton. 2013. Thermal Decomposition of Carboxylate Ionic Liquids: Trends and Mechanisms. The Owner Societies.
CPB. 2015. Table of Characteristic IR Absorptions. https://cpb-us- e1.wpmucdn.com/sites.ucsc.edu/dist/9/291/files/2015/11/IR-Table-1.pdf. 17 September 2018 (20:30).
Dharaskar, Swapnil A., Kailas L. Wasewar, Mahesh N. Varma, Diwakar A. Shende, dan Chang Kyoo Yoo. 2013. Ionic Liquids: The Novel Solvent for Removal of Dibenzothiophene from Liquid Fuel. Procedia Engineering 51 (314 – 317). Elsevier Ltd.
Diaz-Alvarez, Alba E. dan Victorio Cadiero. 2013. “Glycerol : A Promising Green Solvent and Reducing Agent for Metal-Catalyzed Transfer Hydrogenation Reactions and Nanoparticles Formation”. Journal Applied Science. ISSN : 2076-3417.
EPA. 2016(a). Acetonitrile. https://www.epa.gov/sites/production/files/2016- 09/documents/acetonitrile.pdf. 18 Juli 2017 (17:23).
. 2016(b). Methylene Chloride. https://www.epa.gov/sites/production/files/2016- 09/documents/methylene_chloride.pdf. 18 Juli 2017 (20:23).
Ghavre, Mukund. 2012. Low Toxicity Imidazolium & Pyridinium Ionic Liquids:
Synthesis, Antimicrobial Toxicity, Biodegradation Studies and Applications
in Tsuji-Trost Reactions. School of Chemical Sciences. Dublin City University.
Ghodke, Shrinivas.V dan Uma V. Chudasama. 2015. Friedel-Crafts Alkylation and Acylation of Aromatic Compounds Under Solvent Free Conditions Using Solid Acid Catalysts. International Journal of Chemical Studies. Vol: 2(5).
ISSN : 2349–8528.
Gonsior, Nina. 2010. Ionic Liquids: Modern Methods of Synthesis, Polymerization, Characterization, and Application. Universitat Dusseldorf.
Gurau, Gabriela, Hui Wang, Yun Qiao, Xingmei Lu, Suojiang Zhang, dan Robin D.
Rogers. 2012. Chlorine-free Alternatives to the Synthesis of Ionic Liquids for Biomass Processing. Journal Pure Application Chemistry. Vol.84, No.3.
IUPAC.
Handy, Scott T. 2011. Ionic Liquids – Classes and Properties. Edisi Pertama.
InTech.
Hernandez, Oscar. 1999. Acetone. OECD SIDS. USA.
Karkkainen, Johanna. 2007. Preparation and Characterization of Some Ionic Liquids and Their Use in the Dimerization Reaction of 2 - Methylpropene. Fakultas Ilmu Pengetahuan Alam. Departemen Kimia. Universitas Oulu.
Levenspiel, Octave. 1999. Chemical Reaction Engineering. 3th Edition. New York : John Wiley & Sons, Inc.
MEGS. 1999. Dichloromethane. www.megs.ca. Matheson Tri-Gas, Inc.
Nanchariah, Y.V dan A.J. Francis. 2015. Hormetic Effect of Ionic Liquid 1-Ethyl-3- Methylimidazolium Acetate on 1 Bacteria. Journal BNL. Chemosphere.
NIOSH. 1994. “Ethyl Bromide”. https://www.cdc.gov/niosh/docs/2003- 154/pdfs/1011.pdf. 17 Juli 2017 (20:43).
PubChem. 2018. Bromine. https://pubchem.ncbi.nlm.nih.gov. 29 Agustus 2018 (20:13).
Ratti, Rajni. 2014. Ionic Liquids: Synthesis and Applications in Catalysis. Advances in Chemistry. Hindawi Publishing Corporation.
Rios, Antonia Perez de los, Angel Irabien. Frank Hollmann dan Francisco Jose Hernandez Fernandez. 2013. Ionic Liquids: Green Solvents for Chemical
Rodriguez, Hector, Gabriela Gurau, John D. Holbrey dan Robin D. Rogers. 2011.
Reaction of Elemental Chalcogens with Imidazolium Acetates to Yield Imidazole-2-chalcogenones: Direct Evidence for Ionic Liquids as Proto- Carbenes. The Royal Society of Chemistry.
Rufiati, Etna. 2011. Apa perbedaan antara atom, molekul, dan ion?.
https://www.scribd.com/document/339188977/Apaperbedaanantara- EtnaRufiati-9706-pdf. 17 Juli 2017 (14:23).
Santa Cruz. 2010. 1-Ethyl-3-Methylimidazolium. santacruz.com. Santa Cruz Biotechnology, Inc.
Schleicher, Jay. 2009. Kinetics and Solvent Effects in The Synthesis of Ionic Liquid.
Lawrence : University of Kansas.
Schleicher, Jay dan Aaron M. Scurto. 2009. Kinetics and Solvent Effects in the Synthesis of Ionic Liquids : Imidazolium. Journal Green Chemistry. Royal Society of Chemistry.
Sciencelab. 2017(a). 1 – Methylimidazole. sciencelab.com. Sciencelab.com, Inc.
. 2017(b). Ethyl Bromide. sciencelab.com. Sciencelab.com, Inc.
. 2017(c). Acetone. sciencelab.com. Sciencelab.com, Inc.
. 2017(d). Acetonitrile. sciencelab.com. Sciencelab.com, Inc.
. 2017(e). Glycerin. sciencelab.com. Sciencelab.com, Inc.
Sekar, Vinoth K., Kiran Kotramangalam, Manogna Alluru dan Jagadeesh Manikantan. 2014. Ionic Liquids: Evident Application in Medicinal Chemistry. Journal of Comprehensive 1(1). Page 1 – 10.
Sigma-Aldrich. 2017. “1 – Methylimidazole”. sigma-aldrich.com. Sigma-Aldrich.
Inc.
Singh, Geetanjali dan Anil Kumar. 2008. Ionic Liquids: Physico-chemical, Solvent Properties and Their Application in Chemical Process. Indian Journal of Chemistry. Vol. 47A. Page 495 – 503.
Thomas, Martin, Martin Brehm, Oldamur Holloczki, Zsolt Kelemen, Laszlo Nyulaszi, Tibor Pasinszki dan Barbara Kirchner. 2014. Simulating the vibrational spectra of ionic liquid systems: 1-Ethyl-3-methylimidazolium acetate and its mixtures. The Journal of Physics 141. AIP Publishing.
Yesudass, Sasikumar, Lukman O. Olasunkanmi, Indra Bahadur, Mwadham M.Kabanda, I.B. Obot, dan Eno E. Ebenso. 2016. Experimental and Theoetical Studies on Some Selected Ionic Liquids with Different Cations/Anions as Corrosion Inhibitors for Mild Steel in Acidic Medium.
Journal of the Taiwan Institute of Chemical Engineers. Elsevier.




![Gambar 3.4 Flowchart Proses Pemurnian 1-Etil-3-Metilimidazolium Asetat 1-Etil-3-Metilimidazolium Asetat ([EMIM]Ac)t](https://thumb-ap.123doks.com/thumbv2/123dok/2162471.4041943/39.893.233.862.144.882/gambar-flowchart-proses-pemurnian-metilimidazolium-asetat-metilimidazolium-asetat.webp)
![Tabel 4.1 Hasil Sintesis Cairan Ionik [EMIM]Ac dengan Variasi Jenis Solven Aseton, Asetonitril, Diklorometana, dan Propanetriol](https://thumb-ap.123doks.com/thumbv2/123dok/2162471.4041943/40.893.154.804.612.1125/sintesis-cairan-variasi-solven-aseton-asetonitril-diklorometana-propanetriol.webp)

![Gambar 4.3 Perbandingan Antara Cairan Ionik [EMIM]Ac Standar dengan [EMIM] Ac Variasi Pelarut pada Analisa FTIR](https://thumb-ap.123doks.com/thumbv2/123dok/2162471.4041943/43.893.163.828.745.972/gambar-perbandingan-cairan-ionik-standar-variasi-pelarut-analisa.webp)