BAB 3
METODE PENELITIAN
3.1 Alat dan Bahan 3.1.1 Alat
Adapun alat-alat yang digunakan dalam penelitian ini adalah :
Neraca analitis Mettler Toledo
Hotplate Gallenkamp
Oven Memmert
Ayakan 80 mesh
Tabung Reaksi Pyrex
Erlenmeyer Pyrex Cawan petri Botol Aquades Kertas Saring Blender Pisau Cork borer Bunsen Spatula
Alat Autoklaf Fiesher Scientific
Labu Ukur Pyrex
pH Universal p.a. Merck
pH meter
Pipet volume Pyrex
Termometer Fischer
Corong
Kertas Saring Whatman No.42 Penangas Air
Pipet Tetes Statif dan Klem Stirer Magnetik Desikator
Gelas Ukur Pyrex Tungku Kaki Tiga Plastik dan Karet Kapas Alluminium poil Cling warp Serbet Tissue Sprayer Korek api
3.1.2 Bahan
Adapun bahan-bahan yang digunakan dalam penelitian ini adalah : Limbah kulit pinang
Isolat Aspergillus Niger
NaOH p.a. Merck
HCl(p) p.a. Merck Glukosa Akuades Media PDA Agar Urea (NH4)2SO4 KH2PO4 CaCl2 MgSO4. 7H2O Protease Peptone FeSO4. 7H2O MnSO4. 7H2O ZnSO4. 7H2O CoCl2 Alkohol 70% Fehling A dan B
3.2 Pembuatan Reagen dan Pembuatan Media 3.2.1 Larutan HCl 1%
Sebanyak 2,7 mL HCl 37% diencerkan dengan akuades dalam labu ukur 100 mL hingga garis tanda lalu dihomogenkan.
3.2.2 Larutan NaOH 2%
Sebanyak 10 g NaOH pellet dilarutkan dengan akuades dalam labu ukur 500 mL hingga garis tanda lalu dihomogenkan.
3.2.3 Reagen DNS
Sebanyak 1 g asam 3,5 –dinitrosalisilat dilarutkan dengan 20 ml 2 N NaOH, ditambahkan 50 ml H2O kemudian ditambahkan 30 g KNa Tartrat dimasukkan
kedalam labu takar 100 ml, ditambahkan akuades hingga garis batas, dihomogenkan kemudian simpan dan tutup dalam botol gelap.
3.2.4 Media PDA
Sebanyak 4,2 g PDA dimasukkan kedalam Erlenmeyer, ditambahkan aquadest 100 ml, diaduk dan dipanaskan sampai mendidih, kemudian disterilkan pada suhu 121oC selama 15 menit.
3.2.5 Media Starter Aspergillus Niger
Sebanyak 5 g sampel yang telah didelignifikasi dimasukkan kedalam erlenmeyer, dan sebanyak 1,5 g agar dimasukkan kedalam Erlenmeyer ditambahkan akuades 100 ml, diaduk dan dipanaskan hingga mendidih, kemudian disterilkan pada suhu 121oC selama 15 menit.
3.2.6 Pembuatan Medium Sakarifikasi
Sebanyak 0,3 g Urea, 1,4 g (NH4)2SO4,2 g KH2PO4, 0,4 g CaCl2, 0,6 g MgSO4.
ZnSO4. 7H2O dan 3,7mg CoCl2 dimasukkan kedalam beaker glass ditambahkan
3.3 Prosedur Penelitian
3.3.1 Delignifikasi Kulit Pinang
4.Sebanyak 100 g kulit pinang yang telah dikeringkan dan diblender 5.dimasukkan kedalam beaker glass
6.ditambahkan NaOH 2% hingga terendam 7.dipanaskan selama 1 jam pada suhu 600C 8.di oven pada suhu 700C hingga berat konstan 9.diblender kembali hingga halus
10. diayak dengan ayakan 80 mesh.
3.3.2 Peremajaan Isolat Aspergillus Niger
- Disterilkan sekitar tempat kerja dan tangan dengan alkohol 70% - dituang media PDA ke cawan petri steril didinginkan hingga memadat - diinokulasikan aspergillus niger dengan metode transfer media
- ditutup cawan petri dengan cling warp dan dibungkus dengan kertas HVS - diinkubasi selama 5 hari pada inkubator jamur.
3.3.3 Pembuatan Starter Aspergillus Niger
- Disterilkan sekitar tempat kerja dan tangan dengan alkohol 70% - dituang media starter ke cawan petri steril dibiarkan hingga memadat - diinokulasikan aspergillus niger dengan metode transfer media - ditutup cawan petri dengan cling warp dan dibungkus dengan kertas - diinkubasi selama 7 hari pada inkubator jamur.
3.3.4 Sakarifikasi Kulit Pinang
- Sebanyak 4,5 g sampel yang telah didelignifikasi - dimasukkan Erlenmeyer
- ditambahkan 150 ml larutan medium sakarifikasi
- diaduk hingga homogen, kemudian diatur pH 5 dengan menambahkan HCl 1%
- disterilkan pada suhu 1210C selama 15 menit
- Disterilkan sekitar tempat kerja dan tangan dengan alkohol 70%
- diinokulasi Aspergillus Niger sebanyak 5 cork borer ke medium sakarifikasi 7 hari, 8 hari, 9 hari, 10 hari dan 11 hari
- di inkubasi diatas shaker.
3.3.5 Uji Kualitatif dan Kuantitatif Glukosa
3.3.5.1 Uji Kualitatif Glukosa dengan Pereaksi Fehling
- Disaring hasil sakarifikasi menggunakan kertas whattman No.42 - diambil sebanyak 1 ml dan dimasukkan kedalam tabung reaksi - ditambahkan 1 ml masing- masing fehling A dan B
- dipanaskan dalam air mendidih selama 10 menit - diamati perubahan warna yang terjadi.
3.3.5.2 Uji Kuantitatif Glukosa dengan Reagen DNS
- Disaring hasil sakarifikasi menggunakan kertas whattman No.42 - diambil sebanyak 1 ml dimasukkan kedalam tabung reaksi
- ditambahkan 3 ml reagen DNS, dipanaskan dalam waterbath selama 5 menit
- didinginkan
- diuji dengan alat spektrofotometer UV dengan panjang gelombang 550 nm
3.4 Bagan Penelitian 3.4.1 Bagan Alir Penelitian
Preparasi Sampel (Dicuci, Dicacah, Dijemur, Diblender)
Delignifikasi Menggunakan NaOH 2% ( Dioven pada Suhu 700C)
Pemblenderan Sampel Hasil Delignifikasi ( Diayak Menggunakan Ayakan 80 Mesh )
Peremajaan Isolat Aspergillus Niger
Pembuatan Starter Aspergillus Niger
Penyiapan Medium Sakarifikasi
Sakarifikasi Enzimatis Menggunakan Aspergillus Niger
Produksi Glukosa
3.4.2 Preparasi sampel
Kulit Pinang
3.4.3 Delignifikasi Kulit Pinang
Dicuci bersih Dicacah kecil-kecil
Dijemur dibawah sinar matahari
Serabut Kulit Pinang Diblender
Dimasukkan kedalam beaker glass
Ditambahkan NaOH 2% hingga terendam Dipanaskan selama 1 jam pada suhu 60oC
Serbuk Kulit Pinang Terdelignifikasi
Di oven pada suhu 700C hingga berat konstan Diblender kembali hingga halus
100 g Serabut Kulit Pinang
Dicuci hingga pH netral
3.4.4 Peremajaan Isolat Aspergillus Niger
3.4.5 Pembuatan Starter Aspergillus Niger Media PDA
Didinginkan hingga memadat Diinokulasikan Aspergillus Niger
Ditutup cawan petri dengan cling warp dan dibungkus dengan kertas HVS
Diinkubasi selama 5 hari pada inkubator jamur.
Ditutup cawan petri dengan cling warp dan dibungkus dengan kertas HVS
Diinokulasikan aspergillus niger
Dituang media starter ke cawan petri steril Media Starter
Didinginkan hingga memadat
Diinkubasi selama 7 hari pada inkubator jamur. Starter Aspergillus Niger
Dituang media PDA kedalam cawan petri steril
3.4.6 Sakarifikasi Limbah Kulit Pinang
3.4.7 Uji Kualitatif dan Kuantitatif Glukosa 3.4.7.1 Uji Kualitatif Glukosa
Dimasukkan kedalam erlenmeyer
Ditambahkan 150 ml medium sakarifikasi Diaduk
4,5 g Kulit Pinang Terdelignifikasi
Dimasukkan kedalam tabung reaksi
Diatur pH 5 dengan menambahkan HCl 1%
Diamati perubahan warna yang terjadi
Ditambahkan 1 ml masing-masing Fehling A dan B
Di lakukan perlakuan yang sama sebanyak 6 erlenmeyer
Hasil Sakarifikasi
Endapan Merah Bata
Dipanaskan dalam air mendidih selama 10 menit Diambil filtrat sebanyak 1 ml
Disaring dengan kertas whatman No.42
Diinokulasi Aspergillus Niger sebanyak 5 cork borer Di inkubasi diatas shaker dengan variasi 7 hari, 8 hari, 9 hari, 10 hari dan 11 hari.
Disterilkan pada suhu 1210C selama 15 menit. Medium Sakarifikasi
3.4.7.2 Uji Kuantitatif Glukosa
Dimasukkan kedalam tabung reaksi
Didinginkan
Ditambahkan 3 ml reagen DNS
Larutan Kuning Kecoklatan
Di uji dengan alat spektrofotometer UV dengan panjang gelombang 550 nm
Dipanaskan dalam air mendidih selama 5 menit
Diukur absorbansinya
Diambil filtrat sebanyak 1 ml
Disaring dengan kertas whatman No.42 Hasil Sakarifikasi
BAB 4
HASIL DAN PEMBAHASAN 4.1 Hasil Penelitian
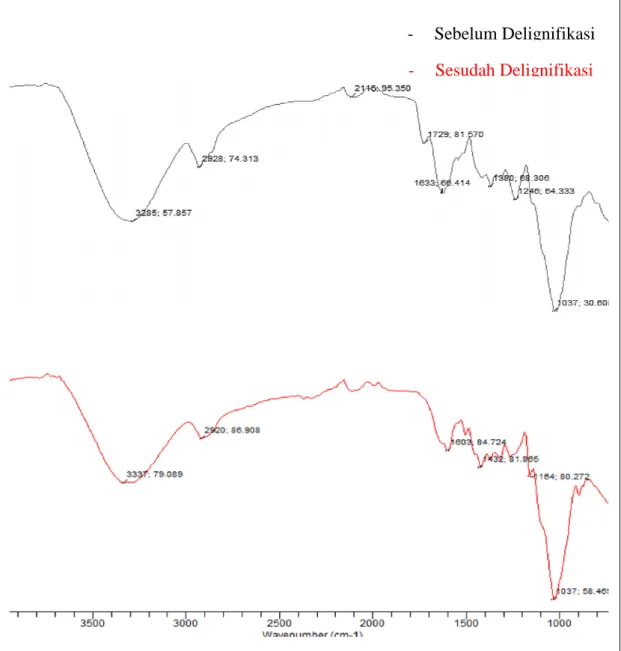
Dalam pembuatan glukosa dari subtrat kulit pinang (Areca catechu L.) menggunakan Aspergillus Niger terlebih dahulu dilakukan proses delignifikasi kulit pinang sebelum proses sakarifikasi, diperoleh data analisa FT-IR kulit pinang sebelum dan sesudah delignifikasi dengan NaOH 2% sebagai berikut :
Gambar 4.1 Spektrum FT-IR Kulit Pinang Sebelum dan Sesudah Delignifikasi NaOH 2%
- Sebelum Delignifikasi - Sesudah Delignifikasi
Berdasarkan gambar 4.1 menunjukkan puncak khas pada spektrum FT-IR dari kulit pinang sebelum dan sesudah delignifikasi sebagai berikut (tabel 4.1) :
Tabel 4.1 Data FT-IR Kulit Pinang Sebelum dan Sesudah Delignifikasi NaOH 2%
Gugus Fungsi Bilangan Gelombang Hasil (cm-1) Teori Regang OH, N-H 3285 (TD) 3750-3000
3337 (SD)
Regang Aldehid 2928 (TD) 3000-2700 CH3, CH2, C-H 2920 (SD)
Regang C=O 1729 dan 1633 (TD) 1900-1650
- (SD)
C-H Bending 1380 (TD) 1475-1300 1432 (SD)
Analisis Struktur Senyawa Organik (Dachriyanus, A. 2002) Keterangan : TD = Kulit Pinang Tanpa Delignifikasi
SD = Kulit Pinang Sesudah Delignifikasi
Kulit pinang terdelignifikasi kemudian disakarifikasi menggunakan Aspergillus Niger. Hasil sakarifikasi dianalisis secara kualitatif yang diuji dengan menggunakan pereaksi Fehling A dan B, sehingga diperoleh hasil sebagai berikut (tabel 4.2) : Tabel 4.2 Hasil Analisa Kualitatif Kadar Glukosa dari Hasil Sakarifikasi
No. Sampel Penambahan Pereaksi Fehling
1. Larutan Hasil Sakarifikasi Endapan Merah Bata Kulit Pinang
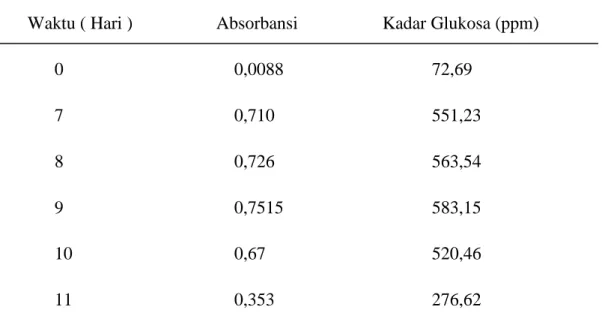
Kemudian hasil sakarifikasi kulit pinang diuji secara kuantitatif dengan menggunakan metode DNS menggunakan spektrofotometer UV dengan panjang gelombang 550 nm, sehingga diperoleh hasil sebagai berikut (tabel 4.3) :
Tabel 4.3 Hasil Analisa Kuantitatif Kadar Glukosa dari Hasil Sakarifikasi Waktu ( Hari ) Absorbansi Kadar Glukosa (ppm)
0 0,0088 72,69 7 0,710 551,23 8 0,726 563,54 9 0,7515 583,15 10 0,67 520,46 11 0,353 276,62
4.2 Pembahasan
4.2.1 Analisa FTIR (Fourier Transform Infra Red) Kulit Pinang Sebelum Deignifikasi dan Sesudah Delignifikasi NaOH 2%
Dari gambar 4.1 memberikan puncak dengan intensitas kuat pada panjang gelombang 3285 cm-1 yang terdapat pada kulit pinang sebelum proses delignifikasi, 3337 cm-1 pada kulit pinang setelah delignifikasi menunjukkan gugus – OH dengan stretching vibration. Gugus –OH pada kisaran panjang gelombang tersebut juga menunjukkan adanya ikatan hidrogen intramolekular dan merupakan gugus utama pada selulosa, karena selulosa merupakan rantai panjang dari β glukosa. Terlihat perbedaan puncak serapan gugus O-H pada kulit pinang sebelum delinifikasi dan kulit pinang setelah delignifikasi, dimana intensitas serapan setelah delignifikasi lebih tajam yang menunjukkan adanya peningkatan selulosa. Gugus C=C stretching vibration merupakan karakteristik dari kerangka lignin yang muncul di sekitar 1500 - 1700 cm-1. Puncak gugus ini pada kulit pinang sebelum delignifikasi dan hasil setelah delignifikasi terjadi penurunan yang menunjukkan adanya penghilangan lignin selama proses delignifikasi (Darni, dkk 2016).
Hermiati (2016) menyatakan puncak lignin dapat ditemukan di sampel tanpa dan dengan perlakuan pada bilangan gelombang 1250 cm-1 untuk unit guaiasil dan 1327 cm-1 untuk unit siringil. Berdasarkan spektrum FTIR tersebut tampak jelas bahwa karakteristik puncak lignin dapat ditemukan di sampel tanpa delignifikasi pada bilangan gelombang 1246 cm-1 dan pada sampel setelah delignifikasi pada bilangan gelombang 1164 cm-1. Hal ini mengindikasikan bahwa perlakuan alkali meningkatkan laju delignifikasi pada kulit pinang. Gugus fungsional yang teridentifikasi pada kulit pinang sebelum dan sesudah pra perlakuan tampak bahwa pra perlakuan delignifikasi menyebabkan kehilangan beberapa gugus fungsional. Selain itu terjadi perbedaan intensitas pada masing-masing gugus fungsional yang teridentifikasi. Pra perlakuan NaOH menyebabkan terjadinya kehilangan gugus fungsi C=O pada hemiselulosa, Hal ini karena dalam aktifitas penyerangan polimer lignin, pra perlakuan juga menyebabkan terjadinya kehilangan karbohidrat terutama hemiselulosa. Struktur rantai bercabang pada
hemiselulosa dan derajat polimerisasi yang lebih rendah pada hemiselulosa menyebabkan polimer ini lebih mudah terdegradasi dibandingkan dengan selulosa yang didominasi struktur kristalin. Hal ini terlihat pada puncak pada bilangan gelombang 1729 cm-1 berhubungan dengan gugus C=O stretching vibration yang melambangkan adanya kehadiran hemiselulosa dan terjadinya penurunan puncak ini pada hasil setelah delignifikasi adalah hasil dari berkurangnya kadar hemiselulosa.
4.2.2 Analisa Kualitatif Glukosa
Pengujian kualitatif glukosa dilakukan dengan menggunakan pereaksi fehling, berdasarkan hasil pengujian kualitatif terhadap hasil sakarifikasi dengan menggunakan larutan Fehling menunjukkan hasil yang positif yaitu memberikan endapan merah bata. Terbentuknya endapan merah bata menandakan adanya glukosa .
4.2.3 Analisa Kadar Glukosa
Pengukuran kadar glukosa dilakukan dengan menggunakan metode DNS menggunakan spektrofotometer UV dengan panjang gelombang 550 nm.
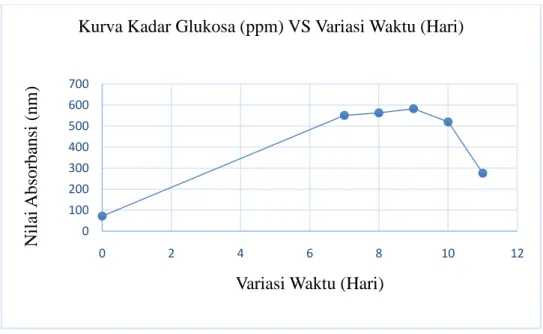
Gambar 4.2 Kurvsa Analisa Kadar Glukosa dengan Variasi Waktu
0 100 200 300 400 500 600 700 0 2 4 6 8 10 12 N il ai A bs or ba ns i (nm )
Variasi Waktu (Hari)
Berdasarkan dari Kurva Kadar Glukosa (ppm) VS Variasi Waktu (Hari) (Gambar 4.2) dapat dilihat bahwa kadar glukosa mengalami perubahan seiring bertambahnya waktu sakarifikasi. Pada sakarifikasi 0 hari atau sebelum ditambahkan A. niger kadar glukosa pada kulit pinang sangat rendah yaitu 72,69 ppm. Hal ini dikarenakan tidak ada enzim selulase yang terbentuk sehingga reaksi penguraian berlangsung lambat. Kadar glukosa relatif meningkat pada hari ke-7 sampai hari ke-8 dan mencapai waktu maksimal pada hari ke-9, dengan kadar glukosa yang diperoleh yaitu sebesar 583,15 ppm. Kadar glukosa mulai menurun pada hari ke-10 dan 11. Menurut Rismawati ( 2016) Hal ini dikarenakan glukosa yang terbentuk dari hasil penguraian selulosa oleh enzime selulase digunakan sebagai nutrisi oleh jamur Aspergillus Niger untuk mempertahankan pertumbuhannya. Sehingga saat dilakukan pengukuran kadar glukosa yang tersedia lebih sedikit dibanding pada hari-hari sebelumnya.
Pertumbuhan Aspergillus Niger mengalami fase lambat (lag) pada hari ke-0. Pada fase ini mikroorganisme menyesuaikan diri dengan subtrat dan kondisi lingkungan di sekitarnya. Pada hari ke-7 sampai hari 9 merupakan fase pertumbuhan lambat dan fase pertumbuha tetap. Pada fase lambat zat nutrisi di dalam medium sudah sangat berkurang dan adanya zat hasil-hasil metabolisme yang mungkin beracun atau dapat menghambat pertumbuhan jasad renik. Pada fase pertumbuhan tetap ukuran sel pada fase ini lebih kecil karena sel tetap membelah meskipun zat nutrisi sudah habis. Sedangkan pada hari ke-10 dan 11 merupakan fase menuju kematian dan fase kematian karena nutrien di dalam medium sudah habis dan energi cadangan di dalam sel habis. Jumlah sel yang mati semakin lama akan semakin banyak, kecepatan kematian dipengaruhi kondisi nutrien, lingkungan, dan jenis jasad renik. Setelah melewati fase ini pertumbuhan mikroba mengalami kematian yang sangat besar terhadap kadar gluosa yang dihasilkan (Waluyo, L. 2010)
semakin lama proses sakarifikasi, maka kadar glukosa yang dihasilkan semakin meningkat. Pada sakarifikasi 0 hari atau sebelum ditambahkan A. niger kadar glukosa pada kulit pinang sangat rendah yaitu 72,69 ppm. Hal ini dikarenakan tidak ada enzim selulase yang terbentuk sehingga reaksi penguraian berlangsung lambat.
Pada hari ke-7 sampai hari ke-11 mengalami peningkatan dan mencapai titik maksimum pada hari ke-9 serta mulai mengalami penurunan pada hari ke-10 dan 11. Hal ini selaras dengan penelitian Gunam, dkk. (2010) yang menyatakan bahwa pH media mengalami penurunan sehingga tidak sesuai dengan kondisi optimum untuk pertumbuhan A. Niger. Mulyono (2009) menyatakan aktivitas selulase terlihat meningkat selaras dengan meningkatnya pH awal medium dari 4,4 menuju 5,0 kemudian aktivitas selulase menurun kembali setelah peningkatan pH menjadi 5,5 dan pH awal 5,0 merupakan pH terbaik.
Kadar glukosa yang dihasilkan pada penelitian ini masih relatif rendah. Menurut Kusumaningati (2008) menyatakan bahwa nilai konversi gula reduksi yang tidak seberapa besar ini karena menggunakan enzim kasar dari kapang Aspergillus Niger sp. yang tidak dimurnikan sehingga kemungkinan juga mengandung enzim-enzim lain seperti hemiselulase dengan hasil akhir xilosa (pentosa) bukan glukosa (heksosa).
Pada penelitian ini dilakukan 2 kali pengulangan, hasil uji berbeda pada setiap pengulangan. Hal ini dikarenakan tidak diketahui jumlah kepadatan kapang pada setiap pengulangan, hal ini sama dengan pada penelitian yang dilakukan Oktavia, F.I. dkk (2014) menyatakan bahwa karena jumlah kapang yang disuspensikan dalam media tidak diketahui kepadatan kapangnya, sehingga menghasilkan aktivitas enzim yang berbeda pada setiap pengulangannya.
BAB 5
KESIMPULAN DAN SARAN 5.1 Kesimpulan
1. Kulit pinang dapat dijadikan sebagai subtrat pembuatan glukosa
2. Aspergillus Niger juga dapat dimanfaatkan untuk menghidrolisis kulit pinang menjadi glukosa dengan proses sakarifikasi.
3. Lama sakarifikasi selama 9 hari merupakan waktu yang optimal untuk Aspergillus Niger menghidrolisis kulit pinang menjadi glukosa yaitu sebesar 583,15 ppm.
5.2 Saran
Diharapkan pada peneliti selanjutnya untuk melakukan penelitian lebih lanjut pada pembuatan glukosa dengan proses sakarifikasi oleh Aspergillus Niger menggunakan subtrat kulit pinang dengan variasi lain seperti variasi pH, konsentrasi subtrat dan konsentrasi perlakuan delignifikasi NaOH sehingga dihasilkan glukosa yang lebih optimal.