PENGARUH MACAM, pH, DAN PENGGOYANGAN MEDIA
TERHADAP PERTUMBUHAN CENDAWAN
Fusarium oxysporum
Oleh :
ENY PUSPITA SARI
E01499078
PROGRAM STUDI BUDIDAYA HUTAN
FAKULTAS KEHUTANAN
INSTITIT PERTANIAN BOGOR
2006
RINGKASAN
ENY PUSPITA SARI (E01499078). Pengaruh Macam, Ph, dan Penggoyangan Media terhadap Pertumbuhan Cendawan Fusarium
oxysporum. Dibimbing oleh ACHMAD.
Cendawan atau fungi adalah organisme heterotrofik, mereka
memerlukan senyawa organik untuk nutrisinya. Bila mereka hidup dari benda organik yang terlarut, mereka disebut saprofit. Beberapa fungi, meskipun saprofit dapat juga menyerang inang yang hidup lalu tumbuh subur pada inang sebagai parasit. Mereka menimbulkan penyakit pada tumbuhan dan hewan termasuk manusia. Salah satu penyakit yang dapat ditimbulkan oleh
cendawan pada tanaman adalah damping-off. Berbagai cendawan tanah yang dapat menimbulkan penyakit damping-off atau lodoh adalah Rhizoctonia sp.,
Rhizoctonia solani, Fusarium sp. dan Pythium sp. Fusarium yang
merupakan salah satu penyebab penyakit pembuluh dikelompokkan dalam jenis Fusarium oxysporum. Untuk mengetahui sifat-sifat dari mikoorganisme khususnya cendawan, maka dapat diberikan perlakuan seperti macam media, pH, dan penggoyangan.
Tujuan dari penelitian ini adalah untuk: 1) mengetahui pengaruh macam media terhadap pertumbuhan cendawan F. oxysporum, 2) mengetahui pengaruh pH terhadap pertumbuhan cendawan F. oxysporum dan 3)
mengetahui pengaruh penggoyangan terhadap pertumbuhan biomassa
F. oxysporum.
Penelitian ini dilaksanakan pada bulan Februari sampai April 2004 di Laboratorium Bioteknologi Kehutanan dan Laboratorium Rekayasa Bioproses Pusat Antar Universitas Bioteknologi Institut Pertanian Bogor.
Bahan yang digunakan dalam penelitian ini adalah : inokulum F.
oxysporum, Potato Dextrose Agar (PDA), Potato Sucrose Agar (PSA), Potato Dextrose Liquid (PDL) dan Potato Sucrose Liquid (PSL), bahan kimia
(alkohol 70% dan Natrium hipoklorit), aquadest. Alat-alat yang digunakan adalah : mikroskop, erlenmeyer 250 ml, cawan petri, autoklaf, laminar air flow, jarum ose, oven, preparat, bunsen dan kertas saring.
Penelitian ini dilakukan dengan melihat pengaruh macam media (PDA, PSA, PDL dan PSL), beberapa tingkat pH ( 2, 3, 4, 5, 6, 7 dan 8), dan penggoyangan media. Rancangan percobaan yang digunakan dalam penelitian ini adalah Rancangan Faktorial dalam Rancangan Acak Lengkap (RAL) untuk analisis diameter koloni F. oxysporum yang terdiri dari dua faktor, yaitu faktor media dan pH. Setiap perlakuan diulang tiga kali, dan tiap ulangan terdiri atas satu biakan dalam cawan petri. Untuk analisis pertumbuhan biomassa F.
oxysporum digunakan Rancangan Faktorial dalam Rancangan Acak Lengkap
(RAL), yang terdiri dari 3 faktor, yaitu media, pH dan penggoyangan. Setiap perlakuan diulang tiga kali, dan dan tiap ulangan terdiri atas satu biakan dalam erlenmeyer.
Pengamatan untuk pengaruh media padat (PDA dan PSA) pada beberapa tingkat pH terhadap diameter koloni F. oxysporum dilakukan setiap hari dengan mengukur diameter koloni (cm) pada cawan petri sampai hari ke tujuh. Pengamatan pertumbuhan biomassa ( bobot kering) F. oxysporum pada media cair (PDL dan PSL) dengan beberapa tingkat pH dan penggoyangan, dilakukan dengan cara menimbang miselium hasil inkubasi selama 4 hari yang telah dikeringkan dengan cara dioven selama 24 jam kemudian ditimbang. Selain itu dilakukan pengamatan secara mikroskopis terhadap F.
oxysporum dengan cara mengambil sedikit miselium dengan menggunakan
jarum ose dan diletakkan di gelas objek yang telah diberi air kemudian diamati dan difoto. Pengamatan kondisi makroskopis biakan F. oxysporum dilakukan dengan mengamati tipis tebalnya miselium dan warnanya.
Hasil pengamatan selama tujuh hari menunjukkan bahwa macam media serta interaksinya dengan pH tidak berpengaruh terhadap diameter koloni F. oxysporum. Derajat kemasaman (pH) berpengaruh nyata terhadap diameter koloni F. oxysporum. Derajat kemasaman (pH) optimal media untuk pertumbuhan koloni F. oxysporum adalah 5.0-8.0. Hasil pengamatan bobot kering miselium menunjukkan bahwa macam media dan interaksinya dengan ke dua faktor yang lain tidak berpengaruh terhadap pertumbuhan biomassa F.
oxysporum. Derajat kemasaman (pH) dan penggoyangan serta interaksi kedua
faktor berpengaruh nyata terhadap pertumbuhan biomassa F. oxysporum. Derajat kemasaman (pH) optimal media untuk pertumbuhan biomassa F.
oxysporum adalah 4.0. Pertumbuhan biomassa optimal pada saat diinkubasi
dalam erlenmeyer yang diberikan perlakuan penggoyangan. Kondisi makroskopis F. oxysporum menunjukkan bahwa miselium yang tumbuh pada medium PSA lebih tebal daripada miselium yang tumbuh pada medium PDA. Kondisi makroskopis F. oxysporum menunjukkan bahwa F. oxysporum mempunyai tiga macam spora, yaitu: mikrokonidia, makrokonidia, dan klamidospora.
PENGARUH MACAM, pH, DAN PENGGOYANGAN MEDIA
TERHADAP PERTUMBUHAN CENDAWAN
Fusarium oxysporum
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kehutanan pada Fakultas Kehutanan
Institut Pertanian Bogor
Oleh :
ENY PUSPITA SARI
E01499078
PROGRAM STUDI BUDIDAYA HUTAN
FAKULTAS KEHUTANAN
INSTITUT PERTANIAN BOGOR
2006
JUDUL : PENGARUH MACAM, pH, DAN PENGGOYANGAN
MEDIA TERHADAP PERTUMBUHAN CENDAWAN
Fusarium oxysporum
NAMA : ENY PUSPITA SARI
NRP : E01499078
Menyetujui, Dosen Pembimbing (Dr. Ir. Achmad, MS) NIP. 131 760 842 Mengetahui, Dekan Fakultas Kehutanan(Prof. Dr. Ir. Cecep Kusmana, MS) NIP. 131 430 799
DAFTAR ISI
Halaman
DAFTAR ISI ... iv
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vii
I.PENDAHULUAN A. Latar Belakang ... 1
B. Tujuan ... 2
C. Manfaat Penelitian ... 3
D. Hipotesis ... 3
II. TINJAUAN PUSTAKA A. Fungi… ... 4 B. Deuteromycetes ... 5 C. Fusarium oxysporum ... 9 D. Media… ... 11 E. Derajat Kemasaman (pH) ... 14 F. Karbohidrat ... 15
III.METODE PENELITIAN A. Waktu dan Lokasi Penelitian ... 19
B. Alat dan Bahan ... 19
C. Metode Penelitian ... 19
1. Pembuatan Media Padat ... 19
2. Pembuatan Media Cair ... 20
3. Sterilisasi ... 20
4. Peremajaan Cendawan ... 21
5. Inokulasi ... 22
6. Pengamatan ... 22
7. Analisis Data ... 23
IV.HASIL dan PEMBAHASAN A. Hasil ... 27
1. Diameter Koloni F. oxysporum ... 27
2. Pertumbuhan Biomassa F. oxysporum ... 31
3. Pengamatan Mikroskopis ... 34
B. Pembahasan ... 36
1. Pengaruh Derajat Kemasaman (pH) Media terhadap Diameter Koloni F. oxysporum ... 36
3. Pengaruh Penggoyangan terhadap Pertumbuhan Biomassa
F. oxysporum ... 40
4. F. oxysporum ... 42
V.KESIMPULAN DAN SARAN A. Kesimpulan ... 44
B. Saran ... 44
DAFTAR PUSTAKA ... 45
DAFTAR GAMBAR
Halaman
1. Bentuk konfigurasi Glukosa ... 17 2. Bentuk konfigurasi Fruktosa ... 18 3. Pertumbuhan Isolat F. oxysporum Setelah Diinkubasi Selama 7 Hari
pada pH Media 2 ... 28 4. Pertumbuhan Isolat F. oxysporum Setelah Diinkubasi Selama 7 Hari
pada pH Media 3 ... 29 5. Pertumbuhan Isolat F. oxysporum Setelah Diinkubasi Selama 7 Hari
pada pH Media 4 ... 29 6. Pertumbuhan Isolat F. oxysporum Setelah Diinkubasi Selama 7 Hari
pada pH Media 5 dan 6 ... 30 7. Pertumbuhan Isolat F. oxysporum Setelah Diinkubasi Selama 7 Hari
pada pH Media 7 dan 8 ... 30 8. Pertumbuhan F. oxysporum pada Media PDA dengan berbagai
Tingkat pH ... 31 9. Pertumbuhan F. oxysporum pada Media PSA dengan berbagai
Tingkat pH ... 31 10. Pertumbuhan Isolat F. oxysporum yang Dibiakkan dalam Media Cair ... 32 11. Bobot Kering Miselium F. oxysporum dengan Perlakuan
Penggoyangan ... 33 12. Bobot Kering Miselium F. oxysporum Tanpa Perlakuan
Penggoyangan ... 33 13. Klamidospora F. oxysporum pada Media PSA dengan pH 4 ... 34 14. Percabangan konidiofor F. oxysporum pada media PDA
dengan pH 6 ... 34 15. Makrokonidia F. oxysporum pada media PDA dengan pH 2 ... 35 16. Mikrokonidia F. oxysporum pada media PSA dengan pH 8 ... 35
DAFTAR LAMPIRAN
Halaman
17. Komposisi Media Pertumbuhan F. oxysporum ... 49
18. Pertumbuhan F. oxysporum pada Kombinasi Macam Media dan Tingkat pH ... 50
19. Sidik Ragam Diameter Koloni F. oxysporum pada Umur 1 Hari ... 50
20. Sidik Ragam Diameter Koloni F. oxysporum pada Umur 2 Hari ... 51
21. Sidik Ragam Diameter Koloni F. oxysporum pada Umur 3 Hari ... 51
22. Sidik Ragam Diameter Koloni F. oxysporum pada Umur 4 Hari ... 51
23. Sidik Ragam Diameter Koloni F. oxysporum pada Umur 5 Hari ... 52
24. Sidik Ragam Diameter Koloni F. oxysporum pada Umur 6 Hari ... 52
25. Sidik Ragam Diameter Koloni F. oxysporum pada Umur 7 Hari ... 52
26. Diameter Koloni F. oxysporum pada Kombinasi Macam Media dan Tingkat pH pada Umur 7 Hari ... 53
27. Sidik Ragam Pertumbuhan Biomassa F. oxysporum ... 53
28. Bobot Kering Miselium F. oxysporum pada Kombinasi pH dan Penggoyangan Media yang Dibiakkan pada Medium Potato Dextrose Liquid (PDL) ... 54
29. Bobot Kering Miselium F. oxysporum pada Kombinasi pH dan Penggoyangan Media yang Dibiakkan pada Medium Potato Sucrose Liquid (PSL) ... 54
30. Diameter Koloni F. oxysporum pada Kombinasi Macam Media dan Tingkat pH pada Hari Pertama ... 55
31. Diameter Koloni F. oxysporum pada Kombinasi Macam Media dan Tingkat pH pada Hari ke Dua ... 55
32. Diameter Koloni F. oxysporum pada Kombinasi Macam Media dan Tingkat pH pada Hari ke Tiga ... 56
33. Diameter Koloni F. oxysporum pada Kombinasi Macam Media dan Tingkat pH pada Hari ke Empat ... 56
34. Diameter Koloni F. oxysporum pada Kombinasi Macam Media dan Tingkat pH pada Hari ke Lima ... 57 35. Diameter Koloni F. oxysporum pada Kombinasi Macam Media dan Tingkat
pH pada Hari ke Enam ... 57 36. Diameter Koloni F. oxysporum pada Kombinasi Macam Media dan Tingkat
pH pada Hari ke Tujuh ... 58 37. Bobot kering F. oxysporum yang Dibiakkan pada Medium PDL
tanpa Penggoyangan ... 58 38. Bobot kering F. oxysporum yang Dibiakkan pada Medium PDL
dengan Penggoyangan ... 59 39. Bobot kering F. oxysporum yang Dibiakkan pada Medium PSL
tanpa Penggoyangan ... 59 40. Bobot kering F. oxysporum yang Dibiakkan pada Medium PSL
I. PENDAHULUAN
A. Latar Belakang
Cendawan atau fungi adalah organisme heterotrofik, mereka memerlukan senyawa organik untuk nutrisinya. Bila mereka hidup dari benda organik yang terlarut, mereka disebut saprofit. Beberapa fungi, meskipun saprofit dapat juga menyerang inang yang hidup lalu tumbuh subur pada inang sebagai parasit. Mereka dapat menimbulkan penyakit pada tumbuhan dan hewan termasuk manusia (Pelczar, 1986).
Salah satu penyakit yang dapat ditimbulkan oleh cendawan pada tanaman adalah damping-off. Menurut Suharti (1972) berbagai cendawan tanah yang dapat menimbulkan penyakit lodoh atau damping-off adalah
Rhizoctonia sp., Rhizoctonia solani, Fusarium sp. dan Pythium sp. Lebih
lanjut Semangun (1996) menjelaskan bahwa tumbuhan yang baru tumbuh dan dalam keadaan lembab dapat diserang oleh beberapa macam jamur (misalnya,
Rhizoctonia, Sclerotium, Fusarium, Phytium, atau Phytopthora) yang
menyebabkan pangkal batang busuk dan tumbuhan rebah. Gejala ini sering disebut sebagai “rebah semai” (damping-off).
Menurut Alexopoulos (1961) Fusarium yang bersifat parasit biasanya menyerang pembuluh yang menyebabkan layu pada tanaman dengan cara menyumbat jaringan penyaluran makanan dan dapat juga dengan mengeluarkan toksin. Semangun (1996) menjelaskan bahwa Fusarium yang menjadi salahsatu penyebab penyakit pembuluh dikelompokkan dalam jenis
Fusarium oxysporum. Selanjutnya Booth (1971) menjelaskan F. oxysporum
merupakan salah satu bagian dari anggota genus Fusarium yang sangat penting dan juga merupakan salah satu spesies yang paling labil dan mudah berubah-ubah.
Karena ukuran cendawan yang kecil, maka keterangan yang dapat diperoleh tentang sifat-sifatnya dari pemeriksaan terhadap individu itu terbatas, oleh karena itu ada dua tahap kerja yang dapat dipergunakan yaitu : isolasi, adalah pemisahan mikroorganisme yang khusus dari populasi campuran yang terdapat di alam dan pembiakan, adalah penumbuhan
populasi mikroba di lingkungan buatan (media biakan) dalam keadaan laboratorium (Stanier et al., 1982). Pembiakan cendawan dapat menggunakan berbagai macam media. Fardiaz (1992) membagi medium (tunggal) atau media (jamak) menjadi tiga macam yaitu :
1. Medium cair yang dapat digunakan untuk berbagai tujuan termasuk menumbuhkan atau membiakkan mikroba, fermentasi dan yang lainnya, misalnya Nutrient Broth, Glucose Broth, dan sebagainya.
2. Medium padat, contohnya: Nutrient agar, Plate Count Agar atau Potato Dextrose Agar yang dapat digunakan untuk menumbuhkan mikroba pada permukaannya sehingga membentuk koloni yang dapat dilihat, dihitung atau diisolasi, dan
3. Medium setengah padat (semi solid) yang mempunyai konsistensi diantara medium cair dan medium padat.
Selain media-media yang disebutkan oleh Fardiaz (1992) masih banyak media lain yang dapat digunakan untuk mengisolasi atau membiakan
cendawan dan untuk mengetahui sifat-sifat dari mikoorganisme umumnya dan F. oxysporum khususnya dapat diberikan perlakuan seperti macam media, pH dan penggoyangan.
B. Tujuan Penelitian
Penelitian ini bertujuan untuk :1. Mengetahui pengaruh macam media terhadap pertumbuhan cendawan
F. oxysporum.
2. Mengetahui pengaruh pH terhadap pertumbuhan cendawan
F. oxysporum.
3. Mengetahui pengaruh penggoyangan terhadap pertumbuhan biomassa
C. Manfaat Penelitian
Penelitian ini dilakukan untuk memberikan informasitentang
pertumbuhan cendawan (biomassa dan diameter) F. oxysporum secara
in-vitro yang diberikan perlakuan macam media, pH dan penggoyangan.
Selain itu hasil penelitian ini diharapkan dapat digunakan sabagai informasi untuk menyusun strategi dalam upaya penanggulangan penyakit yang disebabkan patogen F. oxysporum.
D. Hipotesis
1. Pemberian perlakuan macam media berpengaruh terhadap pertumbuhan cendawan F. oxysporum.
2. Pemberian perlakuan pH berpengaruh terhadap pertumbuhan cendawan
F. oxysporum.
3. Pemberian perlakuan penggoyangan berpengaruh terhadap pertumbuhan biomassa cendawan F. oxysporum.
II. TINJAUAN PUSTAKA
A. Fungi
Gilman (1945) menjelaskan bahwa fungi adalah organisme yang mempunyai sturktur organ vegetatif dan mempunyai sistem seperti pipa tipis yang bercabang yang biasa disebut miselium. Miselium ini biasanya tumbuh dengan cara radial (seperti jari-jari lingkaran), jika kondisinya sama (stabil) dari titik asal tersebut. Setiap cabang dari miselium dapat dibatasi oleh dinding yang melintang (septa) atau dapat tidak dibatasi (tidak bersepta), hal ini tergantung dari spesies cendawan tersebut. Biasanya pertumbuhan miselium terbatas pada daerah yang cukup sempit di permukaan sehingga miselium tersebut menjadi kumpulan berbentuk bundar di cawan petri atau menjadi lingkaran yang sedang pada daerah yang terbuka.
Semangun (1996) menjelaskan bahwa jamur (fungi) adalah organisme yang sel-selnya berinti sejati (eukaryotic), biasanya berbentuk benang, bercabang-cabang, tidak berklorofil, dinding selnya mengandung kitin, selulosa, atau keduanya. Jamur adalah organisme heterotrof, absortif dan membentuk beberapa macam spora. Bagian vegetatif jamur pada umumnya berupa benang-benang memanjang, bersekat (septa) atau tidak, yang disebut hifa. Kumpulan benang-benang hifa disebut miselium. Di dalam Sastrahidayat (1990) dikatakan bahwa dalam perkembangan hidupnya hifa-hifa dapat membentuk berbagai struktur khusus yang mempunyai fungsi tertentu, antara lain :
a. Haustorium, untuk menyerap unsur hara (makanan) dari inang.
b. Sclerotium, untuk melindungi diri dari keadaan yang kurang menguntungkan.
c. Apresorium, untuk melekatkan diri pada sumber makanan dan sebagai persiapan menembus jaringan.
d. Stroma, tempat melekatnya tubuh buah.
e. Plectenchyma, merupakan jaringan yang tebal terbuat dari anyaman hifa, biasanya merupakan dinding badan buah.
f. Alat-alat reproduksi, seperti : gametangium, sporangium dan sporangiofor, konidium dan konidiofor, khlamidospora dan bermacam-macam tubuh buah.
Baskoro (1994) menjelaskan bahwa fungi termasuk eukariot dan memiliki sifat-sifat tertentu sama dengan tumbuh-tumbuhan, seperti memiliki dinding sel, vakuola berisi getah sel dan dengan mikroskop dapat diamati aliran plasma dan juga sifat nyata ketidakmampuan untuk bergerak. Fungi tidak mengandung pigmen fotosintesis dan bersifat khemoorganoheterotrof. Fungi tumbuh pada kondisi aerob dan memperoleh energi dengan mengoksidasi bahan organik.
Menurut Blancard dan Tattar (1981), dalam identifikasi penyakit tanaman yang disebabkan oleh fungi, beberapa pengetahuan tentang klasifikasi mereka dapat bermanfaat. Semakin banyak informasi tentang organisme patogenik yang diketahui maka semakin besar kesempatan dalam mengontrol mereka, lebih dari 100 000 spesies fungi, kurang dari 2 000 telah terbukti patogenik dalam pohon. Fungi-fungi tersebut telah dikelompokkan dengan menggunakan ciri-ciri: morfologi, nutrisi, biokimia, ontogeny, dan karakteristik-karakteristik yang lain. Secara tradisional fungi di bagi ke dalam empat kelompok besar ; Phycomycetes, Ascomycetes, Basidiomycetes, dan Deuteromycetes.
B. Deuteromycetes
Kaul (1997) dalam Hidayat (2005) menyatakan bahwa jamur dibagi ke dalam empat kelas berdasarkan ada tidaknya cirri-ciri seksual dan spora seksual yang dibentuk, yaitu :
1. Deuteromycetes, merupakan jamur imperfect karena dalam proses reproduksinya fase telemorfnya belum diketahui, sedangkan fase anamorfnya sudah diketahui. Jamur ini memiliki hifa yang bersekat. Contoh : Fusarium spp., Rhizoctonia spp. dan Penicillium spp.
2. Basidiomycetes, umumnya memiliki hifa yang bersekat membentuk sambungan kait (clamp connection), berkembangbiak secara aseksual maupun seksual. Perkembangbiakan secara seksual biasanya tidak diikuti
langsung oleh kariogami. Selain itu antara alat kelamin jantan dan betina tidak dapat dibedakan dan pada umumnya membentuk tubuh buah. Contoh : Ganoderma spp., Agaricus spp. dan Pleurotus spp.
3. Ascomycetes, umumnya mempunyai askus (kantong) yang berisi spora seksual dan hifanya bersekat. Alat kelamin jantan anteridium dan alat kelamin betina askogonium. Contoh : Oidium spp., Sacharomycetes spp. dan Nechtira spp.
4. Oomycetes, mempunyai cirri-ciri sebagai berikut : talusnya berbentuk filamen, hifanya tidak bersekat, mempunyai alat kelamin jantan (anteridium) dan alat kelamin betina (oogonium). Contoh dari kelas ini adalah Phytium spp., Phytopthora spp. dan Saprolegnia spp.
Menurut teori dalam hal reproduksi, fungi memproduksi spora sebagai akibat dari pembelahan sel dan peleburan inti (spora seksual), tetapi jika fungi berada di bawah kondisi kultural maka akan terbentuk spora aseksual (konidia) di mana sebagai hasil dari pembelahan sel dari miselium, sehingga mendorong para peneliti untuk menjadikannya sebagai dasar identifikasi dari banyak spora aseksual. Tanpa melihat ke struktur spora seksual, tetapi dari ciri-ciri spora, hifa dan pendukung konidium (konidiofor) yang mereka bentuk, konidia dapat dikelompokkan ke dalam bentuk spesies, genus, dan family, seperti pada fungi. Kelompok genus ini tersusun ke dalam fungi imperfek. Dalam fungi imperfek susunan dari konidiofor dan hubungannya dengan satu sama lain digunakan sebagai dasar pengelompokkan dan sebagai dasar penggabungan spesies ke dalam bentuk genus, family, dan ordo. Tiga ordo yang dikenal, yaitu: Sphaeropsidales, dengan konidia dan konidiofor terdapat batas-batas yang jelas berbentuk seperti wadah botol disebut Pycnidia; Melanconiales, mempunyai bentuk konidiofor berhubungan seperti piring/cakra tetapi dalam kelompok disebut Acervuli ; dan Moniliales, yang mempunyai konidiofor kurang lebih terpencar-pencar dalam dasar media. Pada kelompok terakhir konidiofor terkadang berkumpul seperti bantal yang berkelompok disebut Sporodochia atau bersatu kedalam bentuk hifa yang sejajar atau membentuk kolom disebut Corimia. Karakteristik
sporodochium Tuberculariaceae adalah pada bagian tengah/inti disebut Stilbaceae (Gilman, 1945).
Thompson dan Lim (1965) menjelaskan bahwa Deuteromycetes atau fungi imperfek termasuk ke dalam cendawan tingkat tinggi. Cendawan tingkat tinggi biasanya mempunyai hifa berseptat, tetapi tidak selalu terjalin ke dalam bentuk jaringan seperti struktur dan terbagi menjadi empat golongan, yaitu : Sphaeropsidales, Melanconiales, Hyphomycetes (Moniliales) dan golongan khusus (miselium steril).
Menurut Blancard dan Tattar (1981), Deuteromycetes dikelompokkan berdasarkan tahap reproduksi secara seksual (tahap sempurna) yang tidak atau belum diketahui dan mempunyai hifa berseptat. Reproduksi aseksual Deuteromycetes sama seperti reproduksi aseksual dari kelompok Ascomycetes, karena kesamaan dalam tahap konidia ini, maka dapat diduga bahwa Deuteromycetes adalah tahap konidia dari Ascomycetes (kurang lebih tingkat Basidiomycetes), tetapi telah kehilangan fungsi reproduksi seksualnya.
Menurut McKane dan Kandel (1985), beberapa cendawan yang ada, terdapat cendawan yang tidak diketahui siklus reproduksi seksualnya (tahap sempurna), semua cendawan ini dikelompokkan ke dalam Deuteromycetes. Belum diketahuinya reproduksi seksual yang merupakan karakteristik dari cendawan-cendawan Deuteromycetes, maka mereka biasa disebut fungi imperfek. Mereka mempunyai bentuk menyerupai bentuk salah satu organisme dari tiga kelas cendawan yang ada. Sebagian besar dari Deuteromycetes menyerupai Ascomycetes, dengan hifa bersepta dan spora aseksual yang sama. Anggota dari cendawan imperfek ini akan langsung dikelompokkan ke dalam kelompok yang lain jika reproduksi seksualnya diketahui. Contohnya mold yang memproduksi antibiotik berupa penisillin dikelompokkan ke dalam Deuteromycetes tetapi sekarang di kelompokkan ke dalam Ascomycetes. Banyak patogen penting masih digolongkan ke dalam fungi imperfek.
Menurut Pelczar (1986), klasifikasi cendawan terutama didasarkan pada ciri-ciri spora seksual dan tubuh buah yang ada selama tahap-tahap seksual
dalam daur hidupnya. Cendawan yang diketahui tahap seksualnya disebut cendawan perfek/sempurna, sedangkan cendawan yang belum diketahui tahap seksualnya dinamakan cendawan imperfek. Maka untuk klasifikasinya harus menggunakan ciri-ciri lain di luar tahap seksualnya. Ciri-ciri tersebut mencakup morfologi spora aseksual dan miseliumnya. Selama belum diketahui tahap sempurnanya, cendawan akan digolongkan ke dalam suatu kelas khusus, yaitu kelas Deuteromycetes/fungi imperfek, sampai ditemukan tahap seksualnya.
Deuteromycetes meliputi jamur yang tidak mempunyai stadium sempurna (perfect stage). Yang di maksud dengan stadium sempurna adalah stadium seksual, di mana dibentuk alat perkembangan seksual, seperti zigospora, oospora, askospora, basidiospora, dan teliospora. Oleh karenanya Deuteromycetes disebut juga sebagai fungi imperfek, yang berarti jamur yang tidak mempunyai stadium sempurna. Stadium atau bentuk sempurna, atau bentuk seksual, disebut juga sebagai telemorf, sedang bentuk tidak sempurna atau aseksual disebut anamorf. Berdasarkan sifat tubuh buahnya, Deuteromycetes dibagi menjadi tiga kelas, yaitu : Coelomycetes, Hypomycetes, dan Agnomycetes (Semangun, 1996).
Lebih lanjut Semangun (1996) menjelaskan bahwa Hypomycetes ini mempunyai bangsa yang penting, yaitu Hypales (Moniliales). Bangsa ini mempunyai konidium yang terbentuk tersebar, tidak dalam piknidium atau pada aservulus. Hypales mempunyai tiga suku yang penting bagi penyakit tumbuhan, yaitu Moniliaceae, Dematiceae dan Tuberculariaceae. Tuberculariaceae mempunyai hifa dan konidium hialin atau kelam, mempunyai tubuh buah berbentuk sporodokium. Dari suku ini terdapat marga yang sangat besar, yaitu Fusarium
C. F. oxysporum
Fusarium yang menyebabkan penyakit pembuluh dikelompokkan dalam
jenis F. oxysporum. Jenis ini dibagi menjadi forma-forma spesialis (f.sp) yang menyesuaikan diri pada tumbuhan inang tertentu (Semangun, 1996)
Thompson dan Lim (1965) menyatakan bahwa Fusarium masuk ke dalam kelas Deuteromycetes ordo Hypomycetales atau Moniliales, family Tuberculariaceae dengan letak konidia pada sporodochium dan termasuk ke dalam kelompok Phragmosporae, yaitu konidia terdiri satu atau lebih, berseptat, bening atau berwarna, berbentuk sabit atau berbentuk seperti kumparan.
Menurut Ainsworth dan Bisby (1971), patogen F. oxysporum tergolong ke dalam : Kingdom : Fungi Divisi : Eumycota Subdivisi : Deuteromycetes Klas :Hyphomycetes Bangsa : Moniliales Suku : Tuberculariaceae, Marga : Fusarium Jenis : F. oxysporum.
Fusarium sp. penyebab layu pembuluh yang khas. Cendawan ini
merupakan patogen tular tanah dan tular benih. Penyebaran jarak jauh terjadi melalui benih dan bibit transparan yang terinfeksi. Faktor yang mendukung perkembangan penyakit adalah suhu tanah 28oC, kelembaban tanah yang rendah, kandungan N dan P tanah yang rendah dan K yang tinggi serta pH tanah yang rendah (Agrios, 1997).
Menurut Bilgrami dan Dube (1976), F. oxysporum dalam siklus hidupnya mengalami fase patogenesa dan saprogenesa. Pada fase patogenesa, cendawan ini hidup sebagai parasit pada tanaman inang yang masuk melalui luka pada akar, kemudian patogen berkembang dalam jaringan tanaman. Patogen ini mampu menghasilkan enzim, toksin, polisakarida, dan antibiotik pada jaringan tanaman yang diserangnya. Toksin dapat menyebabkn kematian sel dan tanaman menjadi layu. Menurut Doolitle (1961) dalam Rohman (1990), patogen memasuki fase saprogenesa saat tidak ada tanaman inang. Patogen dapat hidup dalam tanah sebagai saprofit pada sisa-sisa tanaman yang kemudian merupakan sumber inokulum untuk
menimbulkan penyakit pada tanaman lainnya. Penyebaran propagul dapat terjadi melalui angin, air tanah, dan tanah yang terinfeksi dan terbawa oleh alat pertanian serta manusia.
Menurut Gilman (1945), Fusarium mempunyai lapisan konidia berbentuk seperti bantal atau terkandang memanjang tanpa batas yang jelas. Konidiofor bercabang, konidia terpusat, sederhana, berbentuk gelondongan/kumparan atau berbentuk sabit, sebagian besar sel dengan dinding yang bersilangan tidak jelas atau kabur. Fusarium termasuk ke dalam kelompok elegan (mewah) dengan ciri-ciri mikrokonidia tidak berbentuk seperti buah pear, klamidospora terpusat dan sebagai sisipan atau tambahan konidia berdinding tipis, berseptat, meruncing atau mengerut di ujung, dengan foot sell sebagai dasar dengan biomassa berwarna putih kecoklatan, merah jambu, merah muda kekuning-kuningan dan terkadang berwarna cukup terang
Menurut Agrios (1997), cendawan ini menghasilkan tiga macam bentuk spora aseksual, yaitu mikrokonidium, makrokonidium, dan klamidospora. Mikrokonidium merupakan bentuk spora yang paling sering dihasilkan dalam semua keadaan. Spora ini bersel tunggal atau dengan satu sekat, hialin dan berbentuk oval hingga elips dengan ukuran 3μm x 6-15μm. Mikrokonidium merupakan satu-satunya bentuk spora yang dihasilkan di dalam pembuluh tanaman inang yang terinfeksi oleh F. oxysporum.
Makrokonidium adalah bentuk spora yang sangat khas yang dihasilkan oleh genus Fusarium, yakni meruncing dan melengkung ke arah kedua ujungnya. Makrokonidium berdiameter ± 4 µm dengan panjang 30µm dan bersekat tiga sampai lima. Spora ini umumnya dijumpai pada permukaan jaringan tanaman yang telah mati oleh serangan Fusarium sp. dan biasanya dibentuk di dalam sprodokium.
Klamidospora berukuran 7-11 µm, dibentuk pada ujung-ujung miselium atau diantara sel-sel makrokonidium yang telah tua. Bentuk spora ini mampu bertahan dalam waktu lama bila keadaan tidak menguntungkan. Miselium cendawan ini bersekat dan membentuk percabangan, pada awalnya
tidak berwarna tetapi selanjutnya berwarna krem atau kuning muda kadang-kadang juga menghasilkan warna merah muda atau ungu.
F. oxysporum merupakan salah satu bagian dari anggota genus Fusarium yang paling labil dan berubah-ubah (Booth, 1971).
D. Media
Smith (1994) menjelaskan bahwa cendawan dapat hidup dimana-mana dan termasuk spesies yang dapat tumbuh dengan variasi lingkungan yang luas dengan menggunakan kumpulan-kumpulan substrat baik secara natural/alami maupun buatan. Beberapa diantaranya adalah jenis yang spesifik, hingga sekarang belum diketahui nutrisi yang diperlukan untuk pertumbuhannya, oleh karena itu mereka tidak dapat tumbuh di media kultur. Secara umum cendawan tumbuh baik di media yang diformulasikan dari bahan-bahan natural/alami yang didapat dari tempat mereka di isolasi.
Lebih lanjut Smith (1994) menjelaskan bahwa syarat-syarat untuk pertumbuhan bagi cendawan dapat bervariasi dari satu jenis ke jenis yang lain, walaupun kultur yang dilakukan dari spesies dan genus ditujukan untuk pertumbuhan terbaik pada media yang sama. Sumber-sumber untuk suatu isolat dapat memberikan petunjuk untuk kondisi pertumbuhan yang sesuai, sehingga pemilihan pada media khusus untuk pertumbuhan biasanya dikembangkan selama beberapa tahun dan hasil dari pengalaman. Pada sebagian besar pekerjaan, standarisasi untuk formula media diperlukan. Media akan mempengaruhi morfologi koloni dan warna, walaupun struktur khusus terbentuk dan mempengaruhi penyimpanan dari isolat.
Menurut Stanier et al. (1976), tujuan utama dalam menyusun media biakan bagi setiap mikroorganisme adalah memberikan suatu campuran dengan syarat zat gizi yang berimbang dan pada konsentrasi yang dapat memungkinkan pertumbuhan yang baik. Medium yang seluruhnya terdiri dari zat gizi yang ditentukan secara kimiawi disebut medium sintetis. Medium yang berisi bahan-bahan zat kimia yang komposisinya tidak diketahui disebut medium kompleks.
Menurut Sarles et al. (1956), jika mikroorganisme dapat tumbuh di atas beberapa bahan atau zat kimia di laboratorium, bahan atau zat kimia tersebut dinamakan media kultur. Dari ribuan media yang berbeda, telah ditemukan dan disusun kedalam suatu susunan kompleksitas yang didapat dari jaringan hidup sampai ke campuran sederhana dari bahan-bahan anorganik.
Secara umum media diperuntukan untuk tiga tujuan utama : 1. Untuk pertumbuhan dan pemeliharaan kultur bakteri.
2. Untuk mempelajari reaksi mikroorganisme terhadap zat-zat yang ada pada medium dan,
3. Dengan penggunaan mikroorganisme dapat membantu beberapa produk khusus atau kombinasi dari beberapa produk.
Lebih lanjut Sarles et al. (1956), membagi media menjadi dua macam, yaitu :
1. Media alami, yaitu bahan-bahan alami yang dapat digunakan sebagai media kultur, karena pada kenyataannya mikroorganisme parasit akan tumbuh hanya pada jaringan hidup dan hasil sekresi atau estrak dari jaringan hidup. Potongan kentang atauu wortel dapat digunakan sebagai media kultur, dengan cara kentang atau wortel tersebut direbus hingga lunak dan air rebusan tersebut disterillisasi. Dalam penggunaannya, media tersebut terlebih dahulu dituang dari botol ke tempat yang akan digunakan untuk menginokulasi jaringan tanaman yang telah disterillisasikan.
2. Media buatan, yaitu media yang dibuat dari berbagai macam bahan atau zat, jika komposisi dari bahan-bahan tersebut diketahui, maka medium ini dinamakan medium sintetis. Tetapi jika komposisi dari bahan-bahan tersebut belum diketahui, maka medium ini dinamakan medium nonsintesis. Medium ini dapat digolongkan menjadi medium cair, medium semi padat dan medium padat.
Menurut Dhingra dan Sinclair (2000), walaupun pertumbuhan vegetatif atau sporulasi akan dominan, hal itu tergantung pada medium kultur dan konsentrasi dari medium yang dipilih. Lebih lanjut mereka membagi medium kultur menjadi dua, yaitu :
1. Media alami, untuk pertumbuhan dan sporulasi penggunaan media alami lebih baik daripada media sintesis. Hal ini lebih baik, karena penggunaan medium dengan unsur karbon dan atau nitrogen yang dikurangi dapat menghasilkan sporulasi dan menekankan pertumbuhan vegetatif.
2. Media sintesis, media ini dapat lebih mahal daripada media alami dan dalam penyiapannya membutuhkan waktu yang lebih daripada media alami. Pemilihan media ini tergantung pada tujuan dan keperluan dilakukannya percobaan. Secara garis besar tidak ada peraturan umum yang merekomendasikan untuk menggunakan media media sintesis tertentu yang sesuai untuk sporulasi semua fungi.
Menurut Cooke (1979), untuk mendapatkan pertumbuhan cendawan yang baik di laboratorium penggunaan media alami lebih baik dari media sintetis (media buatan).
Dharmaputra (1989) menjelaskan bahwa dilihat dari susunannya, medium dapat dibagi menjadi tiga golongan yaitu, medium alam, medium semi sintetis, medium sintetis. Medium alam mempunyai komposisi nutrisi yang diketahui dengan pasti tiap waktu karena dapat berubah-ubah dalam bahan bahan yang digunakan dan bergantung pada bahan asalnya sebagai contoh, kentang, jagung, serangga, rambut dan sebagainya. Medium semi sintetis terdiri atas bahan hasil pertanian dan juga bahan kimia yang komposisinya telah diketahui dengan pasti. Contoh medium semi sintetis adalah Agar Dextrose Kentang (ADK). Dalam medium sintetis, medium alam dan medium semi sintetis dapat diulang secara tepat.
Lebih lanjut Dhramaputra (1989) menjelaskan bahwa untuk mengisolasi cendawan dapat digunakan empat jenis medium, yaitu :
1. Medium umum, adalah medium yang mengandung kebutuhan pokok penunjang pertumbuhan sebagian besar mikroorganisme.
2. Medium elektif, adalah medium yang mengandung nutrisi dalam jumlah minimum yang dapat menunjang pertumbuhan mikroorganisme tertentu.
3. Medium selektif, adalah medium yang dimodifikasi dengan pengaturan pH medium atau dengan menambah zat penghambat, sehingga pertumbuhan mikroorganisme yang tidak dikehendaki dapat dihambat. 4. Medium diferensial, adalah medium yang digunakan untuk mengisolasi
dan mengidentifikasi cendawan tertentu.
McKane dan Kandel (1985) menjelaskan bahwa media yang biasa dipakai untuk mengisolasi cendawan adalah Sabourad’s agar, karena dalam media tersebut situasi dan kondisi yang selektif telah disatukan. Dalam penggunaannya dapat ditambahkan antibakteri atau antibiotik untuk mencegah pertumbuhan dari bakteri kontaminan yang dapat tumbuh pada media. Pemilihan media yang akan dipergunakan tergantung dari cendawan yang akan diamati.
Menurut Hawksworth (1974), banyak cendawan yang mempunyai kebutuhan khusus untuk pertumbuhan yang optimal dalam kultur buatan. Sebagian besar penyediaan kondisi untuk pertumbuhan cendawan yang optimal tersebut dapat dilakukan dengan beberapa perlakuan, diantaranya adalah mengatur suhu, cahaya, pH, media dan lain-lain.
E. Derajat Kemasaman (pH)
Cendawan F. oxysporum penyebab layu pada tanaman tomat tumbuh dengan baik pada medium dengan kisaran pH 3.6 - pH 8.4 (Walker, 1957). Selanjutnya Scoot (1926) dalam Walker (1957) melaporkan bahwa pertumbuhan patogen tersebut mencapai maksimum pada dua kisaran pH medium, yaitu antara pH 4.5 – 5.3 dan antara pH 5.58 – 6.85. Selanjutnya Walker (1957) menjelaskan bahwa untuk perkembangan spora mempunyai dua puncak maksimum, yaitu pH medium sekitar pH 4.5 - 7.0.
Menurut McKane dan Kandel (1985), sebagian besar dari cendawan dapat tumbuh baik pada pH rendah antara pH 5.0 - 6.0 dan dapat bertoleransi secara ekstrim terhadap konsentrasi gula yang tinggi, terkadang lebih besar dari 50% Sukrosa.
Booth (1971) menjelaskan bahwa para mikologis atau ahli penyakit tanaman dapat menggunakan berbagai medium yang mereka inginkan untuk
mengetahui respon dari isolat Fusarium yang berbeda pada kondisi tertentu. Dalam pembiakkan Fusarium pH medium yang digunakan adalah pH 6.5 - 7.0.
Menurut Sarles et al. (1956), reaksi dari medium diperlihatkan pada konsentrasi ion hidrogen (biasanya disebut pH). Konsentrasi ion hidrogen digunakan untuk mengetahui pengaruhnya pada kecepatan dan tingkat pertumbuhan dari mikroorganisme. Semua mikroorganisme mempunyai pH optimum, dimana mereka dapat tumbuh baik, pH minimum dimana sebagian besar reksinya asam, di mana meraka akan tumbuh, dan pH maksimum di mana sebagian besar reaksinya alkali atau basa yang memungkinkan mereka tumbuh.
Smith (1994) menjelaskan bahwa filamen-filamen cendawan dapat berubah-ubah pada berbagai pH. Pada umumnya sebagian besar fungi tumbuh baik antara pH 3.0 sampai pH 7.0. Walaupun ada yang dapat tumbuh pada pH 2.0 dan kurang dari pH 2.0.
F. Karbohidrat
Karbohidrat digolongkan kedalam monosakarida, disakarida, oligosakarida dan polisakarida. Hal ini tergantung pada nomor dari satuan monosakarida yang menjalin membentuk molekul. Monosakarida adalah karbohidrat yang tidak dapat terhidrolisis menjadi satuan karbohidrat sederhana, monosakarida adalah unit dasar karbohidrat dari metabolisme seluler.
Disakarida adalah gabungan dari monosakarida baik yang sama atau berbeda ketika terhidrolisis. Disakarida sering digunakan oleh tumbuhan atau hewan untuk melakukan transport monosakarida dari satu sel ke sel yang lain. Oligosakarida mempunyai 2 sampai 6 monosakarida yang terjalin. Oligo berasal dari kata Yunani, oligos yang berarti kecil atau sedikit. Oligosakarida bebas jarang di temukan di alam. Polisakarida adalah makromolekuler yang pokok yang dapat terhidrolisis menjadi satuan-satuan monosakarida yang banyak. Polisakarida sangat penting sebagai pendukung struktural (terutama
pad tanaman) dan sebagai tempat penyimpanan monosakarida (dimana sel menggunakannya sebagai energi)
Glukosa merupakan bagian terpenting dari monosakarida. Glukosa adalah aldohexosa dan di temukan pada keadaan bebas di jaringan tanaman atau hewan. Glukosa merupakan komponen dari disakarida sukrosa, maltosa dan latosa.
Disakarida merupakan karbohidrat yang disusun dari dua unit monosakarida yang dihubungkan oleh hubungan glycosidic. Dua disakarida terpenting yang ditemukan pada keadaan bebas di alam adalah sukrosa dan latosa. Sukrosa umum dikenal dengan sebutan gula meja yang terdapat di seluruh dunia tumbuhan (Hein dan Best, 1984).
Menurut Moore (1972), Monosakarida adalah gula sederhana yang mempunyai lima atom karbon (pentosa) atau enam atom karbon (hexosa).
Masing-masing atom gula adalah kelompok aldehida (-CHO) dan keton (-CO). Kelompok ini merupakan hasil reduksi dari turunan alkohol pada gula
atau hasil oksidasi dari turunan asam pada gula. Konfigurasi molekul-molekul gula dapat berbeda, yang terdiri dari rangkaian bentuk D dan L yang membedakan rangkaian ini adalah letak kelompok hidroksil dan kelompok aldehid. Menurut Winarno (1995) Meskipun ada bentuk D dan L, tetapi monosakarida-monosakarida yang terdapat di alam pada umumnya berbentuk D, dan jarang sekali dalam bentuk L.
Lebih lanjut Moore (1972), menjelaskan bahwa gula yang mendukung pertumbuhan hampir semua fungi adalah D-Glukosa, adalah hexosa yang terjadi secara alami. Sedangkan disakarida adalah sumber karbon yang penting di alam selain polisakarida. Disakarida merupakan hasil dari pemisahan polisakarida. Dalam penggunaannya fungi harus memproduksi enzim pencernaan ektrasellular, yang akan membelah rantai glikosida diantar monomer. Setelah gula atau turunannya lepas oleh sistem pencernaan, biasanya fungi dapat menyerap dan menggunakan gula sederhana dengan cara yang sama menggunakan gula bebas.
HC = O HC = O
⏐ ⏐
HC ⎯ OH HO ⎯ C ⎯ H ⏐ ⏐ HO ⎯ C ⎯ H H ⎯ C ⎯ OH ⏐ ⏐H ⎯ C ⎯ OH HO ⎯
C ⎯ H
⏐ ⏐
H ⎯ C
⎯ OH
HO ⎯ C ⎯ H
⏐ ⏐
CH
2⎯ OH
CH
2⎯ OH
D - Glukosa L – Glukosa
H
2C ⎯ OH H
2C ⎯ OH
⏐ ⏐
C = O O = C⏐ ⏐
HO ⎯ C ⎯ H H ⎯ C ⎯ OH⏐ ⏐
H ⎯ C ⎯ OH HO ⎯ C ⎯ H
⏐ ⏐
H ⎯ C ⎯ OH HO ⎯ C ⎯ H⏐ ⏐
CH
2⎯ OH
CH
2⎯ OH
D – Fruktosa L – Fruktosa
III. BAHAN DAN METODE
A. Lokasi dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Bioteknologi Kehutanan dan Laboratorium Rekayasa Bioproses Pusat Antar Universitas (PAU) Bioteknologi Institut Pertanian Bogor. Penelitian ini dilaksanakan salama tiga bulan, dari bulan Februari sampai April 2004.
B. Bahan dan Alat 1. Bahan
Bahan yang digunakan dalam penelitian ini adalah media kultur murni
F. oxysporum yang didapat dari Laboratorium Bioteknologi Kehutanan
Institut Pertanian Bogor, media Potato Dextrose Agar (PDA), Potato
Sucrose Agar (PSA), Potato Dextrose Liquid (PDL) dan Potato Sucrose Liquid (PSL), alkohol 70%, Natrium hipoklorit, aquadest, NaOH, HCL
dan spirtus. 2. Alat
Alat-alat yang dipergunakan dalam penelitian ini, yaitu : erlenmeyer 250 ml, cawan petri, bunsen, alumunium foil, Becker glass 1ℓ, pH meter, pipet, autoklaf, timbangan analitik, hot plate, laminar Air flow, shaker, oven, kapas, jarum ose, bor gabus, sprayer, tissue, plastik wrap, kertas label, penggaris dan alat tulis.
C. Metode Penelitian
1. Pembuatan Media Potato Dextrose Agar (PDA) dan Potato Sucrose
Agar (PSA).
Komposisi bahan untuk membuat 1 ℓ media Potato Dextrose Agar (PDA) dan Potato Sucrose Agar (PSA) dapat dilihat pada Tabel Lampiran 1. Cara pembuatannya kentang yang telah diiris menjadi sebesar potongan dadu direbus dengan 800 ml aquades sampai kentang lunak. Air rebusan tersebut disaring dan ditambahkan gula dextrose (untuk membuat PDA)
dan sukrosa (untuk membuat PSA) dan aquades sampai 1 ℓ, lalu dipanaskan hingga mendidih. Setelah itu dituang ke dalam erlenmeyer sebanyak 143 ml hingga dingin, kemudian diberikan perlakuan pH dengan menambahkan NaOH dan HCL sampai didapat pH media yang diinginkan, yaitu : pH 2, 3, 4, 5, 6, 7 dan 8 dan ditambahkan agar-agar. Media kemudian disterilisasi menggunakan autoklaf pada suhu 121oC, tekanan 1 atm selama 15 menit.
2. Media Potato Dextrose Liquid (PDL) dan Potato Sucrose Liquid (PSL). Komposisi bahan untuk membuat 1 ℓ media Potato Dextrose Liquid (PDL) dan Potato Sucrose Liquid (PSL) dapat dilihat pada Tabel Lampiran1. Cara pembuatannya kentang yang telah diiris menjadi sebesar potongan dadu direbus dengan 800 ml aquades hingga kentang lunak. Air rebusan tersebut disaring dan ditambahkan gula dextrose (untuk membuat PDL) dan sukrosa (untuk membuat PSL) dan aquades sampai 1ℓ, lalu dipanaskan hingga mendidih. Setelah itu dituang ke dalam erlenmeyer sebanyak 100 ml hingga dingin, kemudian diberikan perlakuan pH dengan menambahkan NaOH dan HCL sampai didapat pH media yang diinginkan, yaitu : pH 2, 3, 4, 5, 6, 7 dan 8. Media kemudian disterilisasi menggunakan autoklaf pada suhu 121oC, tekanan 1 atm selama 15 menit.
3. Sterilisasi
Sterilisasi bahan dilakukan pada waktu pembuatan media dengan menggunakan autoklaf selama 15 menit pada suhu 121oC dan tekanan 1 atm.
Alat-alat yang akan dipergunakan terlebih dulu disterilisasi. Sterilisasi alat ini dilakukan seperti, pada cawan petri, erlenmeyer, bor gabus, jarum ose dan kapas. Cawan petri dan Erlenmeyer yang akan dipergunakan disterilisasi dengan autoklaf selama 20 menit pada suhu 121oC, tekanan 1 atm. Sedangkan bor gabus dan jarum ose disterilisasi pada saat akan, selama dan setelah pemakaian, dengan cara dipanaskan dengan menggunakn api bunsen hingga membara. Untuk kapas
disterilisasi dengan cara disimpan dalam oven pada suhu 47oC selama 24 jam. Sterilisasi alat ini dilakukan untuk mencegah agar tidak ada mikroorganisme yang menempel pada alat-alat tersebut, sehingga dalam melakukan kegiatan inokulasi tidak terjadi kontaminasi.
Kebersihan lingkungan kerja dapat dijaga dengan membatasi orang-orang yang memasuki ruangan serta membersihkan ruangan dengan desifektan. Sebelum, selama dan setelah digunakan permukaan tempat kerja (laminar air flow) dibersihkan dengan Alkohol 70% menggunakan sprayer dan dibersihkan dengan menggunakan tissue. Blower atau peniup udara pada Laminar Air Flow dinyalakan sebelum dan selama pemakaian untuk menghindari kontaminan yang air borne. Selain itu sebelum pemakaian laminar air flow dapat disterilisasi dengan menggunakan lampu UV yang dinyalakan selama beberapa menit.
4. Peremajaan cendawan F. oxysporum
Peremajaan cendawan dilakukan agar kondisi cendawan yang akan dipergunakan dalam keadaan baik. Peremajaan ini dilakukan dengan menggunakan media PDA. Isolat cendawan yang akan diremajakan diambil dengan menggunakan bor gabus dan dipindahkan ke dalam cawan petri yang berisi media, proses ini dilakukan di dalam laminar air flow.
Tujuan dari peremajaan cendawan adalah untuk membuat stok isolat
F. oxysporum, agar jika dalam penelitian ini terjadi kontaminasi, maka
untuk penanggulangannya dibuat isolat yang baru yang inokulumnya diambil dari stok ini. Pembuatan stok ini menggunakan media PDA yang ditaruh di tabung reaksi dan diletakkan miring sehingga menjadi agar miring yang akan dipergunakan untuk pembuatan stok cendawan. Agar miring yang telah diinokulasi disimpan dalam lemari pendingin agar dapat bertahan lama.
5. Inokulasi
Inokulasi ini dilakukan dengan cara pada media padat (PDA dan PSA) yang dituang ke dalam cawan petri berukuran 9 cm, dan kemudian didinginkan, ditanam satu potongan inokulum F. oxysporum berdiameter 1 cm (yang diambil dengan bor gabus berdiameter 1 cm) pada bagian tengah media. Cawan ditutup dan disegel menggunakan plastik wrap. Biakan kemudian diinkubasi sampai cendawan memenuhi cawan petri. Setiap perlakuan dilakukan dengan 3 ulangan, dan tiap ulangan terdiri atas satu biakan dalam cawan petri.
b. Inokulasi pada media cair (PDL dan PSL).
Inokulasi ini dilakukan dengan cara satu potongan inokulum F.
oxysporum berdiameter 1 cm (yang diambil dengan bor gabus
berdiameter 1 cm) diinokulasikan pada erlenmeyer yang telah diberi media (PDL dan PSL), lalu ditutup dengan kapas dan alumunium foil yang steril. Isolat kemudian diinkubasi dengan penggoyangan menggunakan shaker 80 rpm dan tanpa penggoyangan selama empat hari. Setiap perlakuan dilakukan dengan 3 ulangan. Setiap perlakuan dilakukan dengan 3 ulangan, dan tiap ulangan terdiri atas satu biakan dalam erlenmeyer.
6. Pengamatan
Peubah yang diamati pada biakkan cendawan dalam media padat adalah diameter koloni F. oxysporum, kondisi cendawan secara makroskopis, karakter mikroskopis. Pengamatan waktu cendawan untuk memenuhi cawan petri dilakukan dengan mengamati pertumbuhan miselia per hari sampai miselia memenuhi cawan petri. Pengamatan kondisi makroskopis cendawan dilakukan dengan mengamati tipis tebalnya miselium dan warna miselium. Pengamatan mikroskopis cendawan dilakukan dengan cara miselium yang akan diamati diambil dengan menggunakan jarum ose dan diletakkan pada gelas objek yang telah diberi air, kemudian diamati di bawah mikroskop dan difoto.
Peubah yang diamati pada biakkan cendawan dalam media cair adalah bobot kering miselium F. oxysporum hasil inkubasi selama empat hari, yang telah disaring dan dikeringkan, kemudian ditimbang.
7. Analisis Data
Analisis statistik dalam penelitian ini bertujuan untuk mengetahui pengaruh macam, pH, dan penggoyangan media terhadap pertumbuhan cendawan F. oxysporum.
Rancangan percobaan yang digunakan dalam penelitian ini adalah Rancangan Faktorial dalam Rancangan Acak Lengkap (RAL) untuk analisis diameter koloni F. oxysporum, yang terdiri dari dua faktor, yaitu faktor A (media) dan faktor B (pH). Pengolahan data menggunakan
software SAS system. Satuan percobaannya adalah biakan F. oxysporum
dalam satu cawan petri.
Model umum yang digunakan :
Yijk : μ + αi +βj + (αβ)ij + εijk, dimana : Yijk : nilai pengamatan pada satuan percobaan ke-k yang memperoleh
perlakuan faktor A taraf ke-i, faktor B taraf ke-j μ : nilai rata-rata umum
αi : pengaruh aditif faktor A taraf ke-i βj : pengaruh aditif faktor B taraf ke-j
(αβ)ij : pengaruh interaksi faktor A taraf ke-i dan faktor B taraf ke-j
εijk : pengaruh galat dari satuan percobaan ke-k yang memperoleh kombinasi perlakuan ij.
Hipetesis-hipotesis : Pengaruh faktor A :
Ho : αi = 0 (faktor A tidak berpengaruh) H1 : minimal ada satu αi ≠ 0.
Pengaruh faktor B :
Ho : βj = 0 (faktor B tidak berpengaruh) H1 : minimal ada satu βj ≠ 0.
Pengaruh interaksi faktor A dengan faktor B :
Ho : (αβ)ij = 0 (interaksi faktor A dengan faktor B tidak berpengaruh) H1 : minimal ada satu (αβ)ij ≠ 0.
Rancangan percobaan yang digunakan untuk analisis pertumbuhan biomassa (bobot kering) F. oxysporum adalah Rancangan Faktorial dalam Rancangan Acak Lengkap (RAL), yang terdiri tiga faktor, yaitu faktor A (media), faktor B (pH), faktor C (penggoyangan). Pengolahan data menggunakan software SAS system. Satuan percobaannya adalah biakan F.
oxysporum dalam satu erlenmeyer.
Model umum yang digunakan :
Yijkl : μ + Ai + Bj + Ck + ABij + ACik + BCjk + ABCijk + εijkl, dimana Yijkl : nilai pengamatan pada satuan percobaan ke-l yang memperoleh
perlakuan faktor A taraf ke-i, faktor B taraf ke-j dan faktor C taraf ke-k
μ : nilai rata-rata umum
Ai : pengaruh aditif faktor A pada taraf ke-i Bj : pengaruh aditif faktor B pada taraf ke-j Ck : pengaruh aditif faktor C pada taraf ke-k
(AB)ij : pengaruh interaksi faktor A taraf i dengan faktor B taraf ke-j
(AC)ik : pengaruh interaksi faktor A taraf ke-i dengan faktor C taraf ke-k
(BC)jk : pengaruh interaksi faktor B taraf j dengan faktor C taraf ke-k
(ABC)ijk : pengaruh interaksi faktor A taraf ke-i dengan faktor B taraf ke-j dan faktor C taraf ke-k
εijkl : pengaruh galat dari kombinasi perlakuan faktor A taraf ke-i, faktor B taraf ke-j dan faktor C taraf ke-k dan ulangan ke-l.
Hipotesis-hipotesis : Pengaruh faktor A :
Ho : Ai = 0 (faktor A tidak berpengaruh) H1 : minimal ada satu Ai ≠ 0.
Pengaruh faktor B :
Ho : Bj = 0 (faktor B tidak berpengaruh) H1 : minimal ada satu Bj ≠ 0.
Pengaruh faktor C :
Ho : Ck = 0 (faktor C tidak berpengaruh) H1 : minimal ada satu Ck ≠ 0.
Pengaruh interaksi faktor A dengan faktor B :
Ho : (AB)ij = 0 (interaksi faktor A dengan faktor B tidak berpengaruh)
H1 : minimal ada satu (AB)ij ≠ 0.
Pengaruh interaksi faktor A dengan faktor C :
Ho : (AC)ik = 0 (interaksi faktor A dengan faktor C tidak berpengaruh)
H1 : minimal ada satu (AC)ik ≠ 0.
Pengaruh interaksi faktor B dengan faktor C :
Ho : (BC)jk = 0 (interaksi faktor B dengan faktor C tidak berpengaruh) H1 : minimal ada satu (BC)jk ≠ 0.
Pengaruh interaksi faktor A dengan faktor B dan faktor C :
Ho : (ABC)ijk = 0 (interaksi faktor A dengan faktor B dan faktor C tidak berpengaruh)
H1 : minimal ada satu (ABC)ijk ≠ 0.
Uji lanjutan :
Untuk mengetahui respon yang diberikan dari masing-masing perlakuan dilakukan uji lanjutan yang digunakan adalah uji jarak berganda Duncan, untuk sumber keragaman yang berpengaruh nyata.
IV. HASIL DAN PEMBAHASAN
A. Hasil
1. Diameter Koloni F. oxysporum
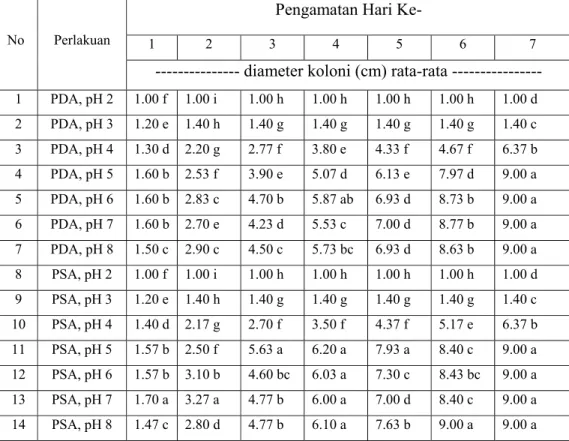
Hasil analisis ragam diameter pada umur tujuh hari menunjukkan bahwa macam media dan interaksinya dengan pH tidak memberikan pengaruh terhadap diameter F. oxysporum, tetapi derajat kemasaman (pH) memberikan pengaruh yang nyata terhadap diameter (Tabel Lampiran 9). Berdasarkan uji lanjut Duncan diketahui bahwa media dan interaksinya dengan pH memberikan pengaruh yang tidak berbeda terhadap diameter koloni F. oxysporum, sebaliknya pH memberikan pengaruh yang berbeda pada pH media 2 – 4, kecuali pada pH media 5 – 8 (Tabel Lampiran 10).
Untuk mengetahui hasil uji lanjut Duncan pada diameter koloni F.
oxysporum per hari dapat dilihat pada Gambar Lampiran 14 sampai
dengan 20.
Hasil pengamatan pada pH media 2 diameter koloni F. oxysporum tidak bertambah, tetapi F. oxysporum tetap tumbuh, hal ini ditandai dengan adanya bintik-bintik berwarna pink dan berkelompok (Gambar 3). Pertumbuhan miselia pada pH medium 3 hanya menghasilkan diameter koloni F. oxysporum 1.4 cm (Gambar 4). Pertumbuhan miselia F.
oxysporum pada pH media 4, hingga hari ketujuh tidak dapat memenuhi
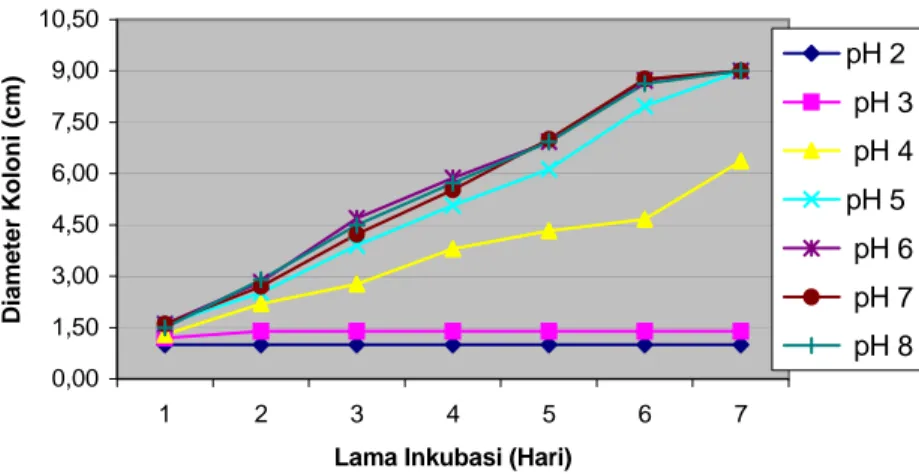
cawan petri, hanya mencapai diameter koloni 6.37 cm. (Gambar 5). Sedangkan pada pH media 5 sampai 8, miselia F. oxysporum dapat memenuhi cawan petri yang berdiameter 9.00 cm (Gambar 6 dan 7).
Pengamatan pada hari pertama pada medium PDA diperoleh bahwa koloni F. oxysporum pada pH medium 5 – 7 mempunyai diameter yang sama yaitu 1.60 cm. Pertumbuhan miselia pada hari ke dua tumbuh cepat pada pH medium 8, dengan diameter koloni 2.90 cm. Hari ke tiga dan ke
empat miselia F. oxysporum tumbuh cepat pada pH medium 6, dengan diameter isolat 4.70 cm dan 5.87 cm.
Pertumbuhan miselia tertinggi pada hari ke lima pada pH medium 7, dengan diameter koloni 7.00 cm. Hari ke enam pertumbuhan miselia pada pH 6 - 8 tidak berbeda jauh, dengan diameter koloni berturut-turut 8.73 cm, 8.77 cm dan 8.63 cm. Pertumbuhan miselia pada hari ke tujuh pada pH medium 5 – 8 telah memenuhi cawan petri, dengan diameter koloni 9 cm (Gambar 8).
Pertumbuhan miselia pada medium PSA pada hari pertama dan ke dua diperoleh bahwa miselia F. oxysporum tumbuh cepat pada pH medium 7, dengan diameter koloni 1.70 cm dan 3.27 cm. Pertumbuhan miselia pada hari ke tiga tertinggi pada pH medium 5, dengan diameter koloni 5.63 cm. Hari ke empat, pertumbuhan miselia dari pH medium 5 sampai pH medium 8 tidak berbeda jauh dengan diameter koloni berturut-turut 6.20 cm, 6.03 cm, 6.00 cm dan 6.10 cm. Hari ke lima pertumbuhan miselia tertinggi pada pH medium 5, dengan diameter koloni 7.93 cm. Pertumbuhan miselia pada pH medium 8 pada hari ke enam telah memenuhi cawan petri, dengan diameter koloni 9.00 cm. Hari ke tujuh selain pH medium 8, diameter koloni F. oxysporum pada pH medium 5 – 7 telah mencapai 9.00 cm (Gambar 9)
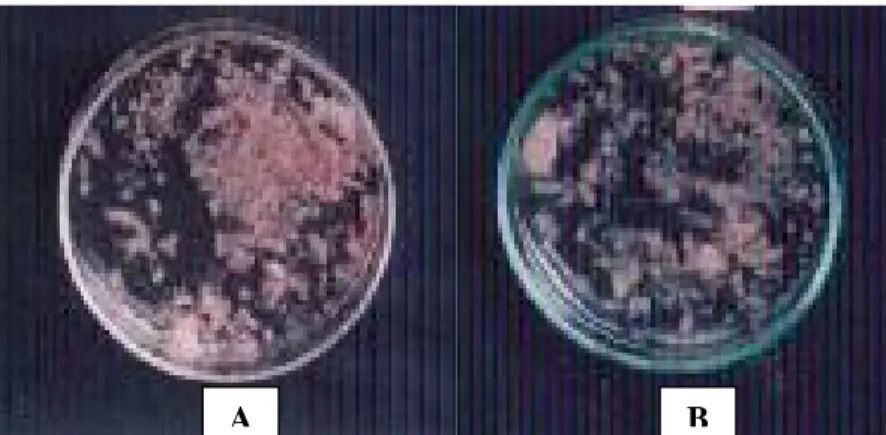
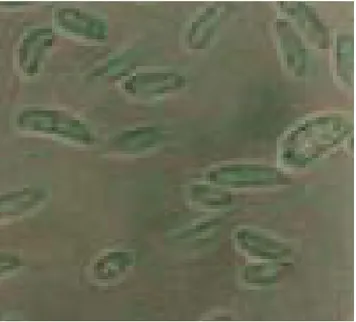
Gambar 3. Pertumbuhan Isolat F. oxysporum setelah Diinkubasi Selama 7 Hari pada Media PSA pH 2 (A) dan PDA pH 2 (B)
Gambar 4. Pertumbuhan Isolat F. oxysporum setelah Diinkubasi Selama 7 Hari pada Media PSA pH 3 (A) dan PDA pH 3 (B)
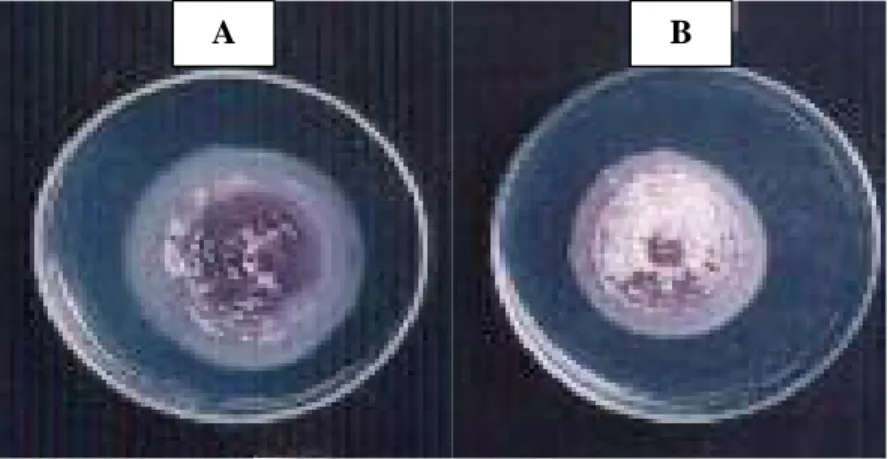
Gambar 5. Pertumbuhan Isolat F. oxysporum setelah Diinkubasi Selama 7 Hari pada Media PDA pH 4 (A) dan PSA pH 4 (B)
A B
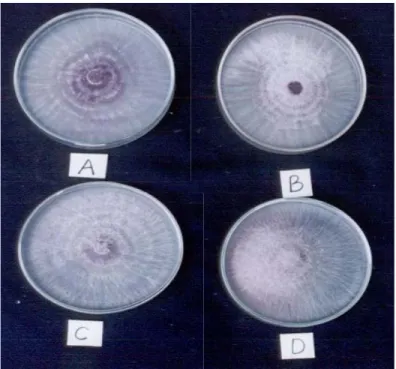
Gambar 6. Pertumbuhan Isolat F. oxysporum setelah Diinkubasi Selama 7 Hari pada Media PDA pH 5 (A), PSA pH 5 (B) PDA pH 6 (C) dan PSA pH 6 (D)
Gambar 7. Pertumbuhan Isolat F. oxysporum setelah Diinkubasi Selama 7 Hari pada Media PDA pH 7 (E), PSA pH 7 (F) PDA pH 8 (G) dan PSA pH 8 (H)
0,00 1,50 3,00 4,50 6,00 7,50 9,00 10,50 1 2 3 4 5 6 7
Lama Inkubasi (Hari)
Diameter Koloni (cm) pH 2 pH 3 pH 4 pH 5 pH 6 pH 7 pH 8
Gambar 8. Pertumbuhan F. oxysporum pada Media PDA dengan Berbagai Tingkat pH 0,00 1,50 3,00 4,50 6,00 7,50 9,00 10,50 1 2 3 4 5 6 7
Lama Inkubasi (Hari)
Diam eter Koloni (cm ) pH 2 pH 3 pH 4 pH 5 pH 6 pH 7 pH 8
Gambar 9. Pertumbuhan F. oxysporum pada Media PSA dengan Berbagai Tingkat pH
2. Pertumbuhan Biomassa F. oxysporum
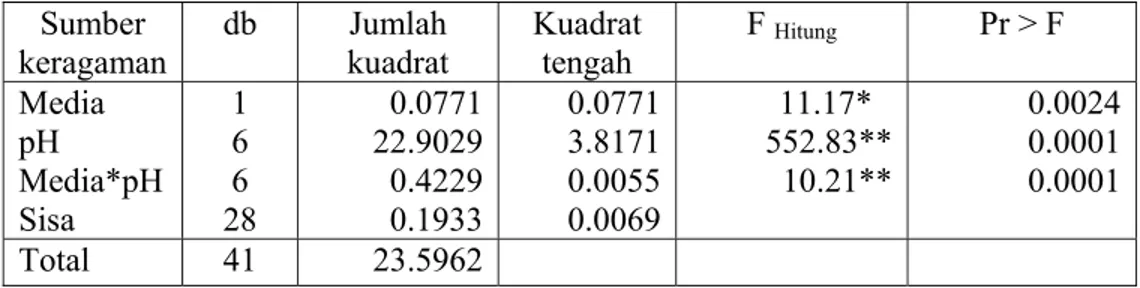
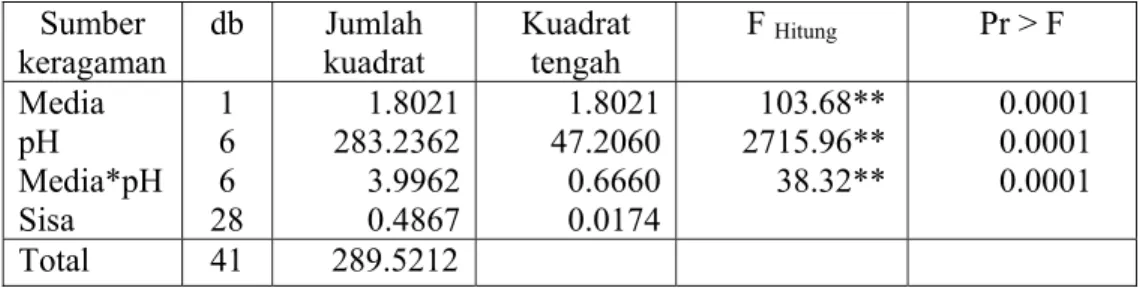
Hasil analisis ragam menunjukkan bahwa pH dan penggoyangan media serta interaksi ke dua faktor berpengaruh sangat nyata terhadap
bobot kering miselia, sedangkan macam media dan interaksinya dengan ke dua faktor yang lain tidak berpengaruh (Tabel Lampiran 11). Berdasarkan hasil uji lanjut Duncan yang dilakukan pada bobot
kering miselia pada kombinasi perlakuan pH dan penggoyangan media pada medium PDL diperoleh bahwa pada pH 4 memberikan respon yang paling tinggi dan berbeda nyata dengan pH - pH yang lain (Gambar Lampiran 21 dan 22). Hal yang sama juga terjadi pada medium PSL (Gambar Lampiran 23 dan 24).
Hasil inkubasi cendawan F. oxysporum pada media yang diberikan perlakuan penggoyangan menunjukkan bahwa pada medium PSL pH 4 dihasilkan bobot kering miselia tertinggi dengan bobot 0.3599 g. Bobot kering miselia tertinggi setelah medium PSL pH 4 adalah: medium PSL pH 3 dan medium PDL pH 4, dengan bobot berturut-turut, 0.3515 g dan 0.3411 g (Gambar 11). Hasil inkubasi cendawan F. oxysporum pada media tanpa perlakuan penggoyangan menunjukkan bahwa pada medium PSL pH 4 dihasilkan bobot kering miselia terbesar, yaitu 0.2269 g, dan pada medium PDL pH 4 yang dihasilkan miselia dengan bobot 0.2187 g (Gambar 12).
Gambar 10. Pertumbuhan F. oxysporum yang Dibiakkan pada Media Cair. (G) PDL pH 6 (H) PSL pH 6
0 0,15 0,3 0,45 PDL, pH 2 PDL, pH 3 PDL, pH 4 PDL, pH 5 PDL, pH 6 PDL, pH 7 PDL, pH 8 PSL, pH 2 PSL, pH 3 PSL, pH 4 PSL, pH 5 PSL, pH 6 PSL, pH 7 PSL, pH 8 Inkubasi 4 Hari
Bobot Kering Miselium (g)
Gambar 11. Bobot Kering Miselium F. oxysporum dengan Perlakuan Penggoyangan setelah Diinkubasi Empat Hari
0 0,1 0,2 0,3 PDL, pH 2 PDL, pH 3 PDL, pH 4 PDL, pH 5 PDL, pH 6 PDL, pH 7 PDL, pH 8 PSL, pH 2 PSL, pH 3 PSL, pH 4 PSL, pH 5 PSL, pH 6 PSL, pH 7 PSL, pH 8 Inkubasi 4 Hari
Bobot Kering Miselium (g)
Gambar 12. Bobot Kering Miselium F. oxysporum dengan Tanpa Penggoyangan setelah Diinkubasi Empat Hari
3. Pengamatan Mikroskopis
Hasil pengamatan mikroskopis diperoleh bahwa pada
F. oxysporum terdapat tiga jenis spora, yaitu mikrokonidia, makrokonidia
dan klamidospora.
Gambar 13. Klamidospora F. oxysporum pada Media PSA dengan pH 4 ( tanda anak panah a)
Gambar 14. Percabangan konidiofor F. oxysporum pada media PDA dengan pH 6 (tanda anak panah b)
Gambar 15. Makrokonidia F. oxysporum pada Media PDA dengan pH 2
Gambar 16. Mikrokonidia F. oxysporum pada Media PSA dengan pH 8
B. Pembahasan
1. Pengaruh Derajat Kemasaman (pH) Medium terhadap Pertumbuhan
F. oxysporum
Stakman dan Harrar (1957) menjelaskan bahwa banyak faktor yang mempengaruhi pertumbuhan, diantaranya adalah: oksigen, karbondioksida dan pH. Mengetahui pengaruh dari faktor yang berbeda dalam kecepatan pertumbuhan patogen sangatlah penting, karena dalam perkembangan penyakit mengetahui tentang kecepatan pertumbuhan suatu patogen harus pasti.
Hasil percobaan ini menunjukkan bahwa F. oxysporum tumbuh baik pada media dengan kisaran pH 5 - 8. Menurut Walker (1957), cendawan F. oxysporum penyebab layu pada tanaman tomat tumbuh baik pada medium dengan kisaran pH 3.6 - 8.4. Booth (1971) menjelaskan bahwa pH yang digunakan dalam pembiakkan F. oxysporum adalah 6.5-7.0. Menurut Griffin (1981), tidak banyak data yang dapat disampaikan tentang reaksi dari pH pada pertumbuhan cendawan, dan sebagian besar informasi yang didapat dari sejumlah penelitian tidak mencukupi. Kesulitan dalam penyusunan informasi ini adalah suatu fakta bahwa cendawan sering berubah pada pH dari medium kultur secara drastis selama pertumbuhan.
Carlile et al. (2001) dalam Hidayat (2005) menyatakan bahwa konsentrasi ion hidrogen pada medium dapat mempengaruhi pertumbuhan secara tidak langsung, yaitu melalui efek terhadap tersedianya nutrisi atau secara langsung melalui aktivitas pada permukaan sel. Selain itu pH mempunyai efek terhadap proses metabolik, sehingga jamur mampu menggunakan zat tertentu untuk mendapatkan kebutuhan nutrisinya.
Lebih lanjut Chang dan Miles (1997) dalam Hidayat (2005) menjelaskan bahwa pengaruh pH adalah pada aktivitas enzim. Pemecahan molekul kedalam ion-ion pada membran permeabel dipengaruhi juga oleh pH. Sebagai contoh ada beberapa kasus suatu spesies jamur dilaporkan tidak dapat memanfaatkan suatu zat tertentu, tetapi studi lebih lanjut
menunjukkan bahwa pH optimum dapat membuat zat tersebut melewati membran kemudian dimanfaatkan oleh jamur.
Pemberian perlakuan pH juga berpengaruh terhadap pertumbuhan biomassa F. oxysporum. Moore (1972) menjelaskan bahwa pengaruh pH terhadap pertumbuhan ada dua. Pengaruh yang pertama adalah terdapatnya ion logam. Ion logam ini dapat berbentuk kompleks dan pada tingkat pH tertentu sulit dipecahkan/diuraikan. Pengaruh kedua adalah pada permeabilitas sel yang dapat berubah pada tingkat keasaman atau kebasaan yang berbeda. Akibatnya yang terutama dapat terlihat pada senyawa-senyawa yang mengalami ionisasi. Penjelasan yang mungkin adalah pada pH rendah membran protoplasma menjadi dipenuhi dengan ion hidrogen, sehingga aliran kation-kation yang essensial terhambat, sebaliknya pada pH tinggi membran protoplasma dipenuhi dengan ion hidroksil dengan demikian akan menghambat aliran anion-anion yang essensial. Pada pH rendah asam ρ-aminobenzoik berada sebagai asam bebas, selain itu pH rendah merupakan kondisi yang baik untuk pengambilan vitamin. Pada pH 6 membutuhkan delapan kali lebih banyak asam ρ-aminobenzoik dibanding pada pH 4 untuk mendukung pertumbuhan cendawan.
Lebih lanjut Moore (1972) menjelaskan bahwa cendawan mempunyai selang pH yang luas di mana mereka dapat tumbuh. Derajat kemasaman (pH) optimum untuk sebagian besar cendawan adalah pada pH asam di bawah 7. Pertumbuhan pada pH rendah ini disebabkan oleh hasil langsung dari tersedianya unsur besi dalam jumlah besar, sementara pertumbuhan pada pH tinggi akan meningkatkan aktivitas enzim dengan pH optimum yang tinggi.
Hasil pengamatan pertumbuhan biomassa diperoleh bahwa F.
oxysporum tumbuh optimum pada pH medium 4 pada masing-masing
perlakuan. Marin et al. (1995) dalam Ramli (1997) yang menyatakan bahwa pH optimum untuk pertumbuhan F. proliferatum adalah 5.5 dan untuk F. moniliforme adalah pH 7. Hal ini berbeda pada media padat,
karena pada media padat F. oxysporum tumbuh baik pada kisaran pH medium 5 - 8.
Penjelasan yang mungkin adalah agar-agar yang ditambahkan pada media padat merupakan polisakarida kompleks yang penyusun utamanya dari monomer galaktosa dengan beberapa persen sulfat ester. Sebagai produk alami dari rumput laut dapat mengandung berbagai unsur tambahan termasuk mikronutrisi, vitamin dan zat penghambat pertumbuhan (Griffin, 1981). Dhingra dan Sinclair (2000) menjelaskan bahwa autoklaf dapat menghidrolisis sebagian agar-agar yang dapat menghambat pertumbuhan mikroba. Stakman dan Harrar (1957) menjelaskan bahwa gas dan zat-zat dari hasil metabolisme patogen pada media kultur dapat menghambat pertumbuhan.
Selanjutnya Moore (1972) menjelaskan bahwa konsentarsi ion hidrogen eksternal dapat mempengaruhi pH sel, yang dapat menyebabkan perubahan aktivitas enzim. Enzim tidak dapat aktif pada pH yang ekstrem, tetapi mereka mempunyai tingkat pH optimum yang berbeda untuk aktivitasnya. Beberapa aktif pada larutan asam lemah dan sebagian aktif pada larutan basa lemah. Derajat kemasaman (pH) optimum untuk enzim adalah antara pH 4.0-8.0 dan pH yang tidak menguntungkan dapat merubah kemampuan normal dari sel. Griffin (1981) menjelaskan bahwa pH sebagian besar berpengaruh pada unsur-unsur medium. Pengaruh yang nyata yaitu pada aktivitas metabolisme pada bagian-bagian dinding sel dan bagian permukaan membran luar. Di samping itu Dhingra dan Sinclair (2000) menjelaskan bahwa pH medium biasanya berubah 0.2 sampai 0.4 ketika di autoklaf.
2. Pengaruh Macam Media terhadap Pertumbuhan F. oxysporum
Pemberian perlakuan macam media menunjukkan bahwa macam media tidak berpengaruh terhadap pertumbuhan biomassa dan diameter koloni F. oxysporum. Booth (1971) dan Smith dan Onions (1994) menyatakan bahwa media yang baik untuk pertumbuhan F. oxysporum adalah media Potato Sucrose Agar (PSA). Walaupun pemberian media tidak berpengaruh terhadap diameter koloni F. oxysporum, tetapi jika dilihat secara visual menunjukkan bahwa miselia yang tumbuh pada medium PSA lebih tebal daripada miselia yang tumbuh pada medium PDA.
Penjelasan yang mungkin adalah pada medium PSA lebih banyak mengandung unsur karbon daripada medium PDA. Menurut Winarno (1995), sukrosa merupakan karbohidrat kelompok oligosakarida dan terdiri dari dua molekul yang disebut disakarida, molekul penyusun sukrosa adalah molekul glukosa dan fruktosa. Moore (1972) menjelaskan bahwa sukrosa yang tersusun atas satu molekul glukosa dan satu molekul fruktosa terdapat dalam tanaman. Sebaliknya dekstrosa menurut Winarno (1995), merupakan karbohidrat kelompok monosakarida yang terdiri dari enam atom C, disebut heksosa. Jadi dilihat dari penyusunnya sukrosa lebih banyak mengandung unsur karbon daripada dekstrosa.
Moore (1972) menjelaskan akan pentingnya unsur karbon bagi cendawan karena cendawan membutuhkan unsur karbon dalam jumlah yang besar daripada unsur-unsur essential yang lain dan karbon merupakan nutrisi yang pokok dan terpenting pada cendawan. Hal ini terlihat dari sekitar 50 % dari berat kering cendawan selnya terdiri atas karbon. Senyawa organik ini dipergunakan sebagai struktur utama dalam penyediaan energi untuk sel pada proses oksidasi dan beberapa senyawa organik yang digunakan oleh cendawan sebagai sumber karbon adalah karbohidrat (monosakarida, gula alkohol, polisakarida dan oligosakarida), asam organik dan karbondiksida. Dari semua itu, yang terpenting adalah karbohidrat. Cendawan mempunyai kemampuan berbeda yang tinggi dalam menggunakan sumber karbon yang berbeda.
Hal yang sama dijelaskan oleh Chang dan Miles (1989) dalam Hidayat (2005) yaitu sumber karbon dibutuhkan untuk keperluan energi dan struktur sel jamur. Menurut Hadi (1989), karbon yang diserap oleh jamur digunakan untuk dua keperluan, yaitu: 1) untuk penyusunan senyawa-senyawa yang ada di dalam sel hidup dan 2) sebagai energi.
Selanjutnya Griffin (1981) menyatakan bahwa media cair dapat mempunyai masalah yang sama seperti yang terdapat pada media gel/padat. Sebagai contoh, ketika medium Broth diinokulasikan cendawan kemudian diinkubasi dan tidak terjadi kontaminasi, maka didapatkan bahwa pertumbuhan miselia yang mengambang seperti tatakan itu sangat heterogen. Kondisi lapisan permukaan atas yang sangat sedikit berhubungan dengan media adalah aerobik. Sebaliknya kondisi lapisan bawah yang lebih banyak berhubungan dengan media adalah anaerobik. Situasi ini dapat menjelaskan bahwa terhambatnya pertumbuhan suatu fungi dan kelebihan pada produksi metobolisme sekunder tergantung pada karakteristik dari fungi tersebut.
Menurut Dhingra dan Sinclair (2000), media kultur dapat berubah karena perlakuan panas, dan pengaruhnya terhadap media dapat menguntungkan atau merugikan. Sebagian karbohidrat akan terhidrolisis dan protein alami akan berubah. Glukosa dan asam amino akan bereaksi menjadi senyawa yang dapat menghambat mikroorganisme.