BAB 2
TINJAUAN PUSTAKA
2.1 Baterai Ion Lithium
Baterai didefenisikan sebagai suatu alat yang dapat mengubah langsung energi kimia menjadi energi listrik melalui proses elektrokimia. Sel baterai adalah unit terkecil dari suatu sistem proses elektrokimia yang terdiri dari elektroda, elektrolit, separator, wadah dan current colector/ terminal.
Komponen terpenting dari sel baterai adalah :
1. Elektroda negatif/ anoda, yaitu elektroda yang melepaskan elektron ke rangkaian luar serta mengalami proses oksidasi pada proses elektrokimia. 2. Elektroda positif/ katoda, yaitu elektroda yang menerima elektron dari
rangkaian luar serta mengalami proses reduksi pada proses elektrokimia. 3. Penghantar ion/ elektrolit, yaitu media transfer ion yang bergerak dari anoda ke
katoda dalam sel baterai saat penggunaan. Fisik elektrolit umumnya berupa cairan/ larutan dimana molekul garam larut didalamnya.
(Linden, 2002)
Baterai terdiri atas dua jenis yaitu baterai primer dan baterai sekunder. Baterai ion lithium merupakan baterai sekunder atau baterai yang dapat diisi ulang. Banyak keunggulan baterai ini dibandingkan dengan jenis baterai sebelumnya, diantaranya memiliki lifecycle yang panjang (500-1000 siklus), memiliki memory effect yang kecil, tegengan kerja yang tinggi (3,6 V), dan memliki kapasitas spesifik lebih tinggi daripada baterai sekunder yang lain.
Dalam kondisi charge dan discharge baterai ion lithium bekerja menurut fenomena interkalasi, yaitu proses pelepasan ion lithium dari tempatnya di struktur kristal suatu bahan elektroda dan pemasukan ion lithium pada tempat di struktur kristal bahan elektroda yang lain (Prihandoko, 2010). Proses interkalasi pada baterai ion lithium pada saat charge dan discharge dapat dilihat pada Gambar 2.1.
Gambar 2.1. Skema Prinsip Kerja Baterai Ion Lithium (Moretti, 2013)
Kemampuan kapasitas energi yang tersimpan dalam baterai lithium tergantung pada beberapa banyak ion lithium yang dapat disimpan dalam struktur bahan elektrodanya dan berapa banyak yang dapat digerakkan dalam proses charging dan discharging, karena jumlah arus elektron yang tersimpan dan tersalurkan sebanding dengan jumlah ion lithium yang bergerak (Linden, 2002). Pada saat charging, material katoda akan terionisasi dan menghasilkan ion lithium bermuatan positif dan berpindah kedalam elektrolit menuju material anoda, sementara elektron yang diberikan akan dilepaskan bergerak melalui rangkaian luar menuju elektroda negatif (anoda). Ion lithium ini akan masuk ke dalam material anoda melalui mekanisme interkalasi yaitu tanpa terjadi perubahan struktur kristal dari bahan katoda dan anoda. Dan pada saat discharging akan terjadi aliran ion dan elektron dengan arah kebalikan dari proses charging.
2.2 Bahan Elektroda
Keunggulan suatu bahan anoda dan katoda terletak pada stabilitas kristal dalam proses interkalasi. Sehingga bahan elektroda harus mempunyai tempat bagi perpindahan ion lithium yang sering disebut host. Oleh karena itu bahan elektroda harus mempunyai struktur host dengan variasi interkalasi yang berbeda-beda. Pada umumnya, bahan memiliki tiga model interkalasi berdasarkan struktur dari hostnya, yaitu interkalasi satu dimensi, dua dimensi dan tiga dimensi seperti pada Gambar 2.2 ( Prihandoko, 2010 ).
Gambar 2.2 Tiga Model Host dari Bahan Anoda dan Katoda. ( Prihandoko, 2010 ).
2.2.1 Material Katoda
Dalam baterai ion lithium yang dapat diisi ulang, katoda sebagai material utuh menyediakan sumber ion lithium untuk reaksi interkalasi. Jadi, sifat fisik, struktur dan elektrokimia bahan katoda sangat penting untuk kinerja baterai. Sifat utama yang diperlukan bahan katoda adalah sebagai berikut:
1. Reaksi discharge harus memiliki energi yang besar (tegangan discharge yang tinggi).
2. Struktur host harus memiliki kemampuan interkalasi yang besar pada jumlah ion lithium (kapasitas energinya tinggi).
3. Struktur host harus memiliki koefisien difusi lithium yang besar (densitas dayanya tinggi).
4. Perubahan struktur host selama interkalasi dan deinterkalasi harus sekecil mungkin (siklus hidupnya panjang).
5. Material harus memiliki sifat kimia yang stabil, tidak beracun dan murah. 6. Cara pengerjaanya mudah
Secara umum, material katoda ini berfungsi sebagai sumber ion lithium penghantar arus yang dapat berpindah dari katoda ke anoda dan sebaliknya, sehingga sangat menentukan performa dari baterai lithium itu sendiri. Jumlah ion yang dilepaskan material katoda saat charging dan jumlah ion yang kembali pada saat discharging menghasilkan densitas energi dan densitas power baterai. Semakin banyak lithium dari katoda menuju anoda maka densitas energi sel baterai semakin besar dan semakin banyak lithium yang kembali ke katoda dari anoda maka densitas powernya semakin besar (Triwibowo, 2011).
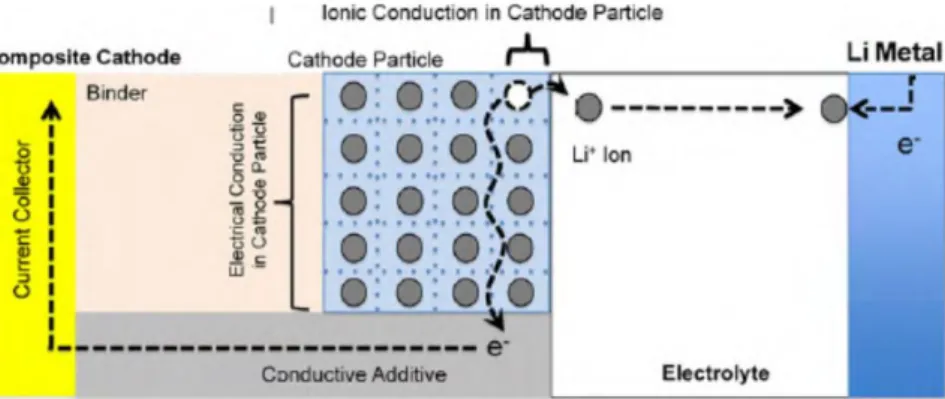
Performa sel baterai sangat bergantung pada kondisi tranfer muatan/ charge transfer. Mekanisme ini berkaitan erat dengan proses difusi dan konduktifitas elektronik dan ionik dari komponen pembentuk sel baterai. Saat proses charging ion lithium akan dilepaskan dari katoda ke anoda melalui elektrolit, maka begitu katoda bersifat konduktif ionik. Dengan keadaan yang sama, elektron akan dilepaskan melewati rangkaian luar menuju anoda sehingga katoda juga harus bersifat konduktif elektronik. Proses ilustrasi ini dapat dilihat pada Gambar 2.3.
Gambar 2.3 Fenomena Konduktifitas Ionik dan Elektronik pada Material Katoda (Park, 2010)
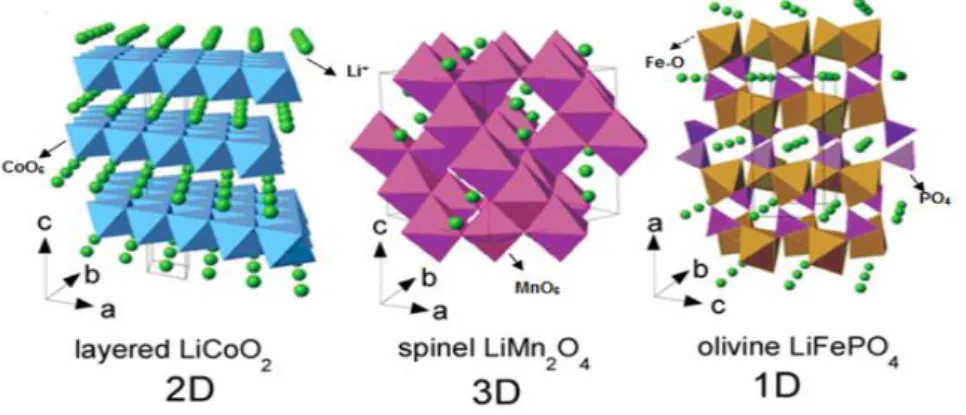
Material katoda yang sering digunakan pada baterai ion lithium yaitu LiCoO2, LiMnO4, LiFePO4. Ketiga material tersebut memiliki bentuk struktur
Gambar 2.4 Ilustrasi Skematis pada Struktur Host dari (a) LiCoO2 (Struktur
Layered), (b) LiMn2O4 (Struktur Spinel), dan (c) LiFePO4 (Struktur
Olivine) (Julien, 2014)
Pada struktur host layered, ion lithium berinterkalasi dalam dua arah, pada struktur host spinel interkalasi ion lithium dalam tiga arah, sedangkan pada struktur host olivine interkalasi dalam satu arah. Karakteristik elektrokimia dari masing-masing material tersebut dapat dilihat perbandingannya pada Tabel 2.1
Tabel 2.1 Karakteristik Elektrokimia dari Beberapa Matrial Katoda (Julien, 2014)
Struktur Host Senyawa Spesifik
Kapasitas(mAh/g) Beda Potensial (V) Layered LiCoO2 272 4,2 Spinel LiMn2O4 148 4,1 Olivine LiFePO4 170 3,45
Dari Tabel 2.1 masing-masing memiliki karakteristik sendiri sebagai contoh, LiCoO2 yang mahal, beracun, dan sumber daya yang tidak lagi melimpah
(AG Ritchie, 2001). LiMn2O4 memiliki kapasitas yang jauh lebih rendah dan
stabilitas siklus rendah (Yuan Gao & Dahn J. R, 1996). Senyawa berbasis besi ini menjadi menarik karena Fe yang berlimpah, murah, dan kurang beracun daripada Co, Ni, Mn. LiFePO4 saat ini sedang dalam penelitian yang luas karena biaya
rendah, toksitas rendah, stabilitas termal tinggi dan spesifik kapasitas 170 mAh/g. (Padhi et al. 1997).
2.2.1.1 Lithium Iron Phosphate ( LiFePO4 )
Bahan katoda yang sangat menjanjikan adalah LiFePO4 dengan struktur
phospo-olivine dengan kapasitas teoritis 170 mAh/g, energi spesifik 0,59 Wh/g, dan densitas 3,60 g/cm3, voltage rata-rata 3,5 V, harga murah, tidak beracun, ramah terhadap lingkungan, dan memiliki stabilitas termal yang baik (Gunawan, 2007).
Namun kelemahan dari material ini adalah konduktifitas listrik rendah yaitu berorde 10-9 S/cm dan difusi ion lithium yang lamban. Dua kelemahan tersebut membatasi aplikasi LiFePO4 sebagai material katoda. Difusi ion lithium
yang rendah dapat diatasi dengan menurunkan dimensi partikel sampai skala nanometer. Untuk mengatasi konduktifitas listrik yang rendah dapat diatasi juga dengan conductive agent seperti penambahan karbon dan polimer yang dapat meningkatkan performance LiFePO4 .(Anies, 2011)
2.2.1.2 Lithium Nickel Phosphate (LiNiPO4)
LiNiPO4 (Lithium Nickel Phosphate) terinspirasi oleh perkembangan komersial
LiFePO4. Para peneliti berusaha untuk menemukan bahan fosfat lain dengan
struktur olivine. LiNiPO4 sangat terbatas karena potensi redoks tinggi yang
melebihi batasan stabil elektrolit yang berjalan (Qing, 2013). LiNiPO4 memiliki
potensi redoks yang lebih tinggi ≈ 5,2-5,4 V dari LiCoPO4. (Deniard et al. 2004;
Padhi et al. 1997).
2.2.2 Material Anoda
Material elektrokimia dapat berfungsi baik sebagai elektroda anoda maupun katoda bergantung pada pemilihan material yang akan menentukan karakteristik perbedaan nilai tegangan kerja dari kedua material yang akan dipilih. Potensial tegangan yang terbentuk antara elektroda negatif dan elektroda positif bergantung dari reaksi kimia reduksi-oksidasi dari bahan elektroda yang dipilih. Beberapa material dapat berfungsi sebagai anoda terhadap matrial katoda lainnya jika memiliki potensial lithium yang lebih rendah.
Bahan anoda yang sering digunakan sebagai komponen sel baterai lithium rechargeable adalah grafit/karbon dan lithium metal. Kedua material tersebut
memenuhi syarat sebagai suatu material sebagai host untuk proses interkalasi. Terdapat tiga syarat utama yang harus dimiliki material anoda yaitu sebagai berikut :
1. Potensial penyisipan dan pelepasan ion lithium pada anoda harus sekecil mungkin.
2. Banyaknya ion lithium yang dapat dimuat oleh material anoda harus besar untuk mencapai kapasitas spesifik yang besar.
3. Host pada anoda harus menahan penyisipan dan pelepasan ion lithium yang berulang - ulang tanpa kerusakan strukturnya untuk memperoleh siklus hidup yang panjang.
(Yao, 2003)
Material anoda yang dipilih dalam penelitian ini adalah lithium metal. Lithium metal termasuk elektroda yang potensialnya rendah terhadap tegangan kerja dari elektroda material lain. Lithium metal adalah material anoda yang ideal untuk beterai lithum karena kapasitas secara teoritis sangat tinggi dari 3.860 mAh/g (10 kali lebih besar dari grafit), densitas rendah sebesar 0.534 g cm-3 dan potensi elektrokimia yang terendah -3.040 V (Xu, 2013).
2.3 Bahan Elektrolit
Elektrolit adalah media transfer ion yang bergerak dari anoda ke katoda dalam sel baterai saat penggunaan. Fisik elektrolit umumnya berupa cairan/ larutan dimana molekul garam larut didalamnya. Karakteristik yang perlu dimiliki elektrolit adalah konduktifitas ionik tinggi dan konduktifitas elektronik yang rendah sehingga mampu menghantarkan ion selama proses reaksi redoks terjadi antara elektroda positif dan elektroda negatif tanpa terjadi kebocoran arus elektron (Subhan, 2011).
Elektrolit yang dipilih dalam percobaan ini adalah LiPF6 (Lithium
hexafluorophosphate). LiPF6 sering digunakan dalam pembuatan baterai ion
lithum. Lithium Hexafluorophosphate (LiPF6) adalah garam yang paling banyak
digunakan sebagai elektrolit untuk sel ion lithium komersial. Garam LiPF6 murni
secara termal stabil sampai suhu 380 K di tempat yang kering, dan merupakan proses dekomposisi dari LiF padat dan PF5 sebagai produk gas (Yang et al. 2003).
2.4 Material Komposit
Matrial komposit adalah suatu material yang terbentuk dari kombinasi dua atau lebih material yang memiliki sifat yang berbeda, membentuk satu material yang memilisski sifat yang lebih baik daripada material penyusunnya. Dari campuran tersebut akan dihasilkan material komposit dengan karakteristik yang berbeda dari material pembentuknya sehingga kita dapat menentukan kekuatan material komposit yang kita inginkan dengan jalan mengatur komposisi dari material pembentuknya. Jadi komposit merupakan sejumlah sistem multi fasa sifat dengan gabungan, yaitu gabungan antara bahan matriks atau pengikat dengan penguat (Matthews, 1993). Bahan komposit secara umum terdiri dari filler dan matriks.
Matriks berfungsi untuk mengikat material penyusun menjadi satu struktur komposit. Pada material komposit matrik memberikan pengaruh yang lebih besar dalam pengikatan material penyusun selain bertugas untuk mendistribusikan beban dan memberikan perlindungan dari pengaruh lingkungan.
Filler berfungsi sebagai penopang kekuatan dari komposit, sehingga tinggi rendahnya kekuatan komposit sangat tergantung dari filler yang digunakan, karena tegangan yang dikenakan pada komposit mulanya diterima oleh matriks akan diteruskan kepada filler, sehingga filler akan menahan beban sampai beban maksimum.
Gambar 2.5 Ikatan Partikel Komposit Baterai Ion Lithium (Whittingham, 2008)
Material katoda yang berupa bahan keramik selanjutnya menjadi serbuk dengan ukuran sekecil mungkin. Sel baterai sekunder yang saat ini mudah ditemui
adalah solid polymer battery. Sel baterai ini dihasilkan dengan membuat komposit yang terdiri dari polimer sebagai binder dan serbuk katoda (material aktif) sebagai filler. Campuran ini selanjutnya dibentuk menjadi lembaran. Polimer yang digunakan harus bersifat penghantar listrik, memiliki struktur dan senyawa yang stabil terhadap bahan elektroda dan elektrolit agar proses interkalasi dapat berjalan dengan baik.
2.4.1 Polyvinylidene fluoride (PVDF)
Polyvinylidene fluoride atau PVDF adalah termoplastik floropolimer murni dan sangat reaktif. Polimer ini berwarna putih atau tembus cahaya dalam bentuk padatanya. Selain itu PVDF tidak larut dalam air. PVDF banyak digunakan dalam aplikasi yang membutuhkan kemurnian, kekuatan, dan ketahanan terhadap bahan pelarut, asam, basa, dan panas yang sangat baik. Adapun contoh produk dari PVDF antara lain pipa, lembaran, dan pelat. Beberapa jenis PVDF juga dapat digunakan sebagai pembuatan baterai ion lithium. PVDF sebagai pengikat memegang peranan penting dalam hal menjaga integritas elektroda dan sebagai perantara hubungan filler dan zat aditif. Sifat umum dari PVDF dapat dilihat pada Tabel 2.2.
Tabel 2.2 Sifat Umum Polyvinylidene Fluoride (PVDF) (Afton Plastics, 2014)
Sifat Nilai
Daya Serap Air 0,03 %
Kuat Tarik 7,105 psi
Penambahan Panjang 250 %
Titik Leleh 169oC
Temperatur Defleksi 114 - 118 oC
2.4.2 Acetylene Black ( AB )
Elektroda pada baterai ion lithium terdiri dari material aktif, pengikat, dan zat aditif. Material aktif yang dipanaskan dengan pelarut dan dicampur dengan karbon yang bersifat zat aditif konduktif untuk meningkatkan konduktifitas elektronik sehingga elektron dapat diangkut ke bahan aktif. Zat aditif konduktif yang digunakan dalan penelitian ini adalah actylene black. Luas spesifik
permukaan dari actylene black setidaknya sepuluh kali lebih besar dari bahan material aktif agar dapat mengumpulkan arus listrik pada konsentrasi yang lebih rendah dan membentuk jaringan karbon konduktif. Besar nilai konduktifitas pada actylene black adalah 5,7 x 10-4 (Shin, 2006).
Penambahan Actylene Black pada material katoda dapat meningkatkan nilai konduktifitas listrik secara efisien dengan penambahan yang minimum, karena partikel tersebut memiliki struktur yang bulat berlubang dan bercabang, luas permukaan yang tinggi dan ukuran partikel yang kecil. Jumlah karbon biasanya digunakan adalah di bawah 10% berat dari total massa elektroda. Sifat umum dari Actylene Black dapat dilihat pada Tabel 2.3.
Tabel 2.3 Sifat Umum Actylene Black (Xuguang Chemical, 2010) Rumus Molekul C
Berat Molekul 12,01
Bentuk Serbuk Hitam
Ukuran 35 - 45 nm
Kelarutan dalam air Tidak larut
Hambatan 1,8 Ω.cm
2.4.3 Pelarut DMAC (Dimethyl-acetamide)
Dimethylacetamide (DMAC) merupakan pelarut yang dapat digunakan sebagai pelarut PVDF pada baterai ion lithium. Pelarut tersebut memiliki kelarutan terhadap bahan organik dan anorganik yang tinggi, titik didih tinggi, titik beku yang rendah, stabilitas yang baik dan tidak akan mengalami degradasi serta perubahan warna jika dipanaskan dibawah suhu 350 0C (BASF, 2014). Sifat fisik dan kimia DMAC dapat dilihat pada Tabel 2.4.
Tabel 2.4. Sifat Fisik dan Kimia DMAC Parameter Nilai Bahan Cair PH (200 g/l, 20 0C) 4 Titik lebur (0C) - 20 Titik didih (0C) 165 – 166 Densitas (g/cm3) pada 20 0C 0,94 Sumber : BASF (2014) 2.5 Pengujian Material 2.5.1 X-Ray Diffraction (XRD)
Pengamatan struktur kristal dengan XRD merupakan tahap awal karakterisasi untuk mengidentifikasi jenis fasa yang terbentuk seperti yang diharapkan dan fasa lainnya yang tidak diharapkan. Kegunaan XRD dapat membedakan antara material yang bersifat kristal dengan amorf, karakterisasi material kristal dan penentuan dimensi-dimensi sel satuan.
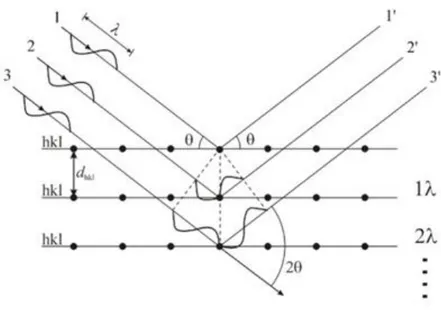
Gambar 2.6 Pola Difraksi Sinar-X yang Terhambur oleh Kisi dalam Bidang Kristal (Triwibowo, 2011)
Sinar-X datang membentuk sudut θ terhadap permukaan sampel, kemudian dipantulkan dengan sudut yang sama. Begitu juga selanjutnya sinar-X kedua yang
jatuh pada bidang dibawahnya dengan berjarak d. Sinar ini akan dipantulkan dengan sudut θ, namun memiliki beda fase. Jika perbedaan fasa sama dengan kelipatan panjang gelombang, makan akan menghasilkan persamaan Bragg. Sinar-X ini bersifat collimated dan mengarahkan ke sampel. Saat sampel dan detektor diputar, intensitas sinar-X pantul itu direkam. Detektor akan merekam dan memproses isyarat penyinaran ini dan mengkonversi isyarat itu menjadi suatu arus yang akan dikeluarkan pada printer atau layar komputer.
Dengan persamaan Bragg, kita dapat memperoleh nilai jarak antara dua bidang kisi (d) :
n λ = 2 d sin θ (2.1)
dengan : d = jarak antar kristal
= sudut pengukuran (sudut difraksi) λ = panjang gelombang sinar-X n = urutan sinar ( dalam bilangan bulat)
Berdasarkan persamaan Bragg, jika seberkas sinar-X di jatuhkan pada sampel kristal, maka bidang kristal itu akan membiaskan sinar-X yang memiliki panjang gelombang sama dengan jarak antar kisi dalam kristal tersebut. Sinar yang dibiaskan akan ditangkap oleh detektor kemudian diterjemahkan sebagai sebuah puncak difraksi. Makin banyak bidang kristal yang terdapat dalam sampel, makin kuat intensitas pembiasan yang dihasilkannya. Tiap puncak yang muncul pada pola XRD mewakili satu bidang kristal yang memiliki orientasi tertentu dalam sumbu tiga dimensi. Puncak-puncak yang didapatkan dari data pengukuran ini kemudian dicocokkan dengan standar difraksi sinar-X untuk hampir semua jenis material. Standar ini disebut JCPDS/ICCD.
2.5.2 Scanning Elektron Microscope (SEM)
Scanning Electron Microscope (SEM) adalah sebuah mikroskop elektron yang didesain untuk mengamati permukaan sampel secara langsung. Analisa SEM dilakukan pada lembar katoda untuk mengetahui distribusi serbuk pada matriks,
porositas dan kemampuan serbuk material aktif terhadap matriks. SEM digunakan untuk menganalisis permukaan pada sampel yang tebal.
Ada beberapa sinyal yang penting yang dihasilkan oleh SEM. Dari pantulan inelastis didapatkan sinyal secondary electron dan karakteristik sinar X sedangkan dari pantulan elastis didapatkan sinyal backscattered electron. Perbedaan dari sinyal secondary electron dengan backscattered electron adalah secondary electron memberikan informasi topografi dari benda yang dianalisa, permukaan yang tinggi berwarna lebis cerah dari permukaan rendah. Sedangkan backscattered elektron memberikan perbedaan berat molekul dari atom – atom yang menyusun permukaan, atom dengan berat molekul tinggi akan berwarna lebih cerah daripada atom dengan berat molekul rendah. Kedua sinyal inilah yang akan dideteksi oleh detektor dan dimunculkan dalam bentuk gambar pada monitor CRT.
Gambar 2.7 Interaksi Antara Elektron dengan Permukaan Sampel (Triwibowo, 2011)
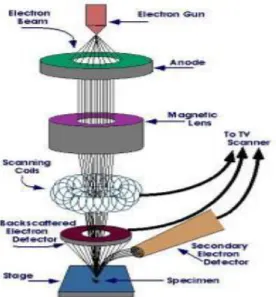
SEM memiliki beberapa peralatan utama diantaranya penembak elektron, lensa magnetik, detektor, sampel holder, dan monitor CRT. Prinsip kerja dari SEM yaitu elektron gun menghasilkan elektron beam dari filamen. Elektron gun yang digunakan adalah tungsten hairpin gun dengan filamen berupa lilitan tungsten yang berfungsi sebagai katoda. Tegangan yang diberikan kepada lilitan mengakibatkan terjadinya pemanasan. Anoda kemudian akan membentuk gaya yang dapat menarik electron menuju anoda. Lensa magnetik memfokuskan elektron menuju suatu titik pada permukaan sampel. Sinar elektron yang terfokus menyapu (scanning) keseluruhan
sampel dengan diarahkan oleh koil penyapuan. Ketika elektron mengenai sampel, maka akan terjadi hamburan elektron, baik Secondary Electron (SE) atau Back Scattered Electron (BSE) dari permukaan sampel dan akan dideteksi oleh detektor dan dimunculkan dalam bentuk gambar pada monitor CRT. Penjelasan prinsip kerja SEM diatas dapat dilihat pada Gambar 2.8 dibawah ini :
Gambar 2.8 Skema Scanning Elektron Microscope (SEM) (Triwibowo, 2011)
2.5.3 Electrochemical Impedance Spectrometry (EIS)
EIS (Electrochemical Impedance Spectrometry) adalah sebuah teknik analisis yang digunakan untuk mempelajari sifat elektrik dari sistem elektroda-elektrolit (Rochliadi,2002). EIS telah banyak digunakan secara luas dalam bidang elektrokimia seperti pelapisan material (coating), baterai, sel bahan bakar (fuel cell) dan lainnya. Pengujian menggunakan metode Electrochemical Impedance Spectroscopy (EIS) dengan alat LCR-meter merek HIOKI 35320-50.
Pergerakan elektron dan ionik dalam baterai lithium dapat diamati secara elektrokimiawi dengan menggunakan metoda EIS. Impedansi elektrokimia pada umumnya diukur dengan menggunakan sebuah tegangan AC pada sebuah sel elektrokimia untuk mengukur arus listrik yang melalui sel. Arus massa dalam elektrolit dipengaruhi oleh besaran frekuensi, dimana kontrol kinetik sangat menonjol pada
frekuensi tinggi. Sedangkan pada frekuensi rendah, arus akan dipengaruhi oleh transfer massa.
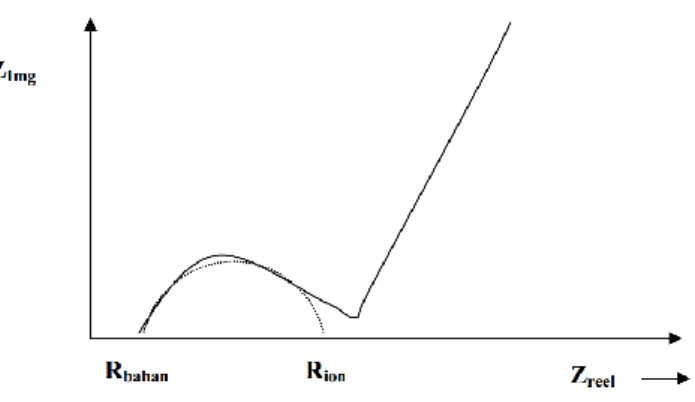
Jika nilai impedansi real (Z’) diproyeksikan pada sumbu-X dan nilai impedansi imajiner (Z”) diproyeksikan pada sumbu-Y, maka akan diperoleh grafik dibawah ini :
Grafik 2.9 Hasil Pengukuran Impedansi Komponen Sel. (Triwibowo, 2011)
Perhitungan konduktifitas dilakukan dengan melakukan interpretasi dari ukuran busur. Dimana akan didapatkan nilai impedansi Rbahan dan Rion. Nilai Rbahan
menunjukkan karakteristik dari bahan material yang bersifat ohmik, sementara Rion
menunjukkan karakteristik kualitatif dari transfer ion antar elektroda. Karakteristik Rbahan selalu nampak pada data berfrekuensi tinggi, sementara Rion teramati pada
frekuensi rendah (Triwibowo, 2011).
Untuk mendapatkan nilai Rtot, maka kita harus mendapatkan Z” = 0 dengan cara
melakukan ekstrapolasi membentuk setengah lingkaran seperti gambar diatas. Rtot
merupakan penjumlahan dari Rbahan dan Rion. Dari nilai Z = Rtot ini, kita dapat
menentukan konduktifitas bahan dengan menggunakan persamaan :
R = ρ (2.2)
dengan
R = Resistivitas bahan (ohm)
ρ = Hambatan jenis bahan (ohm.cm) t = Tebal bahan (cm)
Dikarenakan σ = 1/ ρ , maka rumus persamaan menjadi : σ = =
=
(2.3) dengan : σ = Konduktifitas (Ω-1
.cm-1) atau (S/cm)
Impedansi komplek akan digunakan untuk menguji interaksi antara komponen elektroda dan elektrolit dalam kemampuan migrasi dari elektron ioniknya dalam penelitian ini.
2.5.4 Cyclic Voltammetry (CV)
Voltametri Siklik (Cyclic Voltammetry) merupakan metode yang umum digunakan dalam teknik elektrokimia dan digunakan untuk mempelajari proses reduksi dan oksidasi (redoks). Hal ini dicapai dengan melihat hubungan antara potensial yang diberikan dan arus yang terukur. Karena sistem ini melibatkan reaksi redoks di anoda dan katoda maka peristiwa reaksi di kedua elektroda tersebut dimonitor besarnya arus yang timbul. Pengukuran arus listrik dilakukan dengan rentang potensial awal dan akhir yang sama. Potensial awal diberikan pada awal tidak terjadi reaksi elektrokimia pada permukaan elektroda. Kemudian dialurkan secara linier dengan laju tertentu menuju suatu nilai potensial ketika senyawa aktif mengalami reaksi reduksi.
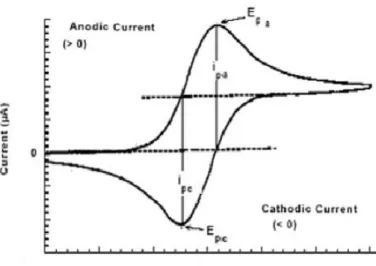
Voltamogram siklik diperoleh dengan mengukur arus pada elektroda kerja selama scan potensial. Arus dapat dianggap sebagai respon sinyal terhadap potensial. Voltamogram yang dihasilkan merupakan kurva antara arus (pada sumbu vertikal) versus potensial (sumbu horizontal). Kurva Voltamogram siklik dapat dilihat pada Gambar 2.10.
Gambar 2.10 Voltamogram Siklik dengan Arus sebagai Fungsi Potensial (Wang, 2000)
Satu dari banyak kegunaan Voltametri siklik adalah informasi kualitatif mengenai mekanisme reaksi dari proses reduksi-oksidasi. Adanya kemungkinan reaksi lain saat reduksi-oksidasi berlangsung dapat melihat dari voltamogramnya. Perubahan pada voltmogram siklik dapat disebabkan oleh persaingan reaksi kimia untuk produk hasil elekrrokimia, ini dapat dijadikan informasi mengenai jalan reaksi. Parameter yang penting dalam voltmogram siklik adalah arus puncak dan potensial puncak yaitu keduanya berasal dari puncak katoda dan anoda.
2.5.5 Charge – Discharge (CD)
Pengujian sel baterai dilakukan dengan proses charging dan discharging. Untuk mendapatkan performasi sebuah baterai maka diperlukan pengujian charge/discharge sehingga didapatkan kapasitas pada sel baterai. Hal yang diutamakan dalam menentukan performa sel baterai terletak pada aspek kimia permukaan yang menghasilkan kontak permukaan yang bagus sehingga menjamin proses interkalasi dan deinterkalasi berjalan dengan baik.
Kapasitas baterai dimaksudkan sebagai besarnya energi listrik yang dapat dikeluarkan baterai pada waktu tertentu. Kapasitas baterai tergantung pada jenis aktif material yang digunakan dan kecepatan reaksi elektrokimia pada saat baterai di charge
atau discharge. Luasnya kontak permukaan antar material aktif juga akan memperbesar kapasitas baterai.
Dalam sistem baterai sekunder lithium, material katoda memegang peranan penting dalam pencapaian kapasitas baterai. Material ini yang nantinya harus dapat melepaskan ion lithiun (deinterkalasi), bergerak menuju anoda dan berinterkalasi didalam struktur anoda saat charging. Makin besar jumlah ion lithum yang dapat dipindahkan ke anoda, maka makin besar pula arus listrik yang dihasilkan saat discharging nantinya. (Triwibowo, 2011). Kapasitas sel baterai semakin menurun ketika dilakukan pengujian cycle berikutnya. Penurunan kapasitas yang terjadi mengindikasikan ion lithium yang berinterkalasi/ deinterkalasi mengalami jumlah yang terus menurun. Ketika performa baterai mengalami penurunan drastis maka kemampuan cycling times masih rendah (Subhan, 2011).