PERAIRAN ESTUARI SUNGAI PORONG DAN SUNGAI
WONOKROMO
RENDY ELIA SORMIN
SKRIPSI
DEPARTEMEN MANAJEMEN SUMBERDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Dengan ini saya menyatakan bahwa skripsi yang berjudul:
Dinamika Kandungan Nutrien Anorganik Terlarut secara Spasial dan Temporal pada Perairan Estuari Sungai Porong dan Sungai Wonokromo
adalah benar merupakan hasil karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang telah diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Juni 2010
Rendy Elia Sormin C24103078
Rendy Elia Sormin. C24103078.Dinamika Kandungan Nutrien Anorganik secara Spasial dan Temporal pada Perairan Estuari Sungai Porong dan Sungai Wonokromo. Dibawah bimbingan Ario Damar dan Enan Mulyana Adiwilaga.
Penelitian dilakukan bulan Maret 2007, Agustus 2007, dan Maret 2008 di perairan estuari Sungai Brantas, Jawa Timur. Tujuannya mengkaji kecenderungan distribusi spasial dan temporal kandungan nutrien (nitrat, nitrit, amonia, ortofosfat dan silikat) di perairan tersebut. Manfaat dari penelitian diharapkan sebagai acuan pengelolaan perairan oleh pihak terkait.
Pengamatan difokuskan pada variasi konsentrasi nutrien pada wilayah estuari baik dari segi spasial maupun temporal. Secara temporal, ada kecenderungan konsentrasi nutrien yang lebih tinggi pada musim hujan (Maret 2007 dan Maret 2008) dibandingkan musim kemarau (Agustus 2007). Secara spasial, kandungan nutrien cenderung lebih tinggi pada mulut muara sungai atau pantai dibanding ke arah laut. Hasil analisis regresi linier umumnya menunjukkan korelasi yang kuat antara tingkat salinitas dengan tingkat konsentrasi nutrien, dimana semakin tinggi salinitas semakin rendah konsentrasi nutrien. Secara ringkas hasil sebaran konsentrasi nutrien pada Sungai Brantas adalah sebagai berikut:
Pada bulan Maret 2007 konsentrasi nitrat berkisar dari 0,0549 mg/l (stasiun 1) sampai 8,3871 mg/l (stasiun 4), nitrit berkisar dari tidak terdeteksi (stasiun 1 dan stasiun 7) sampai 0,5193 mg/l (stasiun 6), amonia berkisar dari 0,0361 mg/l (stasiun 1) sampai 0,9619 mg/l (stasiun 11), ortofosfat berkisar dari tidak terdeteksi (stasiun 1 dan stasiun 2) sampai 0,4535 mg/l (stasiun 6) dan silikat berkisar dari 1,3967 mg/l (stasiun 13) sampai 6,2541 mg/l (stasiun 8). Pada bulan Agustus 2007 konsentrasi nitrat berkisar dari tidak terdeteksi (stasiun 4 dan stasiun 14) sampai 0,4520 mg/l (stasiun 12), nitrit berkisar dari tidak terdeteksi (stasiun 2-6, dan stasiun 11-16) sampai 0,3050 mg/l (stasiun 10), amonia berkisar dari tidak terdeteksi (stasiun 12, 13, dan 15) sampai 2,6220 mg/l (stasiun 9), ortofosfat berkisar dari tidak terdeteksi (stasiun 1-9, dan stasiun 11-16) sampai 0,1320 mg/l (stasiun 10) dan silikat berkisar dari 0,184 mg/l (stasiun 14) sampai 4,064 mg/l (stasiun 9). Pada bulan Maret 2008 konsentrasi nitrat berkisar dari 0,1780 mg/l (stasiun 13) sampai 1,183 mg/l (stasiun 9), nitrit berkisar dari tidak terdeteksi (stasiun 11, 12, dan 15) sampai 0,1490 mg/l (stasiun 10), amonia berkisar dari 0,1180 mg/l (stasiun 9) sampai 0,7700 mg/l (stasiun 16), ortofosfat berkisar dari tidak terdeteksi (stasiun 2, 12, 13, dan 16) sampai 0,034 mg/l (stasiun 10) dan silikat berkisar dari 0,368 mg/l (stasiun 12) sampai 10,879 mg/l (stasiun 9).
Diamati adanya beberapa perkecualian dimana tidak selalu konsentrasi nutrien semakin tinggi pada stasiun yang posisinya lebih mendekati perairan pantai atau muara dibandingkan ke arah laut. Demikian pula korelasi antara salinitas dengan kadar nutrien, tidak selalu berkorelasi negatif (yakni semakin tinggi salinitas semakin rendah kadar nutrien). Oleh karena itu, untuk kedua kelainan (perkecualian) tersebut di atas disarankan untuk mengadakan penelitian lebih lanjut untuk mengetahui penyebabnya yang lebih pasti.
PERAIRAN ESTUARI SUNGAI PORONG DAN SUNGAI
WONOKROMO
RENDY ELIA SORMIN C24103078
Skripsi
sebagai salah satu syarat untuk memperoleh
gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
DEPARTEMEN MANAJEMEN SUMBERDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Penelitian : Dinamika Kandungan Nutrien Anorganik Terlarut secara Spasial dan Temporal pada Perairan Estuari Sungai Porong dan Sungai Wonokromo
Nama Mahasiswa : Rendy Elia Sormin
NRP : C24103078
Program Studi : Pengelolaan Sumberdaya dan Lingkungan Perairan
Menyetujui:
Pembimbing I, Pembimbing II
Dr. Ir. Ario Damar, M.Si. Dr. Ir. Enan M. Adiwilaga aaNIP. 19660428 199002 1 001 aNIP. 19481207 198012 1 001
Mengetahui:
Dekan Fakultas Perikanan dan Ilmu Kelautan
Prof. Dr. Indra Jaya, M.Sc. NIP. 19610410 198601 1 002
Puji syukur kami panjatkan kepada Tuhan Yang Maha Esa karena atas berkat dan bimbingan-Nya penulis dapat menyelesaikan tugas akhir ini, yakni skripsi yang berjudul “Dinamika Kandungan Nutrien Anorganik Terlarut secara Spasial dan Temporal pada Perairan Estuari Sungai Porong dan Sungai Wonokromo”. Skripsi ini disusun sebagai salah satu syarat memperoleh gelar sarjana pada program studi Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Tiada gading yang tak retak, demikian pula dengan skripsi ini mungkin masih memiliki titik kelemahan dan masih memerlukan penyempurnaan. Koreksi, kritik dan saran dari pembimbing dan teman-teman sangat kami harapkan.
Bogor, Juni 2010
Skripsi ini dapat terselesaikan dengan baik dengan bantuan yang sangat berarti dari beberapa pihak yakni:
1. Dr. Ir. Ario Damar, M.Si. sebagai dosen pembimbing akademik dan pembimbing skripsi yang telah banyak memberikan bimbingan, arahan, dan masukan sehingga pada akhirnya skripsi ini dapat terselesaikan, juga sebagai koordinator tim Peneliti PKSPL (Pusat Kajian Sumberdaya Pesisir dan Lautan) IPB dengan sponsor dari IFS Grantee Swedia No. A/3865-1, 2005. 2. Dr. Ir. Enan M. Adiwilaga sebagai dosen pembimbing skripsi yang telah
banyak memberikan bimbingan, arahan, dan masukan sehingga pada akhirnya skripsi ini dapat terselesaikan.
3. Ir. Sigid Hariyadi, M.Sc. sebagai penguji tamu yang memberikan masukan, koreksi, dan perbaikan pada skripsi ini.
4. Dr. Ir. Yunizar Ernawati, M.S. sebagai perwakilan Komisi Pendidikan (Program Studi) Manajemen Sumberdaya Perairan yang telah memberikan masukan dan saran pada skripsi ini.
5. PKSPL sebagai institusi penyelenggara penelitian yang telah memberi kesempatan kepada penulis bergabung dalam penelitian ini.
6. Ayahanda Dr. Ir. Benni H. Sormin, MA. dan Ibunda Tirza Pohan, BA. yang memberikan doa, semangat, dukungan sehingga penulisan skripsi ini dapat terselesaikan.
7. Teman-teman TIM BRANTAS (Fajlur Adi Rahman, S.Pi., Dewi Wulandari S.Pi., dan Ridwan Arifin, S.Pi.) atas kerjasama, kekompakan selama penelitian dan penulisan tugas akhir ini.
8. Feridian Elfinurfajri, S.Pi. dan R. Nurdin Sulaksana, S.Pi. sebagai teman seperjuangan menyelesaikan tugas akhir yang telah memberikan masukan-masukan, kritik dan saran yang membangun, serta teman-teman MSP 40 dan MSP 41 atas kekompakan, kepedulian, solidaritas yang telah diberikan selama ini.
Penulis dilahirkan di Bogor, pada tanggal 3 April 1985 dari pasangan Ayahanda Dr. Ir. Benni H. Sormin, MA. dan Ibunda Tirza Pohan, BA. Penulis merupakan putera pertama dari dua bersaudara. Pendidikan formal ditempuh di SD Regina Pacis Bogor (1996), SMP Regina Pacis Bogor (1999), dan SMU Regina Pacis Bogor (2003). Tahun 2003 penulis diterima di Institut Pertanian Bogor melalui jalur SPMB (Seleksi Penerimaan Mahasiswa Baru) dan terdaftar sebagai mahasiswa pada Departemen Manajemen Sumberdaya Perairan (MSP), Fakultas Perikanan dan Ilmu Kelautan (FPIK).
Selama masa perkuliahan penulis aktif menjadi anggota HIMASPER (Himpunan Mahasiswa Manajemen Sumberdaya Perairan), anggota Komisi Kesenian PMK - IPB, mengikuti PORIKAN (Pekan Olahraga Fakultas Perikanan) bidang kesenian, dan membantu mengisi acara wisuda departemen MSP. Untuk menyelesaikan studi pada Departemen MSP, FPIK, penulis menyusun skripsi dengan judul “Dinamika Kandungan Nutrien Anorganik Terlarut secara Spasial dan Temporal pada Perairan Estuari Sungai Porong dan Sungai Wonokromo”. Penulis dinyatakan lulus sidang ujian skripsi pada tanggal 28 Juni 2010.
Halaman DAFTAR TABEL ... aiii
DAFTAR GAMBAR ... aiv
DAFTAR LAMPIRAN ... aviii
1. PENDAHULUAN 1.1. Latar Belakang ... 1 1.2. Perumusan Masalah ... 2 1.3. Tujuan ... 3 1.4. Manfaat ... 3 2. TINJAUAN PUSTAKA 2.1. Sungai Brantas ... 4
2.2. Nutrien (Unsur Hara) ... 4
2.2.1. Nitrogen ... 5
2.2.1.1. Amonia ... 6
2.2.1.2. Nitrit ... 7
2.2.1.3. Nitrat ... 7
2.2.1.4. Nitrogen Inorganik Terlarut / Dissolved Inorganic Nitrogen (DIN) ... 8
2.2.2. Ortofosfat ... 9
2.2.3. Silika ... 10
2.3. Fitoplankton ... 11
2.4. Parameter Fisika, Kimia, dan Biologi Perairan ... 13
2.4.1. Salinitas ... 13
2.4.2. Suhu permukaan ... 14
2.4.3. Kecerahan ... 15
2.4.4. pH ... 15
3. METODE PENELITIAN 3.1. Waktu dan Lokasi Penelitian ... 17
3.2. Alat dan Bahan... 19
3.3. Metode Kerja ... 20
3.3.1. Penentuan lokasi penelitian ... 20
3.3.2. Pengambilan sampel ... 20
3.3.3. Metode analisis data ... 21
3.3.3.1. Uji statistik regresi linear sederhana ... 21
3.3.3.2. Pengelompokan stasiun menggunakan Indeks Canberra ... 22
ii 4. HASIL DAN PEMBAHASAN
4.1. Kandungan Hara Utama di Estuari Sungai Brantas ... 23
4.1.1. Hara nitrat ... 23
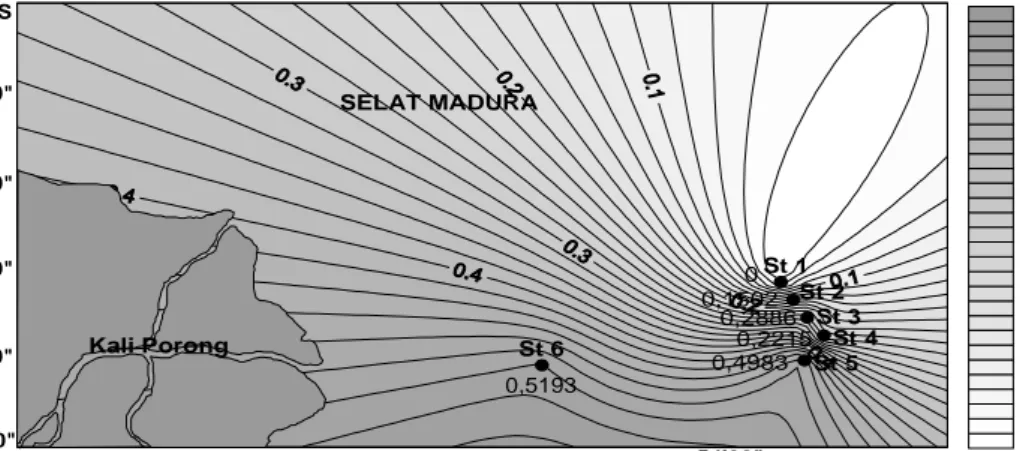
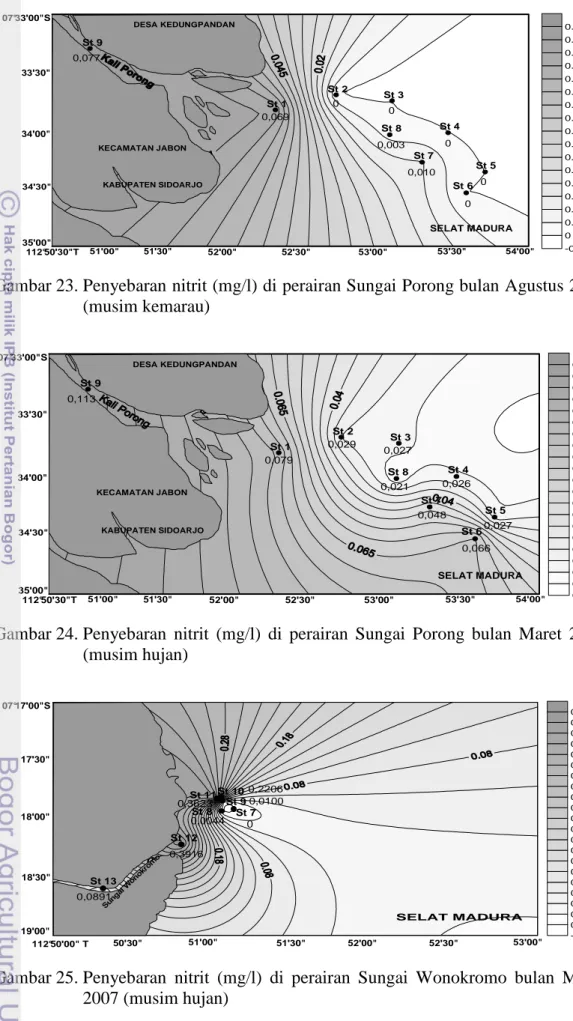
4.1.2. Hara nitrit ... 28
4.1.3. Hara amonia ... 33
4.1.4. Nitrogen inorganik terlarut / Dissolved Inorganic Nitrogen (DIN) ... 38
4.1.5. Hara Ortofosfat ... 41
4.1.6. Hara Silikat ... 44
4.1.7. Keberadaan nutrien yang berkaitan dengan sebaran salinitas ... 49
4.2. Analisa Tingkat Kesamaan Berdasarkan Parameter Fisika dan Kimia Perairan ... 53
4.3. Pembahasan Umum ... 58
4.3.1. Kandungan unsur hara di Estuari Sungai Brantas ... 58
4.3.2. Hubungan antara tingkat konsentrasi nutrien dengan biomassa fitoplankton ... 60
4.3.3. aKajian manajemen ... 68
5. KESIMPULAN DAN SARAN 5.1. Kesimpulan ... 65
5.2. Saran ... 66
Halaman 1. Klasifikasi kesuburan perairan berdasarkan kandungan PO4-P ... 10
Halaman 1. Skema perumusan masalah kandungan nutrien (N, P, dan Si) di estuari
Sungai Brantas, Jawa Timur. ... a2 2. Peta lokasi pengambilan contoh (Jawa Timur) pengamatan bulan
Maret 2007. A: Sungai Porong. B: Sungai Wonokromo. (Google Earth, Google Inc. 2010. Image Terra Metrics, Image DigitalGlobe, Image GeoEye. Data SIO, NOAA, U.S. Navy, NGA, GEBCO) ... 17 3. Peta lokasi pengambilan contoh (Jawa Timur) pengamatan bulan
Agustus 2007 dan Maret 2008. A: Sungai Porong. B: Sungai Wonokromo. (Google Earth, Google Inc. 2010. Image Terra Metrics, Image DigitalGlobe, Image GeoEye. Data SIO,
NOAA, U.S. Navy, NGA, GEBCO) ... 18 4. Peta lokasi pengambilan contoh estuari Sungai Porong bulan Maret 2007
(Bakosurtanal 2000) ... 18 5. Peta lokasi pengambilan contoh estuari Sungai Wonokromo bulan
Maret 2007 (Bakosurtanal 2000) ... 18 6. Peta lokasi pengambilan contoh estuari Sungai Porong bulan
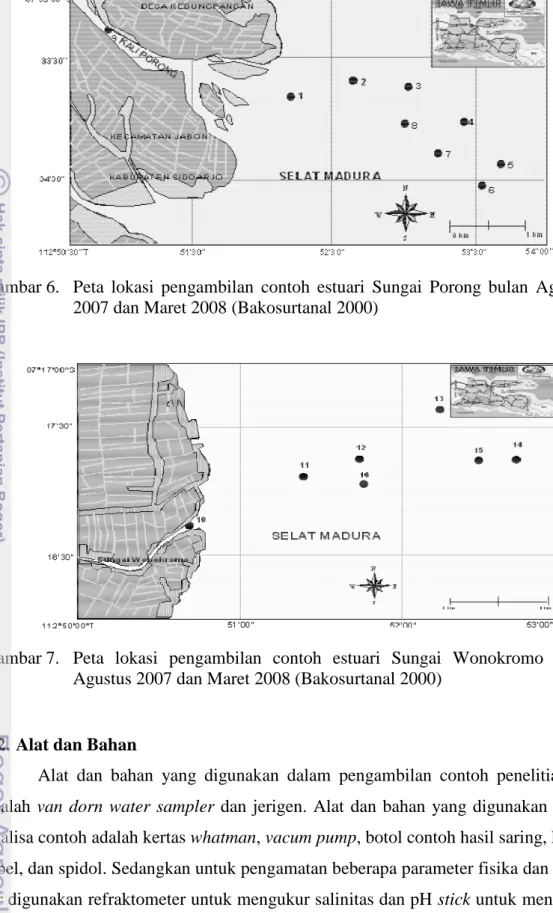
Agustus 2007 dan Maret 2008 (Bakosurtanal 2000) ... 19 7. Peta lokasi pengambilan contoh estuari Sungai Wonokromo bulan
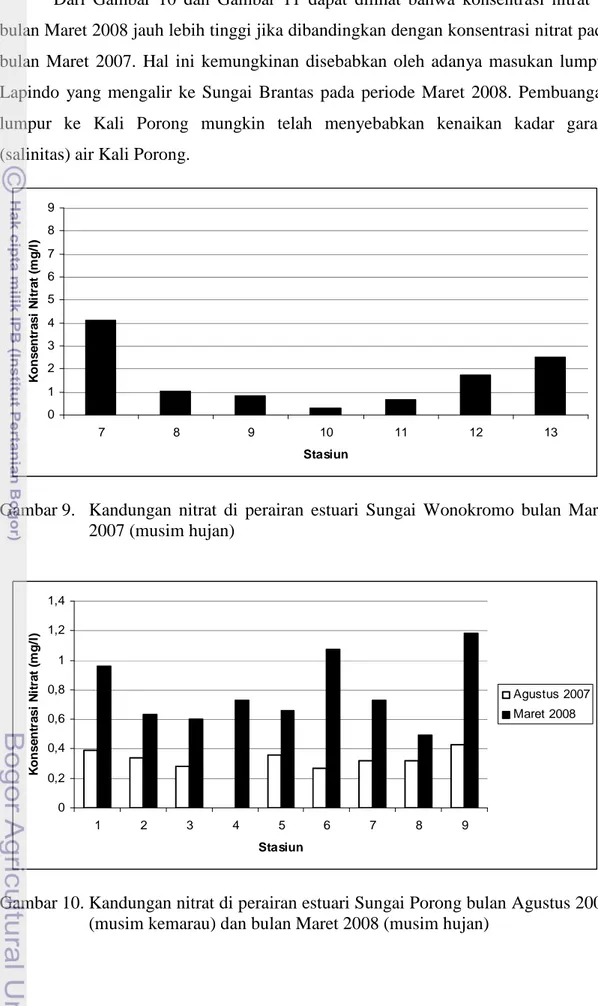
Agustus 2007 dan Maret 2008 (Bakosurtanal 2000) ... 19 8. Kandungan nitrat di perairan estuari Sungai Porong bulan Maret 2007
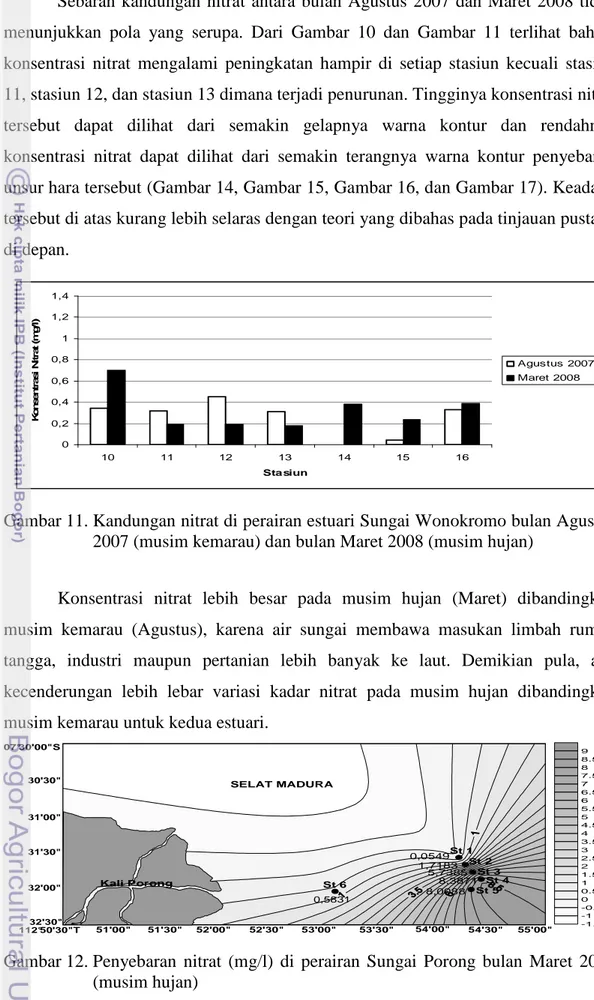
(musim hujan) ... 24 9. Kandungan nitrat di perairan estuari Sungai Wonokromo bulan
Maret 2007 (musim hujan) ... 25 10. Kandungan nitrat di perairan estuari Sungai Porong bulan Agustus 2007
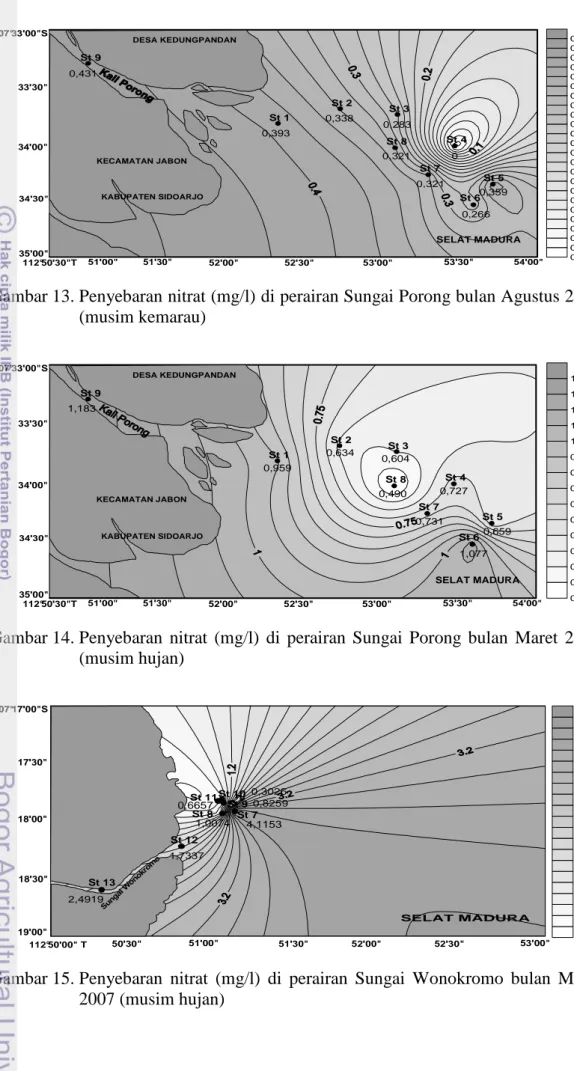
(musim kemarau) dan bulan Maret 2008 (musim hujan) ... 25 11. Kandungan nitrat di perairan estuari Sungai Wonokromo bulan
Agustus 2007 (musim kemarau) dan bulan Maret 2008 (musim hujan) .... 26 12. Penyebaran nitrat (mg/l) di perairan Sungai Porong bulan Maret 2007
(musim hujan) ... 26 13. Penyebaran nitrat (mg/l) di perairan Sungai Porong bulan Agustus 2007
(musim kemarau) ... 27 14. Penyebaran nitrat (mg/l) di perairan Sungai Porong bulan Maret 2008
(musim hujan) ... 27 15. Penyebaran nitrat (mg/l) di perairan Sungai Wonokromo bulan
Maret 2007 (musim hujan) ... 27 16. Penyebaran nitrat (mg/l) di perairan Sungai Wonokromo bulan
v
17. Penyebaran nitrat (mg/l) di perairan Sungai Wonokromo bulan Maret 2008 (musim hujan) ... 28 18. Kandungan nitrit di perairan estuari Sungai Porong bulan Maret 2007
(musim hujan) ... 29 19. Kandungan nitrit di perairan estuari Sungai Wonokromo bulan
Maret 2007 (musim hujan) ... 29 20. Kandungan nitrit di perairan estuari Sungai Porong bulan Agustus 2007
(musim kemarau) dan bulan Maret 2008 (musim hujan) ... 30 21. Kandungan nitrit di perairan estuari Sungai Wonokromo bulan
Agustus 2007 (musim kemarau) dan bulan Maret 2008 (musim hujan) .... 30 22. Penyebaran nitrit (mg/l) di perairan Sungai Porong bulan Maret 2007
(musim hujan) ... 31 23. Penyebaran nitrit (mg/l) di perairan Sungai Porong bulan Agustus 2007
(musim kemarau) ... 32 24. Penyebaran nitrit (mg/l) di perairan Sungai Porong bulan Maret 2008
(musim hujan) ... 32 25. Penyebaran nitrit (mg/l) di perairan Sungai Wonokromo bulan
Maret 2007 (musim hujan) ... 32 26. Penyebaran nitrit (mg/l) di perairan Sungai Wonokromo bulan
Maret 2008 (musim hujan) ... 33 27. Kandungan amonia di perairan estuari Sungai Porong bulan Maret 2007
(musim hujan) ... 34 28. Kandungan amonia di perairan estuari Sungai Wonokromo bulan
Maret 2007 (musim hujan) ... 34 29. Kandungan amonia di perairan estuari Sungai Porong bulan
Agustus 2007 (musim kemarau) dan bulan Maret 2008 (musim hujan) .... 35 30. Kandungan amonia di perairan estuari Sungai Wonokromo bulan
Agustus 2007 (musim kemarau) dan bulan Maret 2008 (musim hujan) .... 35 31. Penyebaran amonia (mg/l) di perairan Sungai Porong bulan Maret 2007
(musim hujan) ... 36 32. Penyebaran amonia (mg/l) di perairan Sungai Porong bulan
Agustus 2007 (musim kemarau) ... 36 33. Penyebaran amonia (mg/l) di perairan Sungai Porong bulan Maret 2008
(musim hujan) ... 37 34. Penyebaran amonia (mg/l) di perairan Sungai Wonokromo bulan
Maret 2007 (musim hujan) ... 37 35. Penyebaran amonia (mg/l) di perairan Sungai Wonokromo bulan
Maret 2007 (musim hujan) ... 37 36. Penyebaran amonia (mg/l) di perairan Sungai Wonokromo bulan
vi
37. Perbandingan total DIN dengan konsentrasi nitrit, nitrat, dan amonia bulan Maret 2007 (musim hujan) ... 38 38. Persentase kontribusi jenis nitrogen di estuari Sungai Brantas bulan
Maret 2007 (musim hujan) ... 39 39. Perbandingan total DIN dengan konsentrasi nitrit, nitrat, dan amonia
bulan Agustus 2007 (musim kemarau) ... 39 40. Persentase kontribusi jenis nitrogen di estuari Sungai Brantas bulan
Agustus 2007 (musim kemarau) ... 40 41. Perbandingan total DIN dengan konsentrasi nitrit, nitrat, dan amonia
bulan Maret 2008 (musim hujan) ... 40 42. Persentase kontribusi jenis nitrogen di estuari Sungai Brantas bulan
Maret 2008 (musim hujan) ... 40 43. Kandungan ortofosfat di perairan estuari Sungai Porong bulan
Maret 2007 (musim hujan) ... 42 44. Kandungan ortofosfat di perairan estuari Sungai Wonokromo bulan
Maret 2007 (musim hujan) ... 42 45. Kandungan ortofosfat di perairan estuari Sungai Porong bulan
Agustus 2007 (musim kemarau) dan bulan Maret 2008 (musim hujan) .... 42 46. Kandungan ortofosfat di perairan estuari Sungai Wonokromo bulan
Agustus 2007 (musim kemarau) dan bulan Maret 2008 (musim hujan) .... 43 47. Penyebaran ortofosfat (mg/l) di perairan Sungai Porong bulan
Maret 2007 (musim hujan) ... 43 48. Penyebaran ortofosfat (mg/l) di perairan Sungai Porong bulan
Maret 2008 (musim hujan) ... 43 49. Penyebaran ortofosfat (mg/l) di perairan Sungai Wonokromo bulan
Maret 2007 (musim hujan) ... 44 50. Penyebaran ortofosfat (mg/l) di perairan Sungai Wonokromo bulan
Maret 2008 (musim hujan) ... 44 51. Kandungan silikat di perairan estuari Sungai Porong bulan Maret 2007
(musim hujan) ... 45 52. Kandungan silikat di perairan estuari Sungai Wonokromo bulan
Maret 2007 (musim hujan) ... 45 53. Kandungan silikat di perairan estuaria Sungai Porong bulan
Agustus 2007 (musim kemarau) dan bulan Maret 2008 (musim hujan) .... 45 54. Kandungan silikat di perairan estuari Sungai Wonokromo bulan
Agustus 2007 (musim kemarau) dan bulan Maret 2008 (musim hujan) .... 46 55. Penyebaran silikat (mg/l) di perairan Sungai Porong bulan Maret 2007
(musim hujan) ... 47 56. Penyebaran silikat (mg/l) di perairan Sungai Porong bulan Agustus 2007
vii
57. Penyebaran silikat (mg/l) di perairan Sungai Porong bulan Maret 2008
(musim hujan) ... 48 58. Penyebaran silikat (mg/l) di perairan Sungai Wonokromo bulan
Maret 2007 (musim hujan) ... 48 59. Penyebaran silikat (mg/l) di perairan Sungai Wonokromo bulan
Agustus 2007 (musim kemarau) ... 48 60. Penyebaran silikat (mg/l) di perairan Sungai Wonokromo bulan
Maret 2008 (musim hujan) ... 49 61. Regresi linear antara salinitas dengan nutrien (nitrat, nitrit, amonia,
ortofosfat, dan silikat) di estuari Sungai Brantas bulan Maret 2007
(musim hujan) ... 51 62. Regresi linear antara salinitas dengan nutrien (nitrat, nitrit, amonia,
ortofosfat, dan silikat) di estuari Sungai Brantas bulan Agustus 2007
(musim kemarau) ... 52 63. Regresi linear antara salinitas dengan nutrien (nitrat, nitrit, amonia,
ortofosfat, dan silikat) di estuari Sungai Brantas bulan Maret 2008
(musim hujan) ... 53 64. Dendrogram pengelompokkan stasiun berdasarkan kesamaan fisika-
kimia di muara Sungai Porong bulan Maret 2007 (musim hujan) ... 54 65. Dendrogram pengelompokkan stasiun berdasarkan kesamaan fisika-
kimia di muara Sungai Wonokromo bulan Maret 2007 (musim hujan) ... 54 66. Dendrogram pengelompokkan stasiun berdasarkan kesamaan fisika-
kimia di muara Sungai Porong bulan Agustus 2007 (musim kemarau) ... 55 67. Dendrogram pengelompokkan stasiun berdasarkan kesamaan fisika-
kimia di muara Sungai Wonokromo bulan Agustus 2007
(musim kemarau) ... 55 68. Dendrogram pengelompokkan stasiun berdasarkan kesamaan fisika-
kimia di muara Sungai Porong bulan Maret 2008 (musim hujan) ... 57 69. Dendrogram pengelompokkan stasiun berdasarkan kesamaan fisika-
kimia di muara Sungai Wonokromo bulan Maret 2008 (musim hujan) ... 58 70. Konsentrasi nilai klorofil-a (µg/l) di permukaan perairan estuari
Sungai Porong bulan Agustus 2007 (musim kemarau) dan bulan Maret 2008 (musim hujan) (Arifin 2009) ... 61 71. Kandungan amonia di perairan estuari Sungai Porong bulan
Agustus 2007 (musim kemarau) dan bulan Maret 2008 (musim hujan) .... 62 72. Konsentrasi nilai klorofil-a (µg/l) di permukaan perairan estuari
Sungai Wonokromo bulan Agustus 2007 (musim kemarau), dan bulan Maret 2008 (musim hujan) (Arifin 2009) ... 62 73. Kandungan amonia di perairan estuari Sungai Wonokromo bulan
Halaman 1. Alat dan bahan ... 72 2. Koordinat stasiun pengambilan sampel ... 73 3. Data parameter biologi, fisika dan kimia perairan estuari Sungai Brantas
pada pengambilan sampel bulan Maret 2007 ... 75 4. Data parameter biologi, fisika dan kimia perairan estuari Sungai Brantas
pada pengambilan sampel bulan Agustus 2007 ... 76 5. Data parameter biologi, fisika dan kimia perairan estuari Sungai Brantas
1.1. Latar Belakang
Sungai Porong dan Sungai Wonokromo merupakan perairan yang terletak di sebelah timur Provinsi Jawa Timur. Kedua sungai ini merupakan delta dari perairan Sungai Brantas. Sungai Porong membatasi Kabupaten Sidoarjo dan Kabupaten Pasuruan. Sungai Porong berhulu di Kota Mojokerto, mengalir ke arah timur dan bermuara di Selat Madura.
Muara Sungai Porong dan muara Sungai Wonokromo adalah termasuk perairan estuari. Keistimewaan lingkungan perairan estuari adalah sebagai penyaring bahan buangan cair yang bersumber dari daratan. Sebagai kawasan yang sangat dekat dengan daerah hunian penduduk, daerah estuari umumnya dijadikan sebagai tempat buangan limbah cair. Limbah cair ini mengandung banyak unsur, diantaranya nutrien dan bahan-bahan kimia lain. Dalam kisaran yang dapat ditolerir, kawasan estuari umumnya bertindak sebagai penyaring limbah cair, mengendapkan partikel-partikel beracun dan menyisakan badan air yang lebih bersih. Suplai air sungai dan laut yang terus menerus dan yang cenderung lebih bersih akan menetralkan sebagian besar bahan polutan yang masuk ke daerah estuari.
Nutrien atau zat hara adalah bahan anorganik hasil penguraian bahan organik oleh detritivor. Unsur hara di perairan merupakan salah satu faktor yang sangat penting bagi kehidupan terutama kehidupan fitoplankton. Beberapa unsur hara utama yang berperan dalam pertumbuhan plankton adalah nitrogen, fosfor dan silikat. Tingginya kadar hara, terutama fosfat, nitrat, dan silikat di permukaan perairan dipadukan dengan intensitas cahaya matahari yang tinggi akan memacu laju fotosintesis fitoplankton (plankton nabati). Masukan limbah domestik, pertanian, dan industri ke sungai akan meningkatkan kadar nutrien, terutama N (nitrogen), P (fosfor), dan Si (silikat). Peningkatan nutrien tersebut akan mempercepat proses eutrofikasi dan berpotensi mengganggu proses ekologis perairan dan menurunkan nilai guna dari perairan. Dinamika dari nutrien menjadi faktor pembatas bagi biota yang hidup di perairan (Hillman et al. 1989; Hemminga et al. 1991; Erftemeijer 1992; Erftemeijer et al. 1994 in Efriyeldi 2003). Untuk mengetahui kondisi perairan
tersebut perlu dilakukan pengamatan terhadap kandungan nutrien anorganik terlarut secara spasial dan temporal.
1.2. Perumusan Masalah
Sungai Porong dan Sungai Wonokromo merupakan delta Sungai Brantas. Adanya perbedaan dari kedua lokasi ini dapat mencirikan karakteristik sebaran nutrien yang berbeda pula. Masukan unsur hara ke dalam aliran sungai yang berasal dari proses alami (erosi, fiksasi dari atmosfer, buangan sisa metabolisme hewan, dan dekomposisi bahan organik oleh bakteri) serta proses non alami, yakni kegiatan manusia (industri, kegiatan rumah tangga, pertanian, perikanan, dan pariwisata) dari waktu ke waktu akan meningkatkan nutrien N, P, dan Si. Pengayaan nutrien ini disebabkan oleh adanya dekomposisi bahan organik menjadi bahan anorganik (unsur hara/nutrien) oleh detritivor.
Secara sederhana, perumusan masalah kandungan nutrien (N, P, dan Si) di Estuari Sungai Brantas, Jawa Timur dikaitkan dengan indikator kesuburan dan pengelolaan perairan disajikan pada skema berikut pada Gambar 1.
Gambar 1. Skema perumusan masalah kandungan nutrien (N, P, dan Si) di estuari Sungai Brantas, Jawa Timur.
Masukan unsur hara
Proses alami
Keberadaan unsur hara
Sebaran N, P, dan Si
INDIKATOR KESUBURAN Proses non alami
Parameter Fisika
Parameter Biologi Parameter Kimia
Keberadaan nutrien tersebut di perairan berpotensi dimanfaatkan untuk pertumbuhan fitoplankton. Proses pemanfaatan ini akan mempengaruhi keberadaan unsur hara di perairan. Selain itu, faktor-faktor fisika dan kimia perairan juga berpotensi mempengaruhi keberadaan nutrien di perairan. Keberadaan nutrien yang berlebihan dapat menyebabkan terjadinya eutrofikasi atau peningkatan kesuburan perairan sehingga kualitas perairan menurun. Demikian pula jika perairan mengalami kekurangan nutrien, akan mengakibatkan terganggunya keseimbangan ekosistem perairan. Oleh karena itu, keberadaan nutrien sangat penting bagi keberlangsungan proses ekologi di perairan tersebut.
1.3. Tujuan
Penelitian ini bertujuan untuk mengetahui sebaran kandungan nutrien anorganik terlarut (nitrat, nitrit, amonia, ortofosfat dan silikat) pada kedua perairan estuari (Sungai Porong dan Sungai Wonokromo) dalam rentang waktu Maret 2007 - Maret 2008 yang mencakup variabilitas spasial dan temporal. Setelah diketahui sebaran nutrien ini, maka aspek pengelolaan sumberdaya air menjadi lebih jelas dilihat dari sudut pandang eutrofikasi perairan.
1.4. Manfaat
Penelitian ini diharapkan dapat menghasilkan informasi ilmiah tentang dinamika nutrien di sebuah estuari tropis (Estuari Sungai Porong dan Sungai Wonokromo) secara temporal maupun spasial karena penelitian ini mewakili variabilitas musim yaitu musim hujan dan kemarau dengan pengamatan lapangan pada beberapa stasiun yang letaknya tersebar. Hasil penelitian dapat menjadi acuan dalam pengelolaan Sungai Brantas secara umum, maupun pengelolaan Sungai Porong dan Sungai Sidoarjo secara khusus oleh pihak terkait baik oleh pemerintah daerah maupun lembaga-lembaga/perusahaan maupun LSM peneliti lingkungan.
2.1. Sungai Brantas
Sungai Brantas berada di Provinsi Jawa Timur dengan panjang 320 km pada daerah aliran sungai seluas 11.050 km2 yang merupakan sungai kedua terbesar di Pulau Jawa. Daerah aliran sungainya mencakup 5 kotamadya, 11 kabupaten dan 33 kecamatan. Sungai Brantas merupakan sungai terpanjang di Jawa Timur dengan luas kurang lebih seperempat luas wilayah Provinsi Jawa Timur.
Kurang lebih sekitar 40 km di sebelah barat Kota Surabaya, Sungai Brantas bercabang menjadi dua, ke arah timur laut mengalir Sungai Wonokromo dan ke arah timur mengalir Sungai Porong. Sungai Brantas mengalir mulai dari Sumber Brantas, Desa Tulungrejo, Kecamatan Bumiaji, dan Kabupaten Malang. Lokasi tersebut terletak di Gunung Arjuno dan Anjasmara.
Curah hujan pada wilayah itu sekitar 1860 mm/tahun dengan presipitasi sekitar 25 mm/bulan pada musim kemarau dan puncaknya 350 mm/bulan pada bulan Januari dan Februari.Selama musim hujan ketika hampir 80% air yang disuplai dari Sungai Brantas dialihkan ke Porong, rata-rata debit sungai sekitar 600 m3/detik dan dapat mencapai 1200 m3/detik pada musim hujan yang ekstrim (Jennerjahn et al. 2004).
2.2. Nutrien (Unsur Hara)
N (nitrogen) dan P (fosfor) merupakan unsur hara yang tergolong ke dalam unsur hara mayor karena dibutuhkan dalam jumlah banyak sehingga bila kekurangan maka proses biologi akan terhambat (Ward 1988). Unsur hara N dan P merupakan faktor pembatas pertumbuhan fitoplankton di perairan alami, bila dalam jumlah yang berlebih maka keduanya bisa menjadi penentu terjadinya pertumbuhan fitoplankton yang sangat pesat (blooming) (Henderson-Seller dan Markley 1987). Senyawa fosfat dan nitrat merupakan unsur hara yang dapat dijadikan sebagai petunjuk kesuburan perairan dan dibutuhkan organisme fitoplankton dalam pertumbuhan dan perkembangan hidupnya (Nybakken 1982).
Reid (1961) menyatakan bahwa aktivitas unsur-unsur hara dan proses-proses pada siklus nutrien di estuari tidak jauh berbeda dengan yang terjadi di air tawar.
Organisme yang terlibat seperti fitoplankton, hewan, dan bakteri mungkin berbeda jenisnya tetapi mereka memainkan fungsi ekologis yang sama dengan organisme di air tawar. Estuari dapat mengandung konsentrasi yang sangat besar dari nutrien tertentu dibandingkan dengan laut lepas dikarenakan tingginya masukan dari sumber-sumbernya di daratan.
2.2.1. Nitrogen
Nitrogen adalah salah satu dari empat elemen penting (karbon, oksigen, hidrogen, dan nitrogen) yang merupakan bentuk struktur dasar dari protein. Umumnya nitrogen dalam perairan berada dalam bentuk gas N2 karena air
permukaan secara terus menerus berhubungan dengan atmosfir yang mengandung 80% N2 dari gas secara keseluruhan (Novotny dan Olem 1994).
Di perairan, nitrogen berupa nitrogen anorganik dan organik. Nitrogen anorganik terdiri atas amonia terlarut (NH3), senyawa amonium (NH4+), nitrit (NO2),
nitrat (NO3), dan molekul nitrogen (N2) dalam bentuk gas. Nitrogen organik berupa
protein, asam amino dan urea. Senyawa nitrogen tersebut sangat dipengaruhi oleh kandungan oksigen bebas dalam air. Pada saat kadar oksigen rendah dalam air, nitrogen akan cenderung berubah menjadi amonia, sedangkan pada saat oksigen tinggi nitrogen akan bergerak menuju nitrat (Hutagalung dan Rozak 1997).
Nitrogen harus mengalami fiksasi terlebih dahulu menjadi NH3, NH4+, dan
NO3- kemudian dimanfaatkan oleh tumbuhan. Beberapa organisme akuatik dapat
memanfaatkan nitrogen dalam bentuk gas, akan tetapi sumber utama nitrogen di perairan bukanlah dalam bentuk gas (Novotny dan Olem 1994).
Secara umum siklus nitrogen dikendalikan oleh proses mikrobiologi yaitu nitrifikasi, denitrifikasi, dan fiksasi molekul nitrogen, berbeda dengan siklus fosfor yang dipengaruhi oleh faktor fisika-kimia (Cole 1988). Siklus nitrogen di perairan estuari melibatkan sejumlah proses yang terjadi di kolom air dan sedimen dasar perairan. Pengambilan, remineralisasi, dan oksidasi nitrogen terjadi di kolom perairan sedangkan pada sedimen terjadi penenggelaman remineralisasi, pengambilan oleh organisme, oksidasi, reduksi dan denitrifikasi (Kennish 1990).
Nitrat dan amonia merupakan sumber nitrogen utama di perairan. Kadar nitrat dalam perairan yang tidak tercemar biasanya lebih tinggi dari amonium. Amonia dan garam-garamnya bersifat mudah larut dalam air. Ion amonium adalah
bentuk transisi dari amonia. Proses ini dikenal dengan amonifikasi. Reaksi amonifikasi di perairan (Novotny dan Olem 1994) adalah sebagai berikut:
N Organik + O2 NH3-N+ O2 NO2-N + O2 NO3-N
Di perairan, kadar nitrit jarang melebihi 1 mg/l (Sawyer dan McCarty in Effendi 2003). Kadar nitrit yang lebih dari 0,05 mg/1 dapat bersifat toksik bagi organisme perairan yang sangat sensitif (Moore in Effendi 2003). Menurut Hutagalung dan Rozak (1997) sebagaimana nitrat, distribusi vertikal nitrit di laut menunjukkan semakin dalam titik pengamatan di dalam perairan maka kadar nitrit semakin tinggi, dan secara horizontal menunjukkan kadar nitrit bertambah tinggi menuju ke arah pantai dan muara sungai.
2.2.1.1. Amonia
Amonia merupakan bentuk nitrogen yang dapat langsung dimanfaatkan fitoplankton untuk mensintesa asam amino (Kennish 1990). Amonia (NH3) dan
garam-garamnya bersifat mudah larut dalam air. Sumber amonia di perairan adalah hasil pemecahan nitrogen organik (protein dan urea) dan nitrogen anorganik yang terdapat di dalam tanah dan air yang berasal dari dekomposisi bahan organik (tumbuhan dan biota akuatik yang telah mati) oleh mikroba dan jamur (Effendi 2003).
Amonia-nitrogen dalam air berasal dari reduksi nitrit oleh bakteri dan hasil ekskresi organisme (Boyd 1982). Amonia yang terukur di perairan merupakan kadar amonia total (NH3 dan NH4+). Di perairan alami, pada suhu dan tekanan normal
amonia berada dalam bentuk gas dan membentuk kesetimbangan dengan amonium. Kesetimbangan antara gas amonia dan amonium ditunjukkan dalam persamaan reaksi:
NH3 + H2O NH4+ + OH
Persentase amonia bebas meningkat dengan meningkatnya pH, oksigen terlarut dan suhu perairan. Pada pH 7 atau kurang sebagian besar amonia mengalami ionisasi. Pada kondisi kadar oksigen terlarut yang rendah toksisitas amonia semakin meningkat dengan meningkatnya pH dan suhu perairan (Effendi 2003). Kehadiran amonia di perairan merupakan petunjuk adanya penguraian bahan organik terutama protein. Kadar amonia yang tinggi dapat merupakan indikasi
pencemaran bahan organik yang berasal dari limbah domestik, industri, maupun limpasan pupuk pertanian. Toksisitas amonia terhadap organisme akan meningkat jika terjadi penurunan kadar oksigen terlarut, pH dan suhu (Effendi 2003). Kadar amonia pada perairan alami biasanya kurang dari 0,1 mg/1 (McNeely et al. in Effendi 2003), dan ambang batas konsentrasi amonia total untuk kehidupan biota laut sebaiknya tidak lebih dari 0,3 mg/1 (Keputusan Menteri Negara Lingkungan Hidup No. 51 Th. 2004 tentang baku mutu air laut, Lampiran III untuk biota laut).
2.2.1.2. Nitrit
Nitrit merupakan bentuk peralihan antara amonia dan nitrat (nitrifikasi) dan antara nitrat dan gas nitrogen (denitrifikasi) (Ruttner 1965). Nitrit biasanya ditemukan dalam jumlah sedikit di perairan, bersifat tidak stabil jika terdapat oksigen. Keberadaan nitrit menggambarkan berlangsungnya proses biologis dari perombakan bahan organik dengan kadar oksigen terlarut sangat rendah. Sumber nitrit dapat berupa limbah industri dan domestik (Effendi 2003).
Di perairan alami, keadaan nitrat, nitrit dan amonia merupakan rangkaian unsur hara yang tidak dapat dipisahkan. Dari ketiga bentuk tersebut nitrit berada dalam keadaan yang labil, artinya nitrit merupakan bentuk sementara dalam proses oksidasi antara amonia dan nitrat (Devlin 1969). Menurut Novotny dan Olem (1994) konsentrasi nitrit yang terakumulasi pada saat nitrifikasi sangat sedikit, hal ini dikarenakan reaksi terakhir, dimana perubahan NO2- menjadi NO3- lebih cepat
dibandingkan perubahan NH4+ menjadi NO2-.
2.2.1.3. Nitrat
Nitrat adalah bentuk utama nitrogen di perairan alami dan merupakan unsur hara utama bagi pertumbuhan tanaman dan algae. Nitrat-nitrogen sangat mudah larut dalam air dan bersifat stabil, dihasilkan dari proses oksidasi sempurna senyawa nitrogen di perairan (Effendi, 2003). Bentuk senyawa nitrogen yang paling dominan adalah ion nitrat (NO3-).
Menurut Hutagalung dan Rozak (1997) distribusi vertikal nitrat di laut menunjukkan bahwa semakin dalam titik pengamatan di perairan maka kadar nitrat semakin tinggi sedangkan secara distribusi horizontal kadar nitrat dalam air laut akan semakin tinggi menuju pantai, dan kadar tertinggi biasa ditemukan di perairan muara.
Peningkatan kadar nitrat di laut disebabkan oleh masuknya limbah domestik atau pertanian yang umumnya banyak mengandung nitrat. Konsentrasi nitrat di suatu perairan dipengaruhi oleh proses nitrifikasi. Proses nitrifikasi tersebut di atas dipengaruhi oleh beberapa faktor, yaitu kadar oksigen terlarut, pH, bakteri nitrifikasi, dan suhu (Novotny dan Olem 1994).
Konsentrasi nitrat di suatu perairan dikontrol dalam proses nitrifikasi, yang merupakan proses oksidasi senyawa amonia dalam kondisi aerob oleh bakteri autotorof. Dalam keadaan terdapat oksigen, unsur amonia akan diubah oleh bakteri
Nitrosomonas menjadi nitrit dan oleh bakteri nitrobacter menjadi nitrat.
Proses reaksi nitrifikasi adalah sebagai berikut (Ruttner 1965): 2NH3 + 3O2 Nitrosomonas 2NO2- + 2H+ + 2H2O
2NO2- + O2 Nitrobacter 2NO3
Kadar nitrat di perairan yang tidak tercemar biasanya lebih tinggi dari kadar amonium. Kadar nitrat-nitrogen pada perairan alami hampir tidak pernah lebih dari 0,1 mg/l. Kadar nitrat-nitrogen yang lebih dari 0,2 mg/l dapat mengakibatkan terjadinya eutrofikasi perairan yang selanjutnya menstimulir pertumbuhan fitoplankton dan tumbuhan secara pesat (Effendi 2003). Kandungan nitrat yang optimum untuk pertumbuhan fitoplankton berkisar antara 0,9 - 3,5 mg/l dan akan menjadi faktor pembatas apabila kurang dari 0,144 mg/l (Chu 1943 in Kennish 1990).
2.2.1.4. Nitrogen inorganik terlarut / Dissolved Inorganik Nitrogen (DIN) DIN merupakan penjumlahan dari konsentrasi nitrat, nitrit, dan amonia (Damar 2003). Kadar nitrat melebihi lebih dari 5 ppm menggambarkan terjadinya pencemaran antropogenik yang berasal dari aktivitas manusia dan tinja hewan (Effendi 2003). Kadar nitrat lebih dari 0,2 ppm dapat mengakibatkan terjadinya eutrofikasi (pengayaan) perairan, yang selanjutnya menstimulir pertumbuhan algae dan tumbuhan air secara pesat (blooming). Blair et al. (1999) in Damar (2003) mengemukakan bahwa nitrat yang tinggi dapat dijadikan indikator pencemaran dari limbah pertanian.
2.2.2. Ortofosfat
Fosfor merupakan salah satu unsur esensial dalam pembentukan sel protein, metabolisme sel organisme dan produktivitas perairan. Dalam perairan, unsur fosfor terdapat dalam bentuk senyawa anorganik, yaitu ortofosfat (PO43-), metafosfat
(P3O43+), dan polifosfat (P3O93-) serta dalam bentuk organik yaitu di dalam tubuh
organisme (Ruttner 1965). Kira-kira 10% dari fosfat anorganik terdapat sebagai ion PO43- dan sebagian besar (90%) dalam bentuk HPO4 (Hutagalung dan Rozak 1997).
Fosfat merupakan bentuk fosfor yang dapat dimanfaatkan oleh tumbuhan. Menurut Moriber (1974), senyawa fosfat dalam perairan dapat berasal dari sumber alami seperti erosi tanah, buangan dari hewan lapuk dan tumbuhan.
Ortofosfat merupakan bentuk fosfor yang dapat dimanfaatkan secara langsung oleh tumbuhan akuatik, sedangkan polifosfat harus mengalami hidrolisis membentuk ortofosfat terlebih dahulu sebelum dapat dimanfaatkan oleh tumbuhan akuatik sebagai sumber fosfor. Setelah masuk ke dalam tumbuhan, misalnya fitoplankton, fosfat anorganik mengalami perubahan menjadi organofosfat. Fosfat yang berkaitan dengan ferri (Fe2(PO4)3) bersifat tidak larut dan mengendap di dasar
perairan. Pada saat terjadi kondisi anaerob ferri mengalami reduksi menjadi ferro, ion besi valensi dua (ferro) bersifat larut dan melepaskan fosfat ke perairan, sehingga meningkatkan keberadaan fosfat di perairan (Brown in Effendi 2003).
Keberadaan polifosfat di daerah pantai dan sungai banyak yang berasal dari limbah deterjen yang terdegradasi dan menghasilkan ortofosfat, sedangkan berbagai bentuk fosfor di laut dikendalikan oleh proses biologi dan fisika (Ruttner 1965). Menurut Susana (1989) in Kabul (2000) senyawa fosfor dalam perairan dapat berasal dari sumber alami seperti erosi tanah, buangan dari hewan dan pelapukan tumbuhan serta limbah industri, pertanian dan domestik.
Senyawa fosfor organik terdapat dalam bentuk asam nukleat, fosfolipid, gula phosphate dan senyawa lainnya (Saeni 1989). Sedangkan senyawa fosfor anorganik yang terlarut di dalam air hanya terdiri dari ion-ion ortofosfat. Selain larut dalam air, ortofosfat juga larut dalam asam lemak yang dapat langsung dimanfaatkan dan mudah diserap oleh organisme nabati (mikro dan makrofita) sehingga kandungan ortofosfat yang terlarut dalam air dapat menunjukkan kesuburan perairan (Lund 1971 in Wardoyo 1981).
Hutagalung dan Rozak (1997) mengatakan bahwa secara umum kandungan fosfat meningkat terhadap kedalaman perairan. Kandungan fosfat yang rendah dijumpai di permukaan perairan dan kandungan fosfat yang lebih tinggi ditemukan pada perairan yang lebih dalam. Bentuk fosfor yang lepas ke dalam ekosistem laut dangkal cenderung berupa endapan dan yang ke laut lepas berupa deposit. Bilamana jumlah fosfat yang lepas ke dalam laut cukup banyak, maka sebagian akan diendapkan dalam sedimen-sedimen dangkal dan sebagian lagi hilang dalam sedimen-sedimen dalam (Odum 1971).
Senyawa ortofosfat merupakan faktor pembatas bila kadarnya di bawah 0,009 mg/1, sementara pada kadar lebih dari 1 mg/1 PO4-P dapat menimbulkan
blooming (Effendi 2003). Keputusan Menteri Negara Lingkungan Hidup No. 51 Th.
2004 tentang baku mutu air laut, Lampiran III untuk biota laut, menetapkan baku mutu PO4-P untuk kehidupan biota laut sebesar 0,015 mg/1. Pada Tabel 1 disajikan
klasifikasi kesuburan perairan berdasarkan kandungan ortofosfat.
Tabel 1.Klasifikasi kesuburan perairan berdasarkan kandungan PO4-P (Yoshimura
1969 in Anggoro 2002).
Kisaran nilai Satuan Tingkat kesuburan
0,000-0,020 mg/l Kesuburan rendah
0,021-0,050 mg/l Kesuburan sedang
0,051-0,100 mg/l Kesuburan tinggi
> 0,210 mg/l Kesuburan sangat tinggi
Menurut Effendi (2003), semua polifosfat mengalami hidrolisis membentuk ortofosfat. Perubahan ini tergantung pada suhu. Pada suhu yang mendekati titik didih, perubahan polifosfat menjadi ortofosfat berlangsung cepat. Kecepatan ini meningkat dengan menurunnya nilai pH.
2.2.3. Silika
Silika atau silikon (Si) merupakan salah satu unsur yang berlimpah pada kerak bumi. Bentuk silika yang umum adalah Silikat (SiO2) (Effendi 2003). Silika
umumnya berbentuk elemen bebas di alam tetapi berikatan dengan oksigen dan elemen lain, sebagai silika dioksida (SiO2). Silikat dalam laut ditemukan dalam
1973). Silikat di laut rata-rata 50% dalam bentuk anorganik dan sisanya kebanyakan menjadi kalsium karbonat (CaCO3). Ion silikat dari silika dioksida terdapat di air
laut, tubuh diatom, dan organisme hidup lainnya serta mineral-mineral tanah liat (Riley dan Skirrow 1975 in Defid 2008).
Kedalaman atau lokasi suatu perairan menjadi faktor penyebaran unsur silikat. Pada perairan pantai, umumnya kadar silikat terlarut tinggi daripada perairan lepas pantai sebagai akibat limpasan dari daratan. Kadar silikat meningkat dengan bertambahnya kedalaman (Sidjabat 1973). Keberadaan silikat di perairan laut berhubungan erat dengan kehadiran fitoplankton.
Kandungan silikat yang rendah di permukaan diakibatkan karena adanya aktivitas biologi dari diatom dan radiolaria. Kandungan silikat yang berasal dari sungai akan turun di laut terbuka karena adanya pertumbuhan diatom, interaksi dengan bahan-bahan lain, dan mengendapnya partikel silikat di pinggir sungai. Banyak partikel silikat berasal dari sungai yang diendapkan di pinggir sungai (Millero dan Sohn 1991).
Raymont (1963) menyatakan bahwa kadar silikat yang tinggi di lepas pantai terjadi akibat adanya turbulensi air ke lapisan permukaan sehingga kadarnya dapat berkisar antara 1-15 mg/l. Konsentrasi rata-rata dari silikat terlarut di laut kurang lebih 1 mg/l, tetapi kandungan silikat dapat berubah dari rendah di permukaan lautan atau laut dangkal hingga sekitar 4 mg/l di laut dalam. Penurunan kadar silikat di laut dapat disebabkan oleh cepatnya pemanfaatan silikat oleh diatom untuk membentuk cangkang. Air laut mengalami kejenuhan ketika kelarutan silikat memiliki konsentrasi sekitar 50 mg/l (Grasshoff et al. 1983).
2.3. Fitoplankton
Fitoplankton adalah mikro-organisme atau tumbuhan mikroskopis yang melayang-layang di dalam air, mempunyai klorofil dan mampu berfotosintesis (Odum 1971). Fitoplankton tumbuh subur pada perairan sekitar muara sungai atau perairan lepas pantai. Di kedua lokasi tersebut biasanya terjadi proses penyuburan karena masuknya unsur hara. Unsur hara tersebut digunakan fitoplankton untuk proses metabolisme tubuh, dimana fitoplankton menggunakan unsur hara sebagai bahan dasarnya. Oleh karena itu kehadiran fitoplankton dapat menjadi salah satu penyebab hilangnya unsur hara di dalam kolam air. Menurut Devlin (1969), cahaya,
ketersediaan unsur hara, dan turbulensi adalah faktor utama yang paling mempengaruhi kehidupan dan produktivitas fitoplankton.
Proses fotosintesis adalah proses kimiawi yang cukup rumit dan kompleks. Secara ringkas proses tersebut dapat dinyatakan sebagai berikut (Devlin 1969):
6CO2 + 6H2O C6H12O6 + H2O
Keberadaan fitoplankton mempengaruhi proses regenerasi unsur hara karena fitoplankton yang mati akan mengalami dekomposisi sehingga akan menghasilkan unsur hara kembali.
Biomassa fitoplankton dicerminkan sebagai bobot fitoplankton per unit volume atau luas area air. Satuan yang umum digunakan untuk itu adalah µg/l, mg/m2, kg/hektar, atau sejenisnya dimana berat harus jelas apakah berat kering, basah atau karbon (Parsons et al. 1984). Biomassa dapat diukur dengan menggunakan beberapa metode, diantaranya metode POC (Particulate Organic
Matter), metode ATP (Adenosine Triphosphate), metode klorofil-a dan
pigmen-pigmen fotosintesis lainnya, serta metode Optical density.
Penentuan biomassa fitoplankton dengan metode klorofil-a mempunyai beberapa keuntungan (ourlake.org 2001), yaitu: (1) pengukuran relatif sederhana dan langsung; (2) menggabungkan semua tipe dan umur sel; (3) menunjukkan tingkat kelangsungan hidup dari sel; dan (4) dapat dihubungkan secara kuantitatif dengan karakteristik optik yang penting dari perairan.
Klorofil-a merupakan pigmen yang paling umum terdapat pada fitoplankton sehingga konsentrasi fitoplankton sering dinyatakan dalam konsentrasi klorofil-a. Konsentrasi klorofil-a di perairan dapat mewakili biomassa dari algae atau fitoplankton (Reynold 1990). Menurut Arinardi (1996), tinggi rendahnya konsentrasi klorofil-a fitoplankton dapat digunakan sebagai petunjuk kelimpahan sel fitoplankton dan juga potensi organik di suatu perairan. Klorofil-a digunakan sebagai indikator dari kelimpahan fitoplankton, sementara kelimpahan fitoplankton berhubungan dengan siklus alami dari ketersediaan nutrien dan dengan input nitrat dan fosfat (omp.gso.uri.edu 2010). Kualitas perairan yang baik merupakan tempat hidup baik bagi fitoplankton, karena kandungan klorofil-a fitoplankton itu sendiri dapat dijadikan indikator tinggi rendahnya produktivitas suatu perairan (Ardiwijaya 2002).
Klorofil Sinar Matahari
Nilai rata-rata konsentrasi klorofil-a fitoplankton untuk seluruh perairan Indonesia adalah sebesar 0,19 mg/m3. Nilai rata-rata selama musim timur adalah sebesar 0,24 mg/m3, sedikit lebih besar daripada kandungan klorofil-a pada musim barat yaitu 0,16 mg/m3 (Nontji 1974 in Arinardi 1996).
2.4. Parameter Fisika, Kimia, dan Biologi Perairan 2.4.1. Salinitas
Salinitas menggambarkan tingkat kandungan garam terlarut di dalam air. Salinitas mencerminkan tingkat kandungan garam-garam terlarut dalam satu kilogram air laut dan dinyatakan dalam satuan perseribu (ppt) (Nybakken 1982). Menurut Nontji (1987), natrium klorida (NaCl) adalah jenis garam paling utama di dalam air laut. Selain itu terdapat pula garam-garam magnesium, kalsium, dan sebagainya.
Menurut Nontji (1987), pola sebaran salinitas perairan dipengaruhi oleh pola sirkulasi, evaporasi (penguapan), curah hujan, dan aliran sungai. Salinitas air laut mempunyai hubungan yang erat dengan proses evaporasi. Bila proses evaporasi tinggi, maka salinitas di perairan juga tinggi karena adanya garam-garam yang terkonsentrasi. Salinitas air laut pada umumnya akan turun apabila curah hujan tinggi.
Pada lingkungan pesisir, fluktuasi salinitas merupakan hal yang umum terjadi. Kondisi tersebut dipengaruhi oleh musim, topografi estuari, pasang surut dan jumlah air tawar yang mengalir ke dalam perairan pesisir. Masukan air tawar dari sungai mempengaruhi distribusi salinitas pada perairan pantai dan muara. Apabila bagian hulu sungai di sekitar pantai mendapatkan banyak bahan organik atau limbah, maka masukan air sungai juga membawa unsur hara. Salinitas juga dapat memperlihatkan pola arus yang bergerak menuju daerah perairan sehingga salinitas dapat mempengaruhi pola penyebaran kandungan unsur hara di laut (Nontji 1987).
Salinitas memiliki pengaruh besar pada kehidupan organisme. Salinitas merupakan salah satu pembatas ekologi air laut, karena beberapa organisme dapat bertahan dengan perubahan salinitas yang besar (euryhaline) tetapi ada juga yang hanya mampu bertahan pada kisaran salinitas yang sempit (stenohaline).
Perairan yang mengalami tingkat curah hujan tinggi atau yang dipengaruhi oleh aliran sungai memiliki salinitas yang rendah sedangkan perairan yang memiliki
penguapan yang tinggi, salinitas perairannya juga tinggi. Selain itu pola sirkulasi juga berperan dalam penyebaran salinitas di suatu perairan (dhamadharma.wordpress.com 2010). Tingkat konsentrasi nutrien berbanding terbalik dengan tingkat salinitas. Semakin besar kandungan nutrien yang terdapat dalam suatu perairan, maka semakin rendah salinitasnya. Demikian pula sebaliknya, semakin rendah konsentrasi nutrient dalam suatu perairan, maka semakin tinggi salinitasnya.
2.4.2. Suhu Permukaan
Suhu merupakan salah satu faktor penting dalam perairan yang berpengaruh langsung maupun tidak langsung terhadap aktivitas dan kehidupan di suatu perairan. Suhu berpengaruh langsung dalam proses fisiologi hewan, khususnya proses metabolisme dan siklus reproduksi. Secara tidak langsung, suhu dapat mempengaruhi keberadaan unsur hara di laut melalui proses upwelling (Novotny dan Olem 1994).
Peningkatan suhu perairan menyebabkan penurunan konsentrasi oksigen terlarut di perairan, yang akhirnya akan mempengaruhi kehidupan organisme perairan sehingga daya larut oksigen di perairan seringkali tidak mampu memenuhi ketersediaan oksigen terlarut yang dibutuhkan untuk metabolisme dan respirasi.
Perubahan suhu secara tiba-tiba akan menyebabkan kematian organisme akuatik (Moriber 1974). Effendi (2003) mengemukakan bahwa peningkatan suhu akan meningkatkan laju metabolisme, karena setiap kenaikan suhu sebesar 10°C akan menyebabkan kebutuhan oksigen biota laut naik hampir dua kali lipat. Setiap peningkatan konsumsi oksigen akan meningkatkan laju dekomposisi dan mempengaruhi proses regenerasi unsur hara. Suhu optimum bagi pertumbuhan fitoplankton terjadi antara selang 25-40°C (Reynols 1990). Faktor suhu merupakan salah satu variabel lingkungan yang secara tidak langsung mempengaruhi kandungan unsur hara di laut.
Suhu air sangat dipengaruhi oleh intensitas sinar matahari yang jatuh ke permukaan air, yang sebagian dipantulkan kembali ke atmosfir dan sebagian masuk ke perairan dan disimpan dalam bentuk energi (Welch 1952). Menurut Nontji (1987) suhu air di permukaan dipengaruhi oleh kondisi meteorologi antara lain curah hujan, penguapan, kelembaban udara, kecepatan angin, dan intensitas radiasi sinar
matahari. Menurut Effendi (2003), suhu air dipengaruhi oleh musim, posisi geografis (lintang atau latitude), ketinggian dari permukaan air laut (altitude), waktu dalam hari, sirkulasi udara, penutupan awan, dan aliran serta kedalaman badan air.
2.4.3. Kecerahan
Kecerahan merupakan parameter fisika yang menggambarkan ukuran transparansi dan sifat optik terhadap transmisi cahaya (Effendi 2003). Tingkat kecerahan perairan dapat diamati secara visual dengan bantuan alat Secchi disc (Basmi 1995). Keadaam cuaca, waktu pengukuran, kekeruhan, dan padatan tersuspensi merupakan faktor utama yang mempengaruhi nilai kecerahan. Semakin besar nilai kekeruhan dan padatan tersuspensi maka nilai kandungan unsur hara relatif akan meningkat (Effendi 2003).
Menurut Wardoyo (1981), kecerahan perairan berhubungan erat dengan jumlah intensitas sinar matahari yang masuk ke suatu perairan. Kemampuan daya tembus matahari ke perairan sangat ditentukan oleh warna perairan, kepadatan plankton, jasad renik, dan detritus. Pada ekosistem estuari yang menjadi penyebab utama kekeruhan adalah lumpur dan bahan organik, baik dari masukan sungai maupun dari dalam estuari.
2.4.4. pH
Derajat keasaman atau pH merupakan parameter penting dalam pemantauan kualitas perairan. pH merupakan gambaran jumlah atau aktifitas ion hidrogen dalam air. Secara umum, nilai pH menggambarkan seberapa asam atau basa suatau perairan. Nilai pH air sangat menentukan sifat dan laju reaksi biokimiawi dalam air (Widigdo 2001). pH juga memiliki kaitan erat dengan kadar karbondioksida selain dengan alkalinitas. Pada pH < 5, alkalinitas dan kadar karbondioksida bebas semakin rendah. Sebagian besar biota akuatik sensitif terhadap perubahan pH dan menyukai nilai pH sekitar 7,0-8,5 (Effendi 2003). Sedangkan menurut Odum (1971), pH perairan yang cocok untuk pertumbuhan organisme air berkisar antara 6-9.
Hal-hal yang dapat mempengaruhi pH dari suatu perairan antara lain buangan industri dan limbah rumah tangga (Boyd 1982). Nilai pH dapat pula dipengaruhi oleh beberapa faktor lainnya, antara lain oleh aktivitas biologis seperti fotosintesis, respirasi, suhu, dan keberadaan ion-ion dalam perairan (Pescod 1973).
Menurut Odum (1971), keberadaan unsur hara di laut dipengaruhi secara tak langsung oleh perubahan nilai pH. Tingkat salinitas mempengaruhi kegiatan mikroorganisme dalam proses dekomposisi bahan organik. Salah satunya adalah terjadinya proses denitrifikasi, yaitu proses mikrobiologi dimana ion nitrat dan nitrit diubah menjadi molekul nitrogen (N2) pada kondisi pH tinggi. Produksi akhir dari
proses tersebut akan menghasilkan gas inert yang tidak dapat dipakai secara langsung, akibatnya kandungan unsur hara yang dapat dimanfaatkan akan menurun.
3.1. Waktu dan Lokasi Penelitian
Pengambilan sampel untuk pengamatan nutrien anorganik terlarut dilakukan sebanyak tiga kali yaitu pada periode sampling sebagai berikut:
Periode Pertama : 31 Maret 2007 - 1 April 2007 (pengambilan contoh pertama), Periode Kedua : 28 - 29 Agustus 2007 (pengambilan contoh kedua), dan
Periode Ketiga : 7 - 8 Maret 2008 (pengambilan contoh ketiga atau contoh terakhir).
Maksud dari pengambilan sampel ini dilakukan sebanyak tiga kali adalah untuk mewakili variabilitas musim yaitu Maret 2007 mewakili musim hujan, Agustus 2007 mewakili musim kemarau, dan Maret 2008 mewakili musim hujan. Pengambilan contoh dilakukan pada perairan estuari dari anak Sungai Brantas yaitu Sungai Porong dan Sungai Wonokromo yang keduanya merupakan cabang utamanya. Kedua perairan estuari ini terletak di Propinsi Jawa Timur yaitu tepatnya di Kabupaten Sidoardjo untuk estuari Sungai Porong (Gambar 2, Gambar 4 dan Gambar 6) dan estuari Sungai Wonokromo (Gambar 3, Gambar 5 dan Gambar 7).
Gambar 2. Peta lokasi pengambilan contoh (Jawa Timur) pengamatan bulan Maret 2007. A: Sungai Porong. B: Sungai Wonokromo. (Google Earth, Google Inc. 2010. Image Terra Metrics, Image DigitalGlobe, Image GeoEye. Data SIO, NOAA, U.S. Navy, NGA, GEBCO)
A B 20 km Surabaya Pulau Madura Sidoarjo U S B T
Gambar 3. Peta lokasi pengambilan contoh (Jawa Timur) pengamatan bulan Agustus 2007 dan Maret 2008. A: Sungai Porong. B: Sungai Wonokromo. (Google Earth, Google Inc. 2010. Image Terra Metrics, Image DigitalGlobe, Image GeoEye. Data SIO, NOAA, U.S. Navy, NGA, GEBCO)
Gambar 4. Peta lokasi pengambilan contoh estuari Sungai Porong bulan Maret 2007 (Bakosurtanal 2000)
Gambar 5. Peta lokasi pengambilan contoh estuari Sungai Wonokromo bulan Maret 2007 (Bakosurtanal 2000) 20 km A B Surabaya Pulau Madura Sidoarjo U S B T
Gambar 6. Peta lokasi pengambilan contoh estuari Sungai Porong bulan Agustus 2007 dan Maret 2008 (Bakosurtanal 2000)
Gambar 7. Peta lokasi pengambilan contoh estuari Sungai Wonokromo bulan Agustus 2007 dan Maret 2008 (Bakosurtanal 2000)
3.2. Alat dan Bahan
Alat dan bahan yang digunakan dalam pengambilan contoh penelitian ini adalah van dorn water sampler dan jerigen. Alat dan bahan yang digunakan untuk analisa contoh adalah kertas whatman, vacum pump, botol contoh hasil saring, kertas label, dan spidol. Sedangkan untuk pengamatan beberapa parameter fisika dan kimia air digunakan refraktometer untuk mengukur salinitas dan pH stick untuk mengukur pH. Untuk lebih lengkapnya perincian alat dan bahan disajikan pada Lampiran 1.
3.3. Metode Kerja
3.3.1. Penentuan Lokasi Penelitian
Posisi stasiun pada pengambilan sampel pertama (Maret 2007) ditentukan berdasarkan perbedaan gradien salinitas, sehingga diharapkan dapat mewakili daerah dengan salinitas air yang berbeda. Dengan demikian, pengambilan sampel dilakukan pada 13 stasiun. Stasiun 1 sampai stasiun 6 terdapat di estuari Sungai Porong dan stasiun 7 sampai stasiun 13 terdapat di estuari Sungai Wonokromo.
Pengambilan sampel kedua (Agustus 2007) dan ketiga (Maret 2008) ditentukan berdasarkan keterwakilan spasial wilayah estuari, yaitu mencakup wilayah sungai (stasiun 9 dan stasiun 10), wilayah peralihan (stasiun 1, 2, 11, 12, dan 16), dan wilayah laut (stasiun 3, 4, 5, 6, 7, 8, 13, 14, dan 15). Dengan demikian, pengambilan sampel dilakukan pada 16 stasiun. Stasiun 1 sampai stasiun 9 terdapat di estuari Sungai Porong dan stasiun 10 sampai stasiun 16 terdapat di estuari Sungai Wonokromo. Posisi stasiun berdasarkan titik GPS (Global Positioning System) disajikan pada Lampiran 2.
3.3.2. Pengambilan Sampel
Pengambilan contoh air dilakukan dengan menggunakan van dorn bottle
sampler pada setiap titik sampling dengan menggunakan perangkat GPS. Setelah
perahu tiba di titik sampling maka dilakukan pengambilan air sampel kemudian dimasukkan secukupnya ke dalam jerigen. Sebelum air dimasukkan ke dalam jerigen, wadah tersebut dibilas terlebih dahulu dengan air contoh.
Data lapangan yang diambil berupa data parameter fisika dan kimia seperti pH, suhu, salinitas, kecerahan, dan konsentrasi nutrien. Data penelitian ini diambil dengan dua cara, yaitu pengukuran parameter secara insitu dan analisis di laboratorium. Sampel yang diambil adalah air laut permukaan dengan kedalaman ± 30 cm sebanyak 5 liter yang selanjutnya dimasukkan ke dalam jerigen. Sampel-sampel tersebut selanjutnya dianalisis di laboratorium Produktivitas dan Lingkungan Perairan untuk mengetahui konsentrasi nutrien (nitrat, nitrit, amonium, silikat, dan fosfor). Pada Tabel 2 disajikan parameter-parameter yang diukur dalam penelitian ini berikut satuan dan alat/metode yang digunakan.
Tabel 2.Daftar parameter - parameter yang diukur dalam penelitian ini
Parameter Satuan Alat/Metode Keterangan
A. Fisika Suhu Salinitas air Kecerahan B. Kimia pH air Nitrat Nitrit Amonia Ortofosfat Silikat °C ‰ meter - mg/l mg/l mg/l mg/l mg/l Thermometer (Hg) / pemuaian Refraksi cahaya / Indeks Refraksi
Secchi disc / Visual
Kertas Lakmus / Visual Spektrofotometer / Screening Spektrofotometer / Sulfamida Spektrofotometer / Phenat Spektrofotometer / AscorbicAcid Spektrofotometer / Silicomolybdic In situ In situ In situ In situ Laboratorium Laboratorium Laboratorium Laboratorium Laboratorium
3.3.3. Metode Analisis Data
Analisis nutrien dilaksanakan di Laboratorium Produktivitas Lingkungan, Fakultas Perikanan dan Ilmu Kelautan di Institut Pertanian Bogor. Setelah data konsentrasi nutrien diperoleh kemudian dilakukan perbandingan antara masing-masing stasiun pada setiap periode sampling. Data disajikan dalam bentuk histrogam dan peta pola sebaran. Peta pola sebaran diproses menggunakan software Surfer 8.0.
3.3.3.1. Uji Statistik Regresi Linear Sederhana
Untuk mengetahui keeratan hubungan antara nutrien dan salinitas digunakan perhitungan koefisien korelasi (r) dari regresi linear sederhana. Rumus regresi
linear sederhana yang digunakan (Walpole 1995) adalah:
y = a + bx
Keterangan:
y = nilai salinitas setiap stasiun (dalam hal ini sebagai peubah tak bebas) x = konsentrasi nutrien setiap stasiun (dalam hal ini sebagai peubah bebas) b = kemiringan
Keeratan hubungan (nilai koefisien korelasi) linear berkisar antara -1 < 0 < +1. Artinya bila r mendekati +1 atau -1, hubungan antara peubah tersebut kuat dan
dikatakan terdapat korelasi yang tinggi antara keduanya. Akan tetapi, apabila r mendekati nol, hubungan linear antara x dan y sangat lemah atau mungkin tidak ada sama sekali. Tidak seperti ragam atau koefisien regresi, koefisien korelasi bebas dari satuan pengukuran; jadi merupakan besaran yang mutlak dan tidak mempunyai satuan (Steel dan Torrie 1993). Perhitungan analisis regresi linear sederhana ini menggunakan program komputer Microsoft Exel 2007. Secara umum digunakan kriteria tentang besaran r (dalam nilai absolut) sebagai berikut:
r = 0 tidak ada korelasi antara dua variabel; r = 0 - 0,25, korelasi sangat lemah;
r = 0,25 - 0,5, korelasi cukup erat; r = 0,5 - 0,75, korelasi kuat;
r = 0,75 - 0,99, korelasi sangat kuat; r = 1, korelasi sempurna.
3.3.3.2. Pengelompokan stasiun menggunakan Indeks Canberra
Tingkat kesamaan antar stasiun pengamatan berdasarkan parameter unsur hara perairan N (nitrat, nitrit, dan amonia), P (fosfor), dan Si (silikat) dapat diketahui dengan Indeks Canberra (Lance dan Willam in Legendre dan Legendre 1983), yaitu:
(
X Y)
x 100% X X n 1 1 I i 0 i ik ij i 0 i ik ij cm + − − =∑
∑
= = Keterangan :Icm = Nilai kesamaan Indeks Canberra
n = Jumlah parameter fisika dan kimia yang dibandingkan Xij = Nilai data parameter ke-i dari stasiun ke-j
Xik = Nilai data parameter ke-i dari stasiun ke-k
Nilai kesamaan Indeks Canberra disajikan dalam bentuk dendrogram. Nilai Indeks Canberra berkisar antara 0 - 100%. Jika mendekati 0 menunjukkan nilai kesamaan yang paling rendah dan mendekati 100% menunjukkan kesamaan yang paling tinggi (mirip). Dalam penelitian ini digunakan taraf kesamaan 80%.
4.1. Kandungan Hara Utama di Estuari Sungai Brantas 4.1.1. Hara Nitrat
Kisaran konsentrasi nitrat pada perairan estuari Sungai Brantas pada bulan Maret 2007 berkisar dari 0,0549 mg/l sampai dengan 8,3871 mg/l. Nilai konsentrasi tertinggi terdapat di stasiun 4, terendah di stasiun 1. Dari Gambar 8 dan Gambar 9, dapat terlihat kadar nitrat pada perairan Sungai Porong secara umum lebih tinggi dibandingkan Sungai Wonokromo. Bulan Maret 2007 adalah periode musim hujan. Adanya musim hujan tersebut diduga membuat banyaknya masukan limpasan dari kegiatan-kegiatan daratan (pertanian) ke badan sungai sehingga konsentrasi nitrat pada Sungai Porong relatif lebih tinggi.
Pada Sungai Wonokromo terlihat bahwa kisaran konsentrasi nitrat tertinggi terdapat pada stasiun 7 dan konsentrasi terendah terdapat pada stasiun 10. Tingkat konsentrasi nitrat lebih rendah jika dibandingkan dengan Sungai Porong. Hal ini kemungkinan terjadi karena selama musim hujan hampir 80% air yang disuplai dari Sungai Brantas dialihkan ke Porong, sehingga Sungai Wonokromo hanya mendapat sekitar 20 % saja dari Brantas dan diperkirakan sungai tersebut lebih sedikit mendapat masukan limbah domestik, industri maupun pertanian. Kenyataan dimana kadar nitrat pada stasiun 7 dan stasiun 10 tersebut di atas kontradiktif dengan teori (Hutagalung dan Rozak 1997) mempertimbangkan bahwa jarak antara kedua stasiun tersebut kurang lebih sama dengan muara sungai. Berdasarkan Chu (1943) in
Kennish (1990), tingkat kadar nitrat pada perairan tersebut (pada periode pengamatan) dapat memicu eutropikasi karena kadar nitrat lebih dari 0,2 mg/l.
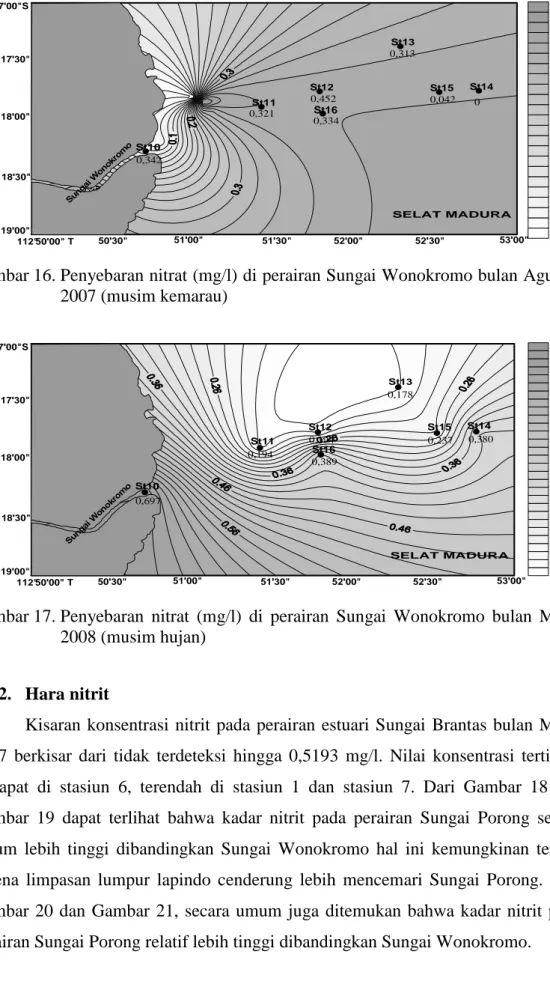
Pada bulan Agustus 2007 konsentrasi nitrat berkisar antara tak terdeteksi sampai dengan 0,452 mg/l. Dari Gambar 10 dan Gambar 11 dapat terlihat bahwa nilai konsentrasi nitrat pada bulan Agustus 2007 di setiap stasiun cukup bervariasi. Konsentrasi nitrat di stasiun 4 (0 mg/l) tidak terdeteksi. Konsentrasi nitrat tertinggi terdapat di stasiun 12 dengan nilai 0,452 mg/l. Konsentrasi nitrat di stasiun 15 (0,042 mg/l) cukup rendah dibandingkan stasiun lainnya.
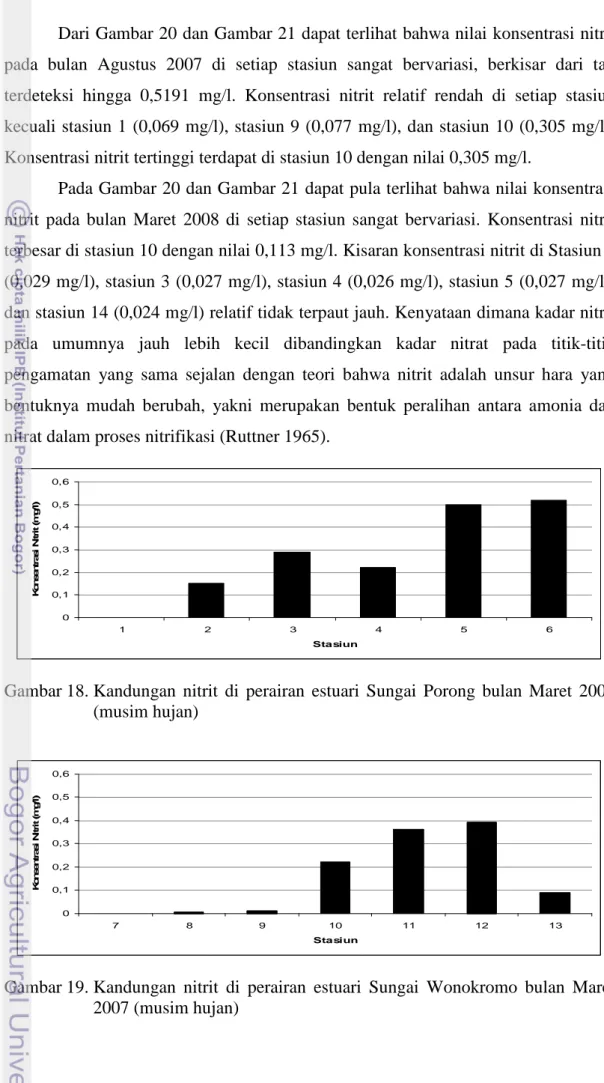
Pada bulan Maret 2008 (musim hujan), konsentrasi nitrat berkisar antara 0,178 mg/l sampai dengan 1,183 mg/l. Dari Gambar 10 dan Gambar 11, untuk kedua
sungai, dapat terlihat bahwa nilai konsentrasi nitrat pada bulan Maret 2008 di setiap stasiun relatif lebih tinggi dibandingkan musim kemarau (Agustus). Pada Sungai Porong, konsentrasi nitrat di stasiun 1 (0,959 mg/l), stasiun 6 (1,077 mg/l), adalah dua konsentrasi terbesar dibandingkan dengan stasiun lainnya. Pada Sungai Wonokromo, konsentrasi terbesar terdapat pada stasiun 10 yaitu 0,697 mg/l. Sementara itu, stasiun 2 (0,634 mg/l), stasiun 3 (0,604 mg/l), stasiun 4 (0,727 mg/l), stasiun 5 (0,659 mg/l), stasiun 7 (0,731 mg/l), dan stasiun 10 (0,697 mg/l) memiliki kisaran nilai konsentrasi nitrat yang tidak terpaut jauh.
Keadaan tersebut di atas kurang lebih selaras dengan teori yang dibahas pada Bab Tinjauan Pustaka yang mengatakan bahwa semakin jauh titik pengambilan sampel dari muara sungai semakin rendah kadar nitrat. Demikian pula kelihatan bahwa kadar nitrat lebih besar pada musim hujan (Maret) dibandingkan musim kemarau (Agustus), karena air sungai membawa masukan limbah rumah tangga, industri maupun pertanian lebih banyak ke laut pada musim hujan. Ada kecenderungan lebih lebar variasi kadar nitrat pada musim hujan dibandingkan musim kemarau untuk kedua estuari. Hal ini kemungkinan ada kaitannya dengan semakin derasnya gerakan air estuari pada musim hujan dibandingkan musim kemarau dimana air lebih tenang.
0 1 2 3 4 5 6 7 8 9 1 2 3 4 5 6 Stasiun K o n s e n tr a s i N it ra t (m g /l )
Gambar 8. Kandungan nitrat di perairan estuari Sungai Porong bulan Maret 2007 (musim hujan)
Dari Gambar 10 dan Gambar 11 dapat dilihat bahwa konsentrasi nitrat di bulan Maret 2008 jauh lebih tinggi jika dibandingkan dengan konsentrasi nitrat pada bulan Maret 2007. Hal ini kemungkinan disebabkan oleh adanya masukan lumpur Lapindo yang mengalir ke Sungai Brantas pada periode Maret 2008. Pembuangan lumpur ke Kali Porong mungkin telah menyebabkan kenaikan kadar garam (salinitas) air Kali Porong.
0 1 2 3 4 5 6 7 8 9 7 8 9 10 11 12 13 Stasiun K o n s e n tr a s i N it ra t (m g /l )
Gambar 9. Kandungan nitrat di perairan estuari Sungai Wonokromo bulan Maret 2007 (musim hujan) 0 0,2 0,4 0,6 0,8 1 1,2 1,4 1 2 3 4 5 6 7 8 9 Stasiun K o n s e n tr a s i N it ra t (m g /l ) Agustus 2007 Maret 2008
Gambar 10.Kandungan nitrat di perairan estuari Sungai Porong bulan Agustus 2007 (musim kemarau) dan bulan Maret 2008 (musim hujan)
Sebaran kandungan nitrat antara bulan Agustus 2007 dan Maret 2008 tidak menunjukkan pola yang serupa. Dari Gambar 10 dan Gambar 11 terlihat bahwa konsentrasi nitrat mengalami peningkatan hampir di setiap stasiun kecuali stasiun 11, stasiun 12, dan stasiun 13 dimana terjadi penurunan. Tingginya konsentrasi nitrat tersebut dapat dilihat dari semakin gelapnya warna kontur dan rendahnya konsentrasi nitrat dapat dilihat dari semakin terangnya warna kontur penyebaran unsur hara tersebut (Gambar 14, Gambar 15, Gambar 16, dan Gambar 17). Keadaan tersebut di atas kurang lebih selaras dengan teori yang dibahas pada tinjauan pustaka di depan. 0 0,2 0,4 0,6 0,8 1 1,2 1,4 10 11 12 13 14 15 16 Sta siun K o n s e n tr a s i N it ra t (m g /l ) Agustus 2007 Maret 2008
Gambar 11.Kandungan nitrat di perairan estuari Sungai Wonokromo bulan Agustus 2007 (musim kemarau) dan bulan Maret 2008 (musim hujan)
Konsentrasi nitrat lebih besar pada musim hujan (Maret) dibandingkan musim kemarau (Agustus), karena air sungai membawa masukan limbah rumah tangga, industri maupun pertanian lebih banyak ke laut. Demikian pula, ada kecenderungan lebih lebar variasi kadar nitrat pada musim hujan dibandingkan musim kemarau untuk kedua estuari.
St 1 St 2 St 3 St 4 St 5 St 6 07°30'00"S 112°50'30"T 51'00" 51'30" 52'00" 52'30" 53'00" 53'30" 54'00" 54'30" 55'00" 30'30" 31'00" 31'30" 32'00" 32'30" 0,0549 1,7183 5,7385 8,3871 8,0088 0,5831 Kali Porong SELAT MADURA -1.5 -1 -0.5 0 0.5 1 1.5 2 2.5 3 3.5 4 4.5 5 5.5 6 6.5 7 7.5 8 8.5 9
Gambar 12.Penyebaran nitrat (mg/l) di perairan Sungai Porong bulan Maret 2007 (musim hujan)