HASIL
Penapisan Kapang yang Berpotensi dalam Produksi AIA
Sebanyak 51 kapang asal serasah tanaman hutan yaitu 19 dari Katingan (Tabel 1) dan 32 dari Tarakan (Tabel 2) telah diuji potensinya dalam memproduksi AIA. Kapang-kapang yang berasal dari dua daerah ini seluruhnya mampu menghasilkan AIA dengan kadar yang sangat bervariasi (Lampiran 3). Secara umum, kapang-kapang asal Katingan memproduksi AIA (1,92±0,26 ppm) lebih tinggi dibanding kapang-kapang asal Tarakan (1,08±0,14 ppm) (Gambar 3a). Isolat kapang asal Katingan merupakan isolat kapang terpilih dalam memproduksi AIA.
Produksi AIA dengan cara inkubasi statis (2,72±0,89 ppm) lebih tinggi dibandingkan dengan cara digoyang (1,92±0,26 ppm) (Gambar 3b). Cara inkubasi statis merupakan cara inkubasi yang dipilih dalam produksi AIA.
Gambar 3 (a)Rataan kadar AIA yang dihasilkan oleh isolat kapang asal Katingan dan Tarakan dengan inkubasi digoyang;(b) Rataan kadar AIA yang dihasilkan oleh isolat kapang asal Katingan dengan inkubasi statis dan digoyang.
Pengaruh penyimpanan terhadap produksi AIA dari 19 isolat kapang asal Katingan bervariasi tergantung kepada jenis kapangnya. Sebesar 36,84% isolat kapang asal Katingan dipengaruhi oleh proses penyimpanan dalam produksi AIA. Produksi AIA pada kapang yang lainnya (63,16%) tidak dipengaruhi oleh proses penyimpanan. Jika produksi AIA dipengaruhi oleh proses penyimpanan, maka sebanyak 31,58% mengalami penurunan produksi AIA secara nyata dan sebaliknya sebanyak 5,26% mengalami kenaikan produksi AIA secara nyata (Tabel 3).
0,00 0,50 1,00 1,50 2,00 2,50 Katingan Tarakan K ad ar A IA (p p m ) Asal Isolat 0,00 1,00 2,00 3,00 4,00 Statis digoyang K ad ar A IA (p p m ) Cara Inkubasi (a) (b)
Tabel 3 Produksi AIA dari isolat asal Katingan sebelum dan setelah proses penyimpanan selama tiga bulan pada suhu 10°C
Nama Kapang No. Aksesi
Kadar AIA (ppm) Sebelum penyimpanan Setelah penyimpanan Acremonium sp. IPBCC 07.548 7,83±0,16 b 3,52±0,46 a
Aspergillus ornatus IPBCC 07.554 1,85±0,09 a 4,50±0,92 b
Gliocladium deliquescens IPBCC 07.543 6,96±2,18 b 2,23±0,38 a
Paecylomyces sp. IPBCC 07.550 0,94±0,71 a 1,33±0,08 a
Penicillium herqueii IPBCC 07.557 1,38±0,18 a 1,46±0,05 a
Penicillium janthinellum IPBCC 07.542 0,88±1,24 a 1,23±0,05 a
Penicillium miczynskii IPBCC 07.541 0,33±0,15 a 1,12±0,00 a
Penicillium notatum IPBCC 07.555 7,20±0,11 b 5,06±0,46 a
Penicillium sp. IPBCC 07.536 4,48±2,80 b 1,25±0,52 a
Penicillium sp. IPBCC 07.537 4,75±2,64 b 2,21±0,57 a
Penicillium sp. IPBCC 07.538 0,82±1,15 a 1,00±0,16 a
Penicillium sp. IPBCC 07.539 1,82±1,15 a 0,77±0,11 a
Penicillium velutenum IPBCC 07.535 1,57±0,09 a 0,88±0,38 a
Trichoderma harzianum IPBCC 07.545 0,50±0,71 a 0,71±0,08 a
T. harzianum IPBCC 07.546 2,13±0,88 a 0,46±0,05 a
T. harzianum IPBCC 07.547 0,39±0,51 a 0,81±0,05 a
Trichoderma koningii IPBCC 07.552 2,07±0,62 a 1,54±0,33 a
Trichoderma
longibranchiatum IPBCC 07.556 1,13±0,18 a 1,29±0,46 a
Trichoderma viridae IPBCC 07.551 4,75±0,35 b 0,75±0,03 a
Angka-angka yang diikuti oleh huruf yang sama pada baris yang sama tidak berbeda nyata pada taraf 5% (DMRT).
(a) (b) (c) (d)
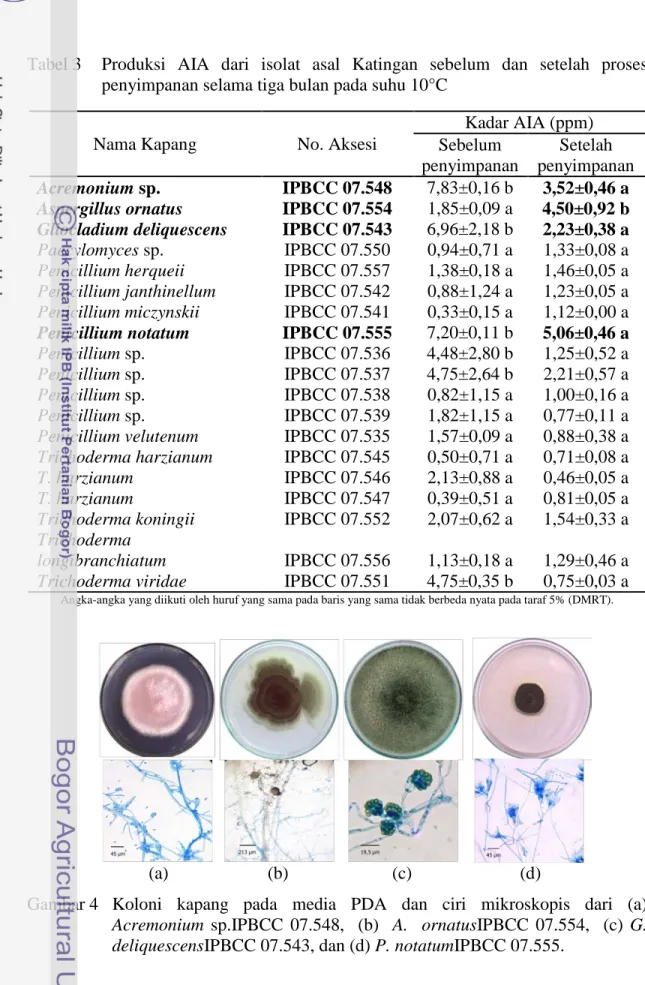
Gambar 4 Koloni kapang pada media PDA dan ciri mikroskopis dari (a)
Acremonium sp.IPBCC 07.548, (b) A. ornatusIPBCC 07.554, (c) G. deliquescensIPBCC 07.543, dan (d) P. notatumIPBCC 07.555.
Empat isolat kapang yang menghasilkan AIA tertinggi dijadikan sebagai sumber inokulum pada uji selanjutnya. Empat isolat kapang tersebut diambil dari hasil uji produksi AIA setelah penyimpanan ialah Acremonium sp.IPBCC 07.548(Gambar 4a) memproduksi AIA sebesar 3,52±0,46 ppm, A. ornatusIPBCC 07.554 (Gambar 4b)memproduksi AIA sebesar 4,50±0,92 ppm, G. deliquescensIPBCC 07.543 (Gambar 4c)memproduksi AIA sebesar 2,23±0,38 ppm,
dan P. notatumIPBCC 07.555(Gambar 4d) memproduksi AIA sebesar 5,06±0,46 ppm.
Toleransi Kapang terhadap pH Asam
Produksi AIA dari keempat kapang terpilih dipengaruhi oleh pH medium. pH optimum untuk produksi AIA bervariasi tergantung kepada jenis kapangnya (Gambar 5a). Namun secara umum, produksi AIA mencapai maksimum pada pH 5,5. pH medium pada akhir masa produksi AIA berubah (meningkat atau menurun) dari pH awalnya (Tabel 4).
Gambar 5 (a) Kadar AIA dan (b) bobot kering biomasa dari (
■
) Acremonium sp.IPBCC 07.548, (▲) A. ornatusIPBCC 07.554, (♦
) G. deliquescensIPBCC 07.543, dan (●
) P. notatumIPBCC 07.555.0,00 1,00 2,00 3,00 4,00 5,00 6,00 4,5 5,0 5,5 7,3 K ad ar A IA (p p m ) pH Awal 0,00 100,00 200,00 300,00 400,00 500,00 600,00 700,00 4,5 5,0 5,5 7,3 B obot K er in g B iom as a ( m g ) pH Awal (a) (b)
Bobot kering biomasa tidak berkorelasi nyata terhadap produksi AIA pada berbagai pH awal medium.Pertumbuhan miselium (bobot kering biomasa)menunjukkan pertumbuhan yang baik pada pH asam. Bobot kering biomasa miselium A. ornatus IPBCC 07.554, G. deliquescens IPBCC 07.543,dan P. notatum IPBCC 07.555 cenderung menurun dengan kenaikan pH media kultur. Sebaliknya, bobot kering biomasa miselium Acremonium sp.IPBCC 07.548 cenderung meningkat(Gambar 5b).
Tabel 4 pH awal dan pH akhir dalam produksi AIA pada kapang terpilih
pH awal pH akhir Acremonium sp.IPBCC 07.548 A. ornatus IPBCC 07.554 G. deliquescens IPBCC 07.543 P. notatum IPBCC 07.555 4,5 4,70±0,00 c 3,05±0,07 a 4,50±0,00 b 4,65±0,07 c 5,0 5,20±0,28 bc 3,15±0,07 a 5,45±0,21 c 4,85±0,07 b 5,5 5,40±0,00 bc 3,55±0,07 a 5,45±0,07 c 5,30±0,00 b 7,3 5,85±0,07 c 2,30±0,14 a 7,25±0,07 d 3,65±0,07 b
Angka-angka yang diikuti oleh huruf yang sama pada baris yang sama tidak berbeda nyata pada taraf 5% (DMRT).
Produksi AIA oleh Acremonium sp.IPBCC 07.548 optimum pada pH 5,5 (Gambar 5a), tumbuh optimum pada pH 7,3 (Gambar 5b), dan pH awal medium cenderung tidak berubah kecuali pada pH awal medium 7,3menurun menjadi 5,85±0,07(Tabel 4).A. ornatus IPBCC 07.554sangat menurunkan pH mediumawalnya (Tabel 4). A. ornatus IPBCC 07.554menunjukkan toleransi yang kuat terhadap asam karena A. ornatus IPBCC 07.554tumbuh baik di pH asam dan tumbuh optimum pada pH 5,0 (Gambar 5b). Namun demikian, produksi AIA dari A. ornatus IPBCC 07.554 sangat rendah pada pH asam tetapi optimum pada pH 7,3 (Gambar 5a), padahal pada pH 7,3 tumbuhnya relatif terhambat (Gambar 5b).Pada akhir produksi AIA, pH akhir medium G. deliquescens IPBCC 07.543 relatif tidak berubah dari pH awalnya (Tabel 4). Produksi AIA oleh G. deliquescens IPBCC 07.543 mencapai maksimum pada pH 5,5 dan tumbuh optimum pada pH 4,5 (Gambar 5b), tetapi pada pH ini produksi AIA relatif rendah (Gambar 5a). pH akhir medium P. notatum IPBCC 07.555 cenderung menurun (Tabel 4) dan menunjukkan toleransi terhadap kondisi asam. Hal ini ditunjukkan oleh pertumbuhannya yang baik di pH asam dan optimum pada pH 4,5 (Gambar 5b).P. notatum IPBCC 07.555 selain menunjukkan pertumbuhan yang baik di pH asam juga mampu memproduksi AIA dengan kadar yang cukup tinggi pada pH
asam (Gambar 5a). Produksi AIA dari P. notatum IPBCC 07.555 optimum pada pH 5,0 dan 5,5 (Gambar 5a).
Sifat Antagonistik
Uji antagonistik menunjukkan bahwa isolat-isolat kapang terpilih tidak bersifat antagonis. Hal ini ditunjukkan oleh nilai persentase hambatan dari setiap kapang yang diuji sangat rendah yaitu berkisar antara 0,00-0,65% (Tabel 5). Dengan demikian, semua isolat kapang terpilih digunakan dalam uji produksi AIA dalam bentuk konsorsium.
Tabel 5 Interaksi penghambatan pertumbuhan antara dua isolat kapang terpilih
Isolat Persentase (%) penghambatan isolat kapang terhadap
Acremonium sp. A. ornatus G. deliquescens P. notatum
Acremonium sp. - 0,00±0,00 0,00±0,00 0,13±0,14
A. ornatus 0,08±0,04 - 0,00±0,00 0,39±0,18
G. deliquescens 0,53±0,12 0,65±0,09 - 0,57±0,13
P. notatum 0,00±0,00 0,00±0,00 0,00±0,00 -
Produksi AIApada Beberapa Konsorsium Kapang
Secara umum, produksi AIA pada beberapa konsorsium kapang lebih tinggi dibandingkan dengan bentuk kultur tunggal. Produksi AIAP. notatum IPBCC 07.555 dalam bentuk kultur tunggal menghasilkan AIA tertinggi. Kehadiran P. notatum IPBCC 07.555 pada bentuk konsorsium apapun selalu menghasilkan kadar AIA yang tinggi (Gambar 6).
Gambar 6 Produksi AIA dari kultur tunggal dan beberapa konsorsiumkapang. Keterangan: (A)Acremonium sp.IPBCC 07.548, (B)A. ornatusIPBCC 07.554, (C) G.
deliquescensIPBCC 07.543, (D)P. notatumIPBCC 07.555, (E)IPBCC
07.543+548, (F)IPBCC 07.543+554,(G) IPBCC 07.543+555, (H)IPBCC 0,00 2,00 4,00 6,00 8,00 10,00 12,00 14,00 A B C D E F G H I J K L M N O K ad ar A IA (p p m ) Konsorsium
07.548+554, (I)IPBCC 07.548+555, (J)IPBCC 07.554+555, (K)IPBCC 07.543+548+554, (L)IPBCC 07.543+548+555, (M)IPBCC 07.543+554+555, (N)IPBCC 07.548+554+555, (O)IPBCC 07.543+548+554+555.
Kemampuan kapang dalam produksi AIA bervariasi menurut bentuk konsorsiumnya, yaitu berkisar 3,28±0,07 ppm hingga 10,51±1,25 ppm. Produksi AIA tertinggi diperoleh oleh konsorsium G yaitu antara G. deliquescens IPBCC 07.543 denganP. notatum IPBCC 07.555 yang diikuti oleh konsorsium M, L, dan O (Gambar 6). Produksi AIA tertinggi dari setiap bentuk konsorsium dikultur ulang untuk uji konfirmasi produksi AIA dengan menggunakan HPLC.
Konfirmasi Produksi AIA
Uji konfirmasi produksi AIA dengan menggunakan HPLC dari konsorsium terpilih (G, L, M dan O) menunjukkan bahwa produksi AIAtertinggi diperoleh oleh konsorsium M yaitu sebesar 38,66 ppm diikuti oleh konsorsium O (23,58 ppm), G (23,13 ppm), dan L (21,57 ppm) (Tabel 6).
Tabel 6 Konfirmasi produksi AIA dari konsorsium terpilih dengan menggunakan HPLC
Kode Sampel Kadar AIA (ppm)
kontrol 0,00
G 23,13
L 21,57
M 38,66
O 23,58
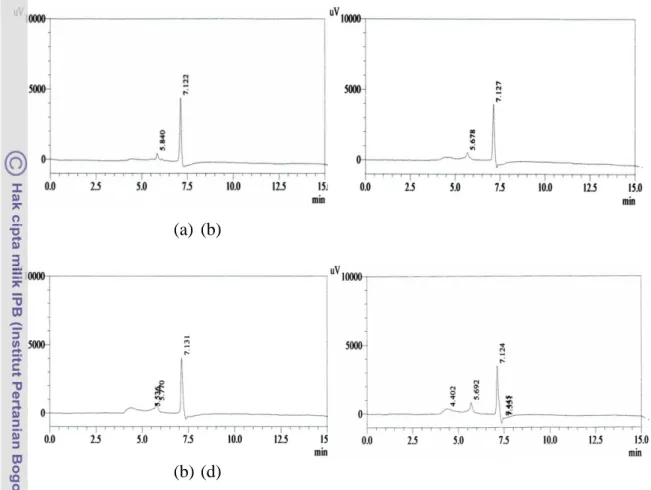
Kromatogram HPLC untuk produksi AIA dari setiap bentuk konsorsium terpilih menunjukkan profil puncak dengan waktu retensi 7,1 (Gambar7). Waktu retensi ini sama dengan waktu retensi pada kromatogram standar AIA dengan konsentrasi 1 ppm, 5 ppm, 10 ppm, 15 ppm, dan 20 ppm (Lampiran 4). Profil puncak dengan waktu retensi selain 7,1 (Gambar 7) diduga sebagai profil puncak untuk asam-asam organik yang lain selain AIA.
(a) (b)
(b) (d)
Gambar 7 Kromatogram HPLC untuk produksi AIA dari (a) konsorsium G, (b) konsorsium L, (c) konsorsium M, dan (d) konsorsium O.
PEMBAHASAN
Penapisan Kapang yang Berpotensi dalam Produksi AIA
Sebanyak 19 kapang asal serasah tanaman hutan dari Katingan dan 32 dari Tarakan seluruhnya berpotensi menghasilkan AIA dengan kadar yang sangat bervariasi. Secara umum, potensi produksi AIA oleh kapang-kapang asal Katingan (1,92±0,26 ppm) lebih tinggi dibanding kapang-kapang asal Tarakan (1,08±0,14 ppm). Hal ini menunjukkan bahwa AIA selain disintesis oleh tumbuhan tinggi, tetapi dapat juga disintesis oleh cendawan berfilamen AIA(Yurekliet al. 2003).
Medium kultur pada produksi AIA dari kapang asal kedua daerah tersebut ditambahkan pepton 1%sebagai sumber nitrogen eksogen (Hasan 2002). Yurekliet
al. (2003) mengemukakan bahwa produksi AIApada L.
sajor-Produksi AIA dipengaruhi oleh suhu, cahaya, waktu inkubasi, maupun sumber karbon yang tepat. Sumber karbon yang digunakan ialah sukrosa3%. Sukrosa digunakan selain sebagai komponen standar dari media Czapek dox, juga merupakan disakarida
caju menurun jika
medium kultur tidak mengandung sumber nitrogen eksogen. Namun, penambahan 0,015 ppm triptofan relatif tidak memberikan peningkatan produksi AIA pada
Penicillium sp. IPBCC 09.620, tetapi produksi AIAmeningkat hingga 27,78 kali dari
kontrol setelah penambahan pepton 1%ke dalam medium kultur (Imaningsih 2010). Hasil penelitian pendahuluan terhadap beberapa kapang simpanan IPBCC menunjukkan bahwa penambahan triptofan 0,0015-0,015 ppm ke dalam medium kultur tidak menunjukkan adanya produksi AIA (data tidak dipublikasikan). Penambahan triptofan eksogen pada konsentrasi tertentu menyebabkan kejenuhan dan hambatan balik pada biosintesis AIA (Zhao et al. 2001). Kapang-kapang asal Katingan dan Tarakan diduga mampu mensintesis triptofan endogen sebagai prekursor AIA dengan menggunakan sumber N dari pepton.
yang seringdigunakanuntukproduksi metabolitsekunder (Adrio & Demain 2003). Glukosamerupakansumberkarbonyang pertama kali digunakanuntuk memproduksisel dalam pertumbuhan somatis,sehingga berpengaruh terhadap sedikitatau tidak adanyametabolitsekunderyangdibentuk (Adrio & Demain 2003).
Produksi AIA juga dipengaruhi oleh cara inkubasi. Kapang yang diinkubasi dalam keadaan statis (2,72±0,89 ppm) menghasilkan AIA dengan konsentrasi yang lebih tinggi dibandingkan dengan cara digoyang (1,92±0,26 ppm). Hal ini berbeda dengan laporanYurekliet al. (2003) yang mengemukakan bahwa produksi AIAmenjadi meningkat jika kapang diinkubasi pada mesin penggoyang.
Pada inkubasi statis, miselium kapang tumbuh di permukaan medium dan bersporulasi, sedangkan pada inkubasi digoyangkapang tumbuh membentuk butiran (pelet) dan tidak bersporulasi. Miselium yang berbentuk pelet dan tidak bersporulasi diduga berhubungan dengan pembentukan metabolit sekunder pada fase stasioner. Fase stasioner berhubungan dengan diferensiasi, sporulasi, dan produksi metabolit sekunder yang memiliki aktivitas biologi (Kavanagh 2005). Cara inkubasi digoyang dapat menyebabkan struktur AIA rusak oleh oksigen karena proses dekarboksilasi yang mengakibatkan hilangnya gugus karboksil (Taiz & Zeiger 2002).
Inkubasi kapang dalam produksi AIA dilakukan dalam kondisi gelap selama 9 hari. Kondisi gelap diharapkan dapat meningkatkan produksi AIA karena menurut Yurekliet al. (2003) bahwa produksi AIApada L.
sajor-Berdasarkan hasil penapisan di atas, maka isolat asal Katingan dan cara inkubasi statis dipilih untuk uji pengaruh proses penyimpanan terhadap produksi AIA. Sebagian besar (63,16%) isolat kapang asal Katingan tidak dipengaruhi oleh proses penyimpanan dalam memproduksi AIA. Jika dipengaruhi oleh penyimpanan, hanya sebanyak 31,58% mengalami penurunan dan 5,26% mengalami kenaikan dalam produksi AIA. Penurunan produksi AIA oleh sebagian kecil kapang asal Katingan ini diduga disebabkan oleh subkultur berulang (Hall 1980;Qu et al.2006). Subkultur berulang pada media agar-agaryang berbeda mengakibatkan (1) perubahan
caju meningkat jika kultur
diinkubasi dalam keadaan gelap. Inkubasi selama 9 hari dilakukan untuk meyakinkan bahwa fase pertumbuhan kapang benar-benar sudah berada pada fase stasioner. Pada umumnya kapang mulai memasuki fase stasioner pada hari ketujuh (Griffin 1994). Selain itu, waktu inkubasi dalam produksi AIA yang pernah dilakukan oleh peneliti sebelumnya berkisar antara 5-15 hari (Bau 1981; Tuomi et al. 1995; Hasan 2002; Chung & Tzeng 2004; Bilkay 2010; Subbarayanetal. 2010; Imaningsih 2010).
karakteristik morfologi dan fisiologi dari kultur murni sebelumnya; (2)ketidakstabilanbiosintesismetabolitsekunder, hasil metabolitberfluktuasi,danmenurunsecara drastisselamasiklussubkultur; dan (3)ukuraninokulummemilikidampakbesarterhadap stabilitasbiosintesis metabolit sekunder (Hall 1980; Qu et al.2006).
Penurunan aktivitas biosintesis AIA sebagai metabolit sekunder oleh kapang asal serasah tanaman hutan diduga tidak ada hubungannya dengan proses penyimpanan. Hal ini ditunjukkan oleh adanya ketidakkonsistenan produksi AIA dari setiap kapang yang diuji. Ketidakkonsistenan respon ini setidaknya untuk beberapa jenis tidak menunjukkan hubungan secara langsung terhadap lama penyimpanan (Hwang 1976). Arabiet al. (2007) melaporkanbahwapenyimpanan dan pengawetanCochliobolussativus menimbulkan masalah,yaitu kelangsungan hidup yang rendah danakibat kontaminasiketika cendawan disimpandimedia PDA
Produksi AIA pada berbagai pH awal medium tidak berkorelasi nyata terhadap bobot kering biomasa miselium. Pertumbuhan miselium (bobot kering biomasa) menunjukkan pertumbuhan yang baik pada pH asam. Bobot kering biomasa miselium A. ornatus IPBCC 07.554, G. deliquescens IPBCC 07.543, dan P. notatum
.
Toleransi Kapang terhadap pH Asam
Kemampuan produksi AIA dari keempat kapang terpilih dipengaruhi oleh pH medium. pH optimum untuk produksi AIA bervariasi tergantung pada jenis kapang. Namun secara umum, produksi AIA mencapai maksimum pada pH 5,5. Walaupun medium kultur dalam kondisi ekstrem masam (pH 4,5), masam sangat kuat(pH 5,0), dan sangat masam (pH 5,5) (Sparks 2003)setiap kapang terpilih masihmampu memproduksi AIA. Hal ini membuktikan bahwa kapang-kapang tersebut toleran terhadap kondisi asam. Organisme toleran asam adalah organisme yangsecara genetik toleran atau organisme yang telah mengalami prosesadaptasi fisiologi sehingga menjadi toleran terhadap kondisi asam (Keyser & Munns 1979). Selain itu, Bau (1981) menyatakan bahwa S.cerevisiae dan A. niger mampu memproduksi AIA pada pH ekstrem asam yaitu pada pH<4,5.
IPBCC 07.555 cenderung menurun dengan kenaikan pH medium kultur. Sebaliknya, bobot kering biomasa miselium Acremonium sp.IPBCC 07.548 cenderung meningkat. Rousk et al. (2009) mengemukakan bahwa pengaruh pH terhadap pertumbuhan kapang dapat meningkat hingga lima kali jika kapang ditumbuhkan pada pH yang lebih rendah (4,5-5,5).
Produksi AIA oleh Acremonium sp.IPBCC 07.548 optimum pada pH 5,5.
Acremonium sp.IPBCC 07.548 tumbuh optimum pada pH 7,3 dengan produksi AIA
relatif tinggi walaupun pH awal 7,3 menurun menjadi 5,85±0,07 pada akhir masa inkubasi. Hal ini sejalan dengan pendapat Yunasfi (2008) yang menyatakan bahwa pada umumnya Acremonium sp. tumbuh optimum pada pH 6 atau yang mendekati pH netral walaupun belum ada laporanAcremonium sp. mampu memproduksi AIA. Kemampuan Acremonium sp.IPBCC 07.548 memproduksi AIA pada pH sangat masam (5,5) menunjukkan bahwa kapang ini toleran terhadap kondisi asam. Selain itu, produksi AIA oleh Acremonium sp. IPBCC 07.548 pada pH awal 7,3 menurun menjadi 5,85±0,07 mendekati pH optimum dalam produksi AIA. Kecilnya bobot kering biomasa Acremonium sp. IPBCC 07.548 diduga disebabkan oleh kecepatan pertumbuhan Acremonium sp. yanglambat(Yunasfi 2008).
Aspergillus ornatus IPBCC 07.554 menunjukkan toleransi yang kuat terhadap
kondisi asam karenaA. ornatus IPBCC 07.554 tumbuh baik di pH asam dan optimum pada pH 5,0 serta sangat menurunkan pH awal medium. Namun demikian, produksi AIA dari A. ornatus IPBCC 07.554 tergolong sangat rendah pada pH asam tetapi optimum pada pH 7,3, padahal pada pH 7,3 tumbuh relatif terhambat. pH akhir yang sangat rendah ini diduga disebabkan banyaknya asam-asam organik yang lain selain AIA seperti asam oksalat, asam sitrat, dan asam glukonat yang dapat menurunkan pH medium kultur (Santi et al. 2000).
Pada akhir masa inkubasi produksi AIA, pH akhir medium G. deliquescens IPBCC 07.543 relatif tidak berubah dari pH awalnya. Produksi AIA oleh G.
deliquescens IPBCC 07.543 mencapai maksimum pada pH 5,5, tumbuh optimum
pada pH 4,5 dan cenderung menurun dengan meningkatnya pH medium kultur, tetapi pada pH 4,5 produksi AIA relatif rendah. Pertumbuhan optimum pada pH 4,5
menunjukkan toleran terhadap kondisi asam. Selain itu, G. deliquescens IPBCC 07.543 mengindikasikan memiliki kemampuan tumbuh pada kisaran pH yang cukup luas. Hal ini berbeda dengan G. roseum yang tumbuh optimum pada kisaran 6,4-8,0 (Isaac 1954).
Penicillium notatum IPBCC 07.555 selain menunjukkan pertumbuhan yang
baik di pH asam juga mampu memproduksi AIA dengan kadar yang cukup tinggi pada pH asam. Produksi AIA dari P. notatum IPBCC 07.555 optimum pada pH 5,0 dan 5,5. pH akhir medium P. notatum IPBCC 07.555 cenderung menurun dan menunjukkan toleran terhadap kondisi asam. Hal ini ditunjukkan oleh pertumbuhan yang baik di pH asam dan optimum pada pH 4,5. Kapang P. notatum IPBCC 07.555 menunjukkan produksi AIA, pertumbuhan, dan toleran terhadap kondisi asam yang lebih baik dibandingkan dengan kapang terpilih lainnya. Imaningsih (2010) menyatakan bahwa Penicilliumsp. 09.620 asal serasah tanaman hutan meranti dapat memproduksi AIA hingga 27,78 kali lipat dari kontrol setelah penambahan pepton 1%.
Sifat Antagonistik
Interaksi antagonistik pada isolat kapang terpilih tidak menunjukkan sifat antagonis. Nilai persentase hambatan pertumbuhan dari setiap kapang yang diuji sangat rendah yaitu berkisar antara 0,00-0,65%. Nilai penghambatan ini sangat kecil jika dibandingkan dengan penghambatan oleh A. niger
Gliocladium deliquescens IPBCC 07.543 sama sekali tidak menunjukkan
adanya respon penghambatan dalam pertumbuhan dari setiap lawan antagonis kapang terpilih. G. deliquescens dikenal sebagai kapang antagonis yang dapat menghambat pertumbuhan kapang patogen (Abou-Zeid et al. 2008).G.deliquescens secara signifikan menghambat pertumbuhan radial dari semua koloni patogen yang diuji bila dibandingkan dengan kontrol. Sebesar 63,33% G. deliquescens menghambat terhadapFusarium solani yaitu sebesar 75% (Madhanraj2010) danPleospora herbarum yaitu sebesar 55,4% (Abdel-Sater 2001).
pertumbuhan P. chrysogenum dan 29,75% terhadap Cephalosporiummadurae(
Hasil uji konfirmasi produksi AIA dengan menggunakan HPLC menunjukkan bahwa kapang-kapang dari konsorsium terpilih (G, L, M dan O) memproduksi AIA. Hal ini ditunjukkan oleh profil puncak waktu retensi yang sama dengan waktu retensi pada standar AIA komersial yaitu 7,1. Dengan demikian, senyawa indol yang dihasilkan oleh konsorsium terpilih merupakan jenis AIA.Produksi AIAtertinggi didapat oleh konsorsium M yaitu sebesar 38,66 ppm diikuti oleh konsorsium O (23,58 ppm), G (23,13 ppm), dan L (21,57 ppm). Hasil uji kadar AIA pada konsorsium kapang terpilih dengan menggunakan HPLC lebih tinggi dibanding hasil pengujian dengan menggunakan pereaksi Salkowski. Hal ini menunjukkan
Abou-Zeidet al. 2008).
Produksi AIApada Beberapa Konsorsium Kapang
Produksi AIA pada beberapa konsorsium kapang secara umum lebih tinggi dibandingkan dengan bentuk kultur tunggal. AIA yang diproduksi bervariasi tergantung kepada bentuk konsorsiumnya, yaitu berkisar 3,28±0,07 ppm hingga 10,51±1,25 ppm. Mittal et al. (2008) melaporkan bahwa kadar AIA yang dihasilkan oleh dua galurA.awamori dan empat galurP.citrinum dalam bentuk konsorsium yaitu sebesar 2,5 ppm sampai dengan 9,8 ppm. Dengan demikian, kadar AIA yang dihasilkan oleh kapang terpilih asal Katingan dalam bentuk konsorsium tersebut tidak jauh berbeda dengan kadar AIA yang dilaporkan oleh Mittal et al. (2008), bahkan sedikit lebih tinggi.
Produksi AIAP. notatum IPBCC 07.555 dalam bentuk kultur tunggal menghasilkan AIA tertinggi. Kehadiran P. notatum IPBCC 07.555 pada bentuk konsorsium cenderung selalu menghasilkan kadar AIA yang tinggi. Produksi AIA tertinggi didapat oleh konsorsium G. deliquescens IPBCC 07.543 dengan P. notatum IPBCC 07.555. Pandya dan Saraf (2010)mengemukakan bahwa Gliocladium dan
Penicilliummerupakan cendawan yang toleran terhadap cekaman dan mampu
membentuk asosiasi mutualistik yang mengakibatkan peningkatan biomasa.
sensitivitas dan akurasi HPLC jauh lebih tinggi dibanding pengukuran dengan menggunakan pereaksi Salkowski (Guinn et al. 1986). HPLC memiliki sensitivitas yang tinggi pada jalur detektor sehingga memungkinkan selektivitas yang tinggi terhadap fraksi-fraksi yang diuji (Guinn et al. 1986).
Pengujian AIA dengan menggunakan HPLC biasanya tidak menggunakan panjang gelombang 530 nm tetapi pada panjang gelombang 254 nm (Guinn et al. 1986). Panjang gelombang yang digunakan untuk uji konfirmasi AIA dengan HPLC dari konsorsium kapang terpilih ialah sama dengan panjang gelombang pada uji AIA dengan menggunakan pereaksi Salkowski yaitu 530 nm. Dengan menggunakan panjang gelombang 530 nm ini, dihasilkan kromatogram dengan satu profil puncak pada waktu retensi 7,1. Kenyataan ini mengindikasikan bahwa panjang gelombang 530 nm lebih spesifik untuk mendeteksi AIA. Menurut Guinn et al. (1986), pengujian AIA dengan menggunakan panjang gelombang 254 nm kurang spesifik untuk AIA, tetapi panjang gelombang ini dapat digunakan untuk uji AIA jika sampel sudah dimurnikan dengan baik.
Berdasarkan hasil penelitian di atas, pengkajian lebih lanjut dari isolat-isolat terpilih dalam penggunaan sumber glukosa, sumber nitrogen, suhu, dan waktu inkubasi yang tepat untuk produksi AIA secara optimum perlu dilakukan. Selain itu, pengkajian tentang aplikasi isolat terpilih baik pada skala laboratorium (bioasai) maupun pada skala lapangan dalam kondisi asam, serta potensi isolat dalam produksi AIA melalui rekayasa genetika (bioteknologi molekuler) perlu juga dilakukan.