SKRIPSI
PEMODELAN MOLEKUL BERDASARKAN METODA PERHITUNGAN SEMIEMPIRIK AM1 UNTUK SINTESIS POLIMER TERCETAK
MOLEKUL ASAM KAFEAT
MOLECULAR MODELLING BASED ON AM1 SEMIEMPIRICAL METHOD FOR SYNTHESIS OF CAFFEIC ACID MOLECULAR IMPRINTED
POLYMER
Arma Desta Wiratama
11/320022/PA/14318
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS GADJAH MADA
YOGYAKARTA
2016
i
MOLEKUL ASAM KAFEAT
MOLECULAR MODELLING BASED ON AM1 SEMIEMPIRICAL METHOD FOR SYNTHESIS OF CAFFEIC ACID MOLECULAR IMPRINTED
POLYMER
Diajukan untuk memenuhi salah satu syarat memperoleh derajat Sarjana Sains Ilmu Kimia
Arma Desta Wiratama
11/320022/PA/14318
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS GADJAH MADA
YOGYAKARTA
2016
iii
PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi ini tidak terdapat karya yang pernah diajukan untuk memperoleh gelar kesarjanaan di suatu Perguruan Tinggi, dan sepanjang sepengetahuan saya juga tidak terdapat karya atau pendapat yang pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara tertulis diacu dalam naskah ini dan disebutkan dalam daftar pustaka.
Yogyakarta, 19 Januari 2016
iv
rahmat dan hidayah serta karunia-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul “PEMODELAN MOLEKUL BERDASARKAN METODA PERHITUNGAN SEMIEMPIRIK AM1 UNTUK SINTESIS POLIMER TERCETAK MOLEKUL ASAM KAFEAT” sebagai salah satu bentuk tanggung jawab mahasiswa yang dilakukan untuk memperoleh gelar Sarjana Sains Ilmu Kimia di Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Gadjah Mada.
Penulis menyadari bahwa kelancaran dan keberhasilan selama ini merupakan anugerah dari Allah SWT dan tidak lepas dari restu orangtua dan peran banyak pihak, untuk itu penuh rasa tulus dan hormat, penulis mengucapkan terima kasih kepada:
1. Prof. Dr. Mudasir, M.Eng selaku dosen pembimbing pertama dan Drs. Iqmal Tahir, M.Si selaku dosen pembimbing kedua yang telah memberikan bimbingan dan pengarahan kepada penulis selama penelitian berlangsung hingga terselesaikannya skripsi ini.
2. Kepala Laboratorium Kimia Fisika Jurusan Kimia FMIPA UGM beserta seluruh staf Laboratorium Kimia Fisika FMIPA UGM khususnya Laboratorium Austrian Indonesian Computational yang telah memfasilitasi dan membantu penulis selama pelaksanaan penelitian ini.
3. Dra. Endang Astuti, M.Si., selaku pembimbing akademik yang telah membimbing dan mengarahkan dalam kegiatan perkuliahan selama proses studi.
4. Cahyo Ambuko dan Fernando Nainggolan selaku partner tugas akhir yang telah membantu, bekerja sama dan mengarahkan dengan sabar selama proses penelitian tugas akhir berlangsung.
v
Penulis menyadari skripsi ini masih jauh dari sempurna, oleh karena itu penulis mengharapkan saran dan kritik yang membangun. Tidak ada yang penulis harapkan selain doa agar ilmu yang diperoleh bermanfaat di dunia dan di akhirat. Semoga laporan penelitian ini dapat memberikan banyak manfaat bagi semua pihak maupun pembaca. Jika ada banyak kekurangan, semoga ke depan dapat lebih diperbaiki dan disempurnakan.
Yogyakarta, 19 Januari 2016
vi
Skripsi adalah sebuah bagian dari tahapan kecil menuju proses selanjutnya yang harus dilalui dengan penuh rasa syukur kepada Allah SWT. Karya ini adalah wujud terima kasih saya kepada:
1. Bagian terpenting dalam hidup yaitu Orangtua yang selalu sabar membimbing dan bekerja tak kenal lelah, Alm Bapak Priyono dan Ibu Dwiyanti Budi Astuti serta kakak-kakak saya, terima kasih atas segala kasih sayang, dukungan, doa dan pengorbanan yang tiada henti serta keluarga besar yang selalu mendoakan.
2. Sahabat-sahabat yang selama ini menemani, mendukung dan berperan penting selama hampir 5 tahun menimba ilmu di Kimia UGM tercinta ini.
3. Penyemangat dan teman cerita dalam menyusun masa depan, Istna Chunaifah terimakasih untuk segala peranmu menjadi motivator hidup.
4. Semua pihak yang tidak dapat disebutkan satu persatu yang membantu terciptanya karya ini.
“Hidup yang sukses tidak diukur dari banyaknya materi yang kita punya, melainkan dari banyaknya manfaat yang mampu kita berikan untuk orang lain, semangat menjalani hidup dan buatlah hidupmu berarti”
vii
DAFTAR ISI
KATA PENGANTAR iii
HALAMAN PERSEMBAHAN v DAFTAR ISI vi DAFTAR TABEL DAFTAR GAMBAR vii viii INTISARI ix ABSTRACT x BAB I PENDAHULUAN
I.1 Latar Belakang 1
I.2 Tujuan Penelitian 4
I.3 Manfaat Penelitian 5
BAB II TINJAUAN PUSTAKA DAN PERUMUSAN HIPOTESIS
II.1 Tinjauan Pustaka 6
II.1.1 Polimer tercetak molekul 6
II.1.2 Polimer tercetak molekul dan peranannya sebagai material selektif
10 sebagai material selektif
II.1.3 Arti penting optimasi komposisi dalam MIP II.1.4 Perhitungan semiempirik AM1 untuk desain MIP
11 12 II.1 Perumusan Hipotesis dan Rancangan Penelitian
II.2.1 Perumusan hipotesis 14 14 II.2.2 Rancangan penelitian 15 BAB III METODE PENELITIAN
III.1 Bahan dan Alat 16
III.2 Prosedur Kerja 16
BAB IV HASIL PENELITIAN DAN PEMBAHASAN IV.1 Pemilihan Monomer Fungsional
IV.2 Interaksi Asam Kafeat-Asam Metakrilat IV.3
20 28 33
IV.3 Analisis Rasio Molekul Optimum 31
IV.4 Pencarian Templat Pengganti Asam Kafeat
35
BAB V KESIMPULAN 39
DAFTAR PUSTAKA 40
viii
Tabel IV.1 Nilai momen dipol monomer fungsional 23 Tabel IV.2 Nilai energi interaksi (∆E) kompleks 24 Tabel IV.3 Data energi interaksi asam kafeat-asam metakrilat pada
variasi rasio molekul 32 Tabel IV.4 Data struktur templat pengganti asam kafeat 38 Tabel IV.5 Data ∆µ, ∆BM dan ∆Vm dari kelima calon templat pengganti 38
ix
DAFTAR GAMBAR
Gambar I.1 Struktur molekul asam kafeat 1 Gambar II.1 Prinsip dasar dari polimer tercetak molekul 6 Gambar IV.1 (a) Struktur asam kafeat 3D hasil optimasi (b) rapat muatan
total, (c) potensial elektrostatik 20
Gambar IV.2 Ilustrasi visual rapat muatan total pada interaksi asam kafeat- asam metakrilat 22 GambarIV.3 Diagram energi interaksi kompleks monomer fungsional-
templat terseleksi momen dipol 25
GambarIV.4 Ilustrasi interaksi kompleks antara asam kafeat dengan
monomer fungsional 27
GambarIV.5 Visualisasi kombinasi interaksi kompleks asam kafeat
dan asam metakrilat pada posisi yang berbeda-beda. 29 GambarIV.6 Diagram energi interaksi kompleks kafeat-asam metakrilat
dengan rasio 1:1 30
Gambar IV.7 Muatan atom-atom pada sisi aktif asam kafeat 30 Gambar IV.8 Grafik ∆E dan ∆(∆E) untuk kompleks asam kafeat-asam
metakrilat pada variasi rasio 34
Gambar IV.9 Visualisasi interaksi asam kafeat-asam metakrilat dengan rasio 1:1. Garis putus menunjukkan ikatan hidrogen. 35 Gambar IV.10 Contoh outline mekanisme pembentukan MIP-dengan
templat asli dan dengan templat pengganti 36 Gambar IV.11 Struktur asam kafeat dan beberapa calon templat pengganti 37
x
PERHITUNGAN SEMIEMPIRIK AM1 UNTUK SINTESIS POLIMER TERCETAK MOLEKUL ASAM KAFEAT
Oleh:
Arma Desta Wiratama 11/320022/PA/14318
Telah dilakukan pemodelan molekul pada sintesis polimer tercetak molekul (Molecular Imprinted Polymer, MIP) berdasarkan metode semiempirik AM1. Tujuan penelitian ini adalah memilih monomer fungsional yang sesuai serta memperoleh rasio molekul dalam MIP yang dapat meningkatkan selektivitas dan afinitas.
Pada tahap pertama, penelitian berupa pemilihan monomer fungsional yang efektif untuk asam kafeat dan dilakukan dengan pendekatan kimia komputasi menggunakan metode semiempirik AM1. Proses seleksi didasarkan pada parameter momen dipol, energi interaksi, dan ikatan hidrogen yang terbentuk. Tahap kedua adalah penentuan rasio optimum asam kafeat/asam metakrilat. Kajian dilakukan dengan pemodelan molekul yang mempelajari interaksi non kovalen antara asam kafeat sebagai templat dan asam metakrilat sebagai monomer fungsional. Evaluasi rasio optimum didasarkan pada kestabilan kompleks antara asam kafeat dan asam metakrilat.
Hasil penelitian menunjukkan bahwa kompleks stabil terbentuk dengan melibatkan ikatan hidrogen. Dari hasil kajian terpilih beberapa monomer fungsional yang sesuai untuk asam kafeat seperti asam metakrilat dan asam akrilat. Kompleks dengan energi interaksi optimum diperoleh dari kompleks asam kafeat/asam metakrilat dengan rasio 1:1. Kompleks dengan rasio ini kemudian direkomendasikan sebagai rasio molekul terbaik pada sintesis polimer tercetak asam kafeat. Pada pencarian templat pengganti sebagai pengganti asam kafeat terpilih senyawa asam 3-(4-metoksifenil)-propanoat berdasarkan pada kesesuaian nilai momen dipol, BM dan volume molekular.
Kata kunci : asam kafeat, asam metakrilat, semiempirik AM1, polimer tercetak molekul
xi
ABSTRACT
MOLECULAR MODELLING BASED ON AM1 SEMIEMPIRICAL METHOD FOR SYNTHESIS OF CAFFEIC ACID MOLECULAR
IMPRINTED POLYMER
By:
Arma Desta Wiratama 11/320022/PA/14318
Research on molecular modelling based on AM1 semiempirical method for synthesis of molecularly imprinted polymer has been conducted. The aims of the research are to choose suitable functional monomers and to obtain molecule ratio in MIP to increase the selectivity and affinity.
The first stage of experiment was selection of the effective functional monomer for MIP synthesis of caffeic acid and it, was done by using computational chemistry approach applying AM1 semiempirical method. Selection processes have been done based on dipole moment, interaction energy, and hydrogen bonding parameters. Second stage experiment was determination of optimum ratio between caffeic acid/methacrylic acid for designing of molecular imprinted polymer (MIP). This study was performed based on molecular modeling to study non covalent interactions between caffeic acid as template and methacrylic acids as functional monomers. The evaluation to determine stability of a caffeic acid/methacylic acid complex was done based on interaction energies obtained from calculation.
The result showed that the stable complex of caffeic acid and methacylic acid involves hydrogen bonding interactions. From the result study selected some functional monomers that suitable for caffeic acid such as methacrylic and acrylic acids. A complex with optimum interaction energy was obtained at the ratio of caffeic/methacrylic of 1:1. This indicates that the best molecule ratio of caffeic acid/methacylic acid for synthesize of caffeic acid imprinted polymer achieved at 1:1 molecule ratio. Based on value suitability of dipole moment, molecular weight and molecular volume, 3-(4-methoxyphenyl)-propanoic acid has been selected as caffeic acid substitute template.
Keywords: caffeic acid, methacrylic acid, AM1 semiempirical, molecular imprinted polymer
1
BAB I
PENDAHULUAN
I.1 Latar Belakang
Asam kafeat atau asam 3-(3,4-dihidroksifenil)-2-propenoat adalah suatu asam fenolik yang ditemukan dalam berbagai produk pertanian seperti kopi, kacang-kacangan, kentang, biji-bijian, dan sayuran (Friedman, 1997). Senyawa itu memiliki berbagai efek antara lain sebagai bahan antioksidan, anti inflamasi, dan anti diabetes, serta anti nociceptive (Chen dan Ho, 1997; Jung dkk., 2006; Gulcin, 2006; de Campos Buzzi dkk., 2009; Chao dkk., 2010). Asam kafeat adalah senyawa yang terkenal sebagai antioksidan fenolik yang penting dan terdapat dalam banyak tanaman dan minuman, termasuk kopi, jus apel dan anggur putih.
Gambar I.1 Struktur kimia asam kafeat
Senyawa fenolik merupakan metabolit sekunder tanaman dan secara alami ada di hampir semua jenis tanaman, termasuk produk makanan yang berasal dari tumbuhan. Senyawa ini diduga menjadi bagian dari makanan manusia dan hewan. Hal ini menyumbang hingga 70% bagian dari total asam hidroksi sinamat dalam buah-buahan. Asam kafeat merupakan antioksidan fenolik yang alami, mengandung cincin katekol yang aromatis. Asam kafeat dilaporkan memiliki lingkup yang luas dari kegiatan biologis yang bermanfaat bagi kesehatan manusia (Motomura dkk., 2008; Chao dkk,, 2010; Kudugunti dkk., 2010; Maurya dan Devasagayam, 2010; Prasad dkk., 2011). Asam kafeat juga dapat memperlambat proses peradangan, sehingga memberikan perlindungan dari efek berbahaya radikal dan kerusakan endotel. Mengingat kegunaannya maka asam kafeat banyak dibutuhkan sebagai nutrasetikal yaitu bahan yang memberikan manfaat medis
2
atau merupakan bahan bioaktif dari tanaman yang berkhasiat obat. Untuk memenuhi produk ini diperlukan proses isolasi dan prakonsentrasi asam kafeat dari bahan dasarnya.
Berdasarkan strukturnya, terdapat beberapa senyawa lain yang mirip dengan asam kafeat sehingga proses isolasi yang selektif memerlukan teknik tersendiri yang spesifik sehingga dapat dilakukan pemisahan asam kafeat dari bahan alamnya. Isolasi dan prakonsentrasi bahan alam termasuk asam kafeat ini secara selektif dapat dilakukan dengan jalan ekstraksi fase padat. Teknik ini dapat dibantu dengan menggunakan polimer tercetak molekul (Molecular imprinted
polymer, MIP) untuk mengikat molekul target secara selektif, bahkan ketika
bahan alam tersebut berada dalam matriks yang kompleks. Pada hal ini, MIP merupakan bahan baru dan dikenal memiliki kemampuan biomimetik yang berfungsi sebagai peniru antibodi yang mengikat (Sellergen, 2001). Pengenalan karakter molekul ini memiliki kegunaan di beberapa bidang yang berbeda, seperti sensor, aplikasi biomedis, pemisahan enantiomer dan aplikasi analisis seperti adsorben untuk ekstraksi fase padat dan lainnya. Penggunaan secara luas dari polimer tercetak molekul pada ekstraksi fase padat (Solid Phase Extraction, SPE) mengindikasikan bahwa teknik ini sering digunakan dalam persiapan sampel sebelum analisis. Keuntungan menggunakan Molecular Imprinted Solid Phase
Extraction (MISPE) tidak hanya dalam prakonsentrasi dan pembersihan sampel
tetapi juga ekstraksi yang selektif terhadap target analit, yang sangat penting dalam sampel yang kompleks atau terkontaminasi (Vasapollo dkk., 2011). Dengan demikian MIP dimungkinkan berguna untuk pengayaan dan pemurnian senyawa aktif yang ada dalam jumlah banyak.
Pencetakan molekul melibatkan monomer fungsional yang dipolimerisasikan sekitar templat (pseudo-sasaran analit atau target analit yang sebenarnya), diikuti oleh polimerisasi dan penghilangan templat. Gugus fungsional molekul templat harus dipastikan dapat berinteraksi dengan gugus fungsional pada polimer dan hal ini merupakan aspek yang sangat penting dalam teknik ini. Pengaturan interaksi ini umumnya dicapai dengan interaksi non kovalen antara gugus fungsional tertentu pada monomer fungsional dan templat,
yang mana posisi monomer dalam orientasi tertentu berhubungan dengan molekul templat sebelum polimerisasi.
Selanjutnya, dilakukan taut silang dari monomer-monomer yang digunakan untuk membentuk kerangka 3D polimer, bentuk yang kaku, membentuk struktur berpori sekitar molekul templat dan menghasilkan rongga ikatan yang stabil. Setelah polimerisasi dan penghilangan templat, kelompok fungsional dalam matriks polimer templat kemudian bisa mengenali dan mengikat target analit menggunakan cara yang sama yaitu interaksi non kovalen selama sintesis.
Sintesis MIP dilakukan berdasarkan prinsip polimerisasi yang melibatkan monomer fungsional, taut silang, inisiator, dan pelarut (Kirsch dkk., 2000). Prosedur sintesis MIP dilakukan dengan mencampurkan molekul target pada bahan polimer yang pada akhir proses templat akan dilepaskan kembali sehingga menghasilkan polimer dengan kaviti yang secara bentuk, ukuran, dan susunan kimia mirip dengan molekul templat (Yan dan Row, 2006). Sebelum melakukan sintesis MIP di laboratorium, optimasi komposisi tertentu dan kondisi proses sintesis dapat diketahui melalui beberapa metode seperti metode kombinatorial (Batra dan Shea, 2003), langkah trial and error, dan desain berbantuan komputer (Computer Aided Design, CAD). Pendekatan CAD telah sukses diaplikasikan untuk menyeleksi monomer fungsional, desain rasio molekul templat-monomer, dan prediksi pelarut yang efektif untuk sintesis polimer tercetak molekul. Metode ini sangat bermanfaat karena dibandingkan dengan metode trial and error dan metode kombinatorial, penggunaan pendekatan komputasi memiliki beberapa keuntungan seperti harga yang murah, waktu pengerjaan yang singkat, aman untuk tubuh manusia (beberapa pelarut bersifat karsinogenik), dan tidak ada buangan bahan kimia (Riahi dkk., 2009; Pardeshi dkk., 2012).
Untuk mendapatkan MIP yang selektif terhadap molekul templat maka beberapa hal yang perlu diperhatikan yaitu penggunaan monomer fungsional, pelarut serta rasio templat-monomer fungsional yang sesuai dalam sintesisnya. Berdasarkan hasil analisis HPLC, Bakas dkk., (2013) dan Ahmadi dkk., (2011) melaporkan bahwa penggunaan monomer dan pelarut yang tidak sesuai dapat
4
menurunkan tingkat absorptivitas MIP dikarenakan molekul templat tidak terikat cukup kuat dalam kavitas MIP. Selanjutnya, Tahir dkk., (2012a) telah melaporkan optimasi rasio antara templat kuersetin dengan monomer asam metakrilat dan dengan analisis UV/Vis yang didapatkan bahwa jumlah monomer yang berlebih akan mengurangi situs adsorpsi selektif dan meningkatkan resistensi transfer massa. Dengan demikian optimasi komposisi menjadi pertimbangan yang penting sebelum sintesis MIP.
Proses penemuan senyawa baru dengan aktivitas yang lebih tinggi tanpa efek biologis yang merugikan memerlukan langkah-langkah eksperimen yang meliputi desain, sintesis, purifikasi, identifikasi dan uji aktivitas. Metode eksperimen ini perlu didukung pendekatan teoritis/pemodelan karena seringkali produk yang diperoleh tidak mempunyai aktivitas yang lebih baik dari senyawa yang telah ada meskipun tahapan-tahapan eksperimental tersebut telah dilakukan sehingga waktu, biaya, dan tenaga yang telah dikeluarkan dalam kerja di laboratorium menjadi sia-sia. Model hubungan antara struktur, baik elektronik maupun geometri dari satu atau sekelompok molekul yang mempunyai aktivitas tertentu dapat dicari melalui suatu pemodelan sebelum dilakukan sintesis terhadap senyawa tersebut. Pemodelan ini dilakukan dengan menggunakan komputer yang merupakan salah satu alternatif dari pemecahan masalah dalam pencarian senyawa baru dengan memodifikasi struktur kimia (Mudasir dkk., 2003).
I.2 Tujuan
Penelitian ini bertujuan untuk :
1. Mencari beberapa senyawa monomer fungsional yang efektif untuk sintesis polimer tercetak molekul asam kafeat dengan pendekatan kimia komputasi dengan metode semiempirik AM1.
2. Menerapkan pemodelan molekul interaksi antara asam kafeat-asam metakrilat dengan pendekatan metode semiempirik AM1 untuk penentuan rasio molekul kompleks terbaik dan optimum pada polimer tercetak molekul.
3. Dapat mencari templat pengganti untuk asam kafeat guna keperluan sintesis MIP
I.3 Manfaat
Hasil penelitian ini diharapkan memberikan informasi mengenai monomer fungsional yang efektif dan selektif berdasarkan kekuatan dan sifat interaksinya terhadap molekul templat asam kafeat serta rasio optimum templat/monomer fungsional yang harus digunakan dalam sintesis MIP di laboratorium guna meningkatkan sensitivitas dan selektivitas pada saat analisis.
6
BAB II
TINJAUAN PUSTAKA DAN PERUMUSAN HIPOTESIS
II.1 Tinjauan Pustaka
II.1.1 Polimer tercetak molekul
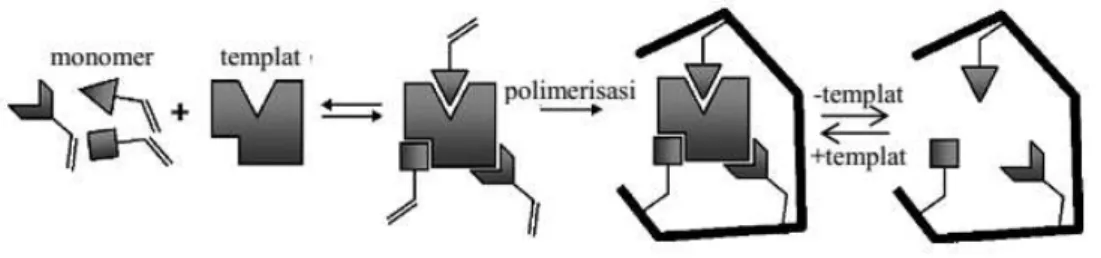
Polimer tercetak molekul atau MIP adalah suatu matriks polimer yang terbentuk mengelilingi templat atau molekul analit dan kemudian templat tersebut dihilangkan sehingga terbentuk rongga atau kaviti pada polimer tersebut. Akibat proses pencetakan seperti ini maka polimer akan memiliki afinitas tinggi terhadap templat (Anderson dan Nicholls, 1997). Sintesis MIP dilakukan dengan cara
self-assembly antara monomer fungsional dengan molekul templat dalam larutan yang
diikuti dengan kopolimerisasi monomer fungsional dengan sejumlah besar molekul taut silang yang sesuai. Setelah polimer terbentuk, kemudian molekul templat dilepaskan kembali dengan menggunakan pelarut yang sesuai atau dengan pemanasan sehingga akan dihasilkan kaviti atau ruang kosong yang mirip dengan molekul templat (Jin dan Kyung, 2005).
Gambar II.1 Prinsip dasar dari polimer tercetak molekul (Sellergen dan Allender, 2005)
Pada Gambar II.1 disajikan skema proses sintesis MIP sehingga pada produk akhir tersisa kaviti hasil pencetakan molekul templat. Sintesis tersebut dilakukan berdasarkan prinsip polimerisasi dengan melibatkan molekul target (templat), monomer fungsional, taut silang, inisiator dan pelarut. Untuk keperluan optimasi komposisi tertentu dan kondisi proses sintesis MIP dapat dilakukan dengan langkah trial and error, desain eksperimen atau desain berbantuan
komputer. Salah satu faktor penting dalam sintesis MIP adalah rasio molekul antara templat dan monomer fungsional yang digunakan. Jadi keperluan sintesis MIP asam kafeat untuk aplikasi ekstraksi bioaktif diperlukan informasi rasio molekul optimum antara asam kafeat dan monomer fungsional. Beberapa paper melaporkan penggunaan asam metakrilat cukup baik untuk digunakan sebagai monomer fungsional bagi templat yang memiliki situs aktif polar (Jin dan Kyung, 2005; Yan dan Row, 2006; dan Khan dkk. 2012).
Pada aplikasi untuk bahan polimer tercetak molekul ini sendiri, kajian pemodelan molekul telah banyak dilaporkan pada beberapa paper (Spivak, 2005; Yao dkk. 2008) dan berhasil menghasilkan data teoritik yang bermanfaat untuk sintesis selanjutnya. Dalam hal mengkaji interaksi monomer dan templat ini dapat dilakukan penggunaan perhitungan mekanika kuantum ab initio atau semiempirik. Salah satu metoda semiempirik yang dapat digunakan untuk mempelajari interaksi antar molekul adalah metoda AM1. Penggunaan metoda semiempirik AM1 telah digunakan untuk keperluan desain MIP oleh beberapa peneliti (Farrington dan Regan, 2007, Yao dkk., 2008, Tahir dkk., 2012a) karena alasan kecepatan dan tingkat akurasi yang tetap mampu memberikan hasil memuaskan.
Pencetakan molekul didasarkan pada kopolimerisasi antara templat-monomer fungsional (vinil, akrilik, metakrilat) membentuk kompleks yang mengikat dengan kelebihan silang di- atau tri-vinil monomer, sehingga membentuk jaringan material organik berpori. Templat bisa dihubungkan dengan monomer fungsional oleh ikatan kovalen koordinasi ion logam, atau obligasi non kovalen. Dua pendekatan utama untuk pencetakan molekul telah ada sampai saat ini, namun dilakukan dengan berbagai modifikasi dan kombinasi: (i) Pendekatan kovalen diawali oleh Wulff dan Sarhan (1972), dan pendekatan non kovalen awalnya dikembangkan oleh Arshady dan Mosbach (1981). Sementara terkait stoikiometri didefinisikan dengan baik melalui pendekatan kovalen yang memiliki kelebihan, pencetakan non kovalen dan teknik pengenalan (molecular
recognition) yang telah banyak dalam literatur, karena berfungsi sebagai
fasilitator, mudah beradaptasi dan sintesis yang cepat, adanya kemiripan dengan mekanisme pengenalan molekul reseptor alam, dan ketersediaan monomer
8
fungsional substansial yang dilaporkan dalam literatur. Namun, kompleksitas dan berbagai interaksi lemah di non kovalen pencetakan perlu dipertimbangkan dengan cermat untuk mengontrol sifat pengenalan MIP non kovalen. Selain itu, heterogenitas situs pengikat yang diproduksi oleh pencetakan non kovalen mencegah MIP non kovalen dari perilaku seperti lapisan yang sangat terorganisir seperti pada antibodi. Pada aplikasi MIP non kovalen memiliki keuntungan dalam proses pemisahan jalur yang panjang atau pada saat waktu inkubasi, sebagaimana diatur dalam aplikasi pemisahan dan tes. Sebaliknya, penggunaan MIP non kovalen dalam teknologi penginderaan kimia yang membutuhkan sinyal yang cepat dan sangat selektif, sehingga kurang baik mengingat fleksibilitas dan kemiripan paling dekat dengan mekanisme pengenalan alami, yang pada penelitian ini akan fokus pada pencetakan non kovalen (Wei dkk., 2007).
Pengenalan (recognition) selektif molekul biologis yang relevan mengatur banyak interaksi biologis esensial. Oleh karena itu pada pembentukan atau sintesis, reseptor dibuat mampu mengenali molekul target yang kemudian menarik dengan afinitas tinggi dan selektivitas yang menjadi tujuan jangka panjang untuk penelitian para ilmuwan di bidang kimia, biologi, dan farmasi. Dibandingkan dengan reseptor alami, produksi dan pengolahan reseptor sintetis lebih sederhana dalam sintesis, lebih murah, dan kemampuan merancang reseptor yang lebih kuat (sellergen, 2001; Molinelli dkk., 2005).
Selama beberapa dekade terakhir, teknik pencetakan atau templat molekul telah diadopsi sebagai strategi sintesis serbaguna menyediakan berbagai rute sintesis untuk mencapai tujuan. Di antara berbagai pendekatan untuk menghasilkan reseptor sintetis, teknik pencetakan molekul menawarkan sejumlah keunggulan yang berbeda, yang meliputi (i) adanya komparatif atau perbandingan dalam pembuatan polimer molekuler yang dicantumkan, (ii) kekuatan yang melekat pada unsur pengenalan (recognition elements) tersebut, dan (iii) stabilitas termal, mekanik, dan kimia yang diperoleh material templat (Sellergen, 2001 ; Molinelli dkk., 2005). Dengan teknik ini relatif telah banyak molekul kecil yang berhasil diaplikasikan untuk deteksi (sensor) dan kuantifikasi molekul templat, serta termasuk penerapan bahan pengenalan pada bidang sensor biomimetik (Kriz
dkk., 1995; Jakusch dkk., 1999; Greene dan Shimizu, 2005), afinitas kromatografi (Kempe dan Mosbach, 1995; Haginaka dan Sanbe, 2001; Watabe dkk., 2005), ekstraksi fase padat (Sellergen dan Allender, 2005), dan tes antibodi (Vidyasankar, 1997). Pada akhirnya tantangan bagi generasi MIP berikutnya adalah sintesis yang dirancang dengan sengaja dan pemahaman tentang reseptor yang lebih baik dengan tingkat efisiensi yang tinggi, dan mendasari pembentukan situs pengikat, caranya adalah dengan menyelidiki interaksi tingkat molekuler antara struktur molekul yang terlibat dalam prosedur pencetakan.
Untuk meningkatkan efisiensi keseluruhan MIP, monomer fungsional dibutuhkan untuk memfasilitasi pembentukan kompleks semakin kuat dengan molekul templat. Penggunaan asam metakrilat (MAA) sebagai monomer fungsional berkaitan dengan fakta bahwa asam karboksilat (kelompok fungsional) dapat bertindak atau membentuk sebagai ikatan hidrogen dan donor proton, serta aseptor ikatan hidrogen (Abraham dkk., 1989). Secara umum, templat yang mengandung gugus fungsional atau ikatan hidrogen berpotensi cocok untuk sistem MAA / EDMA (etilena glikol dimetakrilat) (Sellergen dkk., 1988).
Namun, dalam banyak kasus, kemampuan MIP yang tidak selektif seperti yang diharapkan bahkan setelah optimalisasi pada kondisi sintesis, hal ini berkaitan dengan interaksi lemah antara molekul templat dan monomer fungsional. Dari pertimbangan ini, kelebihan monomer fungsional biasanya diterapkan untuk memastikan pembentukan monomer kompleks templat-fungsional. Situs pengikatan heterogenitas telah ditangani dengan cara menonaktifkan situs afinitas pengikatan yang rendah melalui esterifikasi dengan reagen blocking yang tepat seperti diazometana atau fenil diazometana (Umpleby dkk., 2001).
Dalam proses ini, molekul templat yang digunakan sebagai pelindung sebuah reagen in-situ yang melindungi situs pengikat dengan afinitas yang tinggi. Namun demikian dengan afinitas rata-rata yang semakin meningkat tidak berbanding lurus dengan membaiknya kapasitas pengikatan yang disintesis dari MIP.
10
II.1.2 Polimer tercetak molekul dan peranannya sebagai material selektif Aplikasi MIP yang beragam terutama dalam bidang kimia terapan menyebabkan penelitian mengenai material ini terus berkembang. Pada perkembangannya peranan MIP sebagai material selektif banyak digunakan untuk keperluan ekstraksi fasa padat, penghantar obat, dan bahan sensor kimia (Baeumner, 2003). Rahiminejad, dkk (2009) melaporkan uji adsoptifitas MIP dengan teknik ekstraksi fasa padat untuk analisis kandungan diazinon dalam air mineral dan didapatkan lebih dari 90% diazinon dalam sampel teradsorb secara efektif. Lebih lanjut Awokoya dan Moronkola (2012) telah berhasil melakukan uji adsorptivitas MIP selektif dibenzotiofen dan mendapatkan bahwa karakteristik adsorpsi dibenzotiofen pada MIP mengikuti isotermal Langmuir yang mengindikasikan bahwa proses adsorpsi berlangsung pada situs homogen spesifik dan tidak ada adsorpsi lagi setelah situs spesifik diisi oleh molekul templat. Uji selektivitas adsorpsi MIP dalam larutan dibenzotiofen dan benzotiofen menggunakan spektrofotometer UV/Vis menyatakan bahwa MIP sangat selektif terhadap dibenzotiofen. Di samping itu pula, MIP dapat digunakan kembali dalam lima kali pengulangan tanpa kehilangan performa adsorptivitas dan selektivitasnya. Hasil yang sama pula didapatkan oleh He dkk. (2012) pada MIP selektif kaemferol.
Perkembangan riset MIP sebagai sistem pengantar obat telah banyak dilakukan pada berbagai molekul templat diantaranya Piletsky dkk. (2006), Singh dan Chauhan (2008) dan Zhao dkk. (2009). Sebagai contoh, nanopartikel MIP telah berhasil disintesis oleh Rostamizadeh dkk. (2012) dan menunjukkan kapasitas loading yang tinggi terhadap naltrekson. Selain itu mekanisme pelepasan obat dalam MIP lebih mudah dikontrol karena adsorpsi senyawa obat bukan merupakan absorpsi kimia akan tetapi pengikatan senyawa obat pada kavitas MIP secara non kovalen sehingga dengan perlakukan tertentu akan pelepasan molekul obat lebih terkontrol.
Aplikasi lainnya yaitu salah satu bahan untuk sensor kimia terutama sensor sensitif massa analit seperti sensor Quartz Crystal Microbalance (QCM). Penggunaan MIP dalam sensor QCM akan meningkatkan afinitas dan selektivitas
sensor terhadap bahan analit. Mirmohseni dkk., (2008) melaporkan aplikasi sensor kristal kuarsa untuk pengenalan molekul fenilalanin dalam larutan. Tahap awal MIP selektif fenilalanin disintesis, kemudian dilapiskan pada sensor untuk membentuk struktur komplementer. Penentuan komposisi molekul analit dalam larutan didasarkan pada pergeseran frekuensi elektroda kristal kuarsa termodifikasi MIP dikarenakan adsorpsi fenilalanin. Pergeseran frekuensi berhubungan linier dengan konsentrasi fenilalanin dalam larutan. Hasil yang diperoleh menunjukkan bahwa biosensor termodifikasi MIP memiliki sensitivitas yang tinggi terhadap fenilalanin dibandingkan dengan sensor tanpa MIP. Oleh karena peranannya yang sangat signifikan, maka pengembangan MIP terutama dalam hal optimasi komposisi dan kondisi sintesis terus dilakukan untuk mendapatkan MIP selektif molekul analit.
II.1.3 Arti penting optimasi komposisi dalam MIP
Dalam upaya untuk meningkatkan selektivitas MIP terhadap molekul analit maka optimasi kondisi sintesis MIP perlu dilakukan. Umumnya, optimasi kondisi sintesis MIP meliputi pemilihan monomer fungsional, molekul taut silang dan pelarut yang efektif serta optimasi rasio templat-monomer fungsional. Monomer fungsional berinteraksi secara langsung dengan molekul templat sehingga kriteria pemilihan monomer fungsional harus didasarkan pada kekuatan interaksi kompleks yang dihasilkan. Kekuatan interaksi ini berhubungan langsung dengan tipe interaksi kompleks. Berdasarkan pertimbangan termodinamik dan energetik, dalam MIP non kovalen monomer fungsional yang mampu berinteraksi melalui ikatan hidrogen lebih disukai daripada non ikatan hidrogen (Riahi dkk., 2010). Berdasarkan data eksperimen, kekuatan interaksi melalui ikatan hidrogen berkisar antara 60-120 kJ/mol. Sedangkan kekuatan interaksi phi-phi berkisar antara 0-50 kJ/mol (Albrecht dkk., 2007). Dengan interaksi hidrogen yang relatif kuat ini diharapkan molekul templat tidak akan lepas dengan mudah ketika terperangkap pada kavitas MIP.
Vasquez (2003) telah berhasil melakukan kajian komprehensif mengenai pengaruh monomer fungsional dan molekul taut silang terhadap daya
12
adsorptivitas MIP yang dihasilkan. Hasil yang diperoleh menunjukkan bahwa monomer fungsional dan molekul taut silang efektif adalah yang mampu menstabilkan kompleks templat-monomer fungsional dan struktur polimer. Di samping itu pula, rasio templat-monomer fungsional dan rasio monomer fungsional-molekul taut silang merupakan faktor yang sangat perlu dipertimbangkan dalam sintesis MIP. Rasio templat-monomer fungsional akan mempengaruhi jumlah situs pengikatan komplementer sehingga akan mempengaruhi efektivitas kavitas dalam mengenali molekul templat sedangkan rasio monomer fungsional-molekul taut silang akan mempengaruhi kestabilan kerangka polimer dan kemiripan struktur kavitas dengan molekul templat. Hasil analisis menggunakan HPLC menunjukkan bahwa penggunaan monomer fungsional dan molekul taut silang yang tidak sesuai akan menurunkan daya adsorptivitas MIP. Dengan demikian desain komponen dan kondisi sintesis MIP perlu dilakukan.
II.1.4 Perhitungan semiempirik AM 1 untuk desain MIP
Kimia komputasi termasuk kajian teoritik yang mendukung perkembangan teori-teori ilmu kimia, kajian kimia komputasi terhadap suatu sistem kimia diawali dengan langkah pemodelan sistem yang akan dikaji, dilanjutkan dengan perhitungan sifat fisikokimia, diakhiri dengan analisis data yang dihasilkan dari perhitungan. Jika data eksperimen tersedia, hasil yang diperoleh melalui kajian teori kimia komputasi bisa dibandingkan dengan data-data percobaan. Jika tidak tersedia data eksperimen, maka pemilihan metode yang tepat akan menentukan hasil kajian itu (Jensen, 2007).
Kimia komputasi tidak hanya membicarakan mekanika kuantum saja, tetapi juga mekanika molekular, minimisasi, simulasi, analisis konformasi dan metode komputasi lain untuk memahami serta memperkirakan perilaku sistem molekuler. Pemodelan senyawa dapat menggunakan semua metode tersebut, model senyawa dapat diartikan sebagai representasi dan manipulasi struktur senyawa dan sifat yang didasarkan pada struktur 3D (Leach, 1996).
Perhitungan semiempirik merupakan perhitungan orbital molekul yang didasarkan pada perhitungan kimia kuantum. Perhitungan ini akan menghasilkan penyelesaian terhadap persamaan Schrὃdinger dengan menggunakan pendekatan tertentu dan beberapa data empirik untuk menggambarkan sifat-sifat elektron dari suatu atom atau molekul (Pranowo, 2002). Dibandingkan dengan metode ab
initio, perhitungan dengan metode semiempirik dapat dijalankan lebih cepat
karena tidak semua persamaan diselesaikan secara eksak dan elektron yang diperhitungkan hanyalah elektron valensi saja. Perhitungan semiempirik mekanika kuantum ini meliputi tujuh metode yaitu metode Extended Huckel, Complete
Neglect of Differential Overlap (CNDO), Intermediate Neglect of Differential Overlap (INDO), Modified Neglect on Diatomic Overlap (MNDO), Modified Intermediate Neglect of Differential Overlap (MINDO3), Austin Model 1 (AM1)
dan Parameterized Model 3 (PM3).
Beberapa metode semiempirik yang sering digunakan adalah AM1, PM3 dan MNDO, tetapi secara umum AM1 dan PM3 lebih disukai. AM 1 dan PM3 dapat mengoreksi kesalahan over optimasi yang dilakukan MNDO dalam menghitung tolakan antar atom yang terpisah pada jarak van der Waals. Metode AM1 dan PM3 cukup baik untuk memprediksi cincin beranggota enam seperti benzena (Pranowo, 2002). Dari segi keunggulan dalam perhitungan fungsi tolakan inti, metode AM1 diasumsikan baik digunakan dalam penelitian ini.
Metode AM1 merupakan metode perbaikan serta pengembangan dari metode CNDO dan MNDO terutama untuk perhitungan orbital molekul senyawa-senyawa yang mengandung oksigen dan nitrogen karena merupakan metode perbaikan serta hasil pengembangan lebih lanjut dari metode sebelumnya. Hasil yang diperoleh dari perhitungan ini adalah sifat-sifat elektronik, geometri optimasi, energi total dan panas pembentukan dari molekul yang bersangkutan. Keunggulan metode AM1 ini dibandingkan metode CNDO dan MNDO dari segi teori adalah dapat dilakukan koreksi terhadap adanya tolakan antar inti atom dan terhadap adanya pengaruh ikatan hidrogen (Leach, 1996). Senyawa dalam penelitian ini merupakan senyawa organik yang memiliki ikatan benzena serta mengandung oksigen sehingga AM1 merupakan metode semiempirik yang
14
dianggap cocok dengan mendekati hasil eksperimen. Perhitungan ini telah berhasil digunakan dalam mengevaluasi interaksi non kovalen pada kasus jaringan ikatan hidrogen pada kristal organik (Hajnal dkk., 1999), homo polimerisasi spiroortokarbonat (Harris dkk., 2000), dan interaksi ikatan hidrogen antar molekul pada stereoisomer asam α-fenil furilsinamat (Talaber dkk., 2003). Dengan demikian, dengan menggunakan metode yang sama diharapkan dapat digunakan untuk mempelajari interaksi non kovalen antara monomer fungsional dan templat pada MIP.
II.2 Perumusan Hipotesis dan Rancangan Penelitian II.2.1 Perumusan hipotesis
Dasar Pemikiran 1 :
Pembentukan MIP melewati tahapan struktur supramolekular atau kompleks yang terbentuk dari kompleks dan monomer di dalam pelarut. Kajian kestabilan kompleks tersebut dapat dipelajari dengan bantuan pemodelan molekul. Langkah yang dilakukan dengan perhitungan energi ikat antara templat dan monomer fungsional. Untuk rancangan MIP pada asam kafeat maka langkah serupa dapat diterapkan.
Hipotesis 1 :
Jika asam kafeat diinteraksikan dengan suatu monomer fungsional yang dapat membentuk kompleks maka berdasarkan energi ikat hasil perhitungan mekanika kuantum semiemprik AM1 akan dapat ditentukan monomer-monomer fungsional yang paling sesuai untuk asam kafeat.
Dasar Pemikiran 2 :
Penentuan rasio optimum asam kafeat/asam metakrilat pada desain polimer tercetak molekul (MIP) dapat ditentukan berdasarkan pemodelan molekul yang mempelajari interaksi non kovalen antara asam kafeat sebagai templat dan asam metakrilat sebagai monomer fungsional. Analisis yang dilakukan untuk mencari kestabilan komplek yang terbentuk didasarkan parameter energi interaksi antara asam metakrilat dan asam metakrilat. Rasio kompleks asam kafeat/asam metakrilat yang baik memiliki energi interaksi kompleks yang paling optimum.
Hipotesis 2
Kompleks asam kafeat/asam metakrilat yang paling stabil akan ditandai dengan energi interaksi paling tinggi yang merupakan merupakan rasio optimum kedua senyawa.
Dasar Pemikiran 3 :
Pada struktur molekul asam kafeat yang memiliki ikatan rangkap pada rantai sampingnya, akan berpengaruh pada saat proses sintesis karena senyawa ini dapat terserang agen inisiator seperti radikal bebas dan ikut terpolimerisasi. Hal ini akan berakibat pada sulitnya saat proses pencucian.
Hipotesis 3
Mengingat adanya ikatan rangkap pada rantai alifatisnya maka perlu dilakukan pencarian templat pengganti atau pengganti asam kafeat agar tujuan dari sintesis MIP dapat tercapai.
II.2.2 Rancangan penelitian
Penelitian ini diawali dengan tahap pemilihan monomer fungsional yang di interaksikan dengan templat asam kafeat, parameter yang digunakan adalah momen dipol dan energi interaksi. Monomer yang dipilih memiliki nilai momen dipol besar yang mengindikasikan bahwa monomer tersebut bersifat polar sehingga dapat diinteraksikan dengan asam kafeat yang juga bersifat polar. Energi interaksi dipilih dengan nilai yang optimum sehingga akan membentuk situs ikatan yang baik.
Tahap kedua dilakukan dengan metode yang sama untuk optimasi rasio asam kafeat dan asam metakrilat. Rasio optimum dipilih berdasarkan energi interaksi yang paling optimum.
Setelah itu dilakukan pencarian templat pengganti sebagai pengganti asam kafeat dengan memanfaatkan database dan software kimia komputasi sehingga dapat dipilih templat pengganti yang paling sesuai dan direkomendasikan untuk sintesis MIP.
16
BAB III
METODE PENELITIAN
III.1 Alat dan Materi Penelitian III.1.1 Materi penelitian
Molekul yang dimodelkan adalah asam kafeat dan dua puluh monomer fungsional yang digunakan oleh Karim dkk. (2007). Data struktur monomer fungsional disajikan pada tabel III.1.
III.1.2 Alat
Penelitian ini dilakukan dengan menggunakan seperangkat komputer dengan spesifikasi yaitu, processor Intel® CPU U7300 @1.30 GHz (CPUs), memory 2 GB RAM dan sistem operasi windows 7 32-bit. Prosedur pengerjaan penelitian ini menggunakan software program Hyperchem 8 (Hypercube) (Lisensi: Iqmal-Tahir), Marvin Sketch, Chemspider, RCSB dan pengolahan data menggunakan program Microsoft Excel.
III.2 Prosedur Kerja
III.2.1 Seleksi monomer fungsional
Penelitian ini dimulai dengan melakukan pemodelan molekul asam kafeat dan dua puluh monomer fungsional yang masing-masing dibuat dalam kerangka struktur 2D dan dilanjutkan dengan pembentukan struktur 3D. Selanjutnya pada model molekul yang sudah terbentuk dilakukan optimasi geometri menggunakan algoritma Polak Ribiere dengan gradien Root Mean Square (RMS) ditentukan 0,001 kkal/(Å.mol). Perhitungan energi dan struktur elektronik molekul dilakukan dengan menggunakan pendekatan mekanika kuantum semiempirik AM1 dengan metode Self Consisten Field (SCF) pada tingkat Restricted Hartree-Fock (RHF). Pemodelan kompleks ini berdasarkan pada interaksi sisi aktifnya. Perhitungan dinyatakan selesai sampai kriteria konvergensi tercapai. Untuk mengevaluasi monomer fungsional yang akan memberikan pengikatan yang baik dengan molekul asam kafeat digunakan parameter momen dipol dan energi ikat
suatu senyawa. Senyawa polar akan berinteraksi dengan senyawa yang juga bersifat polar. Dengan mengacu pada referensi dari Farrington dan Regan (2007), energi interaksi monomer fungsional-templat dihitung dengan menggunakan persamaan :
∆E=E kompleks–Easam kafeat–Emonomer fungsional (1) Dimana Ekompleks, Easam kafeat, dan Emonomer fungsional berturut-turut adalah energi ikat kompleks kafeat-asam metakrilat, asam kafeat, dan monomer fungsional. Dari nilai energi interaksi dan momen dipol dilakukan analisis untuk melakukan pemilihan monomer fungsional yang sesuai. Kriteria yang digunakan adalah nilai momen dipol dan energi interaksi templat-monomer.
III.2.2 Optimasi rasio molekul asam kafeat-asam metakrilat
Kemudian penelitian dilanjutkan dengan melakukan pemodelan molekul asam kafeat dan asam metakrilat dengan rasio templat-monomer (1:n) bervariasi mulai n= 1-5. Masing-masing model struktur interaksi dibuat dalam bentuk struktur 2D dilanjutkan dengan pembentukan struktur 3D. Selanjutnya pada model molekul yang sudah terbentuk dilakukan optimasi geometri menggunakan perhitungan dan metode yang sama.
Parameter yang digunakan untuk mengetahui tingkat kestabilan kompleks yang terbentuk adalah energi interaksi kompleks asam kafeat-asam metakrilat yang didapat dengan menerapkan persamaan :
∆E = Ekompleks – Easam kafeat – (n) Easam metakrilat (2) Dimana Ekompleks, Easam kafeat, dan Easam metakrilat berturut-turut adalah energi ikat kompleks kafeat-asam metakrilat, asam kafeat, dan asam metakrilat.
Masing-masing nilai energi tersebut diperoleh dari data hasil optimasi geometri masing-masing senyawa yang dimodelkan. Nilai n pada persamaan (2) adalah jumlah asam metakrilat yang diinteraksikan dan pada penelitian ini dibatasi antara 1-5.
18
Tabel III.1 Struktur monomer fungsional yang digunakan dalam pemodelan (Karim dkk., 2007)
No. Nama Struktur
1 2-vinilpiridin 2 4-vinilpiridin 3 Akrolein 4 Akrilamida 5 Asam akrilat
6 Asam akrilamido-2-metil-1 -propanasulfonat 7 Akrilonitril
8 Alilamin
9 Asam metakrilat
10 Etilen glikol dimetakrilat 11 Hidroksi etil metakrilat 12 m-divinil benzena 13 p-divinil benzena 14 Stirena
15 Asam urokanat
16 N,N-metilen bis akrilamida 17 N,N-dietil amino etil metakrilat 18 Asam urokanat etil ester
19 Asam itakonat 20 Vinil imidazola
III.2.3 Pemilihan templat pengganti
Untuk asam kafeat, struktur molekulnya memiliki ikatan rangkap pada rantai sampingnya. Hal ini berakibat senyawa dapat terserang agen inisiator dan ikut terpolimerisasi. Untuk itu dicari templat pengganti dengan mencari molekul lain yang serupa asam kafeat. Pemilihan dilakukan berdasarkan pencarian struktur serupa yang memiliki data momen dipol, BM dan volume molekular yang tidak jauh berbeda.
20
BAB IV
HASIL DAN PEMBAHASAN
IV.1 Pemilihan Monomer Fungsional
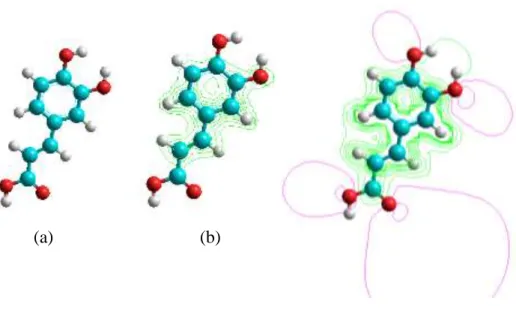
Pada penelitian ini telah dilakukan analisis interaksi setiap monomer fungsional pada templat asam kafeat dengan perhitungan nilai energi ikat dan pengamatan mengenai ikatan non kovalen khususnya ikatan hidrogen pada kompleks yang terbentuk. Untuk menginteraksikan pada posisi yang sesuai, terlebih dahulu disajikan data elektronik molekul asam kafeat yang diwakili oleh peta kontur rapat muatan total dan potensial elektrostatik (Gambar IV.1). Struktur asam kafeat memiliki cincin aromatik dan gugus substituen pada cincin tersebut yaitu 2 gugus hidoksil dan gugus karboksilat yang merupakan gugus penarik elektron karena merupakan pusat elektronegatif.
(a) (b) (c)
= karbon = oksigen = hidrogen
Gambar IV.1. (a) Struktur asam kafeat 3D hasil optimasi (b) peta rapat muatan
total dan (c) peta potensial elektrostatik
Pada Gambar IV.1(b) disajikan peta rapat muatan asam kafeat, dari Gambar ini dapat diketahui informasi mengenai sebaran muatan elektron pada molekul tersebut, dapat dlihat bahwa sebaran elektron berada pada cincin aromatis, dan pada gugus karboksilat dan juga hidroksil yang ditunjukkan dengan garis kontur hijau yang paling rapat. Hal ini mengindikasikan bahwa monomer fungsional akan berinteraksi kuat pada daerah ini. Secara umum, peta rapat muatan elektron total merepresentasikan fungsi kerapatan elektron untuk elektron valensi molekul pada tingkat ⁄ yang menggambarkan peluang untuk menemukan elektron pada suatu titik dalam ruang (Khan dkk., 2012) seperti yang ditunjukkan pada Gambar IV.2. Dari data ini dapat diketahui atom-atom apa saja yang memiliki rapat muatan elektron terbesar yang memungkinkan dapat menimbulkan ikatan hidrogen yang baik jika diinteraksikan dengan molekul asam metakrilat. Peta kontur potensial elektrostatik ditunjukkan pada Gambar IV.1(c). Seperti halnya dengan rapat muatan total, Gambar ini juga memberikan informasi mengenai sisi aktif pada molekul asam kafeat yang ditunjukkan dengan garis merah atau ungu pada kontur. Dari peta kontur potensial elektrosatik selanjutnya dapat digunakan untuk memprediksi daerah mana yang akan dilakukan pemodelan interaksi dalam membentuk kompleks antara monomer fungsional dengan templat asam kafeat. Sisi aktif pada molekul inilah yang kemudian digunakan sebagai daerah utama untuk interaksi antara asam kafeat dan monomer fungsional yang dipelajari pada penelitian ini.
Secara umum interaksi pada MIP terdiri dari interaksi kovalen dan non kovalen. Akan tetapi, interaksi non kovalen digunakan secara lebih luas daripada interaksi kovalen ini dikarenakan pada MIP-non kovalen tidak membutuhkan langkah sintetik pada pembentukan kompleks monomer fungsional templat dan lebih mudah dalam hal pelepasan templat pada langkah pembilasan (Riahi dkk., 2009). Hal yang menjadi pertimbangan utama dalam sintesis MIP adalah terbentuknya kompleks yang stabil yang ditunjukkan dengan energi interaksi monomer fungsional dan asam kafeat yang tinggi. Contoh beberapa monomer fungsional yang polar yang umum digunakan dalam sintesis MIP antara lain adalah asam metakrilat, asam akrilat, vinil imidazola, 2-vinilpiridin, 4-vinilpiridin,
22
akrilamida, asam akrilamido-2-metil-1-propanasulfonat, dan hidroksi etil metakrilat (Vasapollo dkk., 2011). Pada kajian ini sisi aktif pada asam kafeat yang terdapat gugus karboksilat dengan potensial elektrostatik paling tinggi kemudian digunakan sebagai situs interaksi dengan monomer.
Peluang untuk menemukan elektron pada suatu titik dalam ruang
Gambar IV.2 Ilustrasi visual rapat muatan total pada interaksi asam kafeat dan asam akrilat
Tabel IV.1 menyajikan data momen dipol dan energi interaksi serta ditampilkan pula diagram energi interaksi kompleks yang terbentuk dengan rasio perbandingan monomer fungsional-templat 1:1. Dari Tabel IV.1, dapat dilihat nilai momen dipol dua puluh monomer fungsional. Momen dipol merupakan ukuran polaritas molekul yang didapat dari hasil kali antara muatan atom dengan jarak antar atom yang berikatan. Semakin besar perbedaan keelektronegatifan antar atom yang berikatan, maka nilai momen dipol akan semakin besar. Nilai momen dipol asam kafeat adalah 2,96 debye, nilai momen dipol yang besar ini mengindikasikan bahwa molekul asam kafeat merupakan molekul polar yang berinteraksi dengan baik dengan molekul yang juga polar. Berdasarkan data ini maka dipilih monomer fungsional yang mampu berinteraksi polar dengan asam kafeat dengan kriteria nilai momen dipol lebih besar dari 2. Metode seleksi ini juga telah berhasil digunakan dalam mendesain MIP untuk bahan templat sinensetin (Tahir dkk., 2010), quercetin (Tahir dkk., 2012a) dan allopurinol (Tahir dkk., 2012b).
Tabel IV.1. Nilai momen dipol monomer fungsional
Fungsi Nama senyawa Momen dipol (Debye)
Templat Asam kafeat 2,964
Monomer fungsional 1 2-vinilpiridin 1,86 2 4-vinilpiridin 2,25 3 Akrolein 3,06 4 Akrilamida 3,95 5 Asam akrilat 2,46 6
Asam akrilamido2 metil1
-propanasulfonat 4,62
7 Akrilonitril 2,94
8 Alilamin 1,48
9 Asam metakrilat 2,01
10 Etilen glikol dimetakrilat 0,00
11 Hidroksi etil metakrilat 3,31
12 m-divinil benzena 0,02
13 p-divinil benzena 0,03
14 Stirena 0,01
15 Asam urokanat 5,28
16 N,N-metilen bis akrilamida 6,14
17 N,N-dietil amino etil metakrilat 2,81
18 Asam urokanat etil ester 4,63
19 Asam itakonat 3,02
20 Vinil imidazola 3,40
Catatan: Huruf tebal menunjukkan monomer terpilih
Berdasarkan pertimbangan kesesuaian ukuran polaritas menggunakan nilai momen dipol yang terhitung ini, maka digunakan sebagai seleksi pertama dari dua puluh monomer fungsional yang diteliti. Dari nilai momen dipol yang tertera pada tabel IV.1, terpilih 14 monomer fungsional yang memenuhi kriteria yaitu no (2) 4-vinilpiridin, no (3) akrolein, no (4) akrilamida, no (5) asam akrilat, no (6) asam akrilamido-2-metil-1-propanasulfonat, no (7) akrilonitril, no (9) asam metakrilat, no (11) hidroksi etil metakrilat, no (15) asam urokanat, no (16) N,N'-metilen bis akrilamida, no (17) N,N-dietil amino etil metakrilat, no (18) asam urokanat etil ester, no (19) asam itakonat, dan no (20) vinil imidazola.
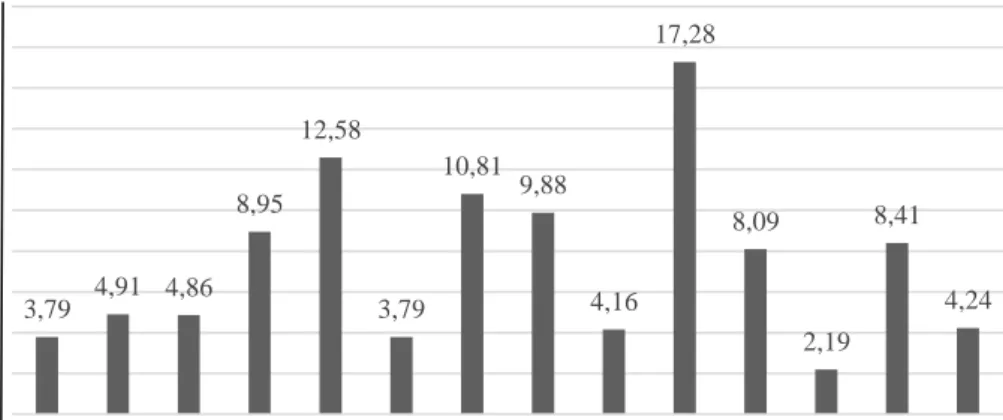
Dari 14 monomer fungsional ini kemudian dilakukan seleksi tahap kedua dengan menggunakan paramater energi interaksi (∆E). Data energi interaksi menunjukkan kestabilan kompleks yang terbentuk, semakin tinggi nilai energi interaksi yang ditunjukkan dengan semakin negatif nilai ∆E maka kompleks yang terbentuk lebih mungkin untuk eksis dalam bentuk kompleksnya. Dengan kata
24
lain, kompleks dengan nilai ∆E yang tinggi akan mampu memberikan selektivitas yang lebih baik pada MIP yang disintesis. Data hasil perhitungan ∆E disajikan pada tabel IV.2.
Tabel IV.2. Nilai energi interaksi (∆E) kompleks asam kafeat-monomer Energi (kkal/mol)
No. Monomer fungsional Monomer fungsional Kompleks ∆E (kkal/mol) 1 2-vinilpiridin -1623,05 -3961,96 -6,95 2 4-vinilpiridin -1625,43 -3961,18 -3,79 3 Akrolein -797,24 -3134,11 -4,91 4 Akrilamida -970,16 -3306,98 -4,86 5 Asam akrilat -916,60 -3257,51 -8,95 6 Asam akrilamido-2- metil-1-propanasulfonat -2435,17 -4779,71 -12,58 7 Akrilonitril -737,10 -3072,85 -3,79 8 Alilamin -978,96 -3314,44 -3,53 9 Asam metakrilat -1198,19 -3540,96 -10,81
10 Etilen glikol dimetakrilat -2822,21 -5158,64 -4,47 11 Hidroksi etil metakrilat -1850,82 -4192,66 -9,88 12 m-divinil benzena -2174,66 -4512,59 -5,97 13 p-divinil benzena -2174,89 -4509,25 -2,39 14 Stirena -1745,43 -4079,52 -2,14 15 Asam urokanat -1709,86 -4045,98 -4,16 16 N,N-metilen bis akrilamida -2087,8939 -4437,1266 -17,27
17 N,N-dietil amino etil
metakrilat -3011,2762 -5351,3234 -8,09
18 Asam urokanat etil ester -2259,8807 -4594,0282 -2,19
19 Asam itakonat -1575,512 -3915,8736 -8,40
20 Vinil imidazola -1316,2098 -3652,4023 -4,23 Catatan: huruf tebal menunujukkan monomer terpilih. ∆E dihitung dari persamaan (1).
Energi untuk templat asam kafeat = 2331,95 kkal/mol
Pada Gambar IV.3 ditampilkan diagram energi interaksi asam kafeat dan masing-masing dengan 14 monomer fungsional yang sudah diseleksi dari tahap pertama. Dari 14 kompleks yang terseleksi pada tahap 2 ini terdapat 2 kompleks dengan energi interaksi tertinggi dan 3 kompleks dengan energi interaksi terendah. Dua kompleks dengan energi interaksi tertinggi dibentuk antara struktur asam kafeat dengan monomer fungsional no (6) asam
akrilamido-2-metil-1-propanasulfonat dengan energi interaksi sebesar -12,58 kkal/mol dan dengan monomer fungsional no (16) N,N'-metilen bis akrilamida dengan energi interaksi sebesar -17,27 kkal/mol. Nilai energi interaksi yang tinggi ini mengindikasikan bahwa MIP yang terbentuk dengan menggunakan dua monomer fungsional tersebut akan memberikan selektivitas MIP yang sangat baik dibandingkan dengan kompleks yang lain. Akan tetapi, interaksi yang sangat kuat tersebut akan berdampak pada sulitnya dalam hal proses pelepasan templat untuk membentuk kaviti berbentuk asam kafeat selama proses pencucian (leaching process). Proses pencucian tersebut akan membutuhkan perlakuan khusus seperti menggunakan pelarut kuat, pemanasan yang tinggi atau waktu proses pelepasan yang lama, padahal seringkali pencucian ini tetap meninggalkan residu asam kafeat pada produk MIP akhir. Dengan demikian dua monomer ini tidak direkomendasikan sebagai monomer fungsional untuk templat asam kafeat.
Gambar IV.3 Diagram energi interaksi kompleks monomer fungsional-templat terseleksi momen dipol
Kemudian tiga kompleks dengan energi terendah yang membentuk
komplek asam kafeat dengan monomer-monomer fungsionalnya no (2) 4-vinilpiridin dengan energi interaksi sebesar 3,79 kkal/mol, no (7) akrilonitril
dengan energi ineraksi sebesar 3,79 kkal/mol dan no (17) N,N-dietil amino etil metakrilat dengan energi interaksi sebesar 2,19 kkal/mol. Energi interaksi yang kecil ini mengindikasikan bahwa kompleks yang terbentuk kurang stabil sehingga
3,79 4,91 4,86 8,95 12,58 3,79 10,81 9,88 4,16 17,28 8,09 2,19 8,41 4,24 0 2 4 6 8 10 12 14 16 18 20 2 3 4 5 6 7 9 11 15 16 17 18 19 20 Neg atif E n er g i In ter ak si (k k al/m o l) Monomer
26
dimungkinkan MIP yang terbentuk juga akan memiliki tingkat selektivitas yang rendah terhadap asam kafeat. Apabila tingkat selektivitas yang dihasilkan pada saat sintesis MIP ini rendah maka berakibat pada kurang spesifiknya dalam hal pengikatan templat sehingga akan mengurangi tingkat keakuratan dari MIP yang dihasilkan.
MIP dirancang untuk mengenali molekul target dan mengikatnya dalam kaviti yang bekerja secara selektif. Dengan demikian untuk mencapai tujuan tersebut dibutuhkan interaksi dengan energi yang optimum dan energi yang optimum tersebut tidak mungkin dicapai dengan interaksi yang lemah antara monomer fungsional dengan asam kafeat sebagai templat.
Berdasarkan alasan ini, maka tiga monomer fungsional dengan energi interaksi yang relatif rendah ini juga tidak digunakan untuk sintesis polimer tercetak asam kafeat. Kompleks yang memiliki energi interaksi ideal yang diduga merupakan kompleks yang stabil dan mengindikasikan MIP yang baik. Sembilan kompleks tersebut ditunjukkan pada Gambar IV.4 untuk energi interaksi yang berada pada batas bawah dan batas atas. Kompleks ini terbentuk dari asam kafeat dan monomer-monomer fungsional no (3) akrolein, no (4) akrilamida, no (5) asam akrilat, no (9) asam metakrilat, no (11) hidroksi etil metakrilat, no (15) asam urokanat, no (17) N,N-dietil amino etil metakrilat, no (19) asam itakonat dan no (20) vinil imidazola. Interaksi templat dan masing-masing monomer fungsional ditampilkan pada Gambar IV.4.
Pada Gambar IV.4, bisa dilihat struktur kompleks antara asam kafeat sebagai templat dan monomer-monomernya setelah dilakukan optimasi geometri. Dari struktur yang terbentuk ini menunjukkan bahwa kompleks ini stabil pada struktur tersebut dan eksis dengan ditunjukkan oleh energi interaksi dengan nilai yang ideal. Hal ini akan memungkinkan untuk sintesis MIP dengan tingkat sensitivitas dan selektivitas yang baik.
(a) (b) (c) (d) (e) (f) (f) (f) (g) (h) (i)
Gambar IV.4. Ilustrasi interaksi kompleks antara asam kafeat dengan monomer fungsional : (a) akrolein, (b) akrilamida, (c) asam akrilat, (d) asam metakrilat, (e) hidroksi etil metakrilat, (f) asam urokanat, (g) N,N-dietil amino etil metakrilat, (h) asam itakonat dan (i) vinil imidazola.
28
Terpilih 9 interaksi kompleks antara asam kafeat dengan monomer-monomernya dan dapat dilihat bahwa 8 monomer fungsional berinteraksi melalui ikatan hidrogen dengan asam kafeat dan 1 monomer fungsional berinteraksi melalui gaya dipol-dipol. Dalam proses seleksi monomer fungsional yang efektif untuk sintesis MIP pembentukan ikatan hidrogen pada interaksi kompleks templat-monomer merupakan suatu pertimbangan yang sangat penting karena dengan ikatan hidrogen akan dihasilkan situs interaksi yang lebih baik dan semakin banyak ikatan hidrogen yang terbentuk maka afinitas dan selektivitas MIP semakin tinggi (Yan dkk., 2006). Berdasarkan pertimbangan ini maka no (4) akrilamida akhirnya juga tidak dipilih sebagai monomer fungsional untuk sintesis polimer tercetak asam kafeat.
Selanjutnya, apabila telah diperoleh monomer fungsional yang cukup baik untuk digunakan pada sintesis MIP asam kafeat yang relatif selektif terhadap asam kafeat, maka penelitian dapat dilanjutkan pada tahap penentuan rasio optimum monomer fungsional-asam kafeat. Hasil ini kemudian dapat digunakan untuk ekstraksi bioaktif untuk analisis asam kafeat secara cepat. Dari 8 monomer fungsional terpilih selanjutnya dipilih asam metakrilat guna dikaji untuk penentuan rasio molekul templat-monomer. Dipilihnya asam metakrilat ini karena bahan ini yang tersedia dan berdasarkan literatur direkomendasikan sebagai monomer fungsional.
IV.2 Interaksi Asam Kafeat-Asam Metakrilat
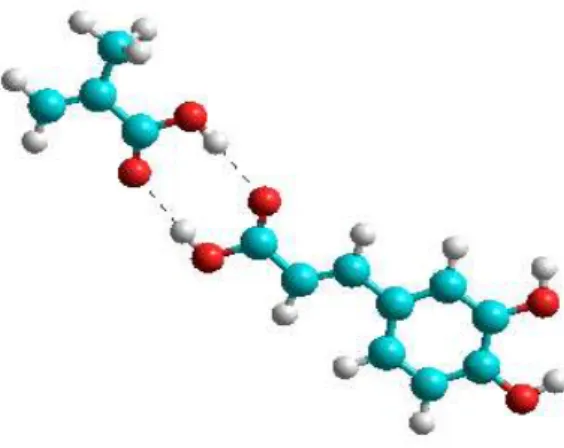
Asam metakrilat telah dipilih sebagai monomer fungsional guna penentuan rasio molekul templat-monomer. Hasil kajian interaksi senyawa secara visual ditunjukkan pada Gambar IV.5 berupa visualisasi kombinasi interaksi kompleks asam kafeat dan asam metakrilat pada posisi yang berbeda-beda. Pada gambar tersebut ditunjukkan model (1), (2), (3), dan (4) terkait interaksi asam metakrilat pada sisi aktif asam kafeat dengan karakteristik interaksi kompleks melalui ikatan hidrogen dan model (5) bukan pada sisi aktif asam kafeat dengan karakteristik interaksi kompleks melalui gaya dipol sesaat. Dalam studi ini, pertimbangan memasukkan model (5) adalah sebagai perbandingan untuk mempelajari grafik
energi interaksi kompleks asam kafeat-asam metakrilat dengan jumlah molekul asam metakrilat yang lebih tinggi (khusus untuk rasio 1:5).
(1) (2) (3)
(4) (5)
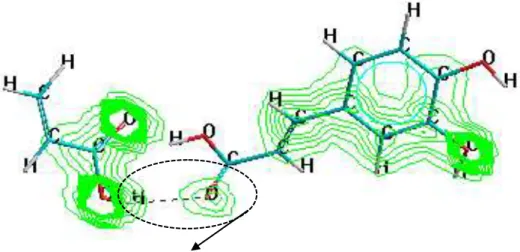
Gambar IV.5. Model interaksi kompleks asam kafeat-asam metakrilat pada posisi yang berbeda. Garis putus menunjukkan ikatan hidrogen.
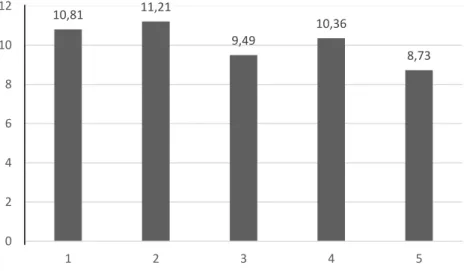
Gambar IV.6 merupakan diagram energi interaksi kompleks kafeat-asam metakrilat dengan rasio 1:1 seperti yang telah disajikan pada Gambar IV.5. Dari Gambar IV.6 dapat dilihat bahwa interaksi seperti model 2 memberikan energi interaksi tertinggi dibandingkan dengan model yang lain yaitu -11,21 kkal/mol. Hal ini dapat dipahami bahwa interaksi non kovalen tersebut terjadi antara gugus karboksilat pada masing-masing asam kafeat dan asam metakrilat. Model (2) ini lebih memungkinkan karena pada sisi ini mempunyai muatan atom yang paling negatif daripada atom yang lainnya. Untuk pada model 5 memberikan energi interaksi terendah yaitu -8,73 kkal/mol, hal ini karena pada model ini asam
kafeat-30
asam metakrilat berinteraksi hanya melalui gaya dipol sesaat sehingga kurang stabil apabila dibandingkan dengan model yang lain.
Gambar IV.6 Diagram energi interaksi dengan rasio asam kafeat / asam metakrilat 1:1
Apabila dilihat dari Gambar IV.7 dapat diketahui muatan atom untuk gugus karboksilat pada asam kafeat memiliki muatan yang paling besar tetapi hal ini akan berimbas kepada makin kuatnya ikatan sehingga akan menjadi sulit dalam pelepasan templat untuk membentuk kaviti asam kafeat.
Gambar IV.7 Muatan atom-atom pada sisi aktif asam kafeat
10,81 11,21 9,49 10,36 8,73 0 2 4 6 8 10 12 1 2 3 4 5 Neg atif en er g i in ter ak si (k k al/m o l) Model kompleks
Berdasarkan tujuan untuk peningkatan selektivitas MIP terhadap molekul target yakni asam kafeat maka rasio 1:1 dimungkinkan kurang dapat mencapai tujuan tersebut. Untuk pencetakan molekul yang melibatkan interaksi non kovalen, kompleks yang dibentuk dengan jumlah situs pengikat yang rendah berarti akan memiliki selektivitas yang rendah pula terhadap molekul target (Anderson dan Nicholls, 1997). Selain itu pada rasio 1:1, jumlah situs aktif akan lebih banyak daripada interaksi pengikatan templat-monomer sehingga tempat untuk molekul templat akan diisi oleh taut silang. Pada kasus ini, pembentukan kaviti yang mirip dengan molekul templat akan dimungkinkan, akan tetapi pada kaviti tersebut tidak ada situs spesifik untuk mengikat sisi aktif yang lain pada templat sehingga MIP akan memiliki kemampuan mengikat yang rendah dan selektivitas MIP yang tinggi terhadap templat tidak akan tercapai (Tahir dkk., 2012b). Tetapi karena asam kafeat ini hanya memiliki sedikit sisi aktif sebagai situs pengikatan, hal ini masih belum dapat dipastikan. Maka dari itu perlu dilakukan variasi rasio kompleks asam kafeat/asam metakrilat untuk mengetahui energi yang paling optimum. Kombinasi kompleks yang terbentuk antara asam kafeat dan asam metakrilat untuk rasio yang lebih tinggi selanjutnya dikembangkan pada kemungkinan posisi sudah dilakukan. Untuk rasio 1:2 kombinasi yang mungkin adalah kompleks (1)-(2), (1)-(3), (1)-(4), (3), (2)-(4), dan (3)-(4). Untuk rasio 1:3 adalah kompleks (1)-(2)-(3), (1)-(2)-(2)-(4), (1)-(3)-(4), dan (2)-(3)-(4). Untuk rasio 1:4, dan 1:5 hanya ada 1 kemungkinan interaksi kompleks yaitu (1)-(2)-(3)-(4) dan (1)-(2) (3)-(4)-(5).
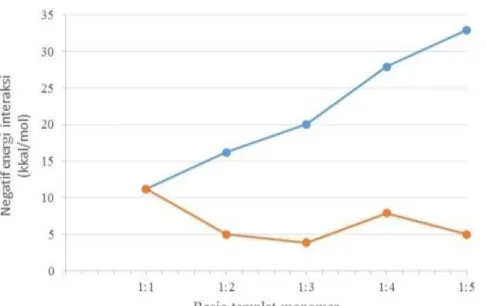
IV.3 Analisis Rasio Optimum
Analisis rasio optimum asam kafeat-asam metakrilat dilakukan dengan mengamati energi interaksi pada setiap kompleks yang terbentuk dari setiap rasio. Energi interaksi memberikan informasi mengenai kestabilan kompleks, karena semakin tinggi nilai energi interaksi maka kompleks yang terbentuk juga akan semakin stabil. Akan tetapi dari fakta yang terjadi menunjukkan bahwa tidak berarti kompleks dengan energi interaksi yang tinggi merupakan struktur yang diinginkan atau yang sesuai. Hal ini karena energi kompleks yang terlalu tinggi
32
akan mengikat molekul templat dengan sangat kuat sehingga akan sulit dalam proses pelepasan molekul templat dari MIP. Sama halnya dalam aplikasi untuk ekstraksi maupun sensor QCM, misalnya pada lapis tipis MIP di QCM sudah mengikat asam kafeat maka pelepasan kembali untuk proses regenerasi akan menjadi lebih sulit. Oleh karena itu yang ingin dicapai adalah rasio optimum templat-monomer yang akan menghasilkan MIP yang efektif dan selektif (Saputra dkk., 2013).
Tabel IV.3. Data energi ikat interaksi asam kafeat-asam metakrilat pada variasi rasio molekul
Keterangan : tanda * menunjukkan energi interaksi tertinggi untuk setiap rasio. Energi asam kafeat= 2331,95 kkal/mol
Pada tabel IV.3 ditampilkan data untuk energi ikat asam metakrilat, energi ikat asam kafeat, energi ikat kompleks asam kafeat-asam metakrilat, energi interaksi templat-monomer. Dari data yang ditampilkan dapat diketahui bahwa setiap variasi rasio templat-monomer yang masing-masing diinteraksikan pada posisi yang berbeda-beda pada asam kafeat akan memberikan nilai energi interaksi yang berbeda pula dimana pada setiap kompleks yang dimodelkan Rasio Kompleks Energi kompleks (kkal/mol) ∑ Energi asam metakrilat (kkal/mol) ∆E (kkal/mol) 1:1 (1) -3540,96 -10,81 (2) -3541,36 -11,21* (3) -3539,47 -1198,19 -9,31 (4) -3540,51 -10,36 1:2 (1-2) -4741,01 -12,66 (1-3) -4740,93 -12,59 (1-4) -4741,01 -2396,39 -12,66 (2-3) -4744,53 -16,18 (2-4) -4744,56 -16,21* (3-4) -4744,54 -16,19 1:3 (1-2-3) -5943,91 -17,36 (1-2-4) -5942,83 -3594,59 -16,29 (1-3-4) -5946,59 -20,04* (2-3-4) -5946,06 -19,52 1:4 (1-2-3-4) -7152,67 -4792,78 -27,93* 1:5 (1-2-3-4-5) -8355,87 -5990,98 -32,93*