TUGAS AKHIR – TL 141584
PENGARUH
TEMPERATUR
REDUKSI
TERHADAP KADAR Ni DAN Fe SERTA
MORFOLOGI AGLOMERAT HASIL REDUKSI
BIJIH
NIKEL
LATERIT
LIMONITIK
MENGGUNAKAN METODE BED BATU BARA
AHLIDIN NURSIDIQNRP. 2713 100 150
Dosen Pembimbing
Sungging Pintowantoro, Ph.D Fakhreza Abdul, S.T., M.T.
DEPARTEMEN TEKNIK MATERIAL DAN METALURGI Fakultas Teknologi Industri
Institut Teknologi Sepuluh Nopember Surabaya
TUGAS AKHIR – TL141584
PENGARUH
TEMPERATUR
REDUKSI
TERHADAP KADAR Ni DAN Fe SERTA
MORFOLOGI AGLOMERAT HASIL REDUKSI
BIJIH
NIKEL
LATERIT
LIMONITIK
MENGGUNAKAN METODE BED BATU BARA
Ahlidin Nursidiq NRP 2713 100 150
Dosen Pembimbing :
Sungging Pintowantoro, Ph.D. Fakhreza Abdul, S.T., M.T.
DEPARTEMEN TEKNIK MATERIAL DAN METALURGI Fakultas Teknologi Industri
Institut Teknologi Sepuluh Nopember Surabaya
FINAL PROJECT – TL141584 Ahlidin Nursidiq NRP 2712 100 150 Advisor : Sungging Pintowantoro, Ph.D. Fakhreza Abdul, S.T., M.T.
DEPARTMENT OF MATERIALS AND METALLURGICAL ENGINEERING Faculty of Industrial Technology
Institut Teknologi Sepuluh Nopember Surabaya
2017
THE
EFFECTS
OF
REDUCTION
TEMPERATURE TO Ni AND Fe CONTAIN
AND THE MORPHOLOGY OF AGGLOMERATE
OF REDUCTED LATERITE LIMONITIC NICKEL
ORE BY COALBED METHOD
AGLOMERAT HASIL REDUKSI BIJIH NIKEL
LATERIT LIMONITIK MENGGUNAKAN METODE
BED BATU BARA
Nama Mahasiswa : Ahlidin NursidiqNRP : 2713 100 150
Departemen : Teknik Material dan Metalurgi Dosen Pembimbing : Sungging Pintowantoro, Ph.D. Co-Pembimbing : Fakhreza Abdul, S.T., M.T.
ABSTRAK
Dengan semakin menurunnya cadangan bijih nikel sulfida saat ini, perhatian mengenai pengolahan bijih nikel laterit semakin meningkat dalam upaya memenuhi kebutuhan nikel di masa mendatang. Penelitian ini bertujuan untuk mengoptimalisasi proses pengolahan bijih nikel laterit menggunakan metode bed batu bara. Penelitian ini dilakukan dengan mereduksi bijih nikel laterit kadar rendah (Limonitik) dengan kadar nikel sebesar 1,25%. Proses reduksi dilakukan menggunakan gas CO hasil reaksi antara batu bara dengan dolomit. Briket campuran bijih, batubara, dan Na2SO4 yang dimasukan pada crucible bersama
dengan bed direduksi selama 6 jam pada temperatur 1200 oC, 1300 oC dan 1400 oC. Dari hasil penelitian, dapat diketahui bahwa
peningkatan kadar Ni dan nilai recovery Ni tertinggi berada pada hasil reduksi 1400 oC dengan peningkatan sebesar 3,44%, dan nilai recovery Ni sebesar 86,75%. Sedangkan peningkatan kadar Fe dan nilai recovery Fe tertinggi berturut-turut berada pada hasil reduksi 1300 oC dengan peningkatan sebesar 22,67 % dan 1200 oC
dengan nilai recovery Fe sebesar 89,41 %
Kata Kunci : Nikel Laterit Limonitik, Temperatur Reduksi, Briket, Bed Batu Bara
OF AGGLOMERATE OF REDUCTED LATERITE
LIMONITIC NICKEL ORE BY COALBED METHOD
Student’s Name : Ahlidin Nursidiq
NRP : 2713 100 150
Department : Materials and Metallurgical Eng. Advisor : Sungging Pintowantoro, Ph.D. Co-Advisor : Fakhreza Abdul, S.T., M.T.
ABSTRACT
As the current drop of nickel sulfide ore on earth, the attention to nickel laterite ore processing was inscreased in order to fulfill the future nickel demand needs. This research aims to optimized the process of nickel laterite ore extraction using coal bed method. This research was conducted by reducing low grade nickel laterite ore (limonitic) with nickel content of 1,25 %. The reduction process was carried out using CO gas which formed by the reaction of coal and dolomite. The Briquette of nickel ore, coal, Na2SO4 mixtures incorporated in the crucible with bed, then
reduced for 6 hours at the temperature of 1200 oC. 1400 oC, and 1400 oC. The result of the research shown that the highest increase
of Ni content and Ni recovery value was in the reduction temperature of 1400 oC with the increase of 3,44 %, and the
recovery value of Ni equal to 86,75 %. While the highest increase of Fe content and Fe recovery value, respectively, was in the reduction temperature of 1300 oC with the increase of 22,67 % and
1200 oC with Fe recovery value of 89,41 %.
Keywords: Laterite Limonitic Nickel Ore, Reducing Temperature, Briquette, Coal Bed
Puji syukur kehadirat Allah SWT, karena berkat rahmat dan hidayah-Nya, tidak lupa shalawat serta salam penulis panjatkan kepada Nabi Muhammad SAW sehingga penulis diberi kesempatan untuk menyelesaikan Tugas Akhir. Tugas Akhir ditujukan untuk memenuhi mata kuliah wajib yang harus diambil oleh mahasiswa Departemen Teknik Material dan Metalurgi Fakultas Teknologi Industri Institut Teknologi Sepuluh Nopember (ITS), penulis telah menyelesaikan Laporan Tugas Akhir yang berjudul “Pengaruh Temperatur Reduksi terhadap Kadar Ni
dan Fe serta Morfologi Aglomerat Hasil Reduksi Bijih Nikel Laterit Limonitik menggunakan Metode Bed Batu Bara”.
Penulis ingin berterima kasih juga kepada :
1. Allah SWT atas karunia, rahmat, dan hidayahnya sehingga penulis dapat menyelesaikan tugas akhir dengan lancar. 2. Kedua Orang Tua, yang telah mendukung secara moril
maupun materil serta doa yang selalu dipanjatkan demi kesehatan ,keselamatan dan kelancaran anaknya dalam menempuh studi.
3. Keempat saudara kandung penulis yang telah memberikan doa, perhatian, dukungan, dan semangat dalam penyelesaian tugas akhir ini.
4. Bapak Dr. Agung Purniawan, S.T, M.Eng., selaku Ketua Departemen Teknik Material dan Metalurgi FTI-ITS. 5. Bapak Sungging Pintowantoro, Ph.D selaku dosen
pembimbing tugas akhir yang telah memberikan bekal yang sangat bermanfaat.
6. Bapak Fakhreza Abdul, S.T., M.T selaku co dosen Pembimbing yang telah memberikan banyak ilmu.
7. Bapak Budi Agung Kurniawan, S.T., M.Sc Selaku dosen wali yang sangat mengayomi
9. Teman-teman Lab. Pengolahan Material yang telah membantu tugas akhir saya selama 1 semester khususnya kepada Ridwan, Kemplo, Fiqri, Hamzah, Rizki, Bima, Anggiat, Orlando, Rahmania, Farid dan juga mas-mas MT14 yang udah banyak memberi saran serta ilmu untuk tugas akhir saya khususnya Mas Iqbal, Mas Arif, Mas Bram, Mas Alfian, Mas Dayat, Mas Afri, dan Mas Mardyanto.
10. Keluarga MT15 yang banyak memberikan saya pemgalaman berharga selama di Departemen Teknik Material dan Metalurgi.
11. Dan seluruh pihak yang telah memberikan partisipasi dalam Tugas Akhir ini.
Penulis menyadari bahwa dalam pembuatan laporan ini masih terdapat kekurangan. Oleh karena itu, penulis mengharapkan kritik yang membangun dari pembaca demi perbaikan dan kemajuan bersama. Penulis berharap laporan Tugas Akhir ini dapat bermanfaat dan dimanfaatkan dengan baik.
Surabaya, Juli 2017
Penulis, Ahlidin Nursidiq
HALAMAN JUDUL ... i
LEMBAR PENGESAHAN ... v
ABSTRAK ... vii
KATA PENGANTAR ... xi
DAFTAR ISI ... xiii
DAFTAR GAMBAR ... xv
DAFTAR TABEL ... xvii
BAB I PENDAHULUAN 1.1 Latar Belakang ... 1 1.2 Rumusan Masalah ... 4 1.3 Batasan Masalah ... 4 1.4 Tujuan Penelitian ... 5 1.5 Manfaat Penelitian ... 5
BAB II TINJAUAN PUSTAKA 2.1 Bijih Nikel ... 7
2.2 Bijih Laterit ... 8
2.3 Ekstraksi Nikel Laterit ... 13
2.4 Aglomerasi dan Reduksi Nikel Laterit Limonitik ... 17
2.5 Reduktor Batu Bara ... 21
2.6 Fluks Dolomit ... 23
2.7 Termodinamika Reduksi Nikel Laterit Limonitik ... 25
2.8 Kinetika Reduksi Ore ... 33
2.9 Kajian Terdahulu mengenai Reduksi Nikel Laterit Limonitik ... 35
BAB III METODE PENELITIAN 3.1 Diagram Alir Penelitian ... 39
3.2 Bahan Penelitian ... 41
3.2.1 Bijih Nikel ... 41
3.2.5 Kanji ... 43 3.2.6 Air ... 43 3.2.7 LPG ... 44 3.3 Peralatan Penelitian ... 44 3.3.1 Alat Kompaksi ... 44 3.3.2 Muffel Furnace... 45 3.3.3 Crucible ... 46 3.3.4 Timbangan Digital ... 47 3.3.5 Ayakan ... 48 3.3.6 Thermocouple ... 48 3.3.7 Blower ... 49 3.3.8 Oven ... 50 3.3.9 Alat Tumbuk ... 50 3.4 Pelaksanaan Penelitian ... 51 3.4.1 Persiapan Material ... 51
3.4.2 Proses Aglomerasi dan Reduksi ... 52
3.4.3 Proses Pengujian Sampel ... 53
3.4.4 Jadwal Rencana Penelitian ... 58
3.4.5 Rencana Penelitian ... 59
3.5 Neraca Massa Briket Nikel Laterit Limonitik ... 59
BAB IV ANALISA DATA DAN PEMBAHASAN 4.1 Karakterisasi Bijih Nikel Laterit Limonitik ... 63
4.2 Karakteristik Batu Bara ... 64
4.3 Karakteristik Batu Kapur (Dolomit) ... 66
4.4 Pengaruh Temperatur Reduksi terhadap Komposisi Unsur pada Briket hasil proses Aglomerasi dan Reduksi ... 68 4.4.1 Pengaruh Temperatur Reduksi terhadap Unsur Nikel
pada Briket hasil proses Aglomerasi dan Reduksi . 69 4.4.2 Pengaruh Temperatur Reduksi terhadap Unsur Besi
4.4.4 Pengaruh Temperatur Reduksi terhadap Nilai
Recovery Unsur Besi ... 77 4.4.5 Pengaruh Temperatur Reduksi terhadap Faktor
Selektivitas pada Proses Reduksi ... 79 4.5 Pengaruh Temperatur Reduksi terhadap Fasa di dalam
Briket hasil proses Aglomerasi dan Reduksi ... 80 4.5.1 Analisis Hasil XRD Briket yang Tereduksi pada
1200 oC... 82 4.5.2 Analisis Hasil XRD Briket yang Tereduksi pada
1300 oC... 84 4.5.3 Analisis Hasil XRD Briket yang Tereduksi pada
1400 oC... 86 4.6 Pengaruh Temperatur Reduksi terhadap Morfologi
Briket hasil proses Aglomerasi dan Reduksi ... 88
BAB V KESIMPULAN DAN SARAN
5.1 Kesimpulan ... 93 5.2 Saran ... 93
DAFTAR PUSTAKA ... xix LAMPIRAN
Gambar 2.1 Distribusi Persebaran Bijih Nikel Laterit di Dunia
Bedasarkan Jumlah Kandungan Nikelnya ... 9
Gambar 2.2 Profil Nikel Laterit ... 10
Gambar 2.3 Profil Laterit pada Daerah Beriklim Kering dan Lembab ... 10
Gambar 2.4 Diagram Ekstraksi Nikel dan FerroNickel ... 16
Gambar 2.5 Bentuk Briket ... 18
Gambar 2.6 Batu Bara ... 23
Gambar 2.7 Batu Kapur / Dolomit ... 25
Gambar 2.8 Diagram Boudouard ... 26
Gambar 2.9 Diagram Ellingham ... 28
Gambar 2.10 Standard Gibbs Free Energy untuk oksida nikel dan karbon ... 32
Gambar 2.11 Mekanisme reduksi untuk mineral berpori ... 34
Gambar 3.1 Diagram Alir Penelitian ... 40
Gambar 3.2 Bijih Nikel Laterit ... 41
Gambar 3.3 Batu Bara ... 42
Gambar 3.4 Batu Kapur ... 42
Gambar 3.5 Serbuk Natrium Sulfat ... 43
Gambar 3.6 Serbuk Kanji ... 43
Gambar 3.7 LPG ... 44
Gambar 3.8 Alat Kompaksi ... 45
Gambar 3.9 Muffle Furnace ... 46
Gambar 3.10 Crucible ... 47
Gambar 3.11 Timbangan Digital ... 47
Gambar 3.12 Ayakan ... 48
Gambar 3.13 Thermocouple ... 49
Gambar 3.14 Blower ... 49
Gambar 3.15 Oven ... 50
Gambar 3.16 Alat Tumbuk ... 50
Gambar 3.17 Skematik Posisi Briket di dalam Crucible ... 52
Gambar 3.18 XRD PAN Analytical ... 54
Gambar 4.2 Hasil Pengujian XRD Batu Kapur Dolomit .... 66
Gambar 4.3 Pengaruh Temperatur Reduksi terhadap Kadar Unsur Nikel di dalam Briket Hasil Proses Reduksi ... 70
Gambar 4.4 Pengaruh Temperatur Reduksi terhadap Kadar Unsur Fe di dalam Briket Hasil Proses
Reduksi ... 73
Gambar 4.5 Pengaruh Temperatur Reduksi terhadap Nilai Recovery Unsur Nikel ... 76
Gambar 4.6 Pengaruh Temperatur Reduksi terhadap Nilai Recovery Unsur Fe ... 78
Gambar 4.7 Nilai Faktor Selektivitas Hasil Proses
Reduksi ... 80
Gambar 4.8 Hasil Pengujian XRD Briket Hasil Proses Reduksi ... 81
Gambar 4.9 Gambar Morfologi Briket Hasil Proses
Tabel 2.1 Tata Nama Gamping Bedasarkan Kandungan
Magnesium ... 24
Tabel 3.1 Jadwal Rencana Penelitian ... 58
Tabel 3.2 Rencana Penelitian ... 59
Tabel 3.3 Target Reduksi Briket ... 60
Tabel 3.4 Perbandingan Komposisi Briket ... 61
Tabel 4.6 Kadar Fe dan Ni pada Briket sebelum Reduksi ... 62
Tabel 4.1 Hasil Pengujian EDX bijih nikel laterit limonitik 64 Tabel 4.2 Hasil Pengujian Proximate Analysis Batubara ... 65
Tabel 4.3 Hasil Pengujian EDX Batu Kapur Dolomit ... 67
Tabel 4.4 Komposisi Unsur Briket Hasil Proses Reduksi .... 68
Tabel 4.5 Perhitungan Massa dan Nilai Recovery Unsur Nikel Hasil Proses Reduksi ... 76
Tabel 4.6 Perhitungan Massa dan Nilai Recovery Unsur Fe Hasil Proses Reduksi ... 77
Tabel 4.7 Perbandingan Selectivity Factor di beberapa Penelitian ... 80
Tabel 4.8 Identifikasi Fasa pada Briket Hasil Proses Reduksi ... 82
BAB I PENDAHULUAN 1.1. Latar Belakang
Nikel memiliki peran penting di dalam perkembangan pembangunan infrastruktur dan teknologi. Nikel digunakan pada berbagai jenis produk dan berbagai aplikasi dalam lingkup yang sangat luas, karena sifat dari nikel yang sangat istimewa seperti konduktivitas listrik yang baik, kekuatan dan ketangguhan yang baik pada temperatur tinggi, dan memiliki sifat ketahanan korosi yang baik. Konsumsi nikel dunia telah meningkat secara signifikan beberapa abad terakhir. Hanya dalam selang waktu 20 tahun, konsumsi nikel meningkat dari 900.000 ton per tahun menjadi lebih dari 1,8 juta ton per tahun. Hal tersebut diakibatkan oleh tren meningkatnya permintaan baja tahan karat (stainless steel) di dunia secara signifikan, yang mana di dalam industri stainless steel kebutuhan terhadap nikel tidak dapat terelakkan. Selain itu, kebutuhan pasokan stainless steel oleh negara-negara berkembang di dunia guna mendukung pembangunan infrastruktur masih terbilang sangat tinggi. Sehingga tingginya permintaan nikel sebagai bahan baku utama dalam pembuatan stainless steel tersebut diprediksi akan terus meningkat hingga tahun-tahun ke depan (ISSF 2015). (Pournaderi, 2014)
Secara umum, bijih nikel dibagi menjadi dua tipe, yaitu bijih nikel sulfida dan bijih nikel oksida (atau biasa disebut laterit). Pada awalnya, sumber nikel hanya diekstraksi dari bijih yang bersumber dari bijih laterit menggunakan Iron Blast Furnace di New Caledonia pada tahun 1879. Kemudian, pada tahun 1886, bijih nikel sulfida mulai ditemukan dan mulai ditambang di Sudbury, Canada. Sejak saat itu, bijih sulfida menjadi sumber utama pasokan nikel di dunia di awal abad ke-20 dan bertahan hingga bertahun-tahun (D. G. E.
Kerfoot, 2005). Namun, tingkat persediaan cadangan bijih nikel sulfida telah menipis akibat dari aktivitas penambangan yang dilakukan secara terus menerus. Selama sepuluh tahun ke depan, produksi nikel dari bijih sulfida diperkirakan hanya akan tumbuh sedikit. Sedangkan hampir 70 % dari sumber daya dunia yang berbasis nikel adalah berupa laterit dan hanya 40% yang digunakan untuk produksi nikel. Jadi ada banyak endapan laterit yang belum dikembangkan di dunia yang memungkinkan eksploitasi laterit untuk memenuhi permintaan untuk nikel. Sehingga produksi nikel di masa depan diharapkan datang dari bijih laterit nikel. Di Indonesia, cadangan nikel laterit sebesar 15,7% dari jumlah cadangan laterit nikel di dunia. Jumlah tersebut menjadikan Indonesia memiliki jumlah cadangan nikel laterit terbanyak ketiga setelah New Caledonia (22,9%) dan Filipina (17,4%). (Dalvi, Bacon, & Osborne, 2004)
Laterit merupakan hasil proses pelapukan dan pengkayaan batuan mafic/ultramafic di daerah tropis. Oleh karena itu, komposisi kimia dan mineraloginya berbeda antara satu endapan dengan endapan lainnya. Nikel dalam bijih nikel laterit berasosiasi dengan besi oksida dan mineral silikat sebagai hasil substitusi isomorphous unsur besi dan magnesium dalam struktur kristalnya (Dalvi A.D., 2004), sehingga secara kimia dan fisik, bijih nikel laterit dapat dibagi menjadi dua jenis, yaitu bijih jenis saprolitik (silikat/hidrosilikat) dan jenis limonitik (oksida/hidroksida) (Rhamdhani, 2009).
Bijih nikel laterit sulit untuk dibuat menjadi konsentrat nikel karena terbentuknya struktur kristal isomorphic dari goethite atau serpentine (Mudd, G., 2010). Kemudian mineralogi yang berbeda membutuhkan pendekatan proses yang berbeda pula. Dalam bijih limonite, nikel membentuk ikatan yang lemah dengan goethite. Akan tetapi dalam bijih saprolit, nikel masuk ke dalam struktur
mineral. Akibatnya, bijih limonite lebih cocok untuk diolah dengan cara hidrometalurgi dan bijih saprolit cocok untuk diolah dengan cara pirometalurgi. Di Indonesia, pada saat ini bijih nikel yang dimanfaatkan adalah bijih nikel yang mempunyai kadar nikel relatif tinggi (diatas 1,5%) yaitu untuk membuat ferronickel oleh P.T. Aneka Tambang dan nickel matte oleh P.T. Vale. Sementara bijih nikel laterit kadar rendah belum dimanfaatkan dengan baik untuk diolah dengan cara pirometalurgi untuk menghasilkan ferronickel atau nickel matte. (Bergma, R. A., 2003)
Proses pirometalurgi pada bijih nikel laterit biasanya menggunakan rotary dryer sebagai alat untuk mengeringkan bijih. Hasil dari rotary dryer berupa conditioned ore dan debu (dust). Debu tersebut akan ditangkap oleh electric presipitator yang nantinya akan diproses kembali pada mixing plant. Conditioned ore dan debu yang telah diproses akan dilakukan proses kalsinasi / reduksi dengan menggunakan rotary kiln. Hasil kalsinasi akan dimasukkan ke dalam electric smelting furnace untuk dilakukannya proses smelting. Namun saat ini negara Brazil menggunakan Mini Blast Furnace untuk mencakup proses pengeringan, kalsinasi / reduksi, dan smelting. Suatu Mini Blast Furnace dapat digunakan untuk membuat Nickel Pig Iron (NPI). Penggunaan Mini Blast Furnace cocok untuk bijih nikel laterit yang berasal dari Indonesia, dikarenakan bijih nikel laterit dari Indonesia memiliki kadar yang rendah sehingga dapat memanfaatkan teknologi Mini Blast Furnace. Namun proses reduksi bijih nikel laterit dengan menggunakan Mini Blast Furnace untuk mengolah nikel laterit dengan kadar rendah masih belum optimal. Sehingga perlu dilakukan optimalisasi dari proses reduksi dengan Mini Blast Furnace. Salah satunya dengan cara memisahkan proses pengeringan dengan proses reduksi bijih nikel tersebut. Hal ini bertujuan untuk mengoptimakan peran batu bara sebagai agen pereduktor pada proses reduksi bijih nikel. Selain
itu upaya untuk mengoptimalisasikan proses produksi nikel laterit adalah dengan cara mereduksi bijih nikel pada derajat temperatur yang tepat. Karena hasil produk aglomerasi dipengaruhi oleh temperatur pemanasan, sehingga temperatur yang tepat tentunya akan membuat proses aglomerasi, dan bijih nikel akan dapat diolah dengan baik di dalam Mini Blast Furnace sehingga akan didapatkan hasil yang optimal serta produktivitas akan meningkat. (Noviyanti, Jasruddin, & Sujiono, 2015)
1.2. Rumusan Masalah
Rumusan masalah dalam penelitian ini adalah :
1. Bagaimana pengaruh temperatur reduksi pada proses aglomerasi dan reduksi bijih nikel laterit limonitik terhadap kadar unsur Ni dan Fe yang dihasilkan ?
2. Bagaimana pengaruh temperatur reduksi pada proses aglomerasi dan reduksi bijih nikel laterit limonitik terhadap morfologi produk aglomerasi ?
3. Pada temperatur berapa proses reduksi bijih nikel laterit limonitik menggunakan metode bed batu bara dapat berlangsung secara optimal?
1.3. Batasan Masalah
Untuk menganalisis masalah pada penelitian ini terdapat beberapa batasan masalah, antara lain :
1. Bijih nikel yang digunakan adalah mineral laterit limonitik dari Sulawesi Tenggara dan Batu bara yang digunakan berjenis sub-bituminus dari Binuang, Kalimantan Selatan. 2. Jenis dan komposisi bijih laterit limonitik, batu bara dan
fluks yang digunakan diasumsikan homogen.
3. Tekanan kompaksi yang diberikan dianggap homogen. 4. Kanji digunakan sebagai pengikat dan pengaruh dari reaksi
kanji diabaikan.
6. Energi panas yang digunakan pada proses reduksi berasal dari furnace. Energi panas pembakaran batu bara tidak dipertimbangkan.
7. Temperatur di bagian luar dan bagian dalam crucible dianggap sama
8. Waktu tahan saat pemanasan dianggap sama.
1.4. Tujuan Penelitian
Tujuan penelitian ini adalah :
1. Menganalisis pengaruh temperatur reduksi pada proses aglomerasi dan reduksi bijih nikel laterit limonitik terhadap kadar unsur Ni dan Fe yang dihasilkan.
2. Menganalisis pengaruh temperatur reduksi pada proses aglomerasi dan reduksi bijih nikel laterit limonitik terhadap morfologi produk aglomerasi.
3. Menentukan derajat temperatur reduksi yang optimal untuk proses aglomerasi dan reduksi bijih nikel laterit limonitik menggunakan metode bed batu bara
1.5. Manfaat Penelitian
Penelitian ini memiliki manfaat yaitu untuk memberikan informasi empiris dari parameter proses (temperatur reduksi / reduction temperature) yang optimal untuk proses aglomerasi dan reduksi bijih nikel laterit limonitik yang berasal dari Sulawesi Tenggara menggunakan metode bed batu bara.
2.1. Bijih Nikel
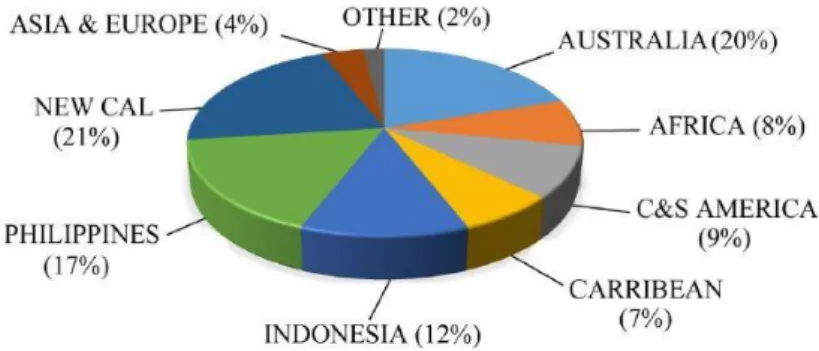
Nikel merupakan salah satu mineral bumi dengan jumlah cadangan yang sangat berlimpah, dan konsentrasinya di dalam kerak bumi diperkirakan sekitar 0,008%. Sumber mineral ini tersebar di banyak negara di dunia, paling banyak terdapat di Kanada, Russia, Australia, Carribean, dan sebagian Asia (G. M. Mudd, 2010). Telah dilaporkan di tahun 2006 bahwa cadangan nikel dengan kadar 1,5 – 3 wt. % Ni mengandung 64 Mt logam yang dapat memenuhi kebutuhan pasokan Nikel selama 40 tahun dengan asumsi tidak ada daur ulang. Gambaran tersebut, bagaimanapun, dapat berubah, selama cadangan logam ekonomis berkaitan secara erat dengan perubahan harga logam dunia dan laju perkembangan teknologi. Peningkatan harga logam dunia dan/atau kemajuan dalam teknologi pengolahan mineral akan menaikkan permintaan atau demand dari logam nikel (T. Norgate & Jahanshahi, 2010).
Selain dari jenis bijih yang didapatkan di atas daratan berupa bijih nikel sulfida dan bijih oksida, Nikel juga ditemukan di nodul laut dalam. Nodul laut ditemukan sekitar tahun 1800 di wilayah luas dasar laut, namun demikian, kegiatan eksploitasi nikel di dasar laut tersebut belum dapat terealisasi hingga saat ini. Hal tersebut bukan dikarenakan oleh kurangnya kemampuan dalam proses recovery, tetapi ketertundan eksploitasi tersebut dikarenakan oleh situasi geo-politik dunia, masalah lingkungan, dan adanya kenyataan bahwa sumber nikel yang didapatkan melalui sumber daratan (tipe sulfida dan oksida) masih dapat memenuhi kebutuhan pasar pada saat ini. (Moskalyk & Alfantezi, 2002)
Bijih nikel sulfida dan oksida memiliki komposisi yang berbeda. Bijih nikel sulfida memiliki kandungan nikel hingga
mencapai 2% Ni dan biasanya disertai dengan logam Tembaga (Cu), Kobalt (Co), dan Besi Sulfida (Fe sulfide). Beberapa logam mulia dan konstituen minor yang tidak diinginkan seperti Arsenic (As), Selerium (Se), Tellerium (Te), dan lain-lain juga ikut hadir. Bijih nikel sulfida dapat terkonsentrasi hingga kadar 6 – 20% Cu-Ni melalui teknik Mineral Dressing.
Sedangkan bijih nikel oksida memiliki kandungan nikel hingga mencapai 3% Ni, biasanya disertai dengan sejumlah Co. Bijih jenis ini mengandung jumlah moisture yang cukup banyak dan mngikat air membentuk hidroksida. Beberapa kasus, kadar air yang terkandung dapat mencapai hingga 45 wt. % (C. M. Diaz & A. Landolt, 1988).
2.2. Bijih Laterit
Bijih Nikel jenis Laterit dihasilkan melalui proses pelapukan batuan ultramafic dalam waktu yang sangat panjang di bawah temperatur yang cukup tinggi. Melalui proses pelapukan, magnesium, besi, nikel, dan silika koloid mengalami proses leaching dari bebatuan (rocks) oleh air tanah yang mengandung karbondioksida. Bagian utama dari besi secara cepat teroksidasi di daerah kontak dengan udara, dan mengendap sebagai presipitat goethite dan hematite. Nikel dan magnesium terlarut, dan silika koloid, meresap ke bawah hingga larutan asamnya ternetralkan bereaksi dengan batu dan tanah. Pada titik ini, material tersebut akan mengendap sebagai hydrated magnesium silicates.
Kedalaman profil bijih laterit biasanya berada pada kedalaman 6 sampai 15 meter dari permukaan. Di beberapa tempat, kedalaman profilnya bisa mencapai kedalaman hingga 60 meter di bawah permukaan. Menurut penelitian yang dilakukan oleh Nahon dan Trady (1992), laju proses laterisasi berlangsung sebanyak 22 mm per 1000 tahun. Dan oleh sebab itu, proses terbentuknya deposit
bijih laterit di dalam kulit bumi dapat berlangsung hingga lebih dari satu juta tahun. Karena profil bijih nikel laterit tersebut bersifat dangkal dan berada pada lokasi/area yang sangat luas, penambangan bijih laterit dilakukan menggunakan metode open-cut. Gambar berikut menunjukkan distribusi persebaran bijih laterit di seluruh dunia.
Gambar 2.1. Distribusi Persebaran Bijih Nikel Laterit di Dunia
Bedasarkan Jumlah Kandungan Nikelnya (Sumber: PADC 2004 International Convention)
Bijih nikel laterit memiliki struktur berlapis, disebabkan oleh sifat dari proses laterisasinya itu sendiri. Lapisan-lapisan yang terbentuk pada profil laterit tidak terpisah sebagai zona yang berbeda, namun terdapat gradasi di antara lapisan tersebut sehingga masih dapat dibedakan. Komposisi kimia dan mineralogi dari masing-masing layer pada profil laterit pun sangat berbeda, terutama berkenaan dengan kandungan dan rasio berat dari SiO2 atau MgO, Fe / Ni serta kadar air. Secara sederhana, profil bijih nikel laterit digambarkan pada gambar di bawah berikut. Kompleksitas profil laterit dan tingkat ketebalan dari masing-masing lapisan dapat bervariasi dari berbagai deposit bijih nikel di seluruh dunia,
tergantung pada komposisi dan struktur batuan induk, serta bergantung pada iklim daerah (A. Warner & C. Diaz, 2006).
Gambar 2.2. Profil Nikel Laterit (Sumber: Ullmann’s
Gambar 2.3. Profil Laterit pada Daerah Beriklim Kering dan
Lembab (Sumber : Ullmann’s Enclyclopedia of Industrial Chemistry)
Bijih nikel laterit diklasifikasikan ke dalam tiga tipe utama bedasarkan komposisi dan mineralogi pada lapisan profilnya (D. G. E. Kerfoot, 2005) :
1. Tipe Limonitik; yaitu salah satu tipe bijih nikel laterit yang kaya kandungan akan logam besi (Fe), tetapi habis di dalam silika dan magnesium (15-23% atau lebih tingi dari Fe, MgO < 10%). Lomonite umumnya mengandung senyawa besi oksida berupa Goethite (α-FeO·OH) sebagai konstituen yang dominan. Nikel laterit tipe limonite juga biasanya kaya kandungan logam kobalt (Co) dan krom (Cr). Senyawa besi oksida yang terkandung di dalam laterit memiliki struktur kristalin yang buruk dengan ukuran kristal nanometrik dan memiliki area permukaan yang besar. Karakteristik tersebut dapat mengakibatkan penyerapan ion dalam jumlah yang besar, khususnya ion Al3+ dari dalam tanah. Sehingga, senyawa besi oksida jarang terbentuk dalam bentuk senyawa murni di dalam laterit, karena ion tersebut dapat mengikat logam Fe.
2. Tipe Saprolitik; atau yang biasa disebut sebagai Garnietite atau Serpentine, mengandung sedikit logam besi (Fe), namun tinggi kandungan magnesium (Fe < 12% dan MgO > 25%). Salah satu mineral paling penting yang mengandung logam nikel termasuk dalam kelompok Garnierit berupa mineral Hydrous Nickel-Magnesium Silicate. Kandungan NiO di dalam mineral tersebut memberikan profil warna hijau. Bedasarkan perbandingan (Mg+Ni)/Si, mineral tersebut dibagi menjadi tiga sub kelompok; yaitu kelompok Serpentine
dan Klorit dengan perbandingan 3/2, dan kelompok berupa tanah liat (clays) dengan perbandingan 3/4.
3. Nontronitik; yaitu merupakan jenis menengah, dan terletak di antara jenis limonitik dan saprolitik (12-15 % Fe dan 25-35 % atau 10-25 % MgO)
Nikel laterit terdiri dari partikel fasa campuran dan tunggal dari berbagai ukuran. Partikel bijih laterit memiliki struktur yang kompleks berupa campuran butir halus, intergrowth, berbentuk seperti vena / seperti pelat, berpori, dan memiliki struktur mikro yang padat (M. A. Rhamdhani, 2009).
Mineralogi laterit yang bersifat heterogen dan kompleks, bersamaan dengan fakta kecenderungan bahwa unsur berharga (Nikel dan Kobalt) membentuk larutan padat (solid solution) dan lebih banyak ditemukan dalam bentuk larutan padat, membuat bijih jenis ini menjadi sangat sulit untuk dilakukan recovery menggunakan metode benefisiasi yang umum (misalnya flotasi). Oleh karena itu, untuk mengekstrak logam berharga berupa nikel atau kobalt, diperlukan berton-ton bijih laterit, sehingga menyebabkan tingginya biaya modal dan biaya operasional. (M. G. King, 2005).
Keberagaman komposisi dan kurangnya metode konsentrasi bijih yang dapat diaplikasikan juga mengharuskan berbagai bijih dicampur untuk menjaga variasi komposisi feed yang dihasilkan tetap berada pada rentan yang sempit. Hal tersebut penting untuk sebagian besar proses dan, dalam situasi ini, penambangan yang selektif harus diterapkan untuk menghasilkan campuran / komposisi feed yang dibutuhkan (J. H. Canterford, 1975).
Satu-satunya proses yang dianggap praktis untuk meningkatkan kadar logam berharga di dalam bijih laterit adalah pemilihan rock yang tepat. Bijih laterit umumnya mengandung suatu
partikel yang dapat mengurangi kadar logam nikel, yang biasanya dikelilingi oleh sebagian kecil partikel ferronickel yang mudah dipisahkan. Sehingga apabila diberikan sedikit abrasi, nikel yang terkandung dapat terlepas dari permukaan partikel keras. Dengan menghindari keberadaan partikel tersebut melalui proses pemilihan rocks yang tepat, dapat menghasilkan peningkatan logam berharga di dalam laterit secara signifikan. Proses ini dapat dilakukan di dalam alat pemilihan rocks “trommel”, atau pada autogenous grinding drum.
Dalam suatu studi, medan magnet dengan gradien tinggi telah diterapkan untuk proses penyiapan bijih laterit sebelum dilakukan proses feed leaching (proses hidrometalurgi). Penerapan alat-alat medan magnet dengan gradien tinggi memberikan keuntungan dengan cara memisahkan mineral ferronikel, yaitu limonite dan serpentine, dari kalsit dan mineral tak berharga lainnya. Proses benefisiasi ini akan sangat efektif juga peralatan yang digunakan benar-benar menggunakan medan magnet dengan instensitas tinggi, dan pemisahan mineral telah sebelumnya dilakukan melalui proses grinding. Melalui cara ini, di bawah kondisi optimal, lebih dari 95% Ni dapat di-recovery, sementara hingga 37% CaO di dalam laterit dapat dihilangkan, dan sebesar 18% dari total berat feed akan berkurang (S. Agatzini-Leonardou, I. G. Zafiratos and D., 2004).
2.3. Ekstraksi Nikel Laterit
Pengolahan metalurgi dari nikel laterit dapat dibagi menjadi dua proses yaitu pirometalurgi dan hidrometalurgi. Pemilihan proses yang akan digunakan ini dipengaruhi oleh kandungan pada bijih, peningkatan kandungan yang terbatas, teknologi pengolahan yang kompleks, kondisi geografis, dan kebutuhan infrastruktur, seperti; pembangkit listrik, pelabuhan, infrastruktur jalan dan fasilitas pengolahan slag (Rodrigues 2013). Hampir dapat diakui secara pasti
bahwa bijih laterit tipe saprolitik lebih cocok untuk diolah menggunakan metode peleburan temperatur tinggi (pyrometallurgy), sedangkan tipe limonitik paling baik diproses menggunakan metode leaching (hydrometallurgy) (C. T. Harris & J. G. Peacey, 2009).
Alasan utama yang mendasari perbedaan proses pengolahan kedua jenis bijih laterit tersebut adalah komposisi unsur kimia heterogen dan mineralogi yang dimiliki. Unsur-unsur kimia yang dimiliki oleh bijih laterit jenis saprolitik membutuhkan metode pengolahan yang lebih fleksibel, yaitu metode pyrometallurgy. Alasan lainnya adalah karena tingginya kandungan Magnesia di dalam bijih tersebut yang dapat mengakibatkan tingginya konsumsi asam jika diolah menggunakan metode hydrometallurgy. Selain itu, saprolite memiliki mineral pembentuk slag yang dibutuhkan, yang tidak dimiliki oleh limonite. Sebaliknya, bijih laterit jenis limonite dengan mineralogi dan komposisi yang lebih homogen, dan karakter konsumsi asam yang relatif rendah, lebih cocok untuk diolah melalui metode hydrometallurgy (D. G. E. Kerfoot, 2005). Pengolahan bijih nikel laterit yang mengandung jumlah sebanding dari kedua jenis bijih laterit tersebut dapat menimbulkan masalah (J. H. Canterford, 1975).
Beberapa proses ekstraksi nikel laterit diantaranya : 1. Matte Smelting Process
Proses ini terdiri dari beberapa langkah utama. Pertama, bijih dimasukkan ke dalam rotary kiln atau Vertical Shaft Reduction Furnace dan mengalami pemanasan dengan temperatur tinggi. Selama proses ini, air kristal tereduksi diikuti dengan reduksi nikel dan sebagian besi ke dalam metallic state. Kemudian, mereduksi kalsin dengan cara direaksikan dengan sulfur dalam Electric Furnace.
Sulfur dapat ditambahkan baik dalam bentuk unsur maupun dalam bentuk gypsum atau pirit. Akibatnya, terak yang mengandung komponen oksida dari bijih dan sulfida nikel terbentuk. Konsentrat yang berisi 30-35% nikel, kemudian dibawa ke converter, di mana udara ditiupkan ke dalam converter, sehingga mengoksidasi besi. Konsentrat akhir yang mengandung 75-78% Ni
2. Reduction Roast – Amonia Leach Process
Proses ini juga disebut sebagai Caron Process. Ada 4 langkah yang utama, yaitu Pengeringan bijih dan grinding, reduction roasting, leaching dengan menggunakan larutan ammonium carbonate, dan metal recovery. Pada proses ini Reduction roasting merupakan proses yang sangat penting. Temperatur reduksi harus dikontrol dengan baik agar mendapatkan recovery nikel dan cobalt secara maksimal.
Caron Process dapat menaikkan recovery 70 – 80% nikel dan hanya 40 – 50% kobalt. Proses ini diutamakan untuk bijih laterit jenis limonit. Ketika proses ini digunakan untuk bijih serpentit atau bijih laterit yang mengandung besi dengan kadar rendah serta magnesium dengan kadar yang tinggi, maka recovery nikel akan menurun secara signifikan. Dikarenakan magnesium lebih dominan untuk bereaksi dengan silica dan NiO, hal ini membuat sebagian besar NiO akan tidak tereduksi ketika proses reduksi roasting.
3. Electric Furnace Smelting to FerroNickel
Pada proses ini, bijih pertama dipanaskan dan dikalsinasi untuk menghilangkan uap air dan air yang berikatan secara kimia, kemudian diproses langsung ke tanur listrik dan mengalami reduksi dan mencair pada temperatur sekitar 1550°C. Hampir semua nikel dan sebagian besar besi tereduksi pada tahap ini dan paduan FerroNickel terbentuk, yang biasanya mengandung sekitar 25% Ni. Proses terakhir yaitu memurnikan crude FerroNickel menjadi produk yang dapat dijual. Proses pemurnian yang dilakukan yaitu
mengeluarkan crude Fe-Ni dari tanur listrik ke dalam Ladle, dimana zat additive seperti soda ash, lime, dan calcium carbide ditambahkan ke dalam crude Fe-Ni untuk menghilangkan unsur-unsur pengotor (Li, 1999).
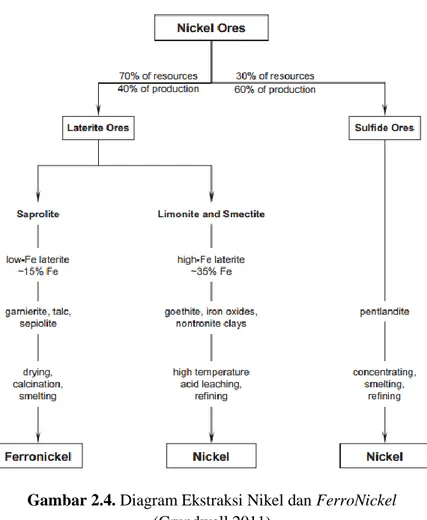
Skema pengolahan bijih nikel laterit maupun bijih nikel sulfida ditunjukkan pada Gambar 2.4.
Gambar 2.4. Diagram Ekstraksi Nikel dan FerroNickel
2.4. Aglomerasi dan Reduksi Nikel Laterit Limonitik
Mini Blast Furnace (MBF) umumnya dipilih untuk digunakan sebagai reaktor karena pada proses menggunakan MBF telah mencakup hampir semua proses pada pirometalurgi, mulai dari proses pengeringan, proses kalsinasi dan reduksi, dan proses smelting. Dengan beberapa proses telah terintegrasi menjadi satu alat yaitu MBF sehingga akan lebih menghemat konsumsi energi dan juga waktu yang membuatnya lebih efisien dan ekonomis.
Salah satu feed material pada reaktor Mini Blast Furnace adalah fluks. Fluks berguna untuk menjaga tingkat basisitas slag agar proses pengolahan / smelting dapat berjalan dengan baik. Akan tetapi, jika fluks tersebut langsung dimasukkan dalam Mini Blast Furnace maka akan membutuhkan banyak energi untuk menaikkan temperatur fluks tadi. Sehingga, fluks akan lebih baik ditambahkan saat proses persiapan material / roasting sebelum masuk ke dalam Mini Blast Furnace. Oleh karena itu diperlukan suatu proses penggumpalan (aglomerasi) yang dilanjutkan dengan proses roasting.
Proses aglomerasi menjadikan bijih laterit yang berupa tanah digumpalkan yang telah dicampur dengan batubara serta fluks dengan komposisi tertentu. Sehingga burden material hasil aglomerasi akan sesuai untuk proses pada Mini Blast Furnace.
Proses algomerasi yang digunakan berupa pembriketan. Campuran dari laterit, batu bara, dan fluks dikompresi dalam suatu cetakan dengan bentuk tertentu, dengan komposisi tambahan berupa kanji yang berfungsi sebagai zat pengikat.
Kanji digunakan sebagai pengikat (binder) briket untuk meningkatkan kekuatan green briquette sebelum proses roasting, mengurangi tingkat degradasi briket saat transporatsi dan handling. Karena hanya untuk keperluan sebelum proses roasting, binder tidak boleh memberikan efek negatif pada proses roasting. Kanji dipilih
sebagai binder karena kanji merupakan zat organik, yang akan terbakar habis saat pemanasan.
Menurut Li (2012), perlu ditambahkan bahan tambahan berupa Natrium Sulfat untuk mekanisme selective reduction pada Ni. Secara spesifik pembriketan dibagi menjadi briket dingin dan birket panas. Briket dingin hanya dilakukan pada temperatur kamar, sedangkan briket panas dilakukan proses kalsinasi hingga temperatur diatas 1000 oC hingga dibawah temperatur lelehnya. Proses kalsinasi dilakukan dalam proses roasting. Salah satu bentuk briket yaitu bentuk pillow seperti yang ditunjukkan pada Gambar 2.5.
Gambar 2.5. Bentuk Briket (Sumber: arstaeco.com)
Proses pembriketan yang dilakukan berupa briket panas, hal ini dilakukan untuk memperoleh komposisi kimia briket laterit yang sesuai dengan proses produksi NPI (Nickel Pig Iron) pada Mini Blast Furnace. Proses pembriketan panas harus mencakup (Crundwell, 2011) :
1. Menghilangkan sisa kadar air pada bijih (untuk menghindari terjadinya ledakan pada Mini Blast Furnace)
2. Mereduksi sekitar seperempat nikel dalam bijih menjadi nikel metal
3. Mereduksi mineral Fe3+ menjadi mineral Fe2+ dengan kadar tinggi dan sekitar 5 % dari besi menjadi besi metal
4. Menambah batu bara dengan cukup, sehingga kadar mineral yang tersisa digunakan untuk reduksi tahap akhir pada Mini Blast Furnace.
Bentuk briket yang digunakan berupa bentuk bantal / pillow (Gambar 2.5) dipilih dengan maksud tertentu. Jika dibandingkan dengan jenis briket lain, briket berbentuk bola lebih memiliki keseragaman tegangan di seluruh permukaannya dibandingkan dengan briket bantal. Namun briket dengan bentuk bola akan sulit dibuat karena keterbatasan alat yang ada, proses pelepasan briket bola dari alat biket atau cetakan akan sulit dilakukan. Maka briket bebentuk bantal lebih mudah dibuat dengan menggunakan alat yang sudah komersial. Briket bentuk bantal dengan volume yang sama memiliki tebal penambang kecil dan luas permukaan yang lebih besar dibanding dengan bentuk bola. Hal tersebut akan meningkatkan heat flux saat proses pemanasan. Heat flux yang besar akan meningkatkan heat transfer sehingga tingkat reduksi yang terjadi juga akan semakin besar.
Pada proses pembriketan, proses reduksi yang terjadi haruslah secara optimal. Temperatur kalsinasi / roasting haruslah sesuai dengan temperature terjadinya reaksi reduksi dari mineral nikel dan besi dalam laterit. Ketika temperatur tidak mencukupi maka reaksi reduksi tidak optimal karena energi yang diperlukan tidak mencukupi.
Perlu juga dipertimbangkan kebutuhan gas CO sebagai agen reduktor. Gas CO berasal dari batu bara, sehingga diperlukan perhitungan kebutuhan komposisi batu bara yang sesuai. Apabila
ketersediaan batu bara tidak memadahi maka reaksi tidak berjalan optimal karena gas CO juga kurang untuk mereduksi mineral nikel dan besi yang ada.
Menurut buku “Extractive Metallurgy of Nickel and Cobalt” (Tyroler & Landolt, 1998). Persamaan reaksi ekstraksi dari nikel laterit pada proses reduksi ditunjukkan pada reaksi :
1. Terjadi dekomposisi garnierite dan goethite (Bijih)
Ni3Mg3Si4O10(OH)8(s) + Heat → 3NiO(s) + 4SiO2(s) +
4H2O(g),pada 800°C (2.1)
2FeO(OH)(s) + heat → Fe2O3(s) + H2O(g), pada 800 °C (2.2) 2. Reaksi reduksi oleh gas CO
3Fe2O3 + CO → 2Fe3O4 + CO2 (2.3)
Fe3O4 + CO → 3FeO + CO2 (2.4)
FeO + CO → Fe + CO2 (2.5)
NiO + CO → Ni + CO2 (2.6)
Karakteristik dari burden material yang sesuai pada proses Blast Furnace diantaranya :
1. Kandungan oksigen, semakin sedikit kandungan oksigen yang dihilangkan saat aglomerasi, akan semakin efisien proses di Blast Furnace
2. Fasa yang terbentuk dari burden material. Standar fasa yang terbentuk pada iron ore sinter umumnya berupa : Magnetit, Calcium Ferrite, Fayalite, Olivines (Gupta 2010).
3. Permeabilitas, kontak antara gas reduktor dengan burden ore sangat penting dalam proses di Blast Furnace. Untuk optimasi kontak antara gas reduktor dengan burden material perlu adanya permeabilitas dari burden material. Permeabilitas semakin tinggi akan semakin baik. Permeabilitas dipengaruhi oleh jumlah pori dari burden ore.
Dimana semakin banyak pori pada burden ore maka akan semakin luas permukaan dari burden ore yang akan berinteraksi dengan gas reduktor.
4. Ukuran burden material, ukuran minimal dari burden material pada Blast Furnace yaitu 5 mm. Ukuran minimal ini didapat dari Shatter Index. Shatter Index merupakan nilai ketahanan suatu burden material yang dijatuhkan dari ketinggian 2 meter (Bhavan and Marg 1981).
5. Komposisi kimia, meliputi Basisitas, Al2O3 dan MgO yang berperan penting dalam proses.
6. Sifat metalurgi, meliputi:
Cold strength, merupakan ketahanan burden material terhadap degradasi selama transportasi dan handling;
Reduksi-disintegrasi, merupakan efek dari tahap reduksi awal dan kesesuaian pada zona stack dalam blast furnace;
Sifat softening dan melting, penting pada pembentukan zona kohesif dan zona melting pada Blast Furnace (Geerdes, Toxopeus and Vliet 2009).
2.5. Reduktor Batu Bara
Batu bara adalah salah satu bahan bakar fosil. Pengertian umumnya adalah batuan sedimen yang dapat terbakar, terbentuk dari endapan organik, utamanya adalah sisa-sisa tumbuhan dan terbentuk melalui proses pembatubaraan. Unsur-unsur utamanya terdiri dari karbon, hidrogen dan oksigen. Batu bara juga adalah batuan organik yang memiliki sifat-sifat fisika dan kimia yang kompleks yang dapat ditemui dalam berbagai bentuk. Analisis unsur memberikan rumus formula empiris seperti C137H97O9NS untuk bituminus dan C240H90O4NS untuk antrasit.
Berdasarkan tingkat proses pembentukannya yang dikontrol oleh tekanan, panas dan waktu, batu bara umumnya dibagi dalam lima kelas : antrasit, bituminus, sub-bituminus, lignit dan gambut.
1. Antrasit; adalah kelas batubara tertinggi, dengan warna hitam berkilauan (luster) metalik, mengandung antara 86% - 98% unsur karbon (C) dengan kadar air kurang dari 8%. 2. Bituminus; mengandung 68 - 86% unsur karbon (C) dan
berkadar air 8-10% dari beratnya. Kelas batubara yang paling banyak ditambang di Australia.
3. Sub-bituminus; mengandung sedikit karbon dan banyak air, dan oleh karenanya menjadi sumber panas yang kurang efisien dibandingkan dengan bituminus.
4. Lignit; atau batubara coklat adalah batu bara yang sangat lunak yang mengandung air 35-75% dari beratnya.
5. Gambut; berpori dan memiliki kadar air di atas 75% serta nilai kalori yang paling rendah
Menurut C. F. K. Diessel (1992) pembentukan batubara diawali dengan proses biokimia, kemudian diikuti oleh proses geokimia dan fisika, proses yang kedua ini sangat berpengaruh terhadap peringkat batubara “coal rank“, yaitu perubahan jenis mulai dari gambut ke lignit, bituminus, sampai antrasit. Faktor yang sangat berperan didalam proses kedua tersebut adalah temperatur, tekanan, dan waktu. Bentuk fisik dari batu bara ditunjukkan pada Gambar 2.6.
Gambar 2.6. Batu Bara (Sumber: id.wikipedia.org) 2.6. Fluks Dolomit
Dolomit merupakan salah satu contoh bahan galian industri penting yang termasuk kelompok mineral karbonat. Batuan dolomit pertama kali dideskripsikan oleh mineralogist Prancis bernama Deodat de Dolomieu pada tahun 1791 dari tempat terdapatnya di daerah pegunungan Alpen Selatan. Dolomit tergolong dalam batuan sedimen karbonat yang merupakan kelas batuan sedimen. Batuan sedimen adalah batuan yang terbentuk akibat proses pembatuan atau lithifikasi dari hasil proses pelapukan dan erosi yang kemudian tertransportasi dan seterusnya terendapkan.
Dolomit terutama terdiri atas dua mineral karbonat yaitu Kalsit (CaCO3) dan Magnesit (MgCO3). Mineral dolomit murnisecara teoritis mengandung 45,6% MgCO3 atau 21,9% MgO dan 54,3% CaCO3 atau 30,4% CaO. Mineral dolomit dapat dituliskan dengan rumus kimia CaCO3MgCO3, CaMg(CO3)2 atau CaxMg1-xCO3, dengan nilai x kurang dari satu. Kandungan unsur magnesium pada dolomit menentukan nama dolomit tersebut.
Adapun tata nama batu gamping bedasarkan kandungan magnesiumnya dapat dilihat pada tabel berikut :
Tabel 2.1. Tata Nama Gamping Bedasarkan Kandungan
Magnesium [Oates, 1998]
Dolomit akan terdekomposisi termal secara langsung membentuk CaCO3 dan CO2 disertai dengan pembentukan MgO pada temperature antara 700 oC hingga 750 oC. Dimana reaksi yang terjadi yaitu :
2CaMg(CO3) → CaCO3 + CaO + 2MgO + 3CO2 (2.7) Pada temperature yang lebih tinggi, CaCO3 akan mulai terdekomposisi meskipun masih terdapat dolomit (CaMg(CO3)2). Reaksi dekomposisi dolomit dan CaCO3 akan berlangsung secara spontan yang terdiri dari 2 reaksi, yaitu :
CaMg(CO3)2 → CaO + MgO + 2CO2 (2.8) Nama Batuan Kadar Dolomit
(%) Kadar MgO (%) Batu Gamping 0 – 5 0,1 – 1,1 Batu Gamping Magnesium 5 – 10 1,1 – 2,2 Batu Gamping Dolomitan 10 – 50 2,2 – 10,9 Dolomit Berkalsium 50 – 90 10,9 – 19,9 Dolomit 90 – 100 19,9 – 21,8
CaCO3 → CaO + CO2 (2.9) Reaksi tersebut akan berlangsung secara spontan pada temperature 780 – 785 oC serta terdekomposisi secara keseluruhan pada
temperatur 950 – 960 oC (Philip Engler, dkk. 1988).
Dalam penelitian ini dolomit yang digunakan berperan sebagai penyedia gas CO2 dalam proses reduksi. Gas CO2 ini berguna untuk reaksi pembentukan gas CO (Reaksi Boduard). Gas CO2 diperoleh dari reaksi dekomposisi dolomit dan CaCO3. Selain itu dolomit juga berperan sebagai flux agent atau pengikat pengotor. Dolomit dapat berperan dalam proses desulfurisasi batubara pada range temperatur 870 – 1037 oC (Spencer. 1985), dengan reaksi : H2S (g) + CaO (s) → CaS (s) + H2O (g) (2.10)
Gambar 2.7. Batu Kapur / Dolomit (sumber : manfaat.co.id) 2.7. Termodinamika Reduksi Nikel Laterit Limonitik
Di dalam aspek termodinamika, dapat dijelaskan apakah suatu reaksi dapat terjadi atau tidak. Pada aspek ini, tidak dapat ditentukan seberapa cepat reaksi tersebut akan berlangsung.
Gambar 2.8. Diagram Boudouard (sumber: Ross, 1980)
Gaussner-Boudouard telah membuat suatu diagram yang menggambarkan suatu kesetimbangan antara besi, hematite, magnetite, wustite, karbon padat, karbondioksida (CO2), dan karbonmonoksida (CO). Diagram ini merupakan dasar untuk reduksi langsung dengan karbon padat. Selain itu kita juga dapat mengetahui pada kadar CO dan temperatur berapa akan terbentuk senyawa-senyawa Fe2O3, Fe3O4, FeO dan lainnya. Pada diagram
Boudouard terdapat kesetimbangan besi oksida dengan campuran gas CO/CO2 seperti yang ditunjukkan pada persamaan (2.11), (2.12), (2.13), dan (2.14) dibawah ini :
Garis kesetimbangan Boudouard : C(s) + CO2(g) → 2CO(g) (2.11) Garis kesetimbangan : 3Fe2O3 + CO(g) → 2Fe3O4(s) + CO2(g) (2.12) Garis kesetimbangan : Fe3O4 + CO → 3FeO + CO2 (2.13)
Garis kesetimbangan : FeO + CO → Fe + CO2 (2.14) Pada daerah di sebelah kanan garis kesetimbangan Boudouard seperti pada gambar 2.8 di atas, gas CO lebih stabil sehingga gas CO2 akan mengalami reaksi Boudouard yang membentuk gas CO. Sedangkan pada daerah sebelah kiri garis kesetimbangan Boudouard, gas CO2 akan lebih stabil sehingga gas CO yang ada akan terurai menjadi CO2. Fenomena inilah yang merupakan contoh dari prinsip Le Chatelier yang mengatakan bahwa reaksi Boudouard adalah reaksi yang endotermik sehingga membutuhkan temperatur tinggi untuk berjalan. Dari diagram tersebut, terlihat bahwa pada keadaan standard, Fe baru dapat terbentuk dengan kadar CO sekitar 60%. Persentase CO itu sendiri dipengaruhi oleh kadar karbon pada sampel dan kadar oksigen pada lingkungan.
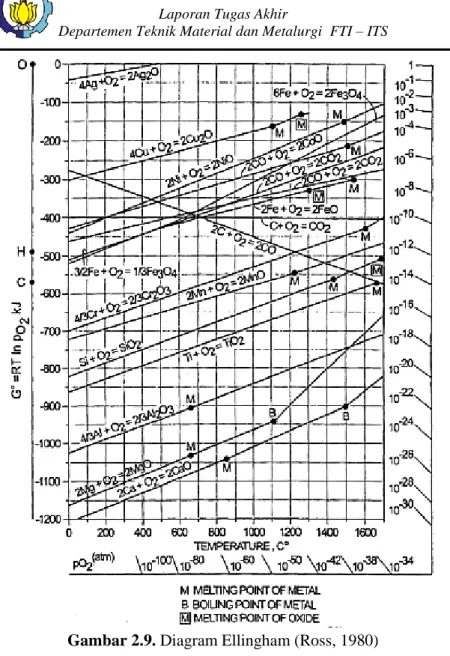
Gambar 2.9. Diagram Ellingham (Ross, 1980)
Diagram Ellingham merupakan diagram yang berisi energi bebas suatu reaksi yang diplot ke dalam suatu grafik dengan parameter energi bebas terhadap temperatur seperti yang
ditunjukkan pada Gambar 2.9. Pada diagram Ellingham, logam yang aktif secara kimia memiliki energi bebas yang paling tinggi (negatif) dalam membentuk oksida dan terletak pada diagram di bagian paling bawah. Sedangkan untuk logam yang memiliki energi bebas terkecil (positif) dalam membentuk oksida terletak pada diagram di bagian paling atas. Besar nilai energi bebas (∆G°) untuk reaksi oksidasi merupakan ukuran afinitas kimia suatu logam terhadap oksigen. Semakin negatif nilai ∆G° suatu logam menunjukkan logam tersebut semakin stabil dalam bentuk oksida.
Dari diagram Ellingham pada Gambar 2.9 dapat diketahui temperatur minimal yang dibutuhkan agar terjadi reaksi tersebut terjadi. Hal tersebut dapat ditunjukkan oleh perpotongan antara kurva oksida dan garis pembentukan CO. Termodinamika hanya dapat digunakan untuk menentukan apakah suatu reaksi dapat berjalan spontan atau tidak pada temperatur tertentu berdasarkan energi bebas yang dimiliki. Namun tidak dapat digunakan untuk menentukan laju reaksi. Perpotongan antara garis reaksi oksida dan reduksi secara termodinamika menunjukkan bahwa reaksi tersebut berjalan pada temperatur tertentu.
Klasifikasi reaksi reduksi suatu bijih mineral berdasarkan reducing agent dikemukakan oleh metallurgist Prancis bernama Jacquez Assenfratz pada tahun 1812 (Andronov 2007). Dia membuktikan secara pengujian bahwa reduksi bijih besi terjadi dalam 2 cara, yaitu: kontak antara bijih dan arang atau interaksi dengan gas reduktor.
Dalam proses berdasarkan batu bara, gas reduktor utama adalah CO. Tiga reaksi reduksi dan entalpi reaksi pada 25 °C dari mineral besi dalam laterit dapat dituliskan sebagai berikut:
Fe3O4 + CO → 3FeO + CO2 ΔH= +8664 cal/mol (2.16) FeO + CO → Fe + CO2 ΔH= -4136 cal/mol (2.17) Ketika wustit bertemu dengan silikat akan membentuk fasa fayalit, seperti reaksi:
2FeO + SiO2 → ¼Fe2SiO4 (2.18) Entalpi reaksi pada 25 °C dapat diketahui dari entalpi pembentukan. Reaksi (2.15) dan (2.17), mempunyai entalpi negatif, yang berarti reaksi eksotermik dan reaksi (2.16) mempunyai entalpi positif, berarti reaksi endotermik dan membutuhkan energi. Karena wustit metastabil di bawah 570°C, Fe3O4 dapat direduksi dalam satu langkah menjadi besi metalik, tanpa melewati reaksi wustit.
⅓Fe3O4 + CO → ¼Fe + CO2 ΔH= -936 cal/mol (2.19) Dalam sistem solid dan reduktor berfasa gas, seluruh rekasi selama reduki bijih besi dapat terjadi dalam dua langkah (Chatterjee 1988): reduksi mineral besi dan gasifikasi karbon.
mFexOy + pCO(g) → nFezOw(s) + rCO2(g) (2.20) C(s) + CO2(g) → 2CO(g) (Reaksi Boudouard) (2.21) Dalam reaksi Boudouard, ketika karbon dioksida bereaksi dengan karbon membentuk karbon monoksida, satu volume karbon dioksida menghasilkan dua volume karbon monoksida pada tekanan konstan. Jika dalam volume konstan, reaksi akan meningkatkan temperatur. Jika tekanan meningkatkan, maka kesetimbangan sistem karbon-oksigen akan bergeser untuk melepas tekanan. Oleh
karena itu untuk menjaga rasio CO/CO2 tetap sama pada tekanan tinggi, temperatur harus ditingkatkan.
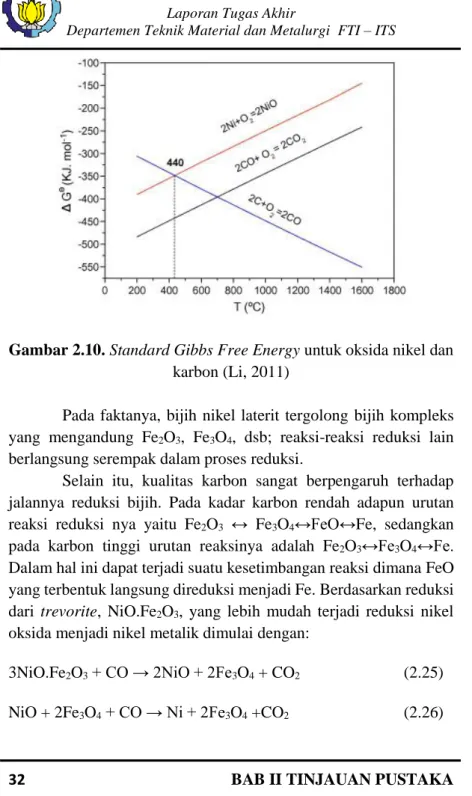
Dilihat dari diagram Ellingham, reaksi reduksi NiO oleh CO mulai terjadi pada temperatur 440 °C. Sedangkan reaksi reduksi Fe2O3 dengan gas CO terjadi pada tempetarur 650 °C. Namun kedua reaksi reduksi ini belum akan terjadi pada temperatur tersebut oleh gas CO karena reaksi Boudouard baru terjadi pada temperatur diatas 900 °C.
Menurut Li (2011), reaksi reduksi nikel dari laterit terjadi pada metode deoksidasi solid-state, reduktor gas dan padat keduanya digunakan. Proses reduksi nikel Ni dipengaruhi oleh temparatur, waktu reduksi, kadar CO, kadar karbon dan kadar CaO. Reaksi utama dari nikel oksida menjadi nikel metalik adalah:
C + CO2 → 2CO ΔG°= 166550 – 171T J/mol (2.22) NiO + C → Ni + CO ΔG°= 124800 – 175T J/mol (2.23) NiO + CO →Ni + CO2 ΔG°= -40590 – 0,42T J/mol (2.24) Dari diagram Ellingham (Gambar 2.9), temperatur terendah pada tekanan atmosfer, reduksi NiO oleh fixed carbon terjadi pada temperatur 440 °C. Kurva energi Gibbs standar dari pembentukan NiO adalah lebih dari CO2, dan energi bebas Gibbs standar dari reaksi (2.24) bernilai negatif pada tekanan atmosfer. Sehingga NiO dengan mudah tereduksi dengan CO (Li, 2011).
Gambar 2.10. Standard Gibbs Free Energy untuk oksida nikel dan
karbon (Li, 2011)
Pada faktanya, bijih nikel laterit tergolong bijih kompleks yang mengandung Fe2O3, Fe3O4, dsb; reaksi-reaksi reduksi lain berlangsung serempak dalam proses reduksi.
Selain itu, kualitas karbon sangat berpengaruh terhadap jalannya reduksi bijih. Pada kadar karbon rendah adapun urutan reaksi reduksi nya yaitu Fe2O3 ↔ Fe3O4↔FeO↔Fe, sedangkan pada karbon tinggi urutan reaksinya adalah Fe2O3↔Fe3O4↔Fe. Dalam hal ini dapat terjadi suatu kesetimbangan reaksi dimana FeO yang terbentuk langsung direduksi menjadi Fe. Berdasarkan reduksi dari trevorite, NiO.Fe2O3, yang lebih mudah terjadi reduksi nikel oksida menjadi nikel metalik dimulai dengan:
3NiO.Fe2O3 + CO → 2NiO + 2Fe3O4 + CO2 (2.25) NiO + 2Fe3O4 + CO → Ni + 2Fe3O4 +CO2 (2.26)
Ni + Fe3O4 + CO → Ni + 3FeO + CO2 (2.27) Reduksi selanjutnya dari wustit menjadi besi metalik terjadi:
FeO + CO → [Fe]Ni + CO2 (2.28)
Berdasarkan kondisi percobaan, proses reduksi dari (2.27) dan (2.28) akan sulit terjadi (Olli 1995).
Menurut Jiang (2013) mekanisme selective reduction dari nikel terjadi sesuai reaksi berikut:
Terjadi dekomposisi termal dan reduksi Natrium sulfat
Na2SO4 + 4CO → Na2S + 4CO2(g) (2.29) Na2SO4 + 3CO → Na2O + S(g) + 3CO(g) (2.30)
Pengikatan Fe membentuk FeS
Na2S + FeO → 2SiO2 + FeS + Na2Si2O5 (2.31)
Fe + S → FeS (2.32)
2.8. Kinetika Reduksi Ore
Kinetika reaksi reduksi bijih mineral adalah kecepatan mineral oksida untuk bertransformasi menjadi logam metalik dengan melepaskan oksigen. Kecepatan reaksi reduksi bijih mineral ditentukan oleh tinggi rendahnya kemampuan bijih mineral tersebut untuk direduksi yang dipengaruhi oleh beberapa faktor, yaitu ukuran partikel, bentuk dan distribusi ukuran partikel, bobot jenis, porosity, struktur kristal, serta komposisi kimia (Ross 1980). Kinetika reduksi menggunakan reduktor batu bara dipengaruhi oleh kombinasi beberapa mekanisme, yaitu perpindahan panas, perpindahan massa
oleh konveksi, difusi fase gas, serta reaksi kimia dengan gasifikasi karbon. El-Geassy (2007) menjelaskan bahwa ada banyak faktor yang mempengaruhi reduksi mineral oksida seperti komposisi bahan baku, basisitas, komposisi gas, dan temperatur reduksi. Pengaruh komposisi gas terjadi pada perubahan volume dari mineral oksida pada temperatur 800 – 1100 °C.
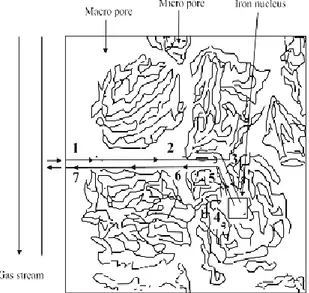
Bijih mineral dapat dianggap tersusun atas butiran-butiran. Celah diantara butiran-butiran dikenal sebagai pori makro dan pori yang lebih kecil dikenal sebagai pori mikro. Mekanisme reduksi ore mineral bertahap melalui langkah-langkah sebagai berikut dan diilustrasikan Gambar 2.11. (Bogdandy, Von and Engell 1971).
Gambar 2.11. Mekanisme reduksi untuk mineral berpori
(Bogdandy, Von and Engell 1971). Dimana:
2. Difusi gas reduktor melalui pori-pori makro pada bijih besi. 3. Difusi gas reduktor melalui pori-pori mikro menuju posisi
reaksi.
4. Reaksi pada batas fasa.
5. Difusi gas hasil reaksi reduksi melalui pori-pori mikro. 6. Difusi gas hasil reaksi reduksi melalui pori-pori makro. 7. Difusi gas hasil reaksi reduksi melalui lapisan batas butir.
Dari semua mekanisme reduksi, langkah-langkah yang mendasar dalam reduksi bijih mineral, diantaranya (Takuda, Yoshikoshi and Ohtano 1973) :
1) Perpindahan panas dalam reaksi antarmuka
2) Perpindahan massa antara gas dan permukaan padat oksida, yang meliputi difusi gas reduktor kedalam permukaan solid atau gas hasil reduksi keluar dari permukaan.
3) Perpindahan massa antara permukaan oksida dan reaksi antarmuka internal melalui lapisan hasil reduksi, yang dipengaruhi oleh:
• Difusi solid melalui oksida rendah • Difusi solid melalui lapisan logam metal
• Difusi antar partikel gas reduktor atau gas hasil reduksi. 4) Reaksi kimia penghilangan oksigen pada permukaan antarmuka. 5) Pengintian dan pertumbuhan fasa logam metalik.
2.9. Kajian Terdahulu Mengenai Reduksi Nikel Laterit Limonitik
Beberapa kegiatan penelitian untuk meningkatkan kadar nikel dalam laterit limonit telah dilakukan oleh beberapa peneliti terdahulu. Rudi dan kawan-kawan dalam penelitiannya yang berjudul “Peningkatan kadar nikel dalam laterit jenis limonit dengan cara peletasi, pemanggangan reduksi, dan pemisahan magnet campuran bijih, batu bara, dan Na2SO4”, telah melakukan
penelitian untuk meningkatkan kadar nikel dalam nikel laterit kadar rendah yang mempunyai kandungan awal NiO 1,42% dan Fe2O3 69,55% dengan cara pemanggangan bijih nikel laterit limonit dengan komposisi 10% Na2SO4 dan 10% batu bara pada temperatur 500 °C selama 1 jam kemudian dilanjutkan dengan proses pemisahan magnet dalam media air terhadap hasil reduksi yang dihasilkannya. Hasil penelitiannya memperlihatkan bahwa kadar nikel dalam bijih dapat ditingkatkan dari 1,42% menjadi 1,51% pada temperatur reduksi 800 oC, kemudian menjadi 1,46% pada temperatur reduksi 900 oC, dan menjadi 1,62% pada temperatur reduksi 1000 oC, serta menjadi 1,60% pada temperatur 1100 oC.
Penelitian lainnya dilakukan oleh Li dan kawan-kawan di dalam penelitiannya yang berjudul “The reduction of nickel from low-grade nickel laterite ore using a solid-state deoxidisation method” yang telah melakukan percobaan untuk meningkatkan kadar nikel dalam bijih nikel laterit kadar rendah yang mempunyai kadar Ni 1,09% dan Fe 9,16%, dengan menggunakan teknik solid-state deoxidization method. Dari hasil penelitiannya diperoleh konsentrat feronikel dengan kadar nikel 4,5% dan perolehan nikel dalam konsentrat mencapai 80%.
Upaya lainnya untuk meningkatkan kadar nikel dalam laterit dilakukan oleh Agus dan kawan kawan dengan judul penelitian “Pengaruh temperatur reduksi dalam proses peningkatan kadar Ni dan Fe pada bijih nikel laterit jenis limonit” yang telah melakukan penelitian proses reduksi bijih nikel laterit limonit menggunakan muffel furnace dengan temperatur reduksi 900 oC, 950 oC, 1000 oC, dan 1100 oC dengan waktu reduksi tetap selama 1 jam. Setelah dilakukan proses reduksi, dilakukan pengujian AAS untuk mengetahui seberapa besar peningkatan kadar Ni dan Fe nya. Hasil analisis AAS dari konsentrat menunjukkan bahwa semakin tinggi temperatur, maka semakin tinggi kadar Ni dan Fe. Dari hasil
percobaan di atas, diperoleh data optimal yaitu pada temperatur 1100 oC dengan perolehan kadar Ni sebesar 2,27% dan Fe sebesar 53,59%.
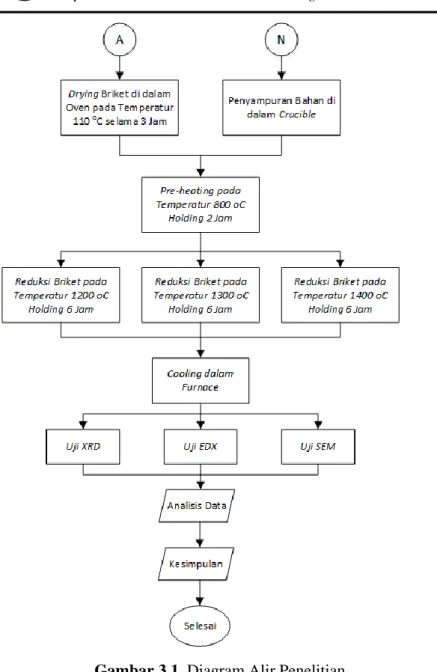
METODE PENELITIAN 3.1. Diagram Alir Penelitian
3.2. Bahan Penelitian
Bahan – bahan yang digunakan dalam penelitian ini, antara lain :
3.2.1. Bijih Nikel
Bijih nikel yang digunakan dalam penelitian ini adalah bijih nikel laterit jenis limonit, yang berasal dari daerah Sulawesi Tenggara. Bijih nikel dihancurkan terlebih dahulu kemudian diayak hingga berukuran 50 mesh. Bijih nikel laterit limonitik yang digunakan ditujukkan pada Gambar 3.2.
Gambar 3.2. Bijih Nikel Laterit Limonitik 3.2.2. Batu Bara
Batu bara yang digunakan dalam penelitian ini yaitu batu bara dengan jenis sub-bituminus dari Binuang, Kalimantan Selatan. Batu bara ini juga dihancurkan terlebih dahulu kemudian diayak hingga berukuran 50 mesh. Batu bara yang digunakan ditunjukkan pada Gambar 3.3.
Gambar 3.3. Batu Bara 3.2.3. Batu Kapur
Batu Kapur (Dolomite) yang digunakan dihancurkan terlebih dahulu kemudian diayak hingga berukuran 50 mesh. Batu kapur yang digunakan ditunjukkan pada Gambar 3.4.
Gambar 3.4. Batu Kapur 3.2.4. Natrium Sulfat
Natrium Sulfat (Na2SO4) digunakan dalam penelitian ini sebagai agen selective reduction pada nikel laterit seperti pada Gambar 3.5.
Gambar 3.5. Serbuk Natrium Sulfat 3.2.5. Kanji
Kanji digunakan dalam penelitian ini sebagai pengikat (binder) dalam pembuatan briket seperti pada Gambar 3.6.
Gambar 3.6. Serbuk Kanji 3.2.6. Air
Air digunakan sebagai bahan campuran di dalam proses pembuatan briket. Air yang digunakan yaitu air ledeng.
3.2.7. LPG
LPG digunakan sebagai sumber bahan bakar pada proses reduksi bijih nikel di dalam Muffle Furnace. LPG yang digunakan ditunjukkan pada Gambar 3.7.
Gambar 3.7. LPG 3.3. Peralatan Penelitian
Peralatan yang digunakan dalam penelitian ini, antara lain :
3.3.1. Alat Kompaksi
Alat kompaksi berfungsi untuk membentuk campuran bahan menjadi briket yang berbentuk bantal (pillow). Alat kompaksi yang digunakan ditunjukkan pada Gambar 3.8. Briket dibuat dengan menggunakan bahan baku berupa bijih nikel laterit limonitik, batubara, natrium sulfat, dan kanji. Volume hasil beriket yaitu 14 cm3 dan dimensi briket :
Panjang : 4,3 cm Lebar : 3,4 cm Tebal : 1,65 cm
Gambar 3.8. Alat Kompaksi 3.3.2. Muffle Furnace
Proses reduksi dilakukan di dalam Muffle Furnace seperti pada Gambar 3.9. Dimensi Muffle Furnace yang digunakan adalah sebagai berikut :
Diameter atas : 36 cm Diameter bawah : 36 cm
Tinggi : 64 cm
Gambar 3.9. Muffle Furnace 3.3.3. Crucible
Di dalam penelitian ini, crucible digunakan sebagai media tempat terjadinya reduksi briket nikel laterit limonitik yang tertimbun di dalam bed batubara. Dimensi crucible yang digunakan adalah sebagai berikut seperti pada gambar 3.10:
Diameter atas : 13 cm Diameter bawah : 10 cm
Tinggi : 17 cm
Gambar 3.10. Crucible 3.3.4. Timbangan Digital
Timbangan digital digunakan dalam penelitian ini untuk menimbang bahan baku yang akan digunakan sebagai bahan campuran untuk pembuatan briket dan pembuatan bed batubara, ditunjukkan pada Gambar 3.11.
3.3.5. Ayakan
Ayakan digunakan dalam penelitian ini untuk mendapatkan ukuran butir dari bahan baku yang digunakan sebagai bahan campuran pembuatan briket. Ayakan yang digunakan berukuran 50 mesh seperti pada Gambar 3.12.
Gambar 3.12. Ayakan 3.3.6. Thermocouple
Thermocouple digunakan untuk mengetahui temperatur di dalam Muffle Furnace saat proses reduksi.
Gambar 3.13. Thermocouple 3.3.7. Blower
Blower digunakan untuk meniupkan udara luar ke dalam Muffle Furnace. Blower yang digunakan ditunjukkan pada Gambar 3.14.

![Tabel 2.1. Tata Nama Gamping Bedasarkan Kandungan Magnesium [Oates, 1998]](https://thumb-ap.123doks.com/thumbv2/123dok/4170696.3085923/45.637.97.521.207.464/tabel-tata-nama-gamping-bedasarkan-kandungan-magnesium-oates.webp)