BAB II
TINJAUAN PUSTAKA
2.1 Uraian Bahan
2.1.1 Taksonomi Jambu Biji (Guava, Psidium guajava L.) Kingdom : Plantae
Divisi : Spermatophyta Sub divisi : Angiospermae Kelas : Dicotyledoneae Bangsa : Myrtales Suku : Myrtaceae Marga : Psidium
Jenis : Psidium guajava L. (Anonim, 2010a) 2.1.2 Deskripsi Tentang Jambu Biji
Jambu biji atau bahasa latinnya Psidium guajava L. merupakan jenis tanaman perdu dengan cabang yang banyak. Tinggi pohon ini rata-rata sekitar 10-12 meter. Tanaman yang berasal dari Amerika Tengah ini dapat tumbuh di dataran rendah maupun dataran tinggi. Ketinggian tempat yang sesuai untuk tanaman ini sekitar 1.200 meter dari permukaan laut. Daunnya berbentuk bulat telur, kasar, dan kusam. Bunganya relatif kecil dan berwarna putih. Besar buahnya sangat bervariasi, berisi banyak biji kecil-kecil dan ada juga yang tidak mempunyai biji yang biasa disebut dengan jambu sukun (Wirakusumah, 2000).
Buah jambu biji yang banyak digemari oleh masyarakat adalah yang mempunyai sifat unggul antara lain berdaging lunak dan tebal, rasanya manis, tidak mempunyai biji,
dan buahnya berukuran besar. Terdapat beberapa jenis jambu biji yang diunggulkan yaitu jambu pasar minggu, jambu bangkok, jambu palembang, jambu sukun, jambu apel, jambu sari, jambu merah, dan jambu merah getas (Wirakusumah, 2000).
2.1.3 Macam-macam Jambu Biji
Buah jambu biji memiliki jenis yang banyak antara lain : 1. Jambu biji delima
Jambu biji delima buahnya berbentuk bulat dan bermoncong dipangkalnya, walaupun kulitnya agak tebal dan banyak bijinya, tapi dengan dagingnya yang berwarna merah dan rasanya yang manis jenis jambu biji delima ini sangat menarik sekali untuk dinikmati.
2. Jambu biji gembos atau jambu biji susu
Jenis yang ini mempunyai bentuk buah bulat agak lonjong dengan meruncing kepangkalnya. Sama seperti jambu biji delima, kulit jambu jenis ini juga tebal dan jika buahnya matang berwarna agak kuning, dagingnya berwarna putih, bijinya tidak banyak, rasa kurang manis tetapi harum baunya.
3. Jambu biji manis
Bentuk buahnya bulat meruncing ke pangkal, kulit buahnya tipis dan jika matang berwarna kuning muda. Jenis yang ini juga mempunyai biji yang banyak dan dagingnya berwarna putih tetapi rasanya manis dan harum baunya.
4. Jambu biji Perawas
Jambu biji perawas berbentuk bulat lonjong dan buahnya lebih besar dari jenis biasanya, kulitnya agak tebal, bila buahnya matang berwarna kuning, dagingnya merah, bijinya tidak banyak, rasanya agak asam, baunya harum.
5. Jambu biji Pipit
Berbentuk bulat kecil-kecil, kulitnya tipis, bila matang buahnya berwarna kuning dan dagingnya berwarna putih, rasanya manis dan harum baunya.
6. Jambu biji sukun
Berbentuk bulat besar dan kulitnya tebal, bila matang buahnya berwarna kuning, bijinya sedikit bahkan hampir tidak berbiji, tapi rasanya hambar dan harum baunya (Anonim, 2010a).
2.1.4 Kandungan Kimia Jambu Biji
Jambu biji banyak mengandung zat kimia : pada buah, daun dan kulit batang pohonnya mengandung tanin, tapi pada bunganya tidak banyak mengandung tanin. Selain mengandung tanin daun jambu biji juga mengandung zat lain seperti asam oleanolat, minyak atsiri, asam kratogolat, asam ursolat, asam psidiolat, asam guajaverin dan vitamin (Anonim, 2010a).
Kandungan buah jambu biji (100 gram) yaitu Kalori 49 kal, Vitamin A 25 SI, Vitamin B1 0,02 mg, Vitamin C 87 mg, Kalsium 14 mg, Hidrat Arang 12,2 gram, Fosfor 28 mg, Besi 1,1 mg, Protein 0,9 mg, Lemak 0,3 gram dan Air 86 gram (Anonim, 2010a).
2.1.5 Khasiat Jambu Biji
Selain banyak digemari karena buahnya yang manis dan segar jambu biji juga mempunyai khasiat untuk mengobati berbagai macam penyakit seperti : maag, diabetes melitus, diare (sakit perut), masuk angin, mencret, prolapsisani, sariawan dan sakit kulit.
2.2 Logam
Logam dapat dibagi menjadi dua bagian yaitu logam esensial dan logam nonesensial. Logam esensial adalah logam yang sangat membantu dalam proses fisiologis makhluk hidup dengan jalan membantu kerja enzim atau pembentukan organ dari makhluk hidup yang bersangkutan. Sebaliknya logam nonesensial adalah logam yang peranannya dalam tubuh makhluk hidup belum diketahui, kandungannya dalam jaringan hewan sangat kecil, dan apabila kandungannya tinggi akan dapat merusak organ-organ tubuh makhluk hidup yang bersangkutan. Logam yang dapat menyebabkan keracunan adalah jenis logam berat. Logam ini termasuk logam yang esensial seperti Cu, Zn, Se dan yang nonesensial seperti Hg, Pb, Cd, dan As.
Logam berat masuk ke dalam tubuh manusia biasanya melalui mulut, yaitu makanan yang terkontaminasi oleh alat masak, wadah (minuman/makanan kaleng) dan juga melalui pernapasan seperti dari asap pabrik, proses industri, dan buangan limbah. Kontaminasi makanan juga dapat terjadi dari tanaman pangan (bidang pertanian) yang diberi pupuk pestisida yang mengandung logam (Darmono, 1995).
Pada lapisan atmosfer yang melingkupi bumi ditemukan bermacam-macam logam, baik itu merupakan logam biasa seperti besi (Fe), magnesium (Mg) dan lainnya sampai pada logam berat seperti tembaga (Cu), kadmium (Cd), arsen (As) dan lainnya. Logam-logam yang banyak ditemukan dalam lapisan atmosfer (di udara) adalah merkuri (Hg), timah hitam (Pb) dan berium (Be). Keberadaan dari logam-logam ini dapat mencemari udara. Logam yang terdapat dalam atmosfer ditemukan dalam bentuk partikulat atau merupakan senyawa. Sangat jarang ditemukan bahan logam sebagai elemen bebas dalam atmosfer (udara) kecuali logam air raksa (merkuri/Hg). Bentuk dan keberadaan bahan atau partikulat-partikulat logam di udara sangat dipengaruhi oleh
sumber asalnya. Sumber tersebut dapat sebagai hasil samping dari suatu pembakaran, sumber penguapan, atau dari sumber lainnya (Palar, 2004).
Treshold Limit Value (TLV) adalah batas konsentrasi maksimum setiap logam di
udara. Pada tabel di bawah ini dapat dilihat TLV dari logam yang bersifat toksik sampai kurang toksik.
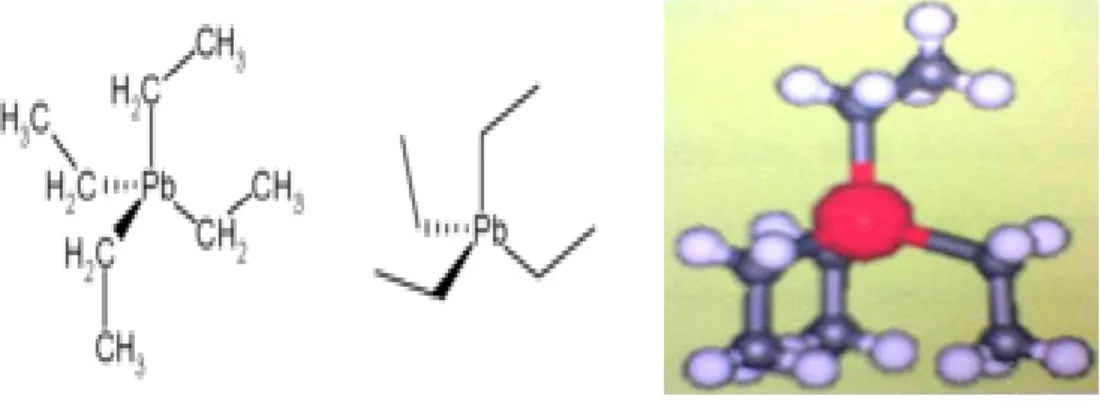
Tabel 1. TLV dari Logam Toksik di Atmosfer
No. Logam TLV (mg/m3) 1 Be 0,002 2 Hg 0,01-0,05 3 Cd 0,1 4 Pb 0,1-0,2 5 As 0,2-0,5 6 V 0,5 7 Ni 0,007-1,0 8 Cu 1,0 9 Fe 1,0 10 Zn 1,0 (Manahan, 1984).
2.3 Timbal
Pemerian : logam berwarna kebiru-biruan sampai abu-abu pudar, mempunyai berat jenis yang tinggi dan lunak. Kelarutan : larut dalam HNO3 pekat, sedikit larut dalam HCl
dan H2SO4 pekat. Nomor Atom / Berat Atom : 82/207,2
Berat Jenis : 11,34 g/ml Titik lebur : 327,5oC
Titik didih : 1740oC (Lawrence, 1957) 2.3.1 Penggunaan Timbal
Timbal dan persenyawaannya banyak digunakan dalam berbagai bidang. Dalam industri baterai, timbal digunakan sebagai grid yang merupakan alloy (suatu persenyawaan) dengan logam bismut (Pb-Bi) dengan perbandingan 93:7 (Palar, 2004).
Timbal oksida (PbO4) dan logam timbal dalam indu stri baterai digunakan sebagai bahan yang aktif dalam pengaliran arus elektron. Alloy Pb yang mengandung 1% stibium (Sb) banyak digunakan sebagai kabel telepon. Alloy Pb dengan 0,15% As, 0,1% Sn, dan 0,1% Bi banyak digunakan untuk kabel listrik (Palar, 2004).
Persenyawaan Pb dengan Cr (chromium), Mo (molibdenum) dan Cl (chlor), digunakan secara luas sebagai pigmen “chrom”. Senyawa PbCrO4 digunakan dalam industri cat untuk mendapatkan warna “kuning-chrom”, Pb(OH)2.2PbCO3 untuk mendapatkan warna “timah putih”, sedangkan senyawa yang dibentuk dari PbO4 digunakan untuk mendapatkan warna “timah merah” (Palar, 2004).
Senyawa silikat timbal (Pb-silikat) yang dibentuk dari intermediet Pb-asetat (CH3-COO-Pb-OOCH3), digunakan secara luas sebagai salah satu bahan pengkilap
keramik dan sekaligus berperan sebagai bahan tahan api. Persenyawaan yang terbentuk antara Pb dengan arsenat dapat digunakan sebagai insektisida (Palar, 2004).
Dalam perkembangan industri kimia, dikenal pula zat aditif yang dapat ditambahkan ke dalam bahan bakar kendaraan bermotor. Persenyawaan yang dibentuk dari logam Pb sebagai zat aditif ini ada dua jenis, yaitu (CH3)4-Pb (tetrametil-Pb) dan (C2H5)4-Pb (tetraetil-Pb) (Palar, 2004).
2.3.2 Toksisitas Timbal
Toksisitas yang ditimbulkan oleh persenyawaan logam Pb dapat terjadi karena masuknya persenyawaan logam tersebut ke dalam tubuh. Proses masuknya Pb ke dalam tubuh dapat melalui beberapa jalur, yaitu melalui makanan dan minuman, udara dan perembesan atau penetrasi pada selaput atau lapisan kulit (Palar, 2004).
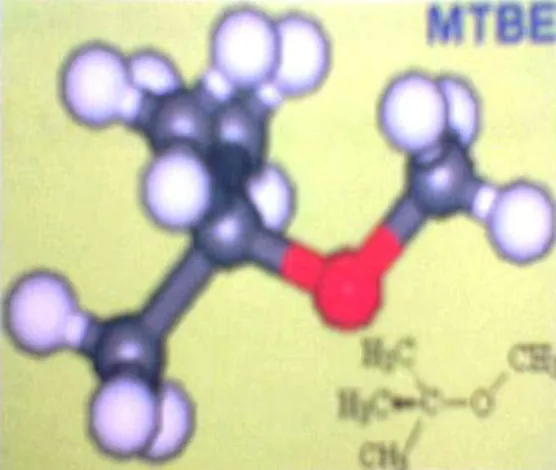
Menurut WHO, batas maksimum konsentrasi Pb yang masih diperbolehkan di udara, makanan dan minuman dapat dilihat pada tabel di bawah ini :
Tabel 2. Batas Maksimum Konsentrasi Pb dalam Udara, Makanan, dan Minuman
No Bahan Satuan Limit Konsentrasi
1 Udara (µg/m3) 30-60
2 Makanan (mg/kg) 0,1-2,0
3 Minuman (mg/l) 0,05
(Darmono, 2001)
Bentuk-bentuk kimia dari senyawa-senyawa Pb, merupakan faktor penting yang mempengaruhi aktivitas Pb dalam tubuh manusia. Senyawa-senyawa Pb organik relatif lebih mudah untuk diserap oleh tubuh melalui selaput lendir atau melalui lapisan kulit, bila dibandingkan dengan senyawa-senyawa Pb anorganik. Namun hal itu bukan berarti semua senyawa Pb dapat diserap oleh tubuh, melainkan hanya sekitar 5-10% dari jumlah Pb yang masuk melalui makanan dan sebesar 30% dari jumlah Pb yang terhirup
yang akan diserap oleh tubuh. Dari jumlah yang terserap itu, hanya 15% yang akan mengendap pada jaringan tubuh, dan sisanya akan terbuang bersama bahan sisa metabolisme seperti urin dan feses (Palar, 2004).
Senyawa Pb yang masuk ke dalam tubuh melalui makanan dan minuman akan diikutkan dalam proses metabolisme tubuh. Namun demikian jumlah Pb yang masuk bersama makanan dan minuman ini masih mungkin ditolerir oleh lambung disebabkan asam lambung (HCl) mempunyai kemampuan untuk menyerap logam Pb. Tetapi walaupun asam lambung mempunyai kemampuan untuk menyerap keberadaan logam Pb ini, pada kenyataannya Pb lebih banyak dikeluarkan oleh tinja (Palar, 2004).
Pada jaringan atau organ tubuh, logam Pb akan terakumulasi pada tulang, karena logam ini dalam bentuk ion Pb2+ mampu menggantikan keberadaan ion Ca2+ (kalsium) yang terdapat dalam jaringan tulang. Di samping itu, pada wanita hamil logam Pb dapat melewati plasenta dan kemudian akan ikut masuk dalam sistem peredaran darah janin dan selanjutnya setelah bayi lahir, Pb akan dikeluarkan bersama air susu (Palar, 2004).
Meskipun jumlah Pb yang diserap oleh tubuh hanya sedikit, logam ini ternyata menjadi sangat berbahaya. Hal itu disebabkan karena timbal (Pb) adalah logam toksik yang bersifat kumulatif dan bentuk senyawanya dapat memberikan efek racun terhadap banyak fungsi organ yang terdapat dalam tubuh (Suharto, 2005).
Gejala yang khas dari keracunan Pb adalah:
1. Gastroenteritis, disebabkan reaksi rangsangan garam Pb pada mukosa saluran pencernaan, sehingga menyebabkan pembengkakan, gerak kontraksi rumen dan usus terhenti, peristaltik menurun sehingga terjadi konstipasi dan kadang-kadang diare.
2. Anemia, Pb terbawa dalam darah dan lebih dari 95% berikatan dengan eritrosit. Ini menyebabkan mudah pecahnya sel darah merah dan berpengaruh terhadap sintesis hemoglobin sehingga menyebabkan anemia.
3. Ensefalopati, Pb menyebabkan kerusakan sel endotel dan kapiler darah otak sehingga dapat menimbulkan sakit kepala, mudah lupa, dan lain-lain (Cahyadi, 2007).
4. Aminociduria, yaitu terjadinya kelebihan asam amino dalam urin disebabkan ikut sertanya senyawa Pb yang terlarut dalam darah ke sistem urinaria (ginjal) sehingga mengakibatkan terjadinya kerusakan pada saluran ginjal dengan terbentuknya
intranuclear inclusion bodies (Palar, 2004).
2.4 Bilangan Oktan
Bilangan oktan adalah angka yang menunjukkan seberapa besar tekanan yang bisa diberikan sebelum bensin terbakar secara spontan. Nama oktan berasal dari oktana (C8), karena dari seluruh molekul penyusun bensin, oktana yang memiliki sifat kompresi paling bagus. Oktana dapat dikompres sampai volume kecil tanpa mengalami pembakaran spontan, tidak seperti yang terjadi pada heptana, misalnya, yang dapat terbakar spontan meskipun baru ditekan sedikit (Anonim, 2010b).
Bensin dengan bilangan oktan 88, berarti bensin tersebut terdiri dari 88% oktana dan 12% heptana (atau campuran molekul lainnya). Bensin ini akan terbakar secara spontan pada angka tingkat kompresi tertentu yang diberikan, sehingga hanya diperuntukkan untuk mesin kendaraan yang memiliki ratio kompresi yang tidak melebihi angka tersebut (Anonim, 2010b).
Angka oktan bisa ditingkatkan dengan menambahkan zat aditif bensin. Menambahkan tetra ethyl lead (TEL, Pb(C2H5)4) pada bensin akan meningkatkan
bilangan oktan bensin tersebut, sehingga bensin "murah" dapat digunakan dan aman untuk mesin dengan menambahkan timbal ini. Untuk mengubah Pb dari bentuk padat menjadi gas pada bensin yang mengandung TEL dibutuhkan etilen bromida (C2H5Br). Kerugiannya, lapisan tipis timbal terbentuk pada atmosfer dan membahayakan makhluk hidup, termasuk manusia. Di negara-negara maju, timbal sudah dilarang untuk dipakai sebagai bahan campuran bensin (Anonim, 2010b).
2.4.1 Tetra Ethyl Lead (TEL) dan Tetra Methyl Lead (TML)
TEL dan TML adalah organologam yang secara bersama-sama ditambahkan ke
dalam bensin sebagai zat aditif antiketukan mesin dengan menaikkan bilangan oktan bensin. TEL berbentuk cairan dengan berat jenis 1,659 g/ml, titik didih 200oC (=390oF) dan larut dalam bensin (Anonim, 2010c).
Bahan aditif yang biasa ditambahkan ke dalam bahan bakar kendaraan bermotor terdiri dari 61,45% TEL dan TML, 17,85% etilendibromida (C2H4Br2), 18,80% etilenklorida (C2H4Cl2), dan 1,90% bahan-bahan lain. Etilendibromida (C2H4Br2) dan etilenklorida (C2H4Cl2) adalah bahan scavenger yaitu senyawa yang dapat mengikat residu Pb yang dihasilkan setelah pembakaran, sehingga di dalam gas buangan terdapat Pb dan halogen (Anonim, 2010c).
Bahan utama pembuatan senywa TML dan TEL adalah metil klorida (CH3Cl) dan etil klorida (C2H5Cl), dengan reaksi pembentukkan sebagai berikut:
4 CH3Cl + 4 NaPb → 4 NaCl + 3 Pb + (CH3)4Pb
Metil klorida Tetra Methyl Lead (TML)
4 C2H5Cl + 4 NaPb → 4 NaCl + 3 Pb + (C2H5)4Pb
Etil klorida Tetra Ethyl Lead (TEL)
(Sukowati, 2010)
Pada saat pembakaran internal mesin, TEL akan mengalami dekomposisi secara
thermis. Mekanisme pemutusan rantai Pb diperkirakan sebagai berikut:
(C2H5)4Pb + 13O2 → 8CO2 + 10H2O + Pb 2Pb + O2 → 2PbO (Sukowati, 2010)
Pb sebagian akan terdeposit dalam ruang bakar, sebagian kecil Pb masuk ke dalam minyak pelumas dan sisanya dibawa bersama gas buang ke dalam sistem pembuangan. Rata-rata 60-70% dari Pb yang terdapat dalam TEL dilepaskan ke atmosfer (Sukowati, 2010).
Berdasarkan analisis yang pernah dilakukan, dapat diketahui kandungan bermacam-macam senyawa Pb yang ada dalam asap kendaraan bermotor yaitu:
PbBrCl, PbBrCl.2PbO, PbCl2, Pb(OH)Cl, PbBr2, PbCl2.2PbO, Pb(OH)Br, PbOx, PbCO3, PbBr2.2PbO, PbCO3.2PbO. Senyawa-senyawa Pb tersebut dalam keadaan kering dapat terdispersi di dalam udara (Palar, 2004).
2.4.2 Methyl Tertiary Butyl Ether (MTBE)
MTBE murni berbilangan setara oktan 118 yang dibuat dari etanol. Selain dapat
meningkatkan bilangan oktan, MTBE juga dapat menambahkan oksigen pada campuran gas di dalam mesin sehingga akan mengurangi pembakaran tidak sempurna bensin yang
menghasilkan gas CO. Belakangan diketahui bahwa MTBE juga berbahaya bagi lingkungan karena mempunyai sifat karsinogenik dan mudah bercampur dengan air, sehingga jika terjadi kebocoran pada tempat-tempat penampungan bensin, MTBE masuk ke air tanah bisa mencemari sumur dan sumber-sumber air minum lainnya (Anonim, 2010c).
Gambar 2. Struktur Molekul Methyl Tertiary Butyl Ether (MTBE) 2.5 Spektrofotometri Serapan Atom
Metode spektrofotometri serapan atom didasarkan pada prinsip absorpsi cahaya oleh atom. Atom-atom akan menyerap cahaya pada panjang gelombang tertentu tergantung pada sifat unsurnya. Sebagai contoh, natrium menyerap pada 589 nm. Cahaya pada panjang gelombang ini mempunyai cukup energi untuk mengubah tingkat elektronik suatu atom yang mana transisi elektronik suatu atom bersifat spesifik. Dengan menyerap suatu energi, maka atom akan memperoleh energi sehingga suatu atom pada keadaan dasar dapat ditingkatkan energinya ke tingkat eksitasi. Natrium mempunyai konfigurasi elektron 1s2, 2s2, 2p6, dan 3s1. Tingkat dasar untuk elektron valensi 3s1 ini dapat mengalami eksitasi ke tingkat 3p atau ke tingkat 4p (Rohman, 2007).
Dalam analisis secara spektrofotometri serapan atom, sampel yang akan dianalisis harus diuraikan menjadi atom-atom netral yang masih dalam keadaan dasar. Ada berbagai macam alat yang dapat digunakan untuk mengubah suatu sampel menjadi uap atom-atom yaitu dengan nyala atau dengan tanpa nyala. Teknik atomisasi dengan nyala dinilai kurang peka sehingga muncullah suatu teknik atomisasi yang baru yaitu teknik atomisasi tanpa nyala atau elektrotermal spektrofotometri serapan atom atau spektrofotometri graphite furnace (Rohman, 2007).
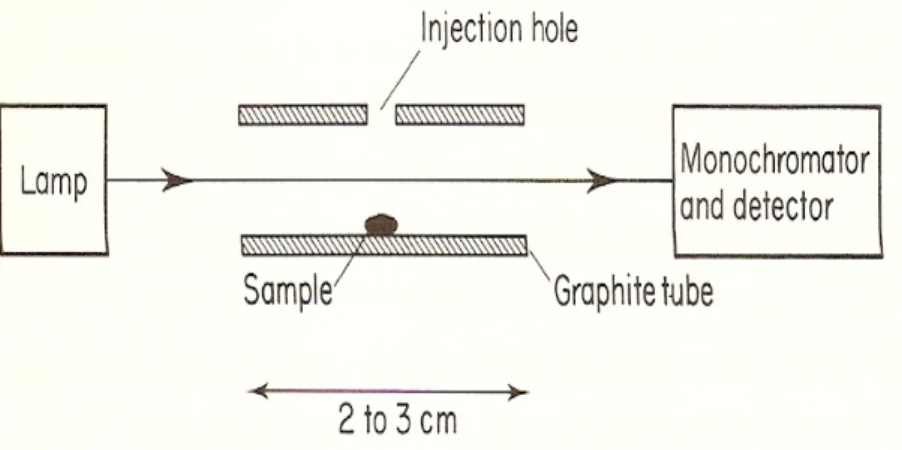
Sistem peralatan spektrofotometer serapan atom graphite furnace dapat dilihat pada Gambar 3.
Gambar 3. Diagram Skematis Spektrofotometer Serapan Atom Graphite Furnace Komponennya terdiri dari:
a. Sumber sinar
Sumber sinar yang lazim dipakai adalah lampu katoda berongga. Lampu ini terdiri atas tabung kaca tertutup yang mengandung suatu katoda dan anoda.
b. Grafit
Grafit berfungsi untuk mengubah zat yang dianalisis menjadi bentuk atom-atom netral. Sistem elektris melewatkan arus listrik pada grafit. Akibat pemanasan ini, maka zat yang akan dianalisis berubah menjadi atom-atom netral dan pada fraksi
atom ini dilewatkan suatu sinar yang berasal dari lampu katoda berongga sehingga terjadilah proses penyerapan energi sinar yang memenuhi kaidah analisis kuantitatif. c. Monokromator
Monokromator dimaksudkan untuk memisahkan dan memilih panjang gelombang yang digunakan dalam analisis.
d. Detektor
Detektor digunakan untuk mengukur intensitas cahaya yang melalui tempat pengatoman (Rohman, 2007).
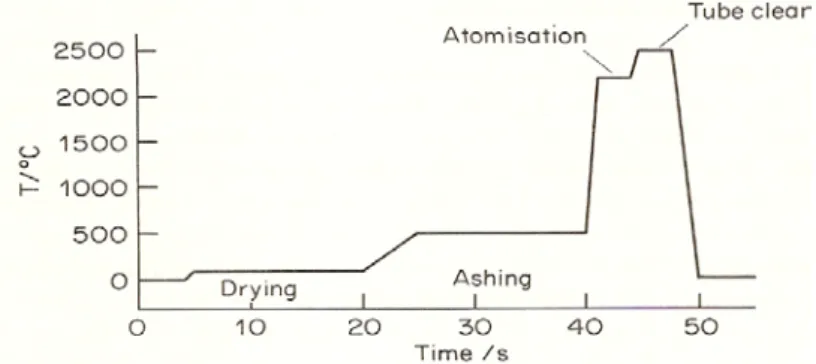
2.6 Proses Pengatoman Pada Spektrofotometer Serapan Atom Graphite Furnace Sistem pengatoman pada spektrofotometer ini melalui tiga tahapan yaitu: a. Pengeringan (Drying)
Pengeringan membutuhkan suhu yang lebih rendah yaitu 100oC untuk menguapkan pelarut.
b. Pengabuan (Ashing)
Pengabuan membutuhkan suhu yang lebih tinggi yaitu 400-500oC untuk menghilangkan matriks kimia dengan mekanisme volatilasi dan pirolisa senyawa organik.
c. Pengatoman (Atomising)
Pengatoman membutuhkan suhu yang sangat tinggi yaitu 2000-3000oC untuk menghasilkan puncak absorpsi (Rohman, 2007; Metcalfe, 1987).
Pada umumnya waktu dan suhu pemanasan pada spektrofotometer serapan atom
Gambar 4. Program Pengatoman Spektrofotometer Serapan Atom Graphite Furnace
2.7 Parameter Analisis
Pensahihan adalah kerja yang dicatat dalam dokumen untuk membuktikan bahwa prosedur analisis yang diuji akan dapat memenuhi fungsi sesuai dengan tujuannya dengan konsisten dan betul-betul memberikan hasil seperti yang diharapkan. Tujuan pensahihan adalah agar prosedur analisis tersebut diketahui akurasi dan variabilitasnya, gangguan yang mungkin ada teridentifikasi dan diketahui pula kespesifikan, presisi, serta kepekaannya (limit deteksi). Parameter analisis khas yang ditentukan pada pensahihan adalah akurasi, presisi, kespesifikan, limit deteksi, kelinieran, dan rentang (Satiadarma, dkk., 2004).
Akurasi dari suatu metode analisis adalah kedekatan nilai hasil uji yang diperoleh dengan prosedur tersebut dari harga yang sebenarnya. Akurasi merupakan ukuran ketepatan posedur analisis (Satiadarma, dkk., 2004).
Presisi dari suatu metode analisis adalah derajat kesesuaian di antara masing-masing hasil uji, jika prosedur analisis diterapkan berulangkali pada sejumlah cuplikan yang diambil dari satu sampel homogen. Presisi dinyatakan sebagai deviasi standar atau deviasi standar relatif (koefisien variasi) (Satiadarma, dkk., 2004).
Kespesifikan dari suatu metode analisis adalah kemampuannya untuk mengukur kadar analit secara khusus dengan akurat, di samping komponen lain yang terdapat dalam matriks sampel. Kespesifikan seringkali dinyatakan sebagai derajat bias dari hasil analisis sampel yang mengandung pencemar, hasil degradasi, senyawa sejenis yang ditambahkan atau komponen matriks, dibandingkan dengan hasil uji sampel analit tanpa zat tambahan (Satiadarma, dkk, 2004).
Limit deteksi dari suatu metode analisis adalah nilai parameter uji batas, yaitu konsentrasi analit terendah yang dapat dideteksi, tetapi tidak dikuantitasi pada kondisi percobaan yang dilakukan. Limit deteksi dinyatakan dalam konsentrasi analit (persen, bagian per milyar) dalam sampel (Satiadarma, dkk., 2004).
Limit kuantitasi dari suatu metode analisis adalah nilai parameter penentuan kuantitatif senyawa yang terdapat dalam konsentrasi rendah dalam matriks. Limit kuantitasi adalah konsentrasi analit terendah dalam sampel yang dapat ditentukan dengan presisi dan akurasi yang dapat diterima pada kondisi eksperimen yang ditentukan. Limit kuantitasi dinyatakan dalam konsentrasi analit (persen, bagian per milyar) dalam sampel (Satiadarma, dkk., 2004).
Kelinieran suatu metode analisis adalah kemampuan untuk menunjukkan bahwa nilai hasil uji langsung atau setelah diolah secara matematika, proporsional dengan konsentrasi analit dalam sampel dalam batas rentang konsentrasi tertentu. Kelinieran dinyatakan sebagai varians di sekitar landaian garis regresi yang dihitung menurut hubungan matematika yang mapan dari hasil uji sampel yang mengandung analit dengan konsentrasi yang bervariasi (Satiadarma, dkk., 2004).
Rentang suatu metode analisis adalah interval antara batas konsentrasi tertinggi dan konsentrasi terendah analit yang terbukti dapat ditentukan menggunakan prosedur
analisis, dengan presisi, akurasi dan kelinieran yang memadai. Rentang biasanya dinyatakan dalam satuan yang sama dengan hasil uji (persen, bagian per sejuta) (Satiadarma, dkk., 2004).
Penentuan linieritas suatu prosedur analisis dilakukan dengan perlakuan matematika dari hasil uji yang diperoleh pada analisis sampel yang mengandung analit dalam rentang konsentrasi yang dituntut oleh prosedur. Perlakuan tersebut pada umumnya adalah perhitungan garis regresi dengan metode least squares lawan konsentrasi analit. Untuk mendapatkan hasil proporsional antara penentuan kadar dan konsentrasi sampel, kadang-kadang data uji harus mendapatkan transformasi matematika sebelum regresi. Landaian garis regresi dan variansnya memberikan ukuran matematika dari linearitas (Satiadarma, dkk., 2004).
Rentang dari prosedur analisis disahihkan dengan jalan memverifikasi data yang menunjukkan bahwa prosedur analisis menghasilkan presisi, akurasi, dan linieritas yang dapat diterima, jika diterapkan pada sampel yang mengandung analit dengan konsentrasi analit di ujung rentang dan di dalam rentang (Satiadarma, dkk., 2004).