PENGARUH KOMBINASI PROSES TERMAL DAN AGITASI
MEKANIK TERHADAP PRESIPITASI SERTA MORFOLOGI
PARTIKEL CaCO
3DALAM AIR SADAH
SKRIPSI
KHOFIFUL WALIDANI 0806456663
DEPARTEMEN TEKNIK KIMIA FAKULTAS TEKNIK
DEPOK JULI 2012
UNIVERSITAS INDONESIA
PENGARUH KOMBINASI PROSES TERMAL DAN AGITASI
MEKANIK TERHADAP PRESIPITASI SERTA MORFOLOGI
PARTIKEL CaCO
3DALAM AIR SADAH
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknik
KHOFIFUL WALIDANI 0806456663
DEPARTEMEN TEKNIK KIMIA FAKULTAS TEKNIK
DEPOK JULI 2011
HALAMAN PERNYATAAN ORISINALITAS
Skripsi ini adalah hasil karya saya sendiri,
dan semua sumber baik yang dikutip maupun yang dirujuk telah saya nyatakan dengan benar.
Nama : Khofiful Walidani
NPM : 0806456663
Tanda tangan :
HALAMAN PENGESAHAN
Skripsi ini diajukan oleh :
Nama : Khofiful Walidani
NPM : 0806456663
Program Studi : Teknik Kimia
Judul Skripsi : Pengaruh Kombinasi Proses Termal dan Agitasi Mekanik terhadap Presipitasi serta Morfologi Partikel CaCO3 dalam Air Sadah
DEWAN PENGUJI
Pembimbing : Dr. Ir. Nelson Saksono, M.T. ( )
Penguji : Dr. Ing. Donni Adinata, ST. M.Eng., Sc. ( )
Penguji : Eva Fathul Karamah, ST. MT. ( )
Penguji : M. Ibadurrohman, ST.,MT.,MSc. Eng ( )
Ditetapkan di : Depok Tanggal : 2 Juli 2012
KATA PENGANTAR/UCAPAN TERIMA KASIH
Puji syukur penulis panjatkan kepada Tuhan Yang Maha Esa, karena atas berkat dan rahmat-Nya, penulis dapat menyelesaikan skripsi ini yang berjudul “Pengaruh Kombinasi Proses Termal dan Agitasi Mekanik terhadap Presipitasi serta Moerfologi Partikel CaCO3 pada Air Sadah”. Penulis menyadari bahwa, tanpa bantuan dan bimbingan dari berbagai pihak, dari masa perkuliahan sampai pada penyusunan skripsi ini, sangatlah sulit bagi penulis untuk menyelesaikannya. Oleh karena itu, penulis mengucapkan terima kasih kepada:
1. Prof. Dr. Ir. Widodo Wahyu Purwanto, DEA selaku Kepala Departemen Teknik Kimia Fakultas Teknik Universitas Indonesia;
2. Dr. Ir. Nelson Saksono, M.T. selaku dosen pembimbing yang telah menyediakan waktu, tenaga, dan pikiran untuk mengarahkan penulis dalam penyusunan seminar ini;
3. Orang tua dan keluarga penulis atas bantuan dukungan material dan moral, kesabaran serta pengertiannya;
4. Wilda Nur Puspita, angkatan 2007, yang pernah melakukan penelitian terkait agitasi mekanik dan bersedia membagi wawasan dan pengalamannya;
5. Puti Parameswari, Karsiyati, Deshinta A., Nadhila A., Rahma Muthia, Nindya S., Ade S. R. dan Fatimatuz Zahroh selaku teman penulis yang saling membantu dan menyemangati dalam masa-masa pembuatan skripsi;
6. Fakhrian A., Taher B., Victor, dan Adi B. selaku teman satu bimbingan Pak Nelson, walaupun berbeda topik namun tetap saling memberikan semangat; 7. Teman-teman angkatan 2008 yang banyak memberikan semangat dan bantuan
kepada penulis dalam menyelesaikan seminar ini;
8. Pihak-pihak lain yang tidak dapat disebutkan satu-persatu oleh penulis. Terima kasih atas segala bantuan, dorongan semangat, dan dukungannya
Akhir kata, penulis berharap Tuhan Yang Maha Esa berkenan membalas segala kebaikan semua pihak yang telah membantu. Semoga seminar ini membawa manfaat bagi pengembangan ilmu ke depannya.
Depok, 21 Juni 2012
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI TUGAS AKHIR UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademik Universitas Indonesia, saya yang bertanda tangan di bawah ini:
Nama : Khofiful Walidani NPM : 0806456663 Program Studi : Teknik Kimia Departemen : Teknik Kimia Fakultas : Teknik Jenis karya : Skripsi
demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Indonesia Hak Bebas Royalti Noneksklusif (Non-exclusive Royalty-Free Right) atas karya ilmiah saya yang berjudul :
Pengaruh Kombinasi Proses Termal dan Agitasi Mekanik terhadap Presipitasi serta Morfologi Partikel CaCO3 dalam Air Sadah
beserta perangkat yang ada (jika diperlukan). Dengan Hak Bebas Royalti Noneksklusif ini Universitas Indonesia berhak menyimpan, mengalih media/ format-kan, mengelola dalam bentuk pangkalan data (database), merawat, dan memublikasikan tugas akhir saya selama tetap mencantumkan nama saya sebagai penulis/pencipta dan sebagai pemilik Hak Cipta.
Demikian pernyataan ini saya buat dengan sebenarnya.
Dibuat di : Depok Pada tanggal : 21 Juni 2012
Yang menyatakan
ABSTRAK Nama : Khofiful Walidani
Program Studi : Teknik Kimia
Judul : Pengaruh Kombinasi Proses Termal dan Agitasi Mekanik terhadap Presipitasi serta Morfologi Partikel CaCO3 dalam Air Sadah
Penelitian ini berusaha menjawab seberapa signifikan pengaruh kombinasi proses termal dan agitasi mekanik dalam menurunkan kesadahan air. Kombinasi proses tersebut dilihat pengaruhnya terhadap proses presipitasi CaCO3 pada air sadah sintetis melalui penurunan kandungan ion Ca2+ dalam larutan dan dinyatakan dalam persen presipitasi CaCO3. Hasil penelitian menunjukkan bahwa persen presipitasi CaCO3 meningkat seiring dengan penambahan kecepatan putar dan suhu larutan. Kombinasi kedua proses mampu mendorong presipitasi CaCO3 hingga mencapai 41% dengan kecepatan putar agitasi 1500 rpm pada suhu 50C. Disamping itu, kenaikan konduktivitas larutan NaHCO3 setelah diberi perlakuan, memperkuat dugaan bahwa kedua proses mampu memperlemah hidrat ion dan
cluster air dalam larutan sehingga mampu mendorong presipitasi CaCO3. Kata kunci :
ABSTRACT
Name : Khofiful Walidani Study Program : Chemical Engineering
Title : The Effect of Combination between Thermal and Mechanical Agitation Processes to the Precipitation and Morphology of CaCO3 in Hardwater
This research trying to answer how significant the effect of combination between thermal and mechanical agitation in softening the hard water is. The influence of this method to the precipitation of CaCO3 was observed by measuring Ca2+ ions in the solution of synthetic hard water. The result of this research shows that the percentage of CaCO3 presipitation increases as rotational speed of agitation and temperature increase. This method could accelerate the CaCO3 precipitation up to 41% when the synthetic hard water was agitated in 1500 rpm, 50C. Besides, the increasing conductivity of NaHCO3 solutions that had been given a treatment could be an indicator that agitation and thermal process weaken the ion hydrate and water cluster.
Key words:
DAFTAR ISI
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PENGESAHAN ... iv
KATA PENGANTAR/UCAPAN TERIMA KASIH ... v
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI ... vi
TUGAS AKHIR UNTUK KEPENTINGAN AKADEMIS ... vi
ABSTRAK ... vii
ABSTRACT ... viii
DAFTAR ISI ... ix
DAFTAR GAMBAR ... xii
DAFTAR TABEL ... xiv
DAFTAR LAMPIRAN ... xv
BAB I. PENDAHULUAN ... 1
1.1. Latar Belakang Masalah... 1
1.2. Rumusan Masalah ... 3
1.3. Tujuan Penelitian ... 3
1.4. Batasan Masalah ... 3
1.5. Sistematika Penulisan ... 3
BAB II. TINJAUAN PUSTAKA ... 5
2.1 Air Sadah ... 5
2.2 Pembentukan Partikel CaCO3 ... 6
2.2.1 Presipitasi CaCO3 di Alam ... 6
2.2.2 Model Presipitasi dan Reaksi Kesetimbangan CaCO3 ... 7
2.2.3 Pengaruh Suhu pada Reaksi Kesetimbangan Pembentukan Partikel CaCO3 ... 10
2.2.4 Pengaruh Hidrodinamika Fluida terhadap Proses Pembentukan CaCO3 ... 11
2.2.5 Mekanisme Presipitasi dan Morfologi Partikel CaCO3 ... 14
2.3 Konduktivitas Larutan Elektrolit ... 15
2.4 Agitasi Mekanik ... 17
2.4.1. Geometri Tangki ... 19
2.4.2. Kebutuhan Daya Pengadukan ... 20
2.5. State of The Art ... 23
BAB III. METODOLOGI PENELITIAN ... 26
3.1. Diagram Alir Penelitian ... 26
3.2. Alat dan Bahan ... 28
3.2.1. Peralatan yang Digunakan ... 28
3.2.2. Instrumentasi Analisis ... 29
3.2.3. Bahan yang Digunakan ... 29
3.3. Prosedur Pembuatan Larutan ... 29
3.3.1. Prosedur Pembuatan Larutan NaHCO3 0,01 M ... 30
3.3.2. Prosedur Pembuatan Larutan CaCl2 0,01 M ... 30
3.3.3. Pembuatan Larutan Standar CaCO3 0,01 M ... 30
3.3.4.Pembuatan Larutan EDTA 0,01 M ... 30
3.3.5. Pembuatan Larutan Indikator Erio Black-T (EBT) 0,5 % ... 31
3.3.6. Pembuatan Larutan Dapar pH 10 ... 31
3.4. Prosedur Pengujian Presipitasi CaCO3 ... 31
3.4.1. Sesaat setelah Pencampuran ... 31
3.4.1.1 Variasi Suhu Larutan ... 32
3.4.1.2. Variasi Kecepatan Agitasi Mekanik ... 32
3.4.1.3. Kombinasi Variasi Suhu dan Kecepatan Putar... 32
3.4.2. Sesaat sebelum Pencampuran ... 33
3.4.2.1. Variasi Suhu Larutan ... 33
3.4.1.4. Variasi Kecepatan Agitasi Mekanik ... 34
3.5. Prosedur Analisis ... 34
3.5.1. Standardisasi Larutan EDTA ... 34
3.5.2. Analisis Larutan Sampel ... 34
3.6. Pengujian Konduktivitas dan pH Larutan NaHCO3 ... 35
3.6.1. Variasi Suhu Larutan ... 35
3.6.3. Kombinasi Variasi Kecepatan Putar Agitasi Mekanik dan Suhu
Larutan ... 35
3.7. Pengujian Efek Memori Pemanasan dan Agitasi Mekanik terhadap Presipitasi CaCO3 ... 36
3.7.1. Pengaruh Suhu Larutan ... 36
3.7.2. Pengaruh Agitasi Mekanik ... 36
3.8. Pengolahan Data ... 37
3.8.1. Standardisasi Larutan EDTA ... 37
3.8.2. Perhitungan Konsentrasi CaCO3 yang Terbentuk dalam ppm ... 37
3.8.3. Menghitung Bilangan Reynolds dan Bilangan Daya ... 38
BAB IV. HASIL DAN PEMBAHASAN ... 40
4.1 Perlakuan setelah Pencampuran Larutan Induk ... 40
4.1.1 Pengaruh Perlakuan Tunggal Proses Termal dan Agitasi Mekanik terhadap Presipitasi CaCO3 ... 41
4.1.2 Pengaruh Kombinasi Proses Termal dan Agitasi Mekanik terhadap Presipitasi CaCO3 ... 47
4.2 Perlakuan sebelum Pencampuran Larutan Induk ... 50
4.2.1 Pengukuran pH dan Konduktivitas Larutan Induk ... 50
4.2.2 Efek Memori Proses Termal dan Agitasi Mekanik ... 54
4.2.3 Pengaruh Kombinasi Proses Termal dan Agitasi Mekanik pada Larutan NaHCO3 terhadap presipitasi CaCO3 ... 57
4.3 Morfologi Kristal CaCO3 ... 58
4.4 Perhitungan Energi Teoritis ... 62
BAB V. KESIMPULAN DAN SARAN ... 64
5.1 Kesimpulan ... 64
5.2 Saran ... 64
DAFTAR REFERENSI ... 66
DAFTAR GAMBAR
Gambar 2. 1 Pembentukan „soap scum‟ dari reaksi antara air sadah dan sabun ... 6
Gambar 2. 2 Efek perubahan pH terhadap Fraksi CO2, HCO3-, dan CO32- dalam larutan karbonat ... 9
Gambar 2. 3 Pengaruh Suhu terhadap Proses Presipitasi CaCO3 pada sampel nonmagnetisasi a)T=27°C; b) T= 50°C (Mubarok, 2007) ... 11
Gambar 2. 4 Interaksi-interaksi yang Terjadi di sekitar Ion (Lyashchenko, 2001) ... 12
Gambar 2. 5 Representasi Skematis Ion yang Terhidrasi dengan Medan Elektrostatis (a) tinggi (b) rendah (Marcus, 1994) ... 12
Gambar 2. 6 Plot (a) log (IAP) dalam larutan dan (b) % abundance dari berbagai kristal polymorf dalam fungsi waktu (Abdel dkk., 2001) ... 15
Gambar 2. 7 Pengaruh suhu dan konsentrasi terhadap konduktivitas Na2SeO3 (1) dan K2TeO3 (2) (Vlaev dkk., 2003) ... 17
Gambar 2. 8 Pola aliran radial... 19
Gambar 2. 9 Dimensi sebuah Tangki Berpengaduk... 19
Gambar 2. 10 Bilangan daya vs bilangan Reynolds ... 22
Gambar 2. 11 State of The Art Penelitian ... 23
Gambar 3. 1. Diagram Alir Penelitian ... 26
Gambar 3. 2 Skema susunan alat penelitian... 27
Gambar 4. 1 Grafik persentase presipitasi CaCO3 terhadap waktu dengan variasi kecepatan putar pengaduk dalam waktu 24 jam (skala Logaritmik) 42 Gambar 4. 2 (a) Grafik persentase presipitasi CaCO3 terhadap waktu dengan variasi suhu dalam waktu 24 jam (skala Logaritmik) ... 45
Gambar 4. 3 (a) Grafik persentase presipitasi CaCO3 terhadap waktu pada suhu 40C dalam waktu 24 jam (skala Logaritmik) ... 47
Gambar 4. 4 (a) Grafik persentase presipitasi CaCO3 terhadap waktu dengan variasi kecepatan putar pada suhu 50C dalam waktu 24 jam (skala Logaritmik) ... 48
Gambar 4. 5 Persen presipitasi CaCO3 dalam fungsi waktu setelah diberi perlakuan dan didiamkan selama 2 jam ... 55
Gambar 4. 6 Konduktivitas Larutan NaHCO3 hingga 3 jam setelah diagitasi ... 56 Gambar 4. 7 Persen Presipitasi CaCO3 pada Berbagai Variasi Perlakuan yang
Diberikan pada Larutan NaHCO3 ... 57 Gambar 4. 8 Hasil SEM Partikel CaCO3 larutan (a) kontrol, (b) agitasi, (c) agitasi
DAFTAR TABEL
Tabel 2. 1 Nilai supersaturasi relatif terhadap kalsit () pada beberapa tingkat
kesadahan dan pH pada suhu 25 oC ... 8
Tabel 2. 2 Data Termodinamika Reaksi Pembentukan CaCO3 ... 10
Tabel 2. 3 Jari-jari ion dan lapisan hidrasi pada beberapa ion ... 13
Tabel 4. 1 Laju Presipitasi CaCO3 yang terbentuk ... 43
Tabel 4. 2 Laju presipitasi larutan dengan kombinasi proses termal dan agitasi mekanik ... 50
Tabel 4. 3 Nilai konduktivitas dan pH Larutan NaHCO3 pada berbagai kondisi . 51 Tabel 4. 4 Daya yang dibutuhkan dalam agitasi larutan pada berbagai kecepatan putar ... 62
DAFTAR LAMPIRAN
Lampiran A. Spesifikasi Alat ... xiv Lampiran B. Data Hasil Penelitian... xvi Lampiran C. Perhitungan Energi Teoritis ... xx
BAB I PENDAHULUAN
1.1. Latar Belakang Masalah
Air merupakan pelarut yang baik sehingga zat pengotor dapat larut dengan mudah di dalamnya. Apabila kandungan mineral dalam air tinggi, maka air itu disebut air sadah. Ion Ca2+ dan Mg2+ adalah dua ion yang paling umum dikaitkan dengan pengukuran kesadahan air. Pemanfaatan air sadah baik dalam skala rumah tangga maupun industri menimbulkan banyak kerugian. Pada skala rumah tangga, pemanfaatan air sadah dapat meningkatkan konsumsi sabun dan deterjen. Sementara itu, dalam skala industri, pemanfaatan air sadah dapat menimbulkan kerak (scale) pada sistem perpipaan sehingga dapat meningkatkan biaya perawatan pipa dan konsumsi energi pada alat penukar panas. Oleh sebab itu, upaya penurunan kesadahan air perlu dilakukan.
Secara kimia, air sadah dapat diatasi dengan menambah inhibitor kerak ke dalam larutan. Akan tetapi, cara ini kurang aman untuk diaplikasikan pada rumah tangga dan industri makanan karena dapat mengakibatkan perubahan sifat kimia larutan. Disamping itu, investasinya yang cukup besar mengakibatkan proses tersebut hanya cocok untuk industri yang memerlukan air olahan dalam jumlah besar (Kozic and Lipus, 2003).
Penurunan kandungan ion Ca2+ dari air yang kadar mineralnya tinggi sebelum masuk ke dalam suatu proses adalah salah satu cara untuk mencegah terbentuknya kerak pada lokasi yang tidak diharapkan (Nishida, 2004). Salah satunya dengan mempercepat proses presipitasi kalsium karbonat (CaCO3), yang merupakan komponen utama pembentuk kerak, menggunakan proses secara fisika. Pada penelitian ini, kombinasi proses termal dan agitasi mekanik digunakan untuk mendorong proses presipitasi CaCO3 sehingga kandungan Ca2+ dalam air sadah dapat berkurang.
Penelitian yang terkait pengaruh ion karbonat dalam proses presipitasi senyawa kalsium fosfat menunjukkan pengadukan larutan dalam waktu lama mengakibatkan terbentuknya kalsium karbonat dalam fasa kristal (Ahmiatri and Soejoko, 2002). Abdel (2002) juga menemukan bahwa 99% ion Ca2+ dan CO3
2-dalam larutan bersupersaturasi tinggi terpresipitasi setelah dilakukan pengadukan. Di lain sisi, proses presipitasi terjadi apabila kondisi supersaturasi tercapai, dimana harga suatu supersaturasi larutan berbanding terbalik dengan solubility product constant atau Ksp larutan tersebut. Pada suatu studi, diketahui bahwa kenaikan temperatur mampu memperkecil Ksp (Brecevic and Nielsen, 1989) sehingga kondisi supersaturasi lebih cepat tercapai. Hal ini menunjukkan bahwa pengadukan, pengaliran, dan panambahan kalor air sadah dapat meningkatkan presipitasi CaCO3.
Pada penelitian ini, campuran larutan NaHCO3 dan CaCl2 digunakan dalam berbagai konsentrasi untuk memperoleh air sadah sintetis. Campuran larutan tersebut kemudian diagitasi dan diberi penambahan kalor selama satu jam lalu kandungan Ca2+ dalam larutan diukur dengan menggunakan metode titrasi kompleksometri EDTA. Perlakuan tunggal berupa agitasi mekanik dan termal secara terpisah juga dilakukan untuk mengetahui pengaruh masing-masing perlakuan terhadap presipitasi CaCO3. Kombinasi kedua proses tersebut diharapkan mampu meningkatkan proses presipitasi CaCO3 sehingga dapat mengurangi kandungan ion Ca2+ dalam air sadah. Berkurangnya kandungan ion Ca2+ sebelum air masuk ke dalam suatu proses akan mencegah pembentukan kerak dalam pipa-pipa aliran air.
Kombinasi kedua proses ini juga diteliti pengaruhnya terhadap morfologi partikel CaCO3 mengingat terdapat tiga jenis morfologi yang bisa dihasilkan partikel CaCO3 dengan sifat yang berbeda. Selain itu, pada penelitian ini juga akan diukur konduktivitas, pH dan presipitasi CaCO3 dari larutan NaHCO3 yang diberi perlakuan sebelum dicampurkan dengan CaCl2 untuk melihat pengaruh proses termal dan agitasi mekanik terhadap mobilitas ion-ion dalam larutan tersebut.
Hasil dari penelitian ini akan menjelaskan seberapa signifikan pengaruh kombinasi proses termal dan agitasi mekanik pada presipitasi CaCO3 sehingga mampu menurunkan kesadahan air. Informasi terkait morfologi partikel CaCO3 akan memberikan keterangan tentang kecenderungan sifat kerak yang akan terbentuk. Metode ini sangat menjajikan dalam mengatasi kesadahan air karena tidak ada penambahan bahan kimia sehingga dapat secara luas diaplikasikan untuk berbagai keperluan air.
1.2. Rumusan Masalah
Rumusan masalah yang akan dijawab dalam penelitian adalah seberapa signifikan kombinasi proses termal dan agitasi mekanik (pengadukan) terhadap proses presipitasi CaCO3 dalam upaya penurunan kesadahan air.
1.3. Tujuan Penelitian
Penelitian ini bertujuan
1. Mengetahui pengaruh kombinasi proses termal dan agitasi mekanik terhadap proses presipitasi CaCO3 dalam upaya penurunan kesadahan air.
2. Mengetahui morfologi partikel CaCO3 yang terbentuk dari larutan yang mengalami kombinasi proses termal dan agitasi mekanik.
1.4. Batasan Masalah
Penelitian ini dibatasi dengan:
1. Air sadah sintetis dibuat dari campuran larutan NaHCO3 dan CaCl2 dengan konsentrasi 0,01 M.
2. Variabel proses yang dilakukan meliputi kecepatan putar agitasi mekanik, dan suhu air sadah sintetis.
3. Agitasi dilakukan dengan agitator tunggal pada suatu vessel/tank yang dilengkapi dengan penyekat
4. Proses pemanasan air sadah dilakukan pada rentang suhu 30°-50°C
5. Perlakuan terhadap larutan induk sebelum pencampuran hanya dilakukan terhadap larutan NaHCO3
1.5. Sistematika Penulisan
Penulisan dalam penulisan penelitian ini dilakukan dengan dengan membagi tulisan menjadi:
BAB I PENDAHULUAN
Meliputi latar belakang penelitian dan penulisan, perumusan masalah yang dibahas, tujuan dilakukannya penelitian, ruang lingkup penelitian, serta sitematika penulisan.
BAB II TINJAUAN PUSTAKA
Berisi tinjauan pustaka yang menjadi dasar penelitian yang meliputi teori-teori tentang air sadah, mekanisme pembentukan partikel CaCO3, reaksi kesetimbangan pembentukan dan morfologi partikel CaCO3, hal-hal yang mempengaruhi hidrasi ion dan pembentukan hidrat ion, seperti konduktivitas dan agitasi mekanik.
BAB III METODE PENELITIAN
Berisi diagram alir penelitian, pembuatan larutan sampel, larutan-larutan standar, pengambilan data penelitian, serta pengolahan data penelitian
BAB II
TINJAUAN PUSTAKA
2.1 Air Sadah
Sesuai dengan praktek di lapangan, kesadahan air didefinisikan sebagai jumlah dari konsentrasi kalsium dan magnesium, keduanya dalam bentuk karbonat, dalam milligram per liter (American Public Health Association dkk., 1998). Ion lain seperti besi (Fe2+) dan mangan (Mn2+) juga berpengaruh pada kesadahan air, tetapi pada umumnya ion-ion selain kalsium dan magnesium tersebut hadir dalam jumlah yang lebih rendah. Tingkat kesadahan air yang terdapat di alam sangat bervariasi sebagaimana pada Tabel 2.1.
Tabel 2. 1 Tingkat kesadahan air berdasarkan kualifikasi Water Quality Association
(Heidekamp, 2005)
Air sadah dengan kandungan ion Ca2+ dan CO3- yang tinggi menyebabkan terbentuknya deposit CaCO3 (Saksono dkk., 2008). Apabila deposit tersebut terbentuk pada suatu permukaan pipa, maka kita kenal sebagai kerak (water scale) yang semakin lama ketebalannya semakin bertambah dan dapat mengganggu aliran fluida dalam pipa. Apabila kerak itu terjadi di permukaan dalam pipa alat penukar panas (disebut fouling), maka kerak tersebut dapat menghambat proses perpindahan panas sehingga terjadi kenaikan konsumsi energi. Pada suatu studi disebutkan bahwa adanya fouling menimbulkan biaya energi naik 1,69 kali dibanding biaya tanpa terjadinya fouling (Salimin and Nuraeni, 2009).
Dalam skala rumah tangga, pemanfaatan air dengan kesadahan tinggi akan membuat sabun kurang berbusa karena ion Ca2+ dan Mg2+ akan membentuk kompleks senyawa („soap scum‟) yang mencegah timbulnya buih sebagaimana
Klasifikasi Kesadahan Kandungan ion Ca
2+ (mg/L or ppm) Soft 0-17 Slightly hard 17-60 Moderately hard 60-120 Hard 120-180 Very hard 180
pada Gambar 2.1. Hal ini dapat meningkatkan konsumsi deterjen dan sabun pada skala rumah tangga. Oleh sebab itu, upaya penurunan kesadahan air sebelum digunakan secara luas, menjadi sangat penting untuk dikaji dan dicari solusinya.
Gambar 2. 1 Pembentukan „soap scum‟ dari reaksi antara air sadah dan sabun
(Hass, 2011)
2.2 Pembentukan Partikel CaCO3
Pembentukan partikel CaCO3 melalui mekanisme presipitasi dipengaruhi oleh beberapa faktor, misalnya supersaturasi larutan dan dinamika fluida. Pada subbab ini akan dijelaskan mekanisme presipitasi di alam, model larutan sebagai pendekatan terhadap presipitasi alami serta beberapa faktor yang mempengaruhi proses presipitasi itu sendiri.
2.2.1 Presipitasi CaCO3 di Alam
Mekanisme presipitasi CaCO3 yang terjadi di alam adalah sebagai berikut :
Karbon dioksida (CO2) yang terlarut dalam air bereaksi dengan H2O membentuk asam karbonat (H2CO3) dalam kesetimbangan. Karbon dioksida yang terlarut merupakan hasil absorbsi dari udara maupun hasil respirasi bakteri dalam tanah.
H2O(l) + CO2(g) H2CO3(aq) (2.1)
Pada pH lingkungan yaitu, 4,5-7,5, H2CO3(aq) akan terurai dan membentuk ion bikarbonat (HCO3-). Ion ini kemudian akan bereaksi dengan ion Ca2+ dalam air sadah membentuk kalsium bikarbonat.
H2CO3(aq) HCO3-(aq) + H+ (2.2)
Ca2+(aq) + 2HCO3-(aq) → Ca(HCO3)2 (2.3)
Ketika air sadah mengalami kenaikan suhu maka tekanan parsial CO2 terlarut lebih besar dibandingkan pada tekanan ambien sehingga
Garam karboksilat yang tidak larut
mengakibatkan terjadinya desorpsi CO2 ke udara. Berpindahnya CO2 terlarut dari larutan Ca(HCO3)2 menjadi fasa gas memicu presipitasi CaCO3 berdasarkan skema reaksi berikut (Hasson dkk., 1996):
Ca2+(aq) + 2HCO3-(aq) CaCO3(s) + CO2(l) + H2O(l) (2.4)
CO2(l) CO2(g) (2.5)
Dari serangkaian mekanisme di atas terlihat bahwa suhu mempengaruhi proses presipitasi CaCO3 karena dapat memicu desorpsi CO2 dari larutan. Hal ini menjelaskan mengapa kerak kerap terbentuk pada permukaan ketel pemasak air atau pipa penukar panas.
2.2.2 Model Presipitasi dan Reaksi Kesetimbangan CaCO3
Pada skala laboratorium, umumnya mekanisme presipitasi CaCO3 di alam dapat didekati dengan tiga model larutan. Pertama, model larutan calco-carbonic
yang diperoleh dengan cara melarutkan CaCO3 bubuk dalam air dan mengalirkan gelembung gas CO2 ke dalamnya. Larutan CaCO3 yang dihasilkan bersifat asam (pH : 5,5 – 6,5) dan akan meningkat mendekati pH iso-elektrik kalsit yaitu sekitar 8,4 seiring dengan meningkatnya kejenuhan larutan CaCO3. Dengan naiknya pH, maka akan terjadi suatu reaksi kesetimbangan pembentukan CaCO3. Reaksi kesetimbangan presipitasi CaCO3 dari model larutan CaCO3 dapat ditulis sebagai berikut (Saksono, 2006) :
Ca2+(aq) + 2HCO3-(aq) ↔ CO2(aq) + CaCO3(s) + H2O(l) (2.6)
2HCO3-(aq) ↔ CO32-(aq) + CO2(aq) + H2O(l) (2.7)
Ca2+(aq) + CO32-(aq) ↔ CaCO3(s) (2.8)
Penyebab utama pembentukan kerak pada berbagai sistem yaitu tercapainya kondisi supersaturasi (Hasson dkk., 1996). Harga supersaturasi () dari larutan merupakan fungsi dari konsentrasi ion Ca2+ dan CO32- serta hasil kali kelarutan (Ksp) di larutan sebagaimana berikut :
= Ca2+ CO32−
Harga supersaturasi tersebut () merupakan fungsi konsentrasi CaCO3 dan pH larutan seperti yang diberikan pada Tabel 2.1. Tercapainya kondisi supersaturasi dalam suatu larutan belum menjamin terjadinya presipitasi CaCO3. Proses pembentukan inti (nuklei) CaCO3 secara spontan akan terjadi di larutan (homogenuos nucleation) apabila supersaturasi larutan tersebut berada di atas nilai supersaturasi kritisnya (c). Presipitasi dalam larutan membutuhkan harga
supersaturasi c = 40 dan di permukaan (deposit) c = 20. Pada suatu studi (Fathi
dkk., 2006) dikemukakan bahwa pada larutan dengan kesadahan 400 ppm dan pH awal 7, supersaturasi kritis baru dicapai ketika pH naik mencapai 8,5.
Tabel 2. 1 Nilai supersaturasi relatif terhadap kalsit () pada beberapa tingkat kesadahan dan pH pada suhu 25 oC
(Fathi dkk., 2006),telah diolah kembali
Model larutan CaCO3 banyak digunakan oleh para peneliti karena sifat larutannya yang lebih mirip dengan air sadah sesungguhnya (Gabrielli et al, 2001; Fathi et al, 2006; Saksono et al, 2007). Namun, proses presipitasi CaCO3 pada model larutan ini berjalan sangat lambat karena terjadi pada supersaturasi rendah (pH 6 – 8) sebagai mana penjelasan di atas.
Kedua, model larutan CaCO3 dapat diperoleh dengan mencampurkan larutan Na2CO3 dan larutan CaCl2 dengan konsentrasi tertentu. Reaksi yang terjadi adalah sebagai berikut:
Na2CO3(aq) ↔ 2Na+(aq) + CO32-(aq) (2.10)
CaCl2(aq) ↔ Ca2+(aq) + 2Cl-(aq) (2.11)
Ca2+(aq) +CO32-(aq) ↔ CaCO3(s) (2.12)
Kesadahan (ppm CaCO3) Supersaturasi () pH 5,7 pH 6,0 pH 7,0 pH 7,5 300 0,05 0,18 1,32 6,1 400 0,15 0,32 3,2 10,11 500 0,23 0,47 4,72 14,93
Proses pembentukan CaCO3 dengan model larutan ini berjalan cepat karena harga supersaturasi () yang jauh lebih tinggi dibanding model larutan CaCO3. Larutan yang dihasilkan bersifat basa (pH 10 – 11) dan akan menurun mendekati pH iso-elektrik sekitar 8,4 seiring dengan meningkatnya jumlah CaCO3 yang terbentuk (Saksono, 2008). Pada rentang pH tersebut, fraksi yang mendominasi larutan pada saat pH berkisar 10-11 adalah fraksi CO32- sebagaimana ditunjukkan gambar 2.2. Di samping itu, Tabel 2.2 memperlihatkan data termodinamik CaCO3 dimana reaksi pembentukan CaCO3 yang berasal dari Ca2+ dan CO32- jauh lebih spontan (Go = -11,38 kcal/mol) dibanding yang berasal dari Ca2+ dan HCO3- (Go = -5,98 kcal/mol). Kedua hal inilah yang menyebabkan presipitasi pada model larutan kedua berlangsung sangat cepat.
Gambar 2. 2 Efek perubahan pH terhadap Fraksi CO2, HCO3-, dan CO32- dalam larutan karbonat (Kemmer, 1998)
Model larutan CaCO3 ketiga diperoleh dengan mencampurkan larutan NaHCO3 dan larutan CaCl2 dengan konsentrasi tertentu. Larutan NaHCO3 memiliki pH sebesar 8,8. Fraksi HCO3- pada larutan sebesar 95% dan CO32- 5% untuk nilai pH 8,8 (Kemmer, 1998). Berdasarkan Gambar 2.2 di atas, pada harga pH tersebut ion yang ada dalam larutan didominasi oleh HCO3- bukan CO32-. Dominasi HCO3- menyebabkan presipitasi CaCO3 berasal dari Ca2+ dan HCO3 -dimana secara termodinamik, sesuai Tabel 2.2, proses presipitasi akan berlangsung relatif lebih lambat jika dibandingkan dengan model kedua. Hal inilah yang mendasari pemilihan model ketiga dalam penelitian ini. Lambatnya
proses presipitasi model ketiga membuat proses presipitasi dapat diamati dan lebih mendekati proses pembentukan kerak yang sesungguhnya terjadi di alam. Jadi, pemilihan model ini untuk memperjelas pengaruh proses termal dan agitasi mekanik terhadap presipitasi CaCO3.
Tabel 2. 2 Data Termodinamika Reaksi Pembentukan CaCO3
(Saksono, 2008)
2.2.3 Pengaruh Suhu pada Reaksi Kesetimbangan Pembentukan Partikel CaCO3
Proses presipitasi CaCO3 terjadi dalam suatu reaksi kesetimbangan sebagaimana digambarkan pada reaksi 2.6-2.8 dan mempunyai hubungan erat dengan tingkat kejenuhan (supersaturasi) dari air sadah. Sebagaimana dituliskan sebelumnya, harga supersaturasi () dari larutan merupakan fungsi dari konstanta produk kelarutan (solubility product constant, Ksp), konsentrasi ion Ca2+ dan konsentrasi ion CO32-di larutan (persamaan 2.9).
Ksp sendiri merupakan konstanta kesetimbangan yang menjelaskan suatu reaksi dimana presipitat larut dalam air membentuk ion konstituennya (Snoeyink, 1980). Konstanta kesetimbangan, secara termodinamik, bergantung pada suhu, sehingga proses presipitasi CaCO3 yang merupakan fungsi dari Ksp akan bergantung pada perubahan suhu. Produk kelarutan (Ksp) CaCO3 diketahui bernilai 5,9; 4,0; 2,5; dan 1,5 x 10-7 M2 pada suhu 10, 25, 40 dan 55°C secara berurutan (Brecevic and Nielsen, 1989). Disamping itu, Tabel 2.2 di atas, menunjukkan bahwa reaksi pembentukan CaCO3 bersifat endotermis dimana kenaikan suhu akan meningkatkan jumlah pembentukan CaCO3.
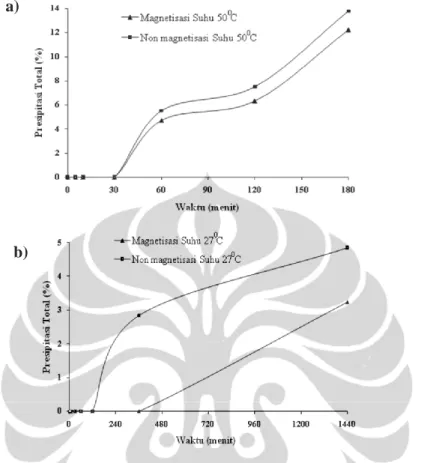
Gambar 2.3 merupakan hasil penelitian yang menunjukkan pengaruh suhu terhadap presipitasi total CaCO3. Pada sampel non-magnetisasi dengan suhu 27°C terlihat bahwa proses presipitasi baru berlangsung di atas 250 menit pertama, sedangkan ketika suhu dinaikkan menjadi 50°C presipitasi mulai terjadi di atas 30 menit pertama. Proses presipitasi terjadi sekitar 220 menit lebih awal pada suhu
Reaksi Kesetimbangan ∆H (kcal/mol)
∆G (kcal/mol)
Ca2+(aq) + 2HCO3-(aq) ↔ CO2(aq) + CaCO3(s) + H2O(l) 4,67 -5,98 2HCO3-(aq) ↔ CO32-(aq) + CO2(aq) + H2O(l) 1,72 5,4
50°C. Hal ini menunjukkan bahwa kenaikan suhu akan mempercepat proses presipitasi.
Gambar 2. 3 Pengaruh Suhu terhadap Proses Presipitasi CaCO3 pada sampel nonmagnetisasi a)T=27°C; b) T= 50°C(Mubarok, 2007)
Fenomena tersebut terjadi dikarenakan keunikan CaCO3, dimana tidak seperti zat lain, kelarutan CaCO3 akan berkurang seiring dengan kenaikan suhu. Secara spesifik variasi suhu 30°-50°C berpengaruh pada kinetika presipitasi dan peningkatan presipitasi homogen (Amor dkk., 2004). Oleh karena itu, dalam percobaan ini digunakan variasi rentang suhu 30°-50°C.
2.2.4 Pengaruh Hidrodinamika Fluida terhadap Proses Pembentukan CaCO3
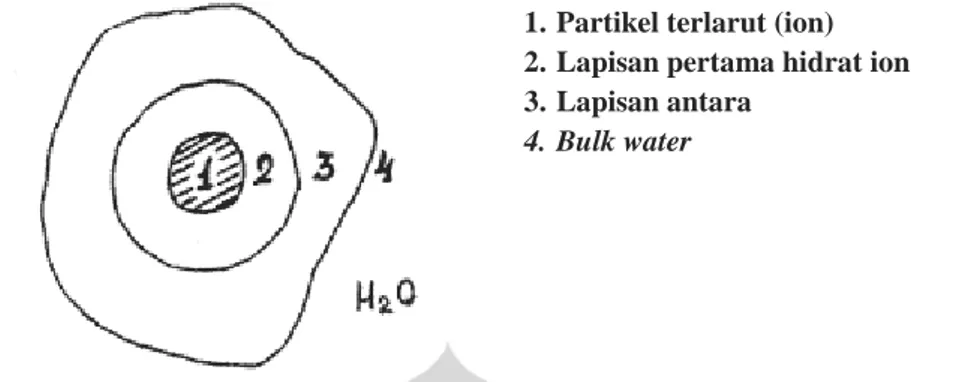
Ketika suatu ion terlarut dalam air, maka ion-ion tersebut akan mengalami hidrasi. Kation dan anion terhidrasi secara berbeda, bergantung pada orientasi molekul air yang berbeda-beda di dalam kulit hidrasi pertamanya (Marcus, 1994). Ion akan dikelilingi oleh lapisan hidrat dimana interaksi yang terjadi adalah interaksi ion dengan dipol H2O, kemudian pada lapisan luar hidrat akan terbentuk pula intermediate layer yang terjadi karena adanya interaksi H2O dari hidrat ion dengan H2O dari bulk water. Sementara itu, pada bulk water air tersusun secara
b) a)
acak. Maka dalam suatu larutan, akan terbentuk lapisan-lapisan yang mengelilingi ion-ion seperti pada Gambar 2.4.
Gambar 2. 4 Interaksi-interaksi yang Terjadi di sekitar Ion (Lyashchenko, 2001)
Begitu pula dengan ion Ca2+ dan CO32- pada air sadah, keduanya dikelilingi oleh molekul air membentuk suatu lapisan hidrasi (hydration shell) yang menahan bergabungnya ion-ion tersebut membentuk molekul CaCO3. Ketebalan lapisan hidrasi pada setiap ion tersebut tidaklah sama karena dipengaruhi oleh jari-jari ion itu sendiri. Gambar 2.5 menunjukkan ilustrasi perbedaan ketebalan lapisan hidrasi pada dua jenis ion dengan jari-jari ion yang berbeda. Pada gambar a terlihat jari-jari ionnya lebih kecil dibandingkan gambar b, tetapi lapisan hidrasi (r) pada gambar a lebih besar dibanding gambar b. Hal ini disebabkan gaya elektrostatik pada ion berbanding terbalik dengan jari-jari ion. Semakin besar jari-jari suatu ion maka semakin kecil gaya elektrostatiknya sehingga semakin lemah kemampuan ion tersebut dalam menarik molekul-molekul air ke arahnya, begitu juga sebaliknya.
a) (b)
Gambar 2. 5 Representasi Skematis Ion yang Terhidrasi dengan Medan Elektrostatis (a) tinggi (b) rendah (Marcus, 1994)
Tabel 2.3 menunjukkan ukuran jari-jari ion beserta keterangan lapisan hidrasinya. Terlihat bahwa setiap ion memiliki perbedaan jari-jari hidrasi dan jumlah molekul air yang mengelilinginya, bergantung dari ukuran ion itu sendiri.
1.Partikel terlarut (ion) 2.Lapisan pertama hidrat ion 3.Lapisan antara
Pada tabel tersebut juga ditunjukkan energi hidrasi dari masing-masing ion (hyd H) yang merepresentasikan entalpi pembentukan hidrat ion. Semakin besar energi hidrasi suatu ion maka semakin kuat interaksi yang terjadi antara ion dan molekul air pada lapisan pertama hidrasi, sehinnga semakin sulit untuk melemahkan interaksi tersebut.
Tabel 2. 3 Jari-jari ion dan lapisan hidrasi pada beberapa ion
Jenis Ion Jari-jari ion (pm) Jari-jari hidrat ion (pm) Jumlah molekul air yang mengelilingi ion hyd H (kJ/mol) Ca2+ 100 171 7,2 1600 Na+ 102 116 3,5 415 CO32- 178 76 4 1395 HCO3- 185 41 2 380 Cl- 181 43 2 365 (Marcus, 1994) Selain adanya lapisan hidrasi, struktur air dalam fasa cairan mengikuti model cluster dimana molekul-molekul air membentuk kelompok (cluster). Model ini mengasumsikan bahwa air terdiri dari distribusi yang kontinu dari berbagai ukuran cluster dimana distribusi cluster yang berukuran sedang akan terurai menjadi ukuran yang lebih kecil lagi seiring dengan naiknya suhu (Li dkk., 2006). Adanya cluster dalam air akan membuat ion sulit bergerak bebas. Cara yang dapat dilakukan agar ion lebih bergerak bebas yaitu dengan memecah cluster
tersebut dalam ukuran yang lebih kecil melalui peningkatan suhu larutan.
Di lain sisi, sifat interaksi ion dengan molekul air relatif lebih kuat dibanding ikatan/interaksi hidrogen antar molekul air, tetapi hidrat ion dapat tergangu oleh adanya pengadukan dan pergerakan larutan. Pada suatu studi dikemukakan bahwa peningkatan kecepatan putar pengaduk dapat meningkatkan laju nukleasi CaCO3 pada suatu model larutan Na2CO3 dan CaCl2 (Abdel dkk., 2002). Tidak hanya itu, larutan serupa yang dialirkan dengan sistem sirkulasi fluida dinamik juga memperlihatkan adanya peningkatan presipitasi CaCO3 (Saksono dkk., 2008). Hal ini dikarenakan, pengadukan dan pengaliran pada sistem sirkulasi fluida dinamik mengganggu hidrat ion dan cluster sehingga dapat
meningkatkan frekuensi tumbukan antara Ca2+ dan CO3-. Oleh sebab itu, proses termal dan agitasi mekanik merupakan cara yang tepat untuk meningkatkan laju presipitasi CaCO3.
2.2.5 Mekanisme Presipitasi dan Morfologi Partikel CaCO3
Pada umumnya, mekanisme prisipitasi melalui tiga tahapan yaitu, nukleasi, pertumbuhan kristal (crystal growth), dan agloromerasi (aggloromeration) (Kemmer, 1998). Nukleasi merupakan tahapan pembentukan nuklei yaitu, partikel kecil atau inti dimana presipitasi spontan dari suatu fasa solid nantinya akan berlangsung. Nukleasi tergolong homogen apabila nuklei terbentuk hanya dalam suatu fasa liquid dan tidak dipengaruhi oleh pengotor. Sedangkan nukleasi digolongkan heterogen apabila nuklei terbentuk di atas suatu penyokong (support) (Amor dkk., 2004). Selanjutnya, setelah terbentuk nuklei maka terbentuk suatu endapan secara perlahan sehingga terbentuk kristal. Kristal-kristal ini kemudian cenderung akan mengelempok menjadi suatu Kristal-kristal yang besar dan selanjutnya masih bisa mengalami pertambahan ukuran. Tahap inilah yang disebut agloromerasi.
Presipitasi CaCO3 sendiri dapat menghasilkan tiga bentuk kristal yang berbeda yaitu kalsit, aragonite, dan vaterit. Secara termodinamis, kalsit merupakan bentuk yang stabil dibanding kedua jenis lainnya (Coelfen, 2003). Jenis kristal aragonit, merupakan kristal metastable pada suhu rendah dan tekanan atmosfer yang nantinya akan bertransformasi dengan perlahan pada 648 K. Sedangkan vaterit merupakan struktur yang relatif tidak stabil dimana apabila terjadi distorsi pada kisi kristalnya maka akan segera bertransformasi menjadi kalsit pada suhu berapapun (Peric dkk., 1996).
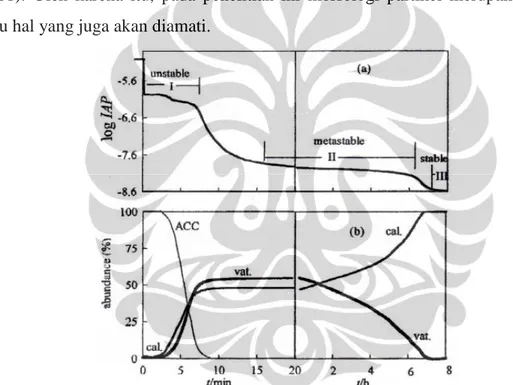
Mekanisme presipitasi CaCO3 telah diteliti oleh Abdel, N., et al (2001) dan menghasilkan kurva log (IAP) dan % abundance versus waktu pada gambar 2.6. Pada kurva tersebut terdapat tiga keadaan yaitu keadaan tidak stabil (I),
metastable (II), dan stabil (III). Pada sesaat setelah pengadukan selesai, 99% ion Ca2+ dan CO32- terpresipitasi menjadi amorphous calcium carbonate (ACC). Tidak seperti ketiga jenis struktur lainnya yang terkategorikan sebagai bimineral, ACC merupakan pengecualian karena ia merupakan bentuk transisi (Coelfen, 2003). Selama presipitasi masih tidak stabil, ACC terpresipitasi menjadi vaterit
dan kalsit. Pada akhir tahap I, log (IAP) menurun menandakan semua ACC terlah berubah menjadi vaterit. Selanjutnya, pada tahap II, veterit secara bertahap berubah menjadi kalsit. Tahap III yang semakin melandai menandakan semua vaterit telah bertransformasi menjadi kalsit.
Dari hasil penelitian tersebut bahwa presipitasi CaCO3 akan membentuk beberapa jenis kristal dengan morfologi berbeda. Jenis kristal yang terbentuk akan memengaruhi jenis kerak yang mingkin nanti terdeposisi pada permukaan. Kalsit biasanya diasosiasikan dengan hardscale sedangkan aragonite dan vaterit merupakan jenis kerak yang lebih lunak yang mudah dihilangkan (Kobe dkk., 2001). Oleh karena itu, pada penelitian ini morfologi partikel merupakan salah satu hal yang juga akan diamati.
Gambar 2. 6 Plot (a) log (IAP) dalam larutan dan (b) % abundance dari berbagai kristal polymorf dalam fungsi waktu (Abdel dkk., 2001)
2.3 Konduktivitas Larutan Elektrolit
Garam-garam seperti NaCl dan KCl membentuk ion-ion positif dan negatif apabila larut dalam air. Dalam pengaruh medan listrik, ion-ion tersebut mengalami pergerakan sehingga terjadi aliran arus. Di lain sisi, ion dalam suatu larutan akan terhidrasi oleh molekul molekul air sehingga terbentuk hidrat ion. Pemberian perlakuan seperti proses termal dan agitasi mekanik akan merubah struktur air dalam suatu larutan elektrolit. Oleh karena itu, dibutuhkan suatu
indikator untuk mengukur pengaruh perlakuan terhadap struktur air pada larutan elektrolit.
Difusi dan konduktivitas suatu larutan elektrolit dalam media aqueous
memiliki keterkaitan yang dekat pada struktur air (Vlaev dkk., 2003). Oleh karena itu, pengukuran konduktivitas dapat dijadikan parameter untuk menggambarkan mobilitas ion-ion hidrat dalam larutan.
Sifat-sifat kelarutan dan perpindahan larutan elektrolit yang dipelajari menggunakan metode konduktivitas bergantung pada jari-jari hidrasi ion dan derajat hidrasi ion (Vlaev and Genieva, 2004). Ukuran jari-jari ion dan jari-jari kulit hidrasi ion dapat dilihat pada Tabel 2.3. Peningkatan konduktivitas untuk beberapa larutan elektrolit dapat disebabkan oleh perubahan ketebalan kulit hidrasi dan perubahan struktur molekul air di kulit hidrasi. Untuk larutan CaCl2, ion Ca2+ memiliki kulit hidrasi paling tebal, sedangkan ion Cl- paling tipis. Hal ini membuat larutan CaCl2 memiliki kulit hidrasi yang tebal sehingga molekul air disekitar ion Ca2+ menjadi teratur.
Pengukuran konduktivitas larutan CaCO3 dalam penelitian ini akan memberikan informasi dan pemahaman yang lebih baik terhadap efek hidrat ion dan presipitasi CaCO3.
2.3.1. Pengaruh Suhu terhadap Konduktivitas Larutan
Seperti yang telah diketahui, bahwa nilai konduktivitas larutan bergantung pada suhu suatu larutan. Hal ini erat kaitannya dengan perubahan struktur fundamental dari air (Vlaev dkk., 2003).
Kenaikan konduktivitas sebagai fungsi perubahan suhu dan konsentrasi pada larutan Na2SeO3 dan K2TeO3 ditunjukkan oleh Gambar 2.7. Apabila suhu
larutan meningkat, maka struktur molekul-molekul air (bulk water cluster) yang besar menjadi tidak stabil dan terputus membentuk struktur yang lebih stabil ditandai dengan menurunnya harga viskositas. Turunnya harga viskositas air menyebabkan mobilitas hidrat ion meningkat yang ditandai dengan naiknya harga konduktivitas. Kenaikan viskositas air bersifat reversibel dan akan segera turun dengan menurunnya suhu larutan (Vlaev and Genieva, 2004). Begitu pula dengan konsentrasi, semakin tinggi konsentrasi larutan maka semakin tinggi pula konduktivitas. Oleh sebab itu, dalam penelitian ini hubungan konduktivitas
sebagai fungsi suhu menarik untuk diamati terkait dengan pengaruhnya terhadap presipitasi CaCO3.
Gambar 2. 7 Pengaruh suhu dan konsentrasi terhadap konduktivitas Na2SeO3 (1) dan K2TeO3 (2) (Vlaev dkk., 2003)
Terkait pengaruh suhu terhadap sifat dan struktur air, diketahui bahwa suhu 45-50°C adalah suhu batas, setelah melewati batasan tersebut maka air akan kehilangan struktur quasicrystalline tetrahedral-nya (Vlaev dkk., 2003). Hal ini merupakan alasan lain yang mendasari variasi suhu dalam penelitian ini adalah 30-50°C.
2.4 Agitasi Mekanik
Agitasi (pengadukan) merupakan sebuah proses yang menunjukkan gerakan yang terinduksi menurut cara tertentu pada suatu bahan di dalam bejana dimana gerakan itu biasanya mempunyai semacam pola sirkulasi. Aplikasi agitasi bisa dilakukan dalam sebuah tangki berpengaduk. Sifat fisik fluida yang berpengaruh pada proses pengadukan adalah densitas dan viskositas. Proses agitasi umumnya bersinergi dengan proses pencampuran (mixing). Pada penelitian ini, terjadi baik proses agitasi maupun pencampuran dalam fasa cair.
Proses pencampuran dalam fasa cair dilandasi oleh mekanisme perpindahan momentum di dalam aliran turbulen. Pada aliran turbulen, pencampuran terjadi pada 3 skala yang berbeda, yaitu:
1. Pencampuran sebagai akibat aliran cairan secara keseluruhan (bulk flow) yang disebut mekanisme konvektif.
2. Pencampuran karena adanya gumpalan-gumpalan fluida yang terbentuk dan tercampakkan di dalam medan aliran yang dikenal sebagai eddies, sehingga mekanisme pencampuran ini disebut eddy diffusion.
3. Pencampuran karena gerak molekular yang merupakan mekanisme pencampuran difusi.
Ketiga mekanisme terjadi secara bersama-sama, tetapi yang paling menentukan adalah eddy diffusion. Mekanisme ini membedakan pencampuran dalam keadaan turbulen daripada pencampuran dalam medan aliran laminar.
Pada umumnya proses pengadukan dan pencampuran dilakukan dengan menempatkan pengaduk pada pusat diameter tangki (center). Posisi ini memiliki pola aliran yang khas. Pada tangki tidak bersekat dengan pengaduk yang berputar di tengah, energi sentrifugal yang bekerja pada fluida meningkatkan ketinggian fluida pada dinding dan memperendah ketinggian fluida pada pusat putaran. Pola ini biasa disebut dengan pusaran (vortex) dengan pusat pada sumbu pengaduk. Pusaran ini akan menjadi semakin besar seiring dengan peningkatan kecepatan putaran yang juga meningkatkan turbulensi dari fluida yang diaduk. Jika pusaran terjadi maka fluida tersebut akan berotasi sebagai massa tunggal dan tidak menghasilkan pencampuran yang berarti. Hal tersebut tentu tidak diinginkan dalam penelitian ini sebab akan mengurangi frekuesi tumbukan ion Ca2+ dan CO32-.
Untuk menghindari terbentuknya pusaran maka ditambahkan sekat pada tangki. Sekat (baffle) adalah lembaran vertikal datar yang ditempelkan pada dinding tangki. Aliran fliuda yang diagitasi dalam tangki bersekat akan terpecah sehingga disamping pusaran dapat dihindari, proses pencampuran yang terjadi akan semakin efektif. Penggunaan sekat mengharuskan posisi pengaduk berada di tengah.
Pemilihan pengaduk yang tepat menjadi salah satu faktor penting untuk menghasilkan proses pengadukan dan pencampuran yang efektif. Pengaduk yang digunakan pada penelitian ini adalah jenis turbin dimana pengaduk ini banyak digunakan pada kecepatan tinggi dan untuk cairan dengan rentang viskositas yang sangat luas. Aplikasi dari konfigurasi tersebut akan menghasilkan pola aliran radial sebagaimana pada Gambar 2.8. Pola aliran radial digunakan pada kondisi
dimana high shear rates dibutuhkan seperti pada proses dispersi. Pada penelitian ini diharapkan proses dispersi berjalan dengan baik sehingga kemungkinan tumbukan ion-ion semakin besar dan proses presipitasi dapat terjadi semakin cepat.
Gambar 2. 8 Pola aliran radial
2.4.1. Geometri Tangki
Kapasitas tangki yang dibutuhkan untuk menampung fluida menjadi salah satu pertimbangan dasar dalam perancangan dimensi tangki. Fuida dengan kapasitas tertentu ditempatkan pada sebuah wadah dengan besarnya diameter tangki sama dengan ketinggian fluida. Rancangan ini ditujukan untuk mengoptimalkan kemampuan pengaduk untuk menggerakkan dan membuat pola aliran fluida yang melingkupi sebuah bagian fluida dalam tangki.
Rancangan dasar dimensi dari sebuah tangki berpengaduk dengan perbandingan terhadap komponen-komponen yang menyusunnya ditunjukkan pada Gambar 2.9.
Gambar 2. 9 Dimensi sebuah Tangki Berpengaduk
Dimana: C = tinggi pengaduk dari dasar tangki D = diameter pengaduk
H = tinggi fluida dalam tangki J = lebar baffle
W = lebar pengaduk
Hubungan dari dimensi pada Gambar 2.9 adalah:
𝐷𝑡 𝐻
=
1 1;
𝐷𝑡 𝐷=
3 1;
𝐶 𝐷=
1 1;
𝑊 𝐷=
1 4;
𝐷𝑡 𝐽=
12 1 (2.13)Geometri dari tangki dirancang untuk menghindari terjadinya dead zone
yaitu daerah di mana fluida tidak bisa digerakkan oleh aliran pengaduk. Geometri di mana terjadinya dead zone biasanya berbentuk sudut ataupun lipatan dari dinding-dindingnya.
2.4.2. Kebutuhan Daya Pengadukan
Hal penting yang turut dipertimbangkan dalam proses pengadukan dan pencampuran adalah kebutuhan daya pengadukan. Idealnya, kita menginginkan kondisi dimana proses pengadukan dan pencampuran berjalan seefektif mungkin dengan sedikit daya yang dibutuhkan. Namun, kenyataannya penggunaan sekat dengan tujuan memperoleh hasil pengadukan dan pencampuran yang lebih baik, dapat meningkatkan daya pengadukan. Oleh sebab itu, perlu dikaji daya yang dibutuhkan dalam proses pengadukan suatu larutan.
2.4.2.1. Parameter Hidrodinamika dalam Tangki Berpengaduk
Kebutuhan daya pengadukan pada proses agitasi mekanik dinyatakan dalam parameter hidrodinamika yang berupa bilangan tak berdimensi. Pada agitasi dengan menggunakan tangki berpenyekat bilangan tak berdimensi yang umum digunakan adalah bilangan Reynold. Bilangan tak berdimensi ini menyatakan perbandingan antara gaya inersia dan gaya viskos yang terjadi pada fluida. Sistem pengadukan yang terjadi bisa diketahui bilangan Reynold-nya dengan menggunakan persamaan 2.14.
Re = ρ.D.(ND )
μ =
ρ.D2.N
μ (2.14)
Dalam sistem pengadukan terdapat 3 jenis bentuk aliran yaitu laminar, transisi dan turbulen. Bentuk aliran laminar terjadi pada bilangan Reynolds hingga
10, sedangkan turbulen terjadi pada bilangan Reynolds lebih besar atau sama dengan sama dengan 104 dan transisi berada di antara keduanya.
2.4.2.2. Daya Pengadukan dan Pencampuran
Pencampuran bisa dikarakterisasi dengan daya kuda, kecepatan dan torsi. Kecepatan ditulis dalam putaran per menit (rpm), karena torsi adalah energi perputaran yang dihasilkan oleh pengaduk dalam inch-pounds atau inch-ounces. Kecepatan, torsi dan daya kuda dihubungkan dengan persamaan di bawah ini
rpm x HP
Torsi 63025 (2.15)
Persamaan 2.15 membantu untuk menjelaskan bagaimana pengaduk dengan kecepatan rendah secara umum menghasilkan kapabilitas torque yang jauh lebih tinggi untuk sebuah horsepower yang diberikan. Diameter dari pengaduk atau dayuh juga berpengaruh terhadap beban torque dalam pencampuran. Daya yang diutuhkan untuk memutar sebuah pengaduk berhubungan dengan diameter dan kecepatan pengaduknya. Persamaannya menjadi :
Daya = rpm3 x Diameter5 (2.16)
Sedikit peningkatan kecepatan putaran dan diameter pengaduk akan menyebabkan sebuah penambahan kebutuhan daya yang besar. Sehingga daya dapat dihitung dengan :
r F. (2.17) . P (2.18)
Dimana “ ” adalah tenaga putaran dan “F” adalah energi dan “r” adalah jarak dari tangkai putaran dan kecepatan angular.
2.4.2.3. Hubungan Daya dengan Hidrodinamika Fluida
Dalam perancangan dari sebuah tangki berpengaduk, salah satu faktor pertimbangan yang penting adalah daya yang dibutuhkan untuk menggerakkan
pengaduk. Karena daya yang dibutuhkan untuk sebuah proses pengadukan dan pencampuran tidak bisa ditebak secara teoritis.
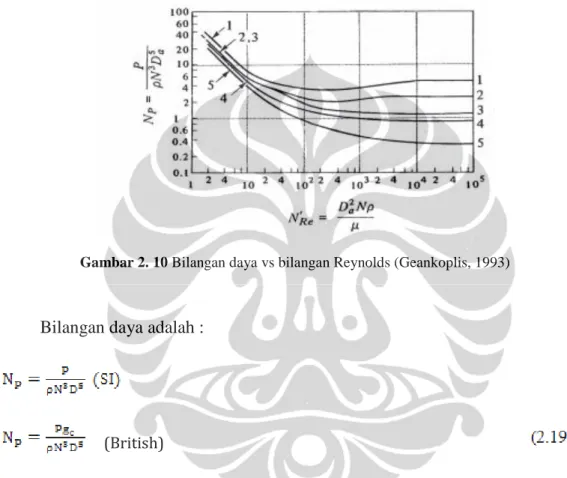
Konsumsi daya adalah hubungan densitas fluida ρ, viskositas fluida μ dan diameter pengaduk Da yang diplot dalam sebuah grafik antara bilangan daya (Np) dibandingkan dengan bilangan Reynold (Nre) seperti Gambar 2.10 di bawah ini.
Gambar 2. 10 Bilangan daya vs bilangan Reynolds (Geankoplis, 1993)
Bilangan daya adalah : NP = P
ρN3D5 (SI)
NP = Pgc
ρN3D5 (English) (2.19)
Sebuah tangki dimana sebuah fluida non-newtonian dengan densitas , dan viskositas µ dan diputar dengan sebuah pengaduk berdiameter D dan pada kecepatan putaran N. Jika diameter tangki adalah T, lebar pengaduk W dan ketinggian cairan H. Kebutuhan daya dari pengaduk (P) menunjukkan jumlah energi yang dibutuhkan pada cairan dan bergantung pada variabel di bawah ini:
N g D T W H
P
P
,
, , , , , , (2.20)Hal ini tidak mungkin untuk mendapatkan hubungan fungsional dalam persamaan di atas, karena geometri yang rumit dari tangki, pengaduk dan variabel lain seperti kawat pemanas. Menggunakan analisis dimensional, jumlah variabel
menggambarkan permasalahannya bisa diminimalisir dan persamaan di atas dikurangi hingga : etc D H D W D T g D N ND f D N P , , , , , 2 2 5 3 (2.21) 5 3 D N P
adalah jumlah daya, PO ;
2
ND
adalah angka Reynolds, Re
2.5. State of The Art
Pemetaan penelitian ini dibandingkan dengan penelitian sebelumnya dapat dilihat pada gambar di bawah ini :
Gambar 2. 11State of The Art Penelitian
Pemetaan di atas diklasifikasikan berdasarkan jenis larutan yang digunakan dan metode fisika yang dilakukan dalam mendorong proses presipitasi CaCO3. Pada pemetaan dan seminar ini sengaja dipilih jurnal di atas tahun 2000 yang dirasa lebih sesuai dan relevan dengan perkembangan studi presipitasi CaCO3.
Chibowski et al (2003) melakukan studi mengenai pengaruh magnetisasi sodium karbonat terhadap presipitasi CaCO3. Pada penelitian tersebut Chibowski et al menggunakan model larutan dari campuran larutan Na2CO3 dan CaCl2 dimana larutan Na2CO3 mengalami magnetisasi terlebih dahulu sebelum dicampurkan dengan larutan CaCl2. Hasil dari penelitian ini menunjukkan bahwa perlakuan terhadap larutan Na2CO3 sebelum pencampuran dapat memperbesar kristal CaCO3 yang terbentuk. Kemudian, dengan model larutan dan metode fisika serupa (magnetisasi), Saksono et al (2006) melakukan penelitian mengenai pengaruh medan magnet terhadap proses presipitasi CaCO3 dalam air sadah. Hasil penelitian ini menunjukkan bahwa proses magnetisasi air sadah mendorong terjadinya penurunan ion Ca2+ akibat adanya peningkatan proses presipitasi CaCO3. Hasil serupa juga didapatkan oleh Mubarok (2007) yang menggunakan magnetisasi pada larutan serupa. Namun, pada penelitian ini pengaruh suhu larutan juga diamati pengaruhnya terhadap presipitasi sebagaimana yang telah dipaparkan pada subbab 2.2.3.
Sementara itu, dengan menggunakan model larutan yang serupa dengan dua penelitian di atas, Abdel et al (2002) dalam penelitiannya mengenai mekanisme adeshi kerak CaCO3 menemukan bahwa terjadi peningkatan presipitasi seiring dengan peningkatan kecepatan putar. Hal ini menunjukkan bahwa proses pengadukan berpengaruh terhadap presipitasi CaCO3. Pada tahun 2008, Saksono et al dengan menggunakan pompa sirkulasi menemukan peningkatan bahwa laju alir larutan dapat meningkatkan presipitasi CaCO3. Dari kedua penelitian tersebut, terlihat bahwa proses agitasi larutan dapat meningkatkan presipitasi CaCO3. Penelitian terbaru mengenai agitasi mekanik secara khusus terhadap masih dilakukan oleh Puspita (2010). Hasil penelitian tersebut belum dipublikasikan karena masih berlangsung hingga tahap pembuatan paper ini.
Amor et al (2004) meneliti pengaruh kesadahan air, suhu, serta bahan dari dinding wadah pada nukleasi heterogen CaCO3. Pada penelitiannya digunakan model calco carbonic dengan melarutkan CaCO3 ke dalam air deionisasi dan diberi gas CO2. Hasil penelitian tersebut menunjukkan bahwa suhu berpengaruh pada kinetika presipitasi dan mampu meningkatkan presipitasi homogen pada rentang suhu 30°-50°C.
Pada penelitian ini, dikombinasikan metode proses termal dan agitasi mekanik agar presipitasi CaCO3 dapat meningkat secara signifikan dibandingkan dengan menggunakan kedua metode secara terpisah. Model larutan sengaja dipilih dari campuran larutan NaHCO3 dan CaCl2 agar proses presipitasi yang berlangsung relatif lambat sehingga mempermudah peneliti dalam mengamati pengaruh treatment yang diberikan terhadap proses presipitasi itu sendiri. Agar agitasi yang dilakukan efektif (memiliki pengaruh yang signifikan terhadap hidrat ion), agitasi dilakukan dari rentang kecepatan 500-1500 rpm pada tangki berpenyekat. Selain itu, suhu larutan berada pada rentang 30°-50°C, mengacu pada penelitian Amor dkk. (2004) yang telah dijelaskan sebelumnya.
BAB III
METODE PENELITIAN
Penelitian ini dilakukan sepenuhnya dengan model eksperimental murni untuk menguji pengaruh proses termal dan agitasi mekanik terhadap proses presipitasi CaCO3 serta menguji pengaruh variasi variabel proses yang meliputi kecepatan putaran pengaduk, dan suhu larutan. Tingkat presipitasi CaCO3 dalam larutan akan diamati dengan mengukur kandungan ion Ca2+ melalui metode analisis titrasi kompleksometri EDTA.
3.1. Diagram Alir Penelitian
Diagram alir secara umum yang dilakukan pada penelitian ini dapat dilihat pada Gambar 3.1
Penelitian ini secara garis besar merupakan modifikasi dari penelitian sebelumnya yang dilakukan Puspita (2011) dimana pada penelitian tersebut pengaruh suhu larutan belum diamati terhadap presipitasi CaCO3. Oleh sebab itu, pada penelitian ini diberikan penambahan variabel suhu larutan. Penelitian dilakukan dengan tahapan umum berikut:
1. Preparasi peralatan seperti skema berikut :
Gambar 3. 2 Skema susunan alat penelitian
2. Preparasi air sadah sintetis dari campuran larutan NaHCO3 dan CaCl2 masing-masing dengan konsentrasi tertentu.
3. Selanjutnya, sampel mengalami perlakuan dengan berbagai variasi meliputi variasi kecepatan putar dan suhu larutan. Pada tiap variasi, sebagian sampel dibiarkan tanpa mengalami perlakuan khusus sehingga presipitasi yang terjadi tidak dipengaruhi oleh apapun (kontrol), dan sebagian sampel lainnya mengalami perlakuan. Khusus pada variasi suhu larutan, sampel dibagi menjadi 3 bagian. Sampel pertama sebagai kontrol, sampel kedua dipanaskan, dan sampel ketiga dipanaskan sembari diagitasi sebagaimana skema pada Gambar 3.2. Data pengamatan dari sampel kedua nantinya akan dibandingkan dengan data yang diperoleh pada variasi kecepatan agitasi sehingga diperoleh perbandingan pengaruh masing-masing proses (termal dan agitasi mekanik) terhadap proses presipitasi CaCO3.
4. Perlakuan serupa juga diberikan pada larutan NaHCO3 sebelum dicampur dengan CaCl2. Hal ini bertujuan untuk mengetahui apakah perlakuan tunggal terhadap larutan induk juga mampu mendorong proses presipitasi. Perlakuan tidak diberikan terhadap CaCl2 karena berdasarkan penelitian Puspita (2011), presipitasi yang dihasilkan dari larutan CaCl2 yang diberi
Water bath T = 30°-50°C Sistem larutan NaHCO3 + CaCl2 RPM Sekat
perlakuan tidak begitu signifikan sehingga dikhawatirkan pengaruh agitasi dan proses termal tidak begitu terlihat. Setelah larutan NaHCO3 diberi perlakuan, larutan tersebut dicampur dengan CaCl2 dan diukur kandungan ion Ca2+.
5. Presipitasi CaCO3. Pada tahap ini proses presipitasi CaCO3 akan diamati secara kuantitatif dengan mengamati kandungan Ca2+ yang dilakukan sebagai fungsi waktu untuk memperoleh waktu presipitasi optimal. Diharapkan terjadi peningkatan presipitasi CaCO3 dengan berbagai variasi variabel yang diberikan.
6. Analisis larutan, baik yang mengalami perlakuan maupun tidak, dengan titrasi kompleksometri EDTA.
7. Preparasi titrasi. Membuat titran berupa larutan EDTA dan menstandardisasi larutan tersebut. Titrasi dilakukan pada tabung diam (statis).
8. Titrasi kompleksometri EDTA. Pada tahap ini 10 ml sampel air sadah yang diambil, baik yang mengalai perlakuan maupun tidak, ditetesi dengan larutan dapar pH 10 sebanyak 2 ml dan 1 tetes indikator EBT. Kemudian, sampel yang berwana merah anggur tersebut dititrasi sampai berubah menjadi biru permanen.
3.2. Alat dan Bahan
Peralatan dan bahan-bahan yang digunakan dalam penelitian ini adalah sebagai berikut:
3.2.1. Peralatan yang Digunakan
Ada dua macam perlatan yang digunakan dalam penelitian ini, yaitu peralatan laboratorium dan agitasi mekanik. Peralatan laboratorium yang digunakan sebagai berikut:
1. Pipet volum 10 dan 20 ml 2. Pipet tetes 3. Beaker glass 250 ml 4. Labu erlenmeyer 100 ml 5. Buret 100 ml 6. Statif 7. Spatula
8. Labu ukur 50 ml dan 1000 ml 9. Kaca arloji 10.Timbangan 11.Stopwatch 12.Power analysis 13.Konduktometer
Alat agitasi mekanik yang digunakan terdiri dari: 1. Wadah agitasi
2. Pengaduk dengan jenis baling-baling
3. Motor pengaduk yang dilengkapi dengan pengaturan kecepatan
3.2.2. Instrumentasi Analisis
Titrasi kompleksometri EDTA untuk mengukur kandungan ion Ca2+ dalam larutan dengan larutan penitrasi EDTA 0,1 M menggunakan mikroburet dengan akurasi 0,02 ml EDTA. Standarisasi larutan EDTA dilaukan dengan larutan standar CaCO3.
3.2.3. Bahan yang Digunakan
Bahan-bahan yang digunakan dalam penelitian ini adalah sebagai berikut: 1. Natrium bikarbonat (NaHCO3) dan kalsium klorida (CaCl2)
2. Air aquades 3. Titriplex III
4. Larutan dapar pH 10
5. Larutan indikator EBT 0,5 % 6. Ammonium klorida 25% 7. Etanol absolut
8. MgCl2.7H2O
3.3. Prosedur Pembuatan Larutan
Prosedur penelitian yang dilakukan terdiri dari preparasi sampel dan analisis sampel. Preparasi sampel terdiri dari pembuatan larutan NaHCO3 dan CaCl2 dengan masing-masing konsentrasi 0,01 M serta pembuatan bahan-bahan lainnya seperti larutan EDTA 0,01 M, indikator EBT 5%, larutan standar CaCO3 0,01 M, dan larutan dapar pH 10.
3.3.1. Prosedur Pembuatan Larutan NaHCO3 0,01 M
1. Menimbang 0,84 gr padatan natrium bikarbonat.
2. Melarutkan padatan menggunakan aquades 60 ml pada beaker glass 250 ml hingga homogen.
3. Memindahkan larutan ke dalam labu erlenmeyer 1000 ml dan melakukan pembilasan dengan aquades.
4. Menambahkan aquades sampai tanda batas.
3.3.2. Prosedur Pembuatan Larutan CaCl2 0,01 M
1. Menimbang 1,11 gr padatan kalsium klorida.
2. Melarutkan padatan menggunakan aquades 60 ml pada beaker glass 250 ml hingga homogen.
3. Memindahkan larutan secara kuantitatif ke dalam labu erlenmeyer 1000 ml dan melakukan pembilasan dengan aquades.
4. Menambahkan aquades sampai tanda batas
3.3.3. Pembuatan Larutan Standar CaCO3 0,01 M
1. Menimbang 0,5 gr CaCO3 murni (yang sudah dioven selama ± 1 jam pada suhu 1050C).
2. Menambahkan HCl pekat tetes demi tetes hingga CaCO3 terlarut sempurna. 3. Menambahkan aquades 100 ml lalu memanaskannya hingga mendidih. 4. Memasukkan ke labu ukur 1000 ml dan mebilas dengan aquades.
5. Menambahkan NaOH 0,1 N untuk menetralkan hingga pH 7-8 dengan menggunakan indikator phenolftalein (perubahan warna: tidak berwarna menjadi merah muda)
6. Menambahkan aquades sampai batas.
3.3.4. Pembuatan Larutan EDTA 0,01 M
1. Menimbang kristal titriplex III (C10H14Na2O8.2H2O) sebanyak 4 gr. 2. Menambahkan aquades hingga homogen.
3. Memindahkan ke labu ukur 1000 ml kemudian menambahkan aquades hingga tanda batas.
3.3.5. Pembuatan Larutan Indikator Erio Black-T (EBT) 0,5 %
1. Menimbang 4,5 gr Hydoxilamin-HCl dan melarutkannya dalam 50 ml etanol absolut
2. Menimbang 0,5 gr Erio Black-T dan melarutkannya dalam 20 ml etanol absolut
3. Mencampurkan kedua larutan dalam labu takar 100 ml kemudian ditera sampai tanda batas.
4. Mengocok hingga larutan homogen.
3.3.6. Pembuatan Larutan Dapar pH 10
1. Menakar 52,7 ml amonia pekat ke dalam gelas ukur 100 ml
2. Menimbang 6,76 g NH4Cl lalu memindahkannya ke dalam gelas beaker 100 ml
3. Menambahkan 52,7 ml amonia pekat ke dalam gelas beaker yang telah berisi 6,76 g NH4Cl (larutan a)
4. Melarutkan 0,4617 g EDTA (tritiplex III) ke dalam 10 ml aquades (larutan b) 5. Melarutkan 0,312 g MgSO4.7H2O ke dalam 10 ml aquades (larutan c)
6. Memasukkan larutan a ke dalam gelas beaker 100 ml kemudian ditambahkan larutan b lalu diaduk hingga homogen
7. Menambahkan larutan c ke dalam larutan yang telah homogen sebelumnya lalu diaduk kembali hingga homogen
8. Menambahkan aquades hingga 100 ml
3.4. Prosedur Pengujian Presipitasi CaCO3
Untuk menguji pengaruh dari variabel operasi suhu larutan, dan kecepatan agitasi mekanik terhadap presipitasi CaCO3 dilakukan prosedur pengujian dengan sebagai berikut.
3.4.1. Sesaat setelah Pencampuran
Pada bagian ini larutan NaHCO3 dicampurkan dengan CaCl2 untuk menghasilkan air sadah sintetis. Selanjutnya, 500 ml larutan segera diberi perlakuan variasi suhu larutan, kecepatan putar agitasi serta kombinasi antara suhu dan kecepatan putar.
3.4.1.1. Variasi Suhu Larutan
1. Mengatur dan mempersiapkan waterbath pada suhu 40°C
2. Mencampurkan 1000 ml larutan natrium bikarbonat (NaHCO3) 0,01 M dengan larutan 1000 ml larutan kalsium klorida (CaCl2) 0,01 M.
3. Menuang 500 ml air sadah sintetis ke dalam gelas beaker 1000 ml
4. Memanaskan 500 ml air sadah sintetis tersebut hingga mencapai suhu 40°C 5. Setelah mencapai suhu 40°C, larutan tersebut dipindahkan ke dalam
waterbath bersuhu 40°C dan dibiarkan selama 1 jam
6. Setelah 1 jam, larutan dikeluarkan dari sistem pemanasan lalu diambil 10 ml dari sampel untuk diukur kandungan ion kalsiumnya. Prosedur yang sama kembali dilakukan untuk setiap waktu presipitasi 1, 2, 6, dan 24 jam pada larutan yang tersisa.
7. Mengulangi prosedur 3-6 yang sama untuk variasi suhu larutan 50°C dan suhu ruang. Khusus larutan kontrol langsung mengikuti prosedur nomor 6.
3.4.1.2. Variasi Kecepatan Agitasi Mekanik
1. Mengatur dan mempersiapkan peralatan agitasi mekanik.
2. Mencampurkan 1000 ml larutan natrium bikarbonat (NaHCO3) 0,01 M dengan larutan 1000 ml larutan kalsium klorida (CaCl2) 0,01 M.
3. Menuang 500 ml air sadah sintetis ke dalam wadah agitasi mekanik 4. Mengagitasi larutan dengan kecepatan putar 500 rpm selama 1 jam
5. Setelah 1 jam, larutan dikeluarkan dari sistem agitasi lalu diambil 10 ml dari sampel untuk diukur kandungan ion kalsiumnya. Prosedur yang sama kembali dilakukan untuk setiap waktu presipitasi 1, 2, 6, dan 24 jam pada larutan yang tersisa.
6. Mengulangi prosedur 3-5 untuk kecepatan putar 1000, dan 1500 rpm. Khusus larutan kontrol langsung mengikuti prosedur nomor 5.
3.4.1.3. Kombinasi Variasi Suhu dan Kecepatan Putar
1. Mengatur dan mempersiapkan peralatan agitasi mekanik dan waterbath pada suhu 40°C.
2. Mencampurkan 1000 ml larutan natrium bikarbonat (NaHCO3) 0,01 M dengan larutan 1000 ml larutan kalsium klorida (CaCl2) 0,01 M.
3. Menuang 500 ml air sadah sintetis ke dalam wadah agitasi mekanik
4. Memanaskan 500 ml air sadah sintetis tersebut hingga mencapai suhu 40°C 5. Setelah mencapai suhu 40°C, larutan tersebut dipindahkan ke dalam
waterbath bersuhu 40°C dan diagitasi dengan kecepatan putar 500 rpm selama 1 jam.
6. Setelah 1 jam, larutan dikeluarkan dari sistem pemanasan dan agitasi lalu diambil 10 ml dari sampel untuk diukur kandungan ion kalsiumnya. Prosedur yang sama kembali dilakukan untuk setiap waktu presipitasi 1, 2, 6, dan 24 jam pada larutan yang tersisa.
7. Mengulangi prosedur 3-5 untuk kecepatan putar 1000, dan 1500 rpm. 8. Mengulangi preosedur 1-7 untuk larutan pada suhu 50°C.
3.4.2. Sesaat sebelum Pencampuran
Pada bagian ini hanya larutan NaHCO3 yang diberi perlakuan berupa variasi suhu, kecepatan putar agitasi, serta kombinasi antara suhu dan kecepatan putar. Tujuan dari bagian ini adalah untuk mengetahui adakah pengaruh agitasi dan proses termal teradap presipitasi CaCO3 apabila hanya salah satu larutan induk yang diberi perlakuan.
3.4.2.1. Variasi Suhu Larutan
1. Mengatur dan mempersiapkan waterbath pada suhu 40°C
2. Membuat 1500 ml larutan NaHCO3 0,01 M dengan larutan 250 ml larutan CaCl2 0,01 M.
3. Menuang 500 ml larutan NaHCO3 ke dalam gelas beaker 1000 ml 4. Memanaskan larutan tersebut hingga mencapai suhu 40°C
5. Setelah mencapai suhu 40°C, larutan tersebut dipindahkan ke dalam waterbath bersuhu 40°C dan dibiarkan selama 1 jam
6. Setelah 1 jam, larutan dikeluarkan dari sistem pemanasan lalu diambil 10 ml dan dicampurkan dengan 10 ml larutan CaCl2 dalam lima tabung reaksi. 7. Mengukur kandungan ion kalsium dalam satu tabung reaksi setelah 30 menit
waktu presipitasi. Prosedur yang sama kembali dilakukan untuk setiap waktu presipitasi 1, 2, 6, dan 24 jam pada tabung reaksi yang tersisa.