4 GENOTIPE TANAMAN
AQUILARIA MICROCARPA
YANG BERINTERAKSI DENGAN
FUSARIUM SOLANI
BERDASARKAN MARKA MIKROSATELIT
4.1 Pendahuluan
Penelitian terdahulu mengenai karakter fenotipe tanaman A.microcarpa, menunjukkan perbedaan antara tanaman bergaharu dan tidak, namun sifat kuantitatif ini umumnya dikendalikan oleh banyak gen dan sangat dipengaruhi lingkungan sehingga perbedaan tersebut terkadang sulit diamati. Penanda fenotipe memiliki keterbatasan karena memerlukan informasi karakter vegetatif dan generatif sehingga umumnya baru dapat teramati setelah tanaman dewasa (Jumari dan Pudjoarianto 2000). Oleh karena itu untuk mendapatkan informasi pembeda antara tanaman bergaharu dan tidak, perlu dilakukan karakterisasi genotik(Finkeldey 2005).
Karakterisasi genotik dapat dilakukan dengan bantuan marka molekuler, karena memiliki tingkat akurasi dan efesiensi yang lebih tinggi. Marka molekuler seringkali dikenal sebagai sidik jari DNA karena mengacu pada pita polimorfisme berdasarkan fragmen DNA. Keunggulan penanda molekuler adalah keakuratan data yang diperoleh dimana tidak dipengaruhi oleh lingkungan, dapat diuji pada semua tingkat perkembangan tanaman, pada pengujian hama dan penyakit tidak tergantung pada organisme pengganggu, penggunaan pada kegiatan seleksi pemuliaan tanaman dapat membantu mempercepat proses seleksi dan lebih hemat pada pengujian selanjutnya dilapangan (Kasim dan Azrai 2004).
Teknologi marka molekuler pada genus Aquilaria berkembang sejalan dengan makin banyaknya pilihan marka DNA, diantaranya penggunaan marka yang berdasarkan pada reaksi rantai polimerase yaitu polymerase chain reaction
(PCR) dengan menggunakan sekuen-sekuen nukleotida sebagai primer, seperti
random amplified polymorphic DNA (RAPD) dilakukan oleh (Lee et al. 2011),
sequence characterized amplified regions (SCARs) (Lee et al. 2011), bahkan Meiling et al. (2012) menemukan 567 pita polimorfik dari 112 accessions A. sinensis dengan menggunakan marka inter-simple sequence repeats (ISSR) dan sequence-related amplified polymorphism (SRAP) dari 11 lokasi.
Marka mikrosatelit merupakan marka genetik yang bersifat kodominan dan memiliki tingkat polimorfisme yang tinggi bahkan dapat diwariskan mengikuti hukum Mendel (Powell et al 1996; Hancock 1999). Eurlings dan Gravendeel (2006), mendesain empat pasang primer mikrosatelit untuk tanaman A. crassna yang memiliki tingkat polimorfisme yang tinggi. Disamping itu Eurlings et al. (2010) mendesain kembali satu primer baru (71PA17) untuk menguji beberapa sampel A. crassna dari beberapa daerah di Asia. Beberapa pertimbangan penggunaan marka mikrosatelit diantaranya; marka terdistribusi secara melimpah dan merata dalam genom, variabilitasnya sangat tinggi dan lokasi genom dapat diketahui, disamping itu marka mikrosatelit merupakan alat bantu yang sangat akurat untuk membedakan genotipe, evaluasi kemurnian benih,
pemetaan dan seleksi genotipe untuk karakter yang diinginkan bagi studi genetik populasi dan analisis diversitas genetik (Powell et al. 1996).
Berdasarkan pertimbangan tersebut maka genotyping tanaman A. microcarpa yang berinteraksi dengan F. solani diharapkan dapat dilakukan
dengan menggunakan marka mikrosatelit guna mendapatkan karakter-karekter molekuler, yang diharapkan dalam membantu kegiatan pemuliaan tanaman A. microcarpa dimasa mendatang.
4.2 Bahan dan Metode
Pengujian F. solani Pada Tingkat Semai A. microcarpa Baill
Untuk mengetahui respon tanaman terhadap F. solani, dilakukan pengujian terhadap 40 tanaman muda (semai) dengan empat strain isolat F. solani yang telah diinokulasikan pada tanaman dewasa di Carita Banten sehingga, masing-masing strain Fusarium diujikan pada 8 tanaman muda. Jenis dan asal strain F. solani masih dalam penelitian pihak Pusat Penelitian dan Pengembangan Konservasi dan Rehabilitasi (Puskonser) Bogor, untuk itu kode strain F. solani pada riset ini berdasarkan kode peneliti yaitu; F. solani FORDA 512, F. solani FORDA 500, F. solani FORDA 509 dan F. solani FORDA 2969.
Pengamatan dilakukan terhadap respon tanaman dari sejak inokulasi sampai gejala awal Nampak, dengan satuan hari setelah inokulasi (hsi). Selanjutnya dilakukan penghitungan keparahan dengan menggunakan kategori serangan atau skala kerusakan menurut Mak et al. (2008), yaitu 0 = tidak ada gejala, 1= tidak ada infeksi, 2= daun sedikit menguning, 3 daun menguning, 4= daun kuning kecoklatan dan 5 = daun gugur, kemudian dihitung dengan rumus keparahan penyakit (disease severity indeks/DSI);
Tingkat keparahan (severity)
Keterangan, n = Jumlah daun dari tiap kategori serangan v = Nilai skala tiap kategori serangan
Z = Nilai skala dari kategori serangan tertinggi N = Jumlah daun yang diamati
Tingkat virulensi setiap isolat ditentukan dengan skor rata-rata dari semua tanaman contoh pada pengamatan terakhir menggunakan kriteria Mak et al. (2008), pada Tabel 4.1.
Tabel 4.1 Kriteria virulensi isolat Fusarium solani pada tanaman muda Aquilaria microcarpa
Skor (v) Tingkat virulensi isolat
0 Tidak virulen
0 < v ≤ 5 Virulensi rendah
5 < v ≤ 10 Virulensi sedang
Ekstraksi DNA
Metode yang digunakan untuk ekstraksi DNA ini adalah metode CTAB (Cetyl Trimethyl Ammonium Bromide) yang telah dimodifikasi (Murray dan Thompson 1980). Sebagian besar metode untuk ekstraksi DNA dari jaringan tanaman yang terdapat dalam literatur, memerlukan waktu yang lama dan bahan kimia yang mahal seperti chesium khlorida sehingga kurang efisien (Brown et al 1993).
Daun segar dipotong dengan ukuran 2 cm X 2 cm, kemudian digerus dengan menambahkan nitrogen cair di dalam pestel/mortar yang bersih. Hasil gerusan kemudian dimasukkan kedalam tabung mikro 2 mL dan ditambahkan larutan penyangga sebanyak 500 – 700 µL. Agar daun hasil gerusan tercampur dengan larutan penyangga dan PVP 2% secara merata maka tabung yang berisi hasil gerusan tersebut di vortex. Setelah itu diinkubasi dalam dalam water bath selama 45 menit – 1 jam sambil dibolak-balik setiap 15 menit. Suhu optimal yang digunakan dalam proses inkubasi berkisar antara 65-700C. Apabila proses inkubasi melebihi suhu optimal maka DNA yang ada dalam tube akan rusak.
Setelah proses inkubasi, tabung mikro tersebut diangkat dan didinginkan selama 15 menit kemudian ditambahkan kloroform sebanyak 500 µL dan fenol sebanyak 10 µL, lalu sentrifugasi pada kecepatan 13.000 rpm selama 2 menit. Supernatan dipisahkan dari endapan sisa-sisa gel dengan menggunakan pipet mikro lalu dipindahkan kedalam tabung mikro baru. Kemudian ditambahkan chloroform dan fenol sebanyak dua kali yang bertujuan untuk menghilangkan pelarut organik yang tersisa dalam larutan.
Supernatan yang telah terpisah dari fase organik, ditambahkan isoproponal dingin sebanyak 500 µL dan NaCl 300 µL. Campuran ini disimpan dalam freezer selama 45 menit – 1 jam. Hasil pengendapan tersebut disentrifus pada kecepatan 13.000 rpm selama 2 menit kemudian cairan dalam tabung mikro dibuang. Hasil pengendapan akan berupa pelet DNA. Pelet DNA ini kemudian ditambahkan etanol 300 µL dan disentrifuge selama 2 menit pada kecepatan 13.000 rpm, kemudian cairan etanol tersebut dibuang. Setelah itu pelet DNA yang tersisa dalam tabung mikro dikeringkan dalam desikator dengan posisi terbalik selama 10 menit lalu ditambahkan larutan TE sebanyak 20 µL divortex kemudian disimpan didalam freezer.
Proses pengeringan pelet DNA dilakukan, disiapkan agarose 1% (0,33 gram agarose dalam 33 mL TAE). Untuk proses elektroforesis, diambil 3 µL DNA ditambahkan 2 µL blue juice 10 X dan kemudian di running pada tegangan 100 volt selama ± 30 menit. DNA akan bergerak kearah positif (anoda). Hasil elektroforesis kemudian direndam dalam larutan etidium Bromide (ETBR) 10 µL per 200 ml aquades selama 3 – 5 menit dan selanjutnya dilihat pada UV transiluminator.
Seleksi Primer
Primer yang digunakan dalam penelitian terdiri atas empat primer spesifik untuk jenis Aquilaria (Eurlings et al. 2010). Primer tersebut diisolasi dan didesain
oleh Eurlings dari jenis A. crassna. Keempat primer tersebut adalah 6pa18, 10pa17, 16pa17, dan 71pa17 seperti disajikan pada Tabel 4.2.
Tabel 4.2 Primer mikrosatelit Aquilaria crasna menurut Eurlings et al. (2010)
Lokuss Sekuens Primer(5’–3’) Repeat Ukuran
basa (bp) Jumlah alel TA (OC) 6pa18 F: TGAGGCGTGAGTGAGATATTGATT R: CCTTCCTCTCTTCTTACCTCACCA (CA)8 180–210 7 50 10pa17 F: ACACACTGTTATGGTCTACAGCTT R: CGCCATCTCATAATATTCTAATGTA (CA)12 152–156 3 50 16pa17 F: AGTGAACAACTTGACTAGGCTTG R: GCTGAACACAACAAGATATCACC (CA)19 143–155 6 59 71pa17 F: AGCAAACAGTGGGATAAGGTC R: AGAAAGGAGGCGAAACGAAT (CA)15 152–224 15 54
Note TA= Annealing Temperature (oC)
PCR (Polymerase Chain Reaction)
Proses PCR membutuhkan 4 komponen utama yaitu H2O, HotStar Mix
dari Promega, primer dan DNA. DNA hasil proses ektraksi sebelum dilakukan proses amplifikasi PCR harus dilakukan pengenceran dengan menggunakan aquabidest. Besarnya perbandingan antara DNA dengan aquabidest tergantung dari tebal dan tipisnya DNA hasil ekstraksi. Untuk proses PCR, DNA 1,5 µl dicampurkan dengan HotStar Mix 7,5 µL, Nuclease-free water 2,5 µL dan primer 1,5 µL) disentrifugasi selama 5-10 detik kemudian dimasukkan kedalam mesin PCR.
Pengujian polimorfisme dilakukan dengan melihat pita hasil PCR yang divisualisasi berdasarkan hasil elektroforesis. Hasil pengujian ini dikatakan polimorfisme jika pola pita yang dihasilkan mempunyai sekurang-kurangnya lebih dari satu variasi, sedang hasil pengujian dikatakan monomorfik jika tidak memperlihatkan adanya variasi pada pola pita hasil elektroforesis.
Analisis data molekuler dilakukan berdasarkan hasil skoring pita DNA yang muncul pada gel poliakrilamid dengan pewarnaan perak, dimana pada masing-masing lokus diasumsikan sebagai alel mikrosatelit. Pita DNA ini diukur panjangnya dengan menggunakan mistar, kemudian hasil pengukuran dimasukkan kedalam persamaan panjang fragmen yang diperoleh dengan software Minitab versi 15. Hal ini dimaksudkan untuk memastikan pita DNA mikrosatelit yang diskoring berada pada posisi yang tepat dan optimasi agar/akrilamid telah benar. Alel mikrosatelit adalah kodominan, maka genotipe ditentukan berdasarkan variasi pita alel yang ada. Jumlah dan frekwensi alel diperoleh dari POPGEN versi 1.32 (Francis dan Yang 2000). Untuk mengetahui penyebaran alel pada setiap individu dari ketiga populasi yang teramati, dilakukan analisis dengan
program Bayesian STRUCTURE versi 2.3
Karakterisasi Genomik Fragmen Mikrosatelit
Hasil amplifikasi PCR dari tanaman A.microcarpa ini, selanjutnya digunakan untuk mengetahui perbedaan pola karakter mikrosatelit antara tanaman yang telah diinokulasi maupun tidak diinokulasi dan juga pada tanaman muda (anakan). Sampel yang disekuens dari tingkat semai adalah sampel A dan C, untuk yang diinokulasi adalah sampel pohon 9 dan 11 sedang yang tidak diinokulasi berasal dari pohon 12 dan 15.
Produk amplifikasi yang diharapkan dalam penelitian ini berkisar antara 158-224 bp. Pada penelitian ini sampel yang akan disekuensing sebanyak 8 buah dengan dua lokus, sehingga untuk masing-masing populasi hanya diujikan pada 2 lokus. Pemilihan sampel yang akan disekuensing berdasarkan frekwensi alel dan tingkat kemiripan band antar populasi.
Kegiatan ini dilakukan untuk mendapatkan gambaran variasi urutan basa DNA yang diperoleh dari hasil perunutan (sekuensing) produk PCR dengan DNA cetakan (template) yang berasal dari genom A.microcarpa dan primer mikrosatelit dari tanaman A.crassna. Proses sekuensing produk PCR menggunakan mesin perunutan otomatis ABI PRISM 377 (Applied Biosystems, Foster City, CA, USA). Kegiatan perunutan (sequencing) nukleotida dilaksanakan di 1st BASE Laboratories Sdn.Bhd., Malaysia. (http://www.base-asia.com/)
Urutan basa yang diperoleh dari hasil sequencing selanjutnya dianalisis dengan program BLASTn (Basic Local Alignment and Search Tool for Nucleotida) (http://blast.ncbi.nlm.nih.gov/Blast.cgi) untuk mengetahui kesesuaian urutan basa atau asam amino yang didapatkan dari suatu gen atau protein dengan urutan lain yang ada dalam bank data gen. Fragmen DNA hasil PCR yang diurutkan dianalisis dengan program BLASTn. Analisis dengan program ini dilakukan untuk mengetahui kesesuaian antara urutan basa yang didapatkan dengan urutan yang terdapat dalam bank data gen. Urutan yang didapatkan diharapkan memiliki tingkat homologi yang tinggi (e-value <10 -4) dengan gen yang sesuai (Claverie dan Notredame 2003).
Analisis hubungan kemiripan susunan urutan nukleotida ditentukan dengan metode aligment (pensejajaran) dengan perangkat lunak ClustalW (EMBL-European Bioinformatics Institute). Jarak genetik digunakan untuk membandingkan setiap individu dari individu lain berdasarkan pensejajaran fragmen mikrosatelit dengan menggunakan perangkat lunak ClustalW dalam situs EBI (http://www.ebi.ac.uk). Hasil Clustalw berupa cladogram atau pohon filogeni selanjutnya dibaca menggunakan perangkat lunak Mega 5.
(http://www.megasoftware.net/)
4.3 Hasil
Karakterisasi Aquilaria microcarpa Berdasarkan Marka Mikrosatelit
Hasil pengujian amplifikasi fragmen DNA dengan menggunakan empat pasang primer mikrosatelit pada populasi A.microcarpa, menunjukkan bahwa hanya dua primer yang mampu mengamplifikasi DNA dengan baik. Adapun deskripsi DNA elektropherogram dari kedua lokus disajikan pada Gambar 4.1.
.
Gambar 4.1 Pola amplifikasi PCR dengan primer 71Pa17 pada tanaman Aquilaria microcarpa anakan (A), tidak diinokulasi (N) dan diinokulasi (i) Dua pasang primer lainnya yakni 10 PA 17 dan 16 PA 17, tidak menghasilkan produk amplifikasi. Eurlings et al. (2010) melakukan pengujian terhadap 12 primer microsatelit pada tanaman A. crassna, 4 primer diantaranya mengamplifikasi sampel dengan pola polimorfik, satu primer teramplifikasi monomorfik dan 7 primer lainnya tidak teramplifikasi. Kegagalan amplifikasi dalam penelitian ini dimungkinkan karena adanya ketidak sesuaian sekuen primer dengan sekuen DNA cetakan, seperti dilaporkan Eurlings et al. (2010) dimana dari beberapa sampel A. crasna untuk lokasi berbeda, pasangan primer yang dirancangnya tidak semua dapat mengamplifikasikan sampel tanaman uji. Primer yang digunakan dalam penelitian ini telah dilaporkan keberhasilannya dalam mengamplifikasi beberapa DNA tanaman penghasil gaharu dari berbagai wilayah (Siburian 2009; Eurlings et al. 2010; Irmayanti 2011). Pasangan primer mikrosatelit 6 PA 18 dan 71 PA 17 yang diuji pada A. microcarpa mampu mengamplifikasi 5 hingga 6 alel. Alel tersebut bersifat polimorfis seperti disajikan pada Tabel 4.3.
Tabel 4.3 Kemampuan amplifikasi Primer mikrosatelit pada Aquilaria microcarpa
Nama Primer Ukuran Fragmen (bp) Kemampuan amplifikasi
Perkiraan Panjang Fragmen (bp) Jumlah alel Keterangan 6 PA 18 10 PA 17 16 PA 17 71 PA 17 180-210 152-156 143-155 152-224 + - - + 184,194,198,202,222 - - 158,166,178,194,198,202,222 5 - - 6 Polimorfik - - Polimorfik
Keterangan: + : teramplifikasi, -: tidak teramplifikasi
Suatu lokus gen dikatakan polimorfik jika sekurang-kurangnya ada dua variasi alel yang berbeda dan frekwensi dari alel yang sering ditemukan kurang dari 95 % (Finkeldey 2005). Ukuran maupun jumlah alel dilakukan menurut Leung et al. (1993) dengan asumsi bahwa semua pita DNA dengan laju migrasi yang sama, digolongkan sebagai lokus yang homolog. Data profil DNA ini kemudian diterjemahkan kedalam data matrik jarak berdasarkan nilai heterosigositas dari populasi yang dibandingkan. Hasil amplifikasi primer
100 bp 200 bp 300 bp A1 A2 A3 A4 N1 N2 N3 N4 I1 I2 I3 I4 M 224 bp 184 bp 210 bp
mikrosatelit ini dapat di gunakan sebagai kandidat marka pada tanaman A. microcarpa.
Panjang fragmen hasil amplifikasi silang dari primer spesifik jenis A.crassna berhasil dilakukan dengan kisaran panjang fragmen (bp) yang diharapkan. Syarat utama terjadinya amplifikasi DNA dengan satu jenis primer adalah apabila primer tersebut mempunyai urutan basa nukleotida yang merupakan komplemen dari kedua untai cetak DNA pada posisi yang berlawanan. Adapun panjang fragmen hasil amplifikasi silang disajikan pada Tabel 4.4.
Tabel 4.4 Panjang fragmen hasil amplifikasi silang pada lokus 6Pa18 dan 71Pa17
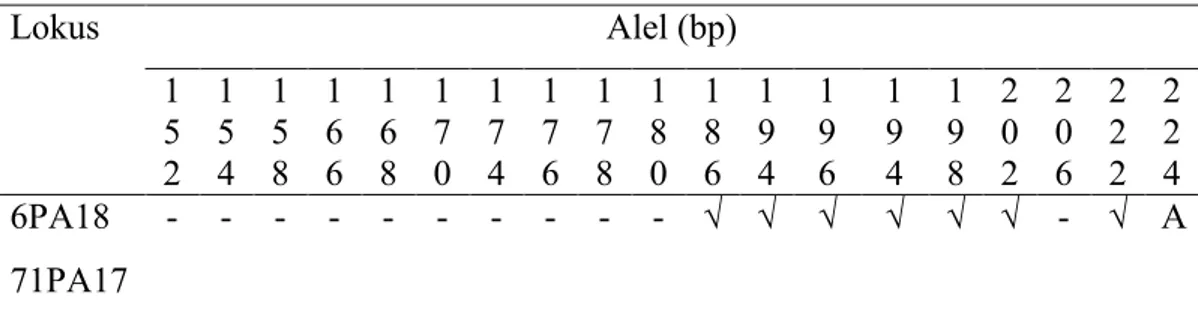
Lokus Alel (bp) 1 5 2 1 5 4 1 5 8 1 6 6 1 6 8 1 7 0 1 7 4 1 7 6 1 7 8 1 8 0 1 8 6 1 9 4 1 9 6 1 9 4 1 9 8 2 0 2 2 0 6 2 2 2 2 2 4 6PA18 - - - √ √ √ √ √ √ - √ A 71PA17 - - A A - - - - √ - - - - √ Keterangan :
- = ada dalam A.crassna (Eurlings et al. 2009), tidak ada dalam penelitian = tidak ada dalam A.crassna (Eurlings et al. 2009), ada dalam penelitian √ = ada dalam A.crassna (Eurlings et al. 2009) dan penelitian
A = Tidak ada dalam A. crassna, hanya pada lokus tertentu dalam penelitian
Berdasarkan Tabel 4.4 penulisan alel didasarkan pada panjang fragmen, misalnya untuk alel dari populasi inokulasi dapat ditulis I158, I196, I198, I202, dan
I222, begitu pula penulisan nama pada populasi lainnya.
Pengujian F. solani Pada Tingkat Semai A. microcarpa Baill
Hasil pengamatan karakter morfologi A. microcarpa yang diinduksi F. solani pada tingkat semai, menunjukkan variasi ketahanan tanaman terhadap jenis F. solani yang diujikan sejak minggu pertama penginokulasian, terutama pada jenis F. solani FORDA 512. Hal ini ditandai dengan adanya perubahan warna daun dari hijau menjadi kuning bahkan mengakibatkan gugur daun, seperti terlihat pada Gambar 4.2 dan Gambar 4.3
Gambar 4.2 Morfologi tanaman setelah 4 hari diinokulasi Fusarium solani FORDA 512
Gambar 4.3 Morfologi daun setelah 8 hari, diinokulasi Fusarium solani FORDA 512
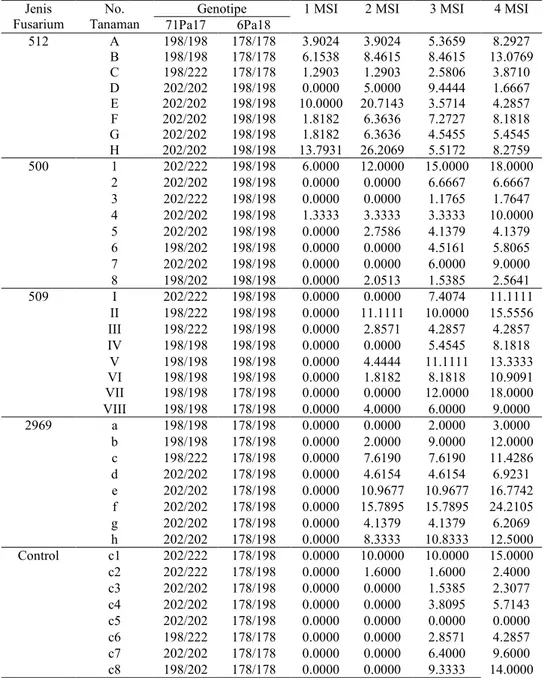
Genotipe setiap semai dan tingkat keparahan inokulasi lima jenis F. solani pada tanaman muda A. microcarpa berdasarkan lokus 6PA18 dan 71Pa17 seperti disajikan dalam Tabel 4.5. Hasil pengukuran panjang fragmen yang terdeteksi, dimana lokus 6PA18 memiliki 10 variasi genotipe yaitu 184/184, 184/198, 198/198, 198/210, 210/210, 198/198, 198/210, 198/222, 210/210, 210/222 sedang untuk lokus 71PA17 memiliki 8 variasi genotipenya diantaranya 158/158, 166/166, 166/178, 178/178, 178/198, 194/195, 194/198 dan 198/198.
Pengujian ketahanan terhadap suatu spesies tanaman, terkadang menyebabkan pergeseran ketahanan. Dalam pengujian interaksi F.solani terhadap tanaman A. microcarpa yang dilakukan di kebun percobaan Carita Banten, untuk kode F. solani FORDA 509 menunjukkan tingkat virulensi yang tinggi dibandingkan dengan kode Fusarium lainnya. Namun berdasarkan nilai rata-rata dan standart deviasi untuk pengamatan pengaruh F. solani pada tanaman muda, terlihat bahwa pada pengamatan minggu pertama dan kedua F. solani FORDA 512 memiliki tingkat virulensi yang tinggi dan berbeda nyata dengan jenis F. solani yang lain, terutama pada genotipe 198/198, 198/222 dan 178/178.
Tabel 4.5 Tingkat keparahan inokulasi lima jenis Fusarium solani pada tanaman muda Aquilaria microcarpa
Jenis Fusarium
No. Tanaman
Genotipe 1 MSI 2 MSI 3 MSI 4 MSI 71Pa17 6Pa18 512 A 198/198 178/178 3.9024 3.9024 5.3659 8.2927 B 198/198 178/178 6.1538 8.4615 8.4615 13.0769 C 198/222 178/178 1.2903 1.2903 2.5806 3.8710 D 202/202 198/198 0.0000 5.0000 9.4444 1.6667 E 202/202 198/198 10.0000 20.7143 3.5714 4.2857 F 202/202 198/198 1.8182 6.3636 7.2727 8.1818 G 202/202 198/198 1.8182 6.3636 4.5455 5.4545 H 202/202 198/198 13.7931 26.2069 5.5172 8.2759 500 1 202/222 198/198 6.0000 12.0000 15.0000 18.0000 2 202/202 198/198 0.0000 0.0000 6.6667 6.6667 3 202/222 198/198 0.0000 0.0000 1.1765 1.7647 4 202/202 198/198 1.3333 3.3333 3.3333 10.0000 5 202/202 198/198 0.0000 2.7586 4.1379 4.1379 6 198/202 198/198 0.0000 0.0000 4.5161 5.8065 7 202/202 198/198 0.0000 0.0000 6.0000 9.0000 8 198/202 198/198 0.0000 2.0513 1.5385 2.5641 509 I 202/222 198/198 0.0000 0.0000 7.4074 11.1111 II 198/222 198/198 0.0000 11.1111 10.0000 15.5556 III 198/222 198/198 0.0000 2.8571 4.2857 4.2857 IV 198/198 198/198 0.0000 0.0000 5.4545 8.1818 V 198/198 198/198 0.0000 4.4444 11.1111 13.3333 VI 198/198 198/198 0.0000 1.8182 8.1818 10.9091 VII 198/198 178/198 0.0000 0.0000 12.0000 18.0000 VIII 198/198 178/198 0.0000 4.0000 6.0000 9.0000 2969 a 198/198 178/198 0.0000 0.0000 2.0000 3.0000 b 198/198 178/198 0.0000 2.0000 9.0000 12.0000 c 198/222 178/198 0.0000 7.6190 7.6190 11.4286 d 202/202 178/198 0.0000 4.6154 4.6154 6.9231 e 202/202 178/198 0.0000 10.9677 10.9677 16.7742 f 202/202 178/198 0.0000 15.7895 15.7895 24.2105 g 202/202 178/198 0.0000 4.1379 4.1379 6.2069 h 202/202 178/198 0.0000 8.3333 10.8333 12.5000 Control c1 202/222 178/198 0.0000 10.0000 10.0000 15.0000 c2 202/222 178/198 0.0000 1.6000 1.6000 2.4000 c3 202/202 178/198 0.0000 0.0000 1.5385 2.3077 c4 202/202 178/198 0.0000 0.0000 3.8095 5.7143 c5 202/202 178/198 0.0000 0.0000 0.0000 0.0000 c6 198/222 178/178 0.0000 0.0000 2.8571 4.2857 c7 202/202 178/178 0.0000 0.0000 6.4000 9.6000 c8 198/202 178/178 0.0000 0.0000 9.3333 14.0000
Keterangan: MSI = Minggu setelah inokulasi
Struktur genetik Aquilaria microcarpa
Frekuensi alel untuk masing-masing lokus dari populasi inokulasi, non inokulasi maupun populasi anakan yang diuji, disajikan pada Gambar 4.5, dan untuk data selengkapnya dapat dilihat pada Lampiran 5. Sembilan alel mikrosatelit terdeteksi pada tiga populasi A. microcarpa, dengan jumlah yang bervariasi dari kedua lokus 6 Pa 18 dan 71 Pa 17. Eurlings et al (2010) mendeteksi 3 hingga 15 alel dari empat lokus polimorfik yang digunakan pada A. crasna.
Gambar 4.5 Distribusi frekuensi alel pada lokus 6PA18 (A) dan 71PA17
Lokus mikrosatelit 71Pa17 mendeteksi alel jarang yakni alel 178 pada populasi anakan (2,5%). Alel disebut jarang apabila frekuensi terdeteksinya <5% dari seluruh genotipe yang dianalisis. Alel-alel intermediate (5%≤frekuensi≤30%) dan alel-alel umum mencapai 41% dari seluruh alel yang diperoleh. Sebagian besar alel-alel jarang juga merupakan alel spesifik, yaitu alel yang dimiliki oleh sebuah genotipe tertentu (Santoso et al 2006).
Alel-alel ini dapat menjadi penciri suatu tanaman (fingerprinting) apabila berkaitan dengan gen-gen penting yang bermanfaat (Santoso et al. 2006). Genotipe-genotipe dengan alel jarang dapat menjadi sumber keragaman genetik baru untuk pemuliaan dan perbaikan genetik, terlebih bila alel-alel tersebut berkaitan dengan karakter penting tanaman ataupun ketahanan terhadap cekaman biotik dan abiotik.
Hasil analisis lanjut terhadap penyebaran alel dari setiap individu pada ketiga populasi yang teramati, dengan menggunakan program analisis Bayesian
STRUCTURE, ∆K menunjukkan K=3 yang berarti populasi A.microcarpa dalam penelitain ini terbagi menjadi tiga grup genetik yang berbeda. Hasil analisis ini juga menunjukkan bahwa proporsi alel berbaur disetiap populasi, sehingga tidak keseluruhan alel dapat digunakan untuk membedakan tanaman bergaharu dengan tidak bergaharu seperti pada Gambar 4.6.
Karakterisasi Genomik Fragmen Mikrosatelit pada A. microcarpa
Hasil amplifikasi PCR menunjukkan bahwa fragmen yang terbentuk sangat pendek yakni kurang lebih 180 bp. Hasil tersebut, selanjutnya disekuens untuk mengetahui perbedaan pola karakter mikrosatelit antara tanaman yang telah diinokulasi maupun tidak diinokulasi juga pada tanaman muda (anakan). Urutan basa yang diperoleh dari hasil sequencing selanjutnya dianalisis dengan program BLAST dan hasilnya dapat dilihat pada Gambar 4.7. Tampilan grafik menunjukkan fragmen DNA yang dianalisis memiliki tingkat homologi yang rendah dengan gen yang terdapat dalam bank gen, hal ini ditunjukkan oleh garis dalam grafik yang hampir semuanya berwarna biru.
.
Gambar 4.7 Analisis BLAST fragmen DNA Aquilaria microcarpa dengan NCBI Hasil sekuen DNA kemudian dialignment ataudisejajarkan dengan tujuan untuk mengetahui tingkat kesamaan dan perbedaan hasil sekuen antara tanaman A.microcarpa yang diamati berdasarkan susunan nukleotida, disajikan pada Gambar 4.8. Berdasarkan hasil pensejajaran sekuen DNA lokus 6Pa18 ditemukan beberapa perbedaan antar sekuen yakni 3 site pada site tunggal (singleton variable sites) diantaranya: 139,141,dan 143. Untuk site informasi Parsimony (two variants) ada 10 site yakni: 26, 125, 126, 130, 134, 136, 137, 140, 158 dan 159 juga 2 site polimorfik informasi Parsimony (three variants): 25 dan 161. Hasil pensejajaran menunjukkan tingkat homologi yang tinggi diantara sampel-sampel yang diteliti, walaupun dijumpai juga beberapa gap (ditandai oleh garis putus-putus). Gap ini menunjukkan proses mutasi, baik berupa insersi maupun delesi.
Pada lokus 6Pa 18, tidak ditemukan pengulangan urutan basa mikrosatelit, walaupun primer ini dapat mengamplifikasi dengan baik pada populasi yang diujikan. Hal ini diduga karena primer mikrosatelit yang digunakan, bukan merupakan primer spesifik tanaman A.microcarpa. Namun populasi anakan 1 yang disekuens menunjukkan susunan basa nukleotida yang hampir sama dengan populasi inokulasi 2, demikian juga dengan populasi anakan 2 memiliki tingkat kesamaan susunan basa nukleotida yang mirip dengan populasi inokulasi 1. Namun demikian susunan basa spesifik antara populasi anakan dan inokulasi pada lokus ini tidak ditemukan.
Anakan_1_6Pa18 TGAGGCGTGATGCTCGATGAAAGGCGCGCACCAAAACCCACAATC--- 45
Inokulasi_2_6Pa18 ...---.TG---..T.--- 17
Non_inokulasi_2_6pa18 ...---.TG---..T.--- 17
Non_inokulasi_1_6pa18 ...---.TGA---..T.--- 18
Anakan_2_6Pa18 ...---.AA---..C.CACAG 22 Inokulasi_1_6Pa18 ...---.AA---..A.--- 17 Anakan_1_6Pa18 ---AAATCAATATCTCTCACTCACCCCAAC--- 72 Inokulasi_2_6Pa18 ---...--- 44 Non_inokulasi_2_6pa18 ---...--- 44 Non_inokulasi_1_6pa18 ---...--- 45
Anakan_2_6Pa18 ATC......CTATCAATGTTTTTGCTAGA 72 Inokulasi_1_6Pa18 ---...CTATCAATGTTTTTGCTAGA 64 Anakan_1_6Pa18 ---TTTCTCAATCTCTCGGGAAACA--- 94 Inokulasi_2_6Pa18 ---TTTCT...T...T.GG.AAA.A--- 66 Non_inokulasi_2_6pa18 ---TTTCT...T...T.GG.CAA.G--- 66 Non_inokulasi_1_6pa18 ---CT...T...T.GG.AAG.A--- 64 Anakan_2_6Pa18 AGAGATTAATTTCATTCATGCTTTGC...A...A.AT.ACA.AGATGGGC 122 Inokulasi_1_6Pa18 AGAGATTAATTTCATTCATGCTTTGC...A...A.AT.ACA.AGATGGGC 114 Anakan_1_6Pa18 ---CGCGAGGAGGCG 106 Inokulasi_2_6Pa18 ---..CG.G--- 72 Non_inokulasi_2_6pa18 ---..CG.CAA---- 74 Non_inokulasi_1_6pa18 ---..CG.CCAC-CG 75 Anakan_2_6Pa18 CATCC..TA.AAAACCG 139 Inokulasi_1_6Pa18 CATCC..TA.AAAACCG 131
Gambar 4.8 Pensejajaran hasil sekuen DNA Aquilaria mikrocarpa lokus 6Pa18. Tanda (.) menunjukkan urutan basa yang sama dengan sampel lain, sedang (-) melambangkan gap.
Pada lokus 71Pa17 ditemukan 18 situs tunggal yang berbeda antara sekuen diantaranya situs 85, 97, 139, 141, 143, 146, 153, 154, 155, 173,176, 178, 180, 187, 189, 191, 192 dan 194 disamping itu ada 6 site informasi Parsimony (two varians)yang berbeda dengan yang lainya yakni site 84, 86, 95, 163, 185, dan 188 sepert disajikan dalam Gambar 4.7. Hal ini dapat digunakan sebagai kandidat penciri tanaman yang memiliki tingkat ketahanan yang sama terhadap Fusarium solani.
Hasil sekuensing DNA A.microcarpa pada lokus 71Pa17 menunjukkan adanya persamaan beberapa nukleotida antara populasi inokulasi dengan populasi anakan. diantaranya pada site 86,88,89, 90 dan 130 seperti pada Gambar 4.9. Hal ini dapat digunakan sebagai penduga kemiripan gen tanaman, antara tanaman yang diinokulasi dengan anakan.
Anakan_2_71pa17 ---AACACAGGGGGAGAA 15 Inokulasi_2_71pa17 --- Inokulasi_1_71pa17 AGTTTGGCAAAGCAAAAATAAAATATATCTCCTCTAGCAAAGAGTGGGAT 50 Anakan_1_71pa17 ---GGGAGAA 7 Non_Inokulasi_1_71pa17 --- Non_inokulasi_2_71pa17 ---
Anakan_2_71pa17 GGTCTCTCTCTCTCTCTCTCTCTCCTGTTTATCTATG TTGCTAG.AG 65
Inokulasi_2_71pa17 ---T.TATG TTGCT.G.AG 19
Inokulasi_1_71pa17 AATGTCTCTCTCTCTCTCTCTCTCCTGTTTAT.TATG T-GCT.G.AG 99
Anakan_1_71pa17 A---TGCACA-.AGTG CTCTC.A.AA 32
Non_Inokulasi_1_71pa17 ---TCTCATG-AG.AAA---C.G.A- 18
Non_inokulasi_2_71pa17 ---TGTGTAG.AAAG---C.G.-- 16
Anakan_2_71pa17 AGATTA-ATTTCATTCATGCTTTGCAGC-ACCCTCACATGACCCAGATGG 113 Inokulasi_2_71pa17 AGATTA-ATTTCATTCATGCTTT--AGC-AAACTCA..T.A.A... 65
Inokulasi_1_71pa17 AGATTA-ATT-CATTCATGCTT---AGCCAAACTCA..T.A.A... 144
Anakan_1_71pa17 CCCCCCCATCTGACACATG-TGAGTAGC-AAACTCA..T.A.A... 80 Non_Inokulasi_1_71pa17 ---TTTCTTTCATGCTTT---GT-CAACTCA..C.C.A... 56 Non_inokulasi_2_71pa17 ---..T.C.A... 30 Anakan_2_71pa17 GGCCATTCCTGAGAAAA-ACAGTGGATTCGTTTCTCCTCCTTTCTC---- 158 Inokulasi_2_71pa17 ..CCA...A....-....T..A.T.G....GCCTC.TT.C.A---- 110 Inokulasi_1_71pa17 ..CCA...G....-....T..A.T.G....TCCTC.TT.C.C---- 189 Anakan_1_71pa17 ..CCA...A....G....T..A.T.G....GCTCT.TC.T.C---- 126 Non_Inokulasi_1_71pa17 ..GGG...G....G....A..G.G.T....TCCCC.CT.C.--ATA 104 Non_inokulasi_2_71pa17 ..CCA...G....-....T..A.T.G....CTCCT.CT.T.CTATA 79 Anakan_2_71pa17 TA---TATA--- 164 Inokulasi_2_71pa17 --- Inokulasi_1_71pa17 TA---TATA--- 195 Anakan_1_71pa17 TACTGTTTATCTATGTTTT-GCTAGA--- 151 Non_Inokulasi_1_71pa17 TACTGTTTATCTATGTTTTTGCTAGAAGAGATTAATTTCATTCATGCTTG 154 Non_inokulasi_2_71pa17 TACTGTTTATCTATGTTTTTGCTAGAAGAGATTAATTTCATTCATGCTTG 129 Anakan_2_71pa17 --- Inokulasi_2_71pa17 --- Inokulasi_1_71pa17 --- Anakan_1_71pa17 --- Non_Inokulasi_1_71pa17 CCAAAC--- 160 Non_inokulasi_2_71pa17 CCAAACTCACAGACACAGAGGGCCTCGAAAGGC 162
Gambar 4.9 Pensejajaran hasil sekuen DNA Aquilaria mikrocarpa lokus 71Pa17 Berdasarkan analisis nukleotida maka tingkat kesaman genetik antara anakan dan inokulasi sangat dekat, dibanding non inokulasi, koefisien kesamaan genetik tersebut tersaji pada Tabel 4.6
Tabel 4.6 Koefisien kesamaan genetik lokus 71Pa17 dan 6Pa18
71Pa17 6Pa18
Anakan1 Anakan2 Inokulasi1 inokulasi2 N.ino1 N.ino2
Anakan1 0.000 0.206 0.147 0.147 0.396 0.167 Anakan2 0.183 0.000 0.015 0.047 0.305 0.064 Inokulasi1 0.184 0.012 0.000 0.031 0.280 0.047 Inokulasi2 0.012 0.183 0.184 0.000 0.328 0.081 N.Ino1 0.038 0.025 0.201 0.025 0.000 0.214 N.ino2 0.051 0.216 0.218 0.038 0.038 0.000
Hubungan kekerabatan berdasarkan urutan basa nukleotida pada sampel tanaman yang diuji menunjukkan hubungan yang sangat erat antara sampel anakan 2 dengan inokulasi 1 pada kedua lokus, seperti terlihat pada Gambar 4.10 dan Gambar 4.11. Untuk sampel non inokulasi terlihat memiliki hubungan yang
agak jauh dengan sampel tanaman inokulasi dan anakan, pada kedua lokus. Hal ini menunjukkan bahwa kedua lokus mampu mengkarakter sampel tanaman yang diuji.
Gambar 4.10 Cladogram tanaman Aquilaria microcarpa berdasarkan lokus 6Pa18
Gambar 4.11 Cladogram tanaman Aquilaria microcarpa berdasarkan lokus 71Pa17
4.4 Pembahasan
Respon tanaman yang teramati pada saat dilakukan inokulasi berupa klorosis daun diduga merupakan respon hipersensitif tanaman untuk membatasi infeksi F. solani yang terjadi karena terganggunya ketersediaan hara akibat adanya pelukaan. Kekurangan hara tersebut menyebabkan daun menjadi kekurangan pigmen klorofil sehingga warna daun berubah kekuningan dan akhirnya gugur (Nieamann dan Visintini 2005).
Patogen yang dapat menginfeksi berbagai tanaman termasuk tanaman penghasil gaharu adalah dari kelompok Acremonium sp dan Fusarium sp. Williams (1997) mengemukakan infeksi cendawan patogen tersebut melibatkan beberapa mekanisme yakni kekuatan mekanik, enzim dan toksin. Semua mekanisme tersebut akan berhadapan dengan sistim pertahanan pasif dan aktif
Anakan_1_6Pa18 Inokulasi_2_6Pa18 Non_inokulasi_1_6pa18 Non_inokulasi_2_6pa18 Anakan_2_6Pa18 Inokulasi_1_6Pa18 0.00 0.02 0.04 0.06 0.08 Anakan_2_71pa17 Inokulasi_1_71pa17 Inokulasi_2_71pa17 Non_inokulasi_2_71pa17 Anakan_1_71pa17 Non_Inokulasi_1_71pa17 0.00 0.05 0.10 0.15
dari tanaman inang. Salah satu pertahanan aktif tanaman adalah dengan menghasilkan senyawa fitoaleksin (Goodman et al. 1986; Harbone 1988).
Pada tanaman A. microcarpa yang diinokulasi dengan F.solani, mekanisme pertahanan terlihat dengan adanya reaksi berupa menguningnya daun hingga menggugurkan daun. Reaksi ini sangat sppesifik terhadap patogen yang berbeda juga tanaman yang berbeda. Pada jenis F. solani FORDA 512, terlihat untuk tanaman A, B dan C, reaksi yang timbul sangat cepat bila dibandingkan dengan jenis inokulasi F. solani maupun tanaman lain. Walaupun pada pengamatan setelah minggu keempat seluruh tanaman tampak kembali normal.
Dixon dan Lamb (1990) mengatakan bahwa pada beberapa sel tanaman, apabila terjadi serangan oleh patogen maka proses tersebut akan dihambat oleh mekanisme pertahanan mekanik (lignin, hydroksiproline, glycoprotein), akan tetapi apabila mekanisme tersebut gagal maka tanaman akan menampakkan gejala nekrosis. Hal ini terjadi karena enzim yang dikeluarkan oleh patogen akan dihalangi oleh gen pertahanan yang akan menghasilkan berbagai ekspresi seperti pembentukan pitoaleksin, antogonis protein ataupun pemindahan siklus metabolisme, bahkan terkadang mekanisme ini dapat terjadi serempak.
Kemajuan dalam pemanfaatan sistem biologi modern tidak terlepas dari prinsip dasar kimia kehidupan. Materi genetik DNA adalah persenyawaan yang terdiri dari gula, fosfat dan basa yang tersusun secara teratur inilah yang menentukan perkembangan dan pertumbuhan suatu organisme dan diturunkan pada generasi berikutnya. Suatu sekuen tertentu dari rantai gula-fosfat-basa ini disebut gen. Gen mengendalikan suatu sifat secara kimiawi melalui kerja enzim-enzim. Melalui teknik tersebut kita dapat melakukan hal-hal seperti menentukan gen-gen dengan fungsi spesifik, mengisolasi gen yang spesifik tersebut, memasukkan gen spesifik yang kita inginkan ke dalam DNA organisme lain dan gen berekspresi memerintahkan sel inangnya untuk membuat bahan sesuai dengan kodenya (Crouch et al. 1998).
Sejumlah daerah DNA mikrosatelit pada suatu individu diduga dapat mengenali ekspresi suatu sifat kuantitatif yang dikendalikan oleh banyak gen (Dolf et al 1993). Mikrosatelit merupakan penanda yang bersifat kodominan sehingga genotipe dapat langsung ditentukan berdasarkan variasi alel (Crouch et al 1998). Kombinasi alel merupakan genotipe untuk setiap lokus. Adanya alel-alel spesifik yang ditemukan diduga menunjukkan sifat fenotipe khas, karena penanda molekuler umumnya berada dekat gen (Muladno 2000). Bila hal ini dihubungkan dengan tingkat resistensi tanaman terhadap inokulasi Fusarium, maka alel spesifik yang dimiliki oleh populasi anakan ini, menunjukkan tingkat kemiripan dengan tanaman diinokulasi (bergaharu).
Hasil sekuen DNA A.microcarpa memberikan informasi akurat melalui pengujian homologi terhadap karakter-karakter fenotipe yang ada. Perbedaan analisis sekuen DNA antara tanaman yang diinokulasi dan yang tidak diinokulasi terlihat berdasarkan perbandingan basa nukleotida yang diuji. Hasil pensejajaran menunjukkan tingkat homologi yang tinggi antara sampel-sampel yang diteliti. Adanya homologi ditunjukkan dengan banyaknya daerah-daerah yang memiliki urutan yang sama (terkonservasi). Pada lokus 6Pa18 maupun 71Pa17 terlihat bahwa urutan basa nukleotida dari anakan 2 dan inokulasi 1 memiliki tingkat homologi yang tinggi, sekalipun dalam pensejajaran ini ada beberapa gap (ditandai oleh garis putus-putus) yakni pada site anakan 2 untuk lokus 6Pa18
terdapat gap pada site 18 hingga site 25. Adanya gap atau perbedaan sekuen ini dapat terjadi karena proses mutasi baik itu berupa substitusi insersi maupun delesi (Gambar 4.8). Terjadinya mutasi dapat disebabkan oleh peristiwa akibat kejadian alam, adaptasi, maupun aktivitas manusia (inokulasi). Sedang untuk lokus 71Pa17, pada kedua sampel ditemukan pengulangan mikrosatelit. Hasil sekuen DNA ini dapat memberikan informasi karakter tanaman dan dapat mendeteksi hubungan kekerabatan yang lebih alami (Chase et al.1993).
Pengulangan sekuen mikrosatelit yang terdeteksi pada tanaman A.microcarpa menunjukkan pengulangan yang berbeda dengan primer mikrosatelit yang berasal dari tanaman A.crasna. Perubahan Perbedaan urutan basa nukleotida ini dimungkinkan karena primer mikrosatelit merupakan penanda spesifik bagi spesies tanaman namun juga mampu mengamplifikasi silang spesies yang berbeda. Adanya pergantian basa nitrogen pada pengulangan mikrosatelit dari CA yang terdapat dalam primer mikrosatelit yang digunakan berubah menjadi CT pada lokus 71Pa17 dimungkinkan karena basa purin pada kondisi tertentu dapat ditransversi menjadi basa pirimidin (Agrios 2004).
4.5 Simpulan
Berdasarkan hasil penelitian ini maka pengujian tanaman A. microcarpa dengan menggunakan beberapa jenis F. solani menunjukkan reaksi yang berbeda antara tiap individu tanaman. F. solani FORDA 512 menunujukkan tingkat virulensi yang tinggi dibandingkan beberapa jenis Fusarium yang diujikan. Pada pengamatan karakterisasi genotipe tanaman, populasi anakan memiliki hubungan kekerabatan secara genetik yang dekat dengan populasi tanaman yang telah diinokulasi, namun diduga kedua populasi ini memiliki sumber genetik yang dekat. Perbedaan pola pita yang dihasilkan dari hasil amplifikasi cetakan DNA dengan primer mikrosatelit menunjukkan adanya perbedaan urutan basa antara fragmen DNA tanaman yang diinokulasi dan tidak diinokulasi.