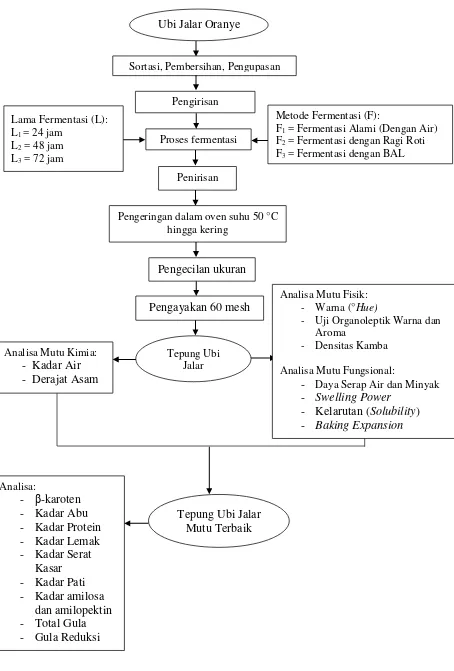
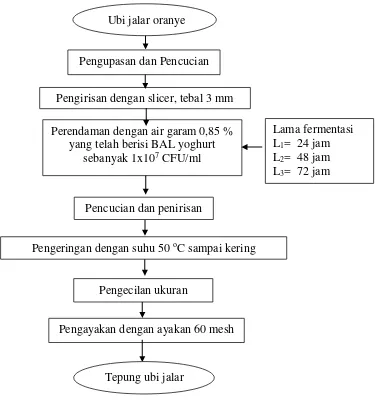
BAHAN DAN METODA
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Februari sampai dengan bulan
Agustus 2016 di Laboratorium Program Studi Ilmu dan Teknologi Pangan
Fakultas Pertanian Universitas Sumatera Utara, Medan. Analisa protein dan
kadar amilosa dilakukan di Laboratorium Balai Besar Penelitian Tanaman Padi,
Subang.
Bahan Penelitian
Bahan penelitian yang digunakan adalah ubi jalar oranye dengan tingkat
kematangan yang optimal dengan ciri ubi jalar berwarna oranye cerah. Bahan lain
adalah air, garam komersil
merk
dolphin
®, ragi roti
merk
saf-instant
®, dan
yoghurt komersil
natural set
merk
biokul
®. Bahan kimia yang digunakan dalam
penelitian ini adalah hexan, H
2SO
4, NaOH, K
2SO
4, HCl, etanol 95%, akuades,
kloroform, KOH, Na
2SO
4, alkohol, DNS (Dinitrosalisilat), CaCO
3, indikator
fenolftalein, ether, asam asetat, CuSO
4, glukosa standar,
β
-karoten murni, amilosa
murni, larutan iod, dan phenol.
Alat penelitian
tabung, pipet skala, labu pisah, cawan porselen, cawan aluminium, kertas
Whatman no. 1, no. 2, dan no. 41, desikator, waterbath, pemanas listrik Maspion,
oven Memmert (tipe BMV 30), kromameter Konica Minolta (tipe CR-400, Jepang),
tanur Carbolite Furnaces (tipe EML 11/2) dan spektrofotometer UV (Genesys 20).
Metode Penelitian
Penelitian ini dilakukan dengan menggunakan rancangan acak lengkap
(RAL), yang terdiri dari dua faktor, yaitu:
Faktor I
: Metode Fermentasi (F)
F
1= Fermentasi Alami (Dengan Air)
F
2= Fermentasi dengan Ragi Roti
F
3= Fermentasi dengan BAL
Faktor II
: Lama Fermentasi (L)
L
1= 24 Jam
L
2= 48 Jam
L
3= 72 Jam
Banyaknya kombinasi perlakuan atau Treatment Combination
(Tc) adalah
3 x 3 = 9 setiap sampel diulang sebanyak 3 kali dengan jumlah sampel seluruhnya
27 sampel.
Model Rancangan
Penelitian ini dilakukan dengan model rancangan acak lengkap (RAL) dua
faktorial dengan model sebagai berikut:
ijk
: Hasil pengamatan dari faktor F pada taraf i dan faktor L pada taraf
ke-j dalam ulangan ke-k
µ
: Efek nilai tengah
α
i: Efek faktor F pada taraf ke-i
β
j: Efek faktor L pada taraf ke-j
(αβ)
ij: Efek interaksi faktor F pada taraf ke-i dan faktor L pada taraf ke-j
ε
ijk: Efek galat dari faktor F pada taraf ke-i dan faktor L pada taraf ke-j dalam
ulangan ke-k
Apabila diperoleh hasil yang berbeda nyata dan sangat nyata maka uji
dilanjutkan dengan uji beda rataan, menggunakan uji
Least Significant Range
(LSR).
Pelaksanaan Penelitian
Pembuatan tepung ubi jalar dilakukan dengan cara memilih ubi jalar oranye
dengan bentuk umbi yang lonjong, kulit umbi berwarna cokelat dan tidak
terkelupas, serta daging umbi berwarna oranye. Ubi jalar oranye yang telah disortir
kemudian dicuci dan dikupas kulitnya, diiris menggunakan slicer dan difermentasi
dalam 3 jenis metode fermentasi yaitu fermentasi alami, fermentasi dengan ragi roti,
dan fermentasi dengan BAL.
Fermentasi Alami
Fermentasi menggunakan Ragi Roti
2 kg chips ubi jalar oranye direndam dalam air sebanyak 6 liter yang telah
ditambahkan ragi roti sebanyak 0,5 % (30 g) dalam baskom putih dan ditutup.
Skema pembuatan tepung ubi jalar oranye dengan metode fermentasi ragi roti dapat
dilihat pada Gambar 3.
Fermentasi menggunakan BAL
BAL yang digunakan dalam fermentasi chips ubi jalar berasal dari yoghurt
komersil (Biokul
natural set
®). Yoghurt yang digunakan mengandung BAL
sebanyak 3,4369 x 10
9CFU/g sehingga untuk menambahkan BAL sebanyak
1 x 10
7CFU/g dalam 6 liter air dilakukan perhitungan sebagai berikut:
1 x 10
7CFU/g =
X
6000 g
X = 6 x 10
10CFU
6 x 10
10CFU = 3,4369 CFU/g x g yoghurt
g yoghurt =
3,4369 x 10
6 x 10
10CFU
9CFU/g
= 17,4575 g
Sehingga yoghurt yang dibutuhkan untuk 6 liter air sebanyak 17,5 g.
2 kg chips ubi jalar oranye direndam dalam 6 liter air garam 0,85 % yang
telah ditambahkan BAL sebanyak 1 x 10
7CFU/g (17,5 g) dalam baskom putih dan
ditutup. Skema pembuatan tepung ubi jalar oranye dengan metode fermentasi
bakteri asam laktat dapat dilihat pada Gambar 4.
diketahui dengan cara mematahkan chips ubi jalar oranye. Pengeringan dilakukan
selama ± 28 jam.
Chips
ubi jalar yang telah kering kemudian dihaluskan
menggunakan
disc mill dan diayak menggunakan ayakan 60 mesh hingga
dihasilkan tepung ubi jalar. Tepung ubi jalar yang dihasilkan dikemas dalam plastik
polietilen sebelum dianalisis. Masing-masing perlakuan dilakukan ulangan
sebanyak 3 kali.
Pengamatan mutu tepung ubi jalar meliputi karakteristik fisik, kimia, dan
fungsional. Karakteristik fisik tepung ubi jalar oranye yang diamati yaitu
pengujian warna (Metode Hunter, Hutchings, 1999), densitas kamba
(Okaka dan Potter, 1977), serta uji organoleptik warna dan aroma (Soekarto, 1985).
Karakteristik kimia tepung ubi jalar oranye yang diamati yaitu kadar air
(AOAC, 1995) dan derajat asam (Dewan Standarisasi Nasional, 1994).
Pengujian sifat fungsional tepung meliputi daya serap air dan minyak
(Sathe dan Salunkhe, 1981),
swelling power (Leach, dkk.,
1959), kelarutan atau
solubility (Anderson, 1982), dan baking expansion (Demiate, dkk., 2000).
Pengamatan dan Metode Pengukuran Data
Masing-masing parameter diberikan bobot variabel (BV) dengan angka
0
–
1. Besar bobot ditentukan berdasarkan tingkat kepentingan parameter. Semakin
tinggi tingkat kepentingan maka semakin tinggi nilai bobot variabel yang diberikan.
Bobot normal (BN) setiap parameter ditentukan dengan cara membagi BV dengan
jumlah semua bobot variabel. Nilai efektivitas (Ne) diperoleh dengan rumus:
Ne =
Nilai Perlakuan (NP) - Nilai Terburuk (NBr)
Nilai Terbaik (NB
k
) - Nilai Teburuk (NBr)
Nilai hasil dari masing-masing parameter ditentukan dari hasil perkalian antara nilai
efektivitas (Ne) dengan bobot normal (BN). Nilai hasil dari tiap parameter
dijumlahkan untuk mengetahui total nilai hasil. Total Nh yang tertinggi
menunjukkan hasil perlakuan terbaik.
Tepung ubi jalar dengan mutu terbaik selanjutnya dianalisis kadar
β
-karoten (Apriyantono,
dkk., 1989), kadar abu (Sudarmadji, dkk., 1997),
kadar protein (metode Kjeldahl, AOAC, 2005), kadar lemak (AOAC, 1995),
kadar serat kasar (AOAC, 1995), kadar pati dengan metode hidrolisis asam
(Apriyantono, dkk., 1989), amilosa dan amilopektin (SNI-6128-2008), gula reduksi
(Apriyantono, dkk., 1989), total gula (Apriyantono, dkk., 1989), derajat
polimerisasi dan dextrose equivalent (Apriyantono, dkk., 1989).
Karakteristik Fisik
Warna (Metode Hunter)
Pengujian warna dilakukan berdasarkan metode Hutchings (1999). Warna
diukur menggunakan alat
chromameter
Minolta (tipe CR 200, Jepang). Sampel
diletakkan pada wadah yang telah tersedia, kemudian ditekan tombol start dan akan
±
100 (putih). Notasi “a”
menyatakan warna kromatik campuran merah-hijau
dengan nilai “+a” (positif) dari
0 sampai + 100 u
ntuk warna merah dan nilai “–a”
(negatif) dari 0 sampai
–
80 untuk warna hijau. Notasi “b” menyatakan warna
kromatik campuran biru-
kuning dengan nilai “+b” (positif) dari
0 sampai
+ 70 untuk warna kuning dan nilai
“–b”
(negatif) dari 0 sampai
–
80 untuk warna
biru sedangkan L menyatakan ketajaman warna. Semakin tinggi ketajaman warna,
semakin tinggi nilai L. Selanjutnya dari nilai a dan b dapat dihitung
oHue dengan
rumus :
o
Hue = tan
-1. Jika hasil yang diperoleh:
18
o–
54
omaka produk berwarna red (R)
54
o–
90
omaka produk berwarna yellow red (YR)
90
o–
126
omaka produk berwarna yellow (Y)
126
o–
162
omaka produk berwarna yellow green (YG)
162
o–
198
omaka produk berwarna green (G)
198
o–
234
omaka produk berwarna blue green (BG)
234
o–
270
omaka produk berwarna blue (B)
270
o–
306
omaka produk berwarna blue purple (BP)
306
o–
342
omaka produk berwarna purple (P)
342
o–
18
omaka produk berwarna red purple (RP)
Densitas kamba
Densitas Kamba (g/ml) =
Volume sampel (ml)
Berat sampel (g)
Uji organoleptik warna dan aroma
Pengujian organoleptik warna dan aroma dilakukan berdasarkan metode
Soekarto (1985). Penilaian organoleptik warna dan aroma tepung ubi jalar
dilakukan dengan cara menyajikan sampel yang telah diberi kode secara acak lalu
diuji oleh 20 panelis. Pengujian dilakukan secara inderawi (organoleptik) yang
ditentukan berdasarkan skala hedonik 1-9 seperti pada Tabel 3. Format uji
organoleptik dapat dilihat pada Lampiran 4.
Tabel 3. Skala hedonik warna dan aroma
Skala hedonik
Keterangan
1
Sangat tidak suka sekali
Karakteristik Kimia
Kadar air
Kadar Air (%) =
Berat sampel awal - berat sampel akhir
Berat sampel awal
x 100%
Derajat asam modifikasi
Pengujian derajat asam dilakukan berdasarkan metode Dewan Standarisasi
Nasional (1994). Sampel ditimbang sebanyak 1 g dimasukkan kedalam labu ukur
100 ml dan ditambahkan alkohol yang telah dinetralkan dengan fenolftalein hingga
batas tera. Sampel selanjutnya ditutup dengan aluminium foil dan dikocok
menggunakan penggosok mekanik selama 1 jam. Setelah itu sampel disaring
dengan menggunakan kertas saring Whatman No. 1, hasil saringan diambil 50 ml
dan diberikan 3 tetes indikator fenolftalein dan dititrasi dengan NaOH 0,05 N.
Derajat asam adalah banyaknya ml NaOH 0,05 N yang diperlukan untuk meniter
1 g contoh, dengan demikian formulanya adalah sebagai berikut.
Derajat Asam
(%) =
100/50 x ml NaOH x N NaOH
Berat Contoh (g)
x 100%
Karakteristik Fungsional
Daya serap air dan minyak
Pengujian daya serap air dan minyak dilakukan berdasarkan metode
Sathe dan Salunkhe (1981). 1 g pati ditempatkan pada tabung sentrifugasi yang
telah diketahui beratnya kemudian ditambahkan 10 ml air atau minyak dan dikocok
hingga homogen. Setelah itu dilakukan sentrifugasi pada 4000 RPM selama
40 menit. Air atau minyak dituang dan ditimbang berat tabung dan pastanya.
DSA/DSM (g/g) =
(
berat akhir - berat tabung)
Berat
bahan kering
-
berat bahan kering
Swelling power
Pengujian
swelling power dilakukan berdasarkan metode Leach, dkk.
(1959). Tepung ubi jalar sebanyak 1 g dimasukkan ke dalam aquadest 10 ml
kemudian dipanaskan dalam waterbath pada suhu 90 °C selama 30 menit. Larutan
disentrifus dengan kecepatan 2200 rpm selama 30 menit sehingga terpisah antara
supernatan dan pasta. Supernatan dan pasta dipisah untuk kemudian diambil pasta
dan ditimbang berat pasta. Swelling power dihitung dengan menggunakan rumus:
Swelling Power (%) =
Berat pasta
Berat sampel kering
x
100%
Kelarutan (
solubility
)
Pengujian
kelarutan
(solubility)
dilakukan
berdasarkan
metode
Anderson (1982). 1 g tepung ubi jalar dimasukkan ke dalam tabung sentrifus dan
ditambahkan 10 ml aquadest, kemudian dikocok hingga tercampur merata.
Campuran dipanaskan dalam waterbath suhu 90 °C selama 30 menit dan disentrifus
dengan kecepatan 2200 rpm selama 30 menit. Supernatan dikumpulkan dan
dimasukkan ke dalam cawan aluminium yang telah diketahui beratnya, kemudian
dikeringkan pada oven suhu 105 °C hingga beratnya konstan. Berat padatan
supernatan kering ditimbang.
Kelarutan air (%) =
Berat padatan supernatan kering
Berat sampel kering
x
100%
Baking expansion
selama 25 menit. Hasil panggangan kemudian didinginkan, ditimbang, kemudian
dilapisi permukaannya dengan pencelupan dalam parafin. Volume hasil
panggangan ditentukan dengan mencelupkan sampel dalam gelas ukur berisi air,
hingga seluruh bagian terendam dan peningkatan volume tercatat.
Baking expansion (ml/g) =
Peningkatan volume
massa hasil panggangan
x
100%
Pengujian Perlakuan Terbaik
β
- karoten modifikasi
Pengujian β
-karoten dilakukan berdasarkan metode Apriyantono, dkk.
(1989). Kurva standar dibuat dengan menimbang dengan teliti
5 mg β
-karoten
murni lalu dimasukkan kedalam labu 100 ml dan ditambahkan kloroform hingga
batas tera. Selanjutnya diambil larutan masing-masing 1 ml, 2 ml, 3 ml, 4 ml dan
seterusnya kemudian dimasukkan kedalam tabung reaksi dan ditambahkan
kloroform 9 ml, 8 ml, 7 ml, 6 ml dan seterusnya. Absorbansi dibaca pada panjang
gelombang 450 nm dan dicatat.
Pengujian kadar
β
- karoten
Perhitungan kurva standar
Dicari persamaan linear dan regresi, dimana nilai r > 0,9 di kurva,
dimasukkan absorbansi sampel dan didapat konsentrasi sampel, kandungan
β
-karoten sampel dihitung dengan rumus :
β-karoten (mg/100 g) =
Konsentrasi sampel x FP x 100
g sampel
Kadar abu
Pengujian kadar abu dilakukan berdasarkan metode Sudarmadji, dkk.
(1997). Sampel yang telah dikeringkan hingga berat konstan selanjutnya ditimbang
sebanyak 5 g. Sampel dimasukkan kedalam cawan porselen yang telah diketahui
berat awalnya dan dibakar selama 1 jam dalam tanur dengan suhu 100 °C, 2 jam
dengan suhu 300 °C kemudian 2 jam dengan suhu 500 °C. Cawan porselen
didinginkan kemudian dikeluarkan dari tanur dan dimasukkan kedalam desikator
selama 15 menit kemudian ditimbang. Kadar abu diperoleh dengan rumus:
Kadar Abu (%) =
Bobot sampel awal (g)
Bobot abu (g)
x 100%
Kadar protein (Metode Kjeldahl)
dalamnya 2
–
4 tetes indikator (campuran metil merah 0,02% dalam alkohol dan
metil biru 0,02% dalam alkohol dengan perbandingan 2:1). Ujung tabung
kondensor harus terendam dalam labu larutan HBO
3, kemudian dilakukan destilasi
hingga sekitar 125 ml destilat dalam labu erlenmeyer. Ujung kondensor kemudian
dibilas dengan sedikit air destilat dan ditampung dalam erlenmeyer lalu dititrasi
dengan HCl 0,02 N sampai terjadi perubahan warna. Penetapan blanko dilakukan
dengan cara yang sama.
Kadar Protein (%) =
(A - B) x N HCl x 14 x 6,25
Berat sampel
x 100%
A = ml titrasi sampel
B = ml titrasi blanko
14 = berat atom nitrogen
6,25 = faktor konversi
Kadar lemak
Kadar Lemak (%) =
Berat sampel
Berat lemak
x 100%
Kadar serat kasar
Pengujian kadar serat kasar dilakukan berdasarkan metode AOAC (1995).
Sampel sebanyak 2 g dimasukan ke dalam labu erlenmeyer 300 ml kemudian
ditambahkan 50 ml H
2SO
40,325 N, dihidrolisis selama 30 menit pada suhu 100 °C.
Setelah itu didinginkan dan ditambahkan kembali NaOH 1,25 N sebanyak 50 ml
dan dihidrolisis kembali selama 30 menit. Sampel disaring menggunakan kertas
saring Whatman No. 41 yang telah diketahui beratnya. Kertas saring tersebut dicuci
berturut-turut dengan akuades mendidih, 25 ml H
2SO
40,325 N, kemudian akuades
mendidih dan yang terakhir dicuci dengan etanol 95%. Kertas saring yang telah
dicuci selanjutnya dikeringkan dalam oven bersuhu 105 °C selama satu jam,
pengeringan dilakukan hingga berat konstan.
berat kertas saring akhir (g)
–
berat kertas awal (g)
Kadar serat kasar (%) =
x 100%
Kadar pati (Hidrolisis Asam)
Pengujian kadar pati dilakukan berdasarkan metode Apriyantono, dkk.
(1989). Terlebih dahulu pereaksi DNS dibuat dengan cara dilarutkan 10,6 g asam
3,5-dinitrosalisilat dan 19,8 g NaOH ke dalam 1416 ml air ditambahkan ke dalam
larutan tersebut 306 g NaK-tartarat, 7,6 ml fenol (cairkan pada suhu 50 °C) dan
8,3 g Na-metabisulfit, dicampur merata. Pereaksi DNS distandarisasi dengan cara
HCl 0,1 N yang dibutuhkan 5-6 ml, jika kurang dari itu ditambahkan 2 g NaOH
untuk setiap kekurangan 0,1 ml HCL 0,1 N.
Setelah itu dilakukan persiapan sampel dengan cara ditimbang pati
sebanyak 5 g yang telah dihaluskan dimasukkan ke dalam beaker glass 250 ml,
selanjutnya ditambahkan 50 ml alkohol 80 % dan diaduk selama 1 jam. Suspensi
tersebut disaring dengan kertas saring dan dicuci dengan air sampai volume filtrat
250 ml. Filtrat ini mengandung karbohidrat yang terlarut dan dibuang.
Residu pati yang terdapat pada kertas saring dicuci sebanyak 5 kali dengan
10 ml ether. Ether dibiarkan menguap dari residu, kemudian dicuci kembali dengan
150 ml alkohol 10% untuk membebaskan lebih lanjut karbohidrat yang terlarut.
Residu dipindahkan secara kuantitatif dari kertas saring ke dalam erlenmeyer
dengan cara pencucian dengan 200 ml air dan ditambahkan 20 ml HCl 25%.
Kemudian erlenmeyer ditutup dengan penangas balik dan dipanaskan di atas
penangas air sampai mendidih selama 2,5 jam pada suhu 100
°C. Residu dibiarkan
dingin dan dinetralkan dengan larutan NaOH 45% hingga ± pH 7 dan diencerkan
sampai volume 500 ml. Campuran disaring kembali dengan kertas saring.
Setelah persiapan sampel selesai diukur gula reduksi dengan cara diambil
1 ml sampel dan dimasukkan ke dalam tabung reaksi bertutup, ditambahkan 3 ml
pereaksi DNS. Sampel ditempatkan dalam air mendidih selama 5 menit dan
dibiarkan
dingin
sampai
suhu
ruang.
Sampel
dibaca
menggunakan
spektrofotometer pada panjang gelombang 550 nm.
tanda tera lalu diaduk menggunakan magnetik stirer. Selanjutnya masing-masing
larutan glukosa standart dipipet sebanyak 1, 2, 4, 6 dan 8 ml dimasukkan ke dalam
tabung reaksi dan masing-masing ditambahkan akuades 9, 8, 6, dan 2 ml.
Setelah itu campuran tersebut dikocok atau dihomogenkan. Masing-masing
dari campuran tersebut diambil 1 ml dan ditambahkan 3 ml DNS kemudian dikocok
dan dipanaskan selama 5 menit dan didiamkan selama 30 menit. Selanjutnya
intensitas
warna
yang
terbentuk
diukur
absorbansinya
menggunakan
spektrofotometer pada panjang gelombang 550 nm. Kurva standar dibuat dengan
memplot konsentrasi glukosa terhadap absorbansinya.
Kadar Pati (%) =
Konsentrasi sampel (mg/ml) x FP x 100%
Berat sampel (g) x 1000
x
0,9
Kadar amilosa dan amilopektin
Pengujian kadar amilosa dan amilopektin dilakukan berdasarkan metode
Dewan Standarisasi Nasional (2008). Sampel sebanyak 0,1 g dimasukkan ke dalam
tabung reaksi selanjutnya ditambahkan 1 ml etanol 95% dan 9 ml NaOH 1 N.
Campuran tersebut dipanaskan dalam air mendidih selama 10 menit hingga semua
terlarut kemudian didinginkan. Selanjutnya campuran tersebut dipindahkan ke
dalam labu takar 100 ml dan ditambahkan akuades sampai tanda tera. Kemudian
5 ml larutan dipipet ke dalam labu takar 100 ml dan tambahkan 1 ml asam asetat
1 N, 2 ml larutan iod dan akuades hingga tanda tera. Lalu dikocok dan didiamkan
Penetapan kurva standar amilosa dilakukan dengan cara menimbang 40 mg
amilosa murni (amilosa kentang), kemudian dimasukkan ke dalam tabung reaksi
lalu ditambahkan 1 ml etanol 95 % dan 9 ml NaOH 1 N. Campuran tersebut
dipanaskan ke dalam air mendidih selama 10 menit sampai semua bahan terlarut,
kemudian didinginkan. Campuran tersebut dipindahkan ke dalam labu takar 100 ml
dan ditambahkan akuades hingga tanda tera. Larutan campuran dipipet ke dalam
labu takar 100 ml masing-masing 1 ml, 2 ml, 3 ml, 4 ml, dan 5 ml. Lalu ke dalam
labu takar tersebut ditambahkan asam asetat 1 N berturut-turut 0,2 ml, 0,4 ml,
0,6 ml, 0,8 ml, 1 ml serta masing-masing 2 ml larutan iod. Kemudian ditambahkan
akuades sampai tanda tera. Larutan dihomogenkan dengan menggunakan magnetik
stirer lalu dibiarkan selama 20 menit, diukur absorbansinya dengan
spektrofotometer pada panjang gelombang 620 nm yaitu hubungan panjang
gelombang yang memberikan absorbansi maksimum untuk warna biru.
Kadar Amilosa (%)
=
Konsentrasi amilosa (mg/ml) x FP x 0,001
Berat sampel (g)
x
100%
Kadar Amilopektin (%) = kadar pati (%) - kadar amilosa (%)
Total gula
tidak berbau alcohol. Tetapkan volume larutan hingga volume tertentu
menggunakan aquades. Setelah persiapan sampel selesai, diukur total gula dengan
cara diambil 1 ml sampel, ditambahkan 0,5 ml larutan fenol 5 %, ditambahkan
dengan cepat 2,5 ml larutan asam sulfat pekat dengan cara menuangkan secara
tegak lurus ke permukaan larutan. Dibiarkan selama 10 menit, dikocok. Diukur
absorbansinya pada 490 nm. Dibuat kurva standar. Kemudian ditentukan total gula
sampel.
Total Gula (%) =
Konsentrasi sampel x FP
Berat sampel (g) x 1000
x
100
%
Gula reduksi
Pengujian gula reduksi dilakukan berdasarkan metode Apriyantono, dkk.
(1989). Terlebih dahulu pereaksi DNS dibuat dengan cara melarutkan 10,6 g asam
3,5-dinitrosalisilat dan 19,8 g NaOH ke dalam 1416 ml air. Selanjutnya ke dalam
larutan tersebut ditambahkan 306 g NaK-tartarat. 7,6 ml fenol (cairkan pada suhu
50 °C) dan 8,3 g Na-metabisulfit, dicampur merata. Larutan distandarisasi dengan
cara dititrasi 3 ml pereaksi DNS dengan HCL 0,1 N dan indikator fenolftalein.
Dibutuhkan 5-6 ml HCL 0,1 N, jika kurang dari itu ditambahkan 2 g NaOH untuk
setiap kekurangan 0,1 ml HCL 0,1 N.
alkohol. Tetapkan volume larutan hingga volume tertentu menggunakan aquades.
Setelah persiapan sampel selesai diukur gula reduksi dengan cara diambil 1 ml
sampel dan dimasukkan ke dalam tabung reaksi bertutup, ditambahkan 3 ml
pereaksi DNS. Ditempatkan dalam air mendidih selama 5 menit. Dibiarkan dingin
sampai suhu ruang. Digunakan aquadest sebagai blanko. Dibuat kurva standar.
Penetapan kurva standar menggunakan larutan glukosa standart dengan
konsentrasi 0,05-0,5 mg/ml dilakukan dengan cara menimbang 50 mg glukosa,
kemudian dimasukkan ke dalam labu ukur 100 ml. Ditambahkan akuades sampai
tanda tera dan diaduk dengan menggunakan magnetik stirer. Selanjutnya
masing-masing dipipet sebanyak 1, 2, 4 dan 6 ml dimasukkan ke dalam tabung
reaksi dan masing-masing ditambahkan akuades 9, 8, 6, dan 4 ml. Setelah itu
campuran tersebut dikocok atau dihomogenkan. Masing-masing dari campuran
tersebut diambil 1 ml dan ditambahkan 3 ml DNS kemudian dikocok dan
dipanaskan selama 5 menit. Didiamkan selama 30 menit. Selanjutnya diukur
absorbansinya menggunakan spektrofotometer pada panjang gelombang 550 nm.
Kurva standar dibuat dengan memplot konsentrasi glukosa terhadap absorbansinya.
Gula reduksi
(%) =
Konsentrasi sampel x FP
Berat sampel (g) x 1000
x
%
Dextrose equivalent
(DE)
DE =
Gula reduksi
Total Gula
x 100%
Derajat polimerisasi (DP)
Pengujian derajat polimerisasi (DP) dilakukan berdasarkan metode
Apriyantono, dkk. (1989). Derajat polimerisasi merupakan indikasi dari nilai
rata-rata unit monomer dari molekulnya. Ini menunjukkan nilai dari unit glukosanya.
DP dihitung dengan menggunakan rumus :
Gambar 1. Skema pembuatan tepung ubi jalar oranye
F1 = Fermentasi Alami (Dengan Air) F2 = Fermentasi dengan Ragi Roti F3 = Fermentasi dengan BAL
-
Daya Serap Air dan Minyak-
Swelling Power
Gambar 2. Skema pembuatan tepung ubi jalar oranye dengan metode fermentasi
alami
Perendaman dengan air sebanyak 6 L
Pengirisan dengan slicer, tebal 3 mm
Pengayakan dengan ayakan 60 mesh
Pengupasan dan Pencucian
Lama fermentasi
L
1= 24 jam
L
2= 48 jam
L
3= 72 jam
Pencucian dan penirisan
Tepung ubi jalar
ungu
Ubi jalar oranye
Pengeringan dengan suhu 50 °C sampai kering
Gambar 3. Skema pembuatan tepung ubi jalar oranye dengan metode fermentasi
ragi roti
Pengirisan dengan slicer, tebal 3 mm
Pengayakan dengan ayakan 60 mesh
Pengupasan dan Pencucian
Lama fermentasi
L
1= 24 jam
L
2= 48 jam
L
3= 72 jam
Pencucian dan penirisan
Tepung ubi jalar
ungu
Ubi jalar oranye
Pengecilan ukuran
Pengeringan dengan suhu 50
oC sampai kering
Perendaman dengan air 6 L yang
Gambar 4. Skema pembuatan tepung ubi jalar oranye dengan metode fermentasi
bakteri asam laktat
Pengecilan ukuran
Pengeringan dengan suhu 50
oC sampai kering
Perendaman dengan air garam 0,85 %
yang telah berisi BAL yoghurt
sebanyak 1x10
7CFU/ml
Pengirisan dengan slicer, tebal 3 mm
Pengayakan dengan ayakan 60 mesh
Pengupasan dan Pencucian
Lama fermentasi
L
1= 24 jam
L
2= 48 jam
L
3= 72 jam
Pencucian dan penirisan
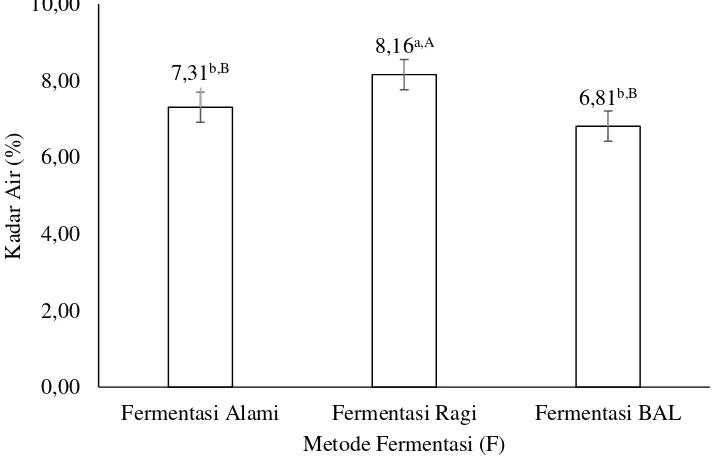
HASIL DAN PEMBAHASAN
Pengaruh Metode dan Lama Fermentasi Terhadap Karakteristik Fisik
Tepung Ubi Jalar Oranye
Karakteristik fisik tepung ubi jalar oranye dari hasil penelitian meliputi
warna (ºHue) dengan kromameter, densitas kamba, nilai organoleptik warna dan
aroma. Pengaruh metode dan lama fermentasi terhadap karakteristik fisik dari
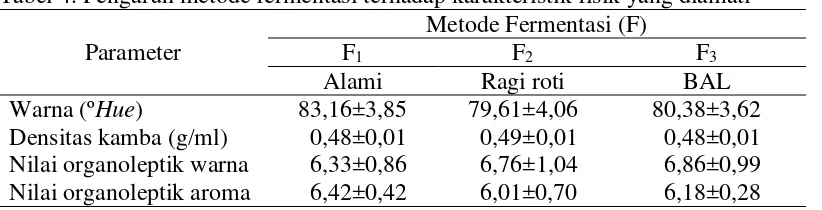
tepung ubi jalar oranye dapat dilihat pada Tabel 4 dan Tabel 5.
Tabel 4. Pengaruh metode fermentasi terhadap karakteristik fisik yang diamati
Parameter
Metode Fermentasi (F)
F
1F
2F
3Alami
Ragi roti
BAL
Warna (ºHue)
83,16±3,85
79,61±4,06
80,38±3,62
Densitas kamba (g/ml)
0,48±0,01
0,49±0,01
0,48±0,01
Nilai organoleptik warna
6,33±0,86
6,76±1,04
6,86±0,99
Nilai organoleptik aroma
6,42±0,42
6,01±0,70
6,18±0,28
Keterangan: Angka dalam tabel merupakan rataan dari 3 ulangan, ± standar deviasi.Tabel 5. Pengaruh lama fermentasi terhadap karakteristik fisik yang diamati
Parameter
Lama Fermentasi (L)
L
1L
2L
324 jam
48 jam
72 jam
Warna (ºHue)
82,67±2,28
a82,28±3,38
a78,20±4,69
bDensitas kamba (g/ml)
0,49±0,01
a,A0,48±0,01
b,A0,47±0,01
c,BNilai organoleptik warna
6,24±0,55
b6,32±0,82
b7,39±1,04
aNilai organoleptik aroma
6,35±0,38
6,19±0,37
6,07±0,75
Keterangan: Angka dalam tabel merupakan rataan dari 3 ulangan, ± standar deviasi. Angka yangdiikuti dengan huruf yang berbeda dalam satu baris menunjukkan berbeda nyata (P<0,05) (huruf kecil) dan berbeda sangat nyata (P<0,01) (huruf besar) dengan uji LSR.
Warna (°
Hue)
Tabel 4 menunjukkan metode fermentasi memberikan pengaruh berbeda
tidak nyata (P>0,05) terhadap warna (°Hue) tepung. Tabel 5 menunjukkan lama
fermentasi memberikan pengaruh berbeda nyata (P<0,05) terhadap warna (°Hue)
antara metode dan lama fermentasi memberikan pengaruh berbeda tidak nyata
(P>0,05) terhadap warna (°Hue) tepung. Hubungan lama fermentasi dengan warna
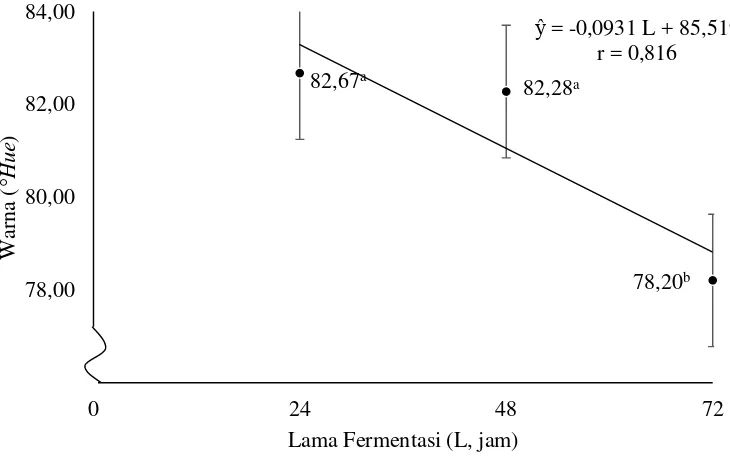
dapat dilihat pada Gambar 5.
Gambar 5. Hubungan lama fermentasi dengan warna (°Hue) tepung (error bar:
± standar deviasi)
Gambar 5 menunjukkan bahwa semakin lama fermentasi menyebabkan
penurunan nilai
°Hue tepung. Nilai
°Hue 54-90 menunjukkan warna kuning
kemerahan sedangkan nilai
°Hue 90-126 menunjukkan warna kuning
(Hutching, 1999). Penurunan nilai
°Hue menyebabkan warna tepung yang
dihasilkan cenderung kuning kemerahan. Kerusakan karotenoid dapat disebabkan
oleh adanya proses oksidasi karotenoid dan dikatalis oleh enzim lipoksigenase yang
secara alami terdapat dalam umbi-umbian. Lipoksigenase berhubungan dengan
penurunan kualitas umbi-umbian karena enzim ini dapat mengkatalis oksidasi
lemak sehingga menimbulkan aroma tidak enak (langu) serta hilangnya pigmen
karoten. Lipoksigenase pada kondisi pH netral dapat mengkatalis oksidasi
karotenoid (Baysal dan Demirdoven, 2007). Salah satu cara yang dapat dilakukan
untuk inaktivasi enzim ini adalah dengan mengatur pH lingkungan. pH asam dapat
digunakan untuk menginaktivasi enzim ini (Rahman, 2007). Asam-asam organik
yang dihasilkan selama proses fermentasi mampu menurunkan pH lingkungan
sehingga menyebabkan enzim lipoksigenase pada ubi jalar oranye menjadi tidak
stabil dan oksidasi pigmen karotenoid dapat di minimalisir.
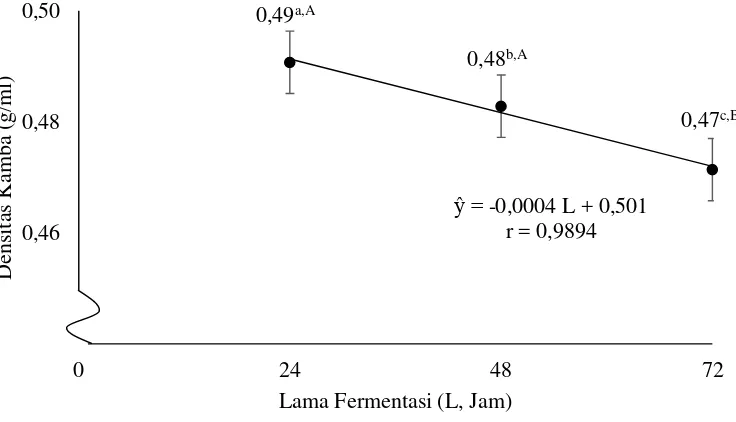
Densitas kamba
Tabel 4 menunjukkan metode fermentasi memberikan pengaruh berbeda
tidak nyata (P>0,05) terhadap densitas kamba tepung. Tabel 5 menunjukkan lama
fermentasi memberikan pengaruh berbeda sangat nyata (P<0,01) terhadap densitas
kamba tepung. Hasil analisis ragam pada Lampiran 6 menunjukkan bahwa interaksi
antara metode dan lama fermentasi memberikan pengaruh berbeda tidak nyata
(P>0,05) terhadap densitas kamba tepung. Hubungan lama fermentasi dengan
densitas kamba dapat dilihat pada Gambar 6.
Gambar 6 menunjukkan semakin lama fermentasi akan menurunkan
densitas kamba tepung. Densitas kamba merupakan massa partikel yang menempati
volume tertentu. Semakin tinggi densitas kamba menunjukkan produk semakin
padat (Rohmah, 2012). Selama proses fermentasi dengan cara perendaman, granula
pati akan menyerap air dan membengkak (Anggraeni dan Yuwono, 2014). Enzim
isoamilase yang dihasilkan ragi roti dan enzim pullulanase yang dihasilkan oleh
BAL menyebabkan terputusnya rantai cabang amilopektin yang dapat
meningkatkan rasio amilosa dalam pati.
Amilosa memiliki kemampuan menyerap air yang lebih besar namun juga
dapat melepaskan air dengan mudah (Yuwono, dkk., 2013). Ketika dikeringkan, air
dalam granula pati akan lebih mudah menguap dan menyisakan granula pati dengan
ukuran yang lebih besar akibat pembengkakan. Granula pati yang membengkak ini
menyebabkan tekstur bahan yang lebih berpori sehingga fermentasi yang semakin
lama menghasilkan volume yang lebih besar dengan berat bahan yang ringan.
Volume yang semakin besar akan menurunkan densitas kamba sehingga fermentasi
yang semakin lama dapat menurunkan densitas kamba tepung.
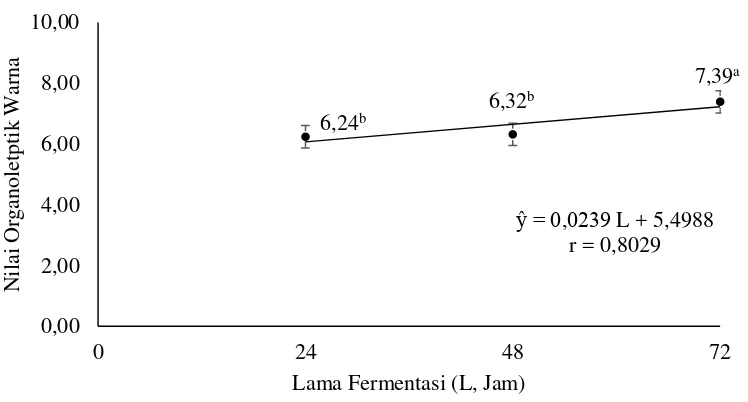
Nilai organoleptik warna
lama fermentasi dengan nilai organoleptik warna tepung dapat dilihat pada
Gambar 7.
Gambar 7. Hubungan lama fermentasi dengan nilai organoleptik warna tepung
(error bar: ± standar deviasi)
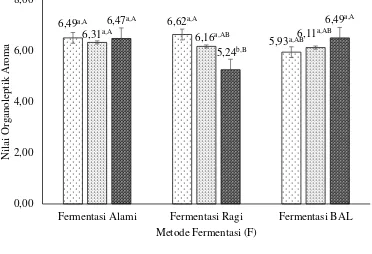
Nilai organoleptik aroma
Tabel 4 menunjukkan metode fermentasi memberikan pengaruh berbeda
tidak nyata (P>0,05) terhadap nilai organoleptik aroma tepung. Tabel 5
menunjukkan lama fermentasi memberikan pengaruh berbeda tidak nyata (P>0,05)
terhadap nilai organoleptik aroma tepung. Hasil analisis ragam pada Lampiran 9
menunjukkan bahwa interaksi metode dan lama fermentasi memberikan pengaruh
berbeda sangat nyata (P<0,01) terhadap nilai organoleptik aroma tepung. Hubungan
metode dan lama fermentasi dengan nilai organoleptik aroma tepung dapat dilihat
pada Gambar 8.
Gambar 8. Hubungan interaksi metode dan lama fermentasi dengan nilai
organoleptik aroma (error bar: ± standar deviasi)
Gambar 8 menunjukkan bahwa peningkatan lama fermentasi pada metode
fermentasi alami tidak berpengaruh terhadap nilai organoleptik aroma, tetapi pada
fermentasi dengan ragi cenderung menurunkan nilai organoleptik aroma sedangkan
6,49a,A 6,62a,A
pada fermentasi dengan BAL cenderung meningkatkan nilai organoleptik aroma
tepung. Penurunan nilai organoleptik aroma tepung dengan fermentasi ragi terjadi
karena penggunaan metode ini memberikan aroma alkohol yang kurang disukai
oleh panelis. Selama fermentasi, khamir Saccharomyces cereviceae
memproduksi
alkohol dari perombakan glukosa yang dihasilkan oleh pemecahan enzimatik
sukrosa, maltosa, pati maupun karbohidrat (Koswara, 2009
b). Semakin lama
fermentasi menyebabkan semakin banyak alkohol yang diproduksi dari hasil
metabolit khamir sehingga aroma alkohol semakin kuat dan kurang disukai panelis.
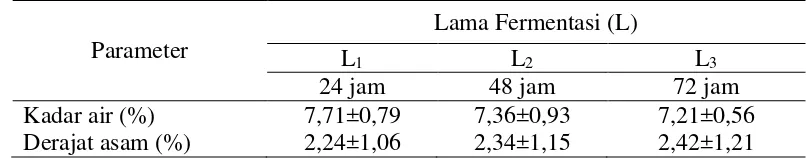
Pengaruh Metode dan Lama Fermentasi Terhadap Karakteristik Kimia
Tepung Ubi Jalar Oranye
Karakteristik kimia tepung ubi jalar oranye dari hasil penelitian meliputi
kadar air dan derajat asam. Pengaruh metode dan lama fermentasi terhadap
karakteristik kimia dari tepung ubi jalar oranye dapat dilihat pada Tabel 6 dan
Tabel 7.
Tabel 6. Pengaruh metode fermentasi terhadap karakteristik kimia yang diamati
Parameter
Keterangan: Angka dalam tabel merupakan rataan dari 3 ulangan, ± standar deviasi. Angka yangdiikuti dengan huruf yang berbeda dalam satu baris menunjukkan berbeda nyata (P<0,05) (huruf kecil) dan berbeda sangat nyata (P<0,01) (huruf besar) dengan uji LSR.