6 BAB II
TINJAUAN PUSTAKA
2.1 Uraian tumbuhan
Uraian tumbuhan meliputi habitat, morfologi, sistematika, nama daerah, kandungan dan manfaat dari rimpang temu giring.
2.1.1 Habitat
Temu giring banyak ditemukan tumbuh liar di hutan atau peladangan dekat rumah penduduk, terutama di kawasan Jawa Timur. Kini, temu giring sudah banyak dibudidayakan oleh masyarakat sebagai tanaman apotik hidup, terutama di pulau Jawa. Penduduk Jawa Tengah, Jawa Timur, dan Jawa Barat sudah membudidayakannya sebagai bahan jamu atau obat tradisional yang relatif menguntungkan (Muhlisah, 1999).
2.1.2 Morfologi tumbuhan
Batang temu giring berwarna hijau pucat dan tumbuh tegak yang tersusun atas banyak pelepah daun. Daunnya berbentuk lanset yang melebar. Helatan daunnya tipis, uratnya kelihatan dan berwarna hijau muda. Bunga temu giring muncul dari bagian samping batang semu. Pinggiran mahkota bunga berwarna merah. Bunga ini memiliki daun-daun pelindung yang berujung lancip (Muhlisah, 1999).
7
rimpang berwarna kuning, berbau khas temu giring. Rimpang bagian samping umumnya memiliki rasa lebih pahit (Muhlisah, 1999).
Tanaman ini tumbuh pada daerah hingga ketinggian 75 cm di atas permukaan tanah. Temu giring dijumpai sebagai tanaman liar di hutan atau di halaman rumah, terutama di tempat yang teduh. Perbanyakan dilakukan dengan stek rimpang induk atau rimpang cabang yang bertunas (Mursito, 2003).
2.1.3 Sistematika tumbuhan
Berdasarkan taksonomi tumbuhan temu giring diklasifikasikan sebagai berikut (Citrosupomo, 1991):
Divisi : Spermatophyta Sub divisi: Angiospermae Kelas : Monocotyledonae Bangsa : Zingiberales Suku : Zingiberaceae Marga : Curcuma
Jenis : Curcuma heyneana Valeton dan Zijp. 2.1.4 Nama daerah
Jawa: Temu giring
Bali : Temu poh (Ditjen POM, 1989) 2.1.6 Kandungan kimia
8
(NADFC, RI., 2004). pati, saponin, dan flavonoid (Depkes dan Kessos, RI., 2001).
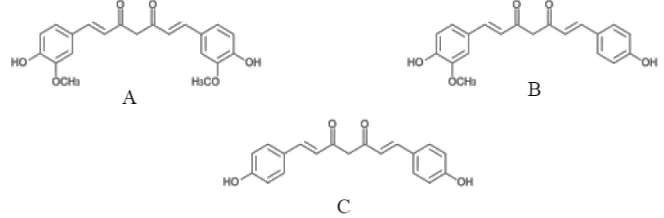
Kurkuminoid adalah suatu campuran yang kompleks berwarna kuning oranye yang diisolasi dari tanaman dan mempunyai efek terapeutik. Kurkuminoid terdiri dari kurkumin, desmetoksi-kurkumin dan bis-desmetoksi-kurkumin (Kristina, dkk., 2006). Rumus bangun kurkuminoid dapat dilihat pada Gambar 2.1
Gambar 2.1 Struktur Kurkumin Keterangan : A = Struktur kurkumin
B = Struktur desmetoksi-kurkumin C = Struktur bis-desmetoksi-kurkumin
Kurkumin (C21H2OO6) pertama kali diisolasi pada tahun 1815, kemudian
tahun 1910 didapatkan dalam bentuk kristal dan dilarutkan pada tahun 1913. Kurkumin tidak dapat larut dalam air, tetapi larut dalam etanol, dan aseton (Kristina, dkk., 2006).
9 2.1.7 Manfaat
Secara tradisional rimpang temu giring mempunyai beberapa kegunaan antara lain sebagai obat luka (Ditjen, POM., 1989), obat cacing, obat sakit perut, obat pelangsing, memperbaiki warna kulit (Mursito, 2003), obat untuk mengatasi perasaan tidak tenang atau cemas, jantung berdebar-debar, haid tidak teratur, obat rematik, menambah nafsu makan, meningkatkan stamina, menghaluskan kulit, obat jerawat, obat cacar air, dan obat batuk (Wijayakusuma, 2006).
2.2 Ekstraksi
Ekstrak yaitu sediaan kental atau cair yang diperoleh dengan cara
mengekstraksi zat aktif dari simplisia nabati atau simplisia hewani menggunakan
pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan
(Depkes, RI., 1995).
Ekstraksi adalah suatu proses pemisahan kandungan senyawa kimia dari
jaringan tumbuhan maupun hewan. Sebelum ekstraksi dilakukan biasanya bahan
dikeringkan terlebih dahulu kemudian dihaluskan pada derajat kehalusan tertentu
(Harborne, 1987). Penarikan zat aktif dari bahan asal (simplisia) dilakukan dengan
pelarut yang sesuai. Tujuan utama dari ekstraksi adalah untuk mendapatkan atau
memisahkan sebanyak mungkin zat-zat yang memiliki khasiat pengobatan. Zat
aktif yang terdapat dalam simplisia tersebut dapat digolongkan ke dalam golongan
minyak atsiri, alkaloid, flavonoid dan lain-lain (Depkes, RI., 2000).
Menurut Depkes, RI (2000), ada beberapa metode ekstraksi yang sering
10 a. Cara dingin
− Maserasi
Maserasi adalah proses penyarian simplisia dengan cara perendaman
menggunakan pelarut dengan sesekali pengadukan pada temperatur kamar.
Maserasi yang dilakukan pengadukan secara terus menerus disebut maserasi
kinetik, sedangkan yang dilakukan pengulangan panambahan pelarut setelah
dilakukan penyaringan terhadap maserat pertama dan seterusnya disebut
remaserasi. − Perkolasi
Perkolasi adalah proses penyarian simplisia menggunakan alat perkolator dengan pelarut yang selalu baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada temperatur kamar. Proses perkolasi terdiri dari tahap pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya (penetesan/penampungan ekstrak) terus menerus sampai diperoleh perkolat.
b. Cara panas − Refluks
Refluks adalah proses penyarian simplisia menggunakan alat dengan pendingin balik pada temperatur titik didihnya dalam waktu tertentu dimana pelarut akan terkondensasi menuju pendingin dan kembali ke labu.
− Digesti
11 − Sokletasi
Sokletasi adalah proses penyarian dengan menggunakan pelarut yang selalu baru, dilakukan dengan menggunakan alat soklet dimana pelarut akan terkondensasi dari labu menuju pendingin, kemudian jatuh membasahi sampel.
− Infundasi
Infundasi adalah proses penyarian dengan menggunakan pelarut air pada temperatur 90°C selama 15 menit.
− Dekoktasi
Dekoktasi adalah proses penyarian dengan menggunakan pelarut air pada temperatur 90°C selama 30 menit.
2.3 Radikal bebas
Radikal bebas didefenisikan sebagai suatu atom atau molekul yang mempunyai satu atau lebih elektron tidak berpasangan pada orbital terluarnya, bersifat sangat reaktif dan tidak stabil (Muchtadi, 2013). Untuk mencapai kestabilan, radikal bebas akan bereaksi dengan molekul disekitarnya untuk memperoleh pasangan elektron dan dapat mengubah suatu molekul menjadi radikal (Winarsi, 2011).
Menurut Kumalaningsih (2006), pembentukan radikal bebas melalui 3 tahapan reaksi, yaitu:
- Tahap inisiasi: tahap awal terbentuknya radikal bebas.
12
- Tahap terminasi: adalah tahap akhir, terjadinya pengikatan suatu radikal bebas dengan radikal bebas yang lain sehingga membentuk senyawa non-radikal yang biasanya kurang reaktif dari radikal induknya.
Radikal bebas ini antara lain golongan hidroksil (OH-), superoksida (O-2),
nitrogen monooksida (NO), nitrogen dioksida (NO2), peroksidal (RO-2),
peroksinitrit (ONOO-), asam hipoklorit (HOCl), hydrogen peroksida (H2O2), ozon
(O3), dinitrogen trioksida (N2O3), lipid peroksida (LOOH) (Silalahi, 2006;
Pham-Huy, dkk., 2008). Reaksi ini akan berlangsung terus menerus dalam tubuh dan bila tidak dihentikan akan menimbulkan berbagai penyakit seperti kanker, jantung koroner, katarak, serta penyakit degeneratif lainnya (Sudiana, 2008).
2.4 Antioksidan
Antioksidan merupakan senyawa yang mampu meredam atau menghambat aktivitas senyawa oksidan dalam tubuh dengan cara mendonorkan elektronnya atau disebut reduktan (Winarsi, 2011). Antioksidan dikelompokkan menjadi dua golongan berdasarkan mekanisme kerjanya, yaitu antioksidan primer (enzimatis) dan antioksidan sekunder (non-enzimatis) (Hamid, dkk., 2010).
Antioksidan primer adalah antioksidan yang berfungsi untuk mencegah terbentuknya radikal bebas baru karena dapat merubah radikal bebas menjadi kurang reaktif sebelum sempat bereaksi. Antioksidan ini berupa enzim yang diproduksi oleh tubuh, meliputi: superoksida dismutase, enzim katalase dan glutation peroksidase. Enzim superoksida dismutase berperan dalam mengubah radikal superoksida (O2˙−) menjadi hidrogen peroksida (H2O2), enzim katalase
dan glutation peroksidase akan mengubah hidrogen peroksida (H2O2) menjadi air
13
mineral-mineral seperti mangan (Mn), selenium (Se), zink (Zn) dan tembaga (Cu) (Kumalaningsih, 2006).
Antioksidan sekunder senyawa fenol yang berfungsi untuk menangkap radikal bebas dan menghentikan reaksi berantai. Antioksidan sekunder juga disebut sebagai antioksidan preventif, dimana pembentukan senyawa oksigen reaktif dihambat dengan cara pengkelatan metal. Antioksidan ini meliputi:
- Antioksidan vitamin, contoh: vitamin A, C, E.
- Senyawa fitokimia, contoh: flavonoid, katekin, karotenoid, β-karoten.
- Antioksidan sintetik, contoh: BHA (butylated hydroxyl anisole), BHT (butylated hydroxytoluene), PG (propyl gallate), EDTA (ethylene diamine tetraacetic acid), TBHQ (tertiary butyl hydroquinone) dan NDGA (nordihydro
guaretic acid) (Hamid, dkk., 2010).
2.4.1 Vitamin C
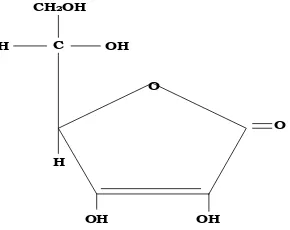
Vitamin C atau asam askorbat mempunyai berat molekul 176,13 dengan rumus molekul C6H8O6. Pemerian vitamin C adalah hablur atau serbuk berwarna
putih atau agak kekuningan. Pengaruh cahaya lambat laun menyebabkan berwarna gelap, dalam keadaan kering stabil di udara namun dalam larutan cepat teroksidasi. Vitamin C mudah larut dalam air, agak sukar larut dalam etanol, praktis tidak larut dalam kloroform, dalam eter dan dalam benzen (Depkes, RI., 1979).
14
yang kurang reaktif, kemudian membentuk asam monodehidroaskorbat dan atau asam dehidroaskorbat. Bentuk tereduksi ini dapat diubah kembali menjadi asam askorbat oleh enzim monodehidroaskorbat reduktase dan dehidroaskorbat reduktase (Packer, 2002).
Rumus bangun vitamin C dapat dilihat pada Gambar 2.2
C
Gambar 2.2 Rumus bangun vitamin C (Depkes, RI., 1995). 2.4.2 Flavonoid
Senyawa flavonoid merupakan salah satu senyawa polifenol terbesar yang
mengandung 15 atom karbon dalam inti dasarnya, yang tersusun dalam
konfigurasi (C6–C3–C6), yaitu dua cincin aromatik yang dihubungkan oleh satuan
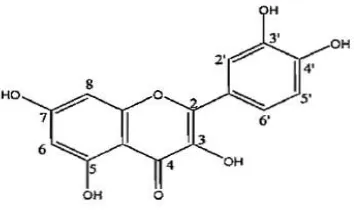
3 karbon (Markham, 1988). Rumus bangun turunan flavonoid dapat dilihat pada Gambar 2.3
Gambar 2.3 Rumus bangun flavonoid (Wetipo, dkk., 2010).
Flavonoid mencakup banyak pigmen yang terdapat dalam fungus hingga
15
sebagai glikosida sehingga untuk menganalisis flavonoid, lebih baik ekstrak
tumbuhan dihidrolisis terlebih dahulu untuk memecah ikatan gula dengan aglikon
(Harborne, 1987). Senyawa ini adalah senyawa pereduksi yang dapat
menghambat reaksi oksidasi sehingga dapat dijadikan sebagai antioksidan Senyawa ini berperan sebagai donor hidrogen terhadap radikal bebas karena
mengandung gugus hidroksil (Silalahi, 2006).
2.4.3 Kuersetin
Kuersetin (3’,4’-dihidroksiflavonol) merupakan senyawa flavonoid dari kelompok flavonol dan terdapat terutama pada tanaman teh, tomat, apel, kakao, anggur dan bawang yang memiliki sifat antioksidan yang sangat potensial. Dengan mengkonsumsi kuersetin dalam jumlah yang cukup (50-200 mg per hari) maka dapat bermanfaat memberi perlindungan karena berperan sebagai senjata pemusnah radikal bebas sehingga dapat mencegah penuaan dini. Kuersetin menunjukkan aktivitasnya dalam menghambat reaksi oksidasi low-density lipoprotein (LDL) secara in vitro, mencegah kerusakan oksidatif dan kematian sel
dengan mekanisme menangkap radikal oksigen, memberi efek farmakologi sebagai antiinflamasi (Herowati, R. 2008). Struktur kimia kuersetin dapat dilihat pada Gambar 2.4
16 2.5 Spektrofotometer UV-visibel
Menurut Dachriyanus (2004), spektrofotometer UV-Vis adalah pengukuran panjang gelombang dan intensitas sinar ultraviolet dan sinar tampak yang diabsorbsi oleh sampel. Sinar ultraviolet berada pada panjang gelombang 200-400 nm, sedangkan sinar tampak berada pada panjang gelombang 400-800 nm. Spektrofotometer UV-Vis pada umumnya digunakan untuk:
1. Menentukan jenis kromofor, ikatan rangkap yang terkonjugasi dan auksokrom dari suatu senyawa organik
2. Menjelaskan informasi dari struktur berdasarkan panjang gelombang maksimum suatu senyawa
3. Menganalisis senyawa organik secara kuantitatif.
Berdasarkan aspek kuantitatif, suatu berkas radiasi dikenakan pada cuplikan (larutan sampel) dan intensitas sinar radiasi yang diteruskan diukur besarnya. Radiasi yang diserap oleh cuplikan kemudian ditentukan dengan membandingkan intensitas sinar yang diteruskan dengan intensitas sinar yang diserap (Gandjar dan Rohman, 2007).
2.6 Metode pemerangkapan radikal bebas DPPH
Metode pemerangkapan radikal bebas DPPH (1,1-diphenyl-2-picrylhydrazine) merupakan metode yang cepat, sederhana, dan tidak mahal untuk
mengukur kemampuan berbagai senyawa dalam memerangkap radikal bebas serta untuk mengevaluasi aktivitas antioksidan pada bahan makanan dan minuman (Marinova, 2011).
17
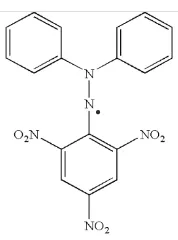
Renn. DPPH berwarna ungu pekat seperti KMnO4 dan bentuk tereduksinya 1,1-diphenyl-2-picrylhydrazine (DPPH-H) berwarna jingga kekuningan, bersifat tidak
larut dalam air (Ionita, 2005).
Rumus bangun DPPH dapat dilihat pada gambar 2.5
Gambar 2.5 Rumus bangun DPPH
DPPH merupakan radikal bebas yang stabil pada suhu kamar. Prinsip metode pemerangkapan radikal bebas DPPH, yaitu elektron ganjil pada molekul DPPH memberikan serapan maksimum pada panjang gelombang 516 nm. Interaksi antioksidan dengan DPPH baik secara transfer elektron atau radikal hidrogen pada DPPH akan menetralkan karakter radikal bebas dari DPPH (Molyneux, 2004). Warna ungu larutan DPPH akan berubah menjadi kuning lemah apabila elektron ganjil tersebut berpasangan dengan atom hidrogen yang dari senyawa antioksidan. Reaksi radikal bebas DPPH dengan antioksidan dapat dilihat pada Gambar 2.6
18
Parameter yang dipakai untuk menunjukkan aktivitas antioksidan adalah harga konsentrasi efisien atau Efficient Concentration (EC50) atau Inhibitory
Concentration (IC50) yaitu konsentrasi suatu zat antioksidan yang dapat
menyebabkan 50% DPPH kehilangan karakter radikal atau konsentrasi suatu zat antioksidan yang memberikan persen peredaman sebesar 50% (Molyneux, 2004). 2.6.1 Pelarut
Metode DPPH akan bekerja dengan baik menggunakan pelarut metanol atau etanol karena kedua pelarut ini tidak mempengaruhi dalam reaksi antara sampel uji sebagai antioksidan dengan DPPH sebagai radikal bebas (Molyneux, 2004).
2.6.2 Pengukuran panjang gelombang
Panjang gelombang yang digunakan untuk analisis kuantitatif adalah panjang gelombang yang mempunyai absorbansi maksimal (Gandjar dan Rohman, 2007). Panjang gelombang maksimum (λmaks) yang digunakan dalam
pengukuran sampel uji pada metode pemerangkapan radikal bebas DPPH sangat bervariasi. Menurut beberapa literatur, panjang gelombang maksimum untuk DPPH antara lain 515-520 nm (Molyneux, 2004).
2.6.3 Waktu pengukuran