POLA EKSPRESI GEN HbACO2 PADA KULIT BATANG DAN
LATEKS KARET (Hevea brasiliensis) AKIBAT STRES
EKSPLOITASI
CHAIRUNISA
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2008
ABSTRAK
CHAIRUNISA. Pola Ekspresi Gen HbACO2 pada Kulit Batang dan Lateks Karet
(Hevea brasiliensis) Akibat Stres Eksploitasi. Dibimbing oleh MARIA BINTANG dan
TETTY CHAIDAMSARI.
Masa produktif dan kualitas produksi tanaman karet alam (Hevea brasiliensis)
amat dipengaruhi oleh respon tanaman terhadap stres eksploitasi. Deteksi dini klon karet
yang memiliki respon stres baik dapat dilakukan salah satunya dengan penanda
molekuler. Pengetahuan mengenai pola ekspresi gen yang terlibat dalam biosintesis
lateks pada tanaman karet diperlukan sebagai langkah awalnya. Penelitian ini
mengamati pola ekspresi gen HbACO2 tanaman karet klon PB 260 umur 5 tahun pada
pengaruh penyadapan dan stimulasi etefon sebagai dua faktor penyebab stres eksploitasi
utama pada tanaman karet perkebunan. Terdapat enam perlakuan; sampel pohon karet
yang disadap 2, 4 dan 6 hari sekali serta pohon karet yang diberi 2.5% etefon 3, 6 dan
12 kali setahun (disadap 4 hari sekali). Gen HbACO2 hanya terekspresi pada kulit
batang dan ekspresinya lebih dipengaruhi pelukaan disertai pemberian etefon dibanding
pelukaan saja. Tingkat ekspresi tertinggi terjadi pada perlakuan stimulasi etefon 12 kali
setahun, 30 hari setelah tanaman buka sadap. Ekspresi gen HbACO2 terhenti di bulan
ketiga pada intensitas penyadapan dan stimulasi etefon paling sering sementara pada
perlakuan lainnya, ekspresi gen terhenti di bulan keempat.
ABSTRACT
CHAIRUNISA. The Expression Patterns of HbACO2 gene in Rubber (Hevea
brasiliensis) Bark and Latex in Response to Exploitation Stresses. Under the direction
of MARIA BINTANG and TETTY CHAIDAMSARI.
Productive time and production quality of rubber plants (Hevea brasiliensis) are
greatly affected by the plant’s response to exploitation stresses. Early detection of a
rubber clone which has a good stresses response can be done using molecular marker.
The knowledge about the gene expression patterns involved in latex biosynthesis in
rubber trees are necessary for the first step. This research observed the HbACO2 gene
expression patterns of 5 years old PB 260 rubber clone under the effect of tapping and
ethephon stimulation as the two main factors of exploitation stresses in plantation’s
rubber plants. There were six sample treatments; rubber trees tapped every 2, 4, and 6
days and rubber trees with 3, 6, and 12 times 2.5% ethephon stimulations a year (tapped
every 4 days). The gene was expressed only in bark tissues and were more affected by
ethephon stimulation followed by tapping rather than tapping only. The highest
expression was in 12 times a year ethephon stimulations treatment, 30 days after
opening. The gene expressions were stopped on the third month on the highest
frequency of tapping and stimulations while others were stopped on the fourth month.
POLA EKSPRESI GEN HbACO2 PADA KULIT BATANG DAN
LATEKS KARET (Hevea brasiliensis) AKIBAT STRES
EKSPLOITASI
CHAIRUNISA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2008
Judul Skripsi
: Pola Ekspresi Gen HbACO2 pada Kulit Batang dan Lateks
Karet (Hevea brasiliensis) Akibat Stres Eksploitasi
Nama
: Chairunisa
NIM
: G44104021
Disetujui
Komisi Pembimbing
Prof. Dr. drh Maria Bintang MS
Dr Tetty Chaidamsari, MSi
Ketua
Anggota
Diketahui
Dr. drh. Hasim DEA
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
PRAKATA
Puji dan syukur kepada Allah SWT atas semua karunia dan rahmat-Nya
sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi sesuai
jadwal yang penulis inginkan. Skripsi ini merupakan laporan dari penelitian
penulis yang berjudul Pola Ekspresi Gen HbACO2 pada Kulit Batang dan Lateks
Karet Akibat Stres Eksploitasi yang penulis lakukan mulai bulan Februari hingga
Juni 2008 di Laboratorium Biologi Molekuler dan Rekayasa Genetika, Balai
Penelitian Bioteknologi Perkebunan Indonesia, Bogor.
Penulis mengucapkan terima kasih kepada Prof. Dr. drh Maria Bintang MS
selaku pembimbing utama dan Dr Tetty Chaidamsari, MSi. selaku pembimbing
anggota yang telah begitu banyak memberi pengarahan dan semangat kepada
penulis selama proses penyusunan skirpsi ini. Ucapan terima kasih juga penulis
sampaikan kepada Bapak Dr Darmono Taniwiryono, MSc. sebagai Kepala Balai
Penelitian Bioteknologi Perkebunan Indonesia dan semua staf Laboratorium
Biologi Molekuler dan Rekayasa Genetika, Balai Penelitian Bioteknologi
Perkebunan Indonesia.
Tidak lupa untuk mereka yang telah berjuang bersama penulis selama masa
penelitian; Fami R, Arlyny F, Resti A dan David T, terima kasih atas bantuannya,
kepada Febri S atas dukungan dan kesabarannya membantu penulis selama
penyelesaian laporan ini, juga kepada orang tua untuk semua perhatian dan
dukungan moral serta materil. Penulis menyadari masih banyak kekurangan dalam
skripsi ini tetapi penulis berharap semoga skripsi ini dapat bermanfaat bagi
pembaca.
Bogor, Agustus 2008
RIWAYAT HIDUP
Penulis dilahirkan di Bogor, 9 Mei 1986 sebagai anak pertama dari empat
bersaudara pasangan Abid Abdul Malik dan Siti Hayatin. Tahun 2004 penulis
lulus dari SMU Negeri 1 Bogor dan pada tahun yang sama diterima masuk IPB
melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis memilih Program
Studi Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama menjadi mahasiswa aktif di IPB, penulis menjadi anggota Himpunan
Profesi (Himpro) CREBs periode 2005-2006 dan 2006-2007 sebagai anggota staf
Divisi Biokimia Tumbuhan. Selama dua tahun bergabung dengan Divisi Biokimia
Tumbuhan, penulis aktif menjadi panitia penyelenggara atau ketua kegiatan divisi
tersebut, di antaranya studium generale, pelatihan, dan seminar.
Selain itu penulis juga pernah menjadi juara pertama lomba Announcer
Contest yang diadakan oleh Fakultas Teknologi Pertanian IPB tahun 2007.
Penulis juga mengikuti lomba Program Kreatifitas Mahasiswa tahun 2007 dan
2008. Penulis melakukan praktik lapang di Balai Penelitian Tanaman Obat dan
Aromatik, Cimanggu mengenai kultur jaringan tanaman stevia.
DAFTAR ISI
Halaman
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN... 1
TINJAUAN PUSTAKA... 1
Karet (Hevea brasiliensis) ... 1
Lateks ... 2
Etilena ... 2
ACC Oksidase... 3
Etefon ... 3
RT-PCR (Reverse Transcription-Polimeration Chain Reaction)... 4
Elektroforesis gel ... 4
BAHAN DAN METODE ... 4
Bahan dan Alat... 4
Metode ... 5
HASIL DAN PEMBAHASAN ... 7
Isolasi RNA Total Sampel Kulit Batang dan Lateks ... 7
Kemurnian RNA Kulit Batang dan Lateks Hasil Isolasi ... 8
Konsentrasi RNA Kulit Batang dan Lateks Hasil Isolasi ... 9
Ekspresi Gen HbACO2 pada Kulit Batang ... 9
Pengaruh Penyadapan terhadap Ekspresi Gen HbACO2 Kulit Batang... 10
Pengaruh Etefon terhadap Ekspresi Gen HbACO2 Kulit Batang ... 11
SIMPULAN DAN SARAN ... 12
DAFTAR PUSTAKA... 12
DAFTAR TABEL
Halaman
1 Sistem perlakuan dan nomor sampel... 5
2 Nilai kemurnian RNA beberapa sampel kulit batang dan lateks... 8
3 Konsentrasi RNA beberapa sampel kulit batang dan lateks... 9
4 Tingkat ekspresi gen HbACO2 terhadap pengaruh pelukaan... 11
5 Tingkat ekspresi gen HbACO2 terhadap pemberian etefon ... 11
DAFTAR GAMBAR
Halaman
1 Monomer isoprena... 2
2 Alur singkat biosintesis etilena... 3
3 Perubahan etefon menjadi etilena pada tanaman karet... 4
4 Elektroforegram RNA lateks dengan pita yang utuh... ... 8
5 Elektroforegram RNA kulit batang ... 8
6 Elektroforegram RNA kulit batang dan RNA lateks... 9
7 Ekspresi gen HBACO2 pada beberapa sampel kulit batang... 10
8 Elektroforegram cDNA sampel lateks dengan primer aktin ... 10
9 Ekspresi gen HbACO2 terhadap pengaruh pelukaan ... 11
DAFTAR LAMPIRAN
Halaman
1 Tahapan penelitian ... 15
2 Komposisi larutan sediaan... 16
3 Tahapan isolasi RNA kulit batang (metode Chaidamsari 2005) ... 17
4 Tahapan isolasi RNA lateks (metode Chaidamsari 2005)... 18
5 Elektroforegram RNA kulit batang hasil isolasi... ... 19
6 Elektroforegram RNA lateks hasil isolasi ... 22
7 Elektroforegram cDNA sampel kulit batang... 25
8 Pola ekspresi gen HbACO2 pada kulit batang akibat pelukaan ... 27
1
PENDAHULUAN
Karet alam (poliisoprena) merupakan salah satu komoditas nonmigas penting di Indonesia. Tercatat pada tahun 2002 produksi karet alam Indonesia sebanyak 1.6 juta ton yang sebagian besar diekspor dengan nilai 1.1 milyar US dolar. Indonesia merupakan produsen karet alam terbesar kedua di dunia setelah Thailand (Nurhaimi-Haris et al 2003) Konsumsi karet alam secara keseluruhan diperkirakan telah meningkat rata-rata 5.9% per tahun sejak tahun 1900 (Budiman 2005). Meskipun saat ini dikenal juga karet sintetis dari bahan baku minyak bumi, karet alam tetap diperlukan karena sifatnya yang tak tergantikan pada beberapa alat dan barang jadi dari karet.
Pohon karet baru dapat menghasilkan lateks setelah berumur lima tahun atau lebih (Webster & Baulkwill 1989). Setiap klon tanaman karet memiliki respon berbeda terhadap stres eksploitasi bergantung pada sifat genetiknya. Penyadapan dan penggunaan stimulan (umumnya etefon) merupakan dua stres eksploitasi utama pada tanaman karet perkebunan. Respon tanaman yang kurang baik dapat berakibat pada berkurangnya masa produktif dan kualitas produksi tanaman karet dan seringkali kekurangan ini baru dapat diketahui ketika pohon karet memasuki usia produktif (5 tahun atau lebih) sehingga merugikan perkebunan. Diperlukan cara yang akurat dan efisien (terutama dalam hal waktu) untuk mengetahui kualitas produksi lateks suatu klon karet tanpa harus menunggu hingga tanaman tersebut dapat berproduksi.
Gen merupakan informasi genetik yang sangat spesifik menggambarkan sifat suatu individu. Melalui analisis gen, dapat diketahui fenotip individu bahkan sebelum gen tersebut terekspresi. Seleksi dini bibit karet yang memiliki potensi produksi lateks tinggi juga dimungkinkan melalui analisis gen-gen yang terlibat dalam metabolisme pembentukan lateks.
Gen HbACO2 merupakan salah satu gen yang terlibat dalam regulasi metabolisme pembentukan lateks dengan menyandi enzim asam aminosiklopropana-1-karboksilat oksidase (ACC oksidase atau ACO). Enzim ini berperan dalam katalisis oksidasi asam aminosiklopropana-1-karboksilat (ACC) menjadi etilena. Etilena itu sendiri dapat meningkatkan aktivitas regenerasi lateks in situ dan metabolisme biosintesis lateks (Kuswanhadi 2005; Jetro 2007). Perkebunan karet umumnya menggunakan senyawa
stimulan yang dapat meningkatkan kadar etilena endogen untuk memperpanjang waktu alir lateks.
Etefon atau asam 2-kloroetilfosfonat telah lama digunakan sebagai stimulan untuk meningkatkan kadar etilena endogen pada tanaman karet perkebunan (Kuswanhadi 2005). Pemberian etefon akan membuat waktu alir lateks lebih lama dan lateks yang dihasilkan dari satu kali penyadapan lebih banyak. Telah banyak penelitian mengenai efek etefon dan pelukaan terhadap biosintesis etilena endogenus, namun belum sampai pada pengaruhnya terhadap ekspresi gen-gen yang berperan dalam biosintesis etilena.
Penelitian ini bertujuan mempelajari pola ekspresi gen HbACO2 sebagai salah satu gen penyandi enzim ACO akibat pengaruh pelukaan dan pemberian etefon sebagai stres eksploitasi utama pada tanaman karet perkebunan. Tanaman karet yang digunakan berasal dari klon PB 260 yang memiliki sifat metabolisme lateks tinggi namun kurang responsif terhadap stimulan. Hipotesis penelitian adalah pemberian etefon pada tanaman karet akan meningkatkan ekspresi gen HbACO2. Penelitian ini diharapkan dapat memberikan informasi berupa pola ekspresi gen HbACO2 saat tanaman mulai buka sadap (umur 5 tahun) yang akan berguna dalam konstruksi penanda molekuler (marka) pada penelitian selanjutnya. Marka tersebut nantinya digunakan untuk deteksi dan seleksi dini klon karet yang mempunyai potensi produksi lateks dan toleransi stres eksploitasi yang baik terhadap pelukaan maupun penggunaan stimulan. Tahapan penelitian meliputi isolasi RNA total dari sampel lateks dan kulit batang karet, karakterisasi RNA hasil isolasi, sintesis cDNA, perbanyakan gen
HbACO2 dengan primer H4 dan pengamatan
pola ekspresi gen HbACO2.
TINJAUAN PUSTAKA
Karet (Hevea brasiliensis)Karet alam yang biasa kita kenal berasal dari tanaman Hevea Brasiliensis dan merupakan satu-satunya jenis yang ditanam untuk tujuan komersial (Webster & Baulkwill 1989). Saat ini, lateks yang diperoleh dari
Hevea brasiliensis memenuhi sekitar 98% dari
total lateks yang diproduksi di seluruh dunia (Tim Penulis PS 1998).
Tanaman karet berasal dari Brazil dan tumbuh baik pada daerah dataran rendah dengan curah hujan 2000-4000 mm/tahun dan
2
pH tanah di bawah 6.5. Pohon karet alam liar dapat tumbuh mencapai tinggi 40 meter dan hidup lebih dari 100 tahun. Tinggi tanaman karet budidaya biasanya hanya 15-25 m karena pertumbuhannya terhambat akibat penyadapan dan hanya berumur sekitar 25 tahun karena pada usia tersebut pohon karet tidak produktif lagi sehingga dilakukan penanaman ulang (Webster & Baukwil 1989). Tanaman karet yang produktif menghasilkan karet, normalnya melakukan regenerasi lateks 3-4 hari setelah penyadapan (Sumarmadji 2001). Lateks dibentuk dan terakumulasi di dalam sel-sel dan jaringan pembuluh lateks yang tersusun pada setiap bagian tanaman. Produksi lateks yang didapat dari penyadapan bergantung pada lamanya aliran dan kecepatan biosintesis lateks (Siswanto 1994). Biosintesis lateks itu sendiri ditentukan oleh ketersediaan bahan dasar pembentuk lateks berupa sukrosa dan oleh aktivitas enzim yang berperan langsung (Jacob & Prevot 1992).
Berbagai usaha telah dilakukan untuk meningkatkan produksi lateks tanaman karet, misalnya dengan pengembangan klon karet, penggunaan stimulan maupun pemberian nutrisi dan perawatan khusus yang mendukung pertumbuhan optimal tanaman (Nurhaimi-Haris et al. 2003; Tim Penulis Penebar Swadaya 2006). Beberapa contoh klon tanaman karet yang telah dikembangkan di antaranya serial klon AVROS (AVROS 33, AVROS 49, dan AVROS 80) dan serial klon TM (TM 2, TM 6, dan TM 9) yang dihasilkan oleh lembaga penelitian di pulau Sumatera. Beberapa klon yang dihasilkan oleh lembaga penelitian di Jawa adalah BD 5, GT 1, WAR 4, TJIR1, LCB 479, dan LCB 1320 (Lasminingsih et al 1994).
Klon PB 260 yang digunakan pada penelitian ini berasal dari Malaysia dan merupakan klon anjuran perkebunan skala kecil, yaitu klon yang berpotensi untuk dipromosikan menjadi klon skala besar setelah diuji daya adaptasinya secara luas dan dapat ditanam secara terbatas pada 20-40% areal penanaman (Lasminingsih et. al. 1994).
Lateks
Lateks merupakan suatu sistem kompleks larut lemak yang terdiri atas hidrokarbon karet, karbohidrat, protein, lipid, karotenoid, garam-garam mineral, enzim, dan berbagai bahan lainnya (De Boer 1950). Komponen lateks ini dapat dipisahkan menjadi tiga bagian utama, yaitu fraksi karet, fraksi serum,
dan fraksi lutoid. Pemisahan dilakukan dengan sentrifugasi pada kecepatan 17.000 rpm selama 45-60 menit (Putri 2005).
Fraksi karet berada pada lapisan atas, berwarna putih susu yang berisi partikel karet atau cis-1,4-poliisoprena (Gambar 1) dan dalam lateks segar partikel karet ini sekitar 30% yang merupakan kadar karet kering (Sumarmadji 2001). Fraksi ini juga mengandung bahan bukan karet seperti fosfolipid, lemak, lilin, protein, logam (Ca, Mg, Cu) dan enzim rubber transferase yang berperan dalam pembentukan polimer karet. Lapisan tengah merupakan fraksi serum sitosol (serum C) yang berupa cairan bening kaya protein dan mudah teroksidasi. Lapisan bawah adalah fraksi lutoid yang bersifat kental seperti gelatin, berisi cairan serum B yang terbungkus oleh membran tipis (mikrokapsul) dan rentan terhadap senyawa kimia, enzim atau bakteri sehingga menyebabkan lateks tidak stabil. Serum B ini mengandung ion kalsium dan magnesium bermuatan positif (d’ Auzac & Jacob 1989).
Biosintesis partikel karet atau cis-1,4-poliisoprena berlangsung di dalam pembuluh lateks (laticiferous vessel) dengan bahan dasar sukrosa hasil fotosintesis yang ditranspor dari daun ke dalam pembuluh lateks melalui pembuluh tapis (Dalimunthe 2004). Pembuluh lateks ini berada di jaringan floem yang terdapat di bawah permukaan kulit batang (Cornish et al 1993).
Gambar 1 Monomer isoprena (Putri 2005).
Etilena
Etilena merupakan hormon tanaman dengan struktur kimia yang paling sederhana. Tidak seperti hormon tanaman lain, etilena berwujud gas. Etilena disintesis oleh semua tanaman tingkat tinggi dan produksinya berbeda bergantung pada jenis jaringan, spesies tanaman, dan tahap perkembangan tanaman (Salisbury & Ross 1995).
Etilena berpengaruh pada berbagai aspek pertumbuhan dan perkembangan tanaman. Peranan etilena antara lain merangsang pematangan buah, pertumbuhan dan diferensiasi akar serta pucuk daun juga merangsang penuaan (senescence) bunga dan buah. Etilena juga menginduksi efek fisiologis pada jaringan tanaman, seperti peningkatan
3
laju respirasi, peningkatan aktivitas beberapa enzim, dan mempengaruhi perubahan kadar mRNA (Gidrol et al 1988). Hormon ini juga punya peranan sebagai hormon stres yang ekspresinya dipengaruhi oleh cekaman lingkungan seperti pelukaan, kekeringan, pengaruh ozon, serangan patogen, senyawa kimiawi, dan suhu ekstrem (Salisbury & Ross 1995; Wang et al 2002).
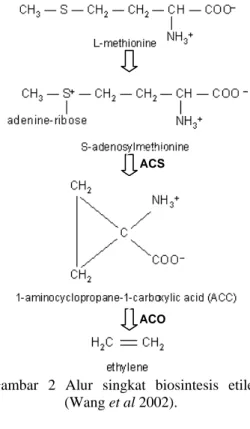
Biosintesis etilena pada tanaman tingkat tinggi dikatalisis oleh dua enzim utama, yaitu asam aminosiklopropana-1-karboksilat sintase (ACS) dan asam aminosiklopropana-1-karboksilat oksidase (ACO). Sintesis etilena terjadi melalui tiga tahap reaksi utama. Pertama, pembentukan S-adenosil metionina (SAM) lalu perubahan SAM menjadi asam aminosiklopropana-1-karboksilat (ACC) dikatalisis ACS dan tahap terakhir adalah oksidasi ACC menjadi etilena dikatalisis ACO (Wang et al 2002).
Komponen esensial pada proses ini adalah ATP. Air (H2O) dan ATP digabung dengan
metionina menghasilkan SAM dengan melepaskan tiga gugus fosfat. Enzim ACS mengatalisis perubahan SAM menjadi ACC. Tahap ini menghasilkan metiltioadenosin (MTA) yang akan digunakan kembali untuk pembentukan metionina, sehingga konsentrasi selulernya tetap terjaga saat laju biosintesis etilena meningkat (Wang et al 2002).
Selanjutnya oksigen diperlukan untuk oksidasi ACC menjadi etilena (Gambar 2).
Gambar 2 Alur singkat biosintesis etilena (Wang et al 2002).
ACC Oksidase
Enzim ACC oksidase (ACO) disebut juga
ethylene forming enzyme (EFE), merupakan
enzim yang berperan dalam katalisis oksidasi ACC menjadi etilena. Enzim ini pada Hevea
brasiliensis disandi oleh beberapa gen
(multifamili), yaitu HbACO1, HbACO2, dan
HbACO3 (Kuswanhadi et al 2005).
Gen HbACO1 memiliki panjang 1456 bp, terdiri atas tiga intron dan empat ekson dengan
open reading frame (ORF) 936 bp. Gen HbACO2 memiliki panjang 1504 bp, terdiri
atas dua intron dan tiga ekson dengan ORF 954 bp sedangkan gen HbACO3 memiliki panjang 1352 bp dengan ORF 954 bp. Ketiga gen ini memiliki homologi nukleotida sebesar 75-86%. Struktur genom dan ekspresi ketiga gen tersebut berbeda dan pada beberapa spesies, ekspresinya amat dipengaruhi faktor perkembangan tanaman dan lingkungan luar seperti pemberian stimulan, pemberian senyawa pertumbuhan (hormon), dan serangan penyakit atau pelukaan (Kuswanhadi 2005).
Etefon
Etefon (asam 2-kloroetilfosfonat) disebut juga ethylene releaser karena senyawa ini akan terdekomposisi pada jaringan tanaman membentuk etilena (gambar 3). Penelitian sebelumnya menunjukkan bahwa etilena meningkatkan tekanan internal dan perubahan pada pembuluh lateks yang menyebabkan lambatnya penyumbatan aliran lateks (Jetro 2007). Penggunaan etefon sebagai stimulan tidak ditujukan untuk meningkatkan produksi lateks secara kumulatif karena stimulasi harus diikuti dengan pengurangan frekuensi sadap untuk menghindari keletihan fisiologis tanaman.
Stimulasi etefon berlebihan dapat menginduksi terjadinya penebalan atau retakan pada kulit batang, nekrosis dan timbulnya bagian tidak produktif pada irisan sadap yang berujung pada gejala kering alur sadap (KAS). Pohon karet yang terkena KAS akan berhenti mengalirkan lateks dan diperkirakan kejadian ini menimbulkan kerugian nasional sekitar 1.7 miliar per tahun (Sumarmadji 2001).
Meski tidak dapat digunakan untuk meningkatkan jumlah produksi lateks secara keseluruhan, etefon tetap digunakan pada perkebunan karet. Keuntungan menggunakan stimulan seperti etefon adalah menghemat waktu dan tenaga penyadap karena tidak perlu terlalu sering melakukan penyadapan namun hasil yang didapat tetap sama banyaknya
ACO ACS
4
selain juga mampu menghemat penggunaan kulit batang karet (Karyudi et al 1994).
Gambar 3 Perubahan etefon menjadi etilena pada tanaman karet (Jetro 2007).
RT-PCR (Reverse Transcription-Polimeration Chain Reaction)
Secara prinsip, PCR merupakan proses replikasi berulang antara 20–35 kali. Tiap siklusnya terdiri atas tiga tahap reaksi, yaitu peleburan (melting), penempelan primer (annealing) dan pemanjangan nukleotida (elongation).
Peleburan berlangsung pada suhu tinggi (94–96°C) agar ikatan hidrogen DNA putus sehingga DNA menjadi utas tunggal. Saat itulah primer akan menempel pada sekuen DNA yang komplementer (annealing). Suhu tahap penempelan berkisar 45-60°C. Suhu yang tidak tepat dapat menyebabkan tidak terjadinya penempelan atau primer menempel di sembarang tempat. Proses elongasi membutuhkan suhu yang bergantung pada jenis DNA polimerase yang digunakan. Proses ini biasanya dilakukan pada suhu 76°C jika menggunakan Taq polimerase (Sambrook
et al 1989).
Metode RT-PCR adalah pengembangan teknik dari PCR yang prinsipnya adalah sintesis DNA dari mRNA sebagai templatnya (transkripsi balik). Enzim yang digunakan untuk proses ini adalah reverse transcriptase (RT) yang secara komersial diisolasi dari sel bakteri yang terinfeksi Moloney murine
leukemia virus (MMLV) dan Avian myleoblastosis virus (AMV). Fungsi kedua
enzim tersebut relatif sama namun berbeda pada suhu dan pH optimum (Reece 2004).
Saat proses transkripsi balik, primer oligo-dT akan menempel pada bagian poli-A mRNA. Enzim RT mengatalisis pembentukan utas pertama (first strand) cDNA dengan memasangkan basa (dNTP) yang komplementer terhadap basa pada mRNA. RNase H akan memisahkan mRNA dari molekul hibrid yang terbentuk. Enzim terminal transferase lalu mensintesis sekuen C berulang (ekor poli-C) pada ujung 3’ cDNA sebagai situs untuk penempelan primer oligo-dG. Selanjutnya terjadi pembentukan utas cDNA kedua sehingga terbentuk cDNA utas ganda (Reece 2004).
Elektroforesis Gel
Prinsip dasar teknik ini adalah bahwa DNA, RNA, atau protein memiliki muatan yang dapat dipisahkan oleh medan listrik. Gel yang digunakan biasanya berupa polimer bertaut silang (crosslinked) dengan porositas yang dapat diatur sesuai kebutuhan. Gel yang umum digunakan untuk memisahkan protein atau asam nukleat berukuran kecil adalah poliakrilamida. Pemisahan molekul yang lebih besar (lebih dari beberapa ratus basa) menggunakan gel agarosa yang dibuat dari ekstrak rumput laut yang sudah dimurnikan.
Sampel molekul ditempatkan pada sumur gel (well) di dalam larutan penyangga. Saat listrik dialirkan, molekul sampel akan bergerak di dalam matriks gel ke arah salah satu kutub listrik sesuai muatannya. Rangka gula-fosfat menyebabkan asam nukleat bermuatan negatif sehingga molekul asam nukleat akan bergerak dari elektroda negatif menuju elektroda positif. Marka (marker) ikut dielektroforesis pada lajur gel yang paralel dengan sampel. Marka atau penanda molekuler merupakan campuran molekul dengan ukuran berbeda-beda yang dapat digunakan untuk menentukan ukuran molekul pita sampel (Khopkar 1990).
Setelah proses elektroforesis selesai, dilakukan pewarnaan (staining) agar molekul sampel yang telah terpisah dapat dilihat. Etidium bromida, perak, atau pewarna biru Coomassie (Coomassie blue) dapat digunakan untuk keperluan ini. Etidium bromida yang ditambahkan pada larutan gel akan membuat molekul sampel terlihat berpendar dalam sinar ultraviolet. Gel kemudian difoto di bawah sinar ultraviolet. Pita-pita (band) yang berbeda pada gel dibandingkan letaknya pada lajur terhadap pita marka untuk menentukan ukurannya.
BAHAN DAN METODE
Bahan dan AlatBahan yang diperlukan untuk isolasi RNA antara lain sampel lateks dan kulit batang tanaman karet klon PB 260, N2 cair, PVP
(polivinyl pyrrolidone), buffer ekstraksi yang terdiri atas EDTA 20 mM, NaCl 2 M, Tris HCl 100 mM pH 8.2, CTAB
(N-cetyl-N,N,N-trimethylammoniumbromide) 2%, larutan kloroform : isoamilalkohol (Ch : IAA) 24:1, ß-merkaptoetanol, larutan fenol : kloroform : isoamilalkohol (Ph : Ch : IAA) 25:24:1, LiCl 8 M, DEPC, ddH2O, natrium asetat 3 M pH 5.8,
5
etanol absolut, dan etanol 70%. Bahan untuk elektroforesis gel agarosa antara lain bubuk agarosa (Sigma), buffer TBE (Tris basa, asam borat, EDTA) 0.5x, etidium bromida 1% (w/v), loading buffer (Brom fenol biru 2.5%, sukrosa 40%), dan marker 1 kb plus (invitrogen).
Sintesis cDNA menggunakan paket
Transcriptor First Strand cDNA Synthesis kit
(Roche), terdiri atas enzim reverse transcriptase (20 U/µL), bufer RT (5x),
inhibitor RNase (40 U/µL), dNTP, molecular
water (MW), dan primer oligo(dT)18.
Perbanyakan DNA menggunakan primer H4
forward dan reverse, buffer PCR, cDNA hasil
RT-PCR, enzim Taq polimerase (Bioron), dNTP dan MW.
Peralatan untuk isolasi RNA antara lain mortar, ruang asam, sentrifus Beckman
Allegra 64R, sentrifus Eppendorf 5417R,
penangas air, autoklaf, pipet Eppendorf,
freezer Decby (-40°C) dan Sansio (-20°C).
Uji kualitatif dan kuantitatif RNA menggunakan spektrofotometer UV-Vis
Beckman Coulter-DU 530, sisir dan cetakan
agar, bak elektroforesis, parafilm, adaptor 100 volt, UV T2201 (sigma), dan Polaroid Fuji Film FP-3000B. Amplifikasi DNA menggunakan mesin GeneAmp PCR System
2400. Peralatan gelas yang digunakan antara
lain gelas piala, gelas ukur, pipet Mohr, dan labu Erlenmeyer.
Metode
Penyadapan dan Aplikasi Stimulan
Pengambilan sampel lateks dan kulit batang tanaman Hevea brasiliensis dilakukan berdasarkan metode dari Balai Penelitian Perkebunan Sembawa (1982). Batang dilukai (disadap) sepanjang setengah spiral (s2). Etefon diberikan dengan cara dioleskan pada kulit batang di bawah irisan sadap.
Kontrol percobaan berupa kulit batang
Hevea brasiliensis yang tidak disadap; dengan
dan tanpa pemberian etefon, masing-masing satu sampel. Terdapat enam perlakuan berdasarkan frekuensi sadap dan pemberian etefon. Perlakuan berdasarkan frekuensi sadap terdiri atas pohon karet yang disadap dua hari sekali (d2), empat hari sekali (d4) dan enam hari sekali (d6). Berdasarkan pemberian etefon, perlakuan terbagi atas tiga kelompok, yaitu pohon karet yang diberi etefon tiga kali setahun (E3), enam kali setahun (E6) dan 12 kali setahun (E12) dengan penyadapan empat hari sekali. Konsentrasi etefon yang digunakan 2.5%. Jumlah sampel sebanyak 65
untuk sampel kulit batang dan 58 untuk sampel lateks (Tabel 1). Penomoran sampel dilakukan berdasarkan urutan waktu penyadapan yang dilakukan oleh Balai Penelitian Perkebunan Sembawa. Pengamatan terhadap gen ini dilakukan selama lima bulan mulai Mei hingga Oktober 2007.
Tabel 1 Sistem perlakuan dan nomor sampel Perlakuan Nomor sampel (K) Nomor sampel (L) Kontrol 1 9 (etefon) 1 9 (etefon) S2 d2 2, 8, 10, 15, 21, 22, 28, 35, 43, 50, 59 2, 8, 10, 15, 21, 22, 28, 35, 43, 50 S2 d4 3, 11, 16, 23, 29, 36, 44, 51, 60 3, 11, 16, 23, 29, 36, 44, 51 S2 d6 4, 17, 24, 30, 37, 45, 52, 61 12, 43, 63, 81, 102, 126, 147 S2 E3 d4 5, 12, 18, 25, 31, 38, 46, 53, 56, 62 5, 12, 18, 25, 31, 38, 46, 53, 56 S2 E6 d4 7, 14, 20, 27, 33, 40, 42, 48, 55, 58, 64 7, 14, 20, 27, 33, 40, 42, 48, 55, 58 S2 E12 d4 6, 13, 19, 26, 32, 34, 39, 41, 47, 49, 54, 57, 63, 65 6, 13, 19, 26, 32, 34, 39, 41, 47, 49, 54, 57 K = kulit batang; L = lateks
Isolasi RNA Kulit Batang Karet
Isolasi RNA kulit batang dilakukan menggunakan metode Chaidamsari et al (2005). Sampel kulit pohon karet 1.5 gram digerus halus dengan N2 cair dan PVP 1.5 %.
Serbuk sampel dimasukkan ke tabung sentrifusa lalu ditambah 15 mL buffer ekstraksi (suhu 65 C) yang telah ditambah 150 L -merkaptoetanol (1%) lalu dikocok kuat sekitar 1 menit. Suspensi diinkubasi dalam
waterbath (suhu 65°C) selama 1 jam sambil
dikocok kuat tiap 15 menit. Setelah inkubasi, didiamkan 5 menit pada suhu ruang kemudian diekstrak dengan 15 mL Ch : IAA (24:1) dan dikocok perlahan. Suspensi disentrifugasi 15 menit pada kecepatan 15.000 rpm, suhu 25°C.
6
Supernatan diambil (dihitung volumenya) dan dipindahkan ke tabung sentrifusa baru lalu diekstrak dengan Ph : Ch : IAA (25:24:1) sebanyak volume supernatan yang didapat kemudian disentrifugasi lagi. Ekstraksi berikutnya dengan Ch : IAA dilakukan dua kali. Tiap sentrifugasi dilakukan pada kecepatan 15.000 rpm, suhu 25°C selama 15 menit. Supernatan yang didapat ditambahkan LiCl 10 M hingga konsentrasinya 2 M kemudian disimpan pada suhu 4°C selama semalam.
Setelah itu, larutan disentrifugasi dengan kecepatan 12.000 rpm, 4°C selama 30 menit. Supernatan dibuang, pelet dilarutkan dengan 750 µL ddH2O lalu dipindahkan ke tabung
mikro. Larutan kemudian diekstrak tiga kali berturut-turut masing-masing dengan fenol, Ph : Ch : IAA dan Ch : IAA (sebanyak 1 kali volume supernatan). Tiap ekstraksi diikuti dengan sentrifugasi pada kecepatan 12.000 rpm, 15 menit dan 4°C. Lapisan atas dipindahkan ke tabung mikro baru lalu ditambahkan Na-asetat 3 M, pH 5.8 sebanyak 0.1 kali volume dan etanol absolut sebanyak 3 kali volume. Larutan disimpan dalam freezer suhu -40°C selama 3 jam.
Setelah 3 jam, larutan disentrifugasi pada kecepatan 12000 rpm, 4°C selama 30 menit. Supernatan dibuang, pelet dicuci dengan 100 L etanol 70% dan disentrifugasi pada 12.000 rpm, 4°C selama 5 menit. Etanol dibuang, pelet disentrifugasi lagi pada kecepatan 12000 rpm, 4 °C, selama 2 menit. Pelet dikeringanginkan beberapa saat lalu ditambah 30 µL DEPC.ddH2O. Jumlah inilah yang
didapat sebagai stok RNA.
Isolasi RNA Lateks
Isolasi RNA lateks dilakukan dengan metode Chaidamsari et al (2005) yang telah dimodifikasi. Sebanyak 6 mL sampel lateks yang telah ditambah 6 mL buffer ekstraksi dipanaskan pada suhu 50°C selama 1 jam lalu disentrifugasi 30 menit pada kecepatan 15000 rpm dan suhu 20°C. Supernatan dipipet (dihitung volumenya) lalu diekstrak dengan larutan Ph : Ch : IAA sebanyak 1 kali volume supernatan kemudian disentrifugasi lagi 10 menit pada kecepatan 10000 rpm, suhu 4 °C. Lapisan atas dipindahkan ke tabung sentrifusa baru dan ditambah Ch : IAA 1 kali volume, disentrifugasi lagi selama 10 menit, 10000 rpm, 4 °C. Lapisan atas diambil dan ditambah LiCl 8 M hingga konsentrasi LiCl 2 M lalu disimpan semalam pada suhu 4 °C.
Setelah semalam, larutan disentrifugasi pada kecepatan 12.000 rpm, suhu 4°C selama
30 menit. Pengerjaan selanjutnya dilakukan pada kondisi dingin (dalam penangas es). Supernatan dibuang, pelet dilarutkan dengan 750 µL ddH2O lalu dipindahkan ke tabung
mikro. Larutan diekstrak berturut-turut dengan larutan Ph : Ch : IAA dan Ch : IAA (sebanyak 1 kali volume). Tiap ekstraksi diikuti dengan sentrifugasi selama 10 menit, kecepatan 10.000 rpm pada suhu 4°C. Lapisan atas dipindahkan ke tabung baru lalu diendapkan dengan Na-asetat 3 M, pH 5.8 sebanyak 0.1 kali volume dan etanol absolut sebanyak 3 kali volume. Larutan disimpan dalam freezer pada suhu -40°C selama 3 jam.
Setelah 3 jam, larutan disentrifugasi pada kecepatan 12000 rpm, 4°C selama 30 menit. Supernatan dibuang, pelet ditambahkan 100 µL etanol 70% kemudian disentrifugasi pada kecepatan 12.000 rpm, suhu 4°C selama 5 menit. Etanol dibuang, tabung mikro berisi pelet disentrifugasi dengan kecepatan 12000 rpm, suhu 4 °C, selama 2 menit untuk mengendapkannya. Pelet dikeringanginkan beberapa saat lalu ditambah 30 µL DEPC.ddH2O.
Analisis Kemurnian dan Konsentrasi RNA
Larutan RNA lateks dan kulit batang hasil isolasi dianalisis secara kualitatif dan kuantitatif untuk mengetahui kemurnian dan konsentrasinya. Uji kemurnian RNA dilakukan dengan dua cara. Pertama dengan metode spektrofotometri, membandingkan serapan larutan RNA pada ? 260 dan 280 nm (nilai A260/280) juga pada ?260 dan 230 nm (nilai A260/230). Larutan sampel RNA sebanyak 2 µL dicampur dengan 198 µL DEPC.ddH2O dan diukur serapannya pada
panjang gelombang 230, 260, dan 280 nm. Menurut Sambrook et al (1989), kemurnian larutan RNA hasil isolasi dapat dikatakan baik jika nilai perbandingan serapan 260/280 nm antara 1.8-2.0.
Cara kedua dengan elektroforesis, sebanyak 5 µL sampel RNA dicampur dengan 1 µL loading buffer menggunakan pipet mikro di atas kertas parafilm. Sampel yang telah dicampur dimasukkan ke dalam sumur gel dan dielektroforesis pada gel agarosa 1%, tegangan 25 volt selama 2 jam. Setelah itu, gel difoto dengan bantuan sinar UV dan jumlah pita yang terbentuk diamati. Bila dari hasil elektroforesis masih terdapat pita DNA maka ditambahkan enzim DNase pada larutan RNA lalu diinkubasi pada suhu dan waktu optimum kerja enzim DNase. Konsentrasi RNA (uji kuantitatif) ditentukan dengan cara konversi nilai serapan larutan RNA pada panjang
7
gelombang 260 nm dengan perbandingan bahwa 1 nilai pada serapan 260 nm sama dengan serapan RNA dengan konsentrasi 40 µg/mL (Sauer et al 1994).
Sintesis cDNA
Proses ini dilakukan dengan metode RT-PCR untuk mendapatkan utas pertama cDNA yang akan digunakan sebagai templat (cetakan) untuk uji ekspresi gen HbACO2. Sebanyak 2 µg/mL larutan RNA sampel kulit batang dan lateks hasil isolasi ditambahkan 1 µL primer oligo(dT)18 dan molecular water (MW) hingga volume totalnya 13 µL. Campuran kemudian diinkubasi dalam mesin PCR (Fermentas) pada suhu 65°C selama 10 menit.
Setelah 10 menit, semua tabung dipindahkan segera ke penangas es lalu ditambahkan larutan campuran yang berisi 4 µL bufer RT, 1 µL inhibitor RNase (40 U/µL), 2 µL dNTP sebagai substrat, dan 1 µL enzim reverse transcriptase (20 U/µL). Tabung kemudian dimasukkan lagi ke dalam mesin PCR dan diinkubasi pada suhu 55 °C selama 30 menit dilanjutkan dengan inkubasi pada suhu 85°C (5 menit) untuk inaktivasi enzim dan mendenaturasi DNA. Terakhir, suhu dikondisikan 10°C dan dapat dibiarkan selama yang diinginkan.
Uji Ekspresi Gen HbACO2
Uji ekspresi gen HbACO2 dilakukan dengan elektroforesis hasil PCR cDNA dengan primer H4. Metode PCR berdasarkan prosedur pada Kit Roche. Pertama, dibuat larutan campuran berisi 2.5 µL buffer
complete RT-PCR (Roche), 1 µL dNTP, 1 µL
primer H4 Forward, 1 µL primer H4 Reverse, 1 µL enzim Taq polimerase dan 17.5 µL MW (total 24 µL). Volume larutan campuran yang dibuat dikalikan sesuai jumlah sampel. Tiap 24 µL larutan campuran dipipet ke dalam tabung mikro, diletakkan dalam penangas es lalu ditambahkan 1 µL cDNA sampel. Primer aktin ditambahkan pada sampel yang perlu diketahui kualitas cDNA-nya.
Larutan diinkubasi dalam mesin PCR (Fermentas) yang telah diatur suhu dan waktunya. Denaturasi pada suhu 94°C selama 30 detik, suhu penempelan primer 55°C selama 1 menit dilanjutkan dengan 72°C selama 1 menit untuk aktivasi enzim Taq polimerase dan suhu 72°C selama 7 menit untuk proses polimerasi. Proses PCR dilakukan sebanyak 35 siklus. Setelah itu, dilakukan inaktivasi enzim Taq polimerase pada suhu 10°C.
HASIL DAN PEMBAHASAN
Isolasi RNA Total Sampel Kulit Batang danLateks
Gen HbACO2 dicari pada kulit batang
Hevea brasiliensis karena jaringan ini merupakan tempat terjadinya metabolisme pembentukan lateks tepatnya pada pembuluh lateks atau laticiferous vessel (Dalimunthe 2001). Ekspresi gen ini juga diamati pada lateks sebagai produk dari pembuluh lateks tanaman karet.
Isolasi RNA untuk sampel kulit batang dimulai dengan penggerusan sampel yang bertujuan menghancurkan dinding sel. Umumnya RNA lebih rentan terhadap degradasi enzimatik dibandingkan DNA sehingga senyawa diethyl pirocarbonate (DEPC) ditambahkan sebagai denaturan kuat untuk mencegah kerja RNase, yaitu enzim yang dapat mendenaturasi RNA. Hancurnya dinding sel menyebabkan sitoplasma beserta RNA total keluar dari sel sehingga mudah diekstrak. Nitrogen cair diperlukan pada proses ini untuk menjaga agar RNase tetap inaktif selain juga untuk membekukan jaringan agar mudah dihancurkan (Koolman & Roehm 2005). Polivinil pirolidon ditambahkan untuk mengikat polifenol. Polifenol merupakan senyawa umum pada jaringan tanaman yang dapat menginaktifkan protein sehingga menghambat reaksi lanjutan seperti PCR (Knight 2004).
Komponen cetyl trimethylammonium bromide (CTAB) dalam buffer ekstraksi
berfungsi sebagai antiseptik terhadap bakteri dan jamur. EDTA berguna untuk mengikat Mg2+ (chelating agent) sehingga mempermudah lisis membran sel dan menghambat kerja RNase (Mg2+ merupakan kofaktor RNase). Merkaptoetanol bekerja sebagai antioksidan yang memangsa (scavenging agent) radikal hidroksil (Knight 2004) sedangkan tris-HCl merupakan komponen bufer untuk menjaga kestabilan pH larutan.
Penggunaan senyawa pelarut organik seperti fenol, kloroform dan isoamilalkohol pada proses ekstraksi bertujuan memisahkan kontaminan seperti DNA dan protein dari RNA. Enzim DNase ditambahkan pada sampel yang masih mengandung DNA untuk mendegradasi DNA. Senyawa LiCl, natrium asetat dan etanol berguna untuk mengendapkan RNA sehingga RNA dapat terpisah dari senyawa kontaminan (Chaidamsari et al 2005).
8
28 S 18 S 10 11 12 13 DNA15 22 23
Isolasi RNA yang baik akan menghasilkan dua pita utuh (Gambar 4). Kedua pita tersebut adalah rRNA berukuran 28 S dan 18 S yang merupakan rRNA sitoplasma utama pada tanaman (Heldt 2005).
Gambar 4 Elektroforegram RNA lateks dengan pita yang utuh.
Kemurnian RNA Kulit Batang dan Lateks Hasil Isolasi
Kemurnian RNA kulit batang dan lateks
Hevea brasiliensis hasil isolasi ditentukan
dengan metode spektrofotometri dan elektroforesis. Pengukuran serapan larutan dilakukan pada panjang gelombang 230, 260 dan 280 nm. Basa-basa bernitrogen pada molekul RNA menyerap sinar ultraviolet (UV) maksimum pada panjang gelombang 260 nm. Berbeda dengan asam nukleat, kontaminan protein memiliki serapan UV maksimum pada panjang gelombang 280 nm. Kontaminasi fenol dapat diketahui pada panjang gelombang 230 nm. Selain fenol, garam-garam chaotropic juga dapat menimbulkan puncak (peak) pada ? 220-230 (Sruhig & Amberger 1994).
Larutan RNA dikatakan memiliki kemurnian yang baik apabila nilai perbandingan serapan ? 260/280 nm dan serapan ? 260/230 nm antara 1.8-2.0 (Sambrook et al 1989). Bila nilai perbandingan kurang dari 1.8, larutan RNA tersebut dapat dikatakan masih banyak mengandung kontaminan seperti protein, fenol, garam-garam chaotropic atau polisakarida. Jika nilai perbandingan melebihi 2, kemungkinan besar masih terdapat DNA dalam larutan. Hal ini karena serapan maksimum DNA sama dengan RNA (260 nm) sehingga adanya DNA dalam larutan akan membuat nilai perbandingan serapan RNA lebih tinggi (O’Connell 2002). Elektroforesis diperlukan untuk memastikan adanya DNA kontaminan dalam sampel.
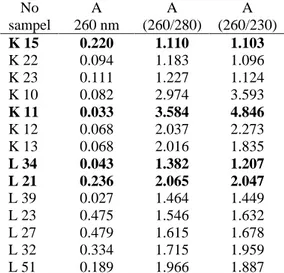
Tabel 2 menunjukkan beberapa contoh kemurnian sampel RNA kulit batang dan lateks beserta nilai perbandingan serapan tertinggi dan terendahnya masing-masing (cetak tebal). Nilai kemurnian RNA kulit batang berkisar antara 1.110-3.584 sedangkan RNA lateks berkisar antara 1.382-2.070.
Dilihat dari nilai tersebut, secara umum dapat dikatakan hasil isolasi RNA lateks relatif lebih tinggi kemurniannya dibanding RNA kulit batang. Kisaran nilai kemurnian RNA kulit batang menunjukkan bahwa beberapa sampel RNA kulit batang masih mengandung kontaminan. Hal ini dapat terjadi disebabkan terbawanya fase fenolik saat proses ekstraksi. Selain itu, isolasi RNA kulit batang lebih sulit mendapatkan kemurnian tinggi karena lebih banyak mengandung senyawa polifenol dan polisakarida dibandingkan sampel lateks. Kontaminan DNA akan terlihat setelah hasil elektroforesis gel dilihat dengan bantuan sinar UV seperti pada sampel nomor 10, 11, 12, 13 yang nilai perbandingan serapannya lebih dari 2.0 (Gambar 5). Sampel yang masih terkontaminasi DNA akan ditambah dengan enzim DNase untuk mendegradasi DNA sebelum digunakan untuk proses RT-PCR.
Tabel 2 Nilai kemurnian RNA beberapa sampel kulit batang dan lateks No sampel A 260 nm A (260/280) A (260/230) K 15 0.220 1.110 1.103 K 22 0.094 1.183 1.096 K 23 0.111 1.227 1.124 K 10 0.082 2.974 3.593 K 11 0.033 3.584 4.846 K 12 0.068 2.037 2.273 K 13 0.068 2.016 1.835 L 34 0.043 1.382 1.207 L 21 0.236 2.065 2.047 L 39 0.027 1.464 1.449 L 23 0.475 1.546 1.632 L 27 0.479 1.615 1.678 L 32 0.334 1.715 1.959 L 51 0.189 1.966 1.887
K = kulit batang; L = lateks; A = nilai serapan
(a) (b)
Gambar 5 Elektroforegram RNA kulit batang (a) nilai kemurnian kurang dari 1.8 (b) nilai kemurnian lebih dari 2.0.
RNA 28 S RNA 18 S
9
Konsentrasi RNA Kulit Batang dan Lateks Hasil Isolasi
Konsentrasi RNA hasil isolasi diperkirakan dengan cara spektrofotometri. Menurut Sauer et al 1994, satu nilai serapan (A) larutan RNA pada panjang gelombang 260 nm merupakan serapan RNA dengan konsentrasi 40 g/mL sehingga konsentrasi RNA didapat dari perhitungan nilai serapan larutan RNA pada ? 260 nm dikalikan 40 g/mL dikalikan faktor pengenceran (100 kali). Tabel 3 menunjukkan beberapa contoh konsentrasi RNA kulit batang dan lateks beserta nilai tertinggi dan terendahnya masing-masing (cetak tebal). Konsentrasi RNA kulit batang bervariasi antara 104 hingga 1012 µg/mL sedangkan konsentrasi RNA lateks berkisar antara 108 hingga 3798 µg/mL.
Konsentrasi RNA hasil perhitungan dikonfirmasi dengan elektroforesis, caranya dengan membandingkan tingkat kecerahan pita RNA pada gel. Konsentrasi larutan RNA yang digunakan untuk elektroforesis dibuat sama, yaitu 250 g/mL dengan tujuan agar intensitas cahaya yang dihasilkan oleh semua pita sampel dapat dibandingkan.
Secara teori, pada pita RNA yang utuh, makin cerah pita RNA pada gel, makin tinggi konsentrasinya. Hal ini tidak berlaku jika kita mengamati pita RNA kulit batang nomor 27 (konsentrasi tertinggi) dan nomor 58 (konsentrasi terendah) yang tingkat kecerahan pitanya hampir sama. Kejadian ini menunjukkan bahwa konsentrasi RNA nomor 27 sebenarnya lebih rendah daripada yang terukur oleh spektrofotometer akibat sampel tersebut tidak murni. Kontaminasi DNA dapat menyebabkan nilai perbandingan serapan larutan RNA lebih tinggi (Gambar 6).
Terlihat juga dari tingkat kecerahan dan keutuhan pita, secara umum dapat dikatakan perolehan konsentrasi RNA lateks lebih tinggi daripada RNA kulit batang (Tabel 3). Perbedaan perolehan konsentrasi antara RNA kulit batang dan RNA lateks dapat disebabkan karena kurang halusnya bubuk kulit batang saat digerus. Semakin halus bubuk kulit batang, semakin luas permukaannya sehingga makin banyak sel yang dapat diekstrak. Lateks lebih mudah diekstrak RNA-nya karena tidak berupa sel (hanya cairan). Konsentrasi RNA kulit batang yang rendah dapat juga disebabkan oleh proses pengocokan yang kurang kuat saat ekstraksi dengan buffer ekstraksi sehingga tidak semua sel kulit batang terlisis.
Tabel 3 Konsentrasi RNA beberapa sampel kulit batang dan lateks
No sampel A (260 nm) Konsentrasi ( g/mL) K 27 0.253 1012 K 58 0.026 104 K 45 0.105 420 K 46 0.078 312 K 47 0.116 464 K 48 0.159 636 L 17 0.633 3798 L 39 0.027 108 L 45 0.330 1320 L 46 0.336 1344 L 47 0.353 1412 L 48 0.317 1268 K = kulit batang; L = lateks
(a) (b)
Gambar 6 Elektroferegram (a) RNA kulit batang konsentrasi rendah (b) RNA lateks konsentrasi tinggi.
Ekspresi Gen HbACO2 pada Kulit Batang
Terekspresi atau tidaknya gen HbACO2 dilihat dari ada tidaknya pita gen pada gel elektroforesis sedangkan tingkat ekspresinya dilihat dan dibandingkan dari intensitas kecerahan pita. Ukuran gen HbACO2 adalah 510 bp sehingga pita DNA yang dicari adalah yang sejajar atau dekat dengan pita marker kelima dari bawah (ukuran 500 bp).
Pengamatan selama lima bulan menunjukkan bahwa gen HbACO2 pada kulit batang terekspresi tiga hari setelah pemberian etefon. Kontrol kulit batang dengan pemberian etefon (K1) memiliki tingkat ekspresi amat tinggi sementara kontrol kulit batang tanpa etefon (K9) tidak menunjukkan ekspresi gen ini (Gambar 7).
Sampel beserta kontrol lateks dengan dan tanpa pemberian etefon (L1 dan L9) tidak memperlihatkan ekspresi gen HbACO2 (tidak muncul pita DNA pada gel) sehingga diduga bahwa gen HbACO2 tidak terekspresi pada
45 46 47 48 45 46 47 48
10
lateks. Sampel lateks tersebut kemudian dielektroforesis lagi dengan menambahkan primer aktin untuk memastikan ada tidaknya RNA total dalam larutan. Elektroforegram menunjukkan hanya terdapat pita aktin pada semua sampel lateks yang diuji kembali tanpa ada pita lain pada gel (Gambar 8). Hal ini dilihat dari ukuran pita yang muncul pada gel terletak antara pita marker kedua (200 bp) dan ketiga (300 bp) dari bawah yang sesuai dengan ukuran aktin yaitu 290 bp. Hasil ini memastikan bahwa gen HbACO2 memang tidak terekspresi pada lateks.
Aktin adalah komponen mikrofilamen, merupakan protein yang paling melimpah di dalam sel eukariot dan selalu dibutuhkan oleh sel (Koolman & Roehm 2005). Protein yang selalu dibutuhkan oleh sel, akan disintesis secara konstan sehingga mRNA-nya akan selalu ada pada sitoplasma tanpa terpengaruh kondisi perlakuan. Sifat tersebut membuat mRNA aktin dalam sampel uji dapat dijadikan kontrol internal sebagai petunjuk bahwa pada larutan hasil isolasi mengandung RNA total.
Terkadang pita hasil elektroforesis tidak utuh tetapi memanjang vertikal dan buram (smear). Hal ini dapat disebabkan RNA terdegradasi (rusak) akibat aktivitas enzim atau suhu annealing yang tidak tepat. Munculnya pita lain pada gel dapat disebabkan primer yang digunakan kurang spesifik sehingga primer menempel di sembarang tempat dan akhirnya pita DNA yang muncul lebih dari satu.
Gambar 7 Ekspresi gen HbACO2 pada beberapa sampel kulit batang.
Gambar 8 Elektroforegram cDNA sampel lateks dengan primer aktin.
Pengaruh Penyadapan terhadap Ekspresi Gen HbACO2 Kulit Batang
Tinggi rendahnya ekspresi gen HbACO2 dapat dilihat dari tingkat kecerahan pita DNA pada gel elektroforesis yang dapat juga dinyatakan secara semikuantitatif menggunakan program UN-SCAN-IT Gel 6.1. Prinsip program tersebut membandingkan nilai piksel pita sampel yang terdeteksi dengan nilai piksel pita marka sebagai standar yang diberi nilai tertentu kemudian dikonversi menjadi satuan konsentrasi (ng) melalui persamaan kurva standar. Konsentrasi pita gen yang dihasilkan dari program ini lebih tepat diinterpretasikan sebagai tingkat ekspresi gen (Tabel 4).
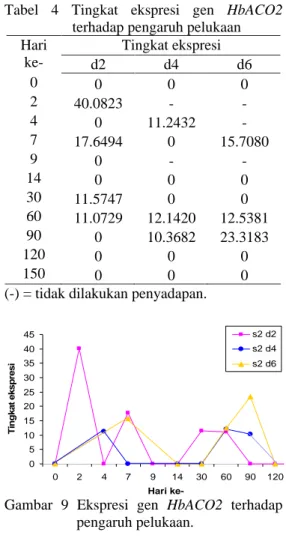
Hasil uji ekspresi gen HbACO2 pada sampel kulit batang menunjukkan gen
HbACO2 mulai terekspresi pada penyadapan
kedua dengan ekspresi paling tinggi pada frekuensi penyadapan dua hari sekali (s2d2). Ekspresi gen HbACO2 pada frekuensi
penyadapan empat (s2d4) dan enam hari sekali (s2d6) tidak jauh berbeda (Gambar 9).
Setelah seminggu, pengambilan sampel tidak dilakukan per hari perlakuan penyadapan tetapi diambil bersamaan sebulan sekali hingga bulan kelima. Pengamatan per bulan menunjukkan ekspresi tertinggi gen HbACO2 terjadi pada bulan pertama untuk penyadapan s2d2, bulan kedua untuk penyadapan s2d4 dan bulan ketiga untuk penyadapan s2d6.
Gen HbACO2 paling sering dan paling tinggi ekspresinya pada kelompok s2d2 namun ekspresi gen ini juga berhenti lebih awal, yaitu pada bulan ketiga sementara kedua kelompok lain terhenti pada bulan keempat. Hal ini memberi kemungkinan bahwa penyadapan dengan frekuensi tinggi (kurang dari 4 hari sekali) menginduksi ekspresi gen HbACO2 lebih tinggi dan sering tetapi juga lebih cepat terhentinya.
Ekspresi gen HbACO2 yang cenderung lebih tinggi pada kelompok s2d2 diakibatkan pelukaan tanaman karena penyadapan. Seperti yang telah disebutkan, etilena merupakan salah satu hormon tanaman yang merespon cekaman lingkungan (Salisbury & Ross 1995; Wang et al 2002). Penyadapan direspon tanaman sebagai salah satu cekaman lingkungan berupa pelukaan. Intensitas pelukaan tanaman yang lebih sering akan meningkatkan ekspresi gen HbACO2 sebagai salah satu anggota gen multifamili penyandi enzim ACO yang berperan dalam katalisis reaksi perubahan asam aminosiklopropana karboksilat menjadi etilena.
1 7 2 3 4 5 6 9 8 14 10 11 12 13 14 15 1 7 2 3 4 5 6 9 8 14 10 11 12 13 20 15 16 17 18 19
11
Tabel 4 Tingkat ekspresi gen HbACO2 terhadap pengaruh pelukaan
Tingkat ekspresi Hari ke- d2 d4 d6 0 0 0 0 2 40.0823 - - 4 0 11.2432 - 7 17.6494 0 15.7080 9 0 - - 14 0 0 0 30 11.5747 0 0 60 11.0729 12.1420 12.5381 90 0 10.3682 23.3183 120 0 0 0 150 0 0 0
(-) = tidak dilakukan penyadapan.
0 5 10 15 20 25 30 35 40 45 0 2 4 7 9 14 30 60 90 120 Hari ke-T in g k a t e k s p re s i s2 d2 s2 d4 s2 d6
Gambar 9 Ekspresi gen HbACO2 terhadap pengaruh pelukaan.
Pengaruh Etefon terhadap Ekpresi gen HbACO2 Kulit Batang
Etefon sebagai stimulan lateks ikut diteliti pengaruhnya terhadap ekspresi gen HbACO2 karena selain sebagai yang paling umum diapakai di perkebunan, juga telah terbukti mempengaruhi kadar etilena endogenus tanaman (Jetro 2007). Tabel 5 memperlihatkan ekspresi tertinggi gen
HbACO2 sampel tanpa etefon (s2d4) masih
jauh di bawah ekspresi tertinggi sampel dengan pemberian etefon meski frekuensi penyadapannya sama, yaitu empat hari sekali. Hal ini menunjukkan pengaruh etefon dalam meningkatkan ekspresi gen HbACO2.
Gen HbACO2 terekspresi tiga hari setelah pemberian etefon yang merupakan ekspresi tertinggi untuk perlakuan etefon tiga (E3) dan enam (E6) kali setahun. Ekspresi gen
HbACO2 perlakuan etefon 12 kali setahun
(E12) mencapai puncaknya sebulan setelah buka sadap dan tidak terekspresi lagi pada bulan ketiga meskipun tetap diberi etefon hingga bulan kelima. Serupa dengan efek penyadapan s2d2, ekspresi gen HbACO2
kelompok E12 juga berhenti lebih awal dari dua kelompok lainnya yang baru berhenti pada bulan keempat (Gambar 10). Penyadapan yang lebih cepat dari waktu normal regenerasi lateks, yaitu 4-5 hari (Sumarmadji 2001) dan pemberian etefon terlalu sering, yaitu lebih dari 6 kali setahun (Balai Penelitian Perkebunan Sembawa 2007) mempercepat terhentinya ekspresi gen HbACO2. Kenaikan ekspresi gen HbACO2 pada sampel yang diberi etefon diduga merupakan regulasi sel untuk menjaga kestabilan kadar etilena endogen tanaman akibat cekaman fisiologis. Secara umum, gen HbACO2 hanya terekspresi tiga bulan di awal tahun kelima tanaman. Hal ini karena HbACO2 merupakan transient gene, yaitu gen yang hanya diekspresikan selama periode tertentu pada tahap perkembangan tanaman (Kuswanhadi 2005).
Tabel 5 Tingkat ekspresi gen HbACO2 terhadap pemberian etefon
Tingkat ekspresi Hari ke- E3 E6 E12 0 0 0 0 4 0 0 0 7 62.4025 52.5320 13.9315 14 0 41.6450 65.6524 30 0 13.2598 105.7287 34 - - 11.3065 60 14.1538 19.7488 12.2506 64 - 11.3829 20.7655 90 38.8135 17.8039 0 94 - - 0 120 0 0 0 124 0 0 0 150 0 0 0 154 - - 0
(-) = tidak dilakukan penyadapan; cetak tebal merupakan hari pemberian etefon
0 20 40 60 80 100 120 0 4 7 14 30 34 60 64 90 94 120 Hari ke-T in g k a t e k s p re s i s2 d4 s2 E6 d4 s2 E3 d4 s2 E12 d4
Gambar 10 Ekspresi gen HbACO2 terhadap pengaruh pemberian etefon.
12
SIMPULAN DAN SARAN
SimpulanEkspresi gen HbACO2 lebih dipengaruhi pelukaan disertai pemberian etefon dibanding pelukaan saja. Ekspresi gen ini hanya terdapat di kulit batang dengan tingkat tertinggi pada perlakuan stimulasi etefon 12 kali setahun, 30 hari setelah tanaman buka sadap. Ekspresi gen
HbACO2 terhenti di bulan ketiga pada
intensitas penyadapan dan pemberian stimulan (etefon) paling sering sementara pada sisa perlakuan lainnya, ekspresi gen ini terhenti di bulan keempat.
Saran
Disarankan agar penelitian dilanjutkan pada sisa bulan tahun pertama masa produktif tanaman (5 tahun) agar diketahui efek etefon dan pelukaan secara menyeluruh terhadap ekspresi gen HbACO2.
DAFTAR PUSTAKA
Balai Penelitian Perkebunan Sembawa. 1982.
Penyadapan Tanaman Karet (Seri Pedoman No. 1). Palembang: Balai
Penelitian Perkebunan Sembawa.
Budiman AFS. 2005. Perkembangan global karet alam dan tantangan bagi Indonesia. Warta Perkaretan 2:1-7.
Chaidamsari T. 2005. Biotechnology for
Cacao Pod Borer Resistance in Cacao.
Netherlands: Wagenigen University.
Cornish K, Pan Z, Backhaus RA. 1993.
Engineering New Domestic Sources of Natural Rubber. New York: Wiley &
Sons.
Dalimunthe A. 2004. Biosintesis lateks [skripsi]. Medan: Fakultas Kehutanan, Universitas Sumatera Utara.
De Boer G. 1952. Pengetahuan Praktis
Tentang Karet. Bogor: Balai Penyelidikan Karet Indonesia.
d’ Auzac J, JL Jacob. 1989. The composition of latex from Hevea brasiliensis as a laticiferous cytoplasm. Physiology of
Rubber Tree Latex 3:59-98.
Gidrol X, Herve Chrestin, Gilles Mounoury, Jean D’Auzac. 1988. Early activation by ethylene of the tonoplast H+ -pumping ATPase in the latex from
Hevea brasiliensis. Plant Physiology
86: 899-903.
Heldt HW. 2005. Plant Biochemistry Third
Edition. USA: Elsevier Academic
Press.
Jacob JL, Prevot JC. 1992. Metabolism of the
Laticiferous System and Its Biochemical Regulation. USA: Elsevier
Academic Press.
Jetro NN, Simon GM. 2007. Effects of 2-chloroethylphosponic acid formulations as yield stimulants on Hevea brasiliensis. Africa J Biotechnol
5:523-528.
Khopkar SM. 1990. Konsep Dasar Kimia
Analitik. Jakarta: UI Press.
Knight JJ. 2004. Encyclopedia of Reagents for
Organic Synthesis. New York: Wiley &
Sons.
Koolman J, KH Roehm. 2005. Color Atlas of
Biochemistry. Edisi ke-2. New York:
Thieme.
Kuswanhadi et al. 2005. Isolation and
characterization of three members of the multigenic family encoding ACC oxidase from H. brasiliensis during plant development. Montpeller: Cedex.
Lasminingsih et al. 1994. Deskripsi Klon
Karet Anjuran pada Tanaman Muda.
Palembang: Balai Penelitian Sembawa.
Nurhaimi-Haris et al. 2003. Kemiripan genetik klon karet (Hevea brasiliensis Muell. Arg.) berdasarkan metode Amplified
Fragment Length Polymorphisms (AFLP). Menara Perkebunan 1:1-15.
O’Connell J. 2002. Methods in Molecular
Biologi: RT-PCR Protocols. Totowa:
Humana Press.
Putri FDRS. 2005. Optimasi penetapan kadar protein antigen lateks karet alam (Hevea brasiliensis) dan produk jadinya [Skripsi]. Bogor: Fakultas
13
Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Pakianathan SW, Haridas, J d’Auzac. 1989. Water relation on latex flow.
Physiology of Rubber Tree Latex
9:233-256.
Reece RJ. 2004. Analyses of Genes and
Genomes. England: John Willey &
Sons.
Salisbury FB, Ross CW. 1995. Fisiologi
Tumbuhan Jilid 3. R Lukman dan
Sumaryono, penerjemah. Bandung: Penerbit ITB. Terjemahan dari: Plant
Phsiology, 4th Edition.
Sambrook et al. 1989. Molecular Cloning :
Laboratory Manual. New York: Cold
Spring Harbour Laboratory Press.
Sauer P, Miller M, Kong. 1998. Quantification of DNA. Qiagen News 2:23.
Siswanto. 1994. Mekanisme fisiologis yang berkaitan dengan produksi lateks
Hevea brasiliensis. Buletin Bioteknologi Perkebunan 1:23-29.
Sruhig TM, Amberger A. 1994. Exposing contaminating phenol in nucleic acid preparations. Biotechnologies 16:403
Sumarmadji. 2001. Pengendalian kering alur sadap dan nekrosis pada kulit tanaman karet. Warta Pusat Penelitian Karet 3:76-88.
Tim Penulis Penebar Swadaya. 2006. Karet:
Budi Daya dan Pengolahan, Strategi Pemasaran. Jakarta: Penebar Swadaya.
Webster CC, Baulkwill WJ. 1989. Rubber. New York: John Wiley & Sons.
Wang KLC, Li H, Ecker JR. 2002. Ethylene biosynthesis and signaling networks.
Plant Cell 14:131-151.