1 BAB I PENDAHULUAN
A. Latar Belakang
Akhir-akhir ini di tengah banyaknya jenisobat modern di pasaran dan munculnya berbagai jenis obatmodern yang baru, terdapat kecenderungan global untukkembali ke alam (back to nature). Faktor yang mendorongmasyarakat untuk mendayagunakan obat bahan alam antaralain mahalnya harga obat modern/sintetis dan banyaknyaefek samping. Oleh karena itu obat bahan alam menjadi semakinpopuler dan penggunaannya meningkat(Pramono, 2002).
Definisi obat tradisional ialah bahan atau ramuan bahanyang berasal dari tumbuhan, hewan, mineral, sediaan sarian(galenik) atau campuran dari bahan tersebut, yang secaraturun temurun telah digunakan untuk pengobatanberdasarkan pengalaman. Obat tradisional biasanya digunakan untuk memelihara kesehatan,mencegah penyakit, mengobati penyakit maupun memulihkan kesehatan (Anonim, 2000).
Salah satu sumber obat tradisional tersebut adalah cacing tanah. Cacing tanah dipercaya oleh masyarakat sebagai salah satu obat alami yang dapat membantu menyembuhkan berbagai macam penyakit. Sebagaimana tertulis dalam catatan pengobatan tradisional Cina, Ben Cao Gang Mu, cacing tanah telah digunakan sejak ribuan tahun lalu sebagai salah satu ramuan obat serta dipercaya dapat menurunkan demam dan membantu memperlancar peredaran darah (Cooper &
Yamaguchi, 2002).Penelitian dan pengkajian lebih dalam mengungkapkan cacing tanah memiliki aktivitas antimikroba (Popovićet al., 2005), antiinflamasi (Balamurugan et al., 2009), antikanker (Chen et al., 2007), antitrombotik dan trombolitik (Trisina et al., 2011).
Seperti halnya obat tradisional lain, cacing tanah dianggap relatif lebih aman untuk pengobatan dibandingkan obat sintetis. Namun, obat tradisional juga dapat memiliki efek samping yang merugikan bila penggunaannyakurang tepat. Bahan yang aman pada dosis kecil kemungkinan dapat berbahaya atau toksis jika digunakan dalam dosis besar dan atau waktu lama. Efek samping yang mungkin timbul dapat diminimalkan jika diperoleh informasi yang cukup serta penggunaan obat tradisional yang tepat berdasarkan pendekatan ilmiah yang rasional. Ketepatan itu menyangkut tepat dosis, cara dan waktu penggunaanserta pemilihan bahan ramuan yang sesuai dengan indikasi penggunaannya(Katno, 2008).
Selain itu, agar serbuk cacing tanah (Lumbricus rubellus) sebagai obat tradisional dapat diterima di pelayanankesehatan formal, maka hasil data empirik harusdidukung oleh bukti ilmiah adanya khasiat dan keamananpenggunaannya pada manusia.Bukti tersebut hanya dapatdiperoleh dari penelitian yang dilakukan secara sistematik. Salah satu tahapan pengembangan obat tradisional adalah uji preklinik yang terdiri atas uji toksisitas dan uji farmakodinamik (Dewoto, 2007).
Penelitian uji toksisitas serbuk cacing tanah perlu dilakukan untuk menetapkan nilai potensi ketoksikan akut (LD50cut-off), mengetahui gejala toksik, wujud dan spektrum efek toksik pada organ vital akibat pemejanan oral serbuk cacing tanah. Hasil penelitian ini diharapkan dapat menjadi dasar ilmiah dalam
penggunaan serbuk cacing tanah secara rasional, melindungi masyarakat dari efek samping yang mungkin merugikan serta dapat dimanfaatkan untuk pengembangan serbuk cacing tanah menjadi obat herbal terstandar maupun fitofarmaka.
B. Rumusan Masalah
1. Berapakahnilai potensi ketoksikan akut (LD50cut-off)serbuk cacing tanah yang diberikan secara oral pada mencit jantan galur Swiss?
2. Apa sajakahgejala toksik yang muncul setelah pemejanan serbuk cacing tanah secara oral pada mencit jantan galur Swiss?
3. Bagaimanakahwujud dan spektrum efek toksik akibat pemejanan oral serbuk cacing tanah berdasarkan hasil pengamatan gross patologi dan histopatologispadaorganhati, paru-paru, lambung, limpa, jantung, usus, testis dan ginjal mencit jantan galur Swiss?
C. Tujuan Penelitian
1. Menetapkannilai potensi ketoksikan akut (LD50cut-off)serbuk cacing tanah yang diberikan secara oral pada mencit jantan galur Swiss
2. Mengetahui gejala toksik yang timbul setelah pemejanan serbuk cacing tanah secara oral pada mencit jantan galur Swiss
3. Mengetahui wujud dan spektrum efek toksik akibat pemejanan oral serbuk cacing tanah berdasarkan hasil pengamatan histopatologis padaorganhati, paru-paru, lambung, limpa, jantung, usus, testis dan ginjal mencit jantan galur Swiss
D. Tinjauan Pustaka 1. Cacing Tanah (Lumbricus rubellus)
a.
Cacing tanah tergolong dalam kelompok binatang avertebrata (tidak bertulang belakang) sehingga sering disebut binatang lunak. Binatang ini banyak dijumpai di tempat-tempat lembap. Seluruh tubuhnya tersusun atas segmen-segmen yang berbentuk cincin sehingga digolongkan dalam filum Annelida. Di setiap segmen terdapat rambut yang keras dan berukuran pendek yang juga disebut seta. Oleh karena jumlah seta pada tubuh cacing sangat sedikit maka cacing ini dimasukkan dalam kelas Oligochaeta.Kelas Oligochaeta dibagi menjadi 12 famili, satu diantaranya adalah Lumbricidae(Palungkun, 2010).
Berikut ini taksonomi cacing tanah: Kingdom : Animalia Filum : Annelida Subfilum : Clitellata Kelas : Oligochaeta Ordo : Haplotaxida Sub Ordo : Lumbricina Superfamili : Lumbricoidea Famili : Lumbricidae Genus : Lumbricus
Spesies : Lumbricus rubellus
Klasifikasi
b.
Saat ini potensi sumber daya cacing tanah di dunia sudah teridentifikasi dan terklasifikasi lebih dari 1800 jenis (spesies). Dari jumlah potensi sumber daya cacing tanah tersebut, baru sembilan spesies yang banyak menarik perhatian kalangan ahli pertanian, pembudidaya cacing tanah (vermiculturist) dan para peminat bidang lainnya, misalnya peternak dan ahli pengobatan tradisional. Hanya empat spesies saja yang dibudidayakan dan diproduksi secara komersial, yaitu
Lumbricus rubellus, Eisenia foetida, Pheretima asiatica dan Eudrilus eugeuniae
(Rukmana, 1999).
Di Indonesia, baru jenis Lumbricus rubellus saja yang dibudidayakan karena dianggap memiliki potensi yang baik. Ditinjau dari segi produktivitasnya, cacing
Lumbricus rubellus lebih unggul daripada jenis lainnya. Dalam setahun saja seekor cacing Lumbricus rubellus dapat menghasilkan sebanyak 106 kokon yang setiap kokon dapat menghasilkan 1-4 bayi cacing. Sementara jenis lainnya hanya berkisar 20-40 kokon per tahun (Palungkun, 2010).Gambar cacing tanahLumbricus rubellus dapat dilihat pada Gambar 1.
Jenis yang dibudidayakan
c.
Dalam Proceeding Seminar Nasional Pangan tahun 2008, Damayanti et al.
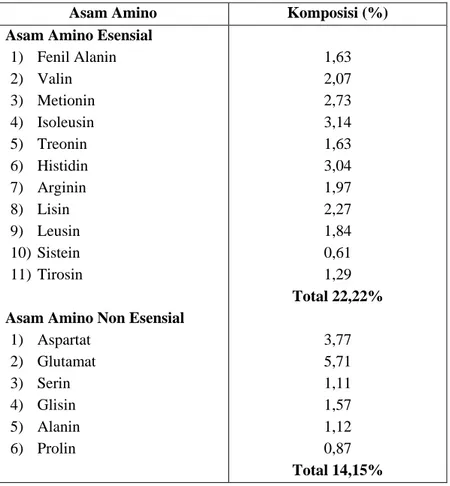
(sebagaimana dikutip dalam Istiqomah et al, 2009) menyebutkan kandungan gizi cacing tanah cukup tinggi, terutama kandungan proteinnya mencapai 63,06%. Selain protein, kandungan lainnya yang terdapat dalam tubuh cacing tanah antara lain lemak 18,5% dan serat kasar 0,19%. Komposisi asam amino yang terkandung dalam cacing tanah dapat dilihat pada Tabel I.
Kandungan
Tabel I. Komposisi Kandungan Asam Amino pada Tepung Cacing Tanah (Hayatiet al., 2011)
Asam Amino Komposisi (%)
Asam Amino Esensial 1) Fenil Alanin 2) Valin 3) Metionin 4) Isoleusin 5) Treonin 6) Histidin 7) Arginin 8) Lisin 9) Leusin 10) Sistein 11) Tirosin
Asam Amino Non Esensial 1) Aspartat 2) Glutamat 3) Serin 4) Glisin 5) Alanin 6) Prolin 1,63 2,07 2,73 3,14 1,63 3,04 1,97 2,27 1,84 0,61 1,29 Total 22,22% 3,77 5,71 1,11 1,57 1,12 0,87 Total 14,15%
d.
Selain berbagai manfaat cacing tanah dalam bidang agrikultur, baik itu sebagai penghasil pupuk organik, pendaur ulang limbah, bahan baku pakan ternak dan ikan, umpan cacing maupun pakan burung, cacing tanah juga dapat dimanfaatkan sebagai bahan baku obat (Palungkun, 2010).
Berdasarkan catatan dalam buku pengobatan tradisional Cina yang sangat terkenal, Ben Cao Gang Mu(Compendium of Materia Medica), bahan obat tradisional Di Long (cacing tanah) telah digunakan sebagai obat untuk berbagai penyakit di Cina sejak ribuan tahun yang lalu, bagaimanapun, tanpa studi ilmiah farmakologi modern(Cooper & Yamaguchi, 2002).
Manfaat
Beberapa penelitian membuktikan adanya daya antibakteri tepung dan ekstrak cacing tanah terhadap pertumbuhan bakteri gram negatif penyebab demam tipoid dan diare, diantaranya Salmonella typhi, E. coli, S. aureus dan S. pyogens
(Julendra & Sofyan, 2007;Noor, 2008).Choet al. (1998) mengemukakan bahwa sebuah peptida antimikroba telah berhasil diisolasi dan dikarakterisasi dari cacing tanahdan disebut lumbricin I. Lumbricin I merupakan peptida antimikroba yang mengandung prolin 15% dari total berat kering, tersusun dari 62 macam asam amino serta mempunyai berat molekul 7,231 kDa.Lumbricin Isecara in vitro menunjukkan aktivitas antimikroba spektrum luas terhadap sejumlah mikroorganisme tanpa aktivitas hemolitik.Penelitian Balamurugan et al. (2009)menyimpulkan adanya sifat antiinflamasi dan antipiretik dari ekstrak cacing
tanah.Chen et al. (2007) menyatakan Earthworm Fibrinolytic Enzyme (EFE) memiliki peran yang penting dalam pengobatan hepatoma.
Pada 1991, Mihara et al., menemukan bahwa cacing tanah dari famili Lumbricidae dapat secara langsung melarutkan fibrin dan mengaktivasi plasminogen. DLBS1033, ekstrak protein cacing tanah, ditemukan memiliki aktivitas fibrigenolitik, menghambat agregasi platelet, memperlama waktu penjendalan darah serta melisis trombus secara efektif. Hal ini menunjukkan ekstrak protein cacing tanah DLBS 1033 memiliki aktivitas antitrombotik dan trombolitik sehingga dapat digunakan sebagai obat trombolitik oral yang menjanjikan (Trisina et al., 2011).
Penelitian Sukandar et al. (2014) terkait studi toksisitas DLBS 1033 menunjukkan ekstrak protein cacing tanahtersebut memiliki toksisitas yang rendah.Pada studi toksisitas akut, DLBS 1033 dapat ditoleransi dengan baik pada dosis tinggi (16,2 g/kg berat badan).
2. Toksisitas dan Toksikologi
Pada mulanya, toksikologi ditakrifkan (didefinisikan) sebagai ilmu tentang racun. Takrif ini kemudian dirasa kurang sesuai, karena pengalaman juga menunjukkan bahwa bahan yang paling tidak berbahaya pun, bila masuk ke dalam tubuh dengan jumlah yang cukup, dapat menimbulkan keracunan. Kenyataan ini ini selanjutnya digunakan oleh Paracelsus (1493-1541) untuk menyatakan bahwa semua senyawa adalah racun. Menurut Doull dan Bruce, takaran (dosis) yang
tepatlah yang membedakan antara racun dan obat. Pernyataan ini mengandung pengertian bahwa ada kekerabatan antara takaransenyawa atau bahan yang dimakan tersebut dengan respon tubuh. Karena itu, takrif toksikologi kemudian berkembang menjadi ilmu yang mempelajari pengaruh zat kimia atas sistem biologi, yang pusat perhatiannya terletak pada aksi berbahaya zat kimia itu. Takrif inilah yang menjadi dasar perkembangan toksikologi modern (Donatus, 2001).
Dewasa ini, toksikologi diaplikasikan pada berbagai bidang. Di kalangan akademisi, ahli riset toksikologi menguji berbagai isu toksikologi melalui penelitian di laboratorium. Perhatian akademisi meliputi semua area kesehatan masyarakat dimana perkembangan pemahaman dalam ilmu toksikologi diperlukan untuk menjawab pertanyaan spesifik yang timbul dari masalah toksikologi yang dapat mempengaruhi kesehatan masyarakat. Dalam industri bioteknologi dan farmasi, uji toksikologi juga dilakukan untuk menskrining senyawa kimia dan obat yang memiliki potensi toksisitas sebelum produk tersebut dipasarkan. Di pemerintahan, ahli toksikologi juga diperlukan untuk menyetujui, mengijinkan dan memonitor penggunaan bahan kimia melalui penetapan pedoman dan kebijakan (Barile, 2008).
Dalam toksikologi, pada dasarnya dikenal dua tolok ukuruntuk mengetahui keparahan pengaruh toksik suatu racun. Termasuk dalam tolok ukur kualitatif antara lain wujud dan sifat efek toksik, di samping gejala-gejala toksik atau klinis yang nampak. Pemahaman terhadapkondisi pemejanan dan kondisi makhluk hidup akan mempermudah dalam menghayati aneka ragam faktor yang dapat
mempengaruhi ketoksikan suatu senyawa. Pemahaman terhadap mekanisme aksi akan mempermudah dalam menghayati penyebab timbulnya efek toksik, sedang pemahaman terhadap wujud dan sifat efek toksik mempermudah penghayatan respon tubuh terhadap ketoksikan suatu senyawa. Selain itu, tolok ukur kuantitatif ketoksikan suatu senyawa, dengan mudah dapat dihayati melalui pemahaman terhadap korelasi antara kondisi pemejanan dan wujud efek toksik (Donatus, 2001).
a.
Donatus (2001) menyebutkan bahwa kondisi pemejanan ialah semua faktor yang menentukan keberadaan racun di tempat aksi tertentu di dalam tubuh, yang berkaitan dengan pemejanannya pada diri makhluk hidup. Menurut Williams et al.(2000), kondisi terjadinya paparan dapat mempengaruhi dosis toksikan, dan sebagai akibatnya, juga berpengaruh terhadap jumlah senyawa yang diabsorbsi. Yang termasuk dalam kondisi pemejanan meliputi jenis, jalur, lama, kekerapan, saat dan takaran pemejanan (Donatus, 2001).
Kondisi pemejanan
1. Jenis pemejanan
Ada dua kondisi pemejanan untuk senyawa toksik, yaitu pemejanan akut dan kronis. Pemejanan akut berlaku untuk episode tunggal dimana sejumlah tertentu senyawa, seperti misalnya obat dosis tinggi, masuk ke dalam diri makhluk hidup. Pemejanan kronis berlaku untuk paparan berulang suatu senyawa yang kemudian dapat terakumulasi atau menimbulkan efek toksik kumulatif (Timbrell, 2002).
Toksisitas akut merupakan kejadian toksik yang terjadi segera setelah paparan akut atau terbatas, sementara toksisitas kronis merupakan kejadian yang terjadi setelah beberapa minggu, bulan atau tahun setelah paparan berulang suatu senyawa toksik (Timbrell, 2002).
2. Jalur pemejanan
Berkaitan dengan ketoksikan racun, jalur pemejanan sangat besar artinya dalam menentukan ketersediaan senyawa induk atau metabolitnya di suatu tempat aksi. Hal ini berkaitan dengan keefektifan absorbsi racun tersebut. Semakin efektif absorbsi racun, berarti semakin cepat dan besar kadar racun yang berada di sirkulasi sistemik, yang tersedia untuk didistrubisikan ke tempat aksi. Dengan cara demikian akan menentukan ketoksikan racun itu (Donatus, 2001).
Jalur pemejanan dimana suatu senyawa kontak dengan tubuh menentukan seberapa banyak senyawa yang dapat masuk (laju dan besarnya absorbsi) dan organ mana yang mula-mula terpapar konsentrasi tertinggi dari senyawa tersebut. Sebagai contoh, karakter kelarutan senyawa kimia dalam lipid dan air mempengaruhi absorbsinya melalui paru-paru (setelah inhalasi), kulit (setelah penggunaan di dermal) atau saluran pencernaan (setelah ingesti oral), dan efek tersebut berbeda untuk tiap organ. Laju dan tempat absorbsi (organ) juga dapat menentukan lajumetabolisme dan eksresi senyawa tersebut. Maka, perubahan jalur pemejanan dapat mengubah dosis yang dibutuhkan untuk menghasilkan toksisitas, selain juga dapat mengubah toksisitas organ yang diamati. Sebagai contoh, organ dengan kapasitas metabolisme terbesar adalah liver, maka suatu
senyawa kimia dapat lebih atau kurang toksik ketika diberikan secara oral atau intra peritoneal, jalur pemejanan yang memastikan senyawa kimia terabsorbsi ke aliran darah melewati liver sebelum perfusi ke organ lain. Apabila metabolisme senyawa tersebut adalah proses detoksifikasi, maka potensi toksik senyawa kimia dapat direduksi relatif terhadap potensinya ketika dipejankan melalui jalur lain (misal intravena). Sebaliknya, bila metabolisme justru menghasilkan metabolit toksik, maka potensi toksik yang lebih besar akan terjadi ketika senyawa tersebut diberikan secara oral daripada inhalasi, dermal atau intramuskular (Williams et al., 2000).
Pemejanan melalui saluran gastrointestinal merupakan jalur yang paling penting untuk kebanyakan obat, bahan tambahan dan kontaminan makanan, produk alam dan senyawa lain yang potensial toksik. Tempat dan jalur absorbsi penting dari 2 sudut pandang, jalur pemejanan dapat mempengaruhi toksisitas sistemik selain juga dapat menjadi penting apabila ada toksisitas lokal pada tempat absorbsi (Timbrell, 2002).
3. Lama dan kekerapan pemejanan
Lama pemejanan adalah batas kurun waktu pemejanan suatu senyawa terhadap makhluk hidup tertentu. Rentang waktu ini berkisar antara satu hari sampai dengan waktu tak terhingga (sampai dengan hari kematian makhluk hidup). Kekerapan pemejanan adalah batas pemejanan racun terhadap makhluk hidup setiap satuan waktu, dengan takaran atau dosis serta melalui jalur pemejanan tertentu (Donatus, 2001).
4. Saat dan takaran pemejanan
Takaran (dosis) merupakan salah satu faktor penting yang menentukan ketoksikan suatu racun. Sebagaimana yang pernah dinyatakan oleh Paracelsus bahwa yang membedakan antara racun dan obat adalah ketepatan takarannya. Semakin besar takaran pemejanannya semakin besar pula kadar yang ada di tempat aksi, sehingga harga kadar toksik maksimum racun cepat terlampaui. Namun, ada kalanya ketoksikan racuntidak bergantung pada takaran pemejanannya, misal kasus keracunan akibat fenomena alergi atau hipersensitifitas (Donatus, 2001).
Ada dua hal penting yang berkaitan dengan saat pemejanan zat toksik, yakni ketersediaan zat toksik atau metabolitnya di tempat aksi tertentu dalam tubuh dan kerentanan makhluk hidup terhadap ketoksikan zat toksik tertentu. Pengaruh saat pemejanan atas ketersediaan obat di tempat aksi dapat beragam karena perbedaan saat pemejanan satu objek di pagi, siang atau sore hari, dan disebut sebagai faktor diurnal (Donatus, 2001).
b.
Mekanisme aksi toksik racun dapat digolongkan menjadi tiga, yakni mekanisme berdasarkan sifat dan tempat kejadian, berdasarkan sifat antaraksi antara racun dan tempat aksinya dan berdasarkan resiko penumpukan racun dalam gudang penyimpanan tubuh (Donatus, 2001).
1. Mekanisme aksi berdasarkan sifat dan tempat kejadian
Pada dasarnya, mekanisme biokimia pada tingkat molekular menuju timbulnya luka selular, dapat dibagi menjadi dua golongan utama, yakni mekanisme luka intrasel dan ekstrasel (Donatus, 2001).
Mekanisme luka intra sel, seringkali disebut mekanisme langsung atau primer, adalah adalah luka sel yang diawali oleh aksi racun pada tempat aksinya di dalam sel (Donatus, 2001).Di sampingsenyawa kimia yang dapat merusak mitokondria dengan mengganggu fosforilasi oksidatif dan/atau mengontrol kalsium intraseluler, ada toksikan yang dapat menyebabkan kematian sel dengan cara mempengaruhi fungsi atau struktur primer lain (Klaassen, 2008).
Mekanisme luka ekstrasel terjadi secara tidak langsung, juga disebut mekanisme tak langsung atau sekunder, yang tempat kejadian awalnya di lingkungan ekstrasel (Donatus, 2001). Toksikan dapat mengganggu sel yang khususnya memberikan support untuk sel lain, jaringan atau organisme secara keseluruhan (Klaassen, 2008).
2. Mekanisme aksi berdasarkan sifat antaraksi
Antaraksi racun dengan reseptor atau sel sasaran dapat mengakibatkan efek toksik yangterbalikkan dan tak terbalikkan. Efek toksik atau luka kimia yang tak terbalikkan dapat segera hilang bila pemejanan racun dihentikan. Sebaliknya, luka kimia yang tak terbalikkan, sulit atau bahkan tidak dapat hilang dengan penghentian pemejanan racun terhadap diri makhluk hidup. Karena itu ketoksikan luka kimia yang tak terbalikkan (nekrosis, karsinogenik, mutagenik dan
teratogenik) pada umumnya lebih berat daripada luka kimia yang terbalikkan (Donatus, 2001).
3. Mekanisme aksi berdasarkan resiko penumpukan
Dosis, durasi, frekuensi dan jalur pemejanan berkontribusi terhadap toksisitas senyawa kima kaitannya dengan akumulasi senyawa tersebut dalam kompartemen fisiologis. Sebuah senyawa kimia, setelah diabsorbsi dapat terdistribusi dan/atau terikat pada satu atau lebih dari banyak lokasi fisiologis. Distribusi senyawa kimia sebagian besar tergantung pada karakter fisikokimianya. Kompartemen yang dimaksud meliputi : darah total, serum dan protein serum, plasma dan protein plasma, jaringan adiposa, cairan interstisial dan ekstraseluler, ruang udara alveolar dan sum-sum tulang. Akumulasi dapat diprediksi berdasarkan volume distribusi (Vd), dimana secara umum semakin besar Vd maka semakin besar potensi terjadinya akumulasi dalam kompartemen fisiologis (Barile, 2004).
Akumulasi juga ditentukan oleh struktur kimia dan interaksinya dengan kompartemen fisiologis. Secara umum, pada pH fisiologis, senyawa larut lipid akan cenderung berada pada bentuk nonionik, sehingga akan lebih mudah terikat dan terakumulasi dalam membran jaringan dan organ. Sebaliknya senyawa yang larut air akan tetap dalam keadaan ionik pada pH darah, maka mereka akan cenderung kurang terikat pada jaringan dan lebih mudah untuk segera eksresi dan eliminasi via renal (Barile, 2004).
c.
Respon toksik merupakan suatu proses dimana sel, jaringan atau organ menanggapi adanya luka dalam diri komponen-komponen tubuh tersebut dan wujud efek toksik, adalah hasil akhir dari aksi dan respon toksik. Pada dasarnya wujud efek toksik suatu racun dapat berupa perubahan atau kekacauan biokimia, fungsional dan atau struktural, dan berbagai perubahan ini memiliki sifat yang khas, yakni terbalikkan atau tak terbalikkan (Donatus, 2001).
Wujud efek toksik
1. Respon dan perubahan biokimia
Menurut Loomis dan Timbrell dalam Donatus (2001), perubahan biokimia seperti halnya perubahan fisiologis, seringkali merupakan tahap awal terjadinya perubahan struktural. Jenis efek toksik berdasarkan perubahan biokimia diantaranya penghambatan respirasi seluler, perubahan keseimbangan cairan dan elektrolit dan gangguan pasokan energi. Lazimnya, perubahan biokimia bersifat terbalikkan selama mekanisme homeostasis normal dalam diri makhluk hidup masih dapat bekerja (Donatus, 2001).
2. Respon dan perubahan fisiologi (fungsional)
Respon fisiologis adalah respon yang berkaitan dengan adanya fungsi tubuh tertentu yang dipengaruhi. Sebagai contoh, beberapa senyawa menyebabkan perubahan pada tekanan darah dengan mempengaruhi beta adrenoreseptor atau dengan menyebabkan dilatasi atau kontriksi vaskuler. Hal ini jelas merupakan reaksi toksik bila terjadi secara ekstrim dan secara langsung membahayakan nyawa. Selain itu, penurunan tekanan darah drastis cukup untuk menginisiasi
respon lain seperti kerusakan jaringan iskemik karena kurangnya aliran darah (Barile, 2004).
Perubahan fungsional, seperti halnya perubahan biokimia, seringkali merupakan tahapan awal terjadinya perubahan struktural. Jenis efek toksik berdasarkan perubahan fungsional diantaranya anoksia, gangguan pernafasan, gangguan sistem syaraf pusat, hiper atau hipotensi, hiper atau hipoglikemia, perubahan keseimbangan cairan dan elektrolit langsung, perubahan kontraksi atau relaksasi otot dan hipo atau hipertermi (Donatus, 2001).
3. Respon dan perubahan struktural
Senyawa toksik dapat menyebabkan luka seluler melalui aksi langsung pada sel sasaran atau tak langsung pada lingkungan ekstra sel, menuju ke perubahan morfologi yang pada akhirnya terwujud sebagai kekacauan struktural. Terdapat tiga respon histopatologis dasar sebagai tanggapan terhadap adanya luka seluler itu, meliputi degenerasi, proliferasi dan inflamasi atau perbaikan. Jenis efek toksik berdasarkan perubahan struktural diantaranya perlemakan sel yang bersifat terbalikkan, nekrosis sel, karsinogenesis, mutagenesis dan teratogenesis yang bersifat tak terbalikkan (Donatus, 2001).
d.
Ada dua jenis efek toksik, yakni reversible (terbalikkan) dan irreversible
(tidak terbalikkan). Efek toksik terbalikkan bercirikan (1) bila jumlah zat toksik dalam tempat kerjanya atau reseptornya telah habis, maka reseptor akan kembali seperti keadaan semula; (2) efek toksik yang diakibatkan akan cepat hilang atau
kembali ke normal; (3) ketoksikan sangat tergantung pada dosis, kecepatan absorbsi, distribusi dan eliminasi zat racun. Sedangkan efek toksik yang tidak terbalikkan bercirikan (1) kerusakan yang terjadi bersifat permanen; (2) paparan berikutnya akan menimbulkan kerusakan yang sifatnya sama sehingga memungkinkan terjadinya akumulasi efek toksik; (3) paparan dengan takaran yang sangat kecil dalam panjang akan menimbulkan efek toksik yang sama efektifnya dengan yang ditimbulkan oleh paparan dosis besar jangka pendek, menunjukkan bahwa zat yang dapat menimbulkan sifat toksik tak terbalikkan adalah zat racun yang terakumulasi atau sangat sukar dieliminasi (Priyanto, 2010).
e.
Di kebanyakan negara, obat (termasuk obat veteriner), zat tambahan makan, senyawa kimia industri, pestisida dan kosmetik, yang kemungkinan terpapar pada manusia dan makhluk hidup lainnya di lingkungan, harus dievaluasi toksisitasnya. Tujuannya adalah untuk memastikan bahwa benefit substansi kimia yang ditujukan untuk digunakan pada manusia jauh melebihi resiko penggunaannya (Timbrell, 2002).
Uji toksisitas
Toksisitas senyawa kimia dapat ditentukan dengan salah satu dari tiga cara berikut : (1) observasi populasi manusia (atau hewan atau tumbuhan) yang terpapar senyawa kimia (epidemiologi); (2) memejankan senyawa kimia pada hewan atau tumbuhan dalam kondisi yang terkontrol dan observasi efek (in vivo); dan (3) pemaparan senyawa kimia pada sel, fraksi subseluler atau organisme sel tunggal (in vitro) (Timbrell, 2002).
Karena uji dengan hewan dapat dikontrol secara lebih seksama dengan dosis pasti yang sudah diketahui, kualitas data umumnya bagus. Jumlah hewan yang digunakan harus cukup agar signifikansi statistik dapat dilakukan. Kondisi manusia dan perlakuan hewan merupakan hal yang esensial untuk alasan ilmiah dan etis, selain juga hal ini membantu untuk memastikan bahwa data reliable dan
robust (Timbrell, 2002).
Menurut Donatus (2001), jenis uji toksikologi digolongkan menjadi dua, yakni uji ketoksikan tak khas dan uji ketoksikan khas. Termasuk uji ketoksikan tak khas meliputi uji ketoksikan akut, subkronis dan kronis, sebagaimana dijabarkan oleh Priyanto (2010) berikut:
a. Uji toksisitas akut, yakni uji untuk mengetahui nilai LD50 dan dosis maksimal yang masih dapat ditoleransi oleh binatang percobaan, yang hasilnya akan ditransformasi pada manusia.
b. Uji toksisitas sub akut, adalah suatu uji untuk menentukan organ sasaran (organ yang rentan) atau tempat kerjanya, umumnya dilakukan selama 4 minggu – 3 bulan.
c. Uji toksisitas kronis, adalah suatu uji yang tujuannya hampir sama dengan uji toksisitas sub akut, umumnya selama 6 bulan atau lebih. Uji ini diperlukan bila obat nantinya akan digunakan dalam jangka waktu yang cukup panjang.
Menurut Donatus (2001), pada dasarnya ketiga uji ini digunakan untuk mengetahui spektrum efek toksik dan potensinya. Termasuk uji ketoksikan khas meliputi uji potensiasi (untuk menentukan adanya potensiasi efek toksik dua
senyawa atau lebih), uji kemutagenikan (untuk menentukan pengaruh senyawa terhadap kode genetik), uji kekarsinogenikan (untuk menentukan kemampuan senyawa dalam menimbulkan kanker), uji keteratogenikan ( untuk menentukan perngaruh senyawa terhadap janin dalam hewan bunting), uji reproduksi (untuk menentukan pengaruh senyawa atas kapasitas reproduksi hewan uji), uji kulit dan mata (untuk menentukan berbagai efek lokal senyawa bila bersentuhan langsung pada kulit dan mata) dan uji perilaku (untuk mengevaluasi aktivitas lokomotor atau pengaruh senyawa).
3. Uji Toksisitas Akut
Toksisitas akut adalah efek berbahaya yang terjadi segera setelah terpapar suatu zat tunggal atau kombinasi zat (substances) sekali atau beberapa kali dalam waktu yang singkat. Sedangkan definisi lain menyatakan, efek berbahaya yang terjadi segera setelah terpapar dosis tunggal atau berulang dalam waktu 24 jam. Jumlah paparan mengacu pada jumlah yang dapat mengancam kehidupan (over dosis) atau untuk pembunuhan atau bunuh diri (Priyanto, 2010).
Uji toksisitas akut adalah tata cara tertentu yang dirancang untuk menentukan dosis letal median (LD50) suatu zat dan kemungkinan mekanisme kerja dan target organnya. LD50 didefinisikan sebagai dosis atau konsentrasi yang diberikan sekali (tunggal) atau beberapa kali dalam 24 jam dari suatu zat yang diharapkan dapat mematikan 50% hewan coba (Priyanto, 2010).
Biasanya pengamatan uji toksisitas akut dilakukan selama 24 jam, kecuali pada kasus tertentu selama 7-14 hari. Dan pengamatan tersebut meliputi : (1) gejala-gejala klinis, (2) jumlah hewan yang mati dan (3) histopatologis organ. Data kuantitatif yang diperoleh dari uji ketoksikan akut adalah LD50 sedang data kualitatifnya berupa penampakan klinis dan morfologis efek toksik senyawa uji. Data LD50 yang didapat dapat digunakan untuk potensi ketoksikan akut senyawa relatif terhadap senyawa lain serta untuk memperkirakan takaran dosis uji toksikologi lainnya (Donatus, 2001).
Jacobson-Kram dan Keller (2006) menyatakan terdapat tiga guideline OECD (Organization for Economic Cooperation and Development) yang dapat digunakan untuk mengestimasikan toksisitas akut senyawa secara per oral.
a. OECD Guideline 420: Acute Oral Toxicity—Fixed Dose Method Fixed dose method menggunakan fase pencarian kisaran terlebih dahulu dengan menggunakan satu ekor hewan sebelum pemejanan lima ekor hewan yang dipejani pada dosis 5, 50, 300 atau 2000 mg/kg (dengan dosis 5000 mg/kg juga sebagai opsi) serta menggunakan bukti toksisitas sebagai end point bukan hanya mortalitas.
b. OECD Guideline 423: Acute Oral Toxicity—Acute Toxic Class Method
Acute toxic class methodmenggunakan dosis yang berurutan pada tiga ekor hewan dengan jenis kelamin yang sama pada dosis 5, 50, 300 atau 2000 mg/kg (dengan 5000 mg/kg BB juga sebagai opsi). Dosis awal dipilih agar dapat
menghasilkan mortalitas pada kelompok dosis yang terdiri dari tiga ekor binatang dan ditetapkan menggunakan informasi yang relevan tentang senyawa kimia tersebut atau senyawa kimia yang serupa. Berdasarkan hasil dari kelompok dosis pertama, kelompok tambahan dipejani pada dosis yang lebih tinggi atau lebih rendah hingga tujuan studi tercapai.
c. OECD Guideline 425: Acute Oral Toxicity—Up and Down Procedure
Prosedur up-and-down dimulai dengan pemberian dosis pada seekor hewan uji dengan tingkat dosis yang diperkirakan tepat di bawah dosis yang mematikan. Pemejanan dosis pada hewan uji berikutnya dilakukan 48 jam kemudian dengan dosis yang ditingkatkan atau diturunkan sekian kali dosis sebelumnya berdasar perhitungan logaritma dan slope. Penurunan dosis dilakukan bila timbul kematian, dan sebaliknya, peningkatan dosis dilakukan bila hewan uji pada pemejanan sebelumnya dapat bertahan hidup. Hal ini terus dilakukan hingga salahsatu kriteria penghentian terpenuhi. Perhitungan LD50 dan taraf kepercayaan dilakukan dengan suatu program komputasi berdasarkan hasil dari semua pemejanan hewan uji.
4. OECD 423
Organisation for Economic Co-operation and Development (OECD) adalah organisasi pemerintah lintas negara dimana perwakilan dari 29 negara industri di Amerika Utara, Eropa dan Pasifik, begitu juga dengan European Commission,
bertemu untuk melakukan koordinasi dan harmonisasi kebijakan, diskusi isu yang menjadi perhatian bersama, dan berkerja bersama-sama untuk menanggapi
permasalahan internasional. Sebagian besar tugas OECD dilakukan oleh lebih dari 200 komite khusus dan kelompok tambahan yang berkomposisikan delegasi-delegasi dari negara anggota. Sekretariat OECD berlokasi di Paris, Prancis, terbagi dalam beberapa badan dan divisi (Anonim, 2001a).
Tugas OECD yang berkaitan dengan keamanan bahan kimiadilaksanakan dalam Environment, Health and Safety Programme. Sebagai bagian dari tugasnya dalam uji bahan kimia, OECD telah membentuk beberapa dewan yang menerbitkan keputusan dan rekomendasi, mempublikasikan banyak pedoman dan laporan teknis. Publikasi yangpaling terkenal adalah OECD Test Guideline, yaitu kumpulan metode yang digunakan untuk menilai keberbahayaan bahan kimia. Metode ini mencakup uji sifat fisika dan kimia, pengaruh terhadap kesehatan manusia dan lingkungan serta akumulasi dan degradasi di lingkungan. OECD Test Guideline diakui di seluruh dunia sebagat standar referensi untuk uji bahan kimia (Anonim, 2001a).
OECD Guideline for Testing of Chemicals secara periodik ditinjau kembali seiring dengan perkembangan ilmiah atau perubahan praktek pengujian. Awalnya
Guideline 423 diadopsi pada Maret 1996 sebagai alternatif kedua terhadap uji toksisitas akut konvensional (Anonim, 2001a). Uji toksisitas oral akut (dulunya OECD Test Guideline401) adalah uji yang paling banyak mendapatkan kritik kaitannya dengan animal welfare dan pertimbangan ini menggerakkan upaya dibalik pengembangan ketiga uji alternatif untuk toksisitas oral akut, termasuk diantaranya Test Guideline 423 (Anonim, 2001c).
OECD Guideline423 berdasarkan pada acute toxic class method dengan prosedur bertahap menggunakan 3 hewan uji untuk setiap tahapannya. Penetapan toksisitas akut senyawa uji didasarkan pada mortalitas dan/atau kondisi sekarat pada hewan uji dan rata-rata membutuhkan 2-4 tahap. Acute toxic class method
berdasarkan pada evaluasi biometrik dengan dosis tertentu, dengan jarak yang cukup, memungkinkan suatu senyawa digolongkan untuk tujuan klasifikasidan penetapan keberbahayaan. Metode ini menggunakan sangat sedikit hewan uji,
reproducible serta secara ekstensif telah divalidasi in vivo terhadap data LD50 yang didapatkan dari literatur, baik nasional maupun internasional (Anonim, 2001a).
Senyawa uji, pada dosis yang diketahui dapat menyebabkan kesakitan dan penderitaan nyata karena bersifat korosif atau aksi iritasi parah, tidak perlu dipejankan. Hewan yang sekarat, atau benar-benar menunjukkan kesakitan maupun tanda-tanda mengalami penderitaan yang parah sebaiknya dikorbankan, dan dalam interpretasi hasil uji dianggap sama dengan hewan mati dalam pengujian (Anonim, 2001a).
Pada prinsipnya, metode ini tidak dimaksudkan untuk menghitung nilai LD50secara eksak, namun dapat digunakan untuk penetapanperkiraan nilai LD50berupa kisaran paparan yang memungkinan kematian. Prosedur dilakukan secara bertahap dengan menggunakan hewan dalam jumlah minimum untuk setiap tahapannya. Didapatkan informasi yang cukup terkait toksisitas akut senyawa uji untuk memungkinkan klasifikasinya. Senyawa uji dipejankan secara oral pada satu kelompok hewan uji dalam dosis tertentu. Ada atau tidaknya mortalitas
hewan uji akibat pemejanan senyawa pada suatu tahap akan menentukan tahapan berikutnya, meliputi:
a. Tidak diperlukan pengujian lebih lanjut
b. Pemejanan 3 hewan uji tambahan dengan dosis yang sama
c. Pemejanan 3 hewan uji tambahan dengan dosis yang lebih tinggi atau lebih rendah
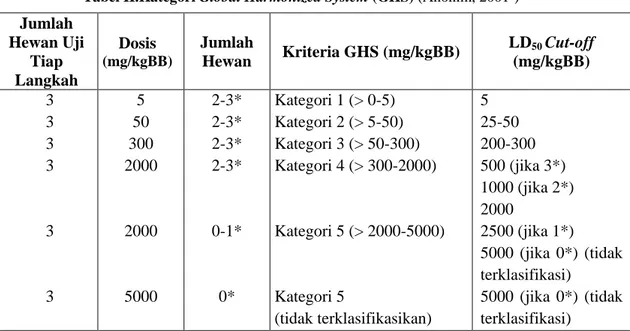
(Anonim, 2001a) Nilai LD50 sangat berguna untuk klasifikasi zat kimia sesuai dengan ketoksikan relatifnya. OECD Guideline for Testing of Chemicals dalam menetapkan besarnya LD50 didapatkan dari kategori-kategori yang terdapat dalam
Global Harmonized System (GHS). Kategori Global Harmonized System (GHS) beserta nilai LD50 yang terdapat dalam pedoman OECD 423 dapat dilihat pada tabel :
Tabel II.Kategori Global Harmonized System (GHS) (Anonim, 2001b)
Jumlah Hewan Uji Tiap Langkah Dosis (mg/kgBB) Jumlah Hewan Kriteria GHS (mg/kgBB) LD50 Cut-off (mg/kgBB) 3 3 3 3 3 3 5 50 300 2000 2000 5000 2-3* 2-3* 2-3* 2-3* 0-1* 0* Kategori 1 (> 0-5) Kategori 2 (> 5-50) Kategori 3 (> 50-300) Kategori 4 (> 300-2000) Kategori 5 (> 2000-5000) Kategori 5 (tidak terklasifikasikan) 5 25-50 200-300 500 (jika 3*) 1000 (jika 2*) 2000 2500 (jika 1*) 5000 (jika 0*) (tidak terklasifikasi) 5000 (jika 0*) (tidak terklasifikasi) Keterangan :
5. Histopatologis Organ
Senyawa toksik dapat mempengaruhi berbagai tipe jaringan dalam berbagai organ. Senyawa toksik dari kelas yang berbeda mempengaruhi bermacam-macam jaringan dalam derajat dan cara yang bervariasi, tergantung pada sifat senyawa tersebut, tipe reseptor yang diserang, sifat ikatannya dengan reseptor, selain juga rute, transport dan metabolisme senyawa dalam organisme (Manahan, 2003).
Sebelum memikirkan kelas kimia senyawa toksik, akan sangat berguna bila dilakukan peninjauan respon toksik utama dan efeknya. Senyawa toksik dapat diinhalasi melalui sistem respirasi atau diabsorbsi melalui kulit. Sementara senyawa toksik yang diingesti melalui saluran pencernaan secara normal melewati hati. Senyawa toksik secara sistemik dibawa oleh darah dan melalui sistem limfe ke berbagai organ dan dapat mempengaruhi sistem endokrin, sistem syaraf dan sistem reproduksi. Akhirnya, ginjal dan saluran urin merupakan rute utama eliminasi metabolit senyawa toksik dari dalam tubuh (Manahan, 2003).
Hasil yang umum terjadi akibat paparan senyawa toksik terhadap jaringan adalah kematian sel. Pada nekrosis sel, sel mati, membengkak dan terdisintegrasi. Membran sel dan membran organel sel pecah dan sejumlah besar pecahan sel dilepaskan. Fragmen ini memicu aksi inflamasi dari sel lain, menyebabkan kerusakan yang semakin parah. Berbeda dengan nekrosis sel, apoptosis adalah suatu proses dimana sel secara sistematis mati dan disingkirkan.Badan nukleus danorganeldalamselakanmengelilingisuatu membrane untukmembentukresiduyangdikenalsebagaibadanapoptosis.Disebutkanbahwabada
napoptosisakandifagositosisketikamerekamengelilingi
membrandansecaraaktifdisingkirkandarilokasitejadinyakerusakan.
Apoptosismerupakanprosesaktifuntukeliminasimaterialselyangtelahmati(Manahan ,2003).
Evaluasi perubahan patologis yang timbul pada hewan percobaan oleh obat baru dapat menjadi landasan awal penilaian keamanannya sebelum diujicobakan pada manusia. Penilaian awal yang sebagian besar tergantung pada teknik histopatologis konvensional ini memberikan kontribusi besar terhadap pengembangan obat baru baik untuk penyakit manusia maupun hewan (Greaves, 2007).
Prosedur awal dalam pengamatan jaringan adalah penyiapan potongan histologis yang dapat diamati di bawah mikroskop cahaya. Dibawah mikroskop cahaya, jaringan diamati menggunakan cahaya lampu yang ditransmisikan melewati jaringan. Jaringan dan organ yang terlalu tebal tidak dapat dilewati oleh cahaya, sehingga harus dipotong terlebih dahulu untuk mendapatkan potongan yang tipis dan tembus cahaya. Pemotongan dilakukan secara seksamamenggunakan instrumen pemotong yang disebut mikrotom pada jaringan yang sebelumnya telah dipreparasi (Junqueira & Carneiro, 2005).
Preparat mikroskop yang ideal harus diproses sedemikian rupa sehingga preparat memiliki struktur dan komposisi molekuler yang sama ketika masih di dalam tubuh. Hal ini terkadang memungkinkan namun pada prakteknya jarang
bisa dilakukan. Penyimpangan dan hilangnya komponen karena proses preparasi hampir selalu terjadi(Junqueira & Carneiro, 2005).
Apabila diinginkan potongan yang permanen, maka jaringan harus difiksasi. Bagian organ harusdifiksasi sesegera mungkin setelah diambil dari tubuh hewan untuk mencegah digesti jaringan oleh enzim yang ada di dalam sel (autolisis) atau oleh bakteri dan untukmenjaga struktur dan komposisi molekuler. Fiksasi dapat dilakukan secara kimiawi maupun fisika, namun metode fisis jarang dilakukan. Pada fiksasi secara kimiawi, jaringan biasanya direndam dalam larutan penstabil atau cross-linking agentsyang disebut fixatives. Karena fixatives membutuhkan waktu untuk berdifusi secara sempurna ke dalam jaringan, maka biasanya jaringan dipotong dalam fragment kecil sebelum fiksasi untuk memfasilitasi penetrasi
fixatives dan menjamin pengawetan jaringan(Junqueira & Carneiro, 2005).
Jaringan biasanya ditempelkan pada medium solid untuk mempermudah pemotongan. Untuk menghasilkan potongan tipis dengan mikrotom, jaringan harus ditanamkan ke dalam bahan yang dapat memberikan konsistensi rigid pada jaringan. Bahan tersebut dapat berupa paraffin dan plastic resins. Paraffin rutin digunakan untuk pengamatan dengan mikroskop cahaya sedangkan resin dapat digunakan baik untuk mikroskop cahaya maupun elektron (Junqueira & Carneiro, 2005).
Proses penanaman jaringan dalam paraffin biasanya diawali dengan dua tahapan utama, yaitu dehidrasi dan penjernihan. Air dikeluarkan terlebih dahulu dari fragmen melalui pencucian fragmen dengan beberapa seri konsentrasi
campuran air dan alkohol (umumnya dari 70% hingga 100% etanol). Etanol kemudian digantikan dengan solven yang dapat bercampur dengan embedding medium. Bila digunakan parafin, maka solven yang biasanya digunakan adalah
xylene. Ketika jaringan direndam dengan solven, mereka umumnya menjadi transparan (jernih). Setelah jaringan diimpregnasi dengan solven, jaringan kemudian diletakkan dalam parafin yang mencair di oven, sekitar 58-60°C. Panasnya menyebabkan solven menguap dan ruang diantara jaringan terisi dengan parafin. Jaringan bersama dengan parafin akan mengeras setelah dikeluarkan dari dalam oven(Junqueira & Carneiro, 2005).
Blok keras yang berisi jaringan tersebut kemudian dipotong pada mikrotom untuk mendapatkan potongan setebal 1-10µm. Potongan akan mengapung di air dipindahkan ke kaca preparat untuk kemudian dilakukan pengecatan (Junqueira & Carneiro, 2005).
Potongan jaringan harus dicat agar dapat diamati secara mikroskopik. Dengan beberapa pengecualian, kebanyakan jaringan tidak berwarna, sehingga tanpa dilakukannya pewarnaan, pengamatan di bawah mikroskop tidak dapat dilakukan. Metode pewarnaanjaringan dirancang tidak hanya agar berbagai komponen jaringan dapat tampak, namun juga agar dapat dibedakan. Zat pewarna memberikan warna pada jaringan secara selektif. Kebanyakan zat pewarna bersifat seperti senyawa asam atau basa dan memiliki tendensi untuk membentuk hubungan elektrostatik (garam) dengan radikal ion pada jaringan. Komponen jaringan yang lebih mudah diwarna dengan zat pewarna basa disebut basofilik,
sedangkan yang memiliki afinitas terhadap zat pewarna asam disebut asidofilik (Junqueira & Carneiro, 2005).
Contoh zat pewarna basa adalah toluidine blue dan methylene blue. Hematoksilin bersifat seperti zat pewarna basa, sehingga akan memberikan warna pada komponen jaringan yang basofilik. Komponen jaringan utama dapat terionisasi dan bereaksi dengan zat pewarna basa karena asam dalam komposisinya (asam nukleat, glikosaminoglikan dan asam glikoprotein). Zat pewarna asam (sepeti orange G, eosin, asam fuchsin) memberikan warna pada komponen asidofilik seperti mitokondria, granul sekretori dan kolagen (Junqueira & Carneiro, 2005).
Diantara semua zat pewarna, kombinasi hematoksilin dan eosin (H&E) adalah yang paling sering digunakan. Hematoksilin akan memberikan warna biru pada nukleus sel dan struktur asam lain (seperti sitoplasma kaya RNA dan matriks kartilago hyalin). Sebaliknya, eosin memberikan warna merah muda pada sitoplasma dan kolagen (Junqueira & Carneiro, 2005).
Seluruh prosedur, mulai dari fiksasi hingga pengamatan jaringan di bawah mikroskop cahaya, membutuhkan watu 12 jam hingga 2,5 hari, tergantung pada ukuran jaringan, fixative dan embedding medium(Junqueira & Carneiro, 2005).
E. Keterangan Empirik
Penelitian ini bersifat eksploratif untuk menetapkan nilai potensi ketoksikan akut (LD50cut-off), mengetahui gejala toksik, wujud dan spektrum efek toksik
pada organ vital meliputi hati, paru-paru, lambung, limpa, jantung, usus, testis dan ginjal akibat pemejanan oral serbuk cacing tanah (Lumbricus rubellus).