BAB II
TINJAUAN PUSTAKA
2.1 Minyak Atsiri
Minyak atsiri atau minyak eteris atau minyak essential oil adalah minyak mudah menguap yang diperoleh dari tanaman dan merupakan campuran dari senyawa-senyawa volatil. Dari 350.000 spesies tanaman yang ada, sekitar 17.500 atau 5% spesies adalah tanaman aromatis dan sekitar 300 spesies tanaman diambil minyak atsirinya dan digunakan dalam industri makanan, flavor dan parfum (Boelens, 1997). Minyak atsiri dapat digunakan juga sebagai antiseptik internal dan eksternal, bahan analgesik, hemolitik atau enzimatik, sedatif, stimulan, untuk obat sakit perut, bahan pewangi kosmetik dan sabun (Guenther, 1987).
Minyak atsiri merupakan campuran alamiah lipofilik yang
komponennya terdiri atas turunan isoprena (Stahl, 1985). Minyak atsiri mengandung sitral dan eugenol yang berfungsi sebagai anastetik dan antiseptik (Dalimarta, 2005). Antiseptik adalah obat yang meniadakan atau mencegah keadaan sepsis, zat ini dapat membunuh atau mencegah pertumbuhan mikroorganisme (Ganiswara, 1995). Senyawa minyak atsiri dengan konsentrasi yang tinggi akan berdifusi dan ditangkap oleh sensor hidrofilik. Komponen hidrofilik sendiri akan mengikat molekul minyak yang akan menyebabkan kerusakan membran lipoprotein sel (Hidayati, 2002). Jika
membran sel yang merupakan pelindung bagi sel rusak, maka akan menyebabkan matinya sel mikrobia (Kusumaningrum, 2003).
2.2 Daun Salam (Syzygium polyanthum)
Tumbuhan salam adalah rempah yang biasa digunakan dalam masakan. Daun salam biasa digunakan sebagai rempah pengharum masakan di sejumlah negeri di Asia Tenggara, baik untuk masakan daging, ikan, sayur mayur, dan juga nasi. Daun salam biasa dicampurkan dalam keadaan utuh, kering atau segar, dan turut dimasak hingga makanan tersebut matang. Aroma khas daun salam disebabkan oleh kandungan minyak atsiri yang ada didalamnya ( Heyne, 1987). Kandungan senyawa aromatik daun salam terdiri dari senyawa golongan seskuiterpena 25,5%, aldehida 14,5%, keton 10,9%, asam lemak 10,9%, alkohol 9,1%, monoterpen 9,1 %, hidrokarbon alifatik dan siklik 7,3%, ester 3,6%, diterpena 1,8 %, dan golongan lain sebanyak 7,3% dari total senyawa aromatik salam (Dalimartha, 2002).
Klasifikasi dari tanaman salam sebagai berikut:
Kingdom : Plantae
Divisio : Spermatophyta
Kelas : Dicotyledoneae
Anak kelas : Dialypetalae
Ordo : Myrtales
Famili : Myrtaceae
Genus : Syzygium
Spesies : Syzygium polyanthum (Wight.) Walp. (Tjitrosoepomo, 1991)
Gambar 2.1. Daun salam (Syzygium polyanthum)
Tanaman salam adalah tanaman dengan batang berkambium, tingginya dapat mencapai 30 meter. Bagian kulit batangnya berwarna abu – abu
teksturnya pecah - pecah dan terlihat bersisik kasar. Daun dari tanaman ini memiliki tangkai dengan panjang hingga 12 mm. Bunga dijumpai tumbuh pada bagian bawah daun dan terkadang juga diketiak daun. Bunga tumbuhan salam ini cenderung kecil, baunya harum dengan kelopak serupa mangkuk.
Daun salam mengandung tanin, minyak atsiri (salamol dan eugenol), flavonoid (quercetin, quercitrin, myrcetin dan myrcitrin), seskuiterpen, triterpenoid, fenol, steroid, sitral, lakton, saponin, dan karbohidrat. Oleh badan POM, daun salam ditetapkan sebagai salah satu dari sembilan tanaman obat unggulan yang telah diteliti atau diuji secara klinis untuk menanggulangi masalah kesehatan tertentu (Purwati, 2004). Kandungan tanin, minyak atsiri dan flavonoid pada daun salam menyebabkan daun salam mempunyai daya antibakteri atau antimikroba (Wahyudi, 2005).
Hasil penelitian sebelumnya menjelaskan bahwa bubuk daun salam efektif diekstrak menggunakan etanol yang menghasilkan rendemen 11,5 %, dengan daya hambat bakteri terhadap P.aeruginosa, Bacillus subtilis,
Staphylococcus aureus dan Escherichia Coli masing-masing adalah 6.5, 6.3,
5.0 dan 0.8 mm/mg (Muhardi, 2007).
Minyak atsiri daun salam mengandung n-kaprialdehida, 3,7 dimetil-1 oktena, n-dekanal, cis-4-dekanal, patchoulena, D-nerolidol dan kariofilena oksida (Agusta, 2000). Kandungan minyak daun salam dari Bogor dan Sukabumi adalah kaprilaldehid, 3,7-dimetil-1-oktena, dekanal, cis-4-dekenal, sikloheksana, asam oktanoat, dan nerolido (Sembiring, 2003).
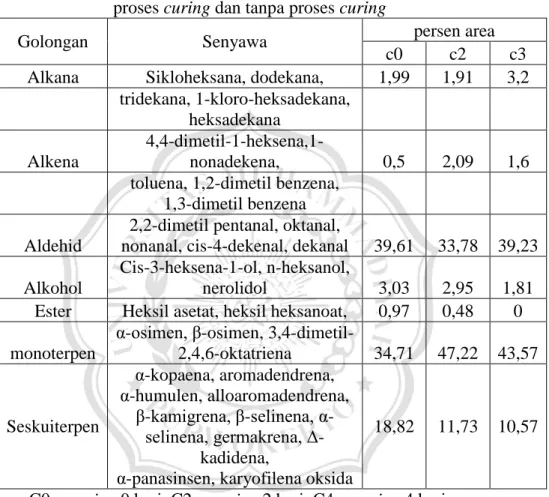
Hasil penelitian Wartini, 2010 tentang perbedaan kandungan senyawa volatil daun salam (eugenia polyanth wight) pada beberapa proses curing. dapat dilihat dalam tabel 2.1.
Tabel 2.1. kandungan senyawa kimia minyak atsiri daun salam dengan
proses curing dan tanpa proses curing
Golongan Senyawa persen area
c0 c2 c3
Alkana Sikloheksana, dodekana, 1,99 1,91 3,2
tridekana, 1-kloro-heksadekana, heksadekana
Alkena
4,4-dimetil-1-heksena,1-nonadekena, 0,5 2,09 1,6
toluena, 1,2-dimetil benzena, 1,3-dimetil benzena Aldehid
2,2-dimetil pentanal, oktanal,
nonanal, cis-4-dekenal, dekanal 39,61 33,78 39,23 Alkohol
Cis-3-heksena-1-ol, n-heksanol,
nerolidol 3,03 2,95 1,81
Ester Heksil asetat, heksil heksanoat, 0,97 0,48 0
monoterpen
α-osimen, β-osimen,
3,4-dimetil-2,4,6-oktatriena 34,71 47,22 43,57 Seskuiterpen α-kopaena, aromadendrena, α-humulen, alloaromadendrena, β-kamigrena, β-selinena, α- selinena, germakrena, Δ-kadidena,
α-panasinsen, karyofilena oksida
18,82 11,73 10,57
C0 = curing 0 hari, C2 = curing 2 hari, C4 = curing 4 hari
Penelitian ini menggunakan daun salam hasil curing dan diekstrak dengan metode simultan destilasi-ekstraksi dengan pelarut n-heksana selama 2 jam. Ekstrak yang diperoleh dikeringkan dengan MgSO4 anhidrat, diuapkan pelarutnya dengan rotari evaporator pengurangan tekanan dilanjutkan dengan pengaliran gas N2. Ekstrak flavor daun salam yang dihasilkan dianalisis menggunakan GC-MS. (Wartini, 2010)
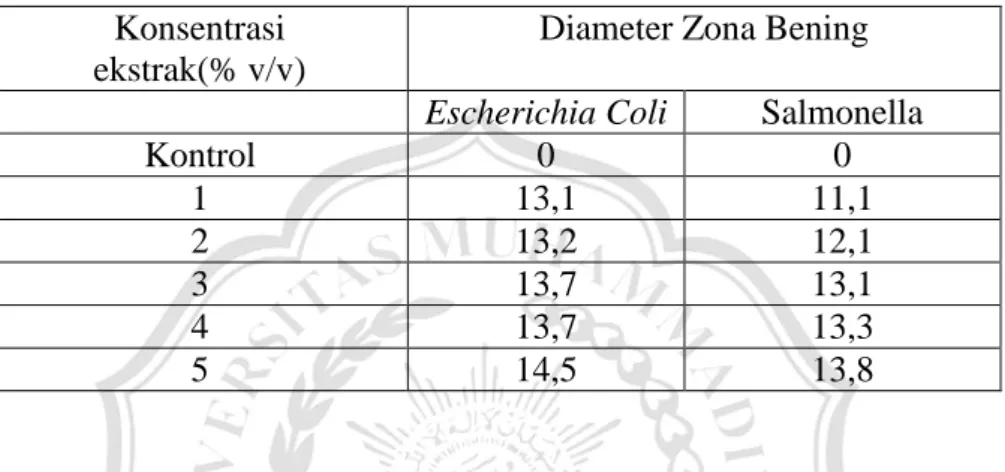
Hasil penelitian dari Khairun Nisya Rambe, 2012 Penelitian tentang rataan diameter zona bening ekstrak metanol daun salam (Sygyzium
polyanthum) Terhadap Bakteri Escherichia Coli dan Salmonella sp dengan
berbagai kosentrasi dapat dilihat dalam tabel 2.2.
Tabel 2.2. Pengaruh Penambahan ekstrak daun salam
Konsentrasi ekstrak(% v/v)
Diameter Zona Bening
Escherichia Coli Salmonella
Kontrol 0 0 1 13,1 11,1 2 13,2 12,1 3 13,7 13,1 4 13,7 13,3 5 14,5 13,8
Hasil dari penelitian adalah ekstrak metanol dari tumbuhan daun salam memiliki aktivitas sebagai antibakteri yang dapat menghambat pertumbuhan bakteri Escherichia Coli pada konsentrasi 5% sebesar 14,5 mm dan bakteri
Salmonella sebesar 13,8mm. Sementara untuk antibiotic yang digunakan
yaitu Chloramfenicol 30 μg mempunyai aktifitas antibakteri yang lebih tinggi yaitu 22 mm untuk bakteri Escherichia coli dan 19 mm untuk bakteri
salmonella sp (Khairun Nisya, 2012). 2.3 Metode Pengambilan Minyak Atsiri
2.3.1. Destilasi
Destilasi adalah pemisahan komponen-komponen suatu campuran dari dua jenis atau lebih berdasarkan perbedaan tekanan uap. (Guenther, 1987).
Macam metode destilasi adalah:
a. Destilasi dengan air
Bahan yang akan didestilasi kontak langsung dengan air mendidih. Bahan tersebut mengapung diatas air atau terendam secara sempurna tergantung dari bobot jenis dan jumlah bahan. Air dipanaskan dengan metode pemanasan yang biasa dilakukan, yaitu dengan panas langsung, mantel uap, pipa uap melingkar tertutup, atau dengan memakai pipa uap berlingkar terbuka dan tertutup (Guenther, 1987).
b. Destilasi dengan air dan uap
Bahan olah diletakan diatas rak-rak atau saringan berlubang. Ketel diisi dengan air sampai permukaan air berada tidak jauh dibawah saringan uap yang digunakan adalah uap jenuh, bahan yang akan didestilasi kontak langsung dengan uap tersebut (Guenther, 1987).
c. Destilasi dengan uap
Destilasi uap prinsipnya sama dengan penyulingan air dan uap, tetapi uap yang digunakan pada penyulingan uap adalah uap kelewat jenuh dengan tekanannya lebih dari 1 atm (Guenther, 1987).
2.3.2 Ekstraksi
Ekstraksi adalah jenis pemisahan satu atau beberapa bahan dari suatu padatan atau cairan. Prinsip ekstraksi adalah melarutkan minyak atsiri dalam bahan dengan pelarut organik yang mudah menguap. Proses ekstraksi biasanya dilakukan dalam wadah (ketel) yang disebut ”extractor”. Ekstraksi dengan pelarut organik umumnya digunakan untuk mengekstraksi minyak atsiri yang mudah rusak oleh pemanasan dengan uap dan air, terutama untuk mengekstrak minyak dari bunga-bungaan misalnya bunga cempaka, melati, mawar, kenanga, lily, dan lain-lain. Pelarut yang biasanya digunakan dalam ekstraksi yaitu: petroleum eter, benzena, dan alkohol (Guenther, 1987).
Pembagian metode ekstraksi menurut (DitJen POM, 2000) yaitu :
a. Cara dingin
Maserasi adalah proses pengekstrakan simplisia dengan menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan (kamar). Cairan penyari akan menembus dinding sel dan masuk ke dalam rongga sel yang mengandung zat aktif yang akan larut, karena adanya perbedaan konsentrasi antara larutan zat aktif di dalam sel dan di luar sel maka larutan terpekat didesak keluar.
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru
temperatur ruangan. Proses terdiri dari tahapan pengembangan, tahap maserasi antara, tahap perkolasi sebenarnya terus-menerus sampai diperoleh ekstrak (perkolat).
b. Cara Panas
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik.
Sokletasi adalah ekstraksi dengan menggunakan pelarut yang selalu baru dan yang umumnya dilakukan dengan alat khusus sehingga terjadi ekstrak kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada temperatur yang lebih tinggi dari temperatur ruangan, yaitu secara umum dilakukan pada temperatur 40-50 0C.
Pelarut sangat mempengaruhi proses ekstraksi (Guenther, 1987). Pemilihan pelarut pada umumnya dipengaruhi oleh faktor-faktor antara lain :
Selektivitas
Pelarut dapat melarutkan semua zat yang akan diekstrak dengan cepat dan sempurna.
Titik didih pelarut
Pelarut harus mempunyai titik didih yang cukup rendah sehingga pelarut mudah diuapkan tanpa menggunakan suhu tinggi pada proses pemurnian dan jika diuapkan tidak tertinggal dalam minyak.
Pelarut tidak larut dalam air
Pelarut bersifat inert sehingga tidak bereaksi dengan komponen yang lain.
Harga pelarut semurah mungkin.
Pelarut mudah terbakar.
Pelarut minyak atau lemak yang biasa digunakan dalam proses ekstraksi antara lain :
1. Etanol
Sering digunakan sebagi pelarut dalam laboratorium karena mempunyai kelarutan yang relatif tinggi dan bersifat inert sehingga tidak bereaksi dengan komponen lainnya. Etanol memiliki titik didih yang rendah sehingga memudahkan pemisahan minyak dari pelarutnya dalam proses distilasi. 2. n-Heksana
Merupakan pelarut yang paling ringan dalam mengangkat minyak yang terkandung dalam biji–bijian dan mudah menguap sehingga memudahkan untuk refluk. Pelarut ini memiliki titik didih antara 65–70 oC.
3. Isopropanol
Merupakan jenis pelarut polar yang memiliki massa jenis 0,789 g/ml. Pelarut ini mirip dengan ethanol yang memiliki kelarutan yang relatif tinggi. Isopropanol memiliki titik didih 81-82oC.
4. Etyl Asetat
Etil asetat merupakan jenis pelarut yang bersifat semi polar. Pelarut ini memiliki titik didih yang relatif rendah yaitu 77oC sehingga memudahkan pemisahan minyak dari pelarutnya dalam proses destilasi.
5. Aseton
Aseton larut dalam berbagai perbandingan dengan air, etanol, dietil eter,dll. Ia sendiri juga merupakan pelarut yang penting. Aseton digunakan untuk membuat plastik, serat, obat-obatan, dan senyawa-senyawa kimia lainnya.
6. Metanol
Pelarut metanol merupakan pelarut yang paling banyak digunakan dalam proses isolasi senyawa organik bahan alam.
2.4. Bakteri - Bakteri Pembusuk Makanan a. Salmonella typhimurium
Salmonella typhimurium merupakan bakteri gram negatif berbentuk
x 0,5-0,8 mm. Bakteri ini umumnya motil karena memiliki flagel (Karsinah, 1994). Salmonella typhimurium termasuk dalam famili
Enterobacteriaceae dan sub famili Escherichieae. Terdapat dalam usus
besar manusia sehingga disebut bakteri enterik. Bakteri ini juga terdapat di saluran pencernaan hewan ternak dan burung (Buckle, 1987).
Salmonella typhimurium merupakan bakteri fakultatif aerob, dengan suhu
optimum pertumbuhan antara 35-37 C, pada pH netral. Sedangkan aw
untuk pertumbuhan optimum Salmonella typhimurium adalah 0,99 dan aw
minimumnya sekitar 0,94. Meskipun begitu, Salmonella masih dapat bertahan hidup pada keadaan kering untuk waktu yang lama (Ray, 2001).
Gambar 2.2. Salmonella
Genus Salmonella ini dapat dibagi lagi menjadi serotypes yang jumlahnya lebih dari 2500. Beberapa serotypes yang dapat mengakibatkan penyakit pada manusia adalah Salmonella Enteriditis PT4 yang banyak terdapat pada telur, kemudian S. Typhimurium dan S.
b. Escherichia coli
Escherichia coli merupakan bakteri gram negatif yang berbentuk
basil, ada yang individu (monobasil), saling berpasangan (diplobasil) atau berkoloni membentuk rantai pendek (streptobasil), tidak membentuk spora maupun kapsula, berdiameter ± 1,1 – 1,5 x 2,0 – 6,0 μm, dapat bertahan hidup di medium sederhana dan memfermentasi laktosa menghasilkan asam dan gas, kandungan G+C DNA ialah 50 ‒ 51 mol % (Pelczar dan Chan, 1988:949).
Gambar 2.3. Escherichia coli
Escherichia coli merupakan bagian dari mikrobiota normal saluran
pencernaan. Escherichia coli dapat berpindah karena adanya kegiatan seperti dari tangan ke mulut atau dengan pemindahan pasif lewat minuman. Escherichia coli dalam usus besar bersifat patogen jika melebihi jumlah normalnya. Strain tertentu dapat menyebabkan peradangan selaput perut dan usus (gastroenteritis) (Pelczar dan Chan, 1988:809-810). Escherichia coli menjadi patogen berbahaya apabila hidup di luar usus seperti pada saluran kemih, yang dapat mengakibatkan peradangan selaput lendir (sistitis) (Pelczar dan Chan, 1988:545).
c. Staphylococcus aureus
Staphylococcus aureus merupakan bakteri berbentuk bulat dengan
diameter koloni 0,5-1 mm dan tersusun dalam susunan yang bergerombol menyerupai gambaran buah anggur. Staphylococcus aureus termasuk dalam famili Micrococcaceae, bersifat tidak motil dan tidak membentuk spora (Jawetz et al., 1996). Staphylococcus aureus penyebab keracunan makanan tumbuh padabahan makanan yang mengandung karbohidrat dan protein yang tinggi seperti telur (Fardiaz, 1993).
Gambar 2.4. Staphylococcus aureus
d. Basilus subtilis
Salah satu yang berperan dalam pembusukan daging, adalah bakteri
Basilus subtilis. Basilus subtilis termasuk dalam kingdom Bacteria,
Phylum:Firmicutes, Class: Bacilli, Order: Bacillales, Family:
Bacillaceae, Genus: Bacillus, dan Species: B. Subtilis. B. Subtilis
berbentuk batang dan merupakan bakteri gram positif yang biasa terdapat di tanah, air, udara dan materi tumbuhan yang terdekomposisi, Basilus
Gambar 2.5. Basilus subtilis
e. Vibrio Cholerae
Vibrio cholerae adalah kuman berbentuk batang bengkok seperti
koma dan pada biakan yang sudah tua berbentuk batang lurus, Vibrio
cholerae mempunyai flagel monotrika, Vibrio cholerae termasuk bakteri
gram negatif, berukuran 2-4 mikron, tidak bersepora dan tidak berkapsul. Bergerak aktif dengan satu flagel kutub. (Jawetz, 1991).
Gambar 2.6. Vibrio Cholerae
2.5. Uji Antibakteri
Uji antibakteri ini dilaksanakan terhadap suatu sediaan antibakteri untuk mengetahui konsentrasi terendah dari antibakteri tersebut dalam menghambat pertumbuhan mikroorganisme. Selain itu, respon MIC ini penting
dilaksanakan untuk mengetahui resistensi suatu bakteri terhadap antibakteri daun salam.
Beberapa metode uji antibakteri adalah:
1. Metode Disc Diffusion (Tes Kirby & Bauer)
Metode ini untuk menentukan aktivitas agen antibakteri. Piringan yang berisi agen antibakteri diletakkan pada media agar yang telah ditanami bakteri yang akan berdifusi pada media agar tersebut. Area jernih mengindikasikan adanya hambatan pertumbuhan bakteri oleh agen antibakteri pada permukaan media agar.
2. Metode E-Test
Metode E-Test digunakan untuk mengestimasi MIC (Minimum
Inhibitory Concentration) yaitu konsentrasi minimal suatu agen
antibakteri untuk dapat menghambat pertumbuhan
mikroorganisme. Pada metode ini digunakan strip plastik yang mengandung agen antibakteri dari kadar terendah hingga tertinggi dan diletakkan pada permukaan media agar yang telah ditanami
bakteri. Pengamatan dilakukan pada area jernih yang
ditimbulkannya yang menunjukkan kadar agen antibakteri yang menghambat pertumbuhan bakteri pada media agar.
3. Ditch Plate Technique
Pada metode ini sampel uji berupa agen antibakteri yang diletakkan pada parit yang dibuat dengan cara memotong media agar dalam
cawan petri pada bagian tengah secara membujur dan mikroba uji (maksimum 6 macam) digoreskan ke arah parit yang berisi agen antibakteri.
4. Cup Plate Tehnique
Metode ini serupa dengan metode Disc Diffusion, dimana dibuat sumur pada media agar yang telah ditanami dengan bakteri dan pada sumur tersebut diberi agen antibakteri yang akan diuji.
5. Gradient Plate Tehnique
Pada metode ini konsentrasi agen antibakteri pada media agar secara teoritis bervariasi dari nol hingga maksimal. Media agar dicairkan dan larutan uji ditambahkan. Campuran kemudian dituang ke dalam cawan petri dan diletakkan dalam posisi miring.
Plate diinkubasi selama 24 jam untuk memungkinkan agen
antibakteri berdifusi dan permukaan media mengering. Bakteri uji (maksimum 6 macam) digoreskan pada arah mulai dari konsentrasi tinggi ke rendah. Hasil diperhitungkan sebagai panjang total pertumbuhan bakteri maksimum yang mungkin dibandingkan dengan panjang pertumbuhan hasil goresan.
Jika:
X= panjang total pertumbuhan bakteri yang mungkin Y= panjang pertumbuhan aktual
C= konsentrasi agen antibakteri pada total volume media mg/ml atau µg/ml
maka konsentrasi hambatan adalah [(X.Y)]:C mg/ml atau µg/ml. Yang perlu diperhatikan adalah dari hasil perbandingan yang didapat dari lingkungan padat dan cair, faktor difusi agen antibakteri dapat mempengaruhi keseluruhan hasil pada media padat.
6. Metode Dilusi Cair / Broth Dilution Test
Metode ini mengukur MIC (Minimum Inhibitory Concentration). Cara yang dilakukan adalah dengan membuat seri pengenceran agen antibakteri pada medium cair yang ditambahkan dengan bakteri uji. Larutan uji agen antibakteri pada kadar terkecil yang terlihat jernih tanpa adanya pertumbuhan bakteri uji ditetapkan sebagai MIC. Larutan yang ditetapkan sebagai MIC tersebut selanjutnya dikultur ulang pada media cair tanpa penambahan bakteri uji ataupun agen antibakteri dan diinkubasi selama 18-24 jam. Media cair yang tetap terlihat jernih setelah inkubasi ditetapkan sebagai MIC.
7. Metode Dilusi Padat / Solid Dilution Test
Metode ini serupa dengan metode difusi cair namun menggunakan media padat (solid). Keuntungan metode ini adalah satu konsentrasi agen antibakteri yang diuji dapat digunakan untuk menguji beberapa bakteri uji.