LABORATORIUM KIMIA FARMASI FAKULTAS FARMASI
UNIVERSITAS HASANUDDIN
LAPORAN KELOMPOK KROMATOGRAFI LAPIS TIPIS
OLEH KELOMPOK III Jeni Rustan (N111 12 009)
Ika Reskia Nurul Hamka (N111 12 105) Edwin Rinaldi Philbert (N111 12 266 ) Krismawati Simon (N111 12 268)
GOLONGAN RABU PAGI ASISTEN : ANDI REZKIANI BETA
MAKASSAR 2013
Ayu Isitiqomah Fauziah (N111 12 296) Nurul Fajaryanti (N111 12 341)
Armala Sahid (N111 12 902) Suharpiami (N111 10 )
BAB I PENDAHULUAN
I.1 Latar Belakang
Didalam sebuah produk seperti cairan vitamin atau obat sejenis lainnya terkadang sulit untuk membedakan dengan benar tentang unsur / zat yang terkandung didalamnya. Dengan adanya kemajuan teknologi dibidang elektrokimia saat ini telah memiliki peranan penting dalam menentukan berbagai kandungan / unsur zat didalam cairan. Adapun teknologi yang masih digunakan saat ini seperti penerapan metode kromatografi. Kromatografi ( Chromatography ) sebenarnya secara harfiah berasal dari nama "warna menulis", namun tak ada hubungan secara langsung kecuali senyawa pertama yang mengalami pemisahan dengan cara ini adalah pigmen hijau tumbuhan, seperti klorofil. Kromatografi adalah suatu nama yang diberikan untuk teknik pemisahan tertentu. Pada dasarnya semua cara kromatografi menggunakan dua fasa yaitu yang pertama, fasa tetap ( Stationary Phase ) dan kedua, fasa bergerak (
Mobile Phase ). Dengan adanya penelitianpenelitian baru yang
memungkinkan untuk menerapkan prinsip kromatografi pada senyawa-senyawa yang tak berwarna termasuk gas.
Adapun perkembangan pesat dari beberapa jenis sistem kromatografi diantaranya adalah ; Kromatografi kertas, kromatografi lapisan tipis ( Thin Layer Chromatography ), kromatografi gas ( Gas
Chromatography ), dan kromatografi cair kinerja tinggi ( High Performance Liquid Chromatography ).
Pada kromatografi lapisan tipis, terdapat lapisan tipis ( tebal 0.1-2 mm ) yang terdiri atas bahan padat yang dilapiskan kepada permukaan penyangga datar ( plat ), yang biasanya terbuat dari kaca, tetapi dapat pula terbuat dari plat polimer atau logam. Lapisan yang melekat pada permukaan dengan bantuan bahan pengikat, biasanya kalsium sulfat dan kromatografi lapisan tipis dapat digunakan untuk keperluan yang luas dalam pemisahanpemisahan. Seperti halnya, kromatografi lapisan tipis yang banyak digunakan akhir-akhir ini oleh sebagian besar laboratorium di Indonesia menggunakan alat berupa TLC Scanner 3 merk CAMAG ( Made in Switzerland ) dengan metode kromatografi lapisan tipis, yang mana proses pengambilan sample yang berada pada permukaan plat (tempat sample yang telah dilakukan pemisahan) menggunakan scanner didalam alat tersebut kemudian hasilnya ditransfer ke PC dan dilakukan proses selanjutnya. Dan kelebihan dari TLC Scanner 3 CAMAG sendiri adalah mampu menganalisa senyawa berwarna dan tak berwarna, membutuhkan waktu yang relatif cepat.
I.2 Maksud dan Tujuan I.2.1 Maksud Percobaan
Mengetahui dan memahami cara-cara pemisahan dan identifikasi suatu zat dengan menggunakan kromatografi lapis tipis.
I.2.2 Tujuan Percobaan
Memisahkan dan mengidentifikasi parasetamol, vitamin c, teofilin dan kofein dengan metode kromatografi lapis tipis (KLT). Menentukan eluen-eluen yang cocok dengan sampel yang ingin diuji. Menentukan nilai Rf dari paracetamol, teofilin, vitamin C, koffein.
I.3 Prinsip Percobaan
Pemisahan parasetamol, Vitamin C, teofilin dan kofein dengan metode kromatografi lapis tipis (KLT) berdasarkan kecepatan partisi dan adsorbsi dari zat uji ke dalam eluen dengan parameter nilai Rf dari noda yang terbentuk.
BAB II
TINJAUAN PUSTAKA
II.1 Teori Umum
Dalam analisis dalam berbagai kandungan kimia, cara pertama yaitu campuran harus dipisahkan. Banyak cara untuk memisahkan senyawa dalam suatu campuran, salah satu diantaranya yang paling sering dan mudah diguunakan yaitu kromatografi. Proses kromatografi melibatkan 2 fase yaitu fase gerak dan fase diam. Fase gerak dapat berupa gas atau cairan sedangkan fase diam dapat berupa celah-celah atau bentuk granul padat atau berupa lapisan cairan encer yang diserap oleh sebuah padatan (1).
Kromatografi pertama kali dikembangkan oleh seorang ahli botani Rusia, Michael Rswett pada tahun 1903 untuk memisahkan pigmen berwarna dalam tanaman dengan cara perlokasi ekstrak petroleum eter dalam kolom gelasyang berisi kalsium karbonat (CaCO3) (2).
Kromatografi merupakan suatu teknik pemisahan yang menggunakan 2 fase yaitu gerak dan diam serta mengkuantifikasi macam-macam komponen dalam suatu campuran yang kompleks, baik komponen organik mauapun anorganik. (2)
Kromatografi dapat diklasifikasikan berdasarkan mekanisme pemisahannya misalnya kromatografi adsorpsi, afinitas, penukar ion, dsb. Kromatografi juga dapat diklasifikasikan berdasarkan alat yang digunakan
seperti Kromatografi Kertas (KK), Kromatografi Lapis Tipis (KLT), Kromatografi Cair Kinerja Tinggi (KCKT) dan Kromatografi Gas (GC). (3)
Dalam kromatografi juga dikenal istilah kromatografi jenis planar dan kolom. Kromatografi planar menggunakan fase diam berupa lempeng tipis yang umumnya terbuat dari kaca, lempeng alumunium dan sebagainya. Yang termasuk kromatografi planar yaitu kromatografi kertas (KK) dan kromatografi lapis tipis (KLT). (2)
Kromatografi lapis tipis dalam pelaksanaannya lebih mudah dan murah dibandingkan dengan kromatografi kolom. Demikiann juga peralatan yang digunakan. Dalam kromatografi lapis tipis, peralatan yang digunakan lebih sederhana dan hampir semua laboratorium melaksanakan metode ini (2).
Kromatografi lapis tipis (KLT) fase diamnya berupa lapisan seragam (uniform) pada permukaan bidang datar yang didukung oleh lempeng kaca, pelat alumunium, atau pelat plastik (2).
Fase diam pada KLT merupakan penjerap berukuran kecil dengan diameter partikel antara 10-30 μm. Semakin kecil ukuran rata-rata partikel fase diam, semakin baik kinerja KLT dalam hal efisien dan resolusinya. Penjerap yang paling sering digunakan adalah silica dan serbuk selulosa, sementara mekanisme sorpsi yang utama adalah pada KLT yaitu adsorpsi dan partisi. Untuk tujuan tertentu, pejerap atau fase diam dapat dimodifikasi dengan cara pembaceman (2).
Fase gerak dari pustaka dapat ditentukan dengan uji pustaka atau dengan dicoba-coba karena pengerjaan KLT ini cukup cepat dan mudah. Sistem yang paling sederhana ialah campuran 2 pelarut organik karena daya elusi campuran ini dapat diatur sedemikian rupa sehingga pemisahan dapat terjadi dengan optimal. Dalam pembuatan dan pemilihan fase gerak yang harus diperhatikan yaitu kemurnian dari eluen itu sendiri karena KLT merupak teknik yang sensitif; daya elusi dari pelarut itu juga harus diatur sedemikian rupa agar harga Rf berkisar antara 0,2-0,8 yang menandakan pemisahan yang baik; polaritas dari pelarut juga harus diperhatikan agar pemisahan terjadi dengan sempurna. (2)
Ada 2 cara yang digunakan untuk menganalisis secara kuantitatif dengan KLT. Pertama, bercak yang terbentuk diukur langsung pada lempeng dengan menggunakan ukur luas atau dengan teknik densitometri. Cara kedua yaitu dengan mengorek bercak lalu menetapkan kadar senyawa yang terdapat dalam bercak tersebut dengan menimbang hasil korekan.
Identifikasi secara kulitatif pada kromatografi kertas khususnya kromatografi lapis tipis dapat ditentukan dengan menghitung nilai Rf. Nilai Rf merupakan ukuran kecepatan migrasi suatu senyawa. Harga Rf didefinisikan sebagai perbandingan antara jarak senyawa titik awal dan jarak tepi muka pelarut dari titik awal (3).
Beberapa metode kromatografi
Kromatografi kertas, dinamakan berdasarkan bahan yang digunakan untuk fiksasi stationer
Kromatografi lapis tipis, mendapatkan namanya dari bentuk luar adsorbs yang digunakan sebagai fase stationer yang difiksasi sebagai lapis tipis pada penyangga seperti kaca atau gelas atau lembar aluminium.
Kromatografi kolom bahan sorpsi dapat diisikan ke dalam kolom gelas.
Kromatografi gas, membutuhkan kolom khusus yang diisi bahan sorpsi, sedangkan fase mobil yang digunakan adalah gas
Kromatografi tekanan tinggi, berbeda dengan kromatografi gas, sebagai ganti gas adalah suatu cairan yang dimasukkan dengan tekana tinggi kedalam kolom yang berisi
Kromatografi penuh terion, menggunakan harsa sintetik sebagai fase stationer yang bertindakk sebagai penukar kation atau anion
Kromatografi afinitas, sebagai fase stationer digunakan pengembang makromolekul dengan gugus fungsi yang mempunyai afinitas yang jelas atau mempunyai kemampuan bereaksi terhadap molekul yang hendak ditentukan.
Kromatografi gel, menggunakan gel untuk pemisah yang terdiri dari partikel berpori yang menggelembung.
II.2 Uraian bahan
1. Parasetamol (4 : 37)
Nama resmi : Acetaminophenum
Sinonim : Asetaminofen, parasetamol RM/BM : C8H9NO2 / 181,16
Pemerian : Hablur atau serbuk hablur putih; tidak berbau; rasa pahit
Kelarutan : Larut dalam 70 bagian air, dalam 7 bagian etanol (95%) P, dalam 13 bagian aseton P, dalam 40 bagian gliserol P, dalam 90 bagian propilengikol P, larut dalam alkali hiroksida.
Penyimpanan : Dalam wadah tertutup baik terlindung dari cahaya.
Kegunaan : Sebagai sampel 2. Vitamin C (4: 47 )
Nama resmi : Acidum Ascorbicum
Nama lain : Asam Askorbat, Vitamin C RM/BM : C6H8O6/ 173,13
Pemerian : serbuk atau hablur; putih atau agak kuning; tidak berbau, rasa asam. Oleh pengaruh cahaya lambat laun menjadi gelap. Dalam keadaan kering mantap di udara, dalam larutan cepat teroksidasi.
Penyimpanan : Dalam wadah tertutup rapat, terlindung cahaya Kelarutan : Mudah larut dalam air; agak sukar larut dalam
etanol (95%) P; praktis tidak larut dalam
kloroform P, dalam eter P dan dalam benzen P.
Kegunaan : Sampel
3. Teofilin (4: 597)
Nama resmi : Theophyllinum Nama lain : Teofilina
RM/BM : C7H8N4O2. H2O/ 198,18
Pemerian : Serbuk hablur; putih; tidak berbau; pahit; mantap di udara
Penyimpanan : Dalam wadah tertutup baik
Kelarutan : Larut dalam lebih kurang 180 bagian air, lebih mudah larut dalam air panas; larut dalam kurang lebih 120 bagian etanol (95%) P; mudah larut dalam larutan alkali hidroksida dan ammonia encer P.
Kegunaan : Sampel
4. Koffein (4 : 175 )
Nama resmi : Coffeinum Nama lain : Kofeina
RM/BM : C8H10N4O2/ 194,19
biasanya menggumpal; putih; tidak berbau; rasa pahit
Penyimpanan : Dalam wadah tertutup baik
Kelarutan : agak sukar larut dalam air dan etanol (95%) P; mudah larut dalam kloroform P; sukar larut dalam eter P.
Kegunaan : Sampel
5. NH4OH (4 : 86)
Nama resmi : Ammonia Nama lain : Amonia
RM/BM : NH4OH/ 35,05
Pemerian : Cairan jernih; tidak berwarna; bau khas; menusuk kuat
Penyimpanan : Dalam wadah tertutup rapat; di tempat sejuk Kelarutan : Mudah larut dalam air
Kegunaan : Sebagai eluen 6. Metanol (4 : 706 )
Nama resmi : Metanol P
RM/BM : CH3OH
Pemerian : Cairan tidak berwarna, jernih, bau khas Penyimpanan : Dalam wadah tertutup baik
Kelarutan : Dapat bercampur dengan air Kegunaan : Sebagai eluen
7. Etil asetat ( 4 : 673 )
Nama resmi : Etil asetat P RM/BM : CH3CO.O.C2H5
Pemerian : Cairan,tidak berwarna, baukhas Penyimpanan : Dalam wadah tertutup baik Kegunaan : Sebagai eluen
8. Kloroform (4: 151)
Nama resmi : Choloroformum Nama lain : Kloroform RM/BM : CHCl3 / 119,38
Pemerian : Cairan, mudah menguap; tidak berwarna; bau khas; rasa manis dan membakar
Penyimpanan : Dalam wadah tertutup baik bersumbat kaca, terlindung dari cahaya
Kelarutan : Larut dalam lebih kurang 200 bagian air; mudah larut dalam etanol mutlak P, dalam eter P, dalam sebagian besar pelarut organic, dalam minyak atsiri dan dalam minyak lemak
Kegunaan : Sebagai eluen 9. Aseton (4 : 655)
Nama resmi : Aseton Nama lain : Aseton RM/BM : (CH3)2CO
Pemerian : Cairan jernih tidak berwarna; mudah menguap; bau khas; mudah terbakar.
Penyimpanan : Dalam wadah tertutup
Kelarutan : Dapat bercampur dengan air, dengan etanol (95%) P, dengan eter P dan dengan kloroform P, memebentuk larutan jernih
Kegunaan : Sebagai sampel 10. n-heksana (4:283)
Nama resmi : Hexaminum
Nama lain : Heksamina
RM/BM : C6H12N4/140,19
Pemerian : Hablur mengkilap, tidak berwarna atau serbuk hablur putih, tidak berbau, rasa membakar dan manis kemudian agak pahit. Jika di panaskan dalam suhu ± 260⁰ menyublim.
Kelarutan : Larut dalam 1,5 bagian air, dalam 12,5 ml etanol (95 %) P dan dalam lebih kurang 10 bagian kloroform P
Penyimpanan : Dalam wadah tertutup baik Kegunaan : Sebagai eluen
III.3 Prosedur kerja
1. Kofein a. Dalam bulk
Fase diam : Silica
Fase gerak : S1 = etil asetat-metanol-NH4OH pekat
S2 = methanol
S3 = metanol-butanol
S4 = metanol-kloroform
Deteksi : UV 254 nm
Penyiapan sampel: Dilarutkan dalam kloroform-etanol
b. Kofein (dalam kapsul bersama denagn profoksifen dan aspirin) Fase diam : Silica
Fase gerak : Butil asetat Deteksi : UV 254 nm
Penyiapan sampel : Diserbuk lalu dilarutkan dalam metanol dan disaring
c. letakan spatula pada sekitar sampel kofein, tambahkan 4,0 ml diklorometana
- siapkan TLC plate. Gunakan pensil untuk menandai garis sekitar 0,5 cm dari pinggir piringan
- Gunakan mmembuat kapiler mikroskopik sebuah titik kecil dari tempat/ standar kofein
- Tempatkan 1 cm dari sisi kiri dan dan terus ke kanan menggunakan pensil
- Sekitar 1 cm dari tempat standar kofein, gunakan mikropipet lain untuk menandai
- Kembangkan TLC plate dengan menempatkannya pada TLC chamber yang telah diisi dengan pelarut hingga level 0,5 cm
- Ketika sudah mencapai 0,5 cm, hapus segera tanda dan tandai di mana npelarut meningkat.
- Biarkan pelaarut berhenti menguap dan amati dibawah cahaya UV. 2. Paracetamol
a. System TA-Rf 95, system TB-Rf 00, system TD-Rf 15, system TE-Rf 45, system TF-Rf 32, system TAD-Rf 26, system TAE-Rf 77, system TAJ-Rf 30, system TAK-Rf 05, system TAL-Rf 73 (solusi besi (III) klorida, biru samar, diasamkan larutan permanganate, positif)
b. Encerkan sejumlah zat uji dengan metanol P hingga diperoleh larutan yang mengandung ± 1 mg paracetamol per ml. Larutan memenuhi uji identifikasi secara kromatografi lapis tipis (281), gunakan fase gerak campuran dari kromopentana klorida P:metanol P (2: ) pH antara 3,8 dan 6,1
c. Fase diam: silica gel Fase gerak: Heksan-aseton Deteksi UV
OH
N N O
Penyiapan sampel: Sebanyak 1 gram sampel dipindahkan ke dalam tabung sentrifus gelas 15 ml bertutup rapat, lalu ditambah dengan 5 ml eter p, digojog selama 30 menit, disentrifus selama 15 menit pada 1000 rpm.
3. Teofilin
a. System TA-Rf 75; system TB-Rf 01; system TC-Rf 30; system TE-Rf II, system TF-Rf 9; system TG-Rf 33; system TL-Rf II; system TAF-Rf 70; system TAF-Rf 66; system TAJ-Rf 40; system TAK-Rf 21; system TAL-Rf 78 (pereaksi ludy+ encer, orange). Plate: silica gel F2S4 (0,25 mm ketebalan la pisau. Fase gerak: kloroform:metanol (9:1). Dilihat dengan UV (λ = 254 nm); Rf = 0,54
b. Teofilin (tablet dengan efedrin dan fenobarbital) Fase diam : Selulosa
Fase gerak:Kloroform-aseton-metanol-amonium hidroksida (50:10:10:1) Deteksi : UV 254 nm
Penyiapan sampel: serbuk ditambah dengan kloroform-metanol (4:1), lalu disaring.
c. Teofilin (kapsul dengan guanefesin) Fase diam : selulosa
Fase gerak: Metanol:air Deteksi : UV 254 nm
Penyiapan sampel: kapsul ditambah air lalu diekstraksi dengan kloroform 4. Vitamin C
a. (dalam bulk) Fase diam : silica
Fase gerak : metanol-aseton-air (20:4:3)
Deteksi : UV
Penyiapan sampel : dilarutkan dalam etanol absoulut.
b. - tuangkan 5 ml eluen ke kamar elusi, tutup ruangan dengan penutup dan diamkan 15-20 menit
- Sementara ruang elusi dijenuhkan dengan upa pelarut, ambil setengah dari tablet Vitamin C, lalu dihancurkan dengan mortar dan ditambah aquades
- Filtrat larutan tersebut ke gelas kimia
- Tandai garis start di silca gel 6-8 mm dari tepi piring dengan pensil grafit
- Tandai juga lokasi dimana sampel akan terlihat
- Jarak antara tetangga bintik-bintik harus sekitar 10 mm dan tempat harus minimal 5 mm dari tepi piring
c. Tuang 5 ml eluen ke kamar elusi. Tutup chamber dan diamkan 15-20 menit . sementara ruang dijenuhkan dengan uap pelarut
METODE KERJA
III.1 Alat dan Bahan III.1.1 Alat Percobaan
Alat-alat yang digunakan dalam percobaan ini adalah botol eluen, chamber, gelas piala, gelasukur, gunting, kertas saring, lampu UV 254 dan 366 nm, mistar , pensil, pinset, pipa kapiler (penotol), Silikagel GF254 III.1.2 Bahan Percobaan
Bahan yang digunakan dalam percobaan ini adalah aquadest, ammonia, etanol, etilasetat, kloroform, larutan sampel (Vitamin c, teofilin, kofein, parasetamol,), kloroform, NH4OH, aseton, dan metanol.
III.2 Cara kerja
1. Sampel dan pembanding dilarutkan dengan NH4OH dalam 2 vial
dan dibungkus dengan alumunium foil
2. Eluen dibuat dengan perbandingan yang sudah ditentukan
3. Chamber dijenuhkan dengan eluen yang telah dibuat, kertas saring dimasukan dan chamber ditutup dengan penutup kaca.
4. Larutan sampel serta larutan pembanding tersebut diambil menggunakan pipa kapiler
5. Sampel dalam pipa kapiler tersebut ditotol bagian batas bawah yang sudah ditandai pada lempeng yang sudah diaktifkan terlebih dahulu
7. Ditunggu hingga eluen mencapai batas atas dan lempeng diagkat, diangin-anginkan beberapa menit
BAB IV
HASIL PENGAMATAN
IV.1 Data Pengamatan
Keterangan
a: jarak noda sampel yang terbentuk b: Jarak noda pembanding yang terbentuk c: Jarak yang ditempuh eluen
IV.2 Perhitungan
Rf a) Kelompok I
Sampel A (heksan:aseton)
KEL Sampel Pembanding Eluen a b c Rf
I A Paracetamol Heksan:aseton (3:1) Etanol:etil asetat (2:1) 1,2 - - - 4,2 - 0,28 - II B Koffein Heksan:Etil asetat (1:3) Metanol:Air (2:1) - - - - - - - - III C Teofilin Kloroform:aseton (6:1) Methanol:NH4OH (1:1) 0,8 - 0,8 - 4,2 - 0,19 - IV D Vitamin C Metanol:Aseton (2:4) Metanol:Etil Asetat (1:3) 3,5 3,6 - - 4,35 4,35 0,80 0,82 V E Paracetamol Heksan:aseton (3:1) Etanol:etil asetat (2:1) - - - - - - - - VI F Vitamin C Metanol:Aseton (2:4) Metanol:Etil Asetat (1:3) 3,2 2,7 - - 4,5 4,0 0,8 0,675
Rf =
= 0,28
Sampel A (etanol:etil asetat)
Rf =
= 0,309
b) Kelompok II Sampel B c) Kelompok III
Sampel C (Kloroform: aseton) (6:1)
Rf =
= 0,19
Pembanding (teofilin) (klororofm:aseton) (6:1)
Rf = = 0,19 d) Keompok IV Sampel D (metanol:aseton) Rf = = 0,80
Sampel D (metanol:etil asetat)
Rf =
= 0,82
f) Kelompok VI
Sampel F (metanol:aseton)
Rf =
= 0,80
Sampel F (metanol:etil asetat)
Rf =
= 0,675 IV.3 Gambar
Laboratorium Kimia Farmasi Fakultas Farmasi Universitas Hasanuddin
Sampel : C
Pembanding : Teofilin
Eluen : Kloroform : Aseton (6:1)
Deteksi : UV 254 nm
Laboratorium Kimia Farmasi Fakultas Farmasi Universitas Hasanuddin
Sampel : C
Pembanding : Teofilin
Eluen : Kloroform : Aseton (6:1)
Laboratorium Kimia Farmasi Fakultas Farmasi Universitas Hasanuddin Sampel : C Pembanding : Teofilin Eluen : Metanol : NH4OH (1:1) Deteksi : UV 366 nm
Laboratorium Kimia Farmasi Fakultas Farmasi Universitas Hasanuddin Sampel : C Pembanding : Teofilin Eluen : Metanol : NH4OH (1:1) Deteksi : UV 254 nm
BAB V
PEMBAHASAN
Pada percobaan ini dilakukan analisis kuantitatif dengan metode kromatografi lapis tipis. Sampel yang dianalisis yaitu sampel C dengan pembanding berupa teofilin baku.
Pada percobaan ini, mula-mula sampel dilarutkan dengan NH4OH didalam vial, kemudian eluen dimasukan dalam chamber dan dijenuhkan dengan kertas saring sebagai penanda kejenuhan chamber. Setelah itu sampel dan pembanding atau baku teofilin ditotolkan pada silica gel yang telah diaktifkan.
Chamber dijenuhkan dengan eluen agar aluen lebih mudah untuk mempartisi sampel maupuin pembanding. Digunakan silica gel karena mengandung bahan tambahan kalsium sulfat untuk mempertinggi daya lekat.
Harga Rf dipengaruhi oleh faktor sebagai berikut: - Pelarut - Bahan pengembang - Suhu - Kejenuhan chamber - Kelembaban ruangan - Konsentrasi
Pada analasis teofillin digunakan 2 eluen yaitu campuran kloroform dengan aseton dengan perbandingan (6:1) serta metanol:NH4OH dengan perbandingan (1:1)
Noda yang terbentuk dengan penggunaan eluen kloroform dan aseton (6:1), sampel danpembanding membentuk noda yang sama sepanjang 0,8 cm diamati dengan UV 254 nm didapat nilai Rf sebesar 0,19. Sedangkan yang diamati dengan UV 366 nm tidak terlihat dengan baik.
Pada sampel C dengan pembanding teofilin, dipisahkan dengan eluen metanol:NH4OH dengan perbandingan (1:1). Pada percobaan ini
tidak terbentuk noda. Kemungkinan karena sampel yang
BAB VI
PENUTUP
VI.1 Kesimpulan
Dari percobaan ini dapat ditarik kesimpulan yaitu:
1. Harga Rf sampel C dengan pembanding teofillin menggunakan eluen kloroform:aseton (6:1) adalah 0,19
2.
3. Rf sampel dan pembanding dengan eluen metanol:NH4OH tidak
dapat ditentukan dikarenakan eluen yang tidak bisa
VI.2 Saran
1. Sebaiknya alat-alat laboratorium diperbanyak jumlahnya agar praktikum berjalan lancar
2. Sebaiknya jumlah asisten yang mengawasi di laboratorium diperbanyak agar praktikum lebih efisien
DAFTAR PUSTAKA
1. Ewing, Galen Wood. Instrumental of Chemical Analysis Fifth edition. Singapore: McGraw-Hill. 1985
2. Gholib, Ibnu.. Kimia Farmasi Analisis. Yogyakarta: Pustaka Pelajar. 2007
3. Marzuki, Asnah.. Kimia Analisis Farmasi. Makassar: Dua Satu Press. 2013
4. Ditjen POM. Farmakope Indonesia, Edisi III. Jakarta: Departemen Kesehatan RI. 1979
Pengertian Kromatografi Lapis Tipis
Kromatografi lapis tipis (KLT) adalah salah satu metode pemisahan komponen menggunakan fasa diam berupa plat dengan lapisan bahan adsorben inert. KLT merupakan salah satu jenis kromatografi analitik. KLT sering digunakan untuk identifikasi awal, karena banyak keuntungan menggunakan KLT, di antaranya adalah sederhana dan murah. KLT termasuk dalam kategori kromatografi planar, selain kromatografi kertas.
Peralatan KLT
Kromatografi lapis tipis menggunakan plat tipis yang dilapisi dengan adsorben seperti silika gel, aluminium oksida (alumina) maupun selulosa. Adsorben
tersebut berperan sebagai fasa diam.
Fasa gerak yang digunakan dalam KLT sering disebut dengan eluen. Pemilihan eluen didasarkan pada polaritas senyawa dan biasanya merupakan campuran beberapa cairan yang berbeda polaritas, sehingga didapatkan perbandingan tertentu. Eluen KLT dipilih dengan cara trial and error.Kepolaran eluen sangat berpengaruh terhadap Rf (faktor retensi) yang diperoleh.
Faktor Retensi
Faktor retensi (Rf) adalah jarak yang ditempuh oleh komponen dibagi dengan jarak yang ditempuh oleh eluen. Rumus faktor retensi adalah:
Nilai Rf sangat karakterisitik untuk senyawa tertentu pada eluen tertentu. Hal tersebut dapat digunakan untuk mengidentifikasi adanya perbedaan senyawa dalam sampel. Senyawa yang mempunyai Rf lebih besar berarti mempunyai kepolaran yang rendah, begitu juga sebaliknya. Hal tersebut dikarenakan fasa diam bersifat polar. Senyawa yang lebih polar akan tertahan kuat pada fasa diam,
Rf KLT yang bagus berkisar antara 0,2 - 0,8. Jika Rf terlalu tinggi, yang harus dilakukan adalah mengurangi kepolaran eluen, dan sebaliknya.
Cara Menggunakan KLT
KLT sangat berguna untuk mengetahui jumlah komponen dalam sampel. Peralatan yang digunakan untuk KLT adalah chamber (wadah untuk proses KLT) , pinset, plat KLT, dan eluen. Inilah langkah-langkah memakai KLT:
1. Potong plat sesuai ukuran. Biasanya, untuk satu spot menggunakan plat selebar 1 cm. Berarti jika menguji 3 sampel (3 spot) berarti menggunakan plat selebar 3 cm.
2. Buat garis dasar (base line) di bagian bawah, sekitar 0,5 cm dari ujung bawah plat, dan garis akhir di bagian atas.
3. Menggunakan pipa kapiler, totolkan sampel cairan yang telah disiapkan sejajar, tepat di atas base line. Jika sampel padat, larutkan pada pelarut tertentu. Keringkan totolan.
4. Dengan pipet yang berbeda, masukkan masing-masing eluen ke dalam
chamber dan campurkan.
5. Tempatkan plat pada chamber berisi eluen. Base line jangan sampai tercelup oleh ulen. Tutuplah chamber.
6. Tunggu eluen mengelusi sampel sampai mencapai garis akhir, di sana pemisahan akan terlihat.
7. Setelah mencapai garis akhir, angkat plat dengan pinset, keringkan dan ukur jarak spot. Jika spot tidak kelihatan, amati pada lampu UV. Jika masih tak terlihat, semprot dengan pewarna tertentu seperti kalium kromat atau ninhidrin.
Kromatografi lapis tipis
Kromatografi Lapis Tipis (KLT) merupakan cara pemisahan campuran senyawa menjadi senyawa murninya dan mengetahui kuantitasnya yang menggunakan. Kromatografi juga merupakan analisis cepat yang memerlukan bahan sangat sedikit, baik penyerap maupun cuplikannya.
KLT dapat dipakai dengan dua tujuan. Pertama, dipakai selayaknya sebagai metode untuk mencapai hasil kualitatif, kuantitatif atau preparatif. Kedua, dipakai untuk menjajaki sistem pelarut dan sistem penyangga yang akan dipakai dalam kromatografi kolom atau kromatografi cair kinerja tinggi (Gritter et al, 1991).
KLT dapat digunakan untuk memisahkan senyawa – senyawa yang sifatnya hidrofobik seperti lipida – lipida dan hidrokarbon yang sukar dikerjakan dengan kromatografi kertas. KLT juga dapat berguna untuk mencari eluen untuk kromatografi kolom, analisis fraksi yang diperoleh dari kromatografi kolom, identifikasi senyawa secara kromatografi dan isolasi senyawa murni skala kecil. Pelarut yang dipilih untuk pengembang disesuaikan dengan sifat kelarutan senyawa yang dianalisis. Bahan lapisan tipis seperti silika gel adalah senyawa yang tidak bereaksi dengan pereaksi – pereaksi yang lebih reaktif seperti asam sulfat. Data yang diperoleh dari KLT adalah nilai Rf yang berguna untuk identifikasi senyawa. Nilai Rf untuk senyawa murni dapat dibandingkan dengan nilai Rf dari senyawa standar. Nilai Rf dapat didefinisikan sebagai jarak yang ditempuh oleh senyawa dari titik asal dibagi dengan jarak yang ditempuh oleh pelarut dari titik asal. Oleh karena itu bilangan Rf selalu lebih kecil dari 1,0.
Pelaksanaan KLT
1. Fase Diam
Fase diam yang digunakan dalam KLT merupakan penjerap berukuran kecil dengan diameter partikel antara 10-30 μm. Semakin kecil ukuran rata-rata partikel fase diam dan semakin sempit kisaran ukuran fase diam, maka semakin baik kinerja KLT dalam hal efisiensi dan resolusinya.
Penjerap yang paling sering digunakan adalah silika dan serbuk selulosa, sementara mekanisme sorpsi yang utama pada KLT adalah adsorpsi dan partisi (Gandjar & Rohman, 2007).
2. Fase Gerak
Fase gerak pada KLT dapat dipilih dari pustaka, tetapi lebih sering dengan mencoba-coba karena waktu yang diperlukan hanya sebentar. Sistem yang paling sederhana ialah campuran 2 pelarut organik karena daya elusi campuran kedua pelarut ini dapat mudah diatur sedemikian rupa sehingga pemisahan dapat terjadi secara optimal. Berikut adalah beberapa petunjuk dalam memilih dan mengoptimasi fase gerak :
1. Fase gerak harus mempunyai kemurnian yang sangat tinggi karena KLT
merupakan teknik yang sensitif.
2. Daya elusi fase gerak harus diatur sedemikian rupa sehingga harga Rf terletak
antara 0,2-0,8 untuk memaksimalkan pemisahan.
3. Untuk pemisahan dengan menggunakan fase diam polar seperti silika gel,
polaritas fase gerak akan menentukan kecepatan migrasi solut yang berarti juga menentukan nilai Rf. Penambahan pelarut yang bersifat sedikit polar seperti dietil eter ke dalam pelarut non polar seperti metil benzene akan meningkatkan harga Rf secara signifikan (Gandjar & Rohman, 2007).
Tabel 2.1. Beberapa Sistem Pemisahan dengan KLT dari Bahan Alam (Gibbons, 2006)
Eluen Fase Diam Keterangan
Heksan : Etil asetat Silika Gel Sistem umum yang digunakan
Petrol : Dietileter Silika Gel Sistem umum yang digunakan untuk senyawa
nonpolar seperti terpen dan asam lemak
Petrol : Kloroform Silika Gel Berguna untuk pemisahan derivat asam sinamat dan
kumarin Toluen : Etil asetat :
Asam asetat (TEA)
Silika Gel Komposisi 80:18:2 v/v atau 60:38:2 v/v baik untuk
pemisahan metabolit asam
Kloroform : Aseton Silika Gel Sistem umum untuk produk dengan polaritas
sedang n-Butanol : Asam
Asetat : Air
Silika Gel Sistem polar untuk flavonoid dan glikosida
Metanol : Air C18 Dimulai dengan metanol 100% dilanjutkan dengan
penambahan konsentrasi air
Asetonitril : Air C18 Sistem umum Reverse phase
Metanol : Air Selulosa Memisahkan senyawa dengan kepolaran tinggi
3. Penotolan Sampel
Untuk memperoleh roprodusibilitas, volume sampel yang ditotolkan paling sedikit 0,5 μl. Jika volume sampel yang ditotolkan lebih besar dari 2-10 μl, maka penotolan harus dilakukan secara bertahap dengan dilakukan pengeringan antar totolan (Gandjar & Rohman, 2007).
4. Pengembangan
Bila sampel telah ditotolkan maka tahap selanjutnya adalah mengembangkan sampel dalam bejana kromatografi yang sebelumnya telah dijenuhi dengan uap fase gerak. Tepi bagian bawah lempeng tipis yang telah ditotoli sampel dicelupkan kedalam fase gerak kurang lebih 0,5-1 cm. Tinggi fase gerak dalam bejana harus dibawah lempeng yang telah berisi totolan sampel.
Bejana kromatografi harus tertutup rapat dan sedapat mungkin volume fase gerak sedikit mungkin, akan tetapi harus mampu mengelusi lempeng sampai ketinggian lempeng yang telah ditentukan. Untuk melakukan penjenuhan fase gerak, biasanya bejana dilapisi dengan kertas saring. Jika fase gerak telah mencapai ujung dari kertas saring, maka dapat dikatakan bahwa fase gerak telah jenuh (Gandjar & Rohman, 2007).
5. Deteksi Bercak
Deteksi bercak pada KLT dapat dilakukan secara kimia dan fisika. Cara kimia yang biasa digunakan adalah dengan mereaksikan bercak dengan suatu pereaksi melalui cara penyemprotan sehingga bercak menjadi jelas. Cara fisika yang dapat digunakan untuk menampakkan bercak adalah dengan cara pencacahan radioaktif dan fluorosensi sinar ultraviolet. Fluorosensi sinar ultraviolet terutama untuk senyawa yang dapat berfluorosensi, membuat bercak akan terlihat jelas (Gandjar & Rohman, 2007).
Deteksi senyawa dilakukan dengan menggunakan detektor UV di bawah sinar UV 254 nm, indikator pada plat KLT akan memancarkan warna hijau dan pada UV 366 nm akan memancarkan warna ungu. Komponen yang menyerap cahaya pada 254 atau 366 nm akan tampak sebagai bercak gelap pada plat yang
bercahaya (Gibbons, 2006). Metode deteksi lain adalah dengan menggunakan pereaksi semprot. Pereaksi semprot yang umum digunakan dapat dilihat pada tabel 2.2.
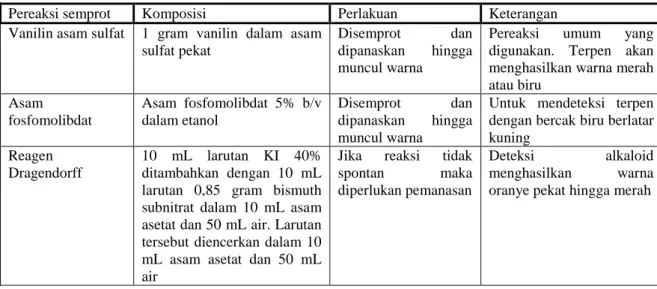
Tabel 2.2. Beberapa Jenis Pereaksi Semprot untuk KLT (Gibbons, 2006)
Pereaksi semprot Komposisi Perlakuan Keterangan
Vanilin asam sulfat 1 gram vanilin dalam asam
sulfat pekat
Disemprot dan
dipanaskan hingga
muncul warna
Pereaksi umum yang
digunakan. Terpen akan menghasilkan warna merah atau biru Asam fosfomolibdat Asam fosfomolibdat 5% b/v dalam etanol Disemprot dan dipanaskan hingga muncul warna
Untuk mendeteksi terpen dengan bercak biru berlatar kuning
Reagen Dragendorff
10 mL larutan KI 40% ditambahkan dengan 10 mL larutan 0,85 gram bismuth subnitrat dalam 10 mL asam asetat dan 50 mL air. Larutan tersebut diencerkan dalam 10 mL asam asetat dan 50 mL air
Jika reaksi tidak
spontan maka
diperlukan pemanasan
Deteksi alkaloid
menghasilkan warna