Abstrak
Penelitian ini bertujuan untuk mengetahui regulasi gen OsHox6 melalui studi bioinformatik promoter gen OsHox6 serta analisis pola ekspresinya di tanaman padi transgenik yang mengandung fusi promoter OsHox6 dengan gen pelapor β-glucuronidase. Satu kb fragment DNA upstream daerah penyandi
OsHox6 diiolasi dari daun tanaman padi cv Ciherang, disekuen, difusikan dengan
gen pelapor GUSPlus dari vektor pCAMBIA1305.1 dan ditrasformasi ke dalam genom tanaman padi varietas Ciherang dan Nipponbare. Ekspresi β-glucuronidase (GUS) diamati dengan uji histokimia. Pensejajaran sekuen promoter hasil isolasi dari padi varietas Ciherang dengan sekuen DNA genom padi acuan (varietas Nipponbare) menunjukkan kemiripan yang tinggi (identity 100%). Hasil analisis bioinformatik sekuen DNA promoter OsHox6 mengindikasikan bahwa promoter OsHox6 mengandung elemen responsif terhadap kekeringan dan ABA. TATA box yang umum dijumpai di daerah promoter tanaman, berdasarkan hasil analisis sekuen promoter OsHox6, tidak ditemukan. Hasil analisis pola ekspressi temporal dan spasial promoter gen
OsHox6 melalui visualisasi gen GUSPlus secara histokimia pada jaringan
tanaman transgenik Ciherang dan Nipponbare menunjukkan bahwa aktivitas promoter ini meningkat saat kekeringan pada organ vegetatif maupun generatif. Aktivitas promoter OsHox6 lebih kuat pada jaringan muda yang aktif membelah. Kata Kunci: Promoter terinduksi kekeringan, OsHox6, Ciherang, Nipponbare
Abstract
This study was aimed to understand the regulation of OsHox6 gene through bioinformatics study of OsHox6 gene promoter and the analysis of its expression patterns in transgenic rice plants containing the fusion of promoter OsHox6 with the β-glucuronidase reporter gene. One kb DNA fragment upstream coding region of OsHox6 was isolated from the leaves of rice Ciherang, sequenced, fused with a GUSPlus reporter gene of vector pCAMBIA1305.1 and transformmed into the genome of rice Nipponbare and Ciherang. Expression of β-glucuronidase (GUS) was observed with histochemical assay. Alignment of isolated promoter sequence of rice cv Ciherang with that of reference fragments of genomic DNA of rice Nipponbare showed a high similarity with 100% identity. The results of the promoter sequence analysis indicate that OsHox6 promoter contains cis-regulatory elements responsive to drought and ABA. TATA box that commonly found in plants promoter region, based on the promoter sequences analysis, was not found. The results of temporal and spatial expression patterns analysis of OsHox6 gene through the histochemical visualization of GUSPlus in transgenic plant tissue of Ciherang and Nipponbare showed that the promoter activity was increased during drought stress both in vegetative and generative organ. Promoter OsHox6 is highly active in meristematic tissue.
Pendahuluan
Respon tanaman terhadap kekeringan sangat kompleks dan melibatkan banyak gen (Rabbani et al. 2003, Shinozaki and Yamaguchi-Shinozaki 2006). Sejumlah gen yang responsif kekeringan telah dilaporkan sebelumnya meskipun belum semuanya berhasil dikarakterisasi dan diketahui fungsinya. Salah satu upaya untuk mempelajari fungsi suatu gen adalah dengan mempelajari aktivitas promoternya. Selain itu, identifikasi promoter terinduksi kekeringan sangat penting dilakukan dalam upaya pengembangan tanaman toleran kekeringan karena penggunaan promoter konstitutif seringkali menimbulkan efek negatif pada pertumbuhan dan produksi tanaman (Jaglo-Ottosen et al. 1998; Kasuga et al. 1999; Pino et al. 2007; Purwantomo 2007). Promoter adalah bagian dari DNA tempat menempelnya RNA polimerase dan faktor transkripsi untuk memulai proses transkripsi suatu gen (http://www.biology-online.org/dictionary/ Promoter).
Berbagai pendekatan telah dikembangkan untuk tujuan identifikasi dan isolasi promoter. Untuk memprediksi promoter beberapa metode komputasi telah dikembangkan (Qiu 2003). Metode ini secara umum dibagi ke dalam dua kelompok. Pertama, pendekatan berbasis motif-motif tertentu (seperti TATA box, CAAT box, dsb) sebagai dasar pencarian. Kedua, pendekatan berbasis urutan basa tertentu yang menggunakan perbedaan urutan basa tertentu (seperti preferensi pasangan basa triplet di daerah awal transkripsi, frekuensi heksamer di daerah 5’ sepanjang 100 pasang basa, dsb) sebagai dasar untuk membedakan daerah promoter dengan daerah non-promoter. Tingkat keberhasilan prediksi promoter dengan metode komputasi bervariasi antara 15-54%.
Saat ini, jumlah gen yang telah berhasil diannotasi dengan baik terus meningkat. Hal ini memudahkan penentuan daerah promoter dengan mensejajarkan mRNA atau cDNA utuh dengan DNA genomik yang sepadan. Dengan pendekatan ini, tingkat ketepatan identifikasi promoter dapat mencapai lebih dari 80% (Qiu 2003). Setelah promoter berhasil diidentifikasi, selanjutnya promoter dapat diisolasi.
Pendekatan yang umum digunakan untuk isolasi promoter adalah dengan menggunakan pendekatan berbasis PCR. Pendekatan ini secara umum dibagi ke
dalam dua kelompok. Pertama, teknik berbasis PCR yang digunakan untuk mendapatkan sekuen yang belum diketahui baik di daerah 5’ atau 3’ dari suatu sekuen yang sudah diketahui urutan basanya. Ada dua metode PCR yang paling banyak digunakan untuk mendapatkan daerah 5’ atau 3’ dari suatu sekuen yang sudah diketahui urutan basanya, inverse PCR dan PCR vectorette (Kilstrup & Kristiansen 2000). Inverse PCR menggunakan dua primer yang masing-masing terletak di ujung fragmen dan mengarah ke bagian luar dari fragmen tersebut (Souza et al. 2009). Cetakan untuk reaksi amplifikasi adalah pustaka fragmen DNA kromosom yang telah disirkulasi. Metode genom walking lainnya disebut metode PCR vectorette. Vectorette adalah kaset DNA beruntai ganda parsial yang
ujung 5'-nya terfosforilasi, dan setelah ligasi unit vectorette dengan campuran fragmen DNA kromosom, masing-masing untai memiliki unit vectorette yang menempel pada kedua ujungnya. Pustaka ini digunakan sebagai cetakan untuk perbanyakan DNA menggunakan primer spesifik genom bersama dengan primer spesifik vectorette yang identik tetapi tidak komplemen satu sama lain. Pendekatan ini sangat populer saat ini karena sudah banyak kit yang tersedia secara komersial
Kedua, teknik PCR genomik yang memanfaatkan informasi sekuen utuh cDNA yang tersedia dan data sekuen lengkap genom di pangkalan data (GenBank). Daerah promoter diidentifikasi dengan mensejajarkan sekuen utuh cDNA dan sekuen genom kemudian diisolasi menggunakan sepasang primer yang spesifik. Rai et al. (2009) berhasil mengidentifikasi dan mengisolasi 3 promoter terinduksi kekeringan (rab16A, OsABA2, dan HP1) dengan menggunakan metode PCR genomik.
(Yang et al. 2002; Chen et al. 2005; Tittarelli et al. 2007).
Saat ini, banyak promoter gen terinduksi kekeringan dari berbagai tanaman yang telah berhasil diisolasi dan dipelajari, diantaranya adalah RD29A (Yamaguchi-Shinozaki & Shinozaki 1993b), BcDh2 (Shen et al. 2004), AtHB7 dan AtHB12 (Olsson et al. 2004), MYB (Chen et al. 2005), Hahb4 (Dezar et al. 2005b), dan rab16, OsABA2, dan HP1 (Rai et al. 2009). Dari hasil penelitian tersebut diketahui bahwa promoter terinduksi kekeringan memiliki motif elemen
cis-acting yang spesifik yang tidak dimiliki oleh promoter lainnya. Selain itu
responsive element (ABRE), drought responsive element (DRE), myb, myc adalah
beberapa elemen cis-acting penting yang banyak dijumpai pada daerah promoter gen terinduksi kekeringan dan bertanggung jawab dalam menginduksi ekspresi gen pada saat tanaman mengalami kondisi keterbatasan air (Shen et al. 2004; Chen et al. 2005; Rai et al. 2009).
Gen OsHox6 dari padi merupakan anggota dari famili HD-Zip. Purwantomo (2007) dan Agalou et al. (2008) melaporkan bahwa transkrip
OsHox6 meningkat pada saat ada induksi kekeringan. Namun, hingga saat ini,
belum ada laporan mengenai analisis promoter gen OsHox6. Analisis promoter penting dilakukan untuk mengetahui mekanisme regulasi proses transkripsi gen pada level molekuler.
Di dalam kegiatan penelitian ini promoter OsHox6 dari padi varietas Ciherang diisolasi dan dipelajari aktivitasnya pada dua tanaman padi varietas Ciherang dan Nipponbare. Promoter diisolasi menggunakan pendekatan PCR genomik dengan memanfaatkan informasi yang ada di GenBank. Kandidat promoter kemudian difusikan dengan gen pelapor GUSPlus dan ditransformasikan ke dalam genom tanaman padi cv Ciherang dan Nipponbare. Aktifitas promoter diamati pada organ vegetatif dan generatif tanaman T0 menggunakan uji GUS. Selanjutnya, elemen cis-acting terkait kekeringan diprediksi dengan bantuan perangkat lunak PLACE (Plant cis-acting regulatory DNA elements)
(http://www.dna.affrc. go.jp/PLACE/ signalscan.html).
Bahan dan Metode Bahan Tanaman
Promoter OsHox6 diisolasi dari tanaman padi (Oryza sativa L.) varietas Ciherang. Fusi promoter OsHox6 dengan gen pelapor GUSPlus ditransformasi ke dalam genom tanaman padi varietas Ciherang dan Nipponbare.
Isolasi DNA dan Konstruksi Plasmid
DNA genom total diisolasi dari daun padi mengikuti protokol yang dijelaskan oleh Heusden et al. (2000). Sekuen promoter gen terinduksi kekeringan
AF145730) dengan klon BAC APOO5681 NCBI (http://www.ncbi.nlm.nih.gov). Daerah upstream cDNA OsHox6 sepanjang 1 kb diperbanyak menggunakan sepasang primer PCR, selanjutnya diisolasi dan disub-klon ke dalam vektor pGEM®-T Easy (Promega). Primer forward 5 ′-GCGAATTCTGGTGTATGTGTGGTGTGTGTTC- 3′ mengandung situs restriksi
EcoRI (miring) sedangkan primer reverse 5′-ATCCATGGCGCCCGATCGAG
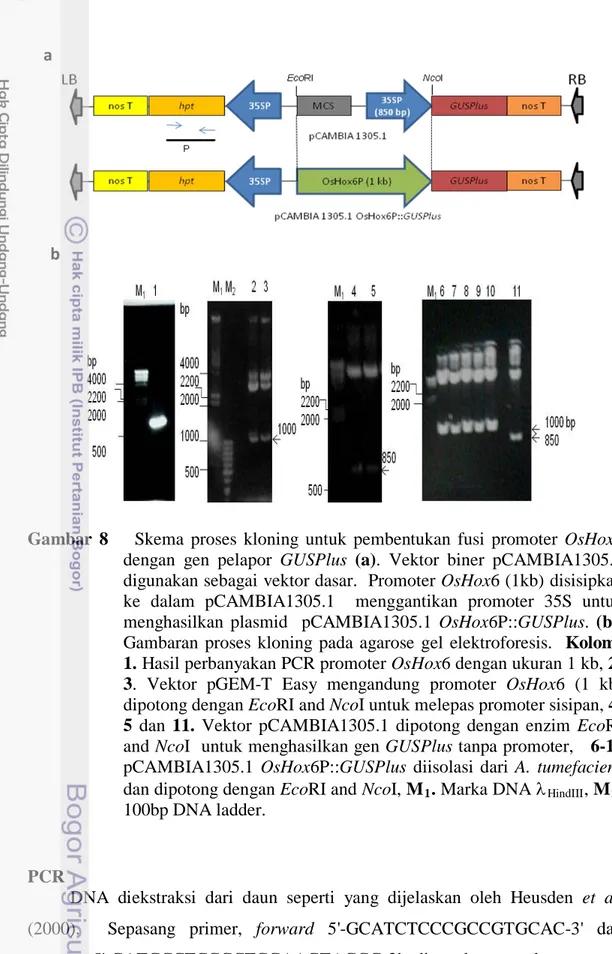
CTCTGATGATCGATG-3′ mengandung situs restriksi NcoI (tebal) pada daerah ujung 5’nya. Plasmid pGEM®-T Easy mengandung kandidat DNA sisipan (insert) selanjutnya ditransformasikan ke dalam sel kompeten E. coli strain DH5α menggunakan metode kejut panas (heat shock). Plasmid pGEM-T Easy mengandung kandidat (putative) promoter OsHox6 diisolasi dari koloni putih positif PCR dan kemudian disekuen untuk menjamin kebenaran hasil isolasi. Urutan DNA diedit secara manual sebelum disejajarkan dengan sekuen DNA acuan (BAC clone APOO5681) menggunakan software DNAMAN for Windows versi 4.0.0.1 (Lynnon BioSoft). Promoter OsHox6 yang berukuran 1 kb kemudian dipotong dari pGEM-T Easy menggunakan enzim restriksi EcoRI and NcoI dan kemudian disisipkan ke dalam vektor biner pCAMBIA1305.1 yang telah dipotong dengan enzim yang sama untuk menghilangkan promoter CaMV 35S yang mengontrol gen GUSPlus (Gambar 8). Plasmid hasil modifikasi, disebut dengan plasmid pCAMBIA1305.1 OsHox6P::GUSPlus, kemudian diuji untuk konfirmasi DNA sisipan dengan memotong plasmid menggunakan enzim restriksi tertentu.
Vector pCAMBIA1305.1 OsHox6P::GUSPlus, selanjutnya, dimobilisasikan dari
E. coli DH5α ke A. tumefaciens EHA 105 menggunakan metode tri-parental mating dengan bantuan E. coli yang membawa plasmid pRK 2013. DNA plasmid
pCAMBIA 1305.1 OsHox6P::GUSPlus, kemudian diisolasi dari A. tumefaciens dan dipotong menggunakan enzim restriksi tertentu untuk konfirmasi.
Transformasi Padi
Transformasi padi varietas Ciherang dan Nipponbare dilakukan pada kalus yang diinduksi dari embrio padi belum masak dengan bantuan A. tumefaciens mengikuti protokol yang telah dijelaskan pada Bab III.
Gambar 8 Skema proses kloning untuk pembentukan fusi promoter OsHox6 dengan gen pelapor GUSPlus (a). Vektor biner pCAMBIA1305.1 digunakan sebagai vektor dasar. Promoter OsHox6 (1kb) disisipkan ke dalam pCAMBIA1305.1 menggantikan promoter 35S untuk menghasilkan plasmid pCAMBIA1305.1 OsHox6P::GUSPlus. (b). Gambaran proses kloning pada agarose gel elektroforesis. Kolom: 1. Hasil perbanyakan PCR promoter OsHox6 dengan ukuran 1 kb, 2-3. Vektor pGEM-T Easy mengandung promoter OsHox6 (1 kb) dipotong dengan EcoRI and NcoI untuk melepas promoter sisipan, 4-5 dan 11. Vektor pCAMBIA1304-5.1 dipotong dengan enzim EcoRI and NcoI untuk menghasilkan gen GUSPlus tanpa promoter, 6-10 pCAMBIA1305.1 OsHox6P::GUSPlus diisolasi dari A. tumefaciens dan dipotong dengan EcoRI and NcoI, M1. Marka DNA λHindIII, M2.
100bp DNA ladder.
PCR
DNA diekstraksi dari daun seperti yang dijelaskan oleh Heusden et al. (2000). Sepasang primer, forward 5'-GCATCTCCCGCCGTGCAC-3' dan
reverse 5'-GATGCCTCCGCTCGAAGTAGCG-3’ digunakan untuk
mengam-plifikasi daerah penyandi gen hpt. Reaksi perbanyakan gen hpt adalah 1 µl sampel DNA, 6,25 µM masing-masing primer, dan 6,5 µl KAPA Taq ReadyMix
a
PCR Kit (KAPA Biosystems) dan air hingga mencapai total reaksi 12,5 µl. Perbanyakan DNA dilakukan dengan kondisi PCR sebagai berikut: satu siklus denaturasi awal pada suhu 95 ºC selama 3 menit, 35 siklus yang terdiri dari denaturasi pada suhu 95 ºC selama 1 menit, annealing pada suhu 60 ºC selama 1 menit dan perpanjangan pada 72 ºC selama 1 menit, dan satu siklus polimerisasi DNA pada suhu 72 oC selama 10 menit. Produk PCR dipisahkan dengan elektrophoresis mengunakan 0.8% gel agarosa.
Analisis Southern Blot
DNA genom total diekstrak dari daun segar tanaman transgenik positif PCR
hpt seperti yang dijelaskan oleh Lodhi et al. (1994). Sampel DNA dipotong
dengan enzim restriksi EcoRI. Southern blot dilakukan seperti yang dijelaskan sebelumnya (Sambrook et al. 1989). Sebagai pelacak gen hpt digunakan fragmen DNA hasil PCR (492 bp) yang diperbanyak menggunakan primer spesifik untuk gen hpt. Pelacak dilabel dan dideteksi dengan Alkphos labelling and detection
system dari GE Healthcare (Amersham Bioscience) mengikuti petunjuk produsen.
Induksi Kekeringan
Induksi kekeringan diberikan pada fase vegetatif dan generatif tanaman T0 positif PCR hpt dengan 2 pendekatan. Pendekatan pertama, induksi kekeringan dilakukan dengan cepat yaitu dengan mengering anginkan sampel di atas kertas seperti yang dilakukan Gao et al. (2011) selama 1 jam. Tanaman yang tidak dikeringkan digunakan sebagai kontrol. Kedua, kekeringan dilakukan secara lambat dimana tanaman ditanam pada pipa paralon (PVC) mengikuti metode yang dijelaskan oleh Yue et al. (2006). Tanaman ditanam masing-masing satu tanaman per paralon. Tanaman disiram setiap hari. Pada saat perlakuan kekeringan air pada pipa dibuang melalui lubang yang ada di bagian bawah pipa, dan tidak disiram selama percobaan kekeringan dilakukan hingga 50% dari tanaman menunjukkan gejala daun menggulung. Sampel (daun, akar, batang, bunga) diambil sebelum perlakuan (hari ke 0), kemudian pada hari ke 2, 4, 6, 7 hari setelah pengeringan, dan 1 hari setelah disiram kembali. Tanaman yang tidak ditransformasi dan yang ditransformasi dengan pCAMBIA1305.1 digunakan
sebagai pembanding. Kadar air relatif daun di ukur pada awal dan akhir percobaan kekeringan mengikuti persamaan berikut: Kadar air relatif (%) = [(berat segar – berat kering)/(berat turgid-berat kering)] x 100
Uji Aktivitas GUS Tanaman T0
Analisis histokimia GUS dilakukan untuk mempelajari pola ekspresi gen
GUSPlus pada tanaman padi yang dikendalikan oleh promoter OsHox6. Organ
tanaman (daun, batang, akar, bunga) direndam dalam larutan Gluc (2 mM X-Gluc, 1 mM potassium ferrisianida, 1 mM potassium ferrosianida, 100 µg/ml chloramphenicol, 10 mM Na
Transgenik
2EDTA.2H2O, 0,1% triton-X, 20% metanol dan 50mM dapar sodium fosfat pH 7) disimpan pada suhu 37oC selama 36 jam pada kondisi gelap. Selanjutnya organ tanaman dicuci dengan tiga seri larutan etanol (50,70, dan 95% v/v) hingga pigmen klorofil hilang. Jaringan kemudian diamati di bawah mikroskop.
Pembuatan Preparat Jaringan
Jaringan yang telah diwarnai secara histokimia disayat secara melintang dan membujur menggunakan mikrotom beku (freeze mikrotom) tipe Yamato RV 240 dengan tebal 15 mikron. Hasil sayatan disusun pada suatu gelas objek dan ditetesi dengan gliserin sebelum ditutup dengan gelas penutup. Sampel diamati menggunakan mikroskop Nikon Eclipse 80i.
Hasil
Identifikasi, Karakterisasi dan Isolasi Promoter OsHox6
Kandidat promoter OsHox6 diidentifikasi dengan mensejajarkan cDNA utuh gen
OsHox6 (no. aksesi AF145730) dengan klon BAC APOO5681 NCBI
(http://www.ncbi.nlm.nih.gov). Motif atau cis-acting elemen yang terdapat pada
daerah 5’ dari gen terinduksi kekeringan OsHox6 diprediksi dengan bantuan
PLACE (Plant cis-acting regulatory DNA elements) (http://www.dna.affrc.go.jp/
PLACE/signalscan.html). Berdasarkan keberadaan cis-regulatory element dan
untuk kemudahan isolasi (PCR) dan konfirmasi (sekuensing) selanjutnya dipilih 1 kb daerah upstream dari kodon ATG gen OsHox6 untuk analisis fungsi. Daerah
promoter OsHox6 yang berukuran 1 kb ini diprediksi mengandung 8 kandidat
cis-regulatory element terkait respon kekeringan, yaitu motif yang mirip dengan
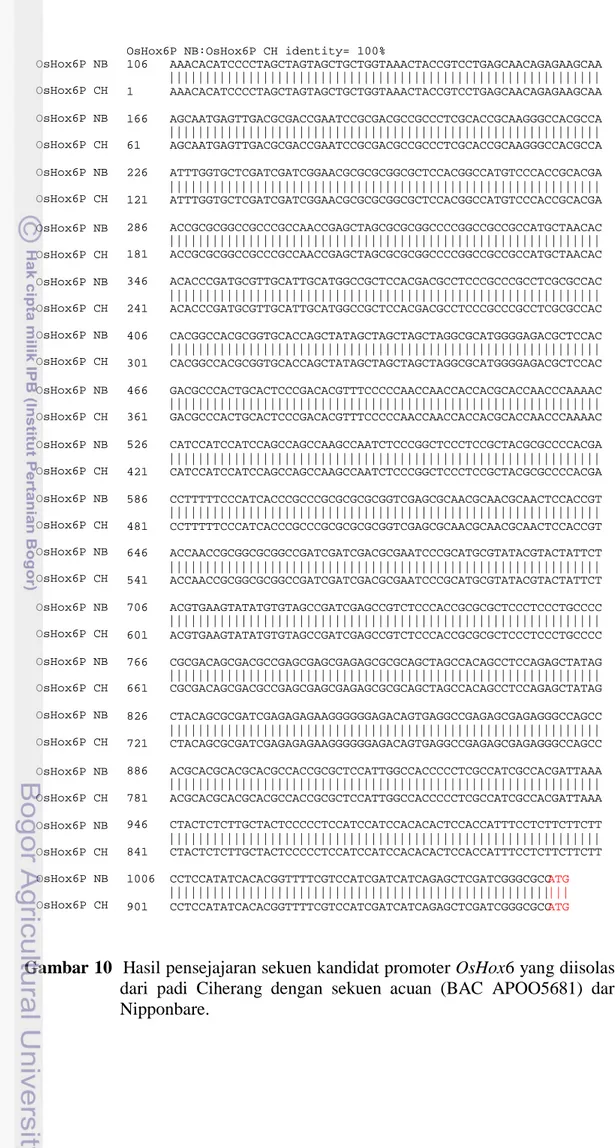
MYB1 dan MYC dari Arabidopsis thaliana, ABRE like/ERD1, ERD1, dan LTRE (Gambar 9; Tabel 10). Selain itu elemen lain (ABRE related sequences, CGCG Box, SORLIP1 dan SORLIP2) yang terkait dengan respon terhadap ABA juga ditemukan. Berdasarkan data ini maka promoter OsHox6 diduga responsive terhadap kekeringan dan ABA. Namun, berdasarkan hasil analisis prediksi ini promoter OsHox6 tidak memiliki TATA box yang umum dijumpai pada promoter sel eukaryot. Selanjutnya promoter OsHox6 diisolasi dari tanaman padi Ciherang menggunakan sepasang primer yang spesifik. Urutan DNA kandidat promoter hasil isolasi dari daun padi kultivar Ciherang menunjukkan kemiripan yang sangat tinggi (identity 100%) dengan sekuen DNA acuan (BAC clone APOO5681) dari Nipponbare (Gambar 10).
Kloning, Konstruksi Plasmid dan Transformasi Tanaman Padi
Kandidat promoter OsHox6 (1 kb) yang diisolasi dari padi cv Ciherang difusikan dengan gen GUSPlus plasmid pCAMBIA 1305.1 yang telah dihilangkan promoter CaMV35S-nya (Gambar 8). Vektor pCAMBIA1305.1
OsHox6P::GUSPlus ditransformasikan ke dalam genom tanaman padi Nipponbare
dan Ciherang dengan bantuan Agrobacterium tumefaciens EHA105. Vektor pCAMBIA yang membawa gen GUSPlus yang dikendalikan oleh promoter CaMV35S digunakan sebagai positif kontrol, sedangkan tanaman yang tidak ditransformasi digunakan sebagai negatif kontrol. Tiga (3) tanaman Ciherang dan tiga puluh dua (32) tanaman Nipponbare kandidat transgenik berhasil diperoleh.
Tanaman transgenik di PCR dan Southern untuk konfirmasi keberadaan transgen menggunakan pelacak gen hpt. Hasil PCR menunjukkan, secara berturut-turut, 30 dan 1 tanaman Nipponbare dan Ciherang, positif PCR hpt (Gambar 11). Sebanyak 12 tanaman Nipponbare positif PCR hpt di Southern menggunakan pelacak hpt. Enam tanaman Nipponbare hasil transformasi dengan gen GUSPlus yang dikontrol oleh promoter OsHox6, mengandung satu salinan gen hpt (data tidak ditampilkan), meyakinkan bahwa gen telah terintegrasi ke dalam genom tanaman. Tanaman yang mengandung satu salinan gen GUSPlus ini
kemudian digunakan untuk analisis selanjutnya untuk mempelajari pola ekspresi gen GusPlus yang dikendalikan oleh promoter OsHox6.
Gambar 9 Posisi elemen cis-acting responsif kekeringan pada daerah promoter
OsHox6. Informasi lebih lanjut dari masing-masing cis-acting elemen
dirangkum pada Tabel 10.
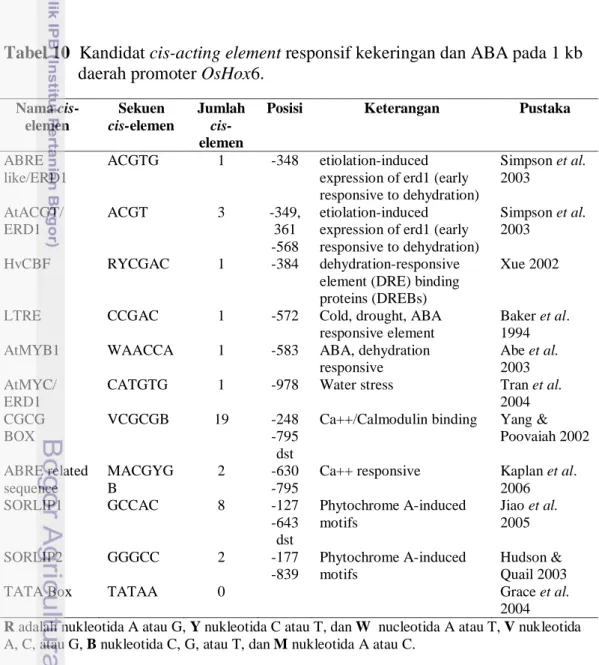
Tabel 10 Kandidat cis-acting element responsif kekeringan dan ABA pada 1 kb daerah promoter OsHox6.
Nama cis-elemen Sekuen cis-elemen Jumlah cis-elemen
Posisi Keterangan Pustaka
ABRE like/ERD1
ACGTG 1 -348 etiolation-induced expression of erd1 (early responsive to dehydration) Simpson et al. 2003 AtACGT/ ERD1 ACGT 3 -349, 361 -568 etiolation-induced expression of erd1 (early responsive to dehydration)
Simpson et al. 2003
HvCBF RYCGAC 1 -384 dehydration-responsive element (DRE) binding proteins (DREBs)
Xue 2002
LTRE CCGAC 1 -572 Cold, drought, ABA
responsive element
Baker et al. 1994
AtMYB1 WAACCA 1 -583 ABA, dehydration
responsive
Abe et al. 2003 AtMYC/
ERD1
CATGTG 1 -978 Water stress Tran et al.
2004 CGCG BOX VCGCGB 19 -248 -795 dst
Ca++/Calmodulin binding Yang & Poovaiah 2002 ABRE related sequence MACGYG B 2 -630 -795
Ca++ responsive Kaplan et al. 2006 SORLIP1 GCCAC 8 -127 -643 dst Phytochrome A-induced motifs Jiao et al. 2005 SORLIP2 GGGCC 2 -177 -839 Phytochrome A-induced motifs Hudson & Quail 2003
TATA Box TATAA 0 Grace et al.
2004
R adalah nukleotida A atau G, Y nukleotida C atau T, dan W nucleotida A atau T, V nukleotida
Gambar 10 Hasil pensejajaran sekuen kandidat promoter OsHox6 yang diisolasi dari padi Ciherang dengan sekuen acuan (BAC APOO5681) dari Nipponbare.
OsHox6P NB:OsHox6P CH identity= 100%
106 AAACACATCCCCTAGCTAGTAGCTGCTGGTAAACTACCGTCCTGAGCAACAGAGAAGCAA |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| 1 AAACACATCCCCTAGCTAGTAGCTGCTGGTAAACTACCGTCCTGAGCAACAGAGAAGCAA 166 AGCAATGAGTTGACGCGACCGAATCCGCGACGCCGCCCTCGCACCGCAAGGGCCACGCCA |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| 61 AGCAATGAGTTGACGCGACCGAATCCGCGACGCCGCCCTCGCACCGCAAGGGCCACGCCA 226 ATTTGGTGCTCGATCGATCGGAACGCGCGCGGCGCTCCACGGCCATGTCCCACCGCACGA |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| 121 ATTTGGTGCTCGATCGATCGGAACGCGCGCGGCGCTCCACGGCCATGTCCCACCGCACGA 286 ACCGCGCGGCCGCCCGCCAACCGAGCTAGCGCGCGGCCCCGGCCGCCGCCATGCTAACAC |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| 181 ACCGCGCGGCCGCCCGCCAACCGAGCTAGCGCGCGGCCCCGGCCGCCGCCATGCTAACAC 346 ACACCCGATGCGTTGCATTGCATGGCCGCTCCACGACGCCTCCCGCCCGCCTCGCGCCAC |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| 241 ACACCCGATGCGTTGCATTGCATGGCCGCTCCACGACGCCTCCCGCCCGCCTCGCGCCAC 406 CACGGCCACGCGGTGCACCAGCTATAGCTAGCTAGCTAGGCGCATGGGGAGACGCTCCAC |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| 301 CACGGCCACGCGGTGCACCAGCTATAGCTAGCTAGCTAGGCGCATGGGGAGACGCTCCAC 466 GACGCCCACTGCACTCCCGACACGTTTCCCCCAACCAACCACCACGCACCAACCCAAAAC |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| 361 GACGCCCACTGCACTCCCGACACGTTTCCCCCAACCAACCACCACGCACCAACCCAAAAC 526 CATCCATCCATCCAGCCAGCCAAGCCAATCTCCCGGCTCCCTCCGCTACGCGCCCCACGA |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| 421 CATCCATCCATCCAGCCAGCCAAGCCAATCTCCCGGCTCCCTCCGCTACGCGCCCCACGA 586 CCTTTTTCCCATCACCCGCCCGCGCGCGCGGTCGAGCGCAACGCAACGCAACTCCACCGT |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| 481 CCTTTTTCCCATCACCCGCCCGCGCGCGCGGTCGAGCGCAACGCAACGCAACTCCACCGT 646 ACCAACCGCGGCGCGGCCGATCGATCGACGCGAATCCCGCATGCGTATACGTACTATTCT |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| 541 ACCAACCGCGGCGCGGCCGATCGATCGACGCGAATCCCGCATGCGTATACGTACTATTCT 706 ACGTGAAGTATATGTGTAGCCGATCGAGCCGTCTCCCACCGCGCGCTCCCTCCCTGCCCC |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| 601 ACGTGAAGTATATGTGTAGCCGATCGAGCCGTCTCCCACCGCGCGCTCCCTCCCTGCCCC 766 CGCGACAGCGACGCCGAGCGAGCGAGAGCGCGCAGCTAGCCACAGCCTCCAGAGCTATAG |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| 661 CGCGACAGCGACGCCGAGCGAGCGAGAGCGCGCAGCTAGCCACAGCCTCCAGAGCTATAG 826 CTACAGCGCGATCGAGAGAGAAGGGGGGAGACAGTGAGGCCGAGAGCGAGAGGGCCAGCC |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| 721 CTACAGCGCGATCGAGAGAGAAGGGGGGAGACAGTGAGGCCGAGAGCGAGAGGGCCAGCC 886 ACGCACGCACGCACGCCACCGCGCTCCATTGGCCACCCCCTCGCCATCGCCACGATTAAA |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| 781 ACGCACGCACGCACGCCACCGCGCTCCATTGGCCACCCCCTCGCCATCGCCACGATTAAA 946 CTACTCTCTTGCTACTCCCCCTCCATCCATCCACACACTCCACCATTTCCTCTTCTTCTT |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| 841 CTACTCTCTTGCTACTCCCCCTCCATCCATCCACACACTCCACCATTTCCTCTTCTTCTT 1006 CCTCCATATCACACGGTTTTCGTCCATCGATCATCAGAGCTCGATCGGGCGCCATG |||||||||||||||||||||||||||||||||||||||||||||||||||||||| 901 CCTCCATATCACACGGTTTTCGTCCATCGATCATCAGAGCTCGATCGGGCGCCATG OsHox6P NB OsHox6P CH OsHox6P NB OsHox6P CH OsHox6P NB OsHox6P CH OsHox6P NB OsHox6P CH OsHox6P NB OsHox6P CH OsHox6P NB OsHox6P CH OsHox6P NB OsHox6P CH OsHox6P NB OsHox6P CH OsHox6P NB OsHox6P CH OsHox6P NB OsHox6P CH OsHox6P NB OsHox6P CH OsHox6P NB OsHox6P CH OsHox6P NB OsHox6P CH OsHox6P NB OsHox6P CH OsHox6P NB OsHox6P CH OsHox6P NB OsHox6P CH
Gambar 11 Contoh hasil PCR menggunakan primer spesifik untuk gen hpt. DNA genomik tanaman diisolasi dari daun tanaman hasil transformasi dengan vektor mengandung gen pelapor GUSPlus yang dikontrol oleh promoter OsHox6. M. DNA λ yang dipotong dengan enzim HindIII, P. DNA plasmid pCAMBIA1305.1
OsHox6P::GUSPlus, Pt. Kontrol tanaman positif hpt, Nt. Kontrol
tanaman tidak ditransformasi, R. Kontrol reaksi. 1-32. Sampel DNA tanaman hasil transformasi dengan vektor mengandung gen pelapor GUSPlus yang dikontrol oleh promoter OsHox6.
Aktifitas GUSPLUS Pada Tanaman T0
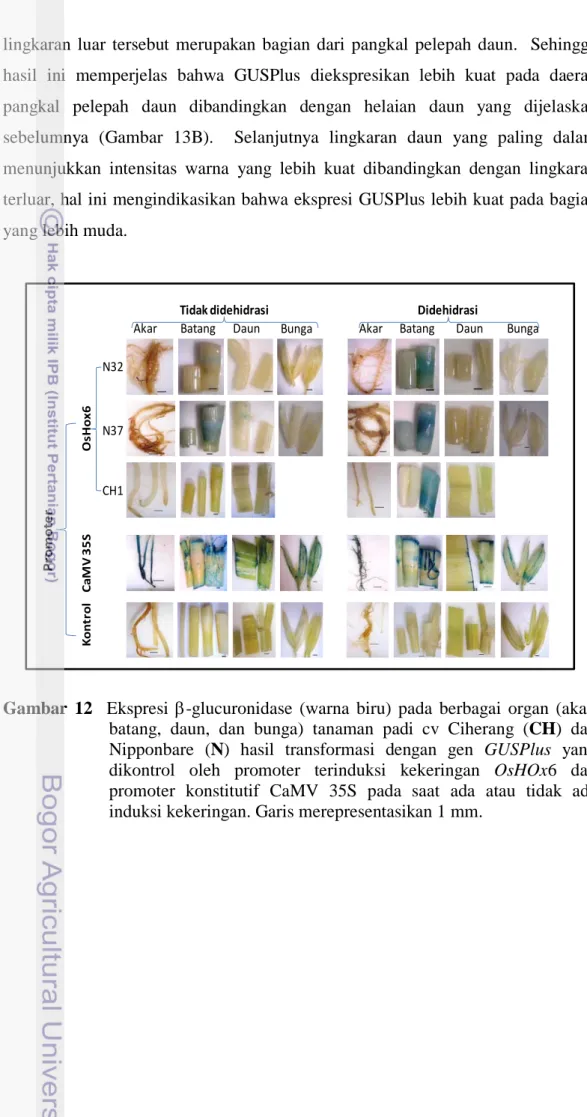
Aktifitas GUSPlus pada tanaman transgenik Nipponbare dan Ciherang hasil transformasi dengan gen GUSPlus yang dikontrol oleh 1 kb promoter OsHox6 diamati dengan uji histokimia pada saat ada atau tidak ada induksi kekeringan. Warna biru pada sel atau jaringan mengindikasikan adanya ekspresi GUSPlus. Pada kondisi normal ekspressi GUSPlus pada berbagai organ vegetatif (seperti akar, batang, dan daun) dan generatif (bunga) tidak ada atau sangat rendah. Ekspresi gen GUSPlus meningkat ketika tanaman diinduksi kekeringan, baik dengan menggunakan metode dehidrasi secara cepat di Lab maupun dengan induksi kekeringan secara lambat di rumah kaca. Ekspresi GUSPlus meningkat secara nyata ditandai dengan munculnya warna biru pada jaringan setelah dikering anginkan selama 1 jam di atas meja di Laboratorium (Gambar 12). Dari hasil pengamatan ekspresi GUSPlus pada berbagai organ (akar, batang, daun dan bunga), sebanyak 92% (dari total 12 tanaman yang diuji) ekspresi GUSPlus di jumpai pada batang terutama pada daerah buku batang, sedangkan pada organ lain (akar, daun, dan bunga) kejadiannya hanya 8,3%. Tidak ada ekspresi GUSPlus Transgenik Pada Saat Ada Induksi Kekeringan
pada tanaman yang tidak ditransformasi, dan seperti yang diharapkan, ekspresi GUSPlus pada tanaman hasil transformasi dengan gen GUSPlus yang dikendalikan promoter konstitutif CaMV 35S terjadi pada berbagai jaringan baik sebelum dan setelah dikeringkan.
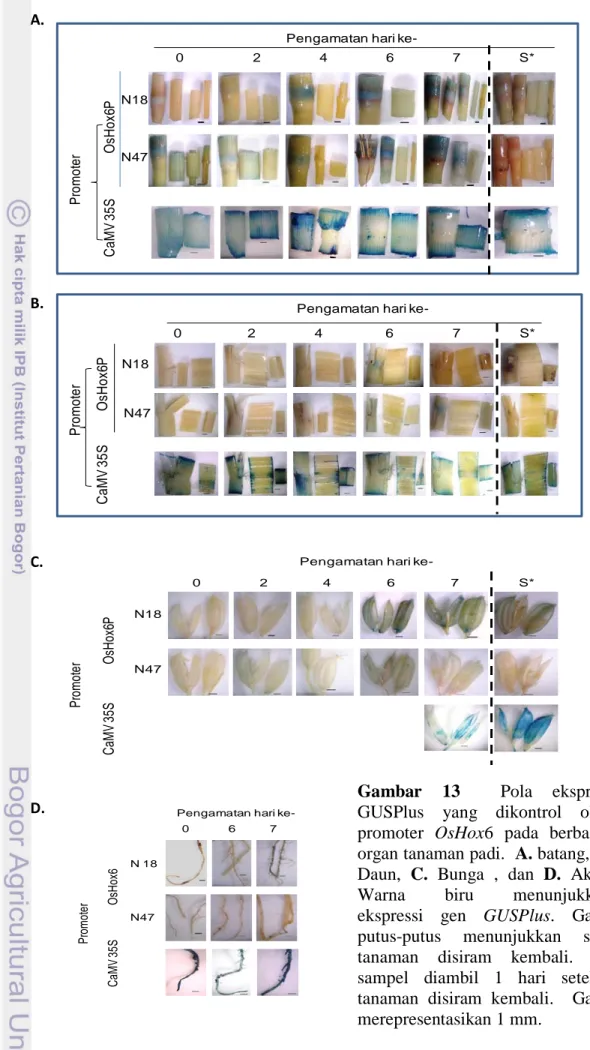
Hasil uji histokimia pada tanaman Nipponbare positif PCR hpt, hasil transformasi dengan gen GUSPlus yang dikendalikan promoter OsHox6, yang diinduksi kekeringan dengan cara kedua (lambat) menunjukkan kecenderungan yang sama. Ekspresi GUSPlus sesaat sebelum dikeringkan (hari ke-0) menunjukkan ekspresi yang rendah atau tidak ada ekspresi (RWC daun berkisar antara 91 - 95%). Ekspresi GUSPlus yang tinggi ditandai dengan peningkatan intensitas warna biru yang kuat dijumpai pada batang, akar, dan bunga pada hari ke 6 dan ke 7 setelah dikeringkan (RWC daun berkisar antara 79 hingga 80%, menunjukkan tingkat stres moderat menurut Agalou et al. (2008) dan 50% tanaman yang diuji sudah mulai menunjukkan gejala daun menggulung.
Ekspresi GUSPlus kembali rendah atau tidak ada 1 hari setelah tanaman di siram kembali (Gambar 13) membuktikan bahwa gen OsHox6 terinduksi kekeringan. Pada batang, ekspresi GUSPlus terutama ditemukan pada bagian buku batang dan sudah mulai terlihat pada awal percobaan kekeringan, kemudian meningkat hingga akhir pengamatan (hari ke -7). Pada daun peningkatan intensitas warna biru tidak meningkat secara nyata dan baru terlihat pada hari ke-6 atau ke-7. Hal yang sama juga ditemukan pada akar dan bunga. Pada bunga warna biru dengan intensitas yang kuat ditemukan pada dasar bunga (Gambar 13C). Sedangkan pada akar intensitas yang kuat ditemukan pada daerah pertemuan akar primer dan lateral.
Untuk mengetahui lebih lanjut bagian sel, jaringan, atau yang mengekspresikan GUSPlus, dilakukan irisan terhadap sampel yang sudah diuji GUS. Irisan dilakukan baik secara melintang maupun membujur. Hasil irisan menunjukkan GUSPlus diakumulasikan terutama pada jaringan meristem yang aktif membelah. Pada kondisi yang melimpah GUSPlus ditemukan menyebar pada berbagai jaringan (Gambar 14). Dengan melihat hasil irisan secara melintang dapat terlihat jelas bahwa warna biru ditemukan lebih pekat pada lingkaran luar yang mengelilingi batang (lingkaran paling dalam). Daerah
lingkaran luar tersebut merupakan bagian dari pangkal pelepah daun. Sehingga hasil ini memperjelas bahwa GUSPlus diekspresikan lebih kuat pada daerah pangkal pelepah daun dibandingkan dengan helaian daun yang dijelaskan sebelumnya (Gambar 13B). Selanjutnya lingkaran daun yang paling dalam menunjukkan intensitas warna yang lebih kuat dibandingkan dengan lingkaran terluar, hal ini mengindikasikan bahwa ekspresi GUSPlus lebih kuat pada bagian yang lebih muda.
N32 N37 CH1 O sH ox 6 Ca M V 3 5S Pr om ote r Ko nt ro l Tidak didehidrasi
Akar Batang Daun Bunga Akar BatangDidehidrasiDaun Bunga
Gambar 12 Ekspresi β-glucuronidase (warna biru) pada berbagai organ (akar, batang, daun, dan bunga) tanaman padi cv Ciherang (CH) dan Nipponbare (N) hasil transformasi dengan gen GUSPlus yang dikontrol oleh promoter terinduksi kekeringan OsHOx6 dan promoter konstitutif CaMV 35S pada saat ada atau tidak ada induksi kekeringan. Garis merepresentasikan 1 mm.
C aM V 35S 0 2 4 6 7 S* N18 N47 O sH o x6 P
Pengamatan hari
ke-P
rom
ot
er
0 2 4 6 7 S* Pengamatan hari
ke-N18 N47 O sH o x6 P C aM V 35S P rom ot er 0 2 4 6 7 S* N18 N47 O sH ox6 P C aM V 35S P rom ot er
Pengamatan hari
ke-N 18
N47
0 6 7
Pengamatan hari
ke-O sH ox6 C aM V 35S P rom ot er
Gambar 13 Pola ekspresi GUSPlus yang dikontrol oleh promoter OsHox6 pada berbagai organ tanaman padi. A. batang, B. Daun, C. Bunga , dan D. Akar. Warna biru menunjukkan ekspressi gen GUSPlus. Garis putus-putus menunjukkan saat tanaman disiram kembali. S* sampel diambil 1 hari setelah tanaman disiram kembali. Garis merepresentasikan 1 mm.
A.
B.
C.
P r omote r Irisan Membujur Irisan Melintang K on tr ol O sHo x6P :: GU S P lus 35S C aM V Ph Xy VB VB
Gambar 14 Penampang melintang dan membujur bagian buku batang padi yang telah di uji GUS. Jaringan tanaman yang tidak ditransformasi digunakan sebagai kontrol pembanding. VB. Vessel bundle (jaringan pembuluh), Xy. Xylem, Ph. Phloem. Garis menunjukkan 100 µm.
Pembahasan
Analisis promoter sangat penting dilakukan untuk mempelajari fungsi dan mekanisme regulasi proses transkripsi gen pada level molekuler. Pengaturan ekspresi gen reponsif terhadap cekaman (kekeringan) terjadi dengan adanya interaksi antara faktor transkripsi dan elemen cis-acting yang ada di daerah promoter gen target. Gen HD-Zip pada tanaman padi baru diteliti beberapa tahun belakangan ini (Agalou et al. 2008), sehingga informasi tentang pola ekspresi gen
dan elemen penting yang mengendalikan regulasi transkripsi gen HD-Zip ini masih sangat terbatas.
Di dalam penelitian ini, promoter gen OsHox6 yang merupakan anggota dari HD-Zip sub-famili I dan dilaporkan responsif kekeringan (Agalou et al. 2008) dipelajari fungsinya dengan melihat keberadaan elemen cis-acting yang ada di daerah promoter tersebut dan dengan melakukan analisis fungsional promoter yang difusikan dengan gen pelapor GUSPlus. Keberadaan elemen cis-acting terkait cekaman tertentu merupakan salah satu petunjuk awal bahwa promoter dapat mengatur proses transkripsi pada saat ada cekaman tertentu, meskipun tidak ada jaminan efektifitas ekspresi gen. Oleh karena itu analisis fungsi dari kandidat promoter perlu dilakukan dengan menggabungkan kandidat promoter dengan suatu gen pelapor dan mengujinya pada kondisi cekaman tertentu.
Hasil analisis sekuen 1 Kb kandidat promoter OsHox6 yang diisolasi dari Ciherang menunjukkan kemiripan yang sangat tinggi (identity 100%) dengan sekuen DNA acuan (Nipponbare). Hal ini mengindikasikan adanya konservasi pengaturan ekspresi gen OsHox6 yang tinggi pada Nipponbare dan Ciherang. Hasil analisis PLACE menunjukkan bahwa promoter OsHox6 mengandung elemen cis-acting yang penting untuk respon kekeringan (yaitu MYB1 dan MYC, ABRE like/ERD1, ERD1, dan LTRE) dan respon ABA (seperti ABRE related sequences, CGCG Box, SORLIP1 dan SORLIP2). Sehingga ekspresi gen
OsHox6 kemungkinan diregulasi oleh kekeringan dan ABA. Untuk membuktikan
dugaan ini maka dapat dilakukan dengan melakukan analisis ekspresi pada tanaman transgenik mengandung promoter OsHox6 yang difusikan dengan suatu gen pelapor. Ekspresi gen pelapor diamati ketika tanaman transgenik di tumbuhkan pada kondisi kekurangan air atau pada media mengandung ABA.
Salah satu hal menarik dari promoter OsHox6 adalah tidak adanya TATA box yang merupakan elemen penting untuk inisiasi proses transkripsi. Hal yang sama juga dilaporkan sebelumnya oleh Chen et al. (2005) dan Rai et al. (2009), masing-masing pada promoter MYB dan HP1. Meskipun demikian, analisis fungsi promoter berdasarkan uji GUS pada tanaman transgenik positif PCR hpt menunjukkan promoter OsHox6 fungsional pada padi Nipponbare dan Ciherang.
Diduga ada motif lain yang belum diketahui yang memiliki fungsi yang mirip dengan TATA box.
Aktivitas promoter OsHOx6 meningkat pada saat ada cekaman kekeringan ditandai dengan peningkatan intensitas warna biru pada jaringan. Namun berdasarkan uji GUS diamati bahwa pola ekspresi GUSPlus cenderung diekspresikan lebih tinggi pada daerah dimana terdapat jaringan meristem, seperti daerah intercalary meristem pada batang dan daun, daerah meristematis pada bunga dan daerah lateral meristem pada batang.
Hasil pengamatan ekspresi GUSPlus pada berbagai organ tanaman padi menunjukkan ada perbedaan pola ekspresi pada batang dan organ selain batang. Pada batang ekspresi GUSPlus dapat diamati pada tahap awal dehidrasi, sedangkan pada akar, daun, dan bunga ekspresi GUSPlus baru dapat diamati setelah kekeringan berlangsung 6-7 hari. Hal ini mengindikasikan adanya kemungkinan mekanisme regulasi gen Oshox6 yang berbeda pada batang dan organ lainnya. Pengamatan lebih lanjut pada setiap tahap perkembangan juga perlu dilakukan untuk melihat apakah promoter OsHox6 diregulasi oleh tahap perkembangan tanaman.
Ekspresi gen OsHox6 seperti yang disimpulkan dari pola aktivitas promoter
OsHox6, mirip dengan promoter AtHB7 Arabidopsis. Keduanya berhubungan
erat dengan sel-sel yang mengalami fase differensiasi (Hjellstrom et al. 2003). Seperti AtHB7, aktivitas GUS paling kuat pada jaringan muda daerah batang yang aktif memanjang atau membelah.
Simpulan
Promoter OsHox6 berdasarkan hasil analisis bioinformatik mengandung elemen cis-acting responsif kekeringan dan ABA. Promoter OsHox6 teraktivasi oleh proses kekeringan berdasarkan hasil analisis histokimia GUS pada tanaman transgenik hasil transformasi dengan gen GUSPlus yang dikendalikan oleh promoter OsHox6. Aktivitas promoter OsHox6 lebih tinggi pada buku batang dan jaringan yang aktif membelah.