DAUN KELADI TIKUS (Typhonium flagelliforme (Lodd.) Blume) SEBAGAI AGEN KEMOPREVENTIF TERHADAP SEL KANKER SERVIKS (HeLa)
MELALUI REGULASI Bcl-2
SKRIPSI
Dijalankan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Disusun Oleh : Fira Elsa Septiana
138114001
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
HALAMAN JUDUL
DAUN KELADI TIKUS (Typhonium flagelliforme (Lodd.) Blume) SEBAGAI AGEN KEMOPREVENTIF TERHADAP SEL KANKER SERVIKS (HeLa)
MELALUI REGULASI Bcl-2
SKRIPSI
Dijalankan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Disusun Oleh : Fira Elsa Septiana
138114001
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii
PERSETUJUAN PEMBIMBING
iii
iv
v
vi
HALAMAN PERSEMBAHAN
Karya ini ku persembahkan kepada :
Kemuliaan Tuhan Yesus Kristus
Kedua orang tuaku
Sahabat dan teman-teman
Farmasi angkatan 2013
vii PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala berkat, rahmat, dan kurnia-Nya yang telah dilimpahkan, sehingga penulis dapat menyelesaikan skripsi dengan judul “Daun Keladi Tikus (Typhonium flagelliforme (Lodd.) Blume) sebagai Agen Kemopreventif terhadap Sel Kanker Serviks (HeLa)
Melalui Regulasi Bcl-2”. Skripsi ini disusun untuk memenuhi salah satu syarat dalam memperoleh gelar Sarjana Farmasi (S.Farm.) Fakultas Farmasi Universitas Sanata Dharma Yogyakarta. Penyusunan skripsi telah banyak melibatkan berbagai pihak baik langsung maupun tidak langsung. Oleh karena itu, pada kesempatan ini, penulis ingin menyampaikan terimakasih kepada :
1. Ibu Aris Widayati, M.Si., Ph.D., Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Ibu Dr. Riris I. Jenie, M.Si., Apt., selaku pembimbing atas segala motivasi dan kesabaran dalam membimbing, mendukung, dan membantu penulisan dari awal hingga skripsi ini dapat terselesaikan.
3. Ibu Dr. Erna Tri Wulandari, M.Si., Apt., selaku Dosen Penguji yang telah memberikan saran dan kritik yang membagun hingga skripsi ini tersusun.
4. Bapak Maywan Hariono, Ph.D., Apt., selaku Dosen Penguji yang telah memberikan saran dan kritik yang membagun hingga skripsi ini tersusun.
5. Staf laboratorium Fakultas Farmasi USD, Bapak Yohanes Wagiran, Mas Bimo Widura, Staf laboratorium Parasitologi Fakultas Kedokteran UGM, Ibu Suprihatin, serta laboran lainnya yang telah membimbing dan membantu penulis dalam penelitian di laboratorium.
viii
7. Orang tua rohani saya, Shari dan Beni Nugroho. Saudara saya Nathania Devina, Vanessa Lyora, Angelo Adi Gempar Persada, Srikah, Ezra Septian yang senantiasa memberikan doa, bimbingan, motivasi, kasih sayang dan semangat kepada penulis untuk menyelesaikan skripsi ini.
8. Saudara saya, Melantina Maria dan Agnes Marhilo serta semua saudara-saudara komsel USD yang telah memberikan doa, motivasi, kasih sayang dan semangat kepada penulis.
9. Teman-teman seperjuangan dan sahabat dalam penelitian Maria Nareswari dan Lela Francisca Adi Liana atas kerja sama, kebersamaan, bantuan, dan perjuangan selama penelitian ini berlangsung.
10.Sahabat saya, Liana Yudhomulyono, Amanda Anggraini, Maria Atika Sukmana, dan semua teman-teman FSM A dan FKK A angkatan 2013 atas kebersamaan selama ini.
11.Semua pihak yang tidak dapat penulis sebutkan satu-persatu yang turut membantu penulis dalam menyelesaikan skripsi ini.
Penulis menyadari bahwa skripsi ini masih banyak kekurangan dan jauh dari sempurna, maka penulis mengharapkan kritik dan saran yang membangun dari semua pihak yang dapat membuat karya ini menjadi lebih baik. Mohon maaf atas segala kesalahan dan kekurangan penulis yang terdapat dalam laporan akhir skripsi ini. Akhir kata, penulis berharap penelitian ini dapat bermanfaat bagi semua pihak dan bermanfaat bagi perkembangan ilmu pengetahuan khususnya di bidang kefarmasian.
Yogyakarta, 31 Januari 2017
Penulis
ix
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI ... v
HALAMAN PERSEMBAHAN ... vi
Uji Sitotoksik dengan MTT ... 4
Uji Apoptosis dengan Flowcytometry ... 4
x
Determinasi dan Ekstraksi Daun Keladi Tikus ... 7
Uji sitotoksik ekstrak terhadap sel kanker serviks HeLa ... 8
Uji Apoptosis menggunakan Flowcytometry dengan Anexin V ... 10
Uji Imunositokimia ... 13
KESIMPULAN ... 15
DAFTAR PUSTAKA ... 16
LAMPIRAN ... 20
xi
DAFTAR TABEL
xii
DAFTAR GAMBAR
xiii
DAFTAR LAMPIRAN
Lampiran 1. Gambar tanaman keladi tikus dan proses ekstraksi ... 21
Lampiran 2. Pengolahan data uji MTT assay ... 22
Lampiran 3. Dokumentasi Uji Apoptosis ... 23
Lampiran 4. Dokumentasi Uji Imunositokimia ... 27
Lampiran 5. Surat Keterangan hasil determinasi tanaman keladi tikus ... 29
xiv ABSTRAK
Kemopreventif merupakan suatu upaya untuk mencegah, menunda, ataupun melawan perkembangan sel kanker dengan menggunakan bahan alam, sintesis, atau kombinasi dari keduanya. Salah satu bahan alam yang memiliki potensi antikanker adalah tanaman keladi tikus (Typhonium flagelliforme (Lodd.) Blume) yang dimanfaatkan sebagai terapi alternatif pada kanker. Pada penelitian sebelumnya, daun keladi tikus memiliki efek sitotoksik terhadap sel kanker serviks HeLa dan kanker kolon WiDr. Tujuan. Mengetahui potensi ekstrak etil asetat daun keladi tikus terhadap sel kanker serviks HeLa terkait aktivitas sitotoksik, induksi apoptosis dan pengaruh terhadap protein Bcl-2 yang berperan sebagai antiapoptosis. Metode. Uji sitotoksik dengan metode MTT, uji induksi apoptosis menggunakan metode flocytometry dan uji imunositokimia untuk observasi aktivitas ekstrak etil asetat daun keladi tikus dalam meregulasi protein Bcl-2. Hasil. Hasil yang diperoleh, ekstrak etil asetat daun keladi tikus memiliki aktivitas sitotoksik lemah dengan nilai IC50 640 µg/mL. Hasil uji apoptosis pada konsentrasi ½ IC50 dengan waktu inkubasi 24 jam menunjukkan bahwa sampel menginduksi kematian (apoptosis 12% dan nekrosis sekunder yang merupakan lanjutan dari apoptosis 86%) sehingga perlu observasi lebih lanjut pada waktu inkubasi kurang dari 24 jam. Hasil uji imunositokimia menunjukkan sampel menekan kuat ekspresi protein Bcl-2, sehingga kemungkinan induksi apoptosis diperantarai penekanan ekspresi protein Bcl-2. Bedasarkan hasil tersebut, potensi esktrak etil asetat daun keladi tikus sebagai agen kemopreventif masih perlu ditelusuri lebih lanjut terutama induksi kematian sel.
xv ABSTRACT
Chemopreventive an attempt to prevent, delay, or against the development of cancer cells using natural product, synthetic, or combination of both. Natural product
that has the potential anticancer is rodent tuber (Typhonium flagelliforme (Lodd.)
Blume) which is used as an alternative therapy in cancer. Previous research represent that rodent tuber leaves have a cytotoxic effect on HeLa cervical cancer cells and WiDr colon cancer cells. Objective. To determine the potential of ethyl acetate extract of rodent tuber leaves against HeLa cervical cancer cell related cytotoxic activity, induction of apoptosis and effect on protein Bcl-2 as regulator antiapoptosis. Method. Cytotoxic test was conducted using MTT assay, induction of apoptosis test using flocytometry, immunocytochemistry test to observe the activity extracts in regulating protein Bcl-2. Results. The results, ethyl acetate extract of rodent tuber leaves have a weak cytotoxic activity with IC50 values of 640 µg/mL. The result of
apoptosis assay in concentration ½ IC50 with 24 hours incubation period showing that
samples induce death (12% apoptosis and secondary necrosis which is the continuation of apoptosis 86%), need further observation on incubation period of less than 24 hours. The result of immunocytochemistry assay showed sampel suppresses powerfully expression of Bcl-2 protein, the possibility induction of apoptosis mediated by suppresses the expression of Bcl-2 protein. Therefore, potential of the ethyl acetate extract of rodent tuber leaves as kemopreventif agent need further exploration, especially the induction of cell death.
1
Kanker merupakan keadaan sel-sel dalam tubuh mulai tumbuh tidak kendali dan dapat menyebar ke seluruh tubuh. Kanker serviks merupakan kanker yang berkembang dari sel di daerah serviks atau mulut rahim sampai bagian bawah uterus (American Cancer Society, 2016). Menurut data dari IARC 2015, prevalensi kanker serviks memiliki tingkat mortalitas dan morbiditas yang tinggi dan menduduki peringkat keempat di belahan benua Australia, Eropa, Afrika dan Asia setelah kanker payudara dan kanker kolon. Di Indonesia, prevalensi kanker serviks menduduki peringkat ketiga setelah kanker payudara (Ferlay, dkk., 2015).
Sebagian besar penderita kanker serviks berobat dengan keadaan stadium lanjut sehingga mengakibatkan rendahnya angka survival (DeSantis, dkk., 2014). Penemuan obat-obat kemopreventif dan alternatif banyak dilakukan untuk penelitian kanker. Kemopreventif merupakan suatu upaya untuk mencegah, menunda, ataupun melawan perkembangan sel kanker dengan menggunakan bahan alam, sintesis, atau kombinasi dari keduanya (Sharma, 2012). Beberapa obat herbal dilaporkan efektif untuk menghambat pertumbuhan sel kanker serviks dan berpotensi untuk digunakan pada terapi kanker serviks (Galluzzi, dkk., 2014). Oleh sebab itu, upaya penemuan agen kemopreventif dengan target yang spesifik perlu ditingkatkan.
Kanker serviks sebagian besar disebabkan karena adanya infeksi Human Papiloma Virus (HPV). Sel kanker leher rahim yang diinfeksi HPV diketahui mengekspresikan dua
onkogen, yaitu E6 dan E7. Protein E6 berikatan dengan tumor suppressor protein p53 dan mempercepat degradasi p53, serta menekan aktivitas p53. Pada keadaan ini mediator antiapoptosis (Bcl-2, Bcl-xL, Bcl-w) terinduksi, sehingga jumlahnya berlebih. Jumlah mediator antiapoptosis yang berlebih mengakibatkan proses apoptosis atau kematian sel terhambat (You, dkk., 2010). Bcl-2 (B-cell lymphoma 2) berperan dalam proses apoptosis pada sel karena Bcl-2 dapat menghambat pelepasan sitokrom C sehingga proses apoptosis terhambat (de Bruin & Medema, 2008). Dengan demikian, salah satu target molekuler dari perkembangan terapi kanker serviks adalah yang potensial adalah Bcl-2.
2
steroid. Alkaloid dan flavonoid merupakan kandungan kimia terbesar dalam daun keladi tikus (Mankaran, dkk. 2013). Dari penelitian Da’i, dkk. (2007) dilakukan uji sitotoksik dari ekstrak diklorometan, etil asetat dan etanol 98% daun keladi tikus terhadap sel HeLa. Ekstrak etil asetat daun keladi tikus memiliki nilai IC50 147,77 µg/mL. Ekstrak etil asetat daun keladi tikus memiliki efek sitotoksik paling baik dibandingkan dengan ekstrak diklorometan dan etanol 98%. Secara in vitro ekstrak etil asetat daun keladi tikus memiliki nilai IC50 yang baik dibandingkan n-hexan dan etanol pada sel leukemia yaitu 11,81 µg/mL (Katrin, dkk., 2012). Sedangkan ekstrak etanol 80% keladi tikus memiliki nilai IC50 30,19 µg/mL terhadap sel HeLa (Purwaningsih, dkk., 2014). Penelitian lebih lanjut perlu dilakukan untuk mengetahui mekanisme molekuler yang spesifik pada kanker serviks.
Penelitian ini bertujuan untuk mengetahui potensi ekstrak etil asetat daun keladi tikus terhadap sel kanker serviks HeLa terkait aktivitas sitotoksik, induksi apoptosis dan pengaruh terhadap regulasi protein Bcl-2 yang merupakan regulator antiapoptosis. Sel kanker serviks yang digunakan untuk penelitian ini adalah sel kanker serviks HeLa yang merupakan sel epitel kanker serviks. Sel kanker serviks HeLa digunakan karena sel bersifat imortal dan dapat membelah secara tidak terbatas selama memenuhi kondisi dasar bagi sel untuk tetap hidup, selain itu sel kanker serviks HeLa dipilih karena cukup aman dan umum digunakan (Landry, dkk., 2013). Uji MTT (3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolium bromida) dilakukan untuk mengetahui aktivitas sitotoksik, uji apoptosis menggunakan metode flowcytometry untuk mengetahui induksi apoptosis dan uji imunositokimia untuk mengetahui regulasi protein Bcl-2.
METODOLOGI PENELITIAN Bahan Penelitian
Ekstrak etil asetat daun keladi tikus, cisplatin 10mg/10mL dari Kalbe Farma, sel kanker serviks HeLa didapat dari Laboratorium Parasitologi Fakultas Kedokteran Universitas Gadjah Mada. Bahan kimia yang digunakan adalah etil asetat teknis, media kultur DMEM (Dulbecco’s modified Eagle’s medium) 10% (Gibco), Tripsin 0,025%, PBS (Phosphat Buffer Saline), SDS (Sodium Dodecyl Sulfate) 10% dalam HCl 0,01 N, DMSO (dimethylsulfoxide)
3
reagen MTT (sigma) 5 mg/mL, etanol, primary monoclonal antibody mouse anti-human Bcl-2 Oncoprotein (Dako), secondary antibody (Biocare), streptavidin, larutan DAB (diaminobenzidin), Mayerhematoxilin.
Alat Penelitian
Alat–alat gelas steril (Pyrex), timbangan analitik, blender, waterbath (Memmert), rotary evaporator (buchi Labortechnik AG CH-99230), oven, 96 well-plate (Iwaki), 6 well-plate (Iwaki), sentrifuge tube, inkubator CO2 (Thermo Heraeus HeraCell 150), Laminar air flow cabinet (Labconco), mikropipet, hemositometer (Neubauer), ELISA reader (Bio-Rad), kamera digital (Canon 550D), mikroskop cahaya (Olympus), mikroskop inverter (Olympus), flowcytometry (FACS Calibur).
Determinasi dan Ekstraksi
Tanaman keladi tikus didapatkan dari Malang, Jawa Timur dengan usia 2-6 bulan. Sebelumnya tanaman dideterminasi menggunakan buku acuan menurut Backer, 1963 dilakukan di Fakultas Biologi Universitas Gajah Mada (lampiran 5). Daun yang dipilih adalah daun tua yang berwarna hijau pekat (Nobakht, dkk., 2014) kemudian daun dipetik dan dikeringkan dalam oven dengan suhu 40-500C. Daun yang telah kering dihaluskan menggunakan blender untuk menjadi simplisia serbuk daun keladi tikus. Serbuk daun keladi tikus ditimbang sebanyak 10 gram kemudian direndam dalam 100 ml etil asetat dalam erlenmeyer bertutup dan digojok menggunakan shaker selama 24 jam. Dilakukan remaserasi
dengan etil asetat seperti proses sebelumnya hingga pelarut tidak berwarna. Kemudian hasilnya ditampung dan dipekatkan menggunakan rotary vaccum evaporator (Setiawati, dkk., 2016).
Pembuatan Larutan Uji
4 Selanjutnya tambahkan 2 ml tripsin 0,025% secara merata dan diinkubasi dalam inkubator selama 3 menit. Sel dipindahkan ke dalam conical tube sampai semua sel terlepas dari plate, kemudian PBS ditambahkan sampai 10 ml untuk deaktivasi tripsin. Selanjutnya disentrifuge selama 10 menit, kemudian PBS dibuang dan ditambahkan media DMEM 10% sebanyak 1-2 ml. Sel diresuspensi menggunakan pipet, kemudian diambil sebanyak 10 μl dan dipindahkan ke hemacytometer untuk dihitung di bawah mikroskop (Nobakht, dkk., 2014; CCRCa, 2009). Uji Sitotoksik dengan MTT
Uji sitotoksik dilakukan dengan cara memberi perlakuan pada sel (dengan populasi 1x106/mL) yang telah ditanam dalam 96 well-plate. Pertama, media kultur dibuang terlebih dahulu kemudian ke dalam tiap lubang diberi 100 μl seri konsentrasi sampel (1.500 μg/ mL, 750 μg/ mL, 375 μg/ mL, 187,5 μg/ mL, 94 μg/ mL, 47 μg/ mL, dan 23 μg/ mL yang telah diencerkan dalam media dan 100 μl seri konsentrasi cisplatin (160 μg/ mL, 80 μg/ mL, 40 μg/ mL, 20 μg/ mL, 10 μg/ mL, 5 μg/ mL dan 2,5 μg/ mL), pada kolom kontrol sel diberi media kultur sedangkan pada kolom kontrol media dikosongkan, lalu diinkubasi selama 24 jam dalam inkubator CO2. Setelah inkubasi 24 jam, media kultur dalam well-plate dibuang lalu ke dalam tiap lubang diberi 100 μl larutan MTT dalam media kultur dan diinkubasi selama 4 jam. Setelah 4 jam ke dalam tiap lubang diberi 100 μl reagen stopper SDS kemudian plate dibungkus dengan alumunium foil dan diinkubasi di ruang selama 24 jam. Setelah inkubasi, dilakukan pembacaan absorbansi menggunakan ELISA Reader pada panjang gelombang 595 nm (Xu, dkk., 2014; CCRCd, 2009).
Uji Apoptosis dengan Flowcytometry
Sel ditanam (dengan populasi 1x106/mL) dalam 2 mL media DMEM 10% di dalam 6 well-plate, kemudian diinkubasi selama 24 jam. Setelah 24 jam, sampel dengan konsentrasi ½
5
dimasukkan ke conical tube. Pada well-plate diberi 1 mL tripsin 0,025% dan ditampung lagi ke dalam conical tube sampai semua sel terlepas dari plate. Setelah semua sel dipanen ditambahkan PBS sampai 10 ml dan conical tube disentrifugasi selama 10 menit. Supernatan dibuang, sisa endapan diberi PBS dingin 1 mL kemudian resuspensi campuran dan dipindahkan ke dalam micro tube sebanyak 1 mL. Campuran dalam micro tube disentrifugasi (5 menit, 5000 rpm). Micro tube yang berisi sampel dibuang supernatannya kemudian diberi reagen 100 μl Annexin V lalu diinkubasi 10 menit. Setelah inkubasi 10 menit diberi 300 μl buffer, dan sampel dianalisis mengunakan flowcytometer FACS Calibur (Huang, dkk., 2015; CCRCc, 2009).
Uji Imunositokimia
6 Analisis Nilai IC50
Dari data yang diperoleh melalui uji MTT, dihitung % viabilitas sel dengan menggunakan rumus:
sor ansi perlakuan sor ansi kontrol media sor ansi kontrol sel sor ansi kontrol media
Setelah data % viabilitas didapatkan, dilanjutkan dengan membuat grafik antara % viabilitas sel dengan konsentrasi untuk mendapatkan nilai IC50 menggunakan program Microsoft Excel (Nobakht, dkk., 2014; CCRCc, 2009).
Analisis Uji Apoptosis
Pengamatan kuantitatif dilakukan dengan mengolah data menggunakan metode cellquest dan dibaca menggunakan alat flowcytometry FACS Calibur yang terhubung dengan software untuk membaca hasil analisis. Hasil yang didapatkan, kemudian dikonversikan dalam
diagram warna sel. Sel yang hidup ditunjukkan dengan warna hijau (Annexin-/PI-), warna kuning menunjukkan sel mengalami early apoptosis (Annexin+/PI-), dan merah muda menunjukkan sel mengalami late apoptosis (Annexin+/PI+) (Li, dkk., 2009).
Analisis Uji Imunositokimia
Pengamatan secara kualitatif digunakan untuk mengetahui ekspresi protein Bcl-2. Adanya ekspresi protein Bcl-2 akan ditunjukkan dengan warna coklat pada sitoplasma (bukan inti sel). Sedangkan warna biru menunjukkan tidak adanya protein Bcl-2. Pembacaan data dilakukan dengan bantuan blind reader. Sebanyak tiga orang responden menghitung jumlah sel yang mengekspresikan Bcl-2 pada preparat. Hasil yang didapatkan berupa % rata-rata ± SD.
Sel er arna oklat otal sel satu lapang pandang
Level skoring ekspresi Bcl-2 ditentukan dengan: 0: kurang dari 5% (sangat kuat), 1+: 6% - 25% (kuat), 2+: 26% - 50% (sedang), 3+: 51% - 75% (lemah), 4+: 76% - 100% (sangat lemah) (Zhang, dkk., 2002).
x 100%
7 Determinasi dan Ekstraksi Daun Keladi Tikus
Determinasi tanaman dilakukan terlebih dahulu untuk memastikan kebenaran dari tanaman yang digunakan untuk diuji. Determinasi dilakukan untuk memastikan bahwa daun yang digunakan dalam penelitian ini benar berasal dari tanaman keladi tikus (Typhonium Flagelliforme (Lodd.) Blume). Daun dipetik dari tanaman, kemudian dicuci dan dikeringkan di
dalam oven dengan suhu 40-500C. Pengeringan bertujuan untuk mengurangi kadar air di dalam daun karena air dapat menyebabkan adanya penjamuran dan mengaktifkan enzim yang dapat merusak zat aktif dalam simplisia.
Simplisia ditimbang sebanyak 10 gram kemudian dilakukan maserasi menggunakan pelarut etil asetat untuk mengambil zat-zat aktif dari simplisia. Prinsip dari maserasi adalah memindahkan masa dari sel simplisia menuju cairan penyari berdasarkan derajat konsentrasi. Setiap 24 jam pelarut diganti menggunakan pelarut baru dan pelarut sebelumnya ditampung dengan tujuan menghindari kejenuhan senyawa dalam pelarut. Hasil maserasi yang sudah ditampung disaring dan dilakukan pemekatan menggunakan rotary evaporator dengan suhu 600C dilanjutkan dengan diuapkan di atas water bath dengan suhu 55-600C sampai semua pelarut menguap atau sampai bobot tetap. Hal ini dilakukan untuk memastikan bahwa sel yang mati disebabkan oleh ekstrak bukan pelarut yang tersisa. Hasil ekstraksi yang dilakukan dengan metode maserasi menggunakan pelarut etil asetat didapatkan rendemen 5,6%.
8
Metode MTT digunakan untuk menentukan viabilitas sel yang berdasarkan pada perubahan garam tetrazolium (MTT) menjadi formazan dalam mitokondria yang aktif pada sel hidup (Jo, dkk., 2015). MTT diabsorbsi ke dalam sel hidup dan dipecah melalui reaksi reduksi oleh enzim reduktase dalam rantai respirasi mitokondria menjadi formazan yang berwarna ungu. Formazan dapat dibaca absorbansinya secara spektrofotometri dengan ELISA reader pada panjang gelombang 595 nm yang merupakan panjang gelombang maksimal untuk mengamati fomazan (Ho, dkk, 2012). Uji sitotoksik dengan metode MTT dilakukan untuk mengetahui efek sitotoksik ekstrak etil asetat daun keladi tikus terhadap sel HeLa.
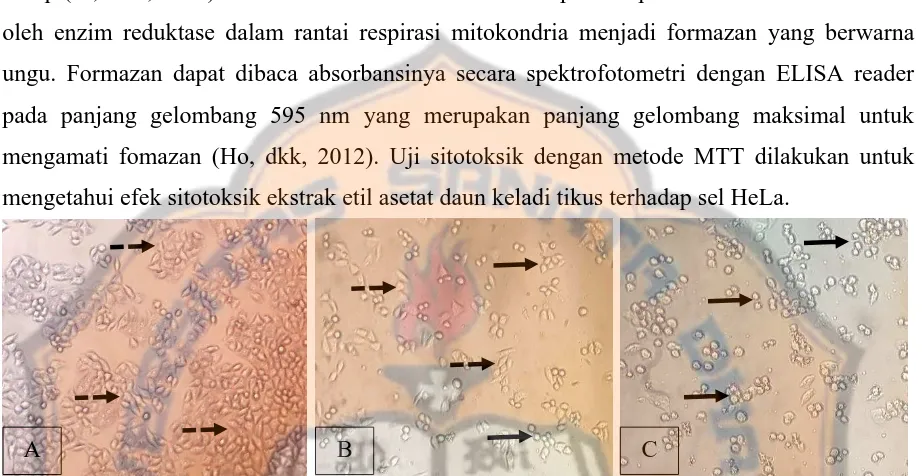
Gambar 1. Morfologi sel HeLa observasi sel secara mikroskopis. Sel HeLa (1x106 sel/mL) yang ditanam
pada 96 well-plate diinkubasi selama 24 jam, kemudian diberi seri konsentrasi ekstrak etil asetat daun keladi tikus dan seri konsentrasi cisplatin dengan waktu inkubasi 24 jam. Selanjutnya diamati dibawah mikroskop dengan perbesaran 100 kali. (A) Kontrol sel HeLa, (B) Perlakuan cisplatin dengan konsentrasi 20 µg/mL, (C) Perlakuan ekstrak etil asetat daun keladi tikus konsentrasi 750 µg/mL.
Keterangan gambar: sel yang ditunjuk tanda panah ( ) menunjukkan sel mengkerut, sel yang ditunjuk tanda panah putus-putus ( ) menunjukkan sel hidup.
Aktivitas sitotoksik ekstrak etil asetat daun keladi tikus terhadap sel HeLa juga berpengaruh pada morfologi sel setelah diberi perlakuan selama 24 jam. Pada kelompok kontrol sel menunjukkan kepadatan sel tinggi, sel berbentuk polygonal dan menempel pada plate. Morfologi sel dengan perlakuan cisplatin dengan konsentrasi 20 µg/mL beberapa sel
mengkerut yang ditandai dengan bentuk bulat tidak menempel pada plate dan kepadatan sel berkurang. Sedangkan morfologi sel dengan perlakuan etil asetat daun keladi tikus sel dengan konsentrasi 750 µg/mL banyak sel mengkerut yang ditandai dengan bentuk bulat tidak menempel pada plate serta kepadatan sel berkurang.
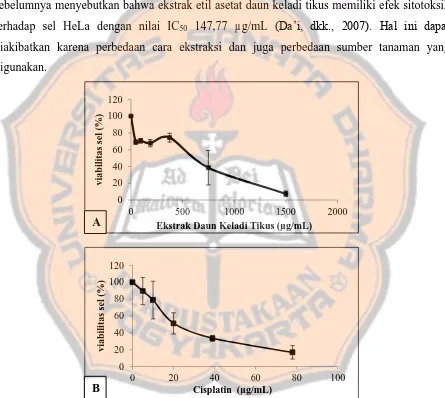
Uji sitotoksik dilakukan untuk menentukan IC50 atau konsentrasi sampel yang mampu menghambat pertumbuhan sel sebanyak 50% yang digunakan sebagai parameter uji sitotoksik. Hasil uji sitotoksik dapat dilihat pada Gambar 2 yang menyatakan kurva hubungan antara
9 sitotoksik menggunakan metode MTT menunjukkan cisplatin memiliki nilai IC50 36 µg/mL sedangkan ekstrak etil asetat daun keladi tikus nilai IC50 640 µg/mL terhadap sel HeLa. Efek sitotoksik pada umumnya menunjukkan pola dose dependent yang dapat dilihat dari menurunnya viabilitas sel seiring dengan meningkatnya konsentrasi. Pada penelitian sebelumnya menyebutkan bahwa ekstrak etil asetat daun keladi tikus memiliki efek sitotoksik terhadap sel HeLa dengan nilai IC50 147,77 µg/mL (Da’i, dkk., 2007). Hal ini dapat diakibatkan karena perbedaan cara ekstraksi dan juga perbedaan sumber tanaman yang digunakan.
Gambar 2. Efek sitotoksik ekstrak etil asetat daun keladi tikus dan cisplatin. Sel HeLa (1x106 sel/mL)
yang ditanam pada 96 well-plate diinkubasi selama 24 jam, kemudian diberi seri konsentrasi ekstrak etil asetat daun keladi tikus dan seri konsentrasi cisplatin. Viabilitas sel ditentukan dengan metode MTT. (A) Viabilitas sel setelah diberi seri konsentrasi ekstrak etil asetat daun keladi tikus selama 24 jam. (B) Viabilitas sel setelah diberi seri konsentrasi cisplatin selama 24 jam.
Potensi ekstrak sebagai agen sitotoksik digolongkan menjadi tiga kategori yaitu kuat (IC50 < 20 µg/mL), sedang (IC50 < 50 µg/mL) dan lemah (IC50 > 50 µg/mL) (Ellithey, dkk.,
A
10
dapat diartikan bahwa ekstrak daun keladi tikus tidak cukup toksik namun memiliki potensi untuk dikembangkan sebagai agen kemopreventif. Efek toksik yang kuat dari cisplatin sebagai obat kemoterapi mengakibatkan efek toksik terhadap sel atau jaringan normal karena tidak selektif terhadap sel kanker (Dasari & Bernard, 2014). Ekstrak etil asetat daun keladi tikus berpotensi sebagai agen kemopreventif karena tidak cukup toksik terhadap sel kanker serviks HeLa sehingga diharapkan ekstrak etil asetat daun keladi tikus tidak bersifat toksik terhadap sel normal. Namun perlu adanya penelitian lebih lanjut untuk memastikan selektivitas ekstrak etil asetat daun keladi tikus terhadap sel kanker.
Efek toksik yang rendah terhadap sel kanker serviks HeLa mengakibatkan ekstrak etil asetat daun keladi tikus memiliki efikasi pengobatan yang rendah. Untuk meningkatkan efikasi penggobatan, ekstrak etil asetat daun keladi tikus dapat dikombinasikan dengan agen kemoterapi. Penggunaan kombinasi kemoterapi dapat diberikan dengan senyawa yang bersifat non-toksik atau senyawa yang memiliki efek toksik rendah dikombinasikan dengan agen kemoterapi untuk meningkatkan efikasi dengan cara mengurangi efek toksik agen kemoterapi pada sel atau jaringan normal (Hemaiswarya & Doble, 2006). Penelitian lebih lanjut perlu dilakukan untuk mengetahui efek sinergis dari kombinasi ekstrak etil asetat daun keladi tikus dan agen kemoterapi terhadap sel kanker dan selektivitas terhadap sel normal.
Uji Apoptosis menggunakan Flowcytometry dengan Anexin V
Mekanisme kematian sel dibedakan menjadi dua yaitu apoptosis dan nekrosis. Apoptosis atau kematian sel yang terprogram secara genetik memiliki mekanisme regulasi pergantian sel karena adanya perkembangan dan penuaan sel (Akl, dkk., 2014). Nekrosis didefinisikan sebagai kematian sel yang tidak terkontrol yang merupakan kematian sel yang secara patologik dapat mengakibatkan adanya inflamasi atau peradangan (de Bruin & Medema, 2008). Uji apoptosis dilakukan untuk mengetahui aktivitas ekstrak etil asetat daun keladi tikus dalam menginduksi kematian sel melalui jalur apoptosis terhadap sel HeLa.
11
kemudian dilewatkan celah sempit dan ditembak sinar UV atau laser. Sel yang telah ditandai dengan fluoresen akan memancarkan fluoresensi yang akan ditangkap oleh detektor. Fluoresensi yang ditangkap oleh detektor akan dikonversikan menjadi sebuah grafik dengan suatu program yang ada pada flowcytometry (Hayrabedyan, dkk., 2012).
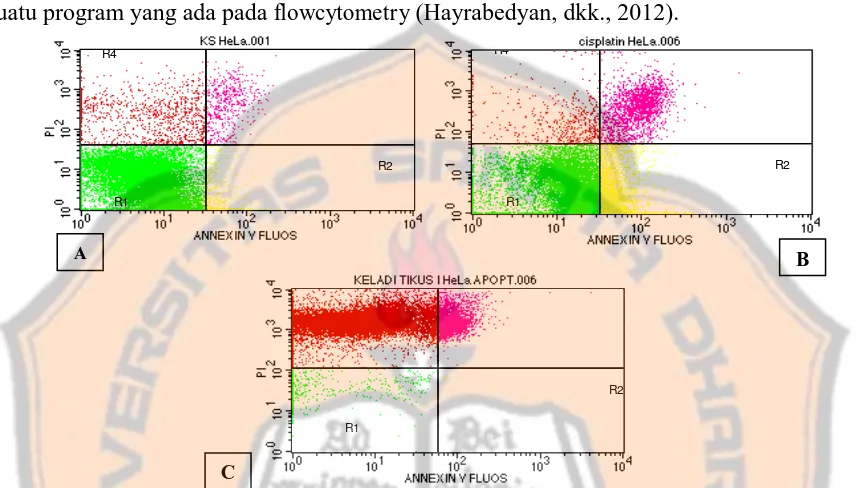
Gambar 3. Induksi apoptosisekstrak etil asetat daun keladi tikus dan cisplatin. Sel HeLa (1x 106/mL)
yang ditanam pada 6 well-plate diinkubasi selama 24 jam, kemudian diberi ekstrak etil asetat daun keladi tikus 320 µg/mL dan cisplatin 18 µg/mL diinkubasi selama 24 jam, dan diwarnai dengan reagen annexin V dan propidium iodida (PI). Hasil dibaca menggunakan flowcytometer. (A) Kontrol sel. (B) Sel kanker serviks HeLa yang diberi cisplatin (18 µg/mL). (C) Sel kanker serviks HeLa yang diberi ekstrak etil asetat daun keladi tikus (320 µg/mL).
Tabel 1. Hasil uji apoptosis menggunakan flowcytometry Total Sel (%)
Radian 1 Radian 2 Radian 3 Radian 4
Sel Hidup Early Apoptosis Late Apoptosis Nekrosis
Kontrol Sel 88,28 % 3,55 % 2,58 % 5,67 % mengalami nekrosis 5,67%. Sel dengan perlakuan cisplatin menunjukkan sel yang masih
12
sebesar 2,69%. Cisplatin dapat menyebabkan kematian sel dengan cara menghentikan siklus sel dan menginduksi apoptosis jika ada kerusakan sel. Cisplatin dapat menginduksi apoptosis pada sel kanker HeLa dengan cara meregulasi proses apoptosis melalui jalur dependent p53 (Kutuk, dkk., 2009). Sedangkan sel dengan perlakuan ekstrak etil asetat daun keladi tikus menunjukkan sel yang masih hidup 2,38%, total sel yang mengalami apoptosis 11,80% dan yang mengalami nekrosis sebesar 86,03%.
Pada penelitian ini uji apoptosis yang dilakukan terbatas karena hanya menggunakan satu time point yaitu 24 jam untuk waktu inkubasi perlakuan sehingga kemungkinan kematian sel sudah berlanjut menjadi nekrosis. Nekrosis yang terjadi akibat perlakuan ekstrak etil asetat daun keladi tikus kemungkinan karena adanya nekrosis sekunder yang merupakan lajutan dari apoptosis. Nekrosis sekunder terjadi karena karena secara in vitro tidak ada fagositosis badan apoptosis oleh makrofag. Nekrosis sekunder juga dapat terjadi kerena perubahan morfologi sel yang semula mengalami apoptosis menjadi nekrosis karena adanya pengaruh waktu inkubasi (Demoy, dkk., 2000). Morfologi sel yang mengalami apoptosis ditandai dengan penyusutan sel secara keseluruhan, blebbing atau pembengkakan membran plasma dan pembentukan badan apoptosis (Akl, dkk., 2014). Sedangkan morfologi sel yang mengalami nekrosis tidak terkontrol, tiba-tiba sel kehilangan integritas membran dan cairan ekstraseluler keluar dari sel (Martin & Henry, 2013). Oleh karena itu, perlu diamati kematian sel yang terjadi akibat perlakuan ekstrak etil asetat daun keladi tikus dengan waktu inkubasi kurang dari 24 jam. Penelitian lebih lanjut perlu dilakukan untuk mengamati induksi apoptosis pada beberapa time point sebelum 24 jam.
13 Uji Imunositokimia
Proses apoptosis diregulasi oleh faktor ekstrenal dan internal. Salah satu faktor internal dari proses apoptosis adalah Bcl-2 (B-cell lymphoma 2) (de Bruin & Medema, 2008). Sel kanker serviks Hela memiliki karakteristik overekspresi Bcl-2 sehingga menghambat proses apoptosis (You, dkk., 2010). Imunositokimia merupakan teknik untuk mendeteksi protein, antigen dalam satu jaringan dengan mendeteksi adanya reaksi antigen antibodi menggunakan bantuan penanda. Antibodi spesifik akan berikatan dengan antigen yang dideteksi dengan antibodi sekunder (Chen, dkk., 2010). Pada penelitian ini uji imunositokimia terhadap protein Bcl-2 dilakukan untuk mengidentifikasi apakah kematian sel diregulasi oleh protein Bcl-2 dengan tujuan mengetahui aktivitas ekstrak daun keladi tikus dalam menghambat protein Bcl-2. Sel yang mengekspresikan protein Bcl-2 ditandai dengan warna coklat pada sitoplasma sedangkan sel yang tidak mengekspresikan Bcl-2 berwarna ungu.
Gambar 4. Ekspresi Bcl-2 ekstrak etil asetat daun keladi tikus dan cisplatin. Sel HeLa (2x105 sel/mL)
ditanam dalam 6 well-plate yang telah diberi cover slip diinkubasi selama 24 jam. Sel diberi perlakuan dengan ekstrak etil asetat daun keladi tikus ½ IC50 dan cisplatin konsentrasi IC50, diinkubasi selama 24 jam. Ekspresi protein diamati di bawah mikroskop cahaya dengan perbesaran 400 kali. (A) Kontrol sel tanpa antibodi Bcl-2. (B) Kontrol sel dengan antibodi Bcl-2. (C) Sel kanker serviks HeLa dengan perlakuan cisplatin (36 µg/mL). (D) Sel kanker serviks HeLa dengan perlakuan ekstrak etil asetat daun keladi tikus (320 µg/mL).
Keterangan gambar: (menunjukkan sel tidak mengekspresikan Bcl-2) dan (menunjukkan sel mengekspresikan Bcl-2)
A B
14
Ekstrak etil asetat daun keladi tikus
1 (n = 207) 16 (7,73%) 1+
2 (n = 219) 18 (8,22%) 1+
3 (n = 178) 17 (9,55%) 1+
Pada tabel 2 dapat dilihat bahwa pada kontrol sel HeLa tanpa antibodi tidak mengekspresikan Bcl-2 (0%) level ekspresi 0, dan untuk kontrol sel HeLa dengan antibodi 100% mengekspresikan Bcl-2 level ekspresi +4. Untuk perlakuan sel HeLa dengan cisplatin mengekspresikan Bcl-2 sebesar 0,78%; 2,4% dan 0% dengan level ekspresi 0 yang menyatakan cisplatin sangat kuat menekan ekspresi Bcl-2. Cisplatin berinteraksi dengan Bcl-2 sebagai faktor intrinsik dalam apoptosis. Cisplatin menekan Bcl-2 sebagai mediator antiapoptosis, sehingga cisplatin dapat menginduksi apoptosis (Leisching, dkk., 2015). Oleh karena itu cisplatin digunakan sebagai pembanding atau kontrol positif dalam skrining penemuan agen kemopreventif yang selektif pada regulasi ekspresi protein Bcl-2.
15
Bcl-2. Sehingga dengan adanya penekanan COX-2 dapat menekan produksi Bcl-2 (Shehzad, dkk., 2015). Pada penelitian ini perhitungan ekspresi Bcl-2 bersifat semikuantitatif, diperlukan penelitian lebih lanjut untuk mengetahui ekspresi Bcl-2 secara kuantitatif.
Protein Bcl-2 mencegah terlepasnya sitokrom-C sehingga proses apoptosis tidak terjadi, dengan dihambatnya protein Bcl-2 maka sitokrom C akan terlepas dan proses apoptosis dapat terjadi (Smedt & Bultynck, 2014). Sitokrom-c berikatan dengan apoptotic protease-activating factor 1 (Apaf-1), sehingga terbentuk kompleks yang teraktivasi dari
(d)ATP, dan procaspase-9. Aktivasi caspase-9 memicu aktivasi caspase-3 dan caspase-7, sehingga memicu terjadinya apoptosis (Weyhenmeyer, dkk., 2012). Adanya mediator lainnya setelah terjadi penekanan ekspresi Bcl-2 juga berpengaruh pada proses apoptosis. Penelitian lebih lanjut diperlukan untuk mengetahui regulasi mediator lainnya yang berperan dalam proses apoptosis setelah terjadi penekanan ekspresi Bcl-2.
KESIMPULAN
Hasil yang diperoleh, ekstrak etil asetat daun keladi tikus memiliki aktivitas sitotoksik lemah dengan nilai IC50 640 µg/mL. Hasil uji apoptosis pada konsentrasi ½ IC50 dengan waktu inkubasi 24 jam menunjukkan bahwa sampel menginduksi kematian melalui apoptosis sebesar 12% dan nekrosis sekunder yang merupakan lanjutan dari apoptosis sebesar 86%. Hasil uji imunositokimia menunjukkan sampel menekan kuat ekspresi protein Bcl-2, sehingga kemungkinan induksi apoptosis diperantarai penekanan ekspresi protein Bcl-2. Bedasarkan hasil tersebut, ekstrak etil asetat daun keladi tikus memiliki potensi sebagai agen kemopreventif namum masih perlu ditelusuri lebih lanjut terutama induksi kematian sel.
Saran untuk penelitian selanjutnya perlu dilakukan identifikasi kandungan dari ekstrak etil asetat daun keladi tikus dan mengetahui selektivitas ekstrak etil asetat daun keladi tikus terhadap sel kanker. Mekanisme induksi apoptosis perlu dikonfirmasi dengan melakukan time course assay dengan waktu inkubasi kurang dari 24 jam. Selain itu penelitian lebih lanjut juga
16
Akl, H., Vervloessem, T., Kiviluoto, S., Bittremieux, M., Parys, J. B., De Smedt, H., & Bultynck, G., 2014. A dual role for the anti-apoptotic Bcl-2 protein in cancer: Mitochondria versus endoplasmic reticulum. Biochimica et Biophysica Acta - Molecular Cell Research, 1843(10), 2240–2252.
American Cancer Society. 2016. Cancer Facts & Figures 2016. Cancer Facts & Figures 2016, 1–9.
Barros, L. F., Kanaseki, T., Sabirov, R., & Morishima, S. 2003. Apoptotic and necrotic blebs in epithelial cells display similar neck diameters but different kinase dependency, d, 687– 697.
Cancer Chemoprevention Research Centera, 2009. Prosedur Tetap: Panen Sel, Unversitas Gajah Mada, Yogyakarta,
http://ccrc.farmasi.ugm.ac.id/en/wp-content/uploads/03.005.-Panen-Sel.pdf diakses pada tanggal 1 April 2016.
Cancer Chemoprevention Research Centerb, 2009. Prosedur Tetap: Pengamatan Ekspresi Protein dengan Metode Immunositokimia, Unversitas Gajah Mada, Yogyakarta,
http://ccrc.farmasi.ugm.ac.id/en/wp-content/uploads/03.012.-Imunositokimia.pdf diakses
pada tanggal 1 April 2016.
Cancer Chemoprevention Research Centerc, 2009. Prosedur Tetap: Preparasi Sampel untuk
Flowcytometry, Unversitas Gajah Mada, Yogyakarta,
http://ccrc.farmasi.ugm.ac.id/wp-content/uploads/03.014.02-flowcytometry.pdf diakses
pada tanggal 1 April 2016.
Cancer Chemoprevention Research Centerd, 2009. Prosedur Tetap: Uji Sitotoksik Metode MTT, Unversitas Gajah Mada, Yogyakarta,
http://ccrc.farmasi.ugm.ac.id/wp-content/uploads/03.010.02-uji-sitotoksik-MTT.pdf diakses pada tanggal 1 April 2016.
Charras, G. T., Yarrow, J. C., Horton, M. A., Mahadevan, L., & Mitchison, T. J. (2005). Non-equilibration of hydrostatic pressure in blebbing cells. Nature, 435(7040), 365–9.
Cheever, M. A., Allison, J. P., Ferris, A. S., Finn, O. J., Hastings, B. M., Hecht, T. T., Matrisian, L. M. 2009. The prioritization of cancer antigens: A National Cancer Institute pilot project for the acceleration of translational research, Clinical Cancer Research, 15(17), 5323–5337.
17
Dasari, S., & Bernard, P. (2014). Cisplatin in an er therapy : Mole ular me hanisms of action. European Journal of Pharmacology, 1–15.
De Bruin, E. C., & Medema, J. P. 2008. Apoptosis and non-apoptotic deaths in cancer development and treatment response. Cancer Treatment Reviews, 34(8), 737–749.
DeSantis, C. E., Lin, C. C., Mariotto, A. B., Siegel, R. L., Stein, K. D., Kramer, J. L., Jemal, A. 2014. Cancer treatment and survivorship statistics, 2014. CA Cancer J Clin, 64(4), 252–271.
Demoy, M., Minko, T., & Kopeckova, P. 2000. Time- and concentration-dependent apoptosis and necrosis induced by free and HPMA copolymer-bound doxorubicin in human ovarian carcinoma cells, 69, 185–196.
Ellithey, M. S., Lall, N., Hussein, A. A., & Meyer, D. 2014. Cytotoxic and HIV-1 enzyme inhibitory activities of Red Sea marine organisms. BMC Complementary and Alternative Medicine, 14, 77.
Fackler, O. T., & Grosse, R. 2008. Cell motility through plasma membrane blebbing, 879– 884.
Ferlay, J., Soerjomataram, I., Dikshit, R., Eser, S., Mathers, C., Rebelo, M., Bray, F. 2015. Cancer incidence and mortality worldwide: Sources, methods and major patterns in GLOBOCAN 2012. International Journal of Cancer, 136(5), E359–E386.
Galluzzi, L., Vacchelli, E., Bravo-San Pedro, J.-M., Buqué, A., Senovilla, L., Baracco, E. E., Kroemer, G., 2014, Classification of current anticancer immunotherapies. Oncotarget, 5(24), 12472–508.
Guimaraes, M.C.M., dkk., 2005. Immunohistochemical Expression of p16INK4a and bcl-2 According to HPV Type and to the Progression of Cervical Squamous Intraepithelial Lesions. Journal of Histochemistry & Cytochemistry, 53(4), 509–16.
Hayrabedyan, S., Georgiev, B., Kacheva, D., Chervenkov, M., Shumkov, K., Taushanova, P., & Kistanova, E. (2012). Flowcytometry as a method for advanced evaluation of boar semen. Comptes Rendus de L’Academie Bulgare Des Sciences, 65(4), 541–548.
Hemaiswarya, S., & Doble, M. 2006. Potential synergism of natural products in the treatment of cancer. Phytotherapy Research : PTR, 20(November 2005), 239–249.
18
Ho, W. Y., Yeap, S. K., Ho, C. L., Rahim, R. A., & Alitheen, N. B. 2012. Development of Multicellular Tumor Spheroid, MCTS) Culture from Breast Cancer Cell and a High Throughput Screening Method Using the MTT Assay. PLoS ONE, 7(9).
Huang, H., Chen, A. Y., Ye, X., Li, B., Rojanasakul, Y., Rankin, G. O., & Chen, Y. C., 2015. Myricetin inhibits proliferation of cisplatin-resistant cancer cells through a p53-dependent apoptotic pathway. International Journal of Oncology, 47(4), 1494–1502. International Agency for Research on Cancer WHO (IARC), 2015, Estimated Cancer
Incidence, Mortality and Prevalence, tersedia dalam www.http://globocan.iarc.fr/, diakses tanggal 15 Juli 2016.
Jo, H. Y., Kim, Y., Park, H. W., Moon, H. E., Bae, S., Kim, J., Paek, S. H. 2015. The Unreliability of MTT Assay in the Cytotoxic Test of Primary Cultured Glioblastoma Cells, 24(3), 235–245.
Katrin, E., Winarno, H., Susanto, & N., F., 2012, Karakteristika dan Khasiat Daun Keladi tikus, Typhonium divaricatum, L .) Decne ) Iradiasi. Jurnal Ilmiah Aplikasi Isotop Dan Radiasi, 8(1), 31–35.
Kutuk, O., Arisan, E. D., Tezil, T., Shoshan, M. C., & Basaga, H. 2009. Cisplatin overcomes Bcl-2-mediated resistance to apoptosis via preferential engagement of Bak: Critical role of Noxa-mediated lipid peroxidation. Carcinogenesis, 30(9), 1517–1527.
Landry, J. J. M., Pyl, P. T., Rausch, T., Zichner, T., Tekkedil, M. M., Stütz, A. M., Steinmetz, L. M., 2013, The genomic and transcriptomic landscape of a HeLa cell line. G3,Bethesda, Md.), 3(8), 1213–24.
Leisching, G., Loos, B., Botha, M., & Engelbrecht, A.-M. 2015. A Nontoxic Concentration of Cisplatin Induces Autophagy in Cervical Cancer. International Journal of Gynecological Cancer, 25(3), 380–388.
Li, ZF., Wang, ZD., Ji, YY., Zhang, S., Huang, C., Li J., Xia, XM. 2009. Induction of apoptosis and cell cycle arrest in human HCC MHCC97H cells with Chrysanthemum indicum extract. World J Gastroenterol September 28; 15 (36): 4538-4546.
Mankaran, S., Dinesh, K., Deepak, S., & Gurmeet, S. 2013. Typhonium flagelliforme : A multipurpose plant. International research journal of pharmacy, 4(3), 45–48.
19
Nobakht, G. M., Kadir, M. a, Stanslas, J., & Charng, C. W. 2014. Cytotoxic effect of Typhonium flagelliforme extract. Journal of Medicinal Plants Research, 8(31), 1021– 1024.
Purwaningsih E., Widayanti E., Suciati Y. 2014. Cytotoxic Assay of Typhonium flagelliforme Lodd Against Breast and Cervical Cancer Cell. Universa Medicina Vol. 33.No.2.
Sak, K. 2012. Chemotherapy and dietary phytochemical agents. Chemotherapy Research and Practice, 2012, 282570.
Sharma, R., 2012. Cancer Chemoprevention: Prevention is Better than Cure. Cancer Science Therapy, S3:e001.
Shehzad, A., Lee, J., & Lee, Y. S. 2015. Autocrine prostaglandin E 2 signaling promotes promonocytic leukemia cell survival via COX-2 expression and MAPK pathway, 48(2), 109–114.
Setiawati, A., Immanuel, H., & Utami, M. T. 2016. The inhibitor of (Typhonium flagelliforme (Lodd.) Blume) leaf extract on COX-2 expression of WiDr colon cancer cells. Asian Pacific Journal of Tropical Biomedicine, 6(3), 251–255.
Smedt, H. De, & Bultynck, G. 2014. A dual role for the anti-apoptotic Bcl-2 protein in cancer: Mitochondria versus endoplasmic reticulum. BBA - Molecular Cell Research.
Xu, T., dkk., 2014. Proteomic Investigation into Betulinic Acid-Induced Apoptosis of Human Cervical Cancer HeLa Cells. PLoS ONE, 9(8), 1–11.
You, B. R., Moon, H. J., Han, Y. H., & Park, W. H. 2010. Gallic acid inhibits the growth of HeLa cervical cancer cells via apoptosis and/or necrosis. Food and Chemical Toxicology : An International Journal Published for the British Industrial Biological Research Association, 48(5).
Zhang, H., Ph, D., Sun, X., & Ph, D. 2002. Overexpression of Cyclooxygenase-2 Correlates With Advanced Stages of Colorectal Cancer, Am J Gastroenterol, 97(4), 1–5.
20
21
Gambar A. Tanaman keladi tikus dipetik dan dicuci menggunakan air mengalir kemudian diangin-anginkan sebelum dimasukkan ke dalam oven
22
Data Konsentrasi Ekstrak Etil Asetat Daun Keladi Tikus vs Viabilitas Sel
Kurva Konsentrasi ekstrak vs % Viabilitas Sel
0
0 200 400 600 800 1000 1200 1400 1600
23
24
File: KS HeLa.001 Gate: No G ate Tota l Even ts: 20000
Re gion % Gated % Total R1 88.28 88.28 R2 3.55 3.55 R3 2.58 2.58 R4 5.67 5.67 File: KS HeLa.001 Gate: No G ate Tota l Even ts: 20000
Quad % Gated % Total UL 5.05 5.05 UR 2.50 2.50 LL 88.72 88.72 LR 3.74 3.74
R2 R3
R4
25
File: cisplatin HeLa.006 Gate: No G ate Tota l Even ts: 20000
Re gion % Gated % Total R1 61.80 61.80 R2 25.44 25.44 R3 10.62 10.62 R4 2.69 2.69 File: cisplatin HeLa.006 Gate: No G ate Tota l Even ts: 20000
Quad % Gated % Total UL 2.54 2.54 UR 10.54 10.54 LL 61.02 61.02 LR 25.91 25.91
R2 R4
26
File: KEL ADI TIKUS I HeLa APOPT Gate: No G ate
Tota l Even ts: 20000
Re gion % Gated % Total
R1 2.38 2.38
R2 0.01 0.01
R3 11.79 11.79
R4 86.03 86.03
File: KEL ADI TIKUS I HeLa AP Gate: No G ate
Tota l Even ts: 20000
Quad % Gated % Total
UL 86.01 86.01
UR 11.58 11.58
LL 2.40 2.40
LR 0.01 0.01
R2
27
Pengamatan tiga lapang pandang sel kanker serviks HeLa dalam perhitungan imunositokimia
A. Kontrol sel tanpa antibodi
B. Kontrol sel dengan antibodi
31