DEGRADASI FENOL DALAM LIMBAH CAIR DENGAN METODE
CONTACT GLOW DISCHARGE ELECTROLYSIS (CGDE)
MENGGUNAKAN ELEKTROLIT Na2SO4
Ratih Tien Seratri dan Nelson SaksonoDepartemen Teknik Kimia, Fakultas Teknik Universitas Indonesia Kampus UI Depok, Depok 16424 Tel. 7863515, 7863516
email: ratihtien@yahoo.com
ABSTRAK
Penelitian ini bertujuan untuk mendegradasi senyawa fenol dalam limbah cair dengan menggunakan reaktor CGDE. Kondisi optimum untuk pengolahan fenol diperoleh dengan melakukan pengujian terhadap pengaruh tegangan, konsentrasi elektrolit, dan kedalaman anoda terhadap produktivitas hidrogen peroksida, persentase degradasi fenol, dan konsumsi energi yang dihasilkan. Berdasarkan hasil penelitian diperoleh bahwa semakin besar tegangan, konsentrasi elektrolit, dan kedalaman anoda yang diberikan, produktivitas hidrogen peroksida dan persentase degradasi fenol yang dihasilkan juga meningkat. Hasil optimum diperoleh pada tegangan 700 Volt, konsentrasi
Na2SO4 0,03 M, dan kedalaman anoda 5 mm dengan persentase penyisihan sebesar 87,27 % dan konsumsi energi
sebesar 5.687 kJ/mmol selama 90 menit. Penambahan ion Fe2+ dalam larutan dapat mendekomposisi hidrogen
peroksida menjadi hidroksil radikal dan ion Fe3+ yang akan mempercepat proses degradasi yang berlangsung.
Penambahan ion Fe2+ sebanyak 20 mg/L dapat menghasilkan persentase degradasi fenol sebesar 92,57 % dengan
konsumsi energi sebesar 36,3 kJ/mmol selama 15 menit.
ABSTRACT
This study aims to remove phenol compounds in waste water using CGDE reactor. The optimum conditions for phenol treatment obtained by known the effect of voltage, electrolyte concentration, and the depth of the anode toward hydrogen peroxide productivity, the degradation percentage, and the energy consumption. The result showed that on the higher voltage, electrolyte concentration, and the depth of the anode, the value of hydrogen peroxide productivity and the degradation percentage was also increased. The optimum result was obtained at a voltage of 700
Volt, 0.03 M Na2SO4 concentration, and the depth of 5 mm which have percentage of 87.27% with energy
consumption as 5,687 kJ/mmol during 90 minutes. The addition of Fe2+ ions in solution could decompose hydrogen
peroxide into hydroxyl radicals and Fe3+ ions which could accelerated the degradation process. Degradation
percentage with addition of 20 mg/L Fe2+ ion was 92.57% with the energy consumption by 36.3 kJ / mmol during 15
minutes.
Keywords: CGDE, phenol, plasma, hydroxyl radical.
1. Pendahuluan
Perkembangan industri yang semakin pesat disertai dengan peningkatan jumlah limbah yang diproduksi. Limbah industri tersebut tak jarang mengandung senyawa organik berbahaya yang dapat menyebabkan permasalahan yang serius bagi manusia dan lingkungan. Salah satu limbah organik yang belakangan menjadi perhatian peneliti adalah fenol.
Fenol (C6H5OH) dapat berasal dari industri pulp,
polimer, migas, organik pestisida, farmasi, dan industri kimia lainnya. Pada konsentrasi tertentu fenol dapat menyebabkan kerusakan hati dan ginjal, melemahkan
detak jantung, menurunkan tekanan darah, hingga menyebabkan kematian pada manusia [1].
Pada tahun 2006, BPLH Provinsi Jawa Barat menemukan senyawa fenol dengan konsentrasi sebesar 100-150 mg/L dihasilkan dari industri farmasi. Padahal di dalam peraturan Menteri Lingkungan Hidup (MENLH) pada tahun 1995 dan 2010 disebutkan bahwa fenol dalam kawasan industri dinyatakan aman pada ambang batas 1 mg/L. Mengingat jumlahnya yang banyak di lingkungan dan bahaya yang ditimbulkan, maka diperlukan suatu metode yang dapat mendegradasi fenol dengan konversi semaksimal mungkin. Metode CGDE telah berhasil mendegradasi
beberapa polutan organik melalui pembentukan radikal hidroksil. Beberapa senyawa organik yang dapat didegradasi dengan metode CGDE diantaranya adalah acid orange 7 [2], amonia [3], alizarin red S [4], dll. CGDE merupakan proses elektrokimia non-Faradaic yang dialiri tegangan yang cukup tinggi pada dua
elektroda dan permukaan elektrolit yang
melingkupinya sehingga menghasilkan plasma pada larutan [5]. Plasma sendiri adalah gas yang terionisasi akibat serangan elektromagnetik dan menghasilkan senyawa-senyawa reaktif seperti radikal hidroksil
(OH•), radikal H (H•), dan H
2O+. Radikal hidroksil
tersebut kemudian akan menyerang molekul fenol dan menguraikannya.
Untuk mengetahui kinerja radikal hidroksil dalam mendegradasi fenol, jumlah radikal hidroksil yang dihasilkan dari proses CGDE perlu diketahui. Akan tetapi radikal hidroksil memiliki waktu tinggal yang
sangat singkat di dalam reaktor yakni 10-6 s [6].
Akibatnya keberadaan radikal hidroksil susah diukur. Keberadaan radikal hidroksil dapat diukur melalui jumlah hidrogen peroksida yang terbentuk karena hidrogen peroksida berasal dari reaksi dua senyawa radikal hidroksil [7]. Produktivitas radikal hidroksil dalam mendegradasi limbah dipengaruhi oleh beberapa variabel seperti tegangan, konsentrasi elektrolit, dan
kedalaman anoda. Penambahan ion Fe2+ di dalam
larutan juga dapat mempercepat proses degradasi yang berlangsung karena dapat menguraikan hidrogen
peroksida menjadi radikal hidroksil dan Fe3+ yang
dapat bereaksi langsung dengan produk intermediate fenol. Penelitian ini bertujuan untuk mengetahui
pengaruh variabel-variabel tersebut terhadap
produktivitas hidrogen peroksida dan persentase degradasi yang dihasilkan.
2. Metode Penelitian
Proses penyisihan fenol dilakukan dengan menggunakan reaktor CGDE yang telah dikembangkan oleh peneliti-peneliti sebelumnya [8]. Reaktor ini menggunakan glass beaker berukuran 600 mL dengan volume limbah sebanyak 400 mL dan bersifat batch yang dilengkapi dengan cooling jacket yang mengalir dengan sistem kontinyu. Cooling jacket berfungi untuk
mengatur suhu larutan pada rentang 50-60 oC.
Pengaturan suhu tersebut disebabkan oleh radikal hidroksil yang menghasilkan selektivitas maksimum
pada suhu 50-60 oC [9]. Fungsi pengadukan dengan
magnetic stirrer bertujuan untuk membuat distribusi suhu menjadi homogen. Selain itu, penelitian ini
menggunakan larutan elektrolit Na2SO4, katoda
berbahan stainless steel dengan diameter 8 mm dan anoda berbahan wolfram dengan diameter 3,5 mm.
2.1. Kurva I-V pada konsentrasi elektrolit yang berbeda.
Pengaruh tegangan terhadap arus yang dihasilkan dengan metode CGDE diperlukan untuk mengetahui rentang tegangan pembentukan plasma yang kemudian akan digunakan lebih lanjut pada variasi tegangan. Selain itu, dari pengujian ini akan dilihat pengaruh konsentrasi elektrolit terhadap pembentukan selubung gas yang berakibat pada karakteristik I-V yang diperoleh.
2.2. Kinerja CGDE dalam mendegradasi fenol Kinerja CGDE dalam mendegradasi fenol dapat dilihat dari pengaruh variabel-variabel prosesnya. Pada prosedur ini, pengujian dilakukan selama 90 menit dengan pengambilan data setiap 15 menit sekali. Data yang diukur berupa konsentrasi hidrogen peroksida, persentase degradasi fenol, dan arus rata-rata yang dihasilkan selama proses berlangsung. Arus rata-rata ini digunakan untuk mengetahui kebutuhan energi selama proses degradasi. Konsumsi energi diperoleh melalui persamaan:
E = tegangan x arus x waktu
fenol yang terdegradasi (mmol) 3. Hasil dan Pembahasan
3.1. Kurva I-V
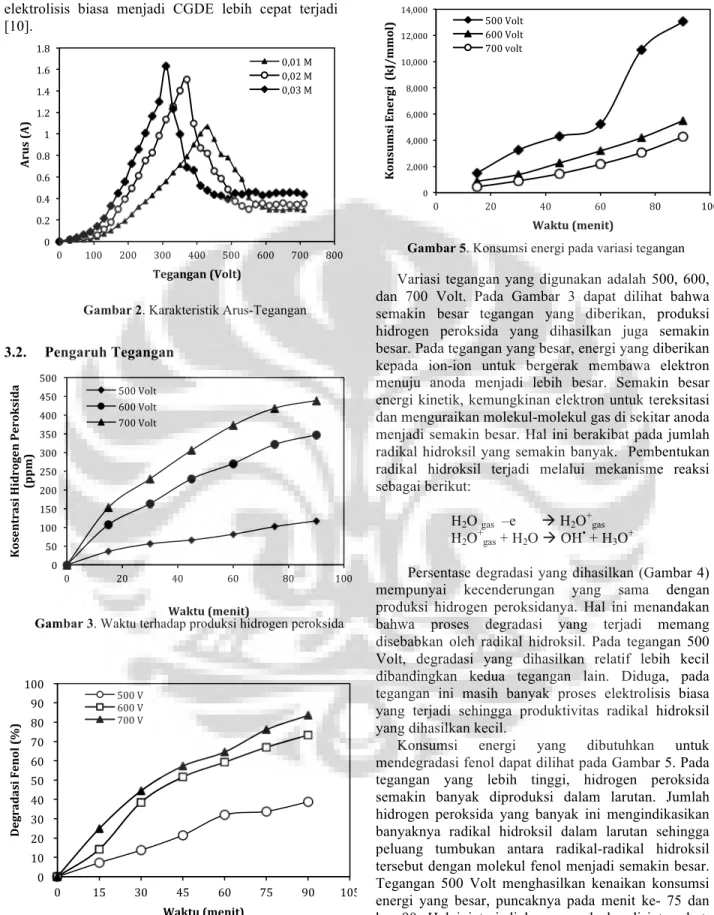
Secara umum, karakteristik I-V yang dihasilkan dari konsentrasi 0,01; 0,02; dan 0,03 M memiliki bentuk kurva yang sama. Perbedaan dari ketiga kurva tersebut terletak pada tegangan breakdown dan nilai arusnya. Tegangan breakdown merupakan tegangan yang dibutuhkan untuk membangkitkan plasma pada larutan, ditandai dengan turunnya nilai arus. Pada konsentrasi yang tinggi, breakdown terjadi pada tegangan yang lebih kecil. Semakin besar konsentrasi elektrolit, semakin besar pula konduktivitasnya. Konduktivitas yang besar menyebabkan pemanasan Joule yang dihasilkan untuk mengevaporasi larutan menjadi lebih besar. Akibatnya breakdown dari
anoda katoda Magnetic stirrer Cooling jacket termometer glass beaker
elektrolisis biasa menjadi CGDE lebih cepat terjadi [10].
3.2. Pengaruh Tegangan
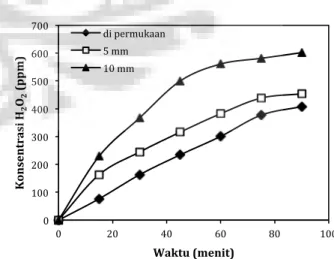
Variasi tegangan yang digunakan adalah 500, 600, dan 700 Volt. Pada Gambar 3 dapat dilihat bahwa semakin besar tegangan yang diberikan, produksi hidrogen peroksida yang dihasilkan juga semakin besar. Pada tegangan yang besar, energi yang diberikan kepada ion-ion untuk bergerak membawa elektron menuju anoda menjadi lebih besar. Semakin besar energi kinetik, kemungkinan elektron untuk tereksitasi dan menguraikan molekul-molekul gas di sekitar anoda menjadi semakin besar. Hal ini berakibat pada jumlah radikal hidroksil yang semakin banyak. Pembentukan radikal hidroksil terjadi melalui mekanisme reaksi sebagai berikut:
H2O gas –e à H2O+gas
H2O+gas + H2O à OH• + H3O+
Persentase degradasi yang dihasilkan (Gambar 4) mempunyai kecenderungan yang sama dengan produksi hidrogen peroksidanya. Hal ini menandakan bahwa proses degradasi yang terjadi memang disebabkan oleh radikal hidroksil. Pada tegangan 500 Volt, degradasi yang dihasilkan relatif lebih kecil dibandingkan kedua tegangan lain. Diduga, pada tegangan ini masih banyak proses elektrolisis biasa yang terjadi sehingga produktivitas radikal hidroksil yang dihasilkan kecil.
Konsumsi energi yang dibutuhkan untuk
mendegradasi fenol dapat dilihat pada Gambar 5. Pada tegangan yang lebih tinggi, hidrogen peroksida semakin banyak diproduksi dalam larutan. Jumlah hidrogen peroksida yang banyak ini mengindikasikan banyaknya radikal hidroksil dalam larutan sehingga peluang tumbukan antara radikal-radikal hidroksil tersebut dengan molekul fenol menjadi semakin besar. Tegangan 500 Volt menghasilkan kenaikan konsumsi energi yang besar, puncaknya pada menit ke- 75 dan ke- 90. Hal ini terjadi karena pada kondisi tersebut, konsentrasi fenol yang tersisa dalam larutan semakin sedikit padahal radikal hidroksil yang dihasilkan
0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 1.8 0 100 200 300 400 500 600 700 800 Arus (A) Tegangan (Volt) 0,01 M 0,02 M 0,03 M 0 50 100 150 200 250 300 350 400 450 500 0 20 40 60 80 100 Kosen trasi Hidrogen Peroksida (ppm) Waktu (menit) 500 Volt 600 Volt 700 Volt 0 10 20 30 40 50 60 70 80 90 100 0 15 30 45 60 75 90 105 Degradasi Fen ol (%) Waktu (menit) 500 V 600 V 700 V 0 2,000 4,000 6,000 8,000 10,000 12,000 14,000 0 20 40 60 80 100 Kon sumsi En ergi (kJ/mmol) Waktu (menit) 500 Volt 600 Volt 700 volt
Gambar 2. Karakteristik Arus-Tegangan
Gambar 3. Waktu terhadap produksi hidrogen peroksida
Gambar 4. Waktu terhadap persentase degradasi
sedikit. Sebaliknya, tegangan 700 Volt menghasilkan konsumsi energi yang paling rendah sehingga efisien untuk digunakan pada penelitian ini.
3.3. Pengaruh Konsentrasi Elektrolit
Pada Gambar 5 dapat dilihat bahwa semakin besar konsentrasi elektrolit yang digunakan, produksi hidrogen peroksida cenderung meningkat. Pada konsentrasi yang besar, ion-ion pembawa elektron berada dalam jumlah banyak pada larutan. Semakin banyak jumlah elektron yang mengalir dalam larutan, kemungkinan elektron-elektron tersebut loncat dari medium elektrolit melalui selubung gas menuju anoda menjadi semakin banyak. Hal ini menyebabkan pembentukan plasma menjadi lebih besar dan memproduksi radikal hidroksil yang lebih banyak [11]. Jumlah radikal hidroksil yang banyak ini menyebabkan persentase degradasi yang dihasilkan juga semakin besar (Gambar 7).
3.4. Pengaruh Kedalaman Anoda
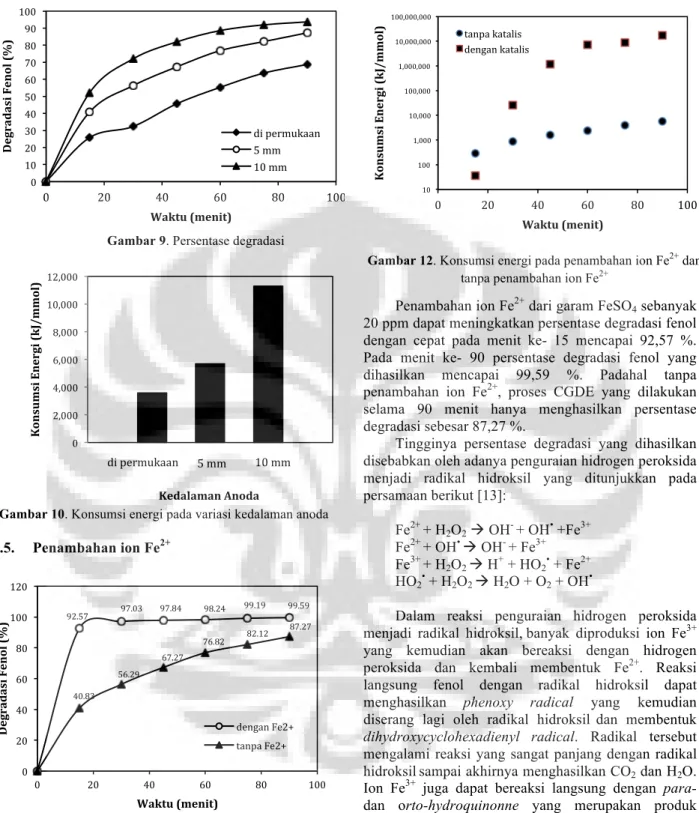
Pada Gambar 8 dapat dilihat bahwa semakin dalam anoda dicelupkan dalam larutan elektrolit, semakin besar pula hidrogen peroksida yang
diproduksi. Semakin besar kedalaman anoda
menyebabkan semakin besar luas permukaan yang mengalami kontak langsung dengan larutan sehingga semakin banyak pula elektron yang mampu mengalir melewati permukaan anoda dan mengalami eksitasi. Hal ini menyebabkan jumlah hidrogen radikal hidroksil yang diproduksi menjadi semakin banyak. Pada kedalaman 10 mm, hidrogen peroksida yang diproduksi mempunyai inkremen semakin kecil dengan kenaikan waktu. Ketika jumlah hidrogen peroksida yang terakumulasi di anolite sudah mencapai titik jenuhnya, hidrogen peroksida tersebut akan akan
dikonversi menjadi O2 akibat reaksi lebih lanjut dengan
radikal hidroksil dengan mekanisme reaksi yang ditunjukkan pada persamaan di bawah ini [12]:
OH• + H2O2
à
H2O + HO2•2HO2•
à
H2O2 + O2HO2 + H2O2
à
OH• + H2O + O2Persentase degradasi yang dihasilkan (Gambar 8)
pada variasi kedalaman anoda mempunyai
kecenderungan yang sama dengan produksi hidrogen peroksidanya. Degradasi terbesar dicapai pada kedalaman 10 mm dengan persentase sebesar 93,69 % selama 90 menit dengan konsumsi energi yang besar yakni 11.288 kJ/mmol. Semakin besar kedalaman anoda, arus yang dihasilkan akan semakin besar dan berdampak pada besarnya konsumsi energinya (Gambar 9).
Meskipun memiliki persentase degradasi yang besar, kedalaman 10 mm tidak disarankan untuk digunakan karena anoda suhu larutan susah diatur dan menyebabkan anoda mudah terbakar. Sebaliknya, kedalaman 5 mm lebih favorable untuk digunakan dengan persentase degradasi sebesar 87,27 % dan konsumsi energi sebesar 5.687 kJ/mmol.
380 390 400 410 420 430 440 450 460 Kon sen trasi Hidrogen Peroksida (ppm) Konsentrasi Na2SO4 0,01 M 0,02M 0,03 M 0 10 20 30 40 50 60 70 80 90 100 0 20 40 60 80 100 Degradasi Fen ol (%) Waktu (menit) 0,01 M 0,02 M 0,03 M 0 100 200 300 400 500 600 700 0 20 40 60 80 100 Kon sen trasi H 2 O2 (ppm) Waktu (menit) di permukaan 5 mm 10 mm
Gambar 6. Produksi hidrogen peroksida
Gambar 7. Persentase degradasi fenol
3.5. Penambahan ion Fe2+
Penambahan ion Fe2+ dari garam FeSO
4 sebanyak
20 ppm dapat meningkatkan persentase degradasi fenol dengan cepat pada menit ke- 15 mencapai 92,57 %. Pada menit ke- 90 persentase degradasi fenol yang dihasilkan mencapai 99,59 %. Padahal tanpa
penambahan ion Fe2+, proses CGDE yang dilakukan
selama 90 menit hanya menghasilkan persentase degradasi sebesar 87,27 %.
Tingginya persentase degradasi yang dihasilkan disebabkan oleh adanya penguraian hidrogen peroksida menjadi radikal hidroksil yang ditunjukkan pada persamaan berikut [13]: Fe2+ + H2O2 à OH- + OH• +Fe3+ Fe2+ + OH• à OH- + Fe3+ Fe3+ + H 2O2 à H+ + HO2• + Fe2+ HO2• + H2O2 à H2O + O2 + OH•
Dalam reaksi penguraian hidrogen peroksida
menjadi radikal hidroksil,banyak diproduksi ion Fe3+
yang kemudian akan bereaksi dengan hidrogen
peroksida dan kembali membentuk Fe2+. Reaksi
langsung fenol dengan radikal hidroksil dapat menghasilkan phenoxy radical yang kemudian
diserang lagi oleh radikal hidroksil dan membentuk
dihydroxycyclohexadienyl radical. Radikal tersebut mengalami reaksi yang sangat panjang dengan radikal
hidroksilsampai akhirnya menghasilkan CO2 dan H2O.
Ion Fe3+ juga dapat bereaksi langsung dengan para-
dan orto-hydroquinonne yang merupakan produk intermediate pada reaksi fenol. Orto-hydroquinone
akan bereaksi dengan Fe3+ menghasilkan
benzoquinone[14]. 0 10 20 30 40 50 60 70 80 90 100 0 20 40 60 80 100 Degradasi Fen ol (%) Waktu (menit) di permukaan 5 mm 10 mm 0 2,000 4,000 6,000 8,000 10,000 12,000 Kon sumsi En ergi (kJ/mmol) Kedalaman Anoda di permukaan 5 mm 10 mm 92.57 97.03 97.84 98.24 99.19 99.59 40.83 56.29 67.27 76.82 82.12 87.27 0 20 40 60 80 100 120 0 20 40 60 80 100 Degradasi Fen ol (%) Waktu (menit) dengan Fe2+ tanpa Fe2+ 10 100 1,000 10,000 100,000 1,000,000 10,000,000 100,000,000 0 20 40 60 80 100 Kon sumsi En ergi (kJ/mmol) Waktu (menit) tanpa katalis dengan katalis
Gambar 9. Persentase degradasi
Gambar 10. Konsumsi energi pada variasi kedalaman anoda
Gambar 11. Persentase degradasi pada penambahan ion Fe2+ dan tanpa penambahan ion Fe2+
Gambar 12. Konsumsi energi pada penambahan ion Fe2+ dan tanpa penambahan ion Fe2+
Hal tersebut menyebabkan proses degradasi yang berlangsung menjadi lebih cepat. Pada penambahan
Fe2+ setelah 15 menit, konsumsi energi yang dihasilkan
meningkat sangat cepat akibat semakin sedikitnya jumlah fenol yang mampu terdegradasi, bahkan bisa
mencapai 1,74 x 107 kJ/mmol.Karena konsumsi energi
yang sangat besar, degradasi fenol dengan penambahan
Fe2+ tidak efektif dilakukan selama 90 menit. Oleh
karena itu, 15 menit dipilih sebagai waktu optimum dengan persentase degradasi fenol sebesar 92,57 % dan konsumsi energi sebesar 36,3 kJ/mmol.
4. Kesimpulan
Pada penelitian dapat ditarik kesimpulan sebagai berikut:
1. Pada konfigurasi elektron CGDE dengan diameter anoda sebesar 3,5 mm dan diameter katoda sebesar 0,8 mm, pembentukan plasma terjadi pada rentang tegangan 500 – 700 Volt.
2. Kondisi optimum untuk degradasi 100 ppm fenol menggunakan reaktor CGDE adalah pada tegangan
700 Volt, konsentrasi Na2SO4 0,03 M, kedalaman
anoda 5 mm, , dan penambahan Fe2+ sebanyak 20
ppm selama 15 menit. Persentase degradasi yang dihasilkan sebesar 92,57 % dengan konsumsi energi sebesar 36,3 kJ/mmol.
5. Referensi
[1]. Slamet, Arbianti, R., & Daryanto. (2005). Makara, Teknologi, 2, 66-71.
[2]. Jin, X., Bai, H., Wang, F., Wang, X., & Ren, H. (2011). IEEE Transactions on Plasma Science, 39, 4.
[3]. Saksono, N., Adiwidodo, B., Karamah, E & Kartohardjono, S. (2013). Journal of Environmental Science and Technology. 6, 41-49.
[4]. Gao, J., Yu, J., Lu, Q., He, X., Yang, W., Li, Y., Pu, L. & Yang, Z. 2008. Dyes and Pigments. 76, 47 – 52.
[5]. Ceccato, P. (2009). Phd Reports. Paris : Ecole Poltytechnique Palaiseau.
[6]. Gai, K., (2006). Journal of the Chinese Chemical Society. 53, 627 – 632.
[7]. Jin, X., Wang, X., Yue, J., Cai, Y. & Zhang, H. (2010). Electrochimica Acta, 56, 925-928.
[8]. Saksono, N., Adiwidodo, B., Karamah, E & Kartohardjono, S. (2013). Journal of Environmental Science and Technology. 6, 41-49.
[9]. Joshi, R. S. (2010). BAM-Dissertationsreihe 59.
[10]. Gao, J., Wang, A., Fu, Y., Wu, J., Ma, D., Guo, X., Li, Y. & Yang, W. (2008). Plasma Science and Technology. 10, 1.
[11]. Gao, J., Yu, Y., Lu, Q., Yang, Wu., Li, Y & Pu, L., (2004). Pakistan Journal of Biological Sciences,7, 1715-1720.
[12]. Jin, X., Bai, H., Wang, F., Wang, X., Wang, X. & Ren, A. H. (2011). IEEE Transactions On Plasma Science, 39 No.4, 1099.
[13]. Gao, J., Yu, J., Li, Y., He, X., Bo, L., Pu, L., Yang, W., Lu, Q. & Yang, Z. (2006). Journal of Hazardous Materials, B 137, 431-436.
[14]. Wang, L. & Jiang, X. (2008). J. Hazardous. Materials., 161, 926-932.