KEANEKARAGAMAN DAN POTENSI BAKTERI
LAHAN RAWA PASANG SURUT KALIMANTAN SELATAN
DAN LAHAN RAWA LEBAK SUMATRA SELATAN
MUHAMMAD FARHAN SYAH
PROGRAM STUDI BIOLOGI
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA
2021 M / 1442 H
KEANEKARAGAMAN DAN POTENSI BAKTERI
LAHAN RAWA PASANG SURUT KALIMANTAN SELATAN
DAN LAHAN RAWA LEBAK SUMATRA SELATAN
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains pada Program Studi Biologi Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
MUHAMMAD FARHAN SYAH 11170950000018
PROGRAM STUDI BIOLOGI
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA
2021 M / 1442 H
i
KEANEKARAGAMAN DAN POTENSI BAKTERI
LAHAN RAWA PASANG SURUT KALIMANTAN SELATAN
DAN LAHAN RAWA LEBAK SUMATRA SELATAN
LEMBAR PENGESAHAN
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains pada Program Studi Biologi Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
MUHAMMAD FARHAN SYAH 11170950000018
Menyetujui,
Pembimbing I
Dr. Nani Radiastuti, M.Si. NIP. 19650902 200112 2 001
Pembimbing II
Dr. Dwi Ningsih Susilowati, S.TP., M.Si. NIP. 19710517 199903 2 001
Mengetahui,
Ketua Program Studi Biologi Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
Dr. Priyanti, M.Si. NIP. 19750526 200012 2 001
ii
PENGESAHAN UJIAN
Skripsi berjudul “Keanekaragaman dan Potensi Bakteri Lahan Rawa Pasang Surut Kalimantan Selatan dan Lahan Rawa Lebak Sumatera Selatan” yang ditulis oleh
Muhammad Farhan Syah, NIM 11170950000018 telah diuji dan dinyatakan LULUS dalam sidang Munaqasah Fakultas Sains dan Teknologi Universitas
Islam Negeri Syarif Hidayatullah Jakarta pada tanggal 4 Agustus 2021. Skripsi ini telah diterima sebagai salah satu syarat untuk memperoleh gelar Sarjana Strata Satu (S1) Program Studi Biologi.
Menyetujui,
Penguji I Penguji II
Narti Fitriana, M.Si. Ir. Etyn Yunita, M.Si.
NIDN. 0331107403 NIP. 19700628 201411 2002
Pembimbing I Pembimbing II
Dr. Nani Radiastuti, M.Si Dr. Dwi Ningsih Susilowati, S.TP., M.Si NIP. 19650902 200112 2 001 NIP. 19710517 199903 2001
Mengetahui,
Dekan Fakultas Sains dan Teknologi Ketua Program Studi Biologi
Nasrul Hakiem, S.Si., M.T., Ph.D Dr. Priyanti, M.Si NIP. 19710608 200501 1 005 NIP. 19750526 200012 2 001
iii
PERNYATAAN
DENGAN INI SAYA MENYATAKAN BAHWA SKRIPSI INI ADALAH BENAR HASIL KARYA SENDIRI YANG BELUM PERNAH DIAJUKAN SEBAGAI SKRIPSI ATAU KARYA ILMIAH PADA PERGURUAN TINGGI ATAU LEMBAGA MANAPUN.
JAKARTA, JULI 2021
MUHAMMAD FARHAN SYAH 11170950000018
iv
ABSTRAK
Muhammad Farhan Syah. Keanekaragaman dan Potensi Bakteri Lahan Rawa Pasang Surut Kalimantan Selatan dan Lahan Rawa Lebak Sumatra Selatan. Fakultas Sains dan Teknologi. 2021. Dibimbing oleh Dr.Nani Radiastuti, M.Si. dan Dr.Dwi Ningsih Susilowati, S.TP., M.Si.
Lahan rawa pasang surut dan lebak merupakan sumber daya lahan yang berpotensi untuk dijadikan lahan pertanian. Namun, diperlukan inovasi teknologi pemanfaatan lahan rawa dengan memerhatikan keanekaragaman serta potensi bakteri indigenous pada lahan tersebut. Penelitian ini bertujuan menganalisis jenis dan potensi bakteri lahan rawa pasang surut Kalimantan Selatan (KS) dan lahan rawa lebak Sumatra Selatan (SS) yang berperan penting meningkatkan kesuburan lahan rawa untuk sektor pertanian. Keanekaragaman bakteri lahan rawa diamati dengan teknik pengkulturan dan nonpengkulturan menggunakan shotgun metagenomic sequencing serta dilakukan uji potensi bakteri penghasil hormon Asam Indol Asetat (AIA), siderofor, dan 1-aminosiklopropana-1-karboksilat (ACC Deaminase). Hasil isolasi dengan teknik pengkulturan diperoleh 3 isolat bakteri lahan rawa pasang surut KS serta 8 isolat bakteri lahan rawa lebak SS yang semuanya termasuk ke dalam filum Firmicutes. Analisis potensi menunjukkan semua isolat bakteri mampu menghasilkan hormon AIA, siderofor, dan ACC Deaminase. Hasil isolasi dengan teknik nonpengkulturan menunjukkan sebanyak 4 filum bakteri teridentifikasi sebagai Proteobacteria (0,63%), Actinobacteria (0,13%), Firmicutes (0,06%), dan Gemmatimonadetes (0,04%) pada lahan rawa pasang surut KS, dan lahan rawa lebak SS diperoleh 5 filum bakteri yaitu, Proteobacteria (0,3%), Actinobacteria (0,24%), Acidobacteria (0,12%), Chloroflexi (0,08%), dan Gemmatimonadetes (0,04%). Bakteri yang teridentifikasi pada kedua lahan rawa berperan penting meningkatkan kesuburan tanah untuk sektor pertanian.
Kata kunci: Bakteri lahan rawa, lebak, pasang surut, shotgun metagenomic
v
ABSTRACT
Muhammad Farhan Syah. Diversity and Potential of Bacteria in Tidal Swamp Land in South Kalimantan and Lebak Swamp Land in South Sumatra. Faculty of Science and Technology. 2021. Supervised by Dr.Nani Radiastuti, M.Si. and Dr.Dwi Ningsih Susilowati, S.TP., M.Si.
Tidal and lowland swamps are land resources that have the potential to be used as agricultural land. However, technological innovations in the use of swamp land are needed by taking into account the diversity and potential of indigenous bacteria on the land. This study aims to analyze the types and potential of bacteria in the tidal swamp land of South Kalimantan (KS) and the lebak swamp land of South Sumatra (SS) which play an important role in increasing the fertility of swamp land for the agricultural sector. The diversity of swamp bacteria was observed by culturing and non-cultivation techniques using shotgun metagenomic sequencing and testing the potential of bacteria producing the hormones Indole Acetic Acid (AIA), siderophores, and 1-aminocyclopropane-1-carboxylate (ACC Deaminase). The results of the isolation by culturing techniques obtained 3 isolates of bacteria from the tidal swamp land of KS and 8 isolates of bacteria from the lebak swamps of SS, all of which belong to the phylum Firmicutes. Potency analysis showed that all bacterial isolates were able to produce AIA, siderophores, and ACC Deaminase hormones. The results of the isolation using non-cultivation techniques showed that as many as 4 bacterial phyla were identified as Proteobacteria (0.63%), Actinobacteria (0.13%), Firmicutes (0.06%), and Gemmatimonadetes (0.04%) in tidal swamp land KS , and the Lebak SS swampland obtained 5 bacterial phyla namely, Proteobacteria (0.3%), Actinobacteria (0.24%), Acidobacteria (0.12%), Chloroflexi (0.08%), and Gemmatimonadetes (0.04 %). The bacteria identified in the two swamps played an important role in increasing soil fertility for the agricultural sector.
vi
KATA PENGANTAR
Bismillahirrahmanirrahim
Puji syukur kehadirat Allah subhanahu wa ta’ala karena atas rahmat dan karunia-Nya yang senantiasa dilimpahkan kepada semua makhluknya. Berkat rahmat Allah subhanahu wa ta’ala, penulis diberikan kemudahan dalam menulis serta menyusun skripsi ini dengan judul “Keanekaragaman dan Potensi Bakteri Lahan Rawa Pasang Surut Kalimantan Selatan dan Lahan Rawa Lebak Sumatra Selatan” sebagai syarat mendapat gelar Sarjana Sains di Program Studi Biologi, Fakultas Sains dan Teknologi, Universitas Islam Negeri Syarif Hidayatullah Jakarta. Skripsi ini dapat terselesaikan atas bantuan beberapa pihak. Pada kesempatan ini penulis ingin menyampaikan terima kasih kepada:
1. Nashrul Hakiem, S.Si., M.T., Ph.D. selaku Dekan Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif Hidayatullah Jakarta.
2. Dr. Priyanti, M.Si. selaku Ketua Program Studi Biologi, Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif Hidayatullah Jakarta.
3. Narti Fitriana, M.Si. selaku Sekertaris Program Studi Biologi, Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif Hidayatullah Jakarta.
4. Dr. Nani Radiastuti, M.Si. selaku Dosen pembimbing I serta Dr. Dwi Ningsih Susilowati, S.TP., M.Si. selaku Dosen Pembimbing II.
5. Dr. Megga Ratnasari Pikoli, M.Si., Reno Fitri, M.Si., dan Arina Findo Sari, M.Si. selaku Dosen Penguji Seminar Proposal dan Hasil Penelitian.
6. Narti Fitriana, M. Si., dan Etyn Yunita, M.Si. selaku Dosen Penguji Sidang Skripsi
7. Kedua orang tua Bapak Iwan Bisri dan Ibu Taty Kuraesin yang selalu memberikan dukungan baik berupa moril maupun materil.
8. Bapak Jajang dan Ibu Aminah selaku keluarga BB-Biogen yang telah membantu dalam proses penelitian.
9. Semua pihak yang telah membantu penulis dalam menyelesaikan penulisan skripsi yang tidak dapat disebutkan satu persatu.
Jakarta, Agustus 2021 Penulis
vii
DAFTAR ISI
Halaman LEMBAR PENGESAHAN ... i ABSTRAK ... iv KATA PENGANTAR ... viDAFTAR ISI ... vii
DAFTAR TABEL ... ix DAFTAR GAMBAR ... x DAFTAR LAMPIRAN ... xi BAB I PENDAHULUAN 1.1. Latar Belakang ... 1 1.2. Rumusan Masalah ... 3 1.3. Hipotesis ... 3 1.4. Tujuan ... 4 1.5. Manfaat ... 4 1.6. Kerangka Berpikir ... 5
BAB II TINJAUAN PUSTAKA 2.1. Potensi dan Karakteristik Lahan Rawa di Kalimantan dan Sumatra ... 6
2.2. Lahan Rawa Pasang Surut dan Lahan Rawa Lebak ... 7
2.3. Bakteri Lahan Rawa ... 8
2.4. Potensi Bakteri dalam Sektor Pertanian ... 9
2.5. Identifikasi Komunitas Bakteri ... 10
2.6. Shotgun Metagenomic Sequencing ... 11
BAB III METODE PENELITIAN 3.1. Waktu dan Tempat ... 14
3.2. Alat dan Bahan ... 14
3.3. Cara Kerja ... 14
3.3.1. Pengambilan Sampel Tanah ... 15
3.3.2. Analisis Sifat Fisik dan Kimia Tanah ... 15
3.3.3. Isolasi dan Purifikasi Bakteri ... 16
3.3.4. Uji Gram KOH ... 16
3.3.5. Identifikasi Bakteri Secara Molekuler dengan Teknik Pengkulturan ... 16
3.3.6. Uji Potensi Bakteri Penghasil AIA ... 19
3.3.7. Uji Potensi Bakteri Penghasil Siderofor ... 19
3.3.8. Uji Potensi Bakteri Penghasil ACC Deaminase ... 21
3.3.9. Identifikasi Komunitas Bakteri Secara Molekuler dengan Teknik Nonpengkulturan ... 22
3.4. Analisis Data ... 22
viii
4.1. Hasil Identifikasi Bakteri Secara Molekuler dengan Teknik
Pengkulturan ... 23
4.2. Hasil Uji Potensi Bakteri dalam Sektor Pertanian ... 24
4.2.1. Hasil Uji Bakteri Penghasil Hormon AIA ... 24
4.2.2. Hasil Uji Bakteri Penghasil Bakteri Siderofor ... 26
4.2.3. Hasil Uji Bakteri Penghasil ACC Deaminase ... 28
4.3. Keanekaragaman Bakteri Lahan Rawa Pasang Surut Kalimantan Selatan dan Lahan Rawa Lebak Sumatra Selatan ... 30
4.4. Hasil Data Pendukung Sifat Fisik dan Kimia Tanah ... 34
BAB V KESIMPULAN DAN SARAN 5.1. KESIMPULAN ... 39
5.2. SARAN ... 39
DAFTAR PUSTAKA ... 40
ix
DAFTAR TABEL
Halaman Tabel 1. Perkiraan luas lahan rawa di Indonesia (BBSDLP, 2015) ... 7 Tabel 2. Lokasi pengambilan sampel tanah lahan rawa ... 15 Tabel 3. Analisis homologi sekuen gen 16S rRNA isolat bakteri culturable
menggunakan program Blast-N ... 23 Tabel 4. Skrining bakteri penghasil siderofor pada media Fe-CAS agar ... 26 Tabel 5. Skrining bakteri penghasil ACC Deaminase pada media DF dan DF
yang dimodifikasi... 29 Tabel 6. Jenis bakteri potensial pada lahan rawa pasang surut KS dan lahan
rawa lebak SS dengan teknik nonpengkulturan ... 33 Tabel 7. Sifat fisik tanah lahan rawa pasang surut Kalimantan Selatan (KS) dan
lahan rawa lebak Sumatra Selatan (SS) ... 35 Tabel 8. Sifat kimia tanah lahan rawa pasang surut Kalimantan Selatan (KS)
x
DAFTAR GAMBAR
Halaman Gambar 1. Kerangka berpikir penelitian keanekaragaman dan potensi bakteri
lahan rawa pasang surut Kalimantan Selatan (KS) dan lahan rawa lebak Sumatra Selatan (SS) ... 5 Gambar 2. Konsentrasi hormon AIA yang dihasilkan oleh 11 isolat bakteri
lahan rawa pasang surut KS dan lahan rawa lebak SS ... 25 Gambar 3. Pertumbuhan isolat bakteri penghasil siderofor pada media Fe-CAS
agar. A. Isolat bakteri penghasil siderofor ditandai dengan koloni berwarna oranye ... 27 Gambar 4. Pertumbuhan bakteri penghasil ACC Deaminase. A. Pertumbuhan
bakteri di media DF; B. Pertumbuhan bakteri di media DF +
amonium sulfat; C. Pertumbuhan bakteri di media DF + ACC ... 30 Gambar 5. Komposisi filum komunitas bakteri lahan rawa pasang surut KS dan
xi
DAFTAR LAMPIRAN
Halaman Lampiran 1. Diagram segitiga tekstur tanah (Soil Survey Staff, 2014). ... 55 Lampiran 2. Kriteria analisis sifat kimia tanah (Eviati & Sulaeman, 2009). ... 55 Lampiran 3. Perhitungan konversi KTK ... 56 Lampiran 4. Reaksi perubahan warna isolat bakteri pada media garam minimal
setelah ditambahkan pereaksi Salkowski ... 57 Lampiran 5. Kurva larutan standar AIA ... 57 Lampiran 6. Keseluruhan filum, kelas, famili, dan genus serta jenis bakteri
lahan rawa pasang surut Kalimatan Selatan (KS) ... 59 Lampiran 7. Keseluruhan filum, kelas, famili, dan genus serta jenis bakteri
1
BAB I
PENDAHULUAN
1.1. Latar Belakang
Lahan rawa merupakan lahan di daratan yang mengalami genangan air secara terus menerus atau pada waktu tertentu akibat memiliki sistem drainase kurang baik (Haryono et al., 2013; Suwanda & Noor, 2014). Luas lahan rawa di Indonesia mencapai ± 34,93 juta hektar (ha), seluas ± 12,9 juta ha lahan rawa terdapat di Sumatra dan luas lahan rawa di Kalimantan mencapai ± 10 juta ha (Balai Besar Sumber Daya Lahan Pertanian (BBSDLP), 2015). Lahan rawa di Kalimantan dan Sumatra memiliki potensi untuk dikembangkan pada sektor pertanian, perikanan, dan kehutanan (Suryana, 2016). Jenis lahan rawa yang berpotensi untuk dijadikan pertanian yaitu lahan rawa pasang surut dan lahan rawa lebak (Gazali & Fathurrahman, 2019). Lahan rawa pasang surut ketersediaan airnya dipengaruhi oleh pasang surut air laut dan sungai yang ada di sekitarnya, sedangkan lahan rawa lebak ketersediaan airnya dipengaruhi oleh air hujan dan sungai yang ada di sekitarnya (Ar-Riza & Alkasuma, 2008; Haryono et al., 2013; Susilawati et al., 2016). Lahan rawa pasang surut dan lebak dapat dijumpai di Kalimantan Selatan dan Sumatra Selatan. Lahan rawa pasang surut dan lebak memiliki topografi lahan yang relatif datar dan ketersediaan air yang memadai sehingga cocok untuk dijadikan lahan pertanian (Suwanda & Noor, 2014).
Lahan rawa pasang surut dan lebak merupakan sumber daya lahan yang belum dimanfaatkan secara optimal karena kondisi lahan rawa sangat rentan dengan perubahan iklim yang tidak menentu serta banyaknya gangguan hama (Haryono et al., 2013). Selain itu, nilai produktivitas tanah lahan rawa sangat rendah karena tanah di lahan rawa banyak mengandung unsur logam berat seperti Al, Mn, Zn, dan Cu (Ar-Riza et al., 2015). Unsur logam berat yang teroksidasi di lahan rawa dapat mengikat unsur hara Fosfor (P) dan Kalium (K) yang sangat penting bagi tumbuhan (Suastika et al., 2014). Oleh karena itu, dalam memanfaatkan lahan rawa untuk dijadikan lahan pertanian diperlukan teknologi yang tepat guna menjadikan lahan tersebut menjadi lahan produktif (Hanafiah & Sembiring, 2018). Berbagai teknologi pemanfaatan lahan rawa dapat dilakukan
seperti: 1) pengolahan tanah dan air; 2) pengendalian gulma; 3) penggunaan varietas adaptif; serta 4) ameliorasi tanah dan pemupukan (Suriadikarta, 2012). Inovasi teknologi pemanfaatan tanah lahan rawa terutama pemupukan dalam sektor pertanian dapat dilakukan dengan mengidentifikasi keanekaragaman komunitas bakteri indigenous pada lahan tersebut (Susilawati et al., 2017). Perbedaan jenis tanah dari kedua tipe lahan rawa akan memengaruhi struktur komunitas bakteri yang ada di lingkungannya (Kesaulya et al., 2015). Menurut Tasma (2015), identifikasi dan analisis keanekaragaman bakteri indigenous dapat dilakukan untuk mengetahui produktivitas lahan terutama dalam sektor pertanian dan pemuliaan tanaman. Keberadaan bakteri indigenous sebagai agen dekomposisi sangat erat kaitannya dengan sifat fisik-kimia seperti tekstur tanah, kadar pH, C organik, serta rasio C/N pada tanah (Hao-Zhi et al., 2015).
Bakteri indigenous berperan penting dalam proses biogeokimia tanah, seperti siklus karbon, penambat nitrogen, penghasil siderofor serta agen pengendali cekaman salinitas tinggi dengan menghasilkan enzim 1-aminosiklopropana-1-karboksilat (ACC) Deaminase (Ali et al., 2012; Too et al., 2018). Upadhyay et al. (2018), menyatakan bakteri berperan penting di suatu lahan karena bakteri mampu menghasilkan zat-zat perangsang pertumbuhan seperti hormon Asam Indol Asetat (AIA), serta menyediakan dan memperbaiki unsur hara tanah. Bakteri juga dapat berperan sebagai biopestisida alami karena sifat antagonis dan kompetitif dalam pemanfaatan nutrisi yang ada di lingkungannya (Hanudin & Marwoto, 2012). Schloter et al. (2018), menyatakan bakteri indigenous dapat dijadikan indikator kesuburan tanah, semakin tinggi jumlah dan jenis bakteri maka semakin baik kesuburan tanah di suatu lahan. Hal ini dikarenakan kelimpahan biomassa bakteri berperan sebagai agen pembentuk hara di dalam tanah yang dimanfaatkan tanaman dan berperan penting untuk memelihara kesuburan tanah (Susilawati et al., 2013). Menurut Suriadikarta & Sutriadi (2007), potensi bakteri pembentuk unsur hara dapat diketahui melalui beberapa uji, seperti uji potensi bakteri penghasil AIA yang berperan penting dalam pertumbuhan tanaman, uji potensi bakteri siderofor yang berperan sebagai pengikat senyawa besi, dan uji potensi bakteri ACC Deaminase sebagai enzim pengatur produksi ACC yang berperan penting dalam cekaman salinitas (A’ini, 2015; Marten et al., 2018).
Penelitian oleh Mahdiyah (2015), diperoleh 5 isolat bakteri dari lahan rawa gambut yang berpotensi menghasilkan enzim protease. Hasil penelitian terbatas pada jenis isolat bakteri yang tidak teridentifikasi. Oleh karena itu perlu dilakukan analisis lebih lanjut mengenai identifikasi serta potensi bakteri terutama dalam sektor pertanian. Salah satunya dengan menggunakan shotgun metagenomic sequencing. Shotgun metagenomic sequencing merupakan analisis secara molekuler untuk mempelajari keanekaragaman jenis bakteri yang dapat dikulturkan (culturable) maupun tidak dapat dikulturkan (nonculturable) berdasarkan ekstraksi Deoxyribonucleic Acid (DNA) total komunitas dari sampel tertentu, tanpa harus mengisolasi dan mengkulturkan jenis individu sebelumnya (Sharpton, 2014; Too et al., 2018). Analisis keanekaragaman bakteri secara molekuler diharapkan dapat mengidentifikasi bakteri potensial lahan rawa Kalimantan Selatan dan Sumatra Selatan serta uji potensi bakteri yang dilakukan dapat dijadikan informasi dalam mengoptimalkan peran bakteri sebagai strategi pengelolaan lahan rawa untuk peningkatan produktivitas pertanian.
1.2. Rumusan Masalah
1. Apakah terdapat perbedaan komunitas bakteri dari lahan rawa pasang surut Kalimantan Selatan (KS) dan lahan rawa lebak Sumatra Selatan (SS) menggunakan teknik pengkulturan dan nonpengkulturan dengan shotgun metagenomic sequencing?
2. Bagaimana pengaruh potensi bakteri tanah dari lahan rawa pasang surut (KS) dan lahan rawa lebak (SS) terhadap kesuburan kedua lahan rawa berdasarkan hasil uji potensi bakteri penghasil AIA, siderofor, dan ACC Deaminase?
1.3. Hipotesis
1. Terdapat perbedaan komunitas bakteri pada lahan rawa pasang surut (KS) dan lahan rawa lebak (SS) berdasarkan teknik pengkulturan dan nonpengkulturan.
2. Potensi bakteri lahan rawa dalam menghasilkan hormon AIA, siderofor, dan ACC Deaminase dapat meningkatkan kesuburan pada kedua lahan rawa.
1.4. Tujuan
Menganalisis jenis dan potensi bakteri dari lahan rawa pasang surut KS dan lahan rawa lebak SS yang berperan penting untuk meningkatkan kesuburan lahan rawa untuk sektor pertanian.
1.5. Manfaat
Memberikan informasi mengenai hubungan keanekaragaman serta potensi bakteri dari ekosistem lahan rawa dengan aktivitas atau fungsi tanah yang dapat digunakan untuk menilai status kesuburan tanah. Adanya informasi tersebut diharapkan dapat dilakukan penelitian lanjutan yang mempelajari optimasi fungsi tanah lahan rawa untuk peningkatan produksi pertanian.
1.6. Kerangka Berpikir
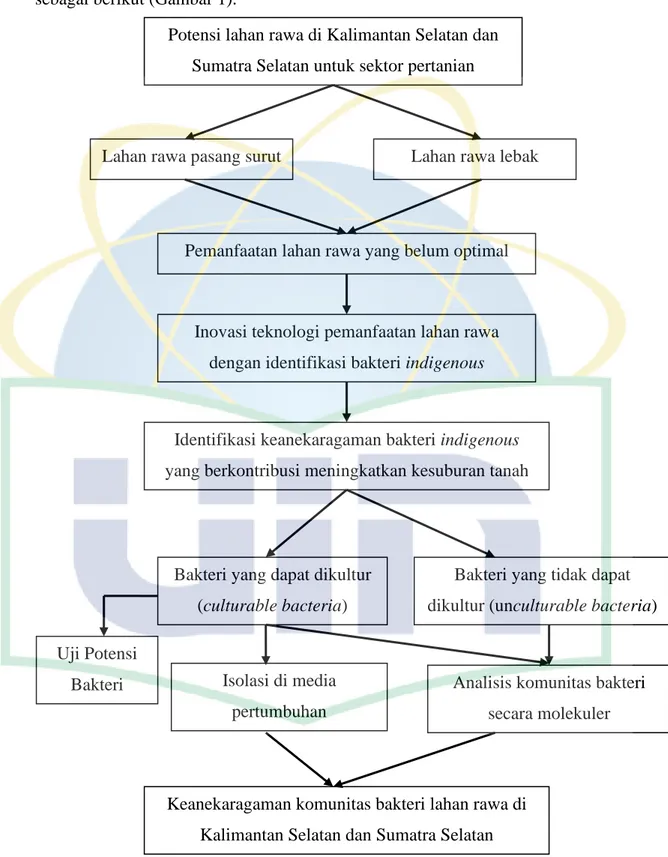
Kerangka berpikir yang menjadi landasan dilakukannya penelitian ini adalah sebagai berikut (Gambar 1).
Gambar 1. Kerangka berpikir penelitian keanekaragaman dan potensi bakteri
lahan rawa pasang surut Kalimantan Selatan (KS) dan lahan rawa lebak Sumatra Selatan (SS)
Potensi lahan rawa di Kalimantan Selatan dan Sumatra Selatan untuk sektor pertanian
Lahan rawa pasang surut Lahan rawa lebak
Pemanfaatan lahan rawa yang belum optimal
Inovasi teknologi pemanfaatan lahan rawa dengan identifikasi bakteri indigenous
Identifikasi keanekaragaman bakteri indigenous yang berkontribusi meningkatkan kesuburan tanah
Bakteri yang dapat dikultur (culturable bacteria)
Bakteri yang tidak dapat dikultur (unculturable bacteria)
Isolasi di media pertumbuhan
Analisis komunitas bakteri secara molekuler
Keanekaragaman komunitas bakteri lahan rawa di Kalimantan Selatan dan Sumatra Selatan Uji Potensi
6
BAB II
TINJAUAN PUSTAKA
2.1. Potensi dan Karakteristik Lahan Rawa di Kalimantan dan Sumatra
Lahan rawa merupakan lahan alami yang mengalami genangan secara terus menerus atau dimusim tertentu akibat sistem drainase yang buruk (Suriadikarta, 2012). Lahan rawa memiliki karakteristik khusus terutama karena sistem perairan dan ekosistemnya, sehingga memiliki potensi untuk dikembangkan sebagai lahan pertanian, kehutanan, sumber air, serta konservasi lahan (Gazali & Fathurrahman, 2019). Lahan rawa memiliki ekosistem terdiri dari komunitas tumbuhan yang telah beradaptasi dengan lingkungan rawa itu sendiri (Yusuf & Purwaningsih, 2009). Menurut Aziz et al. (2020), pada ekosistem rawa umumnya ditemukan tumbuhan yang memiliki akar lutut dengan tunas berongga, serta memiliki tajuk berlapis seperti Pulai (Alstonia sp.), Butun (Barringtonia sp.), Bonsai (Ficus retusa), Simpur air (Dillenia sp.), Jelutung (Dyera sp.), dan Pandan wangi (Pandanus sp.)
Lahan rawa dapat ditemukan di pulau Kalimantan. Kalimantan merupakan pulau terluas di Indonesia dengan luas keseluruhan 743.330 km2. Pulau Kalimantan diduduki oleh beberapa negara seperti Indonesia, Malaysia, dan Brunei Darussalam. Luas pulau Kalimantan untuk wilayah Indonesia sebesar 545.150 km2 (73% dari total luas pulau Kalimantan) yang terbagi menjadi 5 provinsi salah satunya Kalimantan Selatan (Sosilowati et al., 2017). Luas lahan rawa di Kalimantan tercatat ±10 juta ha yang terbagi menjadi 2,3 juta ha lahan rawa pasang surut, dan 2,9 juta ha lahan rawa lebak (BBSDLP, 2015).
Pulau terluas kedua di Indonesia yaitu Sumatra dengan luas total 473.481 km2. Pulau Sumatra dibagi menjadi 10 provinsi besar salah satunya Sumatra Selatan (Sosilowati et al., 2017). Luas lahan rawa di Sumatra tercatat ± 12,9 juta ha yang terbagi menjadi 2,5 juta ha lahan rawa pasang surut, dan 3,9 juta ha lahan rawa lebak (BBSDLP, 2015). Luas lahan rawa di Indonesia diketahui mencapai ± 34,9 juta ha berdasarkan data kompilasi peta rawa yang dilakukan Balai Besar Sumberdaya Lahan Pertanian (BBSDLP) tahun 2015 (Tabel 1).
Tabel 1. Perkiraan luas lahan rawa di Indonesia (BBSDLP, 2015)
Pulau Rawa Pasang Surut
(ha) Rawa Lebak (ha) Sumatra 2.501.888 3.988.301 Jawa 896.122 0 Kalimantan 2.301.410 2.944.085 Sulawesi 318.030 706.220 Maluku 74.395 88.159 Papua 2.262.402 3.916.123 Indonesia 8.354.247 11.642.288
Menurut Suryana (2016), lahan rawa di Kalimantan tersebar di dataran rendah di sepanjang pantai selatan Kalimantan Selatan dengan luas lahan rawa ± 300 ribu ha (Badan Pusat Statistik Provinsi Kalimantan Selatan (BPSPKS), 2014), sedangkan lahan rawa di Sumatra terdapat di pantai Timur provinsi Sumatra Selatan dengan luas ± 500 ribu ha (Badan Pusat Statistik Provinsi Sumatra Selatan (BPSPSS), 2016).
Lahan rawa di Kalimantan Selatan biasa dimanfaaatkan untuk sektor pertanian, peternakan, perkebunan, dan perikanan (Sugiartanti & Sarah, 2020). Lahan rawa di Sumatra Selatan memiliki potensi untuk dijadikan lahan pertanian karena provinsi Sumatra Selatan memiliki kekayaan sumber daya genetik yang melimpah terutama padi (Kodir et al., 2016).
2.2. Lahan Rawa Pasang Surut dan Lahan Rawa Lebak
Lahan rawa dapat dibedakan menjadi lahan rawa pasang surut, lahan rawa lebak dan lahan rawa gambut berdasarkan sumber ketersediaan airnya. Lahan rawa pasang surut merupakan lahan rawa yang ketersediaan airnya dipengaruhi oleh pasang surut air laut dan sungai yang ada di sekitarnya (Susilawati et al., 2016). Terdapat 4 tipe lahan rawa pasang surut berdasarkan jangkauan airnya, yaitu lahan rawa pasang surut tipe A, B, C, dan D (Sawiyo et al., 2000; Sudana, 2005). Tipe A merupakan lahan yang selalu tergenang air saat musim panas maupun musim hujan, tipe B merupakan lahan yang tergenang air saat musim hujan, sedangkan tipe C merupakan lahan yang tidak pernah tergenang air, namun dipengaruhi secara tidak langsung dengan kedalaman air tanah dari permukaan tanah dengan tinggi kurang dari 50 cm, tipe D merupakan lahan yang tidak pernah
terluapi air dan air tanahnya memiliki kedalaman lebih dalam dari 50 cm (Sudana, 2005; Suryana, 2016).
Lahan rawa lebak merupakan lahan rawa yang dipengaruhi oleh lamanya waktu genangan air lebih dari 3 bulan dan tinggi genangan mencapai lebih dari 50 cm (Haryono et al., 2013; Pujiharti, 2017). Genangan air di lahan rawa lebak dipengaruhi luapan air dari sungai dan air hujan (Syahputra & Inan, 2019). Lahan rawa lebak dibagi menjadi 3 berdasarkan lama genangan dan ketinggian air, diantaranya lahan lebak dangkal lama waktu genangan kurang dari 3 bulan dengan tinggi genangan kurang dari 50 cm, lahan lebak tengahan lama waktu genangan kurang dari 6 bulan dengan tinggi genangan 50-100 cm, sedangkan lahan lebak tinggi memiliki tinggi genangan lebih dari 100 cm dengan lama waktu genangan lebih dari 6 bulan (Pujiharti, 2017).
Lahan rawa pasang surut dan lebak memiliki beberapa kendala dalam pemanfaatanya seperti kesuburan tanah yang rendah karena memiliki pH masam (Noor, 2010). Namun, berpotensi untuk dijadikan lahan pertanian karena memiliki ketersediaan air yang cukup dan tipologi lahan yang relatif datar (Waluyo et al., 2008). Potensi lahan rawa dalam hal produktivitas dapat diketahui dengan dilakukannya identifikasi bakteri tanah sebagai bakteri indigenous di dalamnya. Menurut Too et al. (2018), bakteri indigenous berperan penting di lahan habitat aslinya.
2.3. Bakteri Lahan Rawa
Bakteri merupakan mikroorganisme yang hidup berkoloni, bersel tunggal dan tidak memiliki selubung inti namun dapat hidup saja baik di benda hidup maupun mati seperti tanah di lahan rawa sekalipun (Yu et al., 2015). Kelimpahan bakteri lahan rawa memiliki peran penting terutama dalam siklus biogeokimia tanah. Penelitian Moulia et al. (2019) mengenai analisis keanekaragaman bakteri lahan rawa sulfat masam di Kalimantan Selatan dan Kalimantan Tengah diperoleh 10 filum bakteri yang teridentifikasi diantaranya Proteobacteria, Acidobacteria, Actinobacteria, Bacteroidetes, Chloroflexi, Spirochaetes, Nitrospirae, Chlorobi, Fimicutes, dan Ignavibacteriae. Too et al. (2018), memperoleh filum bakteri yang teridentifikasi dari lahan rawa gambut di Malaysia diantaranya, Proteobacteria,
Acidobacteria, Verrucomicrobia, Planctomycetes, Bacteroidetes, Actinobacteria, dan Nitrospirae. Zhang et al. (2020), melaporkan 8 filum memiliki kelimpahan relatif lebih dari 1% yang diisolasi dari lahan rawa di sungai Songhua, China diantaranya Proteobacteria, Actinobacteria, Acidobacteria, Chloroflexi, Bacteroidetes, Verrucomicrobia, Firmicutes, dan Gemmatimonadetes yang berperan dalam metabolisme unsur hara di dalam tanah rawa. Penelitian Mahdiyah (2015), memperoleh 5 isolat dari lahan rawa gambut penghasil enzim protease. Sebanyak 3 isolat bakteri dari lahan rawa di Indralaya, Sumatra Selatan juga teridentifikasi berpotensi menghasilkan enzim protease (Baehaki et al., 2011).
2.4. Potensi Bakteri dalam Sektor Pertanian
Potensi bakteri pada sektor pertanian diantaranya mampu menghasilkan hormon AIA (A’ini, 2015; Sukmadewi et al., 2015), siderofor (Prihatiningsih et al., 2017; Marten et al., 2018), dan ACC Deaminase (Raka et al., 2012). Hormon AIA merupakan hormon yang berperan penting dalam pertumbuhan fisiologis tanaman (Kholida & Zulaika, 2015). Jenis bakteri tertentu mampu menyintesis hormon AIA yang dapat memengaruhi pertumbuhan tanaman dengan memacu pertumbuhan, pembelahan sel serta inisasi akar pada tanaman tersebut (Kesaulya et al., 2015; Wulandari et al., 2019). Sintesis hormon AIA oleh bakteri dapat dipicu karena adanya prekursor berupa L-Tryptophan (Kholida & Zulaika, 2015). L-Tryptophan merupakan eksudat alami berupa asam amino aromatik yang dapat ditemukan pada akar yang telah mati atau membusuk di dalam tanah (Kholida & Zulaika, 2015; Larosa et al., 2013).
Pemanfaatan bakteri penghasil hormon AIA dapat diaplikasikan dalam pertanian terutama dalam pembuatan pupuk organik (A’ini, 2015). 5 isolat bakteri teridentifikasi sebagai Pseudomonas diminuta mampu melarutkan fosfat serta menyintesis hormon AIA untuk memacu pertumbuhan tanaman kedelai (Glycine max) (Sudarmini et al., 2018). Sebanyak 21 isolat bakteri yang diisolasi dari tegakan hutan rakyat Suren dan teridentifikasi sebagai Bacillus, Clostridium, Coryneform, serta Erwinia mampu memproduksi hormon AIA (Firdausi, 2018). Lestari et al. (2015), juga melaporkan 3 isolat bakteri jenis Bacillus aryabhattai,
Bacillus cibi, dan Bacillus marisflavi mampu menyintesis hormon AIA untuk meningkatkan perkecambahan benih padi.
Potensi lainnya yaitu dengan menghasilkan siderofor. Siderofor merupakan senyawa organik dengan berat molekul rendah yang dapat mengikat besi (Fe3+), senyawa ini meningkatkan responsifitas sel bakteri untuk menyerap nutrisi (Sharma & Johri, 2003). Siderofor disintesis oleh bakteri, jamur, dan tumbuhan pada lingkungan yang miskin unsur besi (Wittenwiller, 2007; Husen et al., 2008). Bakteri penghasil siderofor bermanfaat dalam sektor pertanian karena dapat menekan pertumbuhan mikroorganisme patogen yang dapat menyerang tanaman (Prihatiningsih et al., 2017). Pseudomonas fluoresen merupakan salah satu bakteri penghasil siderofor yang berpotensi untuk dikembangkan sebagai penginduksi ketahanan tanaman (Pratama et al., 2018). Genus Bacillus juga berpotensi sebagai agen penghasil siderofor dan bioremoval unsur Fe (Farisna, 2015). Enterobacter sp. dan Micrococcus sp. juga berhasil diisolasi dari tanaman padi sebagai bakteri siderofor (A’laa, 2015).
Potensi bakteri selanjutnya yaitu dengan menghasilkan enzim ACC Deaminase. ACC merupakan prekursor hormon gas etilen yang berperan penting terhadap pertumbuhan fisiologis tanaman terutama pada proses pematangan buah (Husen, 2011). Dalam kondisi lingkungan yang normal, gas etilen yang diproduksi memberikan efek menguntungkan pada pertumbuhan dan perkembangan tanaman. Namun, dalam kondisi cekaman lingkungan tanaman cenderung memproduksi gas etilen secara berlebihan yang mengakibatkan penghambatan proses perkecambahan dan pertumbuhan akar (Husen, 2011; Ali et al., 2012). Bakteri penghasil ACC Deaminase berperan penting dalam sektor pertanian karena dapat menghidrolisis produksi ACC berlebihan pada kondisi cekaman lingkungan terutama cekaman kekeringan (Shrivastava & Kumar, 2015)
2.5. Identifikasi Komunitas Bakteri
Identifikasi komunitas bakteri dapat dilakukan secara konvensional dan molekuler. Identifikasi bakteri secara molekuler melibatkan amplifikasi DNA dengan bantuan teknik Polymerase Chain Reaction (PCR) kemudian amplikon hasil PCR diurutkan dan dikomputasi untuk dikarakterisasi secara bioinfomatis,
sehingga dapat ditentukan jenis bakteri apa yang ditemukan (Goss-Souza et al., 2017). Cara kedua analisis komunitas bakteri yaitu secara konvensional dengan menumbuhkan bakteri di media pertumbuhan kemudian diamati morfologi serta dilakukan uji biokimia untuk mengetahui sifat-sifat fisiologis dari bakteri tersebut (Rahayu & Gumilar, 2017). Analisis bakteri secara konvensional dinilai kurang akurat dibandingkan dengan identifikasi bakteri secara molekuler.
Identifikasi bakteri konvensional dianggap kurang efisien dalam segi tenaga dan waktu karena uji setiap bakteri harus diamati melalui beberapa uji biokimia untuk mengetahui sifat fisiologis dan beberapa reaksi yang terjadi terhadap zat pewarna (Setiawan et al., 2017). Menurut Ochman & Santos (2005), identifikasi bakteri secara biokimia merupakan identifikasi karakter fisik yang bersifat tidak statis dan berubah karena adanya evolusi atau mutasi yang dapat memengaruhi hasil identifikasi. Beberapa jenis bakteri sulit ditumbuhkan di dalam media karena harus beradaptasi di lingkungan yang sangat berbeda dari lingkungan aslinya (Kuczynski et al., 2011).
Seiring dengan kemajuan dalam bidang bioteknologi komputasi, teknik sequencing dapat digunakan untuk mempelajari struktur komunitas bakteri yang tidak dapat dikulturkan di laboratorium (Goss-Souza et al., 2017). Teknik sequencing melibatkan pengurutan amplikon untuk mengkarakterisasi keanekaragaman mikroorganisme. Bakteri hasil isolasi kemudian DNAnya diektraksi lalu penanda informasi taksonomi yang menarik dan umum hampir ditemukan di semua organisme ditargetkan, setelah itu diperkuat dengan PCR. Analisis bakteri menggunakan studi sequencing biasanya menargetkan lokus 16s rRNA yang merupakan penanda informatif taksonomi dan filogenetik (Langille et al., 2013).
2.6. Shotgun Metagenomic Sequencing
Sequencing DNA bertujuan untuk menentukan urutan basa nitrogen yang ada di dalam suatu sampel DNA. Pendeketan sequencing DNA dalam penerapannya dapat digunakan untuk mengidentifikasi, mendiagnosis, dan mengembangkan pengobatan penyakit genetik (Tasma, 2015). Pendekatan sequencing yang biasa digunakan yaitu Sanger dan Next Generation Sequensing (NGS).
Pendekatan NGS dapat membaca cetakan DNA secara acak sepanjang seluruh genom dengan membuat potongan-potongan pendek DNA genom, kemudian menyambungkannya dengan potongan DNA pendek yang didesain khusus agar dapat dibaca oleh mesin NGS secara random selama proses sintesis DNA (Mardis, 2008). Panjang bacaan sekuen DNA yang dihasilkan mesin NGS lebih pendek dibandingkan menggunakan pendekatan Sanger. NGS menghasilkan panjang sekuen DNA antara 50-500 bp (Morganti et al., 2019). Karena sekuen yang dihasilkan NGS pendek, sequencing setiap fragmen DNA harus dilakukan berulang, hal ini bertujuan mendapatkan akurasi data hasil sequencing yang akurat (Mardis, 2008). Oleh karena itu teknologi NGS sering disebut dengan sequencing paralel secara masif (massively parallel sequencing) (Shendure et al., 2017). Salah satu pendekatan NGS adalah shotgun metagenomic sequencing.
Shotgun metagenomic sequencing terdiri dari sequencing DNA yang diisolasi dari seluruh komunitas mikroba. Pembacaan sequencing yang diperoleh kemudian dianalisis menggunakan basis data metagenomic sebagai referensi yang bertujuan untuk menetapkan pembacaan sequencing ke takson tertentu (Truong et al., 2015). Shotgun metagenomic sequencing memungkinkan analisis yang lebih akurat di tingkat jenis, sehingga menghasilkan deskripsi rinci tentang komunitas bakteri yang diidentifikasi. Hal ini dikarenakan pendekatan shotgun metagenomic sequencing menggunakan cakupan yang lebih tinggi (10-30 juta pembacaan) dan analisis data yang lebih kompleks (Laudadio et al., 2018).
Shotgun metagenomic sequencing dapat diterapkan untuk analisis struktur komunitas dalam sampel yang lebih banyak dengan hasil yang lebih akurat dibandingkan dengan pendekatan pengurutan amplikon 16s rDNA. Pengurutan amplikon 16s rDNA memiliki beberapa kelemahan diantaranya data hasil PCR yang bias (Logares et al., 2014), pengurutan amplikon dapat menghasilkan data keanekaragaman yang bervariasi yang terkadang dapat menghasilkan urutan pasang basa DNA yang seringkali sulit untuk diidentifikasi (Wylie et al., 2012). Shotgun metagenomic sequencing digunakan untuk menutupi kekurangan dari pendekatan pengurutan amplikon serta mikroba yang tidak dapat dikulturkan. Shotgun metagenomic sequencing dilakukan dengan mengekstraksi DNA lagi dari semua sel dalam komunitas. Semua DNA selanjutnya dipotong menjadi
fragmen kecil yang diurutkan secara independen (Sharpton, 2014). Urutan data genom bacaan diambil sampelnya dari lokus genom yang informatif secara taksonomis dan sampel lainnya diambil dari urutan pengkodean yang memberikan wawasan tentang fungsi biologis yang dikodekan dalam genom (Laudadio et al., 2018).
Penelitian dengan shotgun metagenomic sequencing sebelumnya oleh Abraham et al. (2020), menganalisis 17 sampel tanah dari lahan rawa di margasatwa Loxahatchee Florida Everglades, ditemukan 3 filum bakteri terbanyak yaitu Actinobacteria, Acidobacteria, dan Proteobacteria. Penelitian oleh Wiseschart et al. (2019), menggunakan shotgun metagenomic sequencing untuk mengeksplorasi komposisi taksonomi dan potensi metabolisme bakteri dalam tanah dari gua Manao-Pee, Thailand. Hasil diperoleh Actinobacteria dan Gammaproteobacteria merupakan kelompok bakteri dominan di tanah gua.
14
BAB III
METODE PENELITIAN
3.1. Waktu dan Tempat
Penelitian ini dilakukan pada bulan Januari sampai Mei 2021. Penelitian dilakukan di Laboratorium Mikrobiologi Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetika Tanaman (BB Biogen), Jalan Tentara Pelajar 3A Bogor.
3.2. Alat dan Bahan
Alat yang digunakan pada penelitian ini terdiri dari neraca analitik (mettler), autoklaf, inkubator (memmert), Laminar Air Flow Cabinet (LAFC) (faithful CJ-2S), Freezer -20 °C, pH meter, sentrifus (Microfuge 22R Beckman CoulterTM), shaker, vortex, pipet mikro, tip pipet mikro (biru, kuning, putih), tube mikro (1,5 dan 2 mL), thermalcycler (Swift Maxi R-ESCO), tube PCR, alat elektroforesis (Mupid-EXU Sub Marine Electrophoresis System), UV transiluminator, dan spektrofotometer (Shimazdu).
Bahan yang digunakan pada penelitian ini terdiri dari sampel tanah dari lahan rawa pasang surut di Kalimantan Selatan dan lahan rawa lebak di Sumatra Selatan. Media Nutrient Agar (NA), media Nutrient Broth (NB), akuades, Natrium klorida (NaCl) fisiologis 0,85%, Alkohol 70 dan 96%, larutan HCl 0,1 N, larutan NaOH 0,1 N, buffer Tris-Acetat EDTA (TAE) 1x, kit purifikasi genomik DNA Wizard® (Promega), Go Taq® Green Master Mix, Nuclease Free Water (NFW), 6x loading dye, DNA ladder 100 bp, primer 63f (5’ CAG GCC TAA CAC ATG CAA GTC 3’), primer 1387r (5’ GGG CGG WGT GTA CAA GGC 3’), agarosa, gel red nucleic acid, lysozyme, isopropanol, RNAase solution, media Fe-Chrome Azurol Sulfate (Fe-CAS), larutan standar AIA, media garam minimal, larutan L-Tryptophan, larutan trace element, dan pereaksi Salkowski.
3.3. Cara Kerja
Tahapan dalam penelitian ini meliputi preparasi alat dan bahan; pengambilan sampel tanah; isolasi dan purifikasi bakteri tanah; identifikasi bakteri secara
molekuler dengan teknik pengkulturan; uji potensi bakteri penghasil AIA; penghasil siderofor; penghasil ACC Deaminase; dan identifikasi bakteri nonpengkulturan menggunakan shotgun metagenomic sequencing.
3.3.1. Pengambilan Sampel Tanah
Sampel tanah lahan rawa Kalimantan Selatan dan Sumatra Selatan didapatkan dari laboratorium mineralogi, BBSDLP Bogor. Pengambilan sampel tanah diambil secara acak (simple random sampling) dari lahan rawa di dua lokasi yang berbeda (Tabel 2). Sampel tanah lahan rawa dari Kalimantan Selatan dan Sumatra Selatan diambil pada akhir tahun 2019 dengan kedalaman masing-masing ± 20 cm. Pengambilan sampel tanah dari kedua lokasi tersebut dilakukan oleh tim peneliti dari balai penelitian tanah.
Tabel 2. Lokasi pengambilan sampel tanah lahan rawa
Lokasi Tipe Lahan Rawa Koordinat Geografis Desa Jerapat Baru, Kec.
Tamban, Kab. Barito Kuala, Kalimantan Selatan
Rawa pasang surut 03° 14' 47.2" LS - 114° 30' 44.9" BT Poktan Harapan Baru, Desa
Tapus, Kec. Pampangan, Kab. Ogan Komering Ilir, Sumatra Selatan
Rawa lebak 03° 13' 00.0" LS - 104° 58' 23.2" BT
3.3.2. Analisis Sifat Fisik dan Kimia Tanah
Sampel tanah dari kedua lahan rawa dianalisis sifat fisik dan kimianya di laboratorium Pelayanan Jasa Balai Penelitian Tanah (Balittanah). Metode pengujian analisis sifat fisik dan kimia tanah merujuk pada metode yang dikeluarkan oleh Balittanah. Faktor yang dianalisis meliputi tekstur tanah, total C, total N, P2O5, K2O, pH, Kapasitas Tukar Kation (KTK), dan Kejenuhan Basa
(KB). Hasil analisis sifat fisik tanah kemudian diinterpretasikan dengan diagram segitiga tekstur tanah dalam buku kunci taksonomi tanah (Soil Survey Staff, 2014) (Lampiran 1), sedangkan hasil analisis kimia tanah diinterpretasikan dengan kriteria analisis sifat kimia tanah dalam buku petunjuk teknis analisis kimia tanah oleh (Eviati & Sulaeman, 2009) (Lampiran 2).
3.3.3. Isolasi dan Purifikasi Bakteri
Isolasi bakteri dilakukan di laboratorium mikrobiologi BB Biogen. Isolasi bakteri mengacu pada Husen et al. (2007). Sampel tanah lahan rawa ditimbang sebanyak 10 g lalu dimasukkan ke dalam 90 mL larutan NaCl fisiologis 0,85% (0,85 g NaCl dalam 1.000 mL akuades), lalu dikocok selama 30 menit sehingga diperoleh pengenceran 10-1. Selanjutnya dibuat seri pengenceran bertingkat sampai 10-5 dan sebanyak 100 µl hasil pengenceran 10-3 – 10-5 ditumbuhkan pada cawan petri yang berisi media NA (13 g Nutrient Broth; 25 g agar; akuades 1.000 mL) dengan metode spread plate. Kemudian media NA diinkubasi selama 3 hari pada suhu ruang. Koloni bakteri tunggal diisolasi dan dimurnikan kembali ke media NA yang baru, lalu diinkubasi pada suhu 30°C selama 24 jam. Koloni tunggal bakteri yang tumbuh di dalam cawan petri diamati secara makroskopis meliputi bentuk, elevasi, permukaan, margin dan warna. Koloni bakteri murni juga disimpan pada media NA miring untuk dilakukan aplikasi lebih lanjut yaitu uji potensi bakteri dan diidentifikasi secara molekuler.
3.3.4. Uji Gram KOH
Uji Gram KOH mengacu pada Anggraini et al. (2016). Uji Gram KOH dilakukan untuk uji praduga bakteri termasuk Gram positif atau negatif sebelum dilakukan isolasi DNA bakteri sehingga dapat disesuaikan dengan prosedur dari KIT yang digunakan dalam isolasi DNA. Uji Gram dilakukan dengan KOH 3%, 10 μL KOH ditetesi ke kaca objek kemudian diambil satu ose koloni bakteri dari media NA miring dan dicampurkan ke kaca objek. Terbentuknya lendir diamati dengan menarik ose secara perlahan. Isolat dinyatakan sebagai bakteri Gram negatif ditandai dengan terbentuknya lendir, sedangkan bakteri Gram positif ditandai dengan tidak terbentuknya lendir.
3.3.5. Identifikasi Bakteri Secara Molekuler dengan Teknik Pengkulturan 3.3.5.1. Isolasi DNA Bakteri
Isolasi DNA dari koloni bakteri yang berhasil dikulturkan (bakteri culturable) di media NA dilakukan sesuai dengan buku panduan Wizard Genomic DNA Purification Kit. Sebanyak 1 mL koloni bakteri yang sudah dishaker semalaman
di media NB kemudian dihomogenkan menggunakan sentrifus pada kecepatan 13.000 x g selama 5 menit, lalu supernatan dibuang. Setelah dihomogenkan menggunakan sentrifus. Pelet bakteri Gram positif hasil sentrifus sebelumnya ditambahkan 480 μL EDTA 50 mM. Kemudian pelet ditambahkan 120μL lysozyme. Selanjutnya, pelet diinkubasi pada suhu 37 °C selama 30 menit. Setelah diinkubasi, pelet dihomogenkan menggunakan sentrifus selama 2 menit pada kecepatan 13.000 x g. Supernatan dibuang. Langkah selanjutnya dilakukan tahap pelisisan sel.
Tahap pelisisan sel. Pelet koloni bakteri ditambahkan 600 μL nuclei lysis solution sambil diambil menggunakan pipet perlahan sampai tercampur. Kemudian pelet diinkubasi selama 5 menit pada suhu 80°C lalu didinginkan di suhu ruang. Pelet yang sudah diinkubasi ditambahkan 3 μL RNAase solution, lalu dihomogenkan. Selanjutnya, pelet diinkubasi kembali pada suhu 37°C selama 30 menit lalu dinginkan hingga suhu ruang. Setelah itu, dilakukan tahap presipitasi protein.
Tahap presipitasi protein. Pelet ditambahkan 200 μL protein presipitasi solution kemudian divortex. Selanjutnya pelet diinkubasi di dalam freezer 20 °C selama 5 menit. Pelet yang sudah diinkubasi, dihomogenkan menggunakan sentrifus selama 5 menit pada kecepatan 13.000 x g.
Tahap presipitasi dan rehidrasi DNA. Supernatan dipindahkan ke tube baru yang sudah ditambahkan 600 μL isopropanol lalu dihomogenkan. Supernatan yang sudah homogen dihomogenkan menggunakan sentrifus selama 5 menit pada kecepatan 13.000 x g. Supernatan yang sudah homogen kemudian ditambahkan 600 μL etanol 70%, dihomogenkan. Supernatan dihomogenkan menggunakan sentrifus kembali selama 3 menit pada kecepatan 13.000 x g. Etanol diuapkan dan pelet dikeringkan di udara selama 10 menit. Setelah kering, pelet DNA direhidrasi dengan 100μL rehydration solution semalaman pada suhu 4°C. Konsentrasi dan kemurnian DNA diukur menggunakan nanodrop.
3.3.5.2. Amplifikasi DNA Bakteri
Proses amplifikasi DNA mengacu pada Joko et al. (2011). Amplifikasi DNA dilakukan dengan menghomogenkan beberapa larutan, yaitu 12,5 μL Go Taq®
Green Master Mix, 8,5 μL NFW, 1 μL primer 63f (5’ CAG GCC TAA CAC ATG CAA GTC 3’), 1 μL primer 1387r (5’ GGG CGG WGT GTA CAA GGC 3’) kedua pasangan primer digunakan karena menurut Marchesi et al. (1998), kedua primer tersebut optimal digunakan dalam proses amplifikasi DNA berdasarkan area konservasi 16S rRNA, dan 2 μL DNA bakteri hasil isolasi sebelumnya. Semua bahan dimasukkan ke dalam tube PCR dengan total volume bahan 25 μL. Tube-tube PCR kemudian dimasukkan ke dalam thermalcycler. Amplifikasi DNA dengan thermalcycler dilakukan sebanyak 29 siklus dengan kondisi denaturasi awal 94°C selama 5 menit, denaturasi pada suhu 94°C selama 1 menit 30 detik, penempelan primer pada suhu 55°C selama 45 detik, dan polimerasi pada suhu 72°C selama 1 menit.
3.3.5.3. Visualisasi DNA Bakteri
Hasil amplifikasi DNA bakteri dideteksi menggunakan alat elektroforesis. Gel agarosa dibuat dengan ditimbang 1,2 g agarosa kemudian dilarutkan dengan 100 mL larutan buffer TAE 1x lalu dimicrowave sampai homogen. Setelah gel agarosa homogen, ditetesi 2 μL gel red nucleic acid. Gel agarosa kemudian dituang ke dalam cetakan sampai membeku, lalu sisir cetakan agar dilepas.
Marker dibuat dengan mencampurkan 6x loading dye sebanyak 3 μL dengan DNA ladder 100 bp sebanyak 2 μL di atas alumunium foil, kemudian dipipet perlahan sampai homogen. Marker dimasukkan ke dalam sumur yang terdapat pada gel. Sebanyak 3 μL DNA hasil amplifikasi dimasukkan ke dalam sumur berikutnya. Gel agarosa diletakkan dalam tangki elektroforesis berisi buffer TAE 1x hingga terendam setinggi 1-2 mm.
Proses elektroforesis dilakukan dengan menyambungkan perangkat elektroforesis ke sumber tegangan 220 V selama 25 menit. Setelah proses elektroforesis selesai, gel diangkat dan diletakkan di atas UV transiluminator untuk divisualisasikan. Hasil visualisasi pita DNA dengan UV transiluminator kemudian didokumentasikan. Hasil amplifikasi DNA koloni bakeri culturable yang berhasil divisualisasi dengan strip utama DNA yang tebal dan terang dikirim ke PT. Genetica Science Indonesia untuk disequencing. Sequencing Sanger digunakan untuk analisis bakteri culturable sesuai prosedur produsen.
3.3.6. Uji Potensi Bakteri Penghasil AIA
Uji potensi bakteri penghasil AIA mengacu pada Aji dan Lestari (2020). Pertama, dibuat kurva larutan standar AIA. Sebanyak 0,1 mg AIA serbuk ditimbang lalu dilarutkan dengan 5 ml metanol, kemudian ditera dengan akuades sampai volume mencapai 20 mL. Larutan AIA sintesis dipipet ke dalam tabung reaksi masing-masing 4 µL (0,2 ppm), 20 µL (1 ppm), 100 µL (5 ppm), dan 300 µL (15 ppm). Masing-masing konsentrasi larutan AIA ditambahkan akuades hingga volume tabung reaksi menjadi 2.000 µL, kemudian ditambahkan 4 mL reagen Salkowski pada masing-masing tabung reaksi lalu dihomogenkan dan diinkubasi selama 60 menit pada suhu ruang. Larutan standar AIA diukur absorbansinya menggunakan spektrofotometer pada panjang gelombang 530 nm.
Koloni bakteri dari media NA miring ditumbuhkan pada media NB (13 g
Nutrient Broth; 1.000 mL akuades) selama 24 jam sambil dishaker. Setelah itu, 100 μL setiap kultur bakteri dari media NB diinokulasi ke dalam 10 mL media garam minimal (0,272 g KH2PO4; 0,426 g Na2HPO4; 0,04 g MgSO4.7H2O; 200
mL akuades; 10 mL trace element) yang sudah ditambahkan 1 mL L-Tryptophan lalu dishaker kembali selama 48 jam. Kemudian, 1 mL kultur bakteri dari media garam minimal dihomogenkan menggunakan sentrifus dengan kecepatan 6.000 x g pada suhu 4°C selama 10 menit. Setelah dihomogenkan menggunakan sentrifus, supernatan diambil lalu dipindahkan ke tabung reaksi untuk ditambahkan 4 mL pereaksi Salkowski (150 mL H2SO4 pekat; 250 mL akuades; 7,5 mL 0.5 M FeCl3.
6H2O). Supernatan diinkubasi selama 25 menit pada suhu 28°C. Bakteri yang
menghasilkan hormon AIA pada supernatannya berwarna merah muda. Intensitas warna merah muda pada supernatan diukur menggunakan spektrofotometer pada panjang gelombang 530 nm. Nilai absorbansi dicatat kemudian dibandingkan dengan kurva larutan standar AIA. Uji bakteri penghasil AIA dilakukan dua kali untuk mendapatkan hasil yang lebih akurat.
3.3.7. Uji Potensi Bakteri Penghasil Siderofor
Uji potensi bakteri penghasil siderofor mengacu pada Husen et al. (2008). Prinsip dari uji bakteri siderofor yaitu media Fe-Chrome Azurol Sulfate (Fe-CAS)
sebagai sumber nutrisi bagi bakteri namun miskin unsur Fe. Hanya bakteri siderofor yang dapat tumbuh di media Fe-CAS ditandai dengan warna koloni berwarna oranye. Media Fe-CAS dibuat dari campuran larutan yang dibuat dan disterilisasi secara terpisah.
Pembuatan larutan blue dye yang terdiri dari campuran 3 larutan. Larutan I dibuat dengan ditimbang 0,06 g Chrome Azurol Sulfate dilarutkan dalam 50 mL akuabides. Selanjutnya, larutan II dibuat dengan ditimbang 0,0027 g FeCl3.6H2O
dilarutkan dalam 10 mL HCl mM. Larutan III dibuat dengan ditimbang 0,073 g hexadecy-ltrimetylammonium bromide (HDTMA) dilarutkan dalam 40 mL akuabides. Sebanyak 10 mL Larutan II dimasukkan ke dalam larutan I, dihomogenkan. Setelah itu, larutan III dimasukkan secara perlahan sambil diaduk sampai larutan berwarna biru. Kemudian, larutan dituang pada wadah yang sudah dideferasi dengan 6 M HCl. Larutan blue dye yang sudah homogen disterilisasi dengan autofklaf selama 15 menit pada suhu 121oC dengan tekanan 1 atm.
Pembuatan larutan mixture yang terdiri dari larutan stok garam, stok glukosa dan larutan asam cassamino. Larutan stok garam dibuat dengan ditimbang 15 g KH2PO4, 25 g NaCl, dan 50 g NH4Cl dilarutkan dalam 500 mL akuabides. Stok
glukosa dibuat dengan ditimbang 4 g glukosa dilarutkan dalam 100 mL akuabides. Setelah itu, disterilisasi dengan kertas saring 0,2 µm lalu diletakkan di botol steril. Larutan asam casamino dibuat dengan ditimbang 5 g asam cassamino dilarutkan dalam 45 mL akuabides, kemudian diekstrak dengan 3% 8-hydroxyquinoline dalam kloroform (v/v). Ekstrak air yang didapat kemudian disterilisasi dengan kertas saring 0,2 µm lalu diletakkan di botol steril.
Pembuatan media Fe-CAS agar dibuat dengan dilarutkan 100 mL larutan stok garam dalam 750 mL akuabides. 32,24 g peperazine-N,N'-bis[2-ethanesulfonic acid] (PIPES) ditimbang kemudian dimasukkan perlahan sambil diaduk menggunakan batang pengaduk. NaOH ditambahkan secara perlahan hingga PIPES larut sempurna atau hingga pH media mencapai 6,8. Kemudian ditambahkan 25 g agar dan disterilisasi dengan autoklaf. Setelah steril, dibiarkan hingga suhu media mencapai (60oC) lalu ditambahkan 30 mL larutan asam cassamino dan 10 mL larutan stok glukosa. Secara perlahan ditambahkan 100 mL blue dye melalui tepi wadah sambil dihomogenkan menggunakan magnet
pengaduk. Setelah homogen, media dituang ke dalam cawan petri steril.
Inokulasi bakteri dilakukan dengan metode gores, tiap isolat ditumbuhkan pada 2 media Fe-CAS agar. Koloni bakteri dari media NA miring diambil menggunakan ose lalu digoreskan di atas media Fe-CAS secara aseptis. Media yang sudah diinokulasikan bakteri selanjutnya diinkubasi pada suhu 37°C selama 24 jam. Setelah diinkubasi, pertumbuhan bakteri di media Fe-CAS diamati. Bakteri siderofor menghasilkan koloni berwarna oranye yang kontras dengan warna biru pada media Fe-CAS agar.
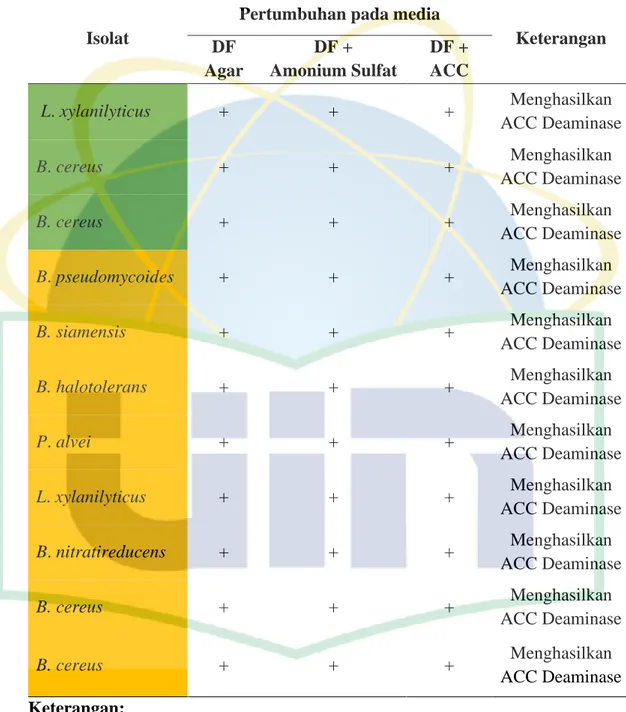
3.3.8. Uji Potensi Bakteri Penghasil ACC Deaminase
Uji potensi bakteri penghasil ACC Deaminase mengacu pada Husen (2011). Uji potensi bakteri penghasil ACC deaminase dilakukan dengan ditumbuhkan koloni bakteri pada media selektif garam minimal Dworkin-Foster (DF) yang dimodifikasi. Media DF dibuat dengan ditimbang 4 g KH2PO, 6 g Na2HPO4, 0,2 g
MgSO4.7H2O, 1 mg FeSO4.7H2O, 2 g glukosa, 2 g asam glukonik, 2 g asam sitrat,
25 g agar yang dilarutkan dalam 1.000 mL akuades. Dibuat juga media DF yang dimodifikasi dengan ditambahkan amonium sulfat sebanyak 2 g (media DF + Amonium Sulfat) dan ditambahkan 0,3033 g ACC (media DF + ACC). Media DF dan DF + Amonium sulfat disterilisasi menggunakan autofklaf selama 15 menit pada suhu 121oC dengan tekanan 1 atm, sedangkan media DF + ACC disterilisasi dengan kertas saring 0,2 µm.
Sebanyak 11 isolat bakteri dari media NA ditumbuhkan dalam media NB sambil dishaker selama 24 jam. Sebanyak 5 µL koloni bakteri yang telah ditumbuhkan di media NB diinokulasikan ke media padat (DF, dan DF + amonium sulfat). Koloni yang mampu tumbuh setelah diinkubasi pada suhu 37°C selama 24 jam pada media selektif DF + amonium sulfat menjadi isolat bakteri dugaan memiliki kemampuan menghasilkan ACC Deaminase. Isolat dugaan penghasil ACC Deaminase kemudian diinokulasi ke media DF + ACC untuk validasi adanya aktivitas bakteri penghasil enzim ACC deaminase. Koloni bakteri yang mampu tumbuh pada media DF (tanpa amonium sulfat) menjadi indikasi adanya bakteri yang mampu mendapatkan sumber N dengan menambat N2 dari
3.3.9. Identifikasi Komunitas Bakteri Secara Molekuler dengan Teknik Nonpengkulturan
Sebanyak masing-masing 250 g sampel tanah lahan rawa pasang surut Kalimantan Selatan dan lahan rawa lebak Sumatra Selatan dikirim ke PT. Genetica Science Indonesia untuk disequencing. Shotgun metagenomic sequencing digunakan untuk analisis keanekaragaman dan potensi bakteri nonculturable sesuai prosedur produsen.
3.4. Analisis Data
Penelitian ini menggunakan analisis deskriptif berupa hasil keanekaragaman dan potensi bakteri dengan pendekatan shotgun metagenomic sequencing untuk bakteri nonculturable. Data hasil sequencing DNA bakteri culturable berupa sekuen pasang basa (forward dan reverse) DNA bakteri diolah menggunakan software Bioedit untuk memperbaiki hasil sequencing serta mendapatkan satu set sekuen lengkap yang diinterpretasikan dengan grafik elektroferogram. Data hasil sequencing yang sudah diperbaiki kemudian dicocokkan dengan DNA database menggunakan Basic Local Alignment Search Tool Nucleotida (BLAST-N) melalui website National Center for Biotechnology Information (NCBI) (www.ncbi.nlm.nih.gov). Hasil analisis BLAST-N yang menunjukkan subjek dengan persentase kemiripan 98-100 % ditentukan sebagai sekuen yang memiliki kekerabatan terdekat dengan sekuen query.
Data hasil uji potensi bakteri yaitu uji deteksi bakteri penghasil hormon AIA, penghasil siderofor, dan penghasil ACC Deaminase dianalisis secara deskriptif. Data disajikan dalam bentuk tabel, grafik atau gambar dengan bantuan software Microsoft Excel 2013.
23
BAB IV
HASIL DAN PEMBAHASAN
4.1. Hasil Identifikasi Bakteri Secara Molekuler dengan Teknik Pengkulturan
Berdasarkan hasil analisis sekuen gen 16S rRNA dan dikomparatif menggunakan data di GeneBank melalui program BLAST-N (Tabel 3) menunjukkan isolat 26.1 teridentifikasi sebagai Lysinibacillus xylanilyticus, isolat 26.2 dan 26.3 teridentifikasi sebagai Bacillus cereus, isolat 27.1 teridentifikasi sebagai Bacillus pseudomycoides, isolat 27.2 teridentifikasi sebagai Bacillus siamensis, isolat 27.3 teridentifikasi sebagai Brevibacillus halotolerans, isolat 27.4 teridentifikasi sebagai P. alvei, isolat 27.5 teridentifikasi sebagai Lysinibacillus xylanilyticus, dan isolat 27.6 teridentifikasi sebagai Bacillus nitratireducens, sedangkan isolat 27.7 dan 27.8 teridentifikasi sebagai Bacillus sp. (Tabel 3). Isolat bakteri 27.7 dan 27.8 memiliki nilai similarity yang rendah (<97%) (Tabel 3). Hal ini dikarenakan isolat bakteri yang dikulturkan kurang murni yang menyebabkan banyaknya kontaminan sehingga sekuen hasil blast menunjukkan kekerabatan yang rendah dengan sekuen database.
Tabel 3. Analisis homologi sekuen gen 16S rRNA isolat bakteri culturable
menggunakan program Blast-N Lahan
Rawa Isolat Isolat Pembanding
Query coverage (%) E value Percent identity (%) Pasang surut (KS) 26.1 Lysinibacillus xylanilyticus 99 0 99,88 26.2 Bacillus cereus 99 0 99,76 26.3 Bacillus cereus 100 0 100 Lebak (SS) 27.1 Bacillus pseudomycoides 99 0 99,88 27.2 Bacillus siamensis 100 0 100 27.3 Brevibacillus halotolerans 99 0 99,88 27.4 Paenibacillus alvei 100 0 100 27.5 Lysinibacillus xylanilyticus 100 0 96,7 27.6 Bacillus nitratireducens 100 0 100 27.7 Bacillus sp 98 0 81,93 27.8 Bacillus sp. 100 0 81,95
Semakin tinggi nilai homologi yang didapatkan maka semakin dekat kekerabatan sekuen query dengan sekuen database (Gaffar & Sumarlin, 2020).
Menurut Tindi et al. (2017), jika nilai query coverage mendekati 100%, e-value mendekati 0, dan percent identity mendekati 100% maka sekuen query dikatakan paling mirip dengan database yang dicirikan dengan nilai total score dan max score sama. Query coverage menyatakan panjang nukleotida yang selaras dengan database dalam persen, e value menyatakan nilai statistik signifikan dari kedua sekuen yang dibandingkan, sedangkan percent identity menyatakan kecocokan antara sekuen query dengan sekuen database yang disejajarkan (Seprianto, 2017). Semua isolat bakteri culturable yang teridentifikasi (Tabel 3), baik dari lahan rawa pasang surut KS maupun lahan rawa lebak SS termasuk ke dalam filum Firmicutes. Bakteri filum Firmicutes mudah dikulturkan karena koloni bakteri filum Firmicutes umumnya menghasilkan endospora untuk bertahan hidup dan membutuhkan waktu inkubasi yang relatif singkat untuk pertumbuhannya (McKenney et al., 2013; Kurm et al., 2019).
4.2. Hasil Uji Potensi Bakteri dalam Sektor Pertanian 4.2.1. Hasil Uji Bakteri Penghasil Hormon AIA
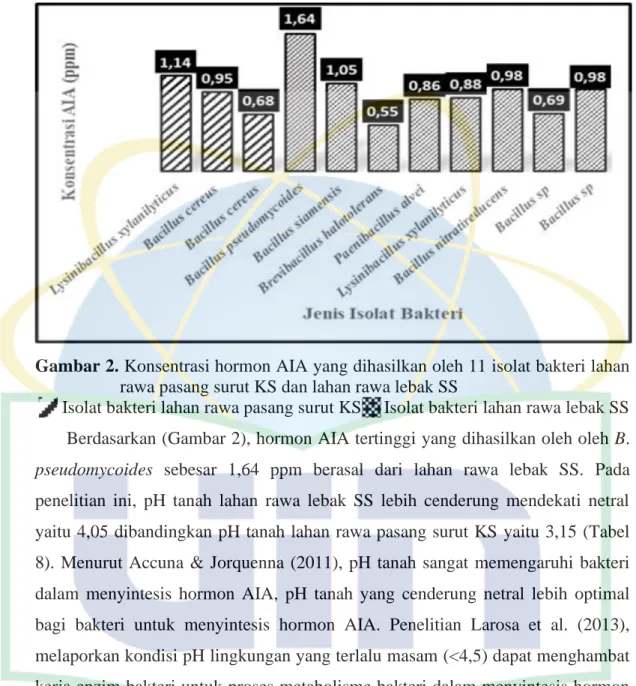
Sebanyak 11 isolat bakteri terdeteksi mampu menyintesis AIA di media garam minimal. Semua isolat bakteri dapat menyintesis AIA yang ditandai dengan terbentuknya warna merah muda pada supernatant isolat bakteri setelah penambahan pereaksi Salkowski (Lampiran 4). Berdasarkan (Gambar 2). hasil konsentrasi hormon AIA yang telah dibandingkan dengan kurva larutan standar AIA (Lampiran 5), diperoleh konsentrasi hormon AIA tertinggi yaitu 1,14 ppm oleh L. xylanilyticus yang merupakan bakteri dari sampel tanah lahan rawa pasang surut KS, sedangkan isolat bakteri dari sampel tanah lahan rawa lebak SS diperoleh konsentrasi hormon AIA tertinggi sebesar 1,64 ppm oleh B. Pseudomycoides.
Hal ini juga menunjukkan kemampuan isolat bakteri dalam menghasilkan hormon AIA berbeda-beda walaupun termasuk dalam satu genus yang sama. Sejalan dengan penelitian Beneduzi et al. (2013), didapatkan beberapa isolat yang termasuk dalam satu genus yang sama tetapi menghasilkan konsentrasi hormon AIA berbeda. Isolat bakteri yang didapatkan antara lain, Stenotrophomonas, Burkholderia, dan Agrobacterium. Hormon AIA yang dihasilkan setiap isolat
bakteri berbeda-beda, hal ini dipengaruhi oleh kemampuan pertumbuhan masing-masing isolat bakteri, lingkungan, dan ketersediaan substrat (Herlina et al., 2017).
Gambar 2. Konsentrasi hormon AIA yang dihasilkan oleh 11 isolat bakteri lahan
rawa pasang surut KS dan lahan rawa lebak SS
Isolat bakteri lahan rawa pasang surut KS Isolat bakteri lahan rawa lebak SS Berdasarkan (Gambar 2), hormon AIA tertinggi yang dihasilkan oleh oleh B. pseudomycoides sebesar 1,64 ppm berasal dari lahan rawa lebak SS. Pada penelitian ini, pH tanah lahan rawa lebak SS lebih cenderung mendekati netral yaitu 4,05 dibandingkan pH tanah lahan rawa pasang surut KS yaitu 3,15 (Tabel 8). Menurut Accuna & Jorquenna (2011), pH tanah sangat memengaruhi bakteri dalam menyintesis hormon AIA, pH tanah yang cenderung netral lebih optimal bagi bakteri untuk menyintesis hormon AIA. Penelitian Larosa et al. (2013), melaporkan kondisi pH lingkungan yang terlalu masam (<4,5) dapat menghambat kerja enzim bakteri untuk proses metabolisme bakteri dalam menyintesis hormon AIA.
Sintesis hormon AIA oleh bakteri di dalam tanah dipicu karena keberadaan L-tryptophan. L-tryptophan merupakan prekursor dalam pembentukan hormon AIA. Penelitian oleh Aji & Lestari (2020), melaporkan isolat bakteri dari genus Enterobacter, Bacillus, Pseduomonas dan Staphylococcus yang diisolasi dari tanaman jeruk nipis mampu menghasilkan hormon AIA setelah diberi prekursor L-tryptofan. Reaksi perubahan L-tryptophan menjadi hormon AIA melalui beberapa tahapan, yaitu tahap deaminase dengan bantuan enzim
amino-transferase L-tryptophan diubah menjadi asam indol piruvat, selanjutnya tahap dekarboksilasi yang mengubah asam indol piruvat menjadi indol asetat dehid, dan tahap terakhir yaitu tahap hidrolisis dengan bantuan enzim AIA1d mengubah indol asetat dehid menjadi hormon AIA (Ahemad & Kibret, 2013; Patten et al., 2013; Duca et al., 2014; Pambudi et al. 2017). Gen dekarboksilase indolpiruvate putative (IpdC) menjadi enzim utama dalam pembentukan hormon AIA oleh bakteri (Xie et al., 2016; Grady et al., 2016).
4.2.2. Hasil Uji Bakteri Penghasil Bakteri Siderofor
Berdasarkan (Tabel 4), hasil penelitian dari 11 isolat bakteri yang diuji menghasilkan siderofor, semua isolat mampu menghasilkan siderofor yang diindikasikan dengan perubahan warna biru media Fe-CAS agar menjadi warna oranye (Gambar 3). Perubahan warna media Fe-CAS agar terjadi karena bakteri penghasil siderofor mengikat Fe yang terkandung pada pewarna blue dye pada media Fe-CAS agar (Farisna, 2015).
Tabel 4. Skrining bakteri penghasil siderofor pada media Fe-CAS agar
Isolat Pertumbuhan pada media
Lysinibacillus xylanilyticus + Bacillus cereus + Bacillus cereus + Bacillus pseudomycoides + Bacillus siamensis + Brevibacillus halotolerans + Paenibacillus alvei + Lysinibacillus xylanilyticus + Bacillus nitratireducens + Bacillus sp + Bacillus sp + Keterangan:
Berdasarkan kemampuan isolat bakteri tumbuh pada media siderofor. Tanda - = koloni bakteri tidak tumbuh; + = koloni bakteri tumbuh. Isolat bakteri lahan rawa pasang surut KS Isolat bakteri lahan rawa lebak SS
Terdapat tiga macam tipe siderofor yaitu, tipe katekolat (merah muda/ungu), hidroksamat (oranye), dan karboksilat (coklat) (Carroll & Moore, 2018). Siderofor berwarna oranye yang dihasilkan 11 isolat bakteri termasuk siderofor tipe hidroksamat. Hal ini sejalan dengan Ahmed & Holmstrom (2014), tipe siderofor hidroksamat dan katekolat umumnya disintesis oleh mikroorgsanisme seperti bakteri dan cendawan, sedangkan tipe karboksilat umumnya disintesis oleh tanaman (Glick & Pasternack, 2013). Prihatiningsih et al. (2017), melaporkan 1 isolat B. subtilis teridentifikasi menyintesis siderofor tipe katekolat dan 4 isolat B. subtilis lainnya menyintesis siderofor tipe hidroksamat. Siderofor dihasilkan oleh bakteri bermanfaat untuk mengikat senyawa besi yang tersedia di lingkungan bagi tanaman. Selain itu, juga mencegah pemanfaatan senyawa besi bagi mikoroorganisme patogen yang dapat menghambat pertumbuhan tanaman (Radhakrishnan et al., 2014). Penelitian oleh Agustiansyah et al. (2013), melaporkan B. subtilis, P. aeruginosa dan, P. dimunata mampu menyintesis senyawa siderofor dan menghambat pertumbuhan Xanthomonas oryzae pv.oryzae (Xoo) pada tanaman padi.
Gambar 3. Pertumbuhan isolat bakteri penghasil siderofor pada media Fe-CAS
agar. A. Isolat bakteri penghasil siderofor ditandai dengan koloni berwarna oranye
Dalam kondisi lingkungan miskin unsur besi, siderofor yang dihasilkan oleh bakteri dapat mereduksi Fe3+ bersifat tidak larut di dalam tanah menjadi Fe2+ yang bersifat larut dan dapat dimanfaatkan oleh bakteri maupun tanaman (Wittenwiller, 2007; Raza & Shen, 2010). Siderofor disintesis oleh bakteri melalui nonribosomal peptide synthetases (NRPSs) yang dikodekan oleh kelompok gen untuk