TERMODINAMIKA
KIMIA
TERMODINAMIKA KIMIA Penyusun : Sudarlin Editor : Liana Aisyah Edisi : Pertama Cetakan : Pertama
LISENSI BUKU
This work is licensed under the Creative Commons Attribution Non-Commercial 4.0 International License. To view a copy of this license, visit http://creativecommons.org/licenses/by-nc/4.0/.
Sudarlin,
TERMODINAMIKA KIMIA/Sudarlin
edisi pertama – Yogyakarta: Penerbit Buku, 2011 cetakan pertama, ix + 190 hal, 14.8 x 21 cm. Seri Buku Elektronik
Kimia Judul
Omah Ilmu
Alamat : Pogung Rejo, Sleman, Yogyakarta Telp : 081226931661
Web : omah-ilmu.co.nr Email : [email protected]
Termodinamika Kimia|
i
KATA PENGANTAR
Reaksi kimia merupakan proses yang selalu melibatkan energi, baik membutuhkan atau melepaskan energi. Bidang ilmu kimia yang mempelajari konsep ini secara teoritikal dan eksperimental disebut termodinamika kimia. Konsep ini sangat penting bagi seorang kimiawan untuk mempelajari dan mengeksplorasi suatu reaksi kimia. Namun, keterbatasan sumber belajar telah mempersulit banyak kimiawan, baik mahasiswa, guru, dosen, atau peneliti untuk memahami konsep ilmu ini.
Buku ini diharapkan membantu mengatasi keterbatasan sumber belajar tersebut. Penjelasan yang digunakan pada buku sangat terstruktur dengan bahasa yang mudah dipahami. Bab pertama berisi penjelasan mengenai konsep-konsep dasar termodinamika dilanjutkan dengan penjelasan sistem kimia yang sering dipelajari secara termodinamika pada bab kedua.
Konsep inti termodinamika meliputi kesetimbangan termal, kesetimbangan kimia, dan kesetimbangan fasa sebagai aplikasi dari hukum pertama, kedua, dan ketiga termodinamika dijelaskan secara berurutan pada bab tiga hingga bab tujuh. Penjelasan tersebut disertai contoh dan penyelesaian soal serta kaidah matematika praktis yang ditampilkan secara pragmatis pada bagian-bagian tertentu untuk memudahkan pemahaman.
Mudah-mudahan buku ini memberikan manfaat sebagaimana yang diharapkan dan terima kasih yang sebesar-besarnya kepada semua pihak yang telah banyak membantu. Saran dan kritik yang konstruktif tetap kami harapkan demi penyempurnaan buku ini pada edisi selanjutnya.
Yogyakarta, Desember 2011 Penyusun
| Termodinamika Kimia
ii
DAFTAR ISI
KATA PENGANTAR ... i
DAFTAR ISI ... ii
BAB 1 KONSEP-KONSEP DASAR ... 1
A. Energetika reaksi kimia ... 1
B. Sistem dan lingkungan ... 3
C. Persamaan keadaan ... 5
D. Fungsi keadaan dan fungsi jalan ... 7
E. Proses perubahan keadaan ... 7
F. Kajian termodinamika kimia ... 8
G. Fasa zat sistem kimia/fisika ... 9
BAB 2 PERSAMAAN KEADAAN GAS ... 13
A. Hukum-hukum gas ... 13
B. Gas ideal ... 23
C. Gas real ... 25
D. Isotherm gas dan titik kritis ... 37
E. Asas keadaan yang bersesuaian ... 40
F. Campuran gas ... 42
BAB 3 KESETIMBANGAN TERMAL DAN HUKUM PERTAMA TERMODINAMIKA ... 49
A. Kalor sebagai bentuk energi ... 49
B. Kerja... 51
C. Energi dalam dan perubahannya ... 58
BAB 4 TERMOKIMIA ... 75
A. Persamaan termokimia ... 75
B. Jenis-jenis perubahan entalpi ... 76
C. Penentuan perubahan entalpi (H) ... 79
BAB 5 HUKUM KEDUA DAN KETIGA TERMODINAMIKA .. 89
A. Hukum kedua termodinamika... 89
B. Entropi ... 91
C. Efisiensi proses termal dan siklus Carnot ... 93
D. Fungsi Helmholtz dan fungsi Gibbs ... 96 E. Gabungan hukum pertama dan kedua termodinamika 99
Termodinamika Kimia|
iii
F. Hubungan Maxwell ... 101
G. Persamaan fundamental bentuk integral dan persamaan Gibbs-Duheim ... 103
H. Merancang fungsi termodinamika secara matematis 106 I. Hukum ketiga termodinamika ... 106
BAB 6 KESETIMBANGAN KIMIA ... 111
A. Syarat kesetimbangan kimia ... 111
B. Kesetimbangan homogen... 112
C. Kesetimbangan Heterogen ... 116
D. Respon Kesetimbangan terhadap Berbagai Kondisi .. 118
BAB 7 KESETIMBANGAN FASA ... 127
A. Fasa dan Transisi Fasa ... 127
B. Jumlah fasa dan komponen dalam campuran ... 128
C. Sistem Satu Komponen ... 131
D. Sistem Dua Komponen ... 141
APENDIKS ... 161
Apendiks A: Simbol Termodinamika Kimia ... 161
Apendiks B: Faktor Konversi ... 163
Apendiks C: Tabel dan Data ... 165
INDEKS ... 183
Termodinamika Kimia|
1
KONSEP-KONSEP
DASAR
A. Energetika reaksi kimia
Reaksi kimia sebagai proses yang melibatkan penataan elektron, pemutusan, dan atau pembentukan ikatan antar atom selalu membutuhkan atau melepaskan energi. Energi dibutuhkan jika reaksi kimia melibatkan proses eksitasi elektron atau pembentukan ikatan baru, sebaliknya energi dilepaskan jika reaksi kimia melibatkan proses emisi elektron atau pemutusan ikatan antar atom.
Kuantitas dan kualitas energi yang terlibat pada reaksi kimia tersebut dapat dipelajari secara mikroskopik dan makroskopik. Ilmu kimia yang mempelajarinya secara mikroskopik adalah termodinamika statistik dan secara makroskopik adalah termodinamika kimia. Termodinamika statistik menggunakan pendekatan teoritis, yakni berdasarkan energi internal masing-masing partikel. Energi internal tersebut meliputi energi elektron, energi inti atom, dan energi gerak vibrasi, rotasi, serta translasi partikel. Masing-masing energi internal ini dapat dihitung secara kuantum sehingga tidak membutuhkan besaran termodinamika lainnya. Sebaliknya, termodinamika kimia menggunakan pendekatan empiris dimana energi molekul dihitung berdasarkan perubahan besaran termodinamika lainnya.
Besaran termodinamika tersebut meliputi temperatur, tekanan, dan volume. Jika energi molekul berubah, maka
| Termodinamika Kimia
2
perubahan tersebut mengakibatkan terjadinya perubahan temperatur, tekanan, atau volume di sekitar molekul. Perubahan-perubahan tersebut diamati dan diukur secara kuantitatif untuk menentukan energi molekul. Oleh karena itu, termodinamika kimia merupakan cabang ilmu kimia yang meliputi pengamatan dan pengukuran besaran-besaran termodinamika.
suplemen
Tekanan (p)
Tekanan adalah gaya per satuan luas. Makin besar gaya yang bekerja pada permukaan tertentu, makin besar tekanannya. Satuan SI tekanan adalah pascal (Pa) yang dinyatakan sebagai 1 Newton per meter persegi. 1 Pa = 1 Nm-2
Beberapa satuan lain untuk tekanan adalah bar, atm, Torr, dan mmHg, dimana:
1 atm = 101325 Pa = 1.01325 bar = 760 Torr = 760 mmHg. Temperatur (T)
Temperatur atau temperatur adalah derajat panas suatu sistem. Sistem yang terasa panas memiliki temperatur yang lebih tinggi. Sebaliknya, sistem yang terasa dingin memiliki temperatur yang lebih rendah. Semakin dingin suatu sistem, semakin rendah temperaturnya. Sebaliknya, semakin panas suatu sistem ,semakin tinggi temperaturnya.
Temperatur dapat dinyatakan dalam satuan 0C (Celcius), 0R (Reamur), 0F (Fahrenheit) atau K (Kelvin). Akan tetapi satuan K sebagai satuan SI lebih sering digunakan dalam analisis termodinamika, dimana:
x 0C = x + 273.15 K Volume (V)
Volume adalah ukuran ruang 3 dimensi (panjang, lebar, dan tinggi) yang ditempati suatu sistem. Volume dapat dinyatakan dalam satuan kubik (cm3, dm3 ,m3 dan seterusnya) sebagai satuan SI atau dalam satuan lain, seperti L (liter), cc (centimetercubic), dan lain-lain.
Termodinamika Kimia|
3 Jumlah partikel (n)
Jumlah partikel zat dalam suatu sistem dapat dinyatakan dalam satuan mol, dimana 1 mol zat mengandung 6.02 x 1023 partikel. Bilangan ini disebut bilangan Avogadro dengan lambang N.
B. Sistem dan lingkungan
Proses kimia sebagaimana telah disebutkan di atas, demikian pula proses fisika selalu melibatkan materi dan terjadi dalam ruang tertentu, misal zat-zat kimia yang direaksi dalam dalam erlenmeyer, es yang dilelehkan dengan air dalam sebuah gelas, kayu yang dibakar dengan oksigen dalam ruang terbuka, atau gas yang dimasukkan ke dalam balon. Materi yang terlibat dan ruang tempat terjadinya beberapa proses tersebut adalah sistem termodinamika. Sistem tersebut dikelilingi oleh lingkungan yang tidak terlibat secara langsung tapi mempengaruhi proses perubahan. Pemisah antara sistem dan lingkungan termodinamika disebut batas sistem, seperti terlihat pada gambar 1.1.
Gambar 1.1. Sistem dan lingkungan yang dibatasi oleh batas sistem Batas antara sistem dan lingkungan dapat bersifat nyata seperti gas dalam balon atau imajiner seperti air dan es dalam gelas. Es yang kita masukkan dalam air dapat dianggap sebagai sistem dan airnya sebagai lingkungan. Namun pada kajian tertentu, air dan es dapat dianggap sebagai sistem, gelas sebagai batas, dan udara di sekitarnya sebagai lingkungan.
| Termodinamika Kimia
4
Penentuan batas antara sistem dan lingkungan dipengaruhi pula oleh interaksi antara keduanya. Jenis sistem berdasarkan interaksinya dibagi menjadi tiga:
1. Jika air dan es tersebut ditempatkan pada gelas terbuka sehingga air dan es yang awalnya terasa dingin akan menjadi hangat akibat terjadinya pertukaran panas dengan udara di sekitanya dan setelah beberapa saat sejumlah molekul air yang menguap dapat bercampur dengan udara di sekitanya, maka sistem ini disebut sistem terbuka.
2. Jika air dan es tersebut ditempatkan pada gelas tertutup,
sehingga yang terjadi hanya pertukaran panas dan tidak disertai pertukaran molekul air (molekul air yang menguap tidak dapat keluar dari sistem, maka sistem ini disebut sistem
tertutup.
3. Jika air dan es tersebut ditempatkan pada gelas yang dilengkapi penyekat udara, seperti termos, sehingga baik panas maupun molekul air tidak dapat berpindah, maka sistem ini disebut
sistem terisolasi.
Gambaran dan penjelasan mengenai sifat pertukaran materi dan energi ketiga sistem tersebut dapat dilihat pada gambar 1.2 dan tabel 1.1.
Termodinamika Kimia|
5 Tabel 2.1. Jenis sistem berdasarkan interaksinya
No Nama Sistem Ada Pertukaran Panas/Energi Materi
1. Sistem terbuka Ya Ya
2. Sistem tertutup Ya Tidak
3. Sistem terisolasi Tidak Tidak
Contoh Soal
Reaksi-reaksi kimia berikut terjadi pada sistem tertentu. Jelaskan sistem yang memungkinkan proses tersebut terjadi! a. Kebakaran hutan
b. Senyawa organik yang direfluks dengan pendingin bola
Jawab:
a. Reaksi pembakaran hanya dapat terjadi jika tersedia O2. Selama reaksi terjadi, O2 dari udara akan terus digunakan untuk bereaksi dengan senyawa organik yang terbakar, sehingga terjadi aliran materi dan tentunya juga panas. Oleh karena itu, proses ini terjadi pada sistem terbuka.
b. Selama proses refluks panas yang diberikan menyebabkan senyawa kimia yang direfluks dan pelarutnya akan menguap. Uap yang dihasilkan akan terkondensasi oleh pendingin bola, sehingga tetesannya akan kembali bercampur, sehingga tidak terjadi aliran materi. Oleh karena itu, proses ini terjadi pada sistem tertutup.
Latihan Soal Tuliskan beberapa contoh proses kimia dan fisika yang terjadi dalam sistem terbuka, tertutup, dan terisolasi!
C. Persamaan keadaan
Perubahan keadaan sistem sebagaimana disebutkan di atas dapat diamati dan diukur berdasarkan variabel-variabel tertentu. Variabel-variabel tersebut dibagi menjadi 2 golongan, yaitu:
| Termodinamika Kimia
6
1. Variabel intensif adalah variabel yang nilainya tidak tergantung pada ukuran/luas sistem, contoh tekanan (p), temperatur (T), besaran-besaran molar, potensial kimia, densitas, dan lain sebagainya.
2. Variabel ekstensif adalah variabel yang nilainya tergantung pada ukuran/luas sistem, contoh volume (V), massa (m), jumlah mol (n), panjang (l), dan lain sebagainya.
Hubungan antara variabel-variabel tersebut dinyatakan sebagai persamaan keadaan. Contoh persamaan keadaan adalah persamaan keadaan gas ideal ( pV = nRT), persamaan van der
Waals, dan lain-lain. Persamaan-persamaan tersebut diturunkan
berdasarkan eksperimen-eksperimen terhadap masing-masing variabel.
Contoh Soal
Sifat intensif dapat diformulasikan dari beberapa sifat ekstensif. Jelaskan pernyataan tersebut dan berikan contoh!
Jawab: Sifat intensif dapat diformulasikan dari beberapa sifat
ekstensif. Contoh yang sederhana adalah perbandingan antara massa dan volume yang keduanya merupakan sifat ekstensif menghasilkan sifat intensif yang disebut massa jenis dan tidak tergantung pada jumlah/ukuran sampel. Contoh yang lain adalah molaritas sebagai perbandingan antara mol dan volume atau potensial kimia sebagai perbandingan antara energi bebas Gibbs dan mol.
Latihan Soal Jelaskan dan berikan contoh secara eksperimen bahwa: a. Volume adalah variabel ekstensif
Termodinamika Kimia|
7
D. Fungsi keadaan dan fungsi jalan
Perubahan variabel-variabel intensif/ekstensif dalam suatu sistem kimia/fisika melibatkan energi tertentu yaitu kerja (w) dan atau kalor (q). Suatu sistem tidak akan berubah jika tidak melibatkan kerja atau kalor atau suatu sistem yang tidak berubah dikatakan tidak memiliki kerja atau kalor. Oleh karena itu kerja dan kalor dipengaruhi oleh proses perubahan sistem, sehingga kerja dan kalor disebut fungsi jalan.
Selain itu, perubahan variabel-variabel intensif/ekstensif tersebut akan menyebabkan perubahan energi tertentu dalam sistem, yaitu energi dalam (U), entalpi (H), entropi (S), energi bebas
Gibbs (G), dan atau energi bebas Helmholtz (A). Kelompok energi ini
tidak dapat diukur secara langsung, tapi hanya dapat diketahui besar perubahannya (∆U, ∆H, ∆S, ∆G, atau ∆Anya) berdasarkan keadaan awal dan akhir sistem sehingga kelompok energi ini disebut fungsi keadaan atau fungsi termodinamika.
E. Proses perubahan keadaan
Proses perubahan keadaan adalah cara suatu sistem berubah dari satu keadaan ke keadaan lain. Proses tersebut dapat dikelompokkan menjadi dua jenis, yaitu proses reversibel dan proses irreversibel. Proses reversibel adalah proses yang berlangsung sangat lambat, sehingga setiap saat sistem selalu berada dalam keadaan kesetimbangan (quasy-static = seolah-olah statis). Contoh:
H2O (l, 1000C, 1 atm) H2O (g, 1000C, 1 atm)
Reaksi ini memperlihatkan air dari fasa cair berubah menjadi air fasa gas kemudian balik lagi dari air fasa gas menjadi air fasa cair pada tekanan dan temperatur yang sama. Proses reversibel dapat terjadi pada temperatur tetap (isotermal), tekanan tetap (isobar), volume tetap (isokhorik), entropi tetap (isotrop), dan tidak ada pertukaran panas antara sistem dan lingkungan (adiabatik).
Proses reversibel sangat jarang terjadi, sebaliknya proses irreversibel adalah proses yang banyak terjadi di alam sekitar.
| Termodinamika Kimia
8
Proses irreversibel adalah proses yang tidak memenuhi syarat reversibel.
F. Kajian termodinamika kimia
Pada saat tertentu, proses perubahan suatu sistem kimia atau fisika akan mencapai keadaan statis, dimana perubahan total keadaan sistem sama dengan nol. Kondisi ini terjadi jika telah tercapai kesetimbangan termodinamika baik antara sistem dengan sistem atau sistem dengan lingkungan. Jenis kesetimbangan termodinamika yang dipelajari pada proses kimia adalah sebagai berikut:
1. Kesetimbangan termal yang terjadi jika temperatur sama pada setiap titik.
2. Kesetimbangan kimia yang terjadi jika reaksi kimia dari reaktan ke produk atau sebaliknya berlangsung dengan laju yang sama. 3. Kesetimbangan fasa yang terjadi jika perubahan antar fasa
berlangsung dengan laju dan jumlah materi yang sama.
Tiga kategori kesetimbangan termodinamika di atas merupakan objek kajian termodinamika kimia yang dipelajari berdasarkan hukum-hukum termodinamika. Hukum pertama termodinamika berkaitan dengan kesetimbagan termal, sedangkan hukum kedua dan ketiga termodinamika berkaitan dengan kesetimbangan kimia dan kesetimbangan fasa. Ketiga hukum termodinamika ini membantu kimiawan untuk:
1. Menentukan kondisi dimana reaksi kimia memungkinkan terjadi.
2. Mengatur dan menvariasikan besaran termodinamika sehingga diperoleh hasil reaksi yang diinginkan.
3. Memaksimalkan reaksi yang diinginkan atau menghambat reaksi yang tidak diinginkan jika reaksi kimia meliputi beberapa jalan.
4. Menentukan kondisi stabil reaktan dan produk yang terlibat dalam reaksi kimia.
Termodinamika Kimia|
9
G. Fasa zat sistem kimia/fisika
Materi sebagai objek kajian termodinamika dikelompokkan ke dalam 3 jenis fasa. Masing-masing fasa tersebut memiliki pengaruh dan respon yang berbeda terhadap besaran termodinamika. Ketiga jenis fasa tersebut adalah sebagai berikut: 1. Padat
Gaya tarik antar partikel penyusun zat padat sangat kuat sehingga partikel-partikel tersebut hanya bergetar pada posisi yang sama dan tetap berada dalam satu kesatuan. Jarak antar partikel yang satu dengan partikel yang lain sangat rapat, sehingga rapatan atau densitasnya sangat besar. Sifat-sifat tersebut menyebabkan zat padat tidak terlalu terpengaruh oleh perubahan variable-variabel sistem seperti perubahan temperatur atau tekanan. 2. Cair
Gaya tarik antar partikel penyusun zat cair kurang kuat sehingga partikel-partikel tersebut bisa bergerak bebas dan tumpang tindih dengan partikel-partikel yang lain. Sifat-sifat tersebut menyebabkan bentuk zat cair, seperti air, minyak tanah, bensin, dan lain-lain bisa mengalir dan berubah-ubah sesuai dengan wadah yang ditempatinya. Akan tetapi, gaya tarik antar partikelnya masih relatif kuat untuk menahan partikel-partikel tersebut tetap dalam satu kesatuan, sehingga meskipun bentuknya dapat berubah-ubah, pada tekanan dan temperatur yang sama volume zat cair tetap tidak berubah.
3. Gas
Gas adalah fasa zat yang berbeda dengan dua jenis fasa sebelumnya. Gaya tarik antar partikelnya sangat lemah sehingga jarak antar partikelnya berjauhan, densitasnya sangat kecil, dan menyebabkan partikel-partikel tersebut dapat bergerak bebas. Perilaku ini menyebabkan gas memiliki sifat unik yang mudah diamati, antara lain:
| Termodinamika Kimia
10
a. Volume dan bentuk sistemnya sesuai wadah.
b. Gerak partikelnya cepat dan bebas serta memberikan tekanan ke dinding wadah. Semakin banyak partikel-partikel gas, tekanan sistemnya semakin besar.
c. Gas dapat ditekan dengan tekanan dari luar yang menyebabkan volume sistemnya menyusut. Jika tekanan luar tersebut dikurangi, volumenya akan mengembang kembali.
d. Jika temperatur sistem gas bertambah, maka volumenya bertambah dan sebaliknya jika dikurangi, volumenya akan menyusut.
e. Jika dua atau lebih zat berfasa gas dicampur pada wadah yang sama, partikel-partikel masing-masing gas tersebut akan terdistribusi merata.
Sifat-sifat gas yang telah diuraikan di atas menunjukkan bahwa gas merupakan sistem kimia/fisika yang sangat dipengaruhi oleh perubahan volume, tekanan, temperatur, dan jumlah partikel. Variable-variabel tersebut saling mempengaruhi. Jika salah satu variable diubah, maka beberapa variabel yang lain akan berubah. Untuk mengetahui hubungan antar variabel-variabel tersebut dan bagaimana variabel-variabel tersebut melibatkan fungsi jalan dan mempengaruhi fungsi keadaan, kajian tentang termodinamika lebih difokuskan pada sistem gas.
Gambaran ketiga jenis fasa zat sistem kimia/fisika sebagaimana dijelaskan di atas dapat dilihat pada gambar 1.3.
Termodinamika Kimia|
11 Gambar 1.3. Wujud dan susunan partikel fasa zat
Soal Latihan
1. Tuliskan beberapa contoh proses kimia atau fisika yang terjadi dalam sistem terbuka, sistem tertutup, dan sistem terisolasi! 2. Tuliskan beberapa contoh persamaan keadaan!
3. Berikan contoh dan alasan bahwa perubahan tekanan tidak terlalu berpengaruh terhadap padatan dan cairan!
Termodinamika Kimia|
13
PERSAMAAN
KEADAAN GAS
A. Hukum-hukum gas
Gas merupakan jenis fasa sistem yang sangat dipengaruhi oleh variabel-variabel sistem, seperti volume, tekanan, temperatur, dan jumlah partikel. Variabel-variabel tersebut saling mempengaruhi. Jika salah satu variable diubah, maka beberapa variabel yang lain akan berubah. Salah satu teknik yang sering dipakai untuk menurunkan hubungan antara variabel-variabel tersebut adalah dengan menjaga salah satu variabel tetap konstan. Misal, untuk mengetahui hubungan antara temperatur dan tekanan gas, maka volume dan jumlah partikelnya harus konstan. Demikian pula, untuk mengetahui hubungan antara temperatur dan volume gas maka tekanan dan jumlah partikelnya harus konstan.
1. Hubungan antara volume dan tekanan (hukum Boyle)
Robert Boyle (1627-1691) melakukan eksperimen untuk
menyelidiki hubungan kuantitaif antara tekanan dan volume sistem gas. Eksperimen ini dilakukan dengan memasukkan sejumlah gas tertentu ke dalam wadah tertutup. Sampai pada pendekatan yang cukup baik, Boyle menyimpulkan bahwa jika temperatur sistem dijaga konstan (isotermal), maka dengan menambah tekanan sistem, volume sistem akan berkurang. Demikian pula sebaliknya dengan mengurangi tekanan sistem, volume sistem akan bertambah.
| Termodinamika Kimia
14
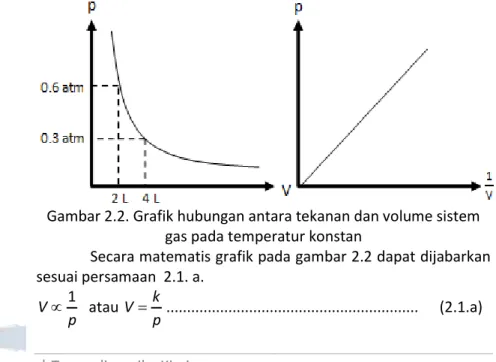
Gambaran mengenai eksperimen Robert Boyle dapat dilihat pada gambar 2.1. Secara sederhana dapat disimpulkan bahwa pada temperatur konstan, tekanan sistem gas berbanding terbalik dengan volumenya sebagaimana digambarkan dengan grafik pada gambar 2.2. Hubungan ini dikenal sebagai hukum Boyle.
Gambar 2.1. Hubungan antara tekanan dan volume sistem gas pada temperatur konstan
Gambar 2.2. Grafik hubungan antara tekanan dan volume sistem gas pada temperatur konstan
Secara matematis grafik pada gambar 2.2 dapat dijabarkan sesuai persamaan 2.1. a. p V1 atau p k V ... (2.1.a)
Termodinamika Kimia|
15 Persamaan 2.1.a memperlihatkan bahwa hasil kali antara p dan V sejumlah gas tertentu pada temperatur konstan adalah sebuah tetapan. Sehingga untuk keadaan 1 dan 2 dapat dirumuskan sesuai persamaan 2.1.b. (tetapan) k pV 2 2 1 1V pV p ... (2.1.b) Jika persamaan 2.1.a diturunkan terhadap p dimana T dan n konstan, akan diperoleh persamaan 2.1.c.
2 , p k p V n T ... (2.1.c) Substitusi nilai k persamaan 2.1.c dengan nilai k dari persamaan 2.1.b menghasilkan persamaan 2.1.d. p V p V n T , ... (2.1.d)
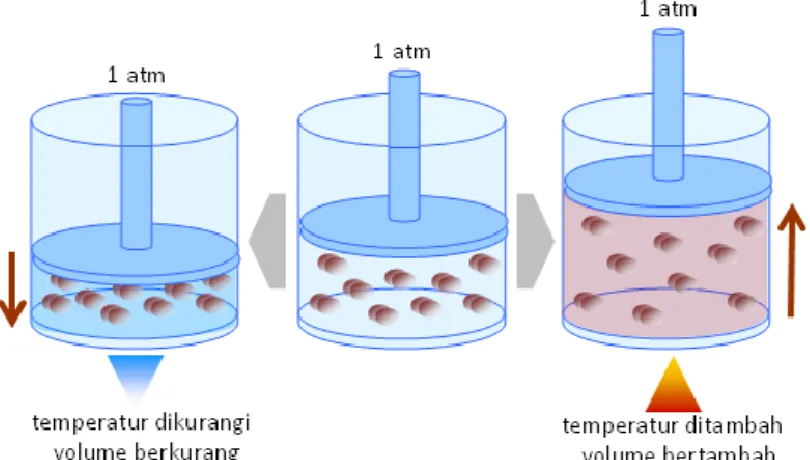
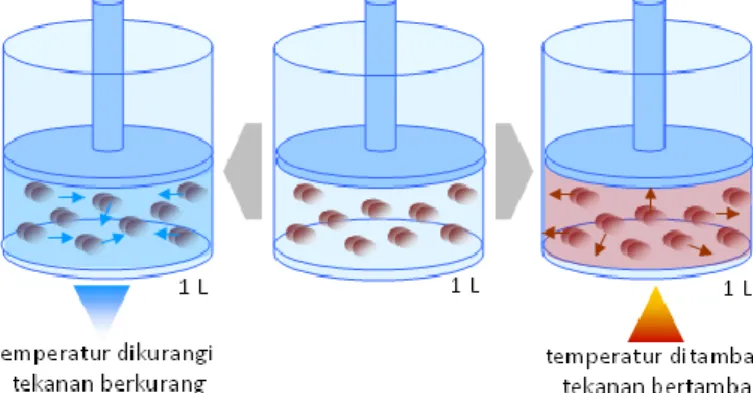
2. Hubungan antara volume dan temperatur (hukum Charles) Beberapa tahun setelah Boyle menemukan hubungan antara volume dan tekanan, seorang ilmuwan berkebangsaan Prancis yang bernama Jacques Charles (1746-1823) menyelidiki hubungan antara volume dan temperatur gas. Berdasarkan hasil eksperimennya, Charles menemukan bahwa apabila tekanan sistem gas konstan, maka dengan menaikkan temperatur sistem, volume sistem juga akan bertambah. Sebaliknya dengan menurunkan temperatur sistem, volume sistem juga akan berkurang.
Gambaran mengenai penemuan Jacques Charles dapat dilihat pada gambar 2.3. Secara sederhana dapat disimpulkan bahwa pada tekanan konstan, temperatur sistem gas berbanding lurus dengan volumenya sebagaimana digambarkan dengan grafik pada gambar 2.4. Hubungan ini dikenal sebagai hukum Charles.
| Termodinamika Kimia
16
Gambar 2.3. Hubungan antara volume dan temperatur sistem gas pada tekanan konstan
Gambar 2.4. Grafik hubungan antara temperatur dan volume sistem gas pada tekanan konstan
Apabila garis pada grafik gambar 2.4 digambarkan sampai temperatur yang lebih rendah maka garis akan memotong sumbu di sekitar -273,15 oC. Berdasarkan banyak eksperimen yang telah dilakukan, ditemukan bahwa walaupun besarnya perubahan volume setiap jenis gas berbeda-beda, tetapi ketika garis pada grafik V-T digambarkan sampai temperatur yang lebih rendah maka garis selalu memotong sumbu di sekitar -273,15 oC. Secara
Termodinamika Kimia|
17 -273,15 oC maka volume gas = 0. Oleh karena itu, temperatur
-273,15 oC adalah temperatur terendah yang bisa dicapai dan ditetapkan sebagai temperatur nol mutlak dalam satuan Kelvin (K).
Jarak skala Kelvin sama dengan jarak skala Celcius dimana 0 K = -273,15 oC atau 273,15 K = 0oC. Temperatur dalam skala Celcius (biasanya disimbol t) dapat diubah menjadi skala Kelvin (biasanya disimbol T) dengan menambahkan 273,15 dan sebaliknya temperatur dalam skala Kelvin dapat diubah menjadi skala Celcius dengan mengurangi 273,15. Perhitungan dalam termodinamika selalu menggunakan temperatur mutlak yang dinyatakan dalam skala Kelvin. Apabila temperatur masih dalam skala Celcius, maka harus diubah terlebih dahulu ke dalam skala Kelvin.
Secara matematis hubungan antara volume dan temperatur pada tekanan sistem konstan dapat dijabarkan sesuai dengan persamaan 2.2.
T
V atau VkT ... (2.2.a) Persamaan 2.2.a memperlihatkan bahwa perbandingan antara V dan T sejumlah gas tertentu pada tekanan konstan adalah sebuah tetapan. Sehingga untuk keadaan 1 dan 2 dapat dirumuskan sesuai persamaan 2.2.b. (tetapan) k T V 2 2 1 1 T V T V ... (2.2.b) Jika persamaan 2.2.a diturunkan terhadap T dimana p dan n konstan, akan diperoleh persamaan 2.2.c.
k T V n p , ... (2.2.c) Substitusi nilai k persamaan 2.2.c dengan nilai k dari persamaan 2.2.b menghasilkan persamaan 2.2.d. T V T V n p , ... (2.2.d)
| Termodinamika Kimia
18
3. Hubungan antara tekanan dan temperatur (hukum Gay Lussac)
Joseph Gay Lussac (1778-1850) menemukan bahwa apabila
volume sistem gas dijaga konstan, maka dengan menambah temperatur sistem, tekanan sistem juga akan bertambah. Demikian juga sebaliknya jika temperatur sistem dikurangi, tekanan sistem juga akan berkurang.
Gambaran mengenai penemuan Joseph Gay Lussac dapat dilihat pada gambar 2.5. Secara sederhana dapat disimpulkan bahwa pada volume konstan, tekanan sistem gas berbanding lurus dengan temperaturnya. Hubungan ini dikenal sebagai hukum Gay
Lussac.
Gambar 2.5. Hubungan antara temperatur dan tekanan sistem gas pada volume konstan
Secara matematis hubungan antara tekanan dan temperatur sistem gas pada volume konstan dapat dijabarkan sesuai persamaan 2.3.
T p atau
kT
p ... (2.3.a) Persamaan 2.3.a memperlihatkan bahwa perbandingan antara V dan T sejumlah gas tertentu pada tekanan konstan adalah sebuah tetapan. Sehingga untuk keadaan 1 dan 2 dapat dirumuskan sesuai persamaan 2.3.b.
Termodinamika Kimia| 19 (tetapan) k T p 2 2 1 1 T p T p ... (2.3.b) Gabungan antara persamaan 2.3.b dengan persamaan 2.2.b menghasilkan persamaan baru untuk sistem gas pada jumlah tertentu sesuai persamaan 2.3.c.
2 2 2 1 1 1 T V p T V p ... (2.3.c) Contoh Soal
Pada tekanan atmosfir (101 kPa), temperatur gas karbondioksida adalah 20 oC dan volumenya adalah 2 liter. Apabila tekanan diubah menjadi 201 kPa dan temperatur dinaikkan menjadi 40
o
C, hitung volume akhir gas karbondioksida tersebut!
Jawab:
Dik: P1 = 101 kPa Dit: V2 = ...L P2 = 201 kPa T1 = 20 oC + 273 K = 293 K T2 = 40 oC + 273 K = 313 K V1 = 2 liter Penyelesaian: 2 1 2 1 1 2 2 2 2 1 1 1 p T T V p V T V p T V p
L kPa K K L kPa 06 . 1 201 293 313 2 101 | Termodinamika Kimia
20
Latihan Soal
Gay Lussac menemukan bahwa volume gas pada tekanan tetap
dapat dinyatakan sebagai V = Vo(1+aot) dimana Vo adalah volume
pada saat 0oC, t adalah temperatur pada skala derajat Celcius, dan
ao adalah sebuah tetapan. Hitung harga ao menggunakan
persamaan 3.2.b!
(ao = 3.66 x 10-3oC-1) 4. Hubungan antara volume dan jumlah partikel (hukum
Avogadro)
Sejauh ini telah ditinjau hubungan antara temperatur, volume, dan tekanan sistem gas. Massa atau jumlah partikel dalam sistem gas belum dibahas. Setiap sistem kimia/fisika selalu melibatkan zat dalam jumlah tertentu. Satuan jumlah yang sering dipakai dalam sistem termodinamika adalah satuan mol, dimana satu mol zat memiliki 6.02 x 1023 partikel. Bilangan ini disebut bilangan Avogadro (N).
Ketika meniup balon, semakin banyak udara yang dimasukkan, balon yang ditiup akan semakin mengembang. Dengan kata lain, semakin banyak partikel gas yang dimasukkan, semakin besar volume balon sebagaimana diperlihatkan pada gambar 2.6. Secara sederhana dapat disimpulkan bahwa pada temperatur dan tekanan yang tetap jumlah partikel berbanding lurus dengan volume gas. Pernyataan ini dikenal sebagai hukum Avogadro.
Gambar 2.6. Hubungan antara jumlah partikel dan volume sistem gas pada tekanan dan temperatur konstan
Termodinamika Kimia|
21 Secara matematis hubungan antara jumlah partikel dan volume sistem gas dapat dijabarkan sesuai persamaan 2.4.
n
V atau Vkn ... (2.4.a) Persamaan 2.4.a memperlihatkan bahwa perbandingan antara V dan n pada temperatur dan tekanan konstan adalah sebuah tetapan. Sehingga untuk keadaan 1 dan 2 dapat dirumuskan sesuai persamaan 2.4.b. (tetapan) k n V 2 2 1 1 n V n V ... (2.4.b) Jika persamaan 2.4.a diturunkan terhadap n dimana p dan T konstan, akan diperoleh persamaan 2.4.c.
k n V p T , ... (2.4.c) Substitusi nilai k persamaan 2.4.c dengan nilai k dari persamaan 2.4.b menghasilkan persamaan 2.4.d. n V n V p T , ... (2.4.d) Pada keadaan standar (tekanan 1 bar dan temperatur 273.15 K), volume 1 mol gas adalah 22.4 liter. Volume ini disebut
Volume Avogadro atau Volume Molar Gas (Vm), yaitu volume yang
ditempati gas tiap 1 mol. Volume molar gas selalu dinyatakan dalam tekanan dan temperatur tertentu.
5. Hubungan antara temperatur, volume, tekanan, dan jumlah partikel gas
Hukum Boyle, hukum Charles, hukum Gay Lussac, dan hukum Avogadro baru menurunkan hubungan antara temperatur, volume, tekanan, dan jumlah partikel gas secara terpisah. Bagaimanapun keempat variabel ini memiliki keterkaitan erat dan saling mempengaruhi. Karenanya, dengan berpedoman pada keempat hukum gas di atas, hubungan yang lebih umum antara
| Termodinamika Kimia
22
temperatur, volume, tekanan, dan jumlah partikel dapat dipadukan dalam satu persamaan.
Jika keempat hukum tersebut digabungkan akan diperoleh kesimpulan bahwa volume gas merupakan parameter yang dipengaruhi oleh tekanan, temperatur, dan jumlah partikel gas yang dinyatakan sebagai fungsi volume.
pT n
V , , ... (2.5) atau secara matematis dapat dituliskan sebagai diferensial parsial sesuai persamaan 3.6. dn n V dT T V dp p V dV p T n p n T, , , ... (2.6)
Substitusi persamaan 2.1.d, 2.2.d, dan 2.4.d ke dalam persamaan 2.6 kemudian dikalikan 1/V dan diintegralkan akan menghasilkan persamaan 2.7. dn n V dp p V dT T V dn n V dp p V dT T V dV T p n T n p , , ,
masing-masing ruas dikalikan 1/V, maka diperoleh:
dn n dp p dT T dn n V V dp p V V dT T V V dV V 1 1 1 1 1 1 1
masing-masing ruas diintegralkan, maka diperoleh:
1 2 3 4
4 3 2 1 ln ln ln ln ln ln ln ln 1 1 1 1 C C C C n p T V C n C p C T C V dn n dp p dT T dV V
dimana
-C1C2-C3C4
adalah sebuah konstanta dan dapat dituliskan sebagai ln R, sehingga persamaan di atas menjadi:Termodinamika Kimia| 23 nRT pV T R n V p atau R n T p V ln ln ln ln ln ln ln ln ln ln ln ln nRT pV ... (2.7) Untuk memudahkan penggunaannya, persamaan 2.7 dapat
dinyatakan dengan menggunakan variabel volume molar (Vm), yaitu volume sistem per satu mol gas sesuai persamaan 2.8.
RT
pVm ... (2.8)
B. Gas ideal
Perlu diketahui bahwa hukum Boyle, hukum Charles, hukum Gay Lussac, dan hukum Avogadro hanya memberikan hasil yang akurat pada tekanan rendah dan temperatur tinggi. Pada kondisi normal atau kondisi sebaliknya, hanya sedikit gas yang memenuhi hukum ini. Hampir semuanya memberikan penyimpangan. Berdasarkan kenyataan ini, hukum Boyle, hukum Charles, hukum Gay Lussac, dan hukum Avogadro yang telah diformulasikan pada persamaan 2.7 tidak bisa diterapkan untuk semua jenis dan kondisi gas.
Selain itu, kondisi yang disyaratkan oleh persamaan tersebut (tekanan rendah dan temperatur tinggi) adalah kondisi yang sangat jarang dipakai, sementara kebutuhan terhadap persamaan tersebut sangat penting untuk mempelajari keadaan sistem pada berbagai kondisi. Berdasarkan hal tersebut, disepakati bahwa persamaan 2.7 dapat digunakan jika sistem gas yang dianalisis dipostulatkan sebagai gas ideal dan oleh karena itu persamaan 2.7 disebut sebagai persamaan keadaan gas ideal.
Gas ideal adalah gas yang dipostulatkan bahwa partikel-partikelnya tidak memiliki interaksi atau gaya tarik menarik dan tolak menolaknya sama dengan nol. Selain itu, volume partikel-partikelnya yang sangat kecil diabaikan, sehingga volume sistem yang dianalisis adalah volume wadahnya. Pada kenyataannya tidak ada gas yang mutlak bersifat seperti itu. Sebagai contoh, jika gas
| Termodinamika Kimia
24
tidak memiliki gaya tarik-menarik, maka tidak mungkin untuk memampatkan gas menjadi cair, seperti nitrogen cair. Oleh karena itu, hasil analisis menggunakan persamaan gas ideal hanyalah sebuah pendekatan.
Jika suatu gas dipostulatkan bersifat ideal maka perbandingan pV Tpada jumlah tertentu akan selalu tetap sebagai sebuah tetapan sesuai persamaan 2.7. Hasil eksperimen dan perhitungan 1 mol gas pada keadaan standar menghasilkan tetapan tersebut sebesar 0,08206 L atm mol-1 K-1 yang selanjutnya dikenal sebagai tetapan gas ideal dan disimbol R. Tetapan R dalam beberapa bentuk satuan dilihat pada tabel 1 apendiks C.
Contoh Soal
Suatu sampel udara menempati 1,0 L pada 25˚C dan 1 atm. Dengan menggunakan persamaan gas ideal, tentukan berapa tekanan yang diperlukan untuk memampatkan sampel tersebut menjadi 100 cm3? Jawab: Dik: V1 = 1 L V2 = 100 cm3 = 0.1 dm3 = 0.1 L T = 25 0C = 298 K p1 = 1 atm Dit: p2 = ... atm Penyelesaian:
Persamaan gas ideal yang dimaksud adalah pV = nRT dimana untuk dua keadaan, nilai R sistem sama, sehingga diperoleh:
atm p p x V p V p T T dan n n T n V p T n V p 10 1 . 0 1 1 . 0 1 1 so , dimana 2 2 2 2 1 1 2 1 2 1 2 2 2 2 1 1 1 1
Termodinamika Kimia|
25 Latihan Soal
Buktikan berdasarkan persamaan gas ideal: a. T T V V pn 1 1 , b. p p V V Tn 1 1 ,
C. Gas real
Untuk mengatasi kelemahan persamaan gas ideal dibutuhkan persamaan gas yang lain, yaitu persamaan gas real. Gas real atau gas nyata adalah kondisi gas yang sebenarnya, yaitu gas yang ada dalam kehidupan sehari-hari. Partikel-partikelnya memiliki gaya tarik menarik dan tolak menolak, terutama pada tekanan tinggi. Selain itu, volume sistem gas real dipengaruhi pula oleh volume partikel-partikelnya.
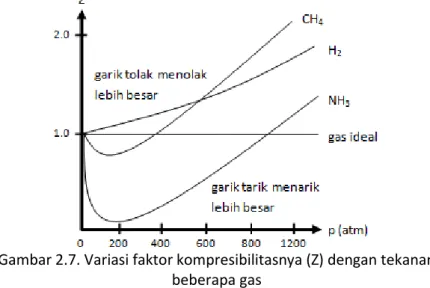
Secara empiris, untuk menyatakan suatu gas bersifat ideal atau real dapat dilakukan dengan menggunakan faktor kompresibilitasnya (Z), kemampuan untuk dimampatkan, yang dirumuskan pada persamaan 2.9.
nRT pV
Z ... (2.9) Jika nilai Z suatu gas sama dengan 1 (Z =1), maka gas tersebut bersifat ideal. Sebaliknya, jika nilai Z suatu gas tidak sama dengan 1 (Z ≠ 1), maka gas bersifat tidak ideal atau gas real. Gas real dengan Z < 1 menunjukkan gas real tersebut sangat mudah dimampatkan menjadi cair karena gaya tarik menarik antar partikelnya lebih besar. Sebaliknya jika Z > 1, gas real tersebut kurang kompresibel atau sulit dimampatkan karena gaya tolak menolak antar partikelnya lebih besar.
| Termodinamika Kimia
26
Gambar 2.7. Variasi faktor kompresibilitasnya (Z) dengan tekanan beberapa gas
Bila digambarkan grafik Z versus p pada temperatur konstan akan diperoleh grafik lurus untuk gas ideal dan grafik melengkung untuk gas real seperti ditunjukkan gambar 2.7. Besarnya simpangan garis lengkung gas real tersebut dari garis lurus gas ideal tergantung pada jenis gas. Gambar 2.7 memperlihatkan bahwa pada tekanan di bawah 400 atm, grafik gas CH4 berada di bawah garis lurus gas ideal (Z < 1), sehingga dikatakan gas CH4 lebih mudah dimampatkan (lebih kompresibel) dibandingkan gas ideal di bawah tekanan tersebut. Sebaliknya, grafik gas H2 selalu di atas garis lurus gas ideal (Z > 1), sehingga dikatakan gas H2 lebih sulit dimampatkan (kurang kompresibel) dibandingkan gas ideal pada semua rentang tekanan. Semua gas akan memiliki mendekati kondisi ideal pada tekanan mendekati nol.
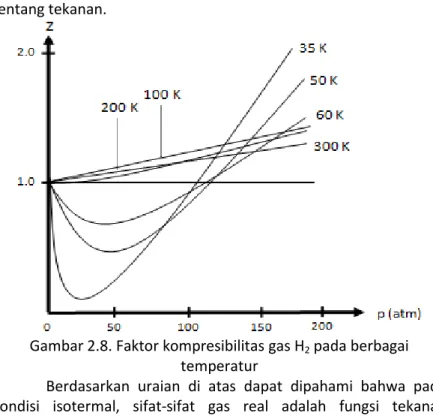
Gambar 2.8 memperlihatkan grafik Z versus p gas H2 pada berbagai variasi temperatur. Pada temperatur 35, 50, dan 60 K, grafik gas H2 berada di bawah garis lurus gas ideal pada tekanan rendah dan berada di atas garis lurus gas ideal pada tekanan yang lebih tinggi. Jika temperatur terus dinaikkan di atas 100 K, grafik gas
Termodinamika Kimia|
27 H2 akan selalu berada di atas garis lurus gas ideal pada semua
rentang tekanan.
Gambar 2.8. Faktor kompresibilitas gas H2 pada berbagai temperatur
Berdasarkan uraian di atas dapat dipahami bahwa pada kondisi isotermal, sifat-sifat gas real adalah fungsi tekanan (termasuk volume). Kesimpulan ini menjadi alasan untuk menyusun persamaan yang baru untuk gas real dengan memperhatikan tekanan dan volume sistemnya. Beberapa persamaan yang dapat digunakan untuk gas real adalah sebagai berikut:
1. Persamaan van der Waals
Pada tahun 1873, Van der Waals memberikan koreksi
terhadap volume dan tekanan pada persamaan gas ideal (pV = nRT). Volume memerlukan koreksi karena volume sistem
yang sebenarnya harus dijumlahkan dengan volume yang ditempati oleh partikel-partikel gas. Pada gas ideal volume partikel ini diabaikan, karena nilainya yang terlalu kecil. Besarnya volume partikel-partikel tersebut ditentukan oleh jenis dan jumlah gas yang
| Termodinamika Kimia
28
dirumuskan oleh Van der Waals sebesar bn dimana b adalah tetapan van der Waals untuk koreksi volume dan n adalah jumlah mol gas. Dengan demikian diperoleh volume sistem sebenarnya berdasarkan persamaan 2.10.
nb V
Vreal ideal ... (2.10)
Van der Waals juga memberikan koreksi terhadap tekanan
sistem gas ideal. Gaya tarik menarik partikel-partikel gas real menyebabkan benturan partikel-partikel tersebut ke dinding wadah semakin berkurang sehingga tekanan yang diberikan juga berkurang (gambar 2.9). Besarnya tekanan yang berkurang tersebut dirumuskan oleh Van der Waals sebesar 2
2
V an
, sehingga secara matematis tekanan gas yang sebenarnya sesuai persamaan 2.11.
2 2 V an p preal ideal ... (2.11) dimana a adalah tetapan van der Waals untuk koreksi tekanan yang berbeda untuk tiap gas. Cara menentukan tetapan van der Walls berkaitan dengan titik kritis akan dibahas pada subbab D.
Gambar 2.9. Efek gaya tarik menarik antar partikel-partikel gas terhadap tekanan sistem
Jika persamaan 2.10 dan 2.11 disubstitusi ke dalam persamaan gas ideal, akan diperoleh persamaan 2.12 yang disebut
Termodinamika Kimia| 29 nRT V pideal ideal
V nb
nRT V an preal real 22 ... (2.12) atau secara sederhana cukup dituliskan:
V nb
nRT V an p 22Persamaan van der Waals dapat ditata ulang menjadi persamaan pangkat tiga dengan merubah variable V menjadi volume molar (Vm), sehingga diperoleh persamaan 2.13.
b V RT V a p m m 2 ... (2.13) Jika persamaan 2.13 dimodifikasi ulang akan diperoleh persamaan pangkat tiga sesuai persamaan 2.14.
0 2 3 p ab V p a V p RT b Vm m m ... (2.14) Nilai tetapan van der Waals (a dan b) tergantung pada jenis gasnya. Nilai tetapan tersebut untuk beberapa jenis gas dapat dilihat pada tabel 11 apendiks.
Contoh Soal
Hitung volume molar CO2 pada 500 K dan 100 atm apabila
mengikuti persamaan Van der Waals jika diketahui a = 3.610 L2 atm mol-2 dan b = 4.29 x 10-2 Lmol-1!
Jawab:
Dik: T = 500 K; p = 100 atm; a = 3.610 L2 atm mol-2 b = 4.29 x 10-2 Lmol-1 Dit: Vm (Van der Waals)= ... L mol-1
Penyelesaian:
Persamaan Van der Waals dengan Vm:
b Vm RT Vm a p 2 1
| Termodinamika Kimia
30
Jika ditata ulang akan diperoleh persamaan pangkat tiga: 0 2 3 p ab Vm p a p RT b Vm Vm
Sehingga dapat diselesaikan:
0 100 100 100 500 08206 . 0 2 3 Vm 0.0429 x 3.610Vm 3.610x0.0429 Vm
Menyelesaikan persamaan pangkat 3 dengan cara praktis:
Misal diketahui persamaan pangkat 3 berikut:
o d cx bx
ax3 2
Maka untuk menentukan nilai x kita gunakan rumus praktis:
r p
q q
r p
p q q x3 2 2 3 3 2 2 3 dimana: a c r a ad bc p q a b p 3 ; 6 3 ; 3 2 3 Untuk soal di atas diperoleh:
00154869 . 0 0361 . 0 4532 . 0 1 d c b a
sehingga nilai p, q, dan r adalah:
0 00154869 . 0 0361 . 0 4532 . 0 2 3 Vm Vm Vm
Termodinamika Kimia| 31 012033 . 0 3 0361 . 0 3 149115 . 0 6 00154869 . 0 3 0361 . 0 4532 . 0 151067 . 0 6 3 151067 . 0 3 4532 . 0 3 3 2 3 a c r x x a ad bc p q a b p
Nilai p, q, dan r kita masukkan ke dalam rumus praktis, dan diperoleh:
1 3 2 2 3 3 2 2 3 3 2 2 3 3 2 2 3 83622 . 0 151067 . 0 151067 . 0 012033 . 0 149115 . 0 149115 . 0 151067 . 0 012033 . 0 149115 . 0 149115 . 0 Lmol p p r q q p r q q Vm Latihan Soal Gunakan persamaan Van der Waals untuk menghitung tekanan yang dihasilkan oleh 1 mol gas Cl2 ketika menempati volume 2 Lpada 273 K, jika diketahui a = 6.49 L2 atm mol-2 dan b = 0.0562 L mol-1!
(p = 9.90 atm) 2. Persamaan Virial
Kelemahan persamaan gas Van der Waals adalah ketidaktelitiannya menggambarkan perilaku gas pada tekanan tinggi. Suatu persamaan yang dapat menggambarkan perilaku gas pada tekanan tinggi adalah persamaan virial yang dikembangkan oleh Kammerlingh Onnes. Bentuk umum persamaan ini sesuai dengan persamaan 2.15.
| Termodinamika Kimia 32 1 2 3 ... m m m m V D V C V B RT pV ... (2.15) dengan B, C, D,... adalah koefisien virial kedua, ketiga, keempat, dan seterusnya. Koefisien ini merupakan fungsi temperatur dan bergantung pada jenis gas. Dalam bentuk lain persamaan ini dinyatakan pada persamaan 2.16.
1 ' ' 2 ' 3...
RT BP CP DP
pVm ... (2.16) dimana B’, C’, D’, dan seterusnya adalah fungsi temperatur.
Nilai koefisifien virial kedua, ketiga, keempat dan seterusnya dapat ditentukan dengan cara membandingkan persamaan 2.15 dengan persamaan van der Waals, yang keduanya dinyatakan dalam bentuk fungsi Z terhadap volume. Jika suku yang lebih tinggi diabaikan, maka fungsi Z persamaan 2.15 dapat dinyatakan dalam persamaan 2.17.
2 1 m m m V C V B RT pV Z ... (2.17) Dengan cara yang sama, fungsi Z untuk persamaan Van der
Waals dinyatakan dalam persamaan 2.18
m m m RTV a V b RT pV Z 1 1 ... (2.18)
Pada tekanan rendah nilai
m
V
b lebih kecil dari satu, sehingga suku
pertama pada ruas kanan persamaan 2.18 dapat diselesaikan dengan menggunakan deret. Dalam deret dinyatakan bahwa bila x lebih kecil dari satu, maka:
... 1
1
1 2 3
x x x x
Termodinamika Kimia| 33 ... 1 ... 1 2 2 m m m m m m V b RTV a V b RTV a V b V b Z 1 1 ... 2 m m V b V RT a b ... (2.19) Dengan membandingkan persamaan 2.17 dan 2.19, diperoleh:
RT a b
B dan Cb2
Konstanta virial kedua (B) beberapa gas dapat dilihat pada tabel 10 apendiks C.
3. Persamaan Beattie-Bridgeman
Persamaan lain yang cukup teliti adalah persamaan keadaan Beattie-Bridgeman yang dirumuskan dalam bentuk persamaan virial sesuai persamaan 2.20.
3 2 m m m m V V V RT pV ... (2.20) dengan β, γ, dan δ masing-masing adalah:
Dengan demikian terlihat bahwa persamaan Beattie-Bridgeman memiliki lima tetapan selain R, yaitu: A0, a, B0. b, dan c.
4. Persamaan Berthelot
Persamaan yang teliti pada tekanan rendah (sekitar 1 atm atau lebih rendah) adalah persamaan Berthelot sebagaimana dinyatakan pada persamaan 2.21.
2 m m TV a b V RT p ... (2.21) 3 0 T bc B RT 0 03 0 T c B RT a A b B RT 0 3 0 T c RT A B RT
| Termodinamika Kimia
34
dimana a dan b disebut parameter Berthelot. Nilai parameter a dan b persamaan ini untuk beberapa gas dapat dilihat pada tabel 12 apendiks C.
Persamaan Berthelot yang lebih akurat dengan melibatkan tekanan kritis (pc) dan temperatur kritis (Tc) dinyatakan pada
persamaan 2.22. Persamaan ini sering digunakan untuk menghitung volume dan massa molekul relatif gas.
1 6 22 128 9 1 T T T p pT V RT p c c c m ... (2.22) 5. Persamaan Redlich-Kwong
Modifikasi persamaan Van der Waals yang lebih akurat dengan melibatkan beberapa turunan diperoleh Otto Redlich dan
Neng Shun Kwong sebagaimana dinyatakan pada persamaan 2.23.
V b
V T a b V RT p m m m 1/2 ... (2.23) Persamaan ini disebut persamaan Redlich-Kwong dimana a dan b disebut parameter Redlich-Kwong yang nilainya ditentukan berdasarkan persamaan 2. 24 dan 2.25.c 2 / 5 2 p 4275 . 0 R Tc a ... (2. 24) c p 08664 . 0 b RTc ... (2.25)
Nilai parameter a dan b persamaan ini untuk beberapa gas dapat dilihat pada tabel 13 apendiks C.
Persamaan Redlich-Kwong sangat akurat jika perbandingan tekanan normal dan tekanan kritis gas kurang dari setengah perbandingan temperatur normal dan temperatur kritis (p/pc < T/2Tc).
Termodinamika Kimia|
35 6. Persamaan Dietrici
Persamaan keadaan lain yang memperhitungkan interaksi dan ukuran volume partikel adalah persamaan Dietrici sebagaimana dinyatakan pada persamaan 2.26.
RT V a m m e b V RT p ... (2.26) dimana a dan b disebut parameter Dietrici. Nilai parameter a dan b persamaan ini untuk beberapa gas dapat dilihat pada tabel 14 apendiks C.
Contoh Soal
Diketahui koefisien virial untuk uap isopropanol pada 200C adalah B = 388 cm3 mol1 dan C = 26.000 cm6 mol2. Hitung Z dan V dari uap isopropanol pada 200C dan 10 bar dengan menggunakan persamaan:
a. Persamaan keadaan gas ideal
b. Persamaan keadaan virial dengan 2 suku c. Persamaan keadaan virial dengan 3 suku
Jawab:
Dik: T = 200C = 473.15 K R = 83.14 cm3 bar mol1 K1 Dit: Z = ... V = ... L Penyelesaian:
a. Persamaan keadaan gas ideal Z = 1
3.934 3 1 10 15 , 473 14 , 83 cm mol P RT Vb. Persamaan keadaan virial dengan 2 suku
RT BP RT PV Z 1
83.14
473.15
0.9014 546 . 3 10 RT PV Z| Termodinamika Kimia 36
388 3.546 3 1 10 15 , 473 14 , 83 B cm mol P RT Vc. Persamaan keadaan virial dengan 3 suku 2 1 V C V B RT PV Z 1 2 V C V B P RT V
Persamaan diselesaikan secara iteratif:
1 1 2 i i i V C V B P RT V Iterasi 1: 2 0 0 1 1 V C V B P RT V
Sebagai tebakan awal digunakan V0 = Vgas ideal = 3.934 539 . 3 934 . 3 000 . 26 934 . 3 388 1 934 . 3 2 1 V Iterasi 2: 2 1 1 2 1 V C V B P RT V 495 . 3 539 . 3 000 . 26 539 . 3 388 1 934 . 3 2 2 V
Iterasi diteruskan sampai selisih antara Vi+1 Vi sangat kecil. Setelah iterasi ke 5 diperoleh hasil : V = 3.488 cm3 mol1 dan Z = 0.8866.
Latihan Soal Perkirakan koefisien a dan b dalam persamaan keadaan Dieterici dari konstanta kritis Argon. Hitung tekanan yang dilakukan gas tersebut sebanyak 1 mol pada ruang 1 L bertemperatur 25 oC!
Termodinamika Kimia|
37
D. Isotherm gas dan titik kritis
Hubungan antara tekanan dan volume pada temperatur konstan telah digambarkan oleh hukum Boyle sebagai kurva yang berbanding terbalik. Menurut hukum Boyle, kurva isotherm tekanan volume tersebut berbentuk hiperbola, seperti ditunjukkan gambar 2.10.
Gambar 2.10. Kurva isoterm gas ideal pada berbagai temperatur Semakin tinggi temperatur, hubungan antara p dan V mendekati garis lurus. Kurva ini digunakan untuk meramalkan volume sistem jika tekanan dirubah atau sebaliknya tekanan sistem jika volume dirubah. Asumsi yang digunakan adalah semakin tinggi tekanan sistem, maka volume akan semakin kecil atau sebaliknya, sebagaimana telah dijelaskan pada subbab hukum-hukum gas.
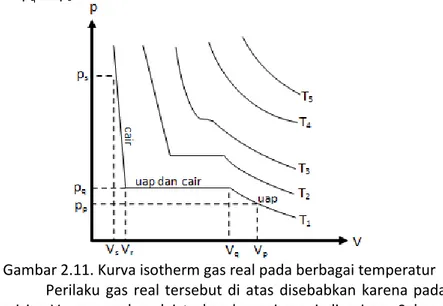
Namun, tetap harus dipahami bahwa kondisi ini hanya berlaku untuk gas ideal yang mengasumsikan bahwa partikel-partikel gas tidak memiliki gaya tarik menarik atau tolak menolak. Pada gas real, kurva isotherm tekanan dan volume sistem memiliki bentuk yang berbeda seperti ditunjukkan pada gambar 2.11. Misalkan suatu gas real pada ppVp temperaturnya dibiarkan konstan pada T1, kemudian secara perlahan volumenya diturunkan dari Vp ke Vq, maka tekanannya akan meningkat dari pp ke pq. Jika volumenya dikurangi lagi dari Vq ke Vr, ternyata tekanannya tidak berubah, tetap dengan pq. Akan tetapi, jika volumenya diturunkan
| Termodinamika Kimia
38
sedikit dari Vr ke Vs, maka tekanannya akan berubah sangat ekstrim dari pq ke ps.
Gambar 2.11. Kurva isotherm gas real pada berbagai temperatur Perilaku gas real tersebut di atas disebabkan karena pada posisi pqVq, gas real mulai terkondensasi menjadi cairan. Selama proses ini terjadi, tekanan sistem tidak berubah karena proses tersebut menyebabkan terjadinya kesetimbangan cair-uap. Proses ini terjadi hingga Vr, saat semua partikel gas telah terkondensasikan. Jika volume sistem dirubah dari Vr ke Vs, maka tekanan sistem akan berubah sangat ekstrim karena cairan hampir tidak dapat ditekan.
Perilaku tersebut akan terjadi pula pada temperatur yang lebih tinggi dengan garis kesetimbangan yang lebih pendek hingga garis kesetimbangan tersebut menjadi sebuah titik seperti pada T3. Jika temperatur terus ditingkatkan, maka perilaku gas real akan mirip dengan perilaku gas ideal. Titik dimana permukaan uap dan cair yang berada dalam kesetimbangan tidak dapat dibedakan lagi disebut titik kritis. Temperatur, tekanan, dan volume pada titik tersebut disebut temperatur kritis (Tc), tekanan kritis (pc), dan volume kritis (Vc). Temperatur dan tekanan kritis beberapa gas dapat dilihat pada tabel 9 apendiks.
Termodinamika Kimia|
39 Jika perilaku gas real diterapkan pada gas Van der Waals maka akan diperoleh kurva sesuai gambar 2.12. Bentuk kurva ini berdasarkan pada persamaan Van der Waals yang merupakan persamaan pangkat tiga, sehingga kurvanya memiliki puncak dan lembah.
Gambar 2.12. Kurva isotherm gas Van der Waals pada berbagai temperatur
Jika volume suatu gas pada T1 diturunkan secara bertahap maka tekanan akan sampai ke titik D. Pada titik ini, kondensasi mulai terjadi, akan tetapi fase cair tidak terbentuk sehingga tekanan akan meningkat hingga titik C. Kondisi ini menyebabkan tekanan gas di atas tekanan uap kesetimbangan (pk), sehingga bagian ini disebut supersaturated/supercooled uap. Dengan cara yang sama, jika volume suatu gas pada T1 dinaikkan secara bertahap maka tekanan akan sampai ke titik A. Pada titik ini, penguapan mulai terjadi, akan tetapi fase uap tidak terbentuk sehingga tekanan akan turun hingga titik B. Kondisi ini menyebabkan tekanan gas di bawah tekanan uap kesetimbangan (pk), sehingga bagian ini disebut superheated liquid. Keadaan
supersaturated dan superheated adalah keadaan metastable.
Garis BC pada gambar tersebut tidak mungkin diperoleh secara eksperimen karena lerengnya bernilai posistif. Tidak
| Termodinamika Kimia
40
mungkin secara eksperimen peningkatan tekanan akan menaikkan volume atau sebaliknya penurunan tekanan akan mengurangi volume. Oleh karena itu, bagian ini disebut unstable.
Seperti halnya sifat umum gas real, jika temperatur dinaikkan garis kesetimbangan akan mencapai titik kritis, dimana fasa cair dan uap tidak dapat lagi dipisahkan. Secara matematis, posisi titik kritis ini dapat diperkirakan menggunakan persamaan van der Waals. Pada saat titik kritis persamaan Van der Waals dapat ditulis sesuai persamaan 2.27.
2 c m c m c c V a b V RT p ... (2.27)
Pada titik kritis diketahui, 0 c T m dV dP dan 0 c T m dV dP , sehingga turunan persamaan 2.27 menghasilkan persamaan 2.28 dan 2.29
0 V ) -(V RT 3 m 2 m c Tc c c a dV dP m 2 b ... (2.28)
2
6 0 2 3 4 2 c c c m m c T m V a V RT dV P d b ... (2.29)Penyelesaian 2.27, 2.27, dan 23.29 menghasilkan:
Rb a b a b Vmc 27 8 T ; 27 p ; 3 c 2 c
dan tetapan van der Waals:
c m c m V V a 3 1 b dan p 3 2 c
E. Asas keadaan yang bersesuaian
Persamaan van der Waals terikat oleh jenis gas yang dianalisis karena melibatkan tetapan a dan b. Akan tetapi, persamaan ini dapat ditata ulang menjadi persamaan yang dapat digunakan untuk semua jenis gas. Jika nilai a, b, dan R yang diperoleh pada titik kritis disubstitusi ke persamaan Van der Waals akan dihasilkan persamaan 2.30.
Termodinamika Kimia| 41 2 2 3 3 3 8 m c m c c m m c c m c V V p V V T T V p p ... (2.30)
yang dapat ditata ulang menjadi persamaan 2.31.
2 3 1 3 8 c m m c m m c c V V V V T T p p ... (2.31)
Persamaan 2.31 mengandung variabel
c p p , c T T , dan c m m V V
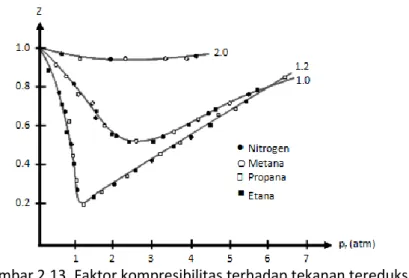
yang disebut variabel tereduksi, yaitu tekanan tereduksi disimbol pr, temperatur tereduksi disimbol Tr, dan volume tereduksi disimbol Vr. Dengan demikian, persamaan 2.31 menjadi lebih sederhana sesuai persamaan 2.32. 2 3 1 3 8 r r r r V V T p ... (2.32) Persamaan 2.32 bermakna jika dua atau lebih sistem gas mempunyai tekanan reduksi san temperatur reduksi yang sama, maka volume reduksinya juga akan sama. Pernyataan ini disebut asas keadaan yang bersesuaian. Aplikasi dari asas ini dapat dilihat pada grafik faktor kompresibilitas gas versus tekanan tereduksinya beberapa gas pada gambar 2.13. Gambar tersebut memperlihatkan keempat gas pada Tr yang sama mempunyai titik yang membentuk kurva yang sama.
| Termodinamika Kimia
42
Gambar 2.13. Faktor kompresibilitas terhadap tekanan tereduksi
F. Campuran gas
Persamaan keadaan gas tidak hanya berlaku pada sistem yang terdiri dari satu jenis gas saja, tetapi juga dapat digunakan untuk sistem campuran gas. Jika beberapa gas yang tidak saling bereaksi dicampur dalam satu wadah, masing-masing gas akan memberikan tekanan yang berbeda. Tekanan yang diberikan setiap gas disebut tekanan parsial. Besarnya tekanan parsial gas akan sama dengan tekanan gas itu jika sebagai gas murni dalam suatu wadah (gambar 2.14).
Gambar 2.14. Tekanan total sistem adalah kontribusi tekanan masing-masing komponen
Termodinamika Kimia|
43 Secara sederhana dapat dirumuskan bahwa tekanan total sistem campuran gas adalah jumlah tekanan parsial semua komponennya. Pernyataan ini dikenal sebagai hukum Dalton. Secara matematis, hukum Dalton dapat dituliskan sesuai persamaan 2.33. … + P + P = P Ptotal A B C ... (2.33)
dimana Ptotal adalah tekanan total gas, PA, PB, dan PC adalah tekanan parsial masing-masing komponen gas.
Tekanan parsial masing-masing gas dapat dihubungkan dengan tekanan total sistem menggunakan fraksi molnya. Misal untuk sistem yang terdiri dari gas A dan gas B.
RT n V p RT n V p B B A A
RT n V p RT n n V p p total total B A B A Maka besarnya tekanan parsial gas A (PA) dan B (PB) berdasarkan fraksi molnya adalah persamaan 2.34.
total A total A total A total A n n p p RT n RT n V p V p A total A X p p pA XAptotal ... (2.34.a) atau pBXBptotal ... (2.34.b) +
| Termodinamika Kimia
44
Contoh Soal
Suatu campuran gas terdiri dari 320 mg metana, 175 mg argon dan 225 mg nitrogen. Tekanan parsial nitrogen pada 300 K adalah 15,2 kPa.
a. Tentukan volume campuran gas tersebut! b. Tentukan tekanan total campuran gas tersebut!
Jawab:
Dik: Dit:
gas CH4 = 320 mg = 0.32 g a. V total = ... L gas Ar = 175 mg = 0.175 g b. p total = ... atm gas N2 = 225 mg = 0.225 g
p N2 = 15.2 kPa = 0.15 atm T = 300 K
Penyelesaian:
Langkah pertama: gambarkan terlebih dahulu
sistem ketiga gas:
Berdasarkan hukum Dalton: V total = VN2 = VAr = VCH4 p total = pN2 + pAr + pCH4
a. Volume total sistem adalah:
2 2 2 2 2 2 2 N N total N total N N N N p RT n V RT n V p RT n V p L x x 3187 . 1 15 . 0 300 08206 . 0 0080357 . 0
b. Untuk menentukan tekanan total sistem (ptotal), anda harus menghitung semua tekanan parsial masing-masing gas: