Makalah Diagram Fasa
Makalah Ini Disusun untuk Memenuhi Salah Satu Tugas Mata Kuliah
Material Teknik
Dosen : Rini Mulyani Sari, S.T., M.T.
Disusun oleh :
TRISHA RANITA BARUS
0516101062
FAKULTAS TEKNIK INDUSTRI
UNIVERSITAS WIDYATAMA
BANDUNG
2017
DAFTAR ISI DAFTAR ISI ...2 BAB I PENDAHULUAN 1.1 Latar Belakang ...3 1.2 Rumusan Masalah………3 1.3 Tujuan ...4 1.4 Manfaat ...4
BAB II LANDASAN TEORI 2.1 Dasar Teori ...5
2.2 Pengertian Diagram Fasa………..6
2.3 Informasi dan Perbedaan Garis yang Terdapat pada Diagram Fasa……....8
2.4 Klasifikasi dan Komposisi Penyusun Kesetimbangan Diagram Fasa……..9
2.5 Komponen terhadap Tekanan dan Temperatur Diagram Fasa…………...14
2.6 Sifat-sifat Termodinamika pada Diagram Fasa………...16
2.7 Pengertian Diagram Equilibrium (Diagram Kesetimbangan Fasa)……….16
2.8 Diagram Fasa Sistem Besi - Besi Karbida………..19
2.9 Perubahan Transformasi Dekomposisi Fasa Selama Pendinginan………..22
2.10 Diagram Fasa ( Diagram Keseimbangan ) ...25
2.11 Tipe Diagram Fasa ...27
2.12 Batas Daya Larut Padat Pada Logam ...30
2.13 Komposisi Fasa ...31
2.14 Kuantitas Fasa ...32
BAB III PENUTUP 3.1 KESIMPULAN………...43
3.2 SARAN………...44 DAFTAR PUSTAKA
BAB I PENDAHULUAN
1.1 Latar Belakang
Pengenalan bahan teknik mempelajari tentang material – material, cara pembuatan, penerapan di lapangan, dan juga teori-teori mengenai bahan teknik. Salah satunya adalah diagram fasa, dimana kita dapat mengetahui bahan-bahan pada fase liquid (cair), padat, atau gas. Fasa adalah bagian sistem dengan komposisi kimia dan sifat – sifat fisik seragam, yang terpisah dari bagian sistem lain oleh suatu bidang batas. Pemahaman perilaku fasa mulai berkembang dengan adanya aturan fasa Gibbs. Untuk sistem satu komponen, persamaan Clausius dan Clausisus – Clapeyron menghubungkan perubahan tekanan kesetimbangan dengan perubahan suhu.
Jika campuran dua cairan nyata (real) berada dalam kesetimbangan dengan uapnya pada suhu tetap, potensial kimia dari masing – masing komponen adalah sama dalam fasa gas dan cairnya. Sistem biner paling sederhana yang mengandung fasa padat dan cair ditemui bila komponen – komponennya saling bercampur dalam fas cair tetapi sama sekali tidak bercampur pada fasa padat, sehingga hanya fasa padat dari komponen murni yang akan keluar dari larutan yang mendingin.
Jika suatu larutan dari dua zat A dan B didinginkan sampai suhu yang cukup rendah, akan muncul suatu padatan. Suhu ini adalah titik beku larutan, yang bergantung pada komposisi.
1.2 Rumusan Masalah
Adapun rumusan masalahnya adalah sebagai berikut: 1. Apa pengertian diagram fasa?
2. Magaimana merbedaan garis terdapat pada diagram fasa?
3. Klasifikasi dan komponen penyusun kesetimbangan pada diagram fasa? 4. Bagaimana fasa larut sempurna dalam keadaan cair dan padat?
5. Komponen terhadap tekanan dan temperatur pada diagram fasa? 6. Sifat-sifat termodinamika pada diagram fasa?
7. Diagram equilibrium?
8. Diagram fasa sistem besi – besi kabrida?
1.3 Tujuan
Diharapkan mahasiswa memahami tentang diagram fasa, tahu cara membacanya dan lebih mengenal fase-fase zat yang ada di sekitar kita.
1.4 Manfaat
Setelah dilakukan penulisan diharapkan makalah ini dapat memiliki manfaat sebagai berikut :
Manfaat teoritis, dapat menberikan sumbangan ilmu pendidikan bagi
mahasiswa lainya dalam upaya meningkatkan pengetahuan mengenai Diagram Fasa.
Manfaat Praktis:
a. Bagi mahasiswa, dapat meningkatkan pengetahuan dan hasil belajar
dalam mata kuliah Material Teknik terutama dalam bidang Diagram Fasa. b. Bagi pengajar, dapat digunakan sebagai sarana referensi dalam
pembelajaran guna peningkatan prestasi siswa didik dalam proses belajar mengajar.
BAB II
LANDASAN TEORI
2.1 Dasar Teori
Pada umumnya logam tidak berdiri sendiri atau keadaan murni, tetapi lebih banyak dalam keadaan dipadu atau logam paduan dengan kandungan unsur-unsur tertentu sehingga struktur yang terdapat dalam keadaan setimbang pada temperatur dan tekanan tertentu akan berlainan. Kombinasi dua unsur atau lebih yang membentuk paduan logam akan menghasilkan sifat yang berbeda dari logam
asalnya. Tujuan pemaduan adalah untuk memperbaiki sifat logam Sifat yang diperbaiki adalah kekuatan, keuletan, kekerasan, ketahanan korosi, ketahanan aus, ketahanan lelah, dll. Komponen-komponen umum diagram fase adalah garis kesetimbangan, yang merujuk pada garisyang menandakan terjadinya transisi fase.
Fasa pada suatu material didasarkan atas daerah yang berbeda dalam struktur atau komposisi dari daerah lainnya.Fasa adalah bagian homogen dari suatu sistem yang memiliki sifat fisik dan kimia yang seragam. Untuk mempelajari paduan dibuatlah kurva yang menghubungkan antara fasa, komposisi dan temperatur. Diagram fasa adalah suatu grafik yang merupakan representasi tentang fasa-fasa yang ada dalam suatu material pada variasi temperatur, tekanan dan komposisi. Pada umumnya diagram fasa dibangun pada keadaan kesetimbangan (kondisinya adalah pendinginan yang sangat lambat). Diagram ini dipakai untuk mengetahui dan memprediksi banyak aspek terhadap sifat material. Informasi penting yang dapat diperoleh dari diagram fasa adalah:
1. Memperlihatkan fasa-fasa yang terjadi pada perbedaan komposisi dan temperatur dibawah kondisi pendinginan yang sangat lambat.
2. Mengindikasikan kesetimbangan kelarutan padat satu unsur atau senyawa pada unsur lain.
3. Mengindikasikan pengaruh temperatur dimana suatu paduan dibawah kondisi kesetimbangan mulai membeku dan pada rentang temperatur tertentu pembekuan terjadi.
4. Mengindikasikan temperatur dimana perbedaan fasa-fasa mulai mencair.
2.2 Pengertian Diagram Fasa
Dalam kimia fisik, mineralogi, dan teknik material, diagram fasa adalah sejenis grafik yang digunakan untuk menunjukkan kondisi kesetimbangan antara fasa-fasa yang berbeda dari suatu zat yang sama. Dalam matematika dan fisika, diagram fasa juga mempunyai arti sinonim dengan ruang fasa. Perubahan Struktur pada bahan paduan terdiri dari fasa tunggal, serta fasa campuran, dimana fasa
adalah bagian dari perubahan sistem kimia untuk menghasilkan paduan dengan karakter khusus bergantung pada komposisi dan temperatur pendinginannya. fasa berada selama pendinginan dan pada temperatur ruangan serta tergantung pula pada perilaku susunan unsur-unsur lainnya.
Fasa pada suatu material didasarkan atas daerah yang berbeda dalam struktur atau komposisi dari daerah lainnya. Tidak seperti struktur logam murni yang hanya dipengaruhi oleh suhu, sedangkanstruktur paduan dipengaruhi oleh suhu dan komposisi. Pada kesetimbangan, struktur paduanini dapat digambarkan dalam suatu diagram yang disebut diagram fase (diagramkesetimbangan) dengan parameter suhu (T) versus komposisi (mol atau fraksi mol). (Fasedapat didefinisikan sebagai bagian dari bahan yang memiliki struktur atau komposisi yang berbeda dari bagian lainnya). Diagram fasa khususnya untuk ilmu logam merupakan suatu pemetaan dari kondisilogam atau paduan dengan dua variabel utama umumnya ( Konsentrasi dan temperatur)Fasa mempunyai bagian homogen dari suatu sistem yang memiliki sifat fisik dan kimia yang seragam. Diagram fasa adalah suatu grafik yang merupakan representasi tentang fasa-fasa yang ada dalam suatu material pada variasi temperatur, tekanan dan komposisi. Pada umumnya diagram fasa dibangun pada keadaan kesetimbangan (kondisinya adalah pendinginan yang sangat lambat). Diagram ini dipakai untuk mengetahui dan memprediksi banyak aspek terhadap sifat material.
J.W Gibbs(1839-1903) menurunkan suatu persamaan yang mampu menghitung jumlah fasa yang ada dalam kesetimbangan pada suatu sistem yang ditentukan atau dipilih. Dapat dirumuskan dengan:
P + F = C + 2
Keterangan:
P = jumlah fasa yang ada pada sistem terpilih.
F = derajat kebebasan (jumlah variabel, tekanan, suhu, komponen) yang dapat diubah bebas tanpa mengubah jumlah fasa dalam kesetimbangannya.
C = jumlah komponen dalam sistem (suatu elemen, campuran atau larutan/cairan). Diagram fasa tunggal memiliki komposisi yang sama dengan paduan, misalnya timbaldan timah. Diagram fasa biner misalnya paduan kuningan (
Cu-Zn), (Cu-Ni) dll. Diagram fasa terner misalnya paduan stainless steel (Fe-Cr-Ni) dllDiagram pendinginan merupakan diagram yang memetakan kondisi struktur mikro apa yanganda akan dapatkan melalui dua variabel utama yaitu ( Temperatur dan waktu) disebut juga diagram TTT atau juga dua variabel utama yaitu (temperatur dan cooling rater) dosebut jugadiagram CCT.
Diagram ini berguna untuk mendapatkan sifat mekanik tertentu dan mikrostruktur tertentu, Fasa bainit misalnya pada baja hanya terdapat pada diagram TTT bukan diagram isothermal Fe-Fe3C. Kegunaan Diagram Fase antara lain sebagai berikut:
1. Dapat memberikan informasi tentang struktur dan komposisi fase-fase dalam
kesetimbangan.
2. Memudahkan memilih temperatur pemanasan yang sesuai untuk setiap proses
perlakuan panas baik proses anil, normalizing maupun proses pengerasan. Baja adalah paduan besi dengan karbon maksimal sampai sekitar 1,7%.paduan besi diatas 1,7% disebut cast iron.
Diagram Time Temperatur Transformation (TTT) mirip dengan diagram Continuous Cooling Transformation (CCT), tetapi proses pendinginannya berbeda. Proses pembuatan diagram ini dengan memanaskan baja karbon sehingga mencapai temperatur austenit kemudian mendinginkan dengan laju pendinginan kontinyu pada daerah fasa austenit kemudian menahannya untuk waktu tertentu dan mendinginkan lagi dengan laju pendinginan kontinyu
Perlakuan panas bertujuan untuk memperoleh struktur mikro dan sifat yang di inginkan. Struktur mikro dan sifat yang diinginkan dapat diperoleh melalui proses pemanasan dan proses pendinginan pada temperatur tertentu. Diagram fase digunakan oleh ahli geologi, ahlikimia, ceramists, metallurgists dan ilmuwan lain untuk mengatur dan meringkaseksperimental dan data pengamatan serta dapat digunakan untuk membuat prediksi tentang proses-proses yang melibatkan reaksi kimia antara fase.
2.3 Informasi dan Perbedaan Garis yang Terdapat pada Diagram Fasa
Informasi penting yang bisa didapatkan dan diperoleh dari diagram fasa adalah sebagai berikut:
komposisi dan temperatur dibawah kondisi pendinginan yang sangat lambat.
2. Mengindikasikan kesetimbangan kelarutan padat satu unsur atau senyawa pada unsur lain.
3. Mengindikasikan pengaruh temperatur dimana suatu paduan dibawah kondisi kesetimbangan mulai membeku dan pada rentang temperatur tertentu pembekuan terjadi.
4. Mengindikasikan temperatur dimana perbedaan fasa-fasa mulai mencair.
Garis yang dapat menentukan tinggi atau rendahnya temperatur yang terdapat pada logam dalam keadaan cair maupun padat, dapat dibedakan menjadi 2, yaitu:
Garis Liquidus : menunjukkan temperatur terendah dimana logam dalam keadaan cair atau temperatur dimana awal terjadinya pembekuan dari kondisi cair akibat proses pendinginan.
Garis Solidus : menunjukkan temperatur tertinggi suatu logam dalam keadaan padat atau temperatur terendah dimana masih terdapat fasa cair.
2.4 Klasifikasi dan Komposisi Penyusun Kesetimbangan Diagram Fasa
Klasifikasi bertujuan untuk mengetahui reaksi yang dapat ditimbulkan dari percobaan yang dilakukan. Klasifikasi yang terdapat pada diagram fasa dibedakan menjadi beberapa golongan. Reaksi yang ditimbulkan dapat terjadi apabila dalam keadaan cair maupun dalam keadaan padat, berikut adalah beberapa klasifikasi yang dapat terjadi:
1. Larut sempurna dalam keadaan cair dan padat.
2. Larut sempurna dalam keadaan cair, tidak larut dalam keadaan padat (reaksi eutektik).
3. Larut sempurna dalam keadaan cair, larut sebagian dalam keadaan padat (reaksi eutektik).
4. Larut sempurna dalam keadaan cair, larut sebagian dalam keadaan padat (reaksi peritektik).
5. Larut sempurna dalam keadaan cair, tidak larut dalam keadaan padat dan membentuk senyawa.
6. Larut sebagian dalam keadaan cair (reaksi monotektik). 7. Tidak larut dalam keadaan cair maupun padat.
Komposisi fasa adalah perbandingan relatif suatu fasa di dalam sistem. Komposisi fasa tergantung pada temperatur dan komposisi unsur penyusun fasa. Untuk mendapatkan informasi tentang komposisi fasa dan komposisi komponen penyusun fasa dipergunakan prosedur sebagai berikut:
Fasa merupakan bagian dari material yang homogen, komposisi kimia dan strukturnya dapat dibedakan secara fisik dapat dipisahkan secara mekanis dari bagian lain material itu. Suatu fasa dapat dibedakan dari material lain secara fisiknya, yaitu cair, gas, dan padat. Bagian material dengan komposisi kimia yang berbeda dapat dikatakan sebagai fasa yang berbeda. Struktur lattice juga membedakan satu fasa dengan fasa yang lainnya. Logam yang memiliki sifat allotropi misalnya, setiap bentuk allotropinya merupakan fasa tersendiri meskipun komposisi kimia dan keadaan fisiknya sama.
Diagram fasa idealnya menggambarkan hubungan antara fase komposisi dan temperature.pada kondisi kesetimbangan yaitu suatu kondisi yang tidak terjadi perubahan yang tergantung pada waktu. Kondisi keseimbangan biasanya didekati dengan kondisi pemanasan atau pendinginan yang sangat lambat, sehingga bila
ada perubahan fase yang harus terjadi akan ada waktu yang cukup untuk mencapai kondisi keseimbangan.
Diagram fasa dapat dibedakan menjadi 2 macam, yaitu:
1. Diagram Biner
Diagram biner adalah diagram yang menggambarkan dua jenis fasa dan menunjukkan sifat solubilitas timbal balik pada suhu tertentu dan tekanan yang sama. Diagram biner adalah diagram yang menunjukkan sistem 2 fasa dari dua zat dalam campuran yang ditunjukkan oleh hubungan temperatur terhadap kosentrasi relatif zat. Dimana pencampuran ini dapat dilakukan dengan menambahkan suatu zat cair ke dalam cairan murni lain pada tekanan tertentu dengan variasi suhu. Pada diagram biner akan terlihat adanya perubahan dari sistem dua fasa menjadi sistem satu fasa.
Diagram kesetimbangan adalah peta-peta stabil yang terdapat pada jangkauan (range) komposisi,temperatur,dan tekanan.
Diagram fase biner biasa disebut binary isomorphous alloy systems, kedua unsur yang dipadukan larut sempurna dalam keadaan cair maupun padat. Pada sistem ini hanya ada satu struktur kristal yang berlaku untuk semua komposisi, syarat yang berlaku adalah:
b. Perbedaan ukuran atom kedua unsur tidak boleh lebih dari 15%. c. Unsur-unsur tidak boleh membentuk senyawa.
d. Unsur-unsur harus mempunyai valensi yang sama.
Contoh klasik untuk jenis diagram fasa ini adalah diagram fasa Cu-Ni.
Titik Peritektik adalah : Titik pelelehan diatas suhu peritektik (Tp) dan pendinginan melalui Tp.
· Titik Eutektik adalah : Titik leleh komposisi hanya pada suhu (suhu eutektik/Te)
atau perpotongan antara kurva likuidus dan garis solidus.
· Garis Solidus adalah : Garis yang menunjukkan temperatur terendah dimana
logam dalam keadaan cair atau temperatur dimana awal terjadinya pembekuan dari kondisi cair akibat proses pendinginan.
· Garis Liquidus : Garis antara fasa cairan dan fasa transisi padat-cair ( α dan L)
dimana paduan berubah menjadi liquid/cair. Garis yang menunjukkan temperatur tertinggi suatu logam dalam keadaan padat atau temperatur terendah dimana masih terdapat fasa cair.
· Level Rule : perhitungan yang digunakan untuk menghitung besarnya
presentasi suatu fasa pada bagian dua fasa pada diagram biner. Disebut juga Aturan Kaidah Lengan.
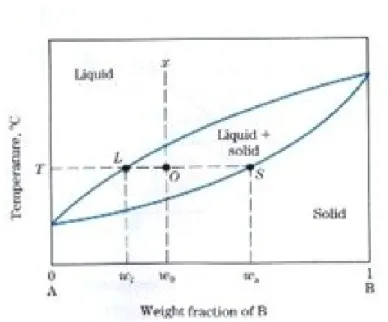
Misalkan x adalah komposisi paduan yang akan dihitung persentase fasa-fasanya pada temperatur T, maka tarik garis yang memotong batas kelarutannya (garis L-S).
Jika x = wo; L = wl dan S = ws
maka % fasa cair dan padat :
2. Diagram Fasa Tinery
Sistem tiga komponen(Tinery) mempunyai derajat kebebasan , karena tidak mungkin membuat diagram dengan 4 variabel, maka sistem tersebut dibuat pada tekanan dan suhu tetap. Sehingga diagram hanya merupakan fungsi komposisi. Harga derajat kebebasan maksimal adalah 2, karena harga P hanya mempunyai 2 pilihan 1 fasa yaitu ketiga komponen bercampur homogen atau 2 fasa yang meliputi 2 pasang misibel. Umumnya sistem 3 komponen merupakan sistem cair-cair- cair. Jumlah fraksi mol ketiga komponen berharga 1. Sistem koordinat diagram ini digambarkan sebagai segitiga sama sisi dapat berupa % mol atau fraksi mol ataupun % berat.
Garis Liquidus ialah garis yang menunjukan awal dari proses pendinginan (pembekuan).
Garis Solidus ialah garis yang menunjukan akhir dari proses pembekuan (pendinginan).
2.5 Komponen terhadap Tekanan dan Temperatur Diagram Fasa
Komponen umum diagram fase adalah garis kesetimbangan atau batas fase, Yang merujuk pada baris yang menandai kondisi di mana beberapa fase dapat hidup berdampingan pada kesetimbangan. Fase transisi terjadi di sepanjang garis dari equilibrium.
Diagram fasa dapat merupakan diagram yang sederhana antara dua komponen atau merupakan paduan dari beberapa diagram fasa yang sederhana. Perubahan fasa dapat terjadi dari fasa cair menjadi padat atau dari padat ke bentuk padat yang lain. Ada beberapa reaksi yang dapat terjadi pada setiap transfomasi, yaitu:
1. Kedua komponenya tetap larut tak terbatas pada keadaan padat.
2. Kedua komponennya saling tidak melarutkan pada keadaan padat(tidak
3. Kedua komponen dapat saling melarutkan secara terbatas(partially solube) pada
keadaan padat.
4. Kedua komponennya mengalami reaksi peritektik.
Pada keadaan padat kemungkinan sudah tidak terjadi lagi perubahan fasa, tetapi pada beberapa sistem paduan dapat terjadi transformasi padat-padat, antara lain :
1. Transformasi allotropic
2. Reaksi eutectoid
3. Reaksi peritektoid
Diagram fasa yang paling sederhana adalah diagram tekanan-temperatur dari zat tunggal, seperti air. Sumbu-sumbu diagram berkoresponden dengan tekanan dan temperatur. Diagram fase pada ruang tekanan-temperatur menunjukkan garis kesetimbangan atau sempadan fase antara tiga fase padat, cair, dan gas.
Diagram fase yang umum. Garis titik-titik merupakan sifat anomali air. Garis berwarna hijau menandakan titik beku dan garis biru menandakan titik didih yang berubah-ubah sesuai dengan tekanan.Penandaan diagram fasa menunjukkan
titik-titik di mana energi bebas bersifat non-analitis. Fasa-fasa dipisahkan dengan sebuah garis non-analisitas, di mana transisi fasa terjadi, dan disebut sebagai
“sempadan fasa”.
2.6 Sifat-sifat Termodinamika pada Diagram Fasa
Selain temperatur dan tekanan, sifat-sifat termodinamika lainnya juga dapat digambarkan pada diagram fasa. Contohnya meliputi volume jenis, entalpi jenis, atau entropi jenis. Sebagai contoh, grafik komponen tunggal Temperatur vs. Entropi jenis (T vs. s) untuk air/uap atau untuk refrigeran biasanya digunakan untuk mengilustrasikan siklus termodinamika seperti siklus Carnot dan siklus Rankine.
Pada grafik dua dimensi, dua kuantitas termodinamika dapat ditunjukkan pada sumbu horizontal dan vertikal. Kuantitas termodinamika lainnya dapat diilustrasikan dengan bertumpuk sebagai sebuah deret garis atau kurva. Garis-garis ini mewakili kuantitas termodinamika pada nilai konstan tertentu.
Secara keseluruhan ada tiga reaksi penting di dalam diagram kesetimbangan fasa Fe-Fe3C, yaitu: Reaksi Peritectic, Reaksi Eutectic, dan Reaksi Eutectoid sebagaimana terlihat di dalam diagram kesetimbangan. Untuk sistem BesiBaja, reaksi Eutectoid adalah reaksi yang sangat penting karena dengan mengontrol Reaksi Eutectoid kita dapat memperoleh berbagai konstituen mikro atau micro constituent yang diinginkan untuk mendapatkan sifat-sifat tertentu.
Berdasarkan kadar karbonnya, baja dapat pula diklasifikasikan menjadi beberapa jenis, yaitu:
1. Baja Eutectoid
2. Baja Hypoeutectoid
3. Baja Hypereutectoid
2.7 Pengertian Diagram Equilibrium (Diagram Kesetimbangan Fasa)
Pada umumnya logam tidak berdiri sendiri atau keadaan murni, tetapi lebih banyak dalam keadaan dipadu atau logam paduan dengan kandungan unsur-unsur tertentu sehingga struktur yang terdapat dalam keadaan setimbang pada temperatur dan tekanan tertentu akan berlainan. Kombinasi dua unsur atau lebih yang membentuk paduan logam akan menghasilkan sifat yang berbeda dari logam asalnya. Tujuan pemaduan untuk memperbaiki sifat logam. Sifat yang diperbaiki
adalah kekuatan, keuletan, kekerasan, ketahanan korosi, ketahanan aus, ketahanan lelah, dll. Jenis pemaduan diantaranya sebagai berikut:
1. Unsur logam + unsur logam
Contoh: Cu + Zn; Cu + Al; Cu + Sn. 2. Unsur logam + unsur non logam
Contoh: Fe + C.
Pemaduan terjadi akibat adanya susunan atom sejenis ataupun ada distribusi atom yang lain pada susunan atom lainnya. Jika ditinjau dari posisi atom-atom yang larut, diperoleh dua jenis larutan padat:
1. Larutan padat substitusi
Larutan padat substitusi akan larut apabila adanya atom-atom terlarut yang menempati kedudukan atom-atom pelarut.
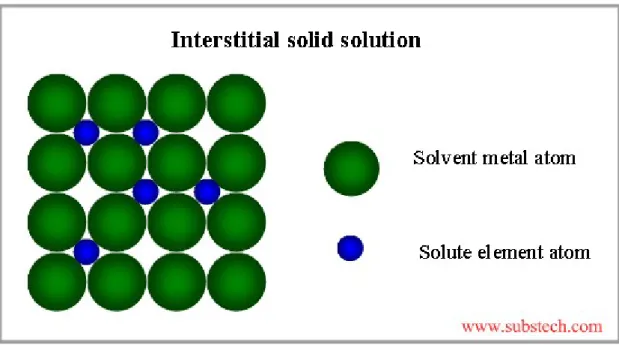
Larutan padat interstisi akan larut apabila Adanya atom-atom terlarut yang menempati rongga-rongga diantara kedudukan atom/sela antara.
Telah diketahui bahwa banyak sifat dari suatu bahan banyak tergantung pada jenis, jumlah/banyaknya dan bentuk dari fasa yang terjadi, maka sifat akan berubah bila hal-hal diatas berubah. Sejumlah besar data mengenai perubahan fasa dari berbagai sistem paduan telah dikumpulkan dan dicatat dalam bentuk diagram yaitu diagram fasa, atau dikenal juga sebagai diagram keseimbangan atau diagram equilibrium.
Suatu diagram fasa, idealnya akan menggambarkan hubungan antara fasa, komposisi dan temperatur, pada kondisi keseimbangan (equilibrium, yaitu kondisi dimana tidak terjadi perubahan yang bergantung pada waktu). Kondisi equilibrium dapat didekati dengan pemanasan dan pendinginan yang sangat lambat, sehingga bila ada perubahan fasa yang harus terjadi maka akan tersedia waktu yang cukup untuk mencapai kondisi keseimbangan.
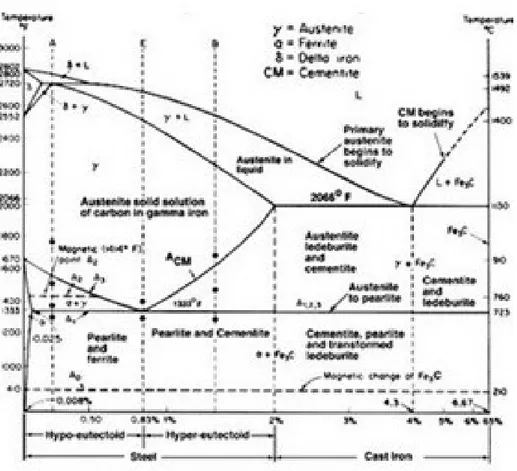
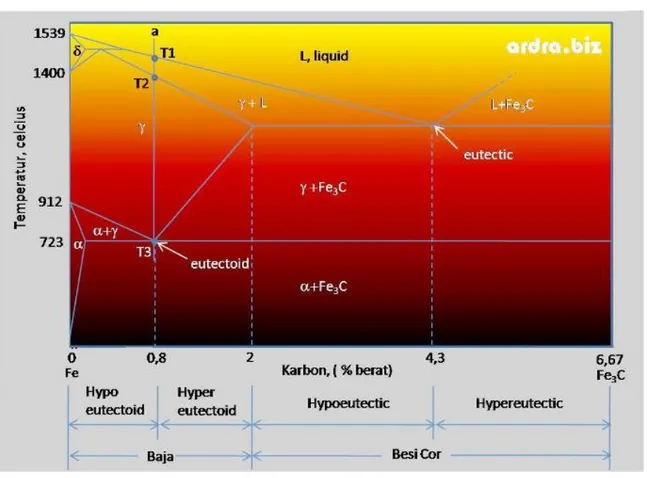
2.8 Diagram Fasa Sistem Besi - Besi Karbida
Diagram fase Fe-Fe3C merupakan diagram untuk kombinasi karbon dengan besi pada keadaan solid solution. Diagram fase ini termasuk diagram fase binary karena menunjukkan hubungan antara dua variable yaitu hubungan antara
temperatur dan kandungan karbon (%C) selama pemanasan lambat.Dari diagram fasa tersebut dapat diperoleh informasi-informasi penting yaitu antara lain:
a. Fasa yang terjadi pada komposisi dan temperatur yang berbeda dengan
kondisi pendinginan lambat.
b. Temperatur pembekuan dan daerah-daerah pembekuan paduan Fe-C bila
dilakukan pendinginan lambat.
c. Temperatur cair dari masing-masing paduan.
d. Batas-batas kelarutan atau batas kesetimbangan dari unsur karbon pada fasa
tertentu.
e. Reaksi-reaksi metalurgis yang terjadi, yaitu reaksi eutektik, peritektik dan
eutektoid.
Diagram kesetimbangan besi-besi karbida dapat dijadikan sebagai dasar untuk mempelajari paduan besi baja. Diagram ini juga disebut sebagai diagram fasa atau diagram kesetimbangan antara dua fasa, yaitu larutan padat besi dan senyawa logam Fe3C yang disebut sementit. Perubahan fasa yang terjadi selama pemanasan, pendinginan, jenis dan jumlah fasa yang ada pada setiap temperature. Paduan besi-besi karbida mempunyai beberapa fasa yaitu: ferit, austenite, besi delta, eutectoid atau perlit, dan eutektik atau ledeburit dan sementit.
1. Ferit
Ferit merupakan larutan padat interstisi dari atom-atom karbon pada besi murni. Fasa ini disebut alpha (α) dan merupakan larutan padat intersrisi karbon dengan sel satuan berupa kubik pemusatan ruang. Kelarutan maksimum karbon dalam ferit adalah 0,025 persen pada temperature 723 celcius. Pada temperature kamar kelarutan karbon sekitar 0,008 persen karbon. Ferit mempunyai struktur sel BCC, body centered cubic. Ferit mempunyai sifat lunak dan ulet, kekuatan tariknya kurang dari 310 MPa. Dalam gambar fasa Ferit dinotasikan dengan α.
2. Austenit
Austenit merupakan larutan padat interstisi atom karbon dalam besi yang mempunyai struktur sel FCC, face centered cubic. Austenit stabil di atas temperature 723 celcius. Dalam gambar fasa austenit dinotasikan dengan γ (gamma). Pada temperatur stabil austenit bersifat lunak dan liat sehingga mudah dibentuk. Austenit merupakan fasa penting sebagai dasar pembentuk fasa-fasa lainnya dalam proses perlakuan panas termasuk perlakuan panas pada permukaan baja.
3. Besi delta
Besi delta merupakan fasa yang mempunyai struktur sel BCC, berada diantara temperature 1400 – 1535 celcius. Atom karbon dapat larut sampai 0,1 persen. Dalam gambar besi delta dinotasikan dengan δ.
4. Sementit (Fe3C)
Sementit merupakan senyawa logam yang mempunyai kekerasan tinggi. Terkeras di antara fasa-fasa yang mungkin terjadi pada baja, tapi sangat rapuh. Sementit biasa disebut besi karbida mempunyai rumus Fe3C. Hal ini tidak berarti bahwa karbida besi membentuk molekul-molekul Fe3C. Akan tetapi kisi Kristal sementit mengandung atom besi dan karbon dalam perbandingan tiga lawan satu. Tiga
atom besi dan satu atom karbon. Sementit mempunyai sel satuan ortorombik dengan 12 atom besi dan empat atom karbon per satu selnya. Kadar karbon dalam sementit 6,7% dan senyawa ini bersifat keras tetapi getas. Pada baja, fasa ini dapat meningkatkan kekuatan dan kekerasan. Kekerasan sementit adalah lebih kurang berkisar antara 800 HVN.
5. Perlit adalah campuran khusus terdiri dari dua fasa dan terbentuk sewaktu
austenite dengan komposisi eutectoid bertransformasi menjadi ferit dan karbida besi secara bersamaan. Struktur dasar perlit adalah struktur lamellar yang tersusun daari lapisan ferit dan sementit. Perlit hanya terjadi di bawah temperature 723 celcius. Perlit mempunyai sifat diantara ferit dan sementit, yaitu kuat dan cukup keras. Kandungan karbon dalam perlit untuk paduan besi karbon adalah 0,8 persen.
6. Martensit
Martensit merupakan fasa dimana ferit dan sementit bercampur. Tetapi bukan dalam lamellar. Fasa ini terbentuk dari austensit metastabil didinginkan dengan laju pendinginan cepat. Terjadi hanya presipitasi Fe3C unsur paduan lainnya tetapi larut transformasi isothermal pada 260°C untuk membentuk dispersi karbida yang halus dalam matriks ferit. Martensit bilah terbentuk jika kadar C dalam baja sampai 0,6% sedangkan di atas 1% akan terbentuk martensit pelat. Perubahan dari bilah ke pelat 18terjadi pada interval 0,6% < C < 1,08%. Kekerasan dari martensit lebih dari 500 HVN.
2.9 Perubahan Transformasi Dekomposisi Fasa Selama Pendinginan
Sebagai ilustrasi akan dijelaskan pendinginan besi baja eutectoid dengan kandunagn karbon 0,8 persen karbon. Proses pendinginan untuk baja eutectoid, seperti ditunjukkan pada Gambar 3 yang dinyatakan oleh garis a. Pada temperature T1 terjadi pengintian austenite, selanjutnya antara temperature T1 – T2 butir-butir tumbuh dan pertumbuhan selasai pada T2. Antara T2 – T3 tidak terjadi perubahan fasa. Fasa yang ada adalah austenite. Setelah mencapai temperature T3, pada temperature ini austenite berangsur-angsur mulai bertransformasi menjadi perlit dan kemudian temperature terus turun sampai temperature kamar. Struktur dassar perlit adalah lamellar yang tersusun dari lapisan-lapisan ferit dan lapisan-lapisan smentit yang kedudukannya atau posisinya berselang-s.
Diagram kesetimbangan fasa Fe-Fe3C adalah alat penting untuk memahamistruktur mikro dan sifat-sifat baja karbon, suatu jenis logam paduan besi (Fe)dan karbon (C). Karbon larut di dalam besi dalam bentuk larutan padat
(solid solution) hingga 0,05% berat pada temperatur ruang. Baja dengan atomkarbon terlarut hingga jumlah tersebut memiliki alpha ferrite pada temperaturruang. Pada kadar karbon lebih dari 0,05% akan terbentuk endapan karbondalam bentuk hard intermetallic stoichiometric compound (Fe3C) yang dikenalsebagai cementite atau carbide. Selain larutan padat alpha-ferrite yang dalamkesetimbangan dapat ditemukan pada temperatur ruang terdapat fase-fase penting lainnya, yaitu delta-ferrite dan gamma-austenite.
Jika pendinginan terjadi lebih cepat maka terjadi segregasi yaitu distribusi yang tidak merata yang terjadi di dalam butir. Pada pusat butir yang pertama mambeku akan kaya oleh bahan yang mempunyai titik leleh tinggi, bahan yang mempunyai titik leleh rendah akan naik manjauhi pusat butir. Jadi terjadi gradien konsentrasi pada butir (gb.3.6). Fenomena ini disebut “ cored structure”. Adapun kelemahan “ cored structure” antara lain sebagai berikut:
1. Ø jika dipadatkan, akan cepat meleleh.
2. Ø mengurangi kekuatan mekanik pada temperatur tinggi.
Logam Fe bersifat polymorphism yaitu memiliki struktur kristal berbeda padatemperatur berbeda. Pada Fe murni, misalnya, alpha-ferrite akan berubahmenjadi gamma-austenite saat dipanaskan melewati temperature 910oC.
Padatemperatur yang lebih tinggi, mendekati 1400oC gamma-austenite akan
kembaliberubah menjadi delta-ferrite. (Alpha dan Delta) Ferrite dalam hal ini memilikistruktur kristal BCC sedangkan (Gamma) Austenite memiliki struktur kristal FCC.
1. Ferrite adalah fase larutan padat yang memiliki struktur BCC (body
centeredcubic). Ferrite dalam keadaan setimbang dapat ditemukan pada temperaturruang, yaitu alpha-ferrite atau pada temperatur tinggi, yaitu delta-ferrite.Secara umum fase ini bersifat lunak (soft), ulet (ductile), dan magnetik(magnetic) hingga temperatur tertentu, yaitu Tcurie. Berbagai jenis baja dan besi tuang dibuat dengan mengeksploitasi sifat-sifatferrite. Baja lembaran berkadar karbon rendah dengan fase tunggal ferritemisalnya, banyak diproduksi untuk proses pembentukan logam lembaran. Untuk paduan baja dengan fase tunggal ferrite, faktorlain yang berpengaruh signifikan terhadap sifat-sifat mekanik adalah ukuranbutir.
2. Fase Austenite memiliki struktur atom FCC (Face Centered Cubic).
Dalamkeadaan setimbang fase Austenite ditemukan pada temperatur tinggi. Fase inibersifat non magnetik dan ulet (ductile) pada temperatur tinggi. Kelarutanatom karbon di dalam larutan padat Austenite lebih besar jika dibandingkandengan kelarutan atom karbon pada fase Ferrite. Secara geometri, dapatdihitung perbandingan besarnya ruang intertisi di dalam fase Austenite (ataukristal FCC) dan fase Ferrite (atau kristal BCC). Perbedaan ini dapat digunakan untuk menjelaskan fenomena transformasi fase pada saat pendinginanAustenite yang berlangsung secara cepat. Selain pada temperatur tinggi, Austenite pada sistem Ferrous dapat puladirekayasa agar stabil pada temperatur ruang. Elemen-elemen seperti Mangandan Nickel misalnya dapat menurunkan laju transformasi dari gamma-austenitemenjadi alpha-ferrite. Dalam jumlah tertentu elemen-elemen tersebut akanmenyebabkan Austenite stabil pada temperatur ruang.
3. Cementite atau carbide dalam sistem paduan berbasis besi
adalahstoichiometric inter-metallic compund Fe3C yang keras (hard) dan
getas(brittle). Nama cementite berasal dari kata caementum yang berarti stone chipatau lempengan batu. Cementite sebenarnya dapat terurai menjadi bentukyang lebih stabil yaitu Fe dan C sehingga sering disebut sebagai fasemetastabil. Namun, untuk keperluan praktis, fase ini dapat dianggap sebagaifase stabil. Cementite sangat penting perannya di dalam membentuk sifat-sifatmekanik akhir baja. Cementite dapat berada di dalam sistem besi baja dalamberbagai bentuk seperti: bentuk bola (sphere), bentuk lembaran (berselangseling dengan alpha-ferrite), atau partikel-partikel carbide kecil. Bentuk,ukuran, dan distribusi karbon dapat direkayasa melalui siklus pemanasan danpendinginan. Jarak rata-rata antar karbida, dikenal sebagai lintasan Ferriterata-rata (Ferrite Mean Path), adalah parameter penting yang dapatmenjelaskan variasi sifat-sifat besi baja. Variasi sifat luluh baja diketahui berbanding lurus dengan logaritmik lintasan ferrite rata-rata.
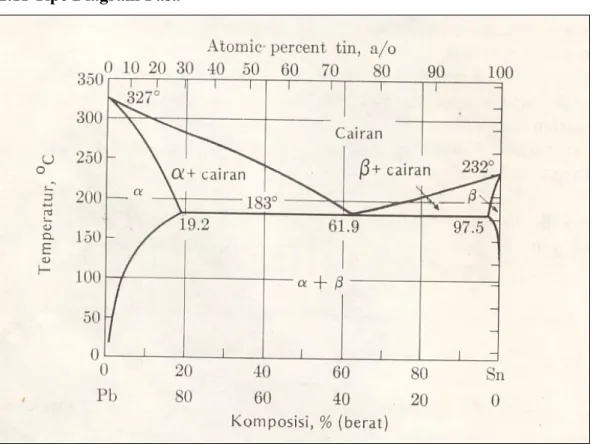
2.10 Diagram Fasa ( Diagram Keseimbangan)
Seperti pada diagram Pb – Sn adalah diagram fasa yang digunakan sebagai peta yang menunjukkan fasa yang ada pada suhu tertentu dan
komposisi paduan pada keadaan keseimbangan, yaitu semua reaksi yang mungkin terjadi telah selesai.
Gb. Diagram Pb – Sn
Pada diagram tersebut pada komposisi 50% Sn dan suhu 100o C,
menunjukkan bahwa terdapat dua fasa padat yaitu fasa α dan fasa β.
Pada komposisi yang sama pada suhu 200o C terdapat fasa α dan cairan.
|Dan pada suhu 250o C seluruh larutan berupa cairan. Sebaliknya pada
komposisi 80% Sn dan suhu 200o C terdapat fasa β dan cairan. Dan pada
komposisi 10% Sn dan suhu 200o C hanya terdapat fasa α saja.
Daerah fasa dalam diagram keseimbangan tergantung pada system paduannya. Untuk diagram keseimbangan tembaga dan nikel bentuk diagramnya sederhana karena hanya ada satu macam fasa dari kedua logam tersebut.
Gb. Diagram Fasa Cu-Ni
Pada bagian bawah dari diagram, semua paduan membentuk satu larutan padat yang terdiri dari satu struktur kristal yaitu kps. Karena tembaga dan nikel mempunyai struktur kristal kps dan ukuran kedua atom hampir sama sehingga tembaga dapat saling menggantikan dalam kristal dengan segala perbandingan pada suhu 1000o C.
Jenis pemaduan:
1. Unsur logam + unsur logam
Contoh: Cu + Zn; Cu + Al; Cu + Sn. 2. Unsur logam + unsur non logam Contoh: Fe + C.
2.11 Tipe Diagram Fasa
Gb. Tipe Diagram Fasa
A. Diagram Fasa Tipe 2D
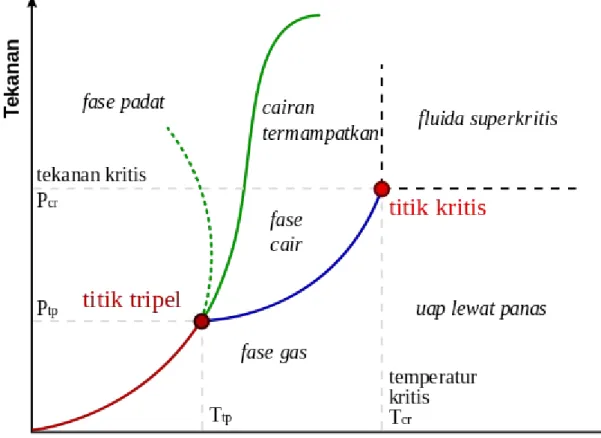
Diagram fase yang paling sederhana adalah diagram tekanan- temperatur dari zat tunggal,seperti air.Sumbu-sumbu diagram berkoresponden dengan tekanan dan temperatur.Diagram fase pada ruang tekanan-temperatur menunjukkan garis kesetimbangan atau sempadan fase antara tiga fase padat,cair,dan gas.
Gb. Diagram Tekanan - Temperatur
Diagram fase yang umum.Garis titik-titik merupakan sifat anomali air.Garis berwarna hijau menandakan titik beku dan garis biru menandakan titik didih yang berubah-ubah sesuai dengan tekanan.
Penandaan diagram fase menunjukkan titik-titik dimana energi bebas bersifat non-analitis.Fase-fase dipisahkan dengan sebuah garis non-analisitas, dimana transisi fase terjadi, dan disebut sebagai sempadan fase.
Pada diagaram di atas, sempadan fase antara cair dan gas tidak berlanjut sampai takterhingga. Ia akan berhenti pada sebuah titik pada diagaram fase yang disebut sebagai titik kritis. Ini menunjukkan bahwa pada temperatur dan tekanan yang sangat tinggi, fase Cair dan gas menjadi tidak dapat dibedakan yang dikenal sebagai fluida super kritis.
Pada air, titik kritis ada pada sekitar 647K dan 22,064MPa(3.200,1psi). Keberadaan titik kritis cair-gas menunjukkan ambiguitas pada definisi diatas.Ketika dari cair menjadi gas,biasanya akan melewati sebuah sempadan fase,namun adalah mungkin untuk memilih lajur yang tidak melewati sempadan
dengan berjalan menuju fase superkritis.Oleh karena itu,fase cair dan gas dapat dicampurt erusmenerus.
Sempadan padat-cair pada diagram fase kebanyakan zat memiliki gradien yang positif.Hal ini dikarenakan fase padat memiliki densitas yang lebih tinggi dari pada fase cair,sehingga peningkatan tekanan akan meningkatkan titik leleh.Pada beberapa bagian diagram fase air,sempadan fase padat-cair air memiliki gradien yang negatif,menunjukkan bahwa es mempunyai densitas yang lebih kecil daripada air.
B. Diagram fasa tipe 3D
Adalah mungkin untuk membuat grafik tiga dimensi (3D) yang menunjukkan tiga kuantitas termodinamika. Sebagai contoh, untuk sebuah komponen tunggal, koordinat 3D Cartesius dapat menunjukkan temperatur (T), tekanan (P), dan volume jenis (v). Grafik 3D tersebut kadang-kadang disebut diagram P-v-T. Kondisi kesetimbangan akan ditungjukkan sebagai permukaan tiga dimensi dengan luas permukaan untuk fase padat, cair, dan gas.
Garis pada permukaan tersebut disebut garis tripel, di mana zat padat, cair, dan gas dapat berada dalam kesetimbangan. Titik kritis masih berupa sebuah titik pada permukaan bahkan pada diagram fase 3D.
Proyeksi ortografi grafik P-v-T 3D yang menunjukkan tekanan dan temperatur sebagai sumbu vertikal dan horizontal akan menurunkan plot 3D tersebut menjadi diagram tekanan-temperatur 2D. Ketika hal ini terjadi, permukaan padat-uap, padat-cair, dan cair-uap akan menjadi tiga kurva garis yang akan bertemu pada titik tripel, yang merupakan proyeksi ortografik garis tripel.
2.12 Batas Daya Larut Padat Pada Logam
Gb. Diagram paduan Pb-Sn
Pada diagram bahan padat yang kaya Pb terdapat atom Sn yang larut dalam struktur kps. (Berbeda pada NaCl tidak larut dalam struktur kristal Es dalam jumlah yang berarti)
Pada suhu 183o C batas daya larut Sn sekitar 29% atom ( 19% berat)
dalam bahan padat yang kaya Pb.
Semakin tinggi suhu larutan padat batas daya larutnya semakin rendah Contoh : Pada 300o C ada 10% atom ( 6% berat ) Sn yang larut pada Pb
Demikian halnya pada 183o C bahan padat yang kaya Sn dapat
mengandung 2.5% berat Pb yang larut pada struktur tpr( Sn) Sesuai perjanjian kedua fasa disebut α ( dengan struktur kristal kps) dan β ( dengan struktur kristal tpr) dari system Pb – Sn
Batas daya larut padat mempunyai harga maksimum pada suhu eutektik. Baik diatas maupun dibawah 183o C jumlah Sn yang dapat larut dalam α kps
yang kaya Pb menurun. Hal yang serupa terjadi pada Pb pada 183o C,
maksimum 2,5% berat Pb larut dalam β tpr yang kaya Sn.
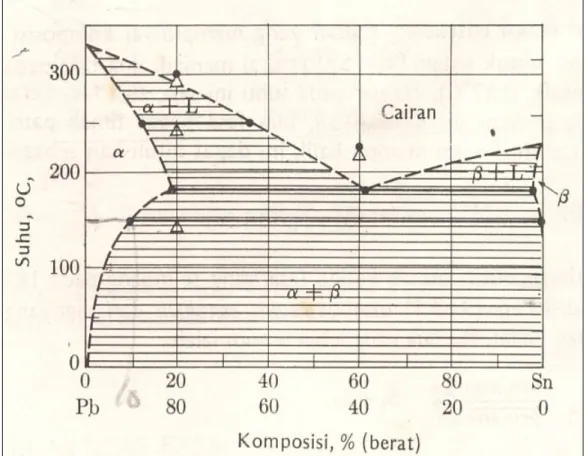
2.13 Komposisi Fasa
Diagram keseimbangan selain berguna sebagai peta , juga memberikan komposisi kimia fasa yang terdapat pada keadaan seimbang setelah semua reaksi berakhir.
Gb. Komposisi Fasa
Daerah Fasa Tunggal
Pada fasa tunggal(keseluruhan logam dalam keadaan padat atau cair) komposisi kimianya sesuai dengan paduannya.
Misalnya dalam paduan 60Sn dan 40 Pb pada 225o C cairan mempunyai
komposisi 60 – 40, hal serupa berlaku untuk diagram fasa dengan larutan padat fasa tunggal.
Daerah dua fasa
Komposisi kedua fasa terdapat pada kedua ujung garis isotermis yang melintasi daerah dua fasa.
Sebagai contoh paduan timah patri 80Pb – 20Sn pada 150o C. Pada
diagram dapat dilihat bahwa α mempunyai komposisi 10% Sn dan komposisi β hampir 100% Sn.
Namun pada paduan yang sama dan suhu yang berbeda komposisi α dan β akan berbeda. Hal ini berdasarkan kenyataan bahwa batas larut Sn dalam α pada 150o C besarnya 10%. Karena paduan adalah 20%Sn maka α jenuh
dengan Sn dan kelebihan Sn terdapat pada β. Demikian batas daya larut Pb dalam β < 1%, maka hampir seluruh Pb berada dalam fasa α.
Reaksi Eutektik
Cairan yang mempunyai komposisi eutektik (38.1% Pb – 61.9% Sn pada system Pb – Sn ) terurai menjadi fasa padat (α dan β) pada suhu eutektik 183o
C . Pda suhu ini saja tiga fasa berada dalam keseimbangan. Reaksi uetektik dapat ditulis :
didinginkan
L2 → S1 + S3
← Dipanaskan
Catatan : 1,2,3 menunjukkan kadar yang meningkat dari salah satu diantara komponen
2.14 Kuantitas Fasa
Dengan melihat diagram fasa maka dapat mengidentifikasi: 1. Jenis fasa yang telah stabil/seimbang
2. Komposisi kimia
Daerah dua fasa
Kuantitas dari dua fasa ditentukan dengan cara interpolasi komposisi paduan diantara komposisi kedua fasa itu.
Gb. Kuantitas Fasa ( paduan Pb – Sn )
Sebagai contoh timah patri 80 Pb – 20 Sn pada 150o C, dari diagram
terlihat bahwa komposisi 80 Pb- 20 Sn terletak pada titik sejauh 0.11 x jarak komposisi kimia α ( 90 Pb -10 Sn ) dan komposisi kimia β (< 1 Pb dan ~ 100Sn ).
Sehingga jumlah seluruh patri , fraksi kuantitas β= 0.11 dan α = 0.89 Jumlah ini dapat ditulis 89% untuk massa α dan 11% untuk massa β.
Dalam komposisi yang sama ( 80 Pb – 20 Sn ) pada 250o C dari diagram
dapat dilihat bahwa α ( 88 Pb -12 Sn ) dan L ( 64 Pb - 36 Sn ). Komposisi kimi paduan ini secara keseluruhan ( 80 Pb – 20 Sn ) sama dengan 1/3 jarak antara α dan komposisi cairan. Sehingga jumlah patri keseluruhan pada 250o C
kuantitas fraksi cairan 1/3 bagian dan fraksi padat ( α ) 2/3 bagian. Kuantitas dinyatakan dalam fasa α dan β atau α dan L, sesuatu yang beda dengan komposisi kimia yang dinyatakan dalam jumlah komponen Pb dan Sn.
Pada Sistem Besi Karbon
Baja merupakan paduan dari besi dan karbon. Besi murni berubah strukturnya pada 912o C dari kpr menjadi kps. Pada 1394o C berubah lagi dari
kps menjadi kpr lagi dan kpr ini stabil sampai besi mencair pada 1538o C.
Ferit atau besi α
Struktur besi murni pada suhu ruangan disebut ferit atau besi α . Ferit mempunyai struktur kpr, ruangan antar atom kecil dan rapat sehingga sulit menampung atom karbon sekalipun kecil. Oleh sebab itu daya larut karbon dalam ferit rendah ( < 1 karbon per 1000 atom besi ).
Austenit atau besi - .
Besi dengan struktur kps disebut Austenit atau besi - . Besi ini stabil
pada suhu antara 912o C dan 1394o C. Austenit mempunyai sifat yang lunak
dan ulet sehingga mudah dibentuk. Besi austenit berstruktur kps yang mempunyai jarak atom yang lebih besar dibanding ferit.
Meskipun demikian lubang pada strtuktur kps hampir tidak dapat menampung atom karbon dan penyisipan ini menyebabkan regangan dalam struktur. Akibatnya tidak semua lobang dapat diisi atom karbon (~ 6% pada 912
o C). Daya larut maksimum 2.11% ( 9%atom) karbon.
Besi- .
Di atas 1394o C austenit bukan bentuk besi yang paling stabil karena
struktur kristal berubah dari kps menjadi kpr atau besi- . Besi- sama dengan
besi α kecuali daerah suhunya. Oleh karena itu biasa disebut ferit . Daya
larut karbon dalam ferit kecil, akan tetapi lebih besar dari pada ferit α , karena suhunya lebih tinggi.
Karbida besi
Pada paduan besi karbon, karbon melebihi daya larut membentuk fasa ke dua yang disebut karbida besi (sementit) yang mempunyai kompsisi kimia Fe3
C. Hal ini tidak berarti sementit membentuk molekul –molekul Fe3C, akan
tetapi membentuk kisi kristal mengandung atom besi dan karbon dalam perbandingan tiga – satu.
Fe3C mempunyai sel satuan ortorombik ( semua sudut = 90o C dan a
≠ b ≠ c ) dengan 12 atom besi dan 4 atom karbon per sel. Kandungan karbonnya 6.7%(berat) dan berat jenisnya 7,6 Mg/m3
Diagram fasa Fe-Fe3C
Pada gambar bawah terlihat diagram fasa besi (Fe) dan karbida besi(Fe3
C). Diagram ini merupakan landasan untuk memberikan perlakuan panas (kebanyakan jenis baja).
Komposisi eutektik terdapat pada 4.3% (berat) karbon atau 17% atom karbon dan suhu eutektik adalah 1148o C. Besi - yang kaya Fe dapat
menampung sampai 2.11% (berat) atau 9%(atom) karbon. Atom-atom karbon ini larut secara intersisi dalam besi kps.
Reaksi eutektik
Pada gambar bawah merupakan perbandingan antara penambahan karbon pada austenit dengan penambahan garam pada air. Pada setiap keadaan penambahan bahan yang dilarutkan menurunkan jangkauan suhu stabil larutan.
Gb. Reaksi eutektik
Pada system es-garam, larutan cairan ada diatas suhu eutektik, sedangkan pada system besi-karbon terdapat larutan padat sehingga reaksi eutektik sungguhan tidak terjadi sewaktu pendinginan. Akan tetapi karena analogi reaksi ini dengan reaksi eutektik, reaksi ini disebut eutectoid ( secara harfiah berarti seperti eutektik ).
didinginkan Eutektik : L2 → S1 + S3 ← Dipanaskan Didinginkan Euitektoid S2 → S1 + S3 ← Dipanaskan
Suhu eutectoid untuk paduan besi – karbon adalah 727o C. Komposisi
eutectoid terdiri sekitar 0.8% karbon.
Reaksi eutectoid untuk paduan Fe – C adalah :
723o C
(0.77%C ) α ( 0.02% C ) + Fe3C ( 6.7% C)
Pergeseran Eutektoid
Pada baja paduan atom karbon dan atom besi saling berkoordinasi dengan atom lain. Oleh karena itu kadar karbon Euitektoid dan suhu Euitektoid berubah bila ada elemen paduan lainnya.
Perubahan kadar karbon Euitektoid dan suhu Euitektoid dapat dilihat pada diagram bawah
Gb. Pergeseran titik eutectoid
Selama pendinginan terjadi reaksi eutiktoid Fe – C yang menyangkut pembentukkan ferit
dan karbida C sebagai hasil dekomposisi austenit berkomposisi eutektoid : ( ~ 0.8% C ) → α + C
Dalam campuran yang dihasilkan terdapat ~ 12% karbida dan lebih dari 88% ferit. Karena karbida dan ferit terbentuk bersama-sama, keduanya bercampur dengan baik.
Dengan kata lain ferit adalah campuran khusus terdiri dari dua fasa dan terbentuk sewaktu austenit dengan komposisi eutectoid bertransformasi menjadi ferit dan karbida.
Perlit adalah campuran khusus dari dua fasa dan terbentuk sewaktu austenit dengan komposisi eutectoid bertransformasi menjadi ferit dan karbid.
PENUTUP
3.1 Kesimpulan
Diagram fasa adalah diagram yang menampilkan hubungan antara temperature, dimana terjadi perubahan fasa selama proses pendinginan dan pemanasan yang lambat dengan kadar karbon. Diagram ini merupakan dasar pemahaman untuk semua operasioperasi perlakuan panas. Diagram Fasa merupakan diagram yang menampilkan hubungan antara temperatur dimana terjadi perubahan fasa selama proses pendinginan dan pemanasan yang lambat dengan kadar karbon. Tidak seperti struktur logam murni yang hanya dipengaruhi oleh suhu, sedangkan struktur paduan dipengaruhi oleh suhu dan komposisi. Pada kesetimbangan, struktur paduan ini dapat digambarkan dalam suatu diagram yang disebut diagram fasa (diagram kesetimbangan) dengan parameter suhu (T) versus komposisi (mol atau fraksi mol). (Fase dapat didefinisikan sebagai bagian dari bahan yang memiliki struktur atau komposisi yang berbeda dari bagian lainnya). Diagram fasa khususnya untuk ilmu logam merupakan suatu pemetaan dari kondisi logam atau paduan dengan dua variabel utama umumnya ( Konsentrasi dan temperatur).
Garis yang dapat menentukan tinggi atau rendahnya temperatur yang terdapat pada logam dalam keadaan cair maupun padat, dapat dibedakan menjadi 2, yaitu:
1. Garis Liquidus = menunjukkan temperatur terendah dimana logam dalam
keadaan cair atau temperatur dimana awal terjadinya pembekuan dari kondisi cair akibat proses pendinginan.
2. Garis Solidus = menunjukkan temperatur tertinggi suatu logam dalam
keadaan padat atau temperatur terendah dimana masih terdapat fasa cair. Selain temperatur dan tekanan, sifat-sifat termodinamika lainnya juga dapat digambarkan pada diagram fasa. Contohnya meliputi volume jenis, entalpi jenis, atau entropi jenis. Sebagai contoh, grafik komponen tunggal Temperatur vs. Entropi jenis (T vs. s) untuk air/uap atau untuk refrigeran biasanya digunakan untuk mengilustrasikan siklus termodinamika seperti siklus Carnot dan siklus Rankine.
Diagram fase Fe-Fe3C merupakan diagram untuk kombinasi karbon dengan besi pada keadaan solid solution. Diagram fase ini termasuk diagram fase binary karena menunjukkan hubungan antara dua variable yaitu hubungan antara
temperatur dan kandungan karbon (%C) selama pemanasan lambat. Diagram kesetimbangan besi-besi karbida dapat dijadikan sebagai dasar untuk mempelajari paduan besi baja. Diagram ini juga disebut sebagai diagram fasa atau diagram kesetimbangan antara dua fasa, yaitu larutan padat besi dan senyawa logam Fe3C yang disebut sementit. Perubahan fasa yang terjadi selama pemanasan, pendinginan, jenis dan jumlah fasa yang ada pada setiap temperature. Paduan besi-besi karbida mempunyai beberapa fasa yaitu: ferit, austenite, besi delta, eutectoid atau perlit, dan eutektik atau ledeburit dan sementit.
3.2 Saran
Kami sadar makalah ini masih jauh dari kata sempurna, untuk itu kami membutuhkan kritik dan saran dari teman-teman yang sifanya membangun. Bagi teman-teman yang ingin menambah wawasan mengenai diagram fasa,teman-teman bisa mencari referensi lain.
DAFTAR PUSTAKA
http://rusman-buru.blogspot.co.id/2012/09/makalah-diagram-fasa.html http://ekasetiawahyudi.blogspot.co.id/2012/11/diagran-fasa.html
https://id.wikipedia.org/wiki/Diagram_fase https://www.academia.edu
https://www.slideshare.net/bayuafajri/diagram-fasa-fe-fe3-c https://www.academia.edu/11592137/Diagram_Fasa_Fe-Fe_3_C