MODUL 4
ENERGI ALTERNATIF : FUEL CELL DAN SEL SURYA
Anandiani Khairunnisa Noviar, Sandy Jaka Adilla, Dhafinta Widya Saraswati, Sarah Zulfa Khairunnisa, Irfan Abdurrahman
10212002, 10212040, 10212043, 10212045, 10212052
Program Studi Fisika, Institut Teknologi Bandung, Indonesia
email : [email protected]
Asisten : Hannan Prasasta W. / 10211089 Tanggal Praktikum : 22-10-2014
Abstrak
Praktiku odul Fuel Cell dan Sel Surya bertujua u tuk menentukan jumlah gas yang terbentuk sebagai fungsi waktu serta menghitung efisiensi pembentukan gas H2 dan O2 dengan menggunakan baterai dan sel
surya. Selain itu, tujuan dari percobaan ini adalah menghitung efisiensi konversi gas H2 dan O2 menjadi listrik.
Praktikum ini menggunakan fuel cell jenis PEM (Proton Exchange Membrane) dan sel surya. Fuel cell merupakan susunan lapisan material tingkat lanjut dimana hydrogen dan oksigen dapat bereaksi satu sama lain untuk menghasilkan listrik dan air tanpa pembuangan. Metode percobaan dilakukan dengan cara mengukur perubahan tegangan dan arus setiap 20 detik selama waktu menyala baterai yang divariasikan sebanyak 5 kali. Kemudian menghitung volume gas H2 dan O2 yang terbentuk dan sambungkan dengan fuel cell agar motor
bergerak. Lalu ganti baterai dengan sel surya yang dipapari dengan cahaya lampu untuk percobaan pertama dan sinar matahari untuk percobaan kedua, data yang dibutuhkan untuk kedua percobaan ini sama dengan percobaan pertama. Hipotesis pada percobaan ini adalah gas-gas yang terbentuk karena paparan sinar matahari akan lebih banyak daripada paparan cahaya lampu.
Kata kunci : Efisiensi, Elektrokimia, Elektrolisis, Fuel Cell, Sel Surya, .
I. Pendahuluan
Tujuan dari praktikum ini adalah untuk menentukan jumlah gas yang terbentuk sebagai fungsi waktu serta menghitung efisiensi pembentukan gas H2 dan O2 dengan menggunakan baterai dan sel surya. Selain itu, tujuan dari percobaan ini adalah menghitung efisiensi konversi gas H2 dan O2 menjadi listrik.
Fuel cell merupakan sebuah alat elektrokimia yang dapat mengubah energy kimia menjadi energy listrik. Setiap fuel cell memiliki dua elektroda yang biasa disebut katoda dan anoda, dimana setiap reaksi yang menghasilkan listrik terjadi di kedua elektroda ini. Fuel cell dapat mengubah hydrogen dan oksigen menjadi energy listrik, serta air sebagai produk sisanya[1].
Fuel Cell jenis PEM (Proton Exchange Membrane) bekerja dengan sebuah elektrolit polymer yang tipis dan permeable. Efisiensi dari PEMFC adalah
sekitar 40%-50%. Untuk mempercepat reaksi, PEMFC menggunakan katalis platinum pada kedua sisi membrannya[2].
Gambar 1. Skema Rangkaian Fuel Cell jenis PEM (Proton Exchange Membrane)[3]
Reaksi Elektrokimia
Reaksi pada anoda : 2H2 4H +
+ 4e -Reaksi pada katoda : O2 + 4H
+
+ 4e- 2H2O Reaksi total : 2H2 + O2 2H2O
Untuk memperoleh gas hydrogen sebagai bahan bakar fuel cell (menggerakan motor), maka terlebih dahulu dilakukan proses elektrolisis, yaitu air diberi sumber listrik agar terbentuk gas H2 dan O2.
Reaksi Elektrolisis
Reaksi pada anoda : 2H2O O2 + 4H +
+ 4e -Reaksi pada katoda : 4H+ + 4e- 2H2 Reaksi total : 2H2O 2H2 + O2
Sel surya merupakan alat yang dapat mengkonversi energy cahaya menjadi energy listrik. Konversi ini didasarkan pada fenomena efek fotovoltaik. Sinar matahari terdiri dari foton dengan tingkat energy yang berbeda tergantung spectrum warnanya. Secara teori, sel surya dapat mengkonversi sekitar 30% energy radiasi matahari menjadi listrik[4]. Prinsip kerjanya adalah cahaya datang dengan panjang gelombang tertentu, kemudian mengenai bahan semikonnduktor. Terjadilah pair generation atau electron-hole production. Elektron yang semula berada pada pita valensi akan tereksitasi menuju pita
konduksi sehingga timbul aliran listrik. Bagian yang ditinggalkan elektron disebut hole. Elektron akan menyebar di bagian n dan hole menyebar di bagian p, serta terdapat bandgap energy diantara pita valensi dan pita konduksi[2].
Gambar 2. Prinsip Kerja Sel Surya[4]
II. Metode Percobaan
Sebelum memulai percoban, praktikan harus paham penyusunan kit yang akan digunakan. Setelah kit terpasang, isi kedua silinder dengan aquadest sampai skala 0.
Percobaan pertama yaitu melakukan elektrolisis terlebih dahulu untuk menghasilkan gas O2 dan H2 menggunakan baterai. Data yang diperlukan adalah perubahan arus dan tegangan setiap 5 detik untuk nyala baterai selama 60, 90, 120, 150, dan 180 detik dan volume gas H2 dan O2 setelah proses elektrolisis. Setelah itu, jalankan fuel cell dengan gas H2 yang terbentuk, serta catat perubahan arus dan tegangannya tiap 5 detik sampai mobil-mobilan berhenti. Kemudian catat lagi volume gas H2 dan O2 setelah proses elektrokimia.
elektrokimia. Kemudian sel surya yang tadinya dipapari cahaya lampu, divariasikan dengan dipapar sinar matahari langsung.
Hipotesis dari percobaan ini adalah gas yang terbentuk dengan elektrolisis menggunakan baterai jumlahnya lebih sedikit karena lama baterai menyala hanya sebentar. Kemudian, gas yang terbentuk karena paparan sinar matahari jumlahnya lebih banyak karena sinar matahari memiliki intensitas lebih tinggi dari cahaya lampu dengan waktu pengamatan yang sama.
III. Data dan Pengolahan Data
Untuk ketiga percobaan (fuel cell baterai, cahaya matahari, cahaya lampu), kita akan menggunakan beberapa rumus berikut :
P = V.I (1)
E = ∫ (2)
n =
(3)
ηn = (4)
Keterangan :
P = Daya listrik (Watt) V = Tegangan (Volt) I = Arus (Ampere) E = Energi (Joule) n = jumlah mol η = efisiensi
3.1 Percobaan Fuel Cell Menggunakan Baterai
Hasil pengukuran perubahan tegangan dan arus tiap 5 detik selama baterai menyala ditunjukkan oleh kelima tabel berikut:
Tabel 1a. Tegangan, Arus, dan Daya Elektrolisis selama 60 detik BATTERY ELECTROLYSIS
t Tegangan (V)
Arus (A)
Daya Listrik P = V.I 0 1.298 0.0016 0.0020768 5 2.616 0.3458 0.9046128 10 2.6621 0.3161 0.84148981 15 2.6786 0.3019 0.80866934 20 2.74 0.2208 0.604992 25 2.7244 0.2588 0.70507472 30 2.7001 0.2789 0.75305789 35 2.7366 0.2496 0.68305536 40 2.7403 0.2418 0.66260454 45 2.7336 0.2479 0.67765944 50 2.7399 0.2398 0.65702802
55 2.661 0.3 0.7983
60 2.5858 0.2896 0.74884768
Tabel 1b. Tegangan, Arus, dan Daya Elektrolisis selama 90 detik
BATTERY ELECTROLYSIS
t Tegangan (V)
Arus (A)
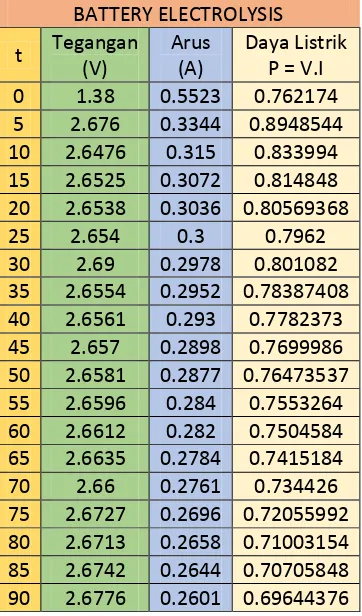
Daya Listrik P = V.I 0 1.38 0.5523 0.762174 5 2.676 0.3344 0.8948544 10 2.6476 0.315 0.833994 15 2.6525 0.3072 0.814848 20 2.6538 0.3036 0.80569368
25 2.654 0.3 0.7962
Tabel 1c. Tegangan, Arus, dan Daya Elektrolisis selama 120 detik
BATTERY ELECTROLYSIS
Tabel 1d. Tegangan, Arus, dan Daya Elektrolisis selama 150 detik
BATTERY ELECTROLYSIS
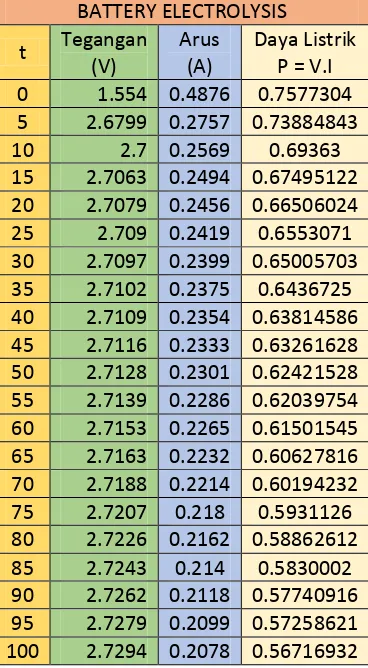
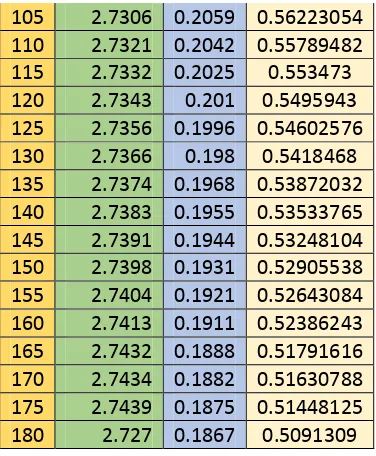
105 2.7306 0.2059 0.56223054 110 2.7321 0.2042 0.55789482 115 2.7332 0.2025 0.553473 120 2.7343 0.201 0.5495943 125 2.7356 0.1996 0.54602576 130 2.7366 0.198 0.5418468 135 2.7374 0.1968 0.53872032 140 2.7383 0.1955 0.53533765 145 2.7391 0.1944 0.53248104 150 2.7398 0.1931 0.52905538 155 2.7404 0.1921 0.52643084 160 2.7413 0.1911 0.52386243 165 2.7432 0.1888 0.51791616 170 2.7434 0.1882 0.51630788 175 2.7439 0.1875 0.51448125 180 2.727 0.1867 0.5091309
Untuk tabel 1a sampai tabel 1e, plot grafik dan regresi daya listrik (P) terhadap waktu, sehingga didapatkan energy yang merupakan luas daerah dibawah grafik.
Grafik 1a. Daya terhadap waktu (60 detik)
P(t)1a = (-0.003505) t + 0.8222 E1a = ∫
= ∫ [ ]
= 43.0230 Joule
Grafik 1b. Daya terhadap waktu (90 detik)
P(t)1b = (-0.001518) t + 0.8378 E1b = ∫
= ∫ [ ]
= 69.2541 Joule
Grafik 1c. Daya terhadap waktu (120 detik)
P(t)1c = (-0.001236)t + 0.7671 E1c = ∫
= ∫ [ ]
= 83.1528 Joule
Grafik 1d. Daya terhadap waktu (150 detik)
P(t)1d = (-0.001263)t + 0.7009 E1d = ∫
= ∫ [ ]
= 90.9262 Joule
Grafik 1e. Daya terhadap waktu (180 detik)
P(t)1e = (-0.001263)t + 0.7009 E1e = ∫
= ∫ [ ]
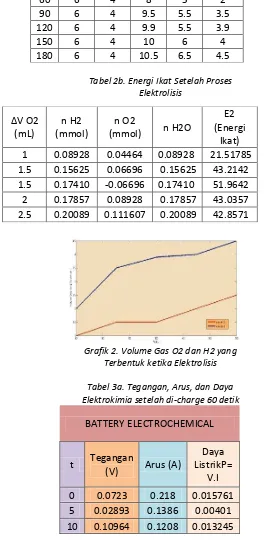
Tabel 2a. Perubahan Volume Gas O2 dan H2
Setelah Proses Elektrolisis
Tabel 2b. Energi Ikat Setelah Proses Elektrolisis
Grafik 2. Volume Gas O2 dan H2 yang Terbentuk ketika Elektrolisis
Tabel 3a. Tegangan, Arus, dan Daya Elektrokimia setelah di-charge 60 detik
BATTERY ELECTROCHEMICAL
Tabel 3b. Tegangan, Arus, dan Daya Elektrokimia setelah di-charge 90 detik
BATTERY ELECTROCHEMICAL
Tabel 3c. Tegangan, Arus, dan Daya Elektrokimia setelah di-charge 120 detik
BATTERY ELECTROCHEMICAL
Tabel 3d. Tegangan, Arus, dan Daya Elektrokimia setelah di-charge 150 detik
BATTERY ELECTROCHEMICAL
Tabel 3e. Tegangan, Arus, dan Daya Elektrokimia setelah di-charge 180 detik
Untuk tabel 3a sampai tabel 3e, plot grafik dan regresi daya listrik (P) terhadap waktu, sehingga didapatkan energy yang merupakan luas daerah dibawah grafik.
Grafik 3a. Daya terhadap waktu (60 detik)
P(t)4a = (-0.0002516)t + 0.012263 E4a = ∫
= ∫ [ ]
= 0.1101 Joule
Grafik 3b. Daya terhadap waktu (90 detik)
P(t)4b = (-0.00352)t + 0.03154 E4b = ∫
= ∫ [ ]
= 0.1394 Joule
Grafik 3c. Daya terhadap waktu (120 detik)
P(t)4c = (-0.003606)*t + 0.04244
E4c = ∫
= ∫ [ ]
= 0.2441 Joule
Grafik 3d. Daya terhadap waktu (150 detik)
P(t)4d = (-0.003846)*t + 0.03978 E4d = ∫
= ∫ [ ]
= 0.2055 Joule
Grafik 3e. Daya terhadap waktu (180 detik)
P(t)4e = (-0.0042405)*t + 0.046317 E4e = ∫
= ∫ [ ]
= 0.2511 Joule
Tabel 4a. Perubahan Volume Gas O2 dan H2
Setelah Proses Elektrokimia
t Vi H2 (mL)
Vi O2 (mL)
Vf H2 (mL)
Vf O2 (mL)
ΔV H2 (mL)
60 8 5 7.5 5 0.5
90 9.5 5.5 9 5.4 0.5
120 9.9 5.5 9 5 0.9
150 10 6 9 5.5 1
Tabel 4b. Energi Ikat Proses Elektrokimia
Tabel 5. Hasil Perhitungan Energi Untuk Setiap Lamanya Waktu Charge Battery
t E1 E2 E3 E4
Tabel 6. Efisiensi Baterai
t η1 η2 η3 η4
3.2 Percobaan Fuel Cell Menggunakan Sel Surya
a. Cahaya Lampu
Tabel 7. Perubahan Tegangan, Arus, dan Daya Elektrolisis dengan paparan cahaya
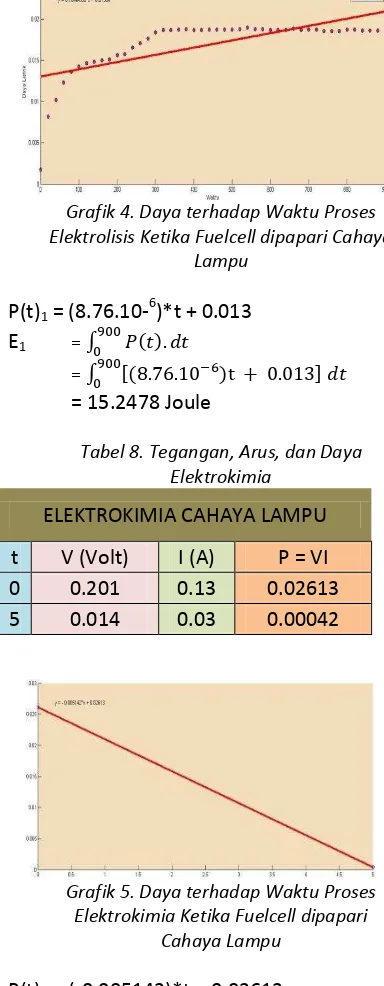
Grafik 4. Daya terhadap Waktu Proses Elektrolisis Ketika Fuelcell dipapari Cahaya
Lampu
P(t)1 = (8.76.10-6
)*t + 0.013 E1 = ∫
= ∫ [ ]
= 15.2478 Joule
Tabel 8. Tegangan, Arus, dan Daya Elektrokimia
ELEKTROKIMIA CAHAYA LAMPU
t V (Volt) I (A) P = VI
0 0.201 0.13 0.02613
5 0.014 0.03 0.00042
Grafik 5. Daya terhadap Waktu Proses Elektrokimia Ketika Fuelcell dipapari
Cahaya Lampu
P(t)4 = (-0.005142)*t + 0.02613 E4 = ∫
= ∫ [ ]
= 0.0644 Joule
b. Sinar Matahari
Tabel 9. Perubahan Tegangan, Arus, dan Daya Elektrolisis dengan paparan Sinar
Matahari
t Tegangan (Volt)
Arus (A)
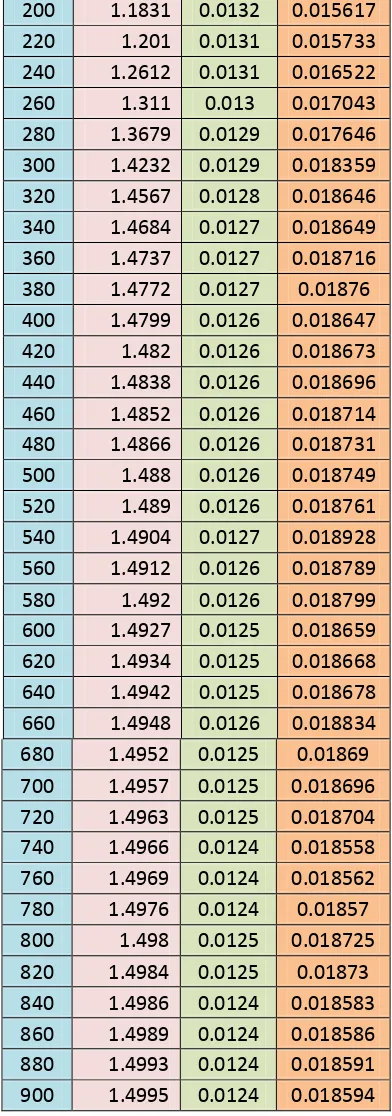
Daya (P) = VI 0 0.171 0.0057 0.0009747 20 0.5965 0.0137 0.0081721
40 0.769 0.014 0.010766
60 0.9726 0.014 0.0136164 80 1.1252 0.0131 0.0147401 100 1.2972 0.016 0.0207552
120 1.45 0.0168 0.02436
840 1.6676 0.0232 0.0386883 860 1.6563 0.0226 0.0374324 880 1.6517 0.0223 0.0368329 900 1.6515 0.0225 0.0371588
Lalu dengan regresi linier Daya terhadap waktu, didapatkan persamaan garisnya.
Grafik 6. Daya terhadap Waktu Proses Elektrolisis ketika Fuelcell dipapari sinar
matahari
P(t)1 = (2.034.10-5
)*t + 0.2288 E1 = ∫
= ∫ [ ]
= 214.157 Joule
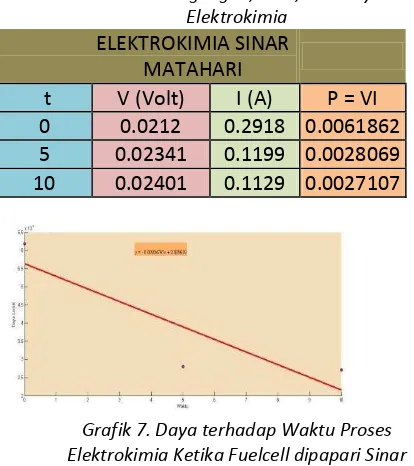
Tabel 10. Tegangan, Arus, dan Daya Elektrokimia
ELEKTROKIMIA SINAR MATAHARI
t V (Volt) I (A) P = VI 0 0.0212 0.2918 0.0061862 5 0.02341 0.1199 0.0028069 10 0.02401 0.1129 0.0027107
Grafik 7. Daya terhadap Waktu Proses Elektrokimia Ketika Fuelcell dipapari Sinar
Matahari
P(t)4 = (-0.0003476)*t + 0.005639 E4 = ∫
= ∫ [ ]
= 0.039 Joule
Tabel 11. Energi dan Efisiensi Fuelcell dengan Cahaya Lampu dan Sinar Matahari
Sumber Cahaya E1 E4 η4
Lampu 15.2478 0.0644 0.004224 Matahari 214.157 0.039 0.000182
I. Pembahasan
Grafik jumlah H2 dan O2 yang terbentuk dapat dilihat pada grafik 2. Grafik ini menerangkan bahwa jumlah H2 dan O2 yang terbentuk meningkat seiring lamanya waktu baterai di-charge.
Jumlah mol gas yang terbentuk dengan mol gas yang tersisa dapat dihitung oleh persamaan (3). Hasilnya sudah tertera pada tabel 2b.
Efisiensi pembentukan gas H2 dan O2 dengan baterai dapat dilihat pada tabel (6), sedangkan efisiensi dengan sel surya ada pada tabel 11.
Fuel cell harus dibuat lembab agar transfer proton dapat terjadi. Hal ini karena H+ membutuhkan air untuk dapat berpindah dari anoda ke katoda. Jika kondisi fuel cell kering, H+ tidak dapat berpindah dari anoda ke katoda. Karena pada dasarnya, fuel cell menghasilkan panas yang dapat menyebabkan keringnya membrane. Tegangan dan arus yang dihasilkan dapat turun jika kondisinya kering.
Perbandingan gas hydrogen dan oksigen yang terbentuk tidak 2:1 karena adanya reaksi pembatas. Oleh karena itu salah satu reaktan akan habis terlebih dahulu, sehingga hasil pembentukannya tidak sesuai dengan perbandingan koefisien yaitu 2:1.
dihasilkan untuk dapat dikonversi menjadi energy listrik. Sisa gas tersebut memiliki energy yang kurang dari energy ambang sehingga tidak cukup untuk menggerakkan mobil-mobilan.
Proses elektrolisis prinsipnya adalah mengalirkan arus listrik pada air, sehingga air dapat terdisosiasi ke bentuk molekul diatomik yaitu hydrogen dan oksigen. Elektrolisis dari satu mol air menghasilkan satu mol gas hydrogen dan setengah mol gas oksigen dalam bentuk diatomic.
Cara kerja fuel cell diawali dari masuknya gas hidogen ke bagian anoda fuel cell. Kemudian gas ini akan tertekan menuju katalis. Ketika molekul hydrogen terkena bagian platina dari katalis, molekul ini terbagi menjadi 2 ion hydrogen dan 2 elektron. Elektron dialirkan melewati anoda, kemudian bergerak ke arah rangkaian luar lalu kembali menuju katoda. Sementara itu pada bagian katoda dari fuel cell, gas oksigen terdorong menuju katalis sehingga terbentuk 2 atom oksigen. Setiap atom memiliki muatan negative yang besar sehingga dapat menarik ion positif hydrogen melewati membrane, dimana ion hydrogen, oksigen, dan elektron yang berasal dari bagian luar rangkaian bergabung membentuk molekul air.
Ketika percobaan sel surya menggunakan cahaya lampu, tidak teramati gas H2 dan O2. Hal ini dapat terjadi karena frekuensi cahaya lampu tidak mampu membuat elektron tereksitasi dari tingkat valensi ke tingkat konduksi. Oleh karena itu kita tidak akan memiliki sumber tegangan untuk mengelektrolisis air agar didapatkan gas O2 dan H2.
Sedangkan pada percobaan dengan menggunakan sinar matahari, akan dihasilkan gas H2 dan O2. Hal ini karena cahaya matahari memiliki banyak spectrum warna sehingga terdapat berbagai frekuensi cahaya yang dapat menyebabkan elektron tereksitasi. Oleh karena itu, sumber tegangan dapat dihasilkan untuk
mengelektrolisis air agar terbentuk gas O2 dan H2.
Faktor yang dapat mempengaruhi kecepatan terbentuknya gas pada proses elektrolisis adalah besarnya arus yang mengalir saat proses elektrolisis. Selain itu, jenis katalis yang digunakan juga dapat mempengaruhi karena fungsi katalis sebagai pemercepat reaksi. Semakin baik jenis katalis yang digunakan, maka semakin cepat reaksinya, oleh karena itu semakin cepat pula gas terbentuk pada proses elektrolisis.
Asumsi yang digunakan pada percobaan ini adalah daya listrik yang dihasilkan dianggap sebagai luas daerah di bawah grafik regresi garis. Selain itu, jumlah mol atom gas di dalam kerucut dianggap ideal sehingga nilai molnya dapat dihitung dengan cara volume gas dibagi 22.4, serta air dapat terelektrolisis sempurna.
II. Kesimpulan
1. Jumlah gas yang terbentuk dipengaruhi oleh lamanya waktu proses elektrolisis berlangsung.
2. Efisiensi yang dihasilkan pada percobaan menggunakan baterai bermacam-macam dengan rentang yang cukuup jauh
3. Adanya sisa gelembung gas pada proses elektrokimia karena gelembung gas tersebut tidak memiliki cukup energy untuk dapat menggerakan mobil-mobilan.
III. Pustaka
[1]www.mie.uth.gr/ekp_yliko/FuelCells.ppt (diakses 24 Oktober 2014 pukul 17.10)
[2]http://americanhistory.si.edu/fuelcells/pem /pemmain.htm (diakses 24 Oktober 2014, pukul 18.15)
[3]Modul Eksperimen Fisika, Institut Teknologi Bandung 2014-2015
![Gambar 2. Prinsip Kerja Sel Surya[4]](https://thumb-ap.123doks.com/thumbv2/123dok/3918444.1864504/2.612.343.546.165.268/gambar-prinsip-kerja-sel-surya.webp)