7 BAB II LANDASAN TEORI A. TINJAUAN PUSTAKA 1. Klasifikasi tumbuhan 1.1. Klasifikasi Rambutan
Rambutan berasal dari Malaysia dan Indonesia. Rambutan banyak terdapat di daerah tropis seperti Afrika, Kamboja, kepulauan Karibia, Amerika Tengah, India, Indonesia, Malaysia, Filipina, Thailand dan Sri Lanka. Kata Rambutan berasal dari bentuk buahnya yang mempunyai kulit menyerupai rambut. Secara taksonomi tumbuhan rambutan (Nephelium lappaceum) dikelompokkan dalam klasifikasi sebagai berikut (Alibasyah,2010) :
Divisio : Magnoliophyta
Kelas : Magnoliopsida Ordo : Sapindales
Familia : Sapindaceae Genus : Nephelium
Spesies : Nephelium lappaceum
Nama asing dari tumbuhan rambutan adalah Rambutan, Usan (Filipina); Rambután (Spanyol); Rambutan (Inggris, Jerman, Malaysia); Ngoh, Phruan (Thailand); Chôm chôm, Vai thiêù (Vietnam); saaw maaw, ser mon (Kamboja); Ramboutan, Litchi chevelu (Perancis). Rambutan banyak ditanam sebagai pohon Gambar 1. Rambutan ( Alibasyah,
buah, dan kadang-kadang ditemukan tumbuh liar. Tumbuhan tropis ini memerlukan iklim lembab dengan curah hujan tahunan paling sedikit 2.000 mm. Rambutan merupakan tanaman dataran rendah, hingga ketinggian 300-600 m dibawah permukaan laut. Pohon dengan tinggi 15-25 m ini mempunyai banyak cabang. Jenis-jenis rambutan yang banyak terdapat di Indonesia adalah Rambutan Rapiah, Aceh, Lebak bulus, Simacan, Binjai, Sinyonya, Garuda, dan lain-lain (Alibasyah, 2010).
1.2. Klasifikasi Jamur Tiram
Taksonomi jamur putih adalah sebagai berikut (Akindahunsi, 2006) :
Super kerajaan : Eukariota
Kerajaan : Myceteae
Divisi : Amastimygota Sub divisi : Eumycota
Kelas : Basidiomycetes
Sub kelas : Holobasidiomycetes
Bangsa : Agaricales
Suku : Agariceae Spesies : Pleurotus ostreatus
Ditinjau dari segi morfologisnya, tubuh jamur tiram terdiri dari tudung (pileus) dan tangkai(stipe). Jamur tiram tersebar luas di hutan beriklim subtropis di seluruh dunia, meskipun tidak terdapat di Amerika Utara, digantikan oleh P. pulmonaris dan P. populinus. Jamur tiram adalah salah satu dari beberapa jamur
Gambar 2. Jamur tiram ( Akindahunsi, 2006)
kayu. Pileus berbentuk mirip cangkang telinga dengan ukuran diameter 5-15 cm dan permukaan bagian bawah berlapis-lapis seperti insang berwarna putih dan lunak yang berisi basidiospora. Bentuk pelekatan lamella ini adalah memanjang sampai ke tangkai atau disebut dicrident. Sedangkan tangkainya dapat pendek atau panjang (2-6 cm) tergantung pada kondisi lingkungan dan iklim yang mempengaruhi pertumbuhannya. Tangkai ini menyangga tudung agak lateral(di bagian tepi) atau eksentris(agak ke tengah) (Chirinang, 2009).
Jamur tiram putih mengandung protein sebanyak 19-35% dari berat kering jamur, dan karbohidrat sebanyak 46,6-81,8%. Selain itu jamur mengandung vitamin atau vitamin B1, vit B2, niasin, biotin, serta beberapa garam mineral unsur-unsur Ca, P, Fe, Na, K dalam komposisi yang seimbang. Macam asam amino yang terkandung dalam jamur tiram adalah alanin, arginin, asam aspartat, sistein, asam glutamat, glutamina, glisin, histidin, isoleusin, lisin, metinin, prolin, dll (Akindahunsi AA, Oyetayo FL., 2006).
2. Tinjauan Antioksidan
Menurut Widjaya (2003), antioksidan dinyatakan sebagai senyawa secara nyata dapat memperlambat oksidasi, walaupun dengan konsentrasi yang lebih rendah sekalipun dibandingkan dengan substrat yang dapat dioksidasi. Antioksidan berperan penting untuk mempertahankan mutu produk pangan. Berbagai kerusakan seperti ketengikan, perubahan nilai gizi, perubahan warna dan aroma, serta kerusakan fisik lain pada produk pangan karena oksidasi dapat dihambat oleh antioksidan.
2.1 Berdasarkan Mekanisme Kerja
2.1.1 Antioksidan primer adalah antioksidan yang bekerja dengan mencegah reaksi berantai pembentukan radikal bebas dengan mengubahnya menjadi senyawa yang tidak reaktif atau stabil. Antioksidan ini berperan sebagai donor hidrogen atau dapat juga sebagai akseptor elektron. Contohnya adalah enzim superoksida dismutase (SOD). Enzim ini sangat penting sekali, dikarenakan dapat melindungi sel-sel dalam tubuh akibat kerusakan yang ditimbulkan oleh radikal bebas. Kinerja enzim ini dipengaruhi oleh beberapa mineral seperti Mn, Zn, Cu, dan Se (Kumalaningsih, 2007).
2.1.2 Antioksidan sekunder adalah senyawa penangkap radikal bebas yang mampu mencegah terjadinya reaksi berantai, sehingga tidak terjadi kerusakan yang lebih hebat. Contoh antioksidan sekunder adalah vitamin C, vitamin E, dan betakaroten (Kumalaningsih, 2007).
2.1.3 Antioksidan tersier dan Oxygen Scavenger. Antioksidan tersier merupakan senyawa yang dapat memperbaiki kerusakan sel ataupun jaringan yang disebabkan radikal bebas. Metionin sulfoksidan reduktase merupakan contoh antioksidan tersier yang dapat memperbaiki DNA dalam sel. Oxygen Scavenger adalah antioksidan yang dapat mengikat okigen, sehingga tidak mendukung kelangsungan reaksi oksidasi oleh radikal bebas, misalnya vitamin C (Atmosukarto dan Mitri, 2003).
2.2 Berdasarkan sumbernya
2.2.1 Antioksidan sintetik adalah antioksidan alami yang telah diproduksi secara sintetis untuk tujuan komersial. Antioksidan sintetik yang
diijinkan penggunaannya untuk makanan yaitu Butil Hidroksi Anisol (BHA), Butil Hidroksi Toluen (BHT), Propil galat, Tert-Butil Hidoksi Quinon (TBHQ) dan Tokoferol.
2.2.2 Antioksidan alami merupakan antioksidan yang diperoleh dari bahan alam, merupakan senyawa metabolit sekunder tumbuhan seperti senyawa golongan alkaloid, fenolik, flavanoid. Golongan flavonoid yang memiliki aktivitas antioksidan meliputi flavon, flavonol, isoflavon, kateksin, flavonol dan kalkon. Contoh: Epigalokatekin galat (EGCG) dalam ekstrak teh hijau dan 6 gingerol dan 6-shogaol dalam Jahe (Zingiber officinale Roscoe).
Untuk mengetahui apakah suatu zat memiliki kemampuan sebagai antioksidan maka diperlukan uji aktivitas antioksidan, diantaranya dengan penentuan bilangan peroksida, uji asam Tiobarbiturat (TBA), dan penangkapan radikal DPPH.
3. Mekanisme kerja antioksidan
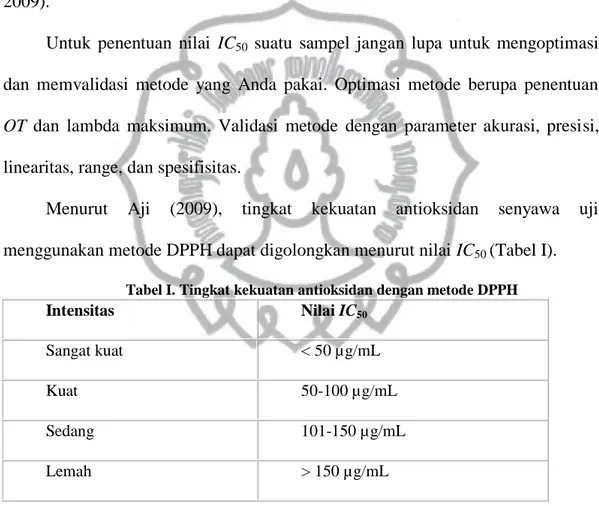
Mekanisme kerja antioksidan memiliki dua fungsi. Fungsi pertama merupakan fungsi utama dari antioksidan yaitu sebagai pemberi atom hidrogen. Antioksidan (AH) yang mempunyai fungsi utama tersebut sering disebut sebagai antioksidan primer. Senyawa ini dapat memberikan atom hidrogen secara cepat ke radikal lipida (R*, ROO*) atau mengubahnya ke bentuk lebih stabil, sementara turunan radikal antioksidan (A*) tersebut memiliki keadaan lebih stabil dibanding radikal lipida. Fungsi kedua merupakan fungsi sekunder antioksidan, yaitu memperlambat laju autooksidasi dengan berbagai mekanisme diluar mekanisme
pemutusan rantai autooksidasi dengan pengubahan radikal lipida ke bentuk lebih stabil (Rohmatussolihat, 2009).
Mekanisme pemberian satu elektron oleh antioksidan ini dapat berlangsung sebagai berikut (Rohmatussolihat, 2009):
Gambar 3. Mekanisme kerja antioksidan (Rohmatussolihat,2009)
3.1 Metode DPPH
DPPH adalah radikal bebas yang stabil dalam larutan berair atau larutan metanol serta memiliki serapan yang kuat pada panjang gelombang 515 nm dalam bentuk teroksidasi. DPPH mampu menerima elektron atau radikal hidrogen dari senyawa lain sehingga membentuk molekul diamagnetik yang stabil. Tujuan metode ini adalah mengetahui parameter konsentrasi yang ekuivalen memberikan 50% efek aktivitas antioksidan (IC50). Hal ini dapat dicapai dengan cara
menginterpretasikan data eksperimental dari metode tersebut. DPPH merupakan radikal bebas yang dapat bereaksi dengan senyawa yang dapat mendonorkan atom hidrogen, dapat berguna untuk pengujian aktivitas antioksidan komponen tertentu dalam suatu ekstrak (Dehpour, Ebrahimzadeh, Fazel, dan Mohammad, 2009).
Karena adanya elektron yang tidak berpasangan, DPPH memberikan serapan kuat pada 516 nm. Ketika elektronnya menjadi berpasangan oleh keberadaan penangkap radikal bebas, maka absorbansinya menurun secara stokiometri sesuai jumlah elektron yang diambil. Keberadaan senyawa
antioksidan dapat mengubah warna larutan DPPH dari ungu menjadi kuning (Dehpour, Ebrahimzadeh, Fazel, dan Mohammad, 2009). Perubahan absorbansi akibat reaksi ini telah digunakan secara luas untuk menguji kemampuan beberapa molekul sebagai penangkap radikal bebas.
Metode DPPH merupakan metode yang mudah, cepat, dan sensitif untuk pengujian aktivitas antioksidan senyawa tertentu atau ekstrak tanaman (Aji, 2009).
Untuk penentuan nilai IC50 suatu sampel jangan lupa untuk mengoptimasi
dan memvalidasi metode yang Anda pakai. Optimasi metode berupa penentuan OT dan lambda maksimum. Validasi metode dengan parameter akurasi, presisi, linearitas, range, dan spesifisitas.
Menurut Aji (2009), tingkat kekuatan antioksidan senyawa uji menggunakan metode DPPH dapat digolongkan menurut nilai IC50 (Tabel I).
Tabel I. Tingkat kekuatan antioksidan dengan metode DPPH
Intensitas Nilai IC50 Sangat kuat < 50 µg/mL Kuat 50-100 µg/mL Sedang 101-150 µg/mL Lemah > 150 µg/mL 4. Ekstraksi
Ekstraksi adalah penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Menurut Ewing (1975), proses awal ekstraksi komponen-komponen aktif dari suatu jaringan
tanaman adalah dengan menghaluskan jaringan tanaman tersebut. Hal ini bertujuan untuk memperbesar peluang terlarutnya komonen-komponen metabolit yang diinginkan. Sebelum di ekstraksi jaringan tanaman dikeringkan untuk mempertahankan kanduungan metabolit dalam tanaman yang telah dipotong sehingga proses metabolisme terhenti. Metode ekstraksi ada berbagai macam, salah satunya adalah ekstraksi dengan menggunakan pelarut dengan cara dingin atau cara panas.
4.1Cara dingin 4.1.1 Maserasi
Maserasi adalah proses pengekstrakan simplisia dengan menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan. Secara teknologi termasuk ekstraksi dengan prinsip metode pencapaian konsenterasi pada keseimbangan. Maserasi kinetik berarti dilakukan pengadukan yang kontinu (terus- menerus). Remaserasi berarti dilakukan pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama dan seterusnya. Prinsip dari metode ini adalah proses difusi pelarut ke dalam dinding sel tanaman untuk mengekstrak senyawa-senyawa yang ada dalam tanaman tersebut. Biasanya maserasi digunakan untuk mengekstrak senyawa yang kurang tahan panas, dan digunakan untuk sampel yang belum diketahui karakteristik senyawanya. Sedangkan kelemahan metode ini adalah waktu ekstraksi yang relatif lama (Yulanda,2007).
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai sempurna (exhaustive extraction) yang umumnya dilakukan pada suhu kamar. Proses terdiri dari tahapan pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya (penetesan atau penampungan ekstrak) terus menerus sampai diperoleh perkolat yang jumlahnya 1-5 kali bahan (Yulanda, 2007).
4.2Cara Panas 4.2.1 Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur pada titik didihnya selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik. Umumnya dilakukan pengulangan proses pada residu pertama sampai 3-5 kali sehingga proses ekstraksi sempurna (Rini,2012).
4.2.2 Soxhletasi
Soxhletasi adalah ekstraksi yang umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik (Rini,2012).
4.2.3 Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada temperatur yang lebih tinggi dari temperatur kamar, secara umum dilakukan pada temperatur 40-500C (Rini,2012).
4.2.4 Infusa
Infus adalah ekstraksi dengan pelarut air pada temeratur 96-980C selama waktu 15-20 menit di penangas air, dapat berupa bejana infus tercelup dalam penangas air mendidih (Rini,2012).
4.2.5 Dekokta
Dekokta adalah infus pada waktu yang lebih lama (≥300C) dan temperatur sampai titik didih air (Rini,2012).
5 Identifikasi Kandungan Kimia
5.1Uji Flavonoid
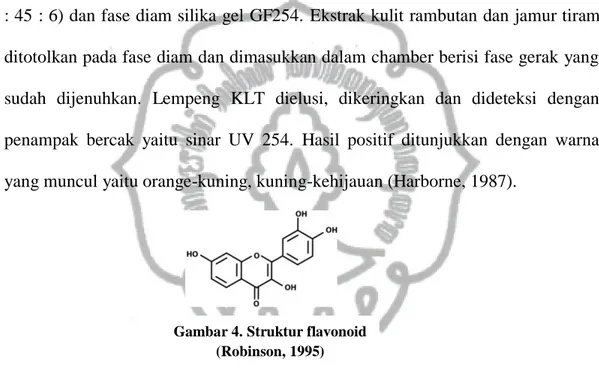
Fase gerak yang digunakan adalah kloroform : asam asetat glasial : air (90 : 45 : 6) dan fase diam silika gel GF254. Ekstrak kulit rambutan dan jamur tiram ditotolkan pada fase diam dan dimasukkan dalam chamber berisi fase gerak yang sudah dijenuhkan. Lempeng KLT dielusi, dikeringkan dan dideteksi dengan penampak bercak yaitu sinar UV 254. Hasil positif ditunjukkan dengan warna yang muncul yaitu orange-kuning, kuning-kehijauan (Harborne, 1987).
5.2 Uji Saponin
Fase gerak yang digunakan adalah kloroform : asam asetat glasial : metanol : air (64 : 32 : 12 : 8) dan fase diam silika gel GF254. Ekstrak kulit rambutan dan jamur tiram ditotolkan pada fase diam dan dimasukkan dalam chamber berisi fase gerak yang sudah dijenuhkan. Lempeng KLT dielusi, dikeringkan dan dideteksi dengan cara lempeng KLT disemprot pereaksi anisaldehid, dipanaskan di oven pada suhu 1000 C selama 5-10 menit kemudian dideteksi dengan penampak bercak yaitu sinar UV 366. Hasil positif ditunjukkan
Gambar 4. Struktur flavonoid (Robinson, 1995)
dengan warna yang muncul yaitu biru-violet, hijau fluoresensi (Wagner dan Bladt, 1996).
5.3 Uji Tanin
Fase gerak yang digunakan adalah n-butanol : asam asetat glasial : air (14 : 1 : 5) diikuti asam asetat 6 % dan fase diam silika gel GF254 Ekstrak kulit rambutan dan jamur tiram ditotolkan pada fase diam dan dimasukkan dalam chamber berisi fase gerak yang sudah dijenuhkan. Lempeng KLT dielusi, dikeringkan dan diuapkan dengan NH3. Kemudian dideteksi dengan penampak
bercak yaitu sinar UV 366. Hasil positif ditunjukkan dengan warna yang muncul yaitu ungu (Wagner dan Bladt, 1996).
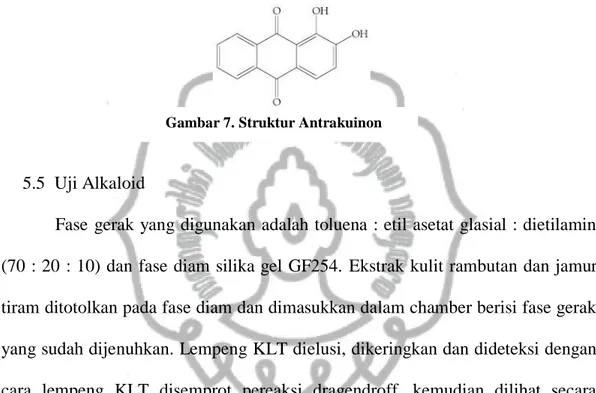
5.4 Uji antrakuinon
Fase gerak yang digunakan adalah etil asetat : metanol : air (100 : 13,5 : 10) dan fase diam silika gel GF254. Ekstrak kulit rambutan dan jamur tiram
Gambar 5. Struktur saponin (Robinson, 1995)
ditotolkan pada fase diam dan dimasukkan dalam chamber berisi fase gerak yang sudah dijenuhkan. Lempeng KLT dielusi, dikeringkan dan dideteksi dengan cara lempeng KLT disemprot pereaksi Brown Treager. Kemudian dideteksi dengan penampak bercak yaitu sinar UV 366. Hasil positif ditunjukkan dengan warna yang muncul yaitu merah (Wagner dan Bladt, 1996).
5.5 Uji Alkaloid
Fase gerak yang digunakan adalah toluena : etil asetat glasial : dietilamin (70 : 20 : 10) dan fase diam silika gel GF254. Ekstrak kulit rambutan dan jamur tiram ditotolkan pada fase diam dan dimasukkan dalam chamber berisi fase gerak yang sudah dijenuhkan. Lempeng KLT dielusi, dikeringkan dan dideteksi dengan cara lempeng KLT disemprot pereaksi dragendroff, kemudian dilihat secara visual. Hasil positif ditunjukkan dengan warna yang muncul yaitu oranye kecoklatan (Wagner dan Bladt, 1996).
5.6 Uji Terpenoid
Fase gerak yang digunakan adalah toluena : etil asetat (93 : 7) dan fase diam silika gel GF254. Ekstrak kulit rambutan dan jamur tiram ditotolkan pada
Gambar 7. Struktur Antrakuinon
fase diam dan dimasukkan dalam chamber berisi fase gerak yang sudah dijenuhkan. Lempeng KLT dielusi, dikeringkan dan dideteksi dengan cara lempeng KLT disemprot pereaksi vanillin asam sulfat, dipanaskan di oven pada suhu 1100 C selama 5-10 menit kemudian dilihat secara visual. Hasil positif ditunjukkan dengan warna yang muncul yaitu coklat kemerahan, violet atau oranye (Wagner dan Bladt, 1996).
6 Spektrofotometri UV-Vis
Spektrosfotokopi merupakan studi mengenai interaksi cahaya dengan atom atau molekul. Bila cahaya jatuh pada senyawa, maka sebagai cahaya tersebut akan terserap oleh molekul tersebut. Banyaknya sinar yang diabsorbsi adalah sebanding dengan konsentrasi senyawa yang dianalisis (Christian, 2004).
Spektrofotometri UV-Vis adalah anggota teknik analisis spektroskopik yang memakai sumber REM (radiasi elektromagnetik) ultraviolet dekat (190-380 nm) dan sinar tampak (380-780 nm) dengan memakai instrumen spektrofotometer. Spektrofotometri UV-Vis melibatkan energi elektronik yang cukup besar pada molekul yang dianalisis, sehingga spektrofotometri UV-Vis lebih banyak dipakai untuk analisis kuantitatif dibandingkan kualitatif (Hendayana, 2009).
Pelarut yang banyak digunakan untuk spektroskopi UV adalah etanol 95% karena kebanyakan golongan senyawa larut dalam pelarut tersebut. Alkohol mutlak niaga harus dihindari karena mengandung benzena yang menyerap di daerah UV pendek. Pelarut lain yang sering digunakan ialah air, metanol, heksana, eter minyak bumi, dan eter. Pelarut seperti kloroform dan piridina sebaiknya dihindari karena menyerap kuat di daerah 200-260 nm, tetapi sangat cocok untuk mengukur spektrum pigmen tumbuhan, seperti karotenoid, di daerah spektrum tampak (Harborne, 1987).
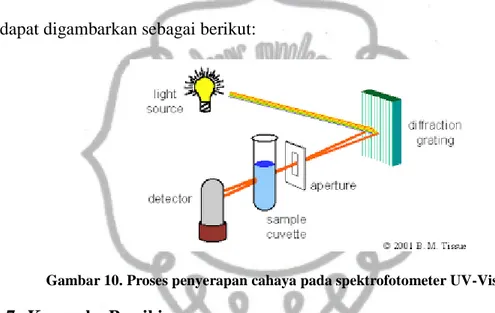
Proses Absorbsi Cahaya pada Spektrofotometri
Ketika cahaya dengan panjang berbagai panjang gelombang (cahaya polikromatis) mengenai suatu zat, maka cahaya dengan panjang gelombang tertentu saja yang akan diserap. Di dalam suatu molekul yang memegang peranan penting adalah elektron valensi dari setiap atom yang ada hingga terbentuk suatu materi. Elektron-elektron yang dimiliki oleh suatu molekul dapat berpindah (eksitasi), berputar (rotasi) dan bergetar (vibrasi) jika dikenai suatu energi. Jika zat menyerap cahaya tampak dan UV maka akan terjadi perpindahan elektron dari keadaan dasar menuju ke keadaan tereksitasi. Perpindahan elektron ini disebut transisi elektronik. Apabila cahaya yang diserap adalah cahaya inframerah maka elektron yang ada dalam atom atau elektron ikatan pada suatu molekul dapat hanya akan bergetar (vibrasi). Sedangkan gerakan berputar elektron terjadi pada energi yang lebih rendah lagi misalnya pada gelombang radio. Atas dasar inilah spektrofotometri dirancang untuk mengukur konsentrasi suatu yang ada dalam suatu sampel. Dimana zat yang ada dalam sel sampel disinari dengan cahaya yang
memiliki panjang gelombang tertentu. Ketika cahaya mengenai sampel sebagian akan diserap, sebagian akan dihamburkan dan sebagian lagi akan diteruskan (Eka, 2007).
Pada spektrofotometri, cahaya datang atau cahaya masuk atau cahaya yang mengenai permukaan zat dan cahaya setelah melewati zat tidak dapat diukur, yang dapat diukur adalah It/I0 atau I0/It (perbandingan cahaya datang dengan
cahaya setelah melewati materi (sampel)). Proses penyerapan cahaya oleh suatu zat dapat digambarkan sebagai berikut:
Gambar 10. Proses penyerapan cahaya pada spektrofotometer UV-Vis
7 Kerangka Pemikiran
Kulit rambutan (Nephelium lappaceum) saat ini masih menjadi limbah dari makanan tetapi pada penelitian sebelumnya menyatakan bahwa ekstrak kulit rambutan ini bisa dijadikan pewarna makanan dan kosmetik. Penggunaan kulit rambutan belum maksimal, hal ini dikarenakan berdasarkan penelitian yang telah dilakukan kulit rambutan memiliki beberapa aktivitas farmakologi diantaranya sebagai antimikroba, antibakteri, antivirus, dan aktivitas antioksidan yang sangat kuat. Jamur telah banyak dimanfaatkan sebagai makanan masa kini karena kandungan protein dan lemak pada jamur tidak kalah dengan kandungan protein
dan lemak pada ayam potong. Selain itu, manfaat jamur tiram yang lain di bidang kesehatan adalah untuk menghentikan pendarahan dan mempercepat pengeringan luka pada permukaan tubuh, mencegah penyakit diabetes melitus dan mencegah penyempitan pembuluh darah, menurunkan kolesterol darah, kelenjar gondok dan influenza, sekaligus memperlancar buang air besar.
Penggunaan zat-zat yang bersifat antioksidan dapat mencegah berbagai penyakit yang ditimbulkan oleh radiasi sinar UV. Beberapa golongan senyawa aktif antioksidan seperti flavonoid, tanin, antraquinon, sinamat dan lain-lain telah dilaporkan memiliki kemampuan sebagai pelindung terhadap sinar UV. Sehingga perlu dilakukan penelitian untuk menguji aktivitas antioksidan kulit rambutan dan jamur tiram. Penelitian ini diharapkan mampu memberikan bukti ilmiah tentang pengujian aktivitas antioksidan ekstrak etanol kulit rambutan (Nephelium lappaceum) dan jamur tiram (Pleurotus ostreatus).
8 Hipotesis
1. Ekstrak etanol kulit rambutan (Nephelium lappaceum) dan jamur tiram (Pleurotus ostreatus) memiliki aktivitas antioksidan dilihat dari nilai IC50.
2. Kombinasi kulit rambutan (Nephelium lappaceum) dan jamur tiram (Pleurotus ostreatus) memiliki aktivitas antioksidan yang sinergis dilihat dari nilai CI.