26
HASIL DAN PEMBAHASAN
1. Teknik Ekstraksi Protein Serisin
Hasil ekstraksi protein serisin dari kokon dipengaruhi oleh teknik
degumming dan isolasi protein yang dilakukan. Oleh karena itu perlu adanya
kajian tentang teknik ekstraksi yang tepat untuk menghasilkan respon (rendemen protein) yang maksimal. Ada beberapa kajian yang dilakukan dalam penelitian ini untuk mendapatkan teknik ekstraksi protein serisin.
Padamwar & Pawar (2004), menghasilkan protein serisin Bombyx mori terbaik dari teknik ekstraksi serisin melalui degumming dengan kombinasi suhu, waktu dan tekanan (105oC, 30 menit dan 200 mbar). Wu et al. (2007), mengisolasi protein serisin Bombyx mori dengan teknik pengendapan menggunakan etanol absolut. Akan tetapi etanol absolut harganya cukup mahal sehingga kurang efisien untuk diterapkan dalam skala industri. Perlu ada kajian tentang alternatif lain sebagai pengganti etanol absolut. Kajian isolasi protein pada tingkat kemurnian etanol berbeda dilakukan di awal penelitian ini untuk memberikan informasi tersebut. Berbeda dengan isolasi protein, teknik
degumming Attacus atlas pada awal penelitian ini masih merujuk pada Padamwar
& Pawar (2004), karena diduga kulit kokon Attacus atlas dan Bombyx mori mempunyai karakteristik yang sama.
a. Kajian Pengaruh Kemurnian Etanol terhadap Rendemen Protein Serisin Attacus atlas
Etanol digunakan sebagai pengendap dalam isolasi protein serisin. Wu et al. (2007) menggunakan etanol absolut dengan volume 75% (v/v) untuk mengisolasi protein serisin Bombyx mori. Pada kajian ini digunakan etanol dengan kemurnian berbeda yaitu etanol absolut dan etanol teknis 96% dengan masing-masing perbandingan volume terhadap larutan hasil degumming sebesar 75% (v/v). Hasil kajian pengaruh kemurnian etanol disajikan pada Tabel 10.
Tabel 10 Hasil kajian pengaruh kemurnian etanol terhadap rendemen protein serisin Attacus atlas
Perlakuan Rendemen protein serisin dalam kulit kokon (%)
E1 1,03 ± 0,04
E2 1,00 ± 0,16
27 Hasil kajian menunjukkan bahwa E1 (etanol absolut) dapat mengisolasi protein dengan rendemen sebesar 1,03 ± 0,04 %, sedangkan E2 (etanol teknis 96%) sebesar 1,00 ± 0,16 %. Analisis ragam dari data pengaruh kemurnian etanol (Lampiran 4) menunjukkan bahwa kemurnian etanol tidak berpengaruh nyata (P>0,05) terhadap rendemen protein serisin. Artinya tidak ada perlakuan yang berbeda nyata akibat perbedaan kemurnian etanol. Hasil tersebut memberikan informasi bahwa etanol teknis dapat digunakan untuk isolasi pada tahap kajian selanjutnya.
Teknik ekstraksi hanya dengan degumming secara fisik pada suhu 105oC selama 30 menit belum menghasilkan rendemen protein serisin (Tabel 10) yang maksimal, yaitu hanya sebesar 1,03 ± 0,04 % dan 1,00 ± 0,16 % saja. Rendemen protein serisin tersebut masih jauh dari informasi sebelumnya yang menyatakan bahwa rendemen protein serisin sebesar 20%-30% dari bobot kulit kokon (Masahiro et al. 2000). Hasil ekstraksi yang belum maksimal didukung oleh hasil analisis penampang fibroin dengan mikroskop (Gambar 5). Kondisi fibroin terlihat masih utuh dengan warna coklat tua pada kedua perlakuan. Hasil tersebut memperlihatkan bahwa serisin belum terekstraksi maksimal.
Gambar 5 Penampang fibroin Attacus atlas hasil ekstraksi pada suhu 105oC selama 30 menit dengan, a) isolasi etanol absolut dan b) isolasi etanol teknis pada pembesaran 400 kali.
b. Kajian Pengaruh Rasio Volume NaOH 0,1 N dan Jenis Spesies Ulat Sutera terhadap Rendemen Protein Serisin
Basa kuat NaOH 0,1 N adalah bahan pelarut untuk degumming yang dapat menghasilkan fibroin terbaik (Suriana 2011). Rasio volume NaOH 0,1 N digunakan untuk mengkaji pengaruhnya terhadap rendemen protein serisin yang dihasilkan. Suhu dan waktu yang digunakan pada kajian ini lebih tinggi daripada kajian sebelumnya yaitu dari 105oC selama 30 menit menjadi 115oC selama 40
28 menit. Hal ini dilakukan karena rendemen protein serisin yang dihasilkan pada kajian sebelumnya belum maksimal (Tabel 10).
Perlakuan jenis spesies juga digunakan pada tahap ini untuk mengetahui perbedaan pengaruhnya terhadap rendemen protein serisin. Spesies yang digunakan adalah Attacus atlas dan Bombyx mori. Rendemen protein serisin hasil perlakuan rasio volume NaOH 0,1 N dan jenis spesies ulat sutera disajikan pada Tabel 11.
Hasil analisis ragam (Lampiran 5) menunjukkan bahwa rasio volume NaOH 0,1 N tidak berpengaruh nyata (P>0,05), sedangkan spesies sangat berpengaruh nyata (P<0,01) terhadap rendemen protein serisin. Hal ini menunjukkan bahwa rasio volume NaOH 0,1 N baik 50% (1:1 terhadap DW) maupun 33,3% (1:2 terhadap DW) mempunyai pengaruh sama terhadap rendemen protein yang dihasilkan. Oleh karena itu rasio volume yang lebih kecil yaitu 33,3% NaOH 0,1 N akan digunakan pada proses degumming selanjutnya.
Tabel 11 Rendemen protein serisin hasil perlakuan rasio volume NaOH 0,1 N dan jenis spesies ulat sutera
Perlakuan
Rendemen protein serisin dalam kulit kokon
(%) S1R1 4,21 ± 0,30 a S1R2 3,99 ± 0,81 a S2R1 27,83 ± 3,76 b S2R2 32,34 ± 0,25 b
S1 = Attacus atlas, S2 = Bombyx mori, R1 = 50% NaOH 0,1 N, dan R2 = 33,3% NaOH 0,1 N. Huruf (a,b) adalah superscript dari hasil uji lanjut Tukey. Jika superscript sama hurufnya maka tidak berbeda nyata dan jika berbeda hurufnya maka berbeda nyata.
Perlakuan spesies mempunyai pengaruh nyata pada rendemen protein serisin. Hal ini membuktikan bahwa dengan perlakuan yang sama setiap spesies mempunyai potensi rendemen protein serisin yang berbeda. Perbedaan ini dapat disebabkan oleh dua hal, yaitu pertama karena kandungan protein serisin dalam kedua spesies kokon tersebut berbeda, kedua adalah akibat proses degumming yang digunakan pada kokon Bombyx mori seluruh serisinnya berhasil diekstraksi sedangkan pada Attacus atlas belum seluruhnya terekstraksi. Serat sutera Attacus
atlas diduga lebih kuat dan lebih sulit diekstraksi serisinnya dibandingkan dengan Bombyx mori, karena makanan Attacus atlas mengandung tanin yang dapat
29 Pada kajian ini rendemen protein serisin Bombyx mori yang dihasilkan sekitar 27%-32% (Tabel 11). Hal ini membuktikan bahwa teknik ekstraksi protein serisin dari kokon Bombyx mori pada kajian ini sudah cukup baik karena hasilnya sudah maksimal melepaskan protein serisin yang ada pada kokonnya dan hasil ini sesuai dengan Masahiro et al. (2000). Akan tetapi rendemen protein serisin
Attacus atlas memperlihatkan hasil yang belum maksimal yaitu masih berkisar
3%-4% (Tabel 11). Hal ini berarti bahwa tahap ekstraksi yang dilakukan pada kajian ini belum dapat mengekstraksi protein serisin dari kokon Attacus atlas secara maksimal. Perlu ada perlakuan lebih lanjut dalam mengekstraksi protein serisin dari kokon Attacus atlas. Meskipun demikian, rendemen protein Attacus
atlas pada kajian ini sudah mengalami peningkatan dari kajian sebelumnya, dari
sekitar 1% (Tabel 10) menjadi sekitar 4% (Tabel 11).
Penampang fibroin pada Gambar 6 mendukung hasil analisis ragam (Lampiran 5), dimana rasio volume NaOH 0,1 N tidak berpengaruh pada penampang fibroin, sedangkan spesies berpengaruh pada penampang fibroin. Penampang fibroin antar spesies terlihat berbeda dimana penampang fibroin
Bombyx mori terlihat lebih bersih dan bening dibandingkan penampang fibroin Attacus atlas.
Gambar 6 Penampang fibroin Attacus atlas (a. 50% NaOH 0,1 N; b. 33,3% NaOH 0,1 N), dan Bombyx mori (c. 50% NaOH 0,1 N; d. 33,3% NaOH 0,1 N) dengan 400 kali pembesaran.
c. Kajian Pengaruh Konsentrasi NaOH terhadap Rendemen Protein Serisin Attacus atlas
Pada kajian sebelumnya, rendemen protein serisin Attacus atlas belum maksimal seperti rendemen protein Bombyx mori (Tabel 11) yang sejalan dengan hasil Masahiro et al. (2000). Oleh karena itu dilakukanlah kajian pengaruh variasi konsentrasi NaOH (N) terhadap rendemen protein serisin Attacus atlas. Variasi konsentrasi NaOH yang digunakan adalah 0,05 N, 0,10 N, 0,15 N, 0,20 N, 0,25 N
30 dan 0,30 N. Rendemen protein serisin dengan konsentrasi NaOH berbeda dapat dilihat pada Tabel 12.
Tabel 12 Rendemen protein serisin Attacus atlas pada konsentrasi NaOH berbeda
Perlakuan
Rendemen protein serisin dalam kulit kokon
(%) N1 5,86 ± 0,27 a N2 6,78 ± 0,42 a N3 8,74 ± 2,07 a N4 7,40 ± 0,44 a N5 11,69 ± 0,34 b N6 11,84 ± 1,06 b
N1 = NaOH 0,05N, N2 = NaOH 0,10N, N3 = NaOH 0,15N, N4 = NaOH 0,20N, N5 = NaOH 0,25N dan N6 = NaOH 0,30N. Huruf (a,b) adalah superscript dari hasil uji lanjut Tukey. Jika superscript sama hurufnya maka tidak berbeda nyata dan jika berbeda hurufnya maka berbeda nyata.
Data pengaruh konsentrasi NaOH (Tabel 12) dan hasil analisis ragamnya (Lampiran 6) menunjukkan bahwa variasi konsentrasi NaOH berpengaruh nyata (P<0,01) terhadap rendemen protein. Analisis kemudian dilanjutkan dengan uji lanjut Tukey (Lampiran 6) dan menghasilkan nilai tengah N1, N2, N3 dan N4 yang tidak berbeda, begitu juga antara N5 dan N6 mempunyai nilai tengah yang relatif sama. Hal ini berarti bahwa penggunaan konsentrasi NaOH antara 0,05–0,20 N pada kajian ini mempunyai pengaruh yang sama terhadap rendemen protein, begitu juga konsentrasi NaOH antara 0,25-0,30 N. Akan tetapi nilai tengah dari rendemen protein serisin tersebut berbeda nyata pada konsentrasi NaOH 0,25-0,30 N (Lampiran 6). NaOH merupakan basa kuat yang dapat berfungsi sebagai pelarut. Pada konsentrasi yang semakin tinggi kemampuan melarutkannyapun semakin besar. Hal tersebut terjadi pada kajian ini, dimana pada konsentrasi tinggi yaitu 0,25 N dan 0,30 N, rendemen protein serisin yang dihasilkan lebih tinggi dibanding pada konsentrasi NaOH 0,05-0,20 N.
Hasil tersebut didukung oleh hasil analisis penampang fibroin (Gambar 7) menggunakan mikroskop dengan pembesaran 1000 kali. Pada Gambar 7 (a), (b), (c) dan (d) dengan konsentrasi masing-masing NaOH 0,05 N, 0,10 N, 0,15 N dan 0,20 N, menunjukkan kondisi penampang fibroin yang tidak berbeda jauh, warna coklat muda dan transparan. Warna coklat tua yang mulai memudar menunjukkan adanya material yang terlarut akibat proses ekstraksi. Berbeda dengan Gambar 7
31 (e) dan (f) dengan masing-masing konsentrasi NaOH 0,25 N dan 0,30 N yang mulai bening transparan.
Gambar 7 (f) fibroin terlihat sudah mengalami kerusakan dengan adanya lubang-lubang pada penampang filamennya. Hasil tersebut menunjukkan bahwa konsentrasi NaOH 0,30 N dapat menghasilkan rendemen protein tinggi (11,84% ± 1,06%) dan tidak berbeda nyata dengan NaOH 0,25 N, tetapi menyebabkan kerusakan pada fibroinnya sehingga tidak sesuai dengan tujuan awal degumming yaitu menghasilkan fibroin dengan kualitas baik. Kualitas fibroin salah satunya ditentukan oleh bentuk filamen yang tidak berbulu, bersimpul, pecah dan kusut (Atmosoedarjo et al. 2000). Konsentrasi NaOH 0,25 N akan digunakan pada kajian selanjutnya.
Gambar 7 Penampang fibroin Attacus atlas dengan 1000 kali pembesaran (a. 33,3% NaOH 0,05 N; b. 33,3% NaOH 0,10 N; c. 33,3% NaOH 0,15 N; d. 33,3% NaOH 0,20 N; e. 33,3% NaOH 0,25 N; f. 33,3% NaOH 0,30 N).
d. Optimasi Rendemen Protein Serisin
Pada kajian ekstraksi sebelumnya, yaitu pada teknik ekstraksi melalui
degumming (115oC selama 40 menit, 33,3% NaOH 0,25N) dan isolasi protein (etanol teknis 96%) dapat menghasilkan rendemen protein serisin 11,69% ± 0,34% dengan penampang fibroin yang baik. Hasil tersebut sudah cukup baik meskipun masih lebih kecil dari hasil Masahiro et al. (2000) yaitu sebesar 20%-30%. Oleh karena itu perlu dilakukan kajian optimasi rendemen protein serisin
a b c
32 untuk mengetahui rendemen protein serisin yang maksimal dari kokon Attacus
atlas. Rendemen protein yang maksimal dapat disebabkan oleh teknik ekstraksi
yang dilakukan atau kandungan protein serisin dalam kokon Attacus atlas memang hanya sekitar 11%.
Optimasi dilakukan dengan cara mencari titik optimum dari faktor-faktor yang berpengaruh dalam ekstraksi protein serisin. Faktor yang digunakan dalam penelitian ini adalah suhu dan waktu degumming, sedangkan volume dan konsentrasi NaOH serta etanol adalah konstan berdasarkan hasil kajian sebelumnya. Pada penelitian ini ada tiga optimasi rendemen protein.
d.1 Optimasi dengan Teknik Ekstraksi pada Degumming (33,3 NaOH 0,25 N) dan Isolasi Protein Serisin (etanol teknis 96%) (O1)
Penelitian ini terdiri dari dua kelompok yaitu O11 (tanpa penambahan AFB) dan O12 (dengan penambahan AFB). AFB adalah larutan hasil degumming yang terikut dalam fibroin basah. Hal ini dapat terjadi karena keterbatasan alat pemisah (pemisahan antara larutan dan fibroin) yang digunakan sehingga fibroin terlihat masih basah. Fibroin yang masih basah tersebut diduga karena masih adanya larutan hasil degumming yang terikut di fibroin. Serisin merupakan protein globular yang larut dalam air, sehingga pada proses degumming serisin akan terlarut dalam larutan hasil degumming.
Respon atau rendemen protein serisin dari O11 dan O12 dapat dilihat pada Lampiran 7. Data pada Lampiran 7 kemudian dianalisis dengan Response Surface
Methodology (RSM) dan hasilnya disajikan pada Lampiran 8 dan 9 dengan
masing-masing menghasilkan titik optimum pada suhu 90,96oC dan waktu 36,31 menit, serta suhu 77,52oC dan waktu 36,24 menit. Titik optimum yang dihasilkan merupakan optimasi minimum, artinya titik-titik tersebut meminimalkan respon (rendemen protein). Hal ini ditunjukkan oleh eigen value yang positif (Lampiran 8 dan 9). Lenth (2010) menyatakan jika dua eigen value bernilai positif maka optimasi minimum, jika keduanya bernilai negatif maka optimasi maksimum dan jika ada positif dan negatif maka optimasi saddle point atau pelana kuda.
Rendemen protein serisin dapat diduga dari persamaan fungsi yang dihasilkan dari pengolahan RSM. Fungsi persamaan yang dihasilkan sebagai berikut:
33 Persamaan O11 Y = 6,86 + 0,63X1 + 1,04X2 + 0,02X1X2 + 0,74X12 + 0,11X22 Persamaan O12 Y = 7,46 + 0,65X1 + 1,09X2 + 0,003X1X2 + 0,83X12 + 0,07X22
keterangan: Y = respon (rendemen protein serisin), X1= waktu, X2= suhu.
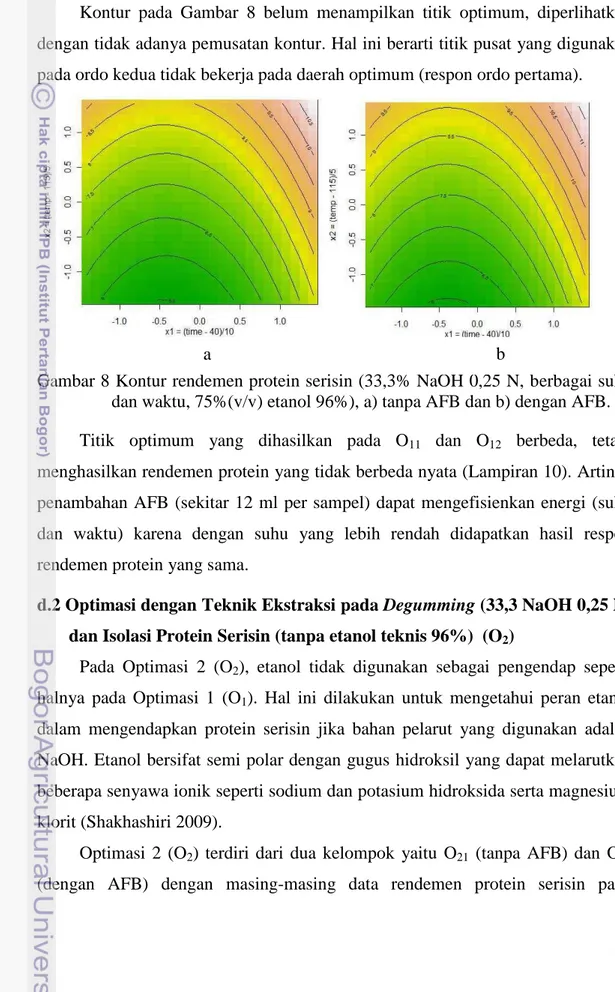
Kontur pada Gambar 8 belum menampilkan titik optimum, diperlihatkan dengan tidak adanya pemusatan kontur. Hal ini berarti titik pusat yang digunakan pada ordo kedua tidak bekerja pada daerah optimum (respon ordo pertama).
Gambar 8 Kontur rendemen protein serisin (33,3% NaOH 0,25 N, berbagai suhu dan waktu, 75%(v/v) etanol 96%), a) tanpa AFB dan b) dengan AFB.
Titik optimum yang dihasilkan pada O11 dan O12 berbeda, tetapi menghasilkan rendemen protein yang tidak berbeda nyata (Lampiran 10). Artinya penambahan AFB (sekitar 12 ml per sampel) dapat mengefisienkan energi (suhu dan waktu) karena dengan suhu yang lebih rendah didapatkan hasil respon rendemen protein yang sama.
d.2 Optimasi dengan Teknik Ekstraksi pada Degumming (33,3 NaOH 0,25 N) dan Isolasi Protein Serisin (tanpa etanol teknis 96%) (O2)
Pada Optimasi 2 (O2), etanol tidak digunakan sebagai pengendap seperti halnya pada Optimasi 1 (O1). Hal ini dilakukan untuk mengetahui peran etanol dalam mengendapkan protein serisin jika bahan pelarut yang digunakan adalah NaOH. Etanol bersifat semi polar dengan gugus hidroksil yang dapat melarutkan beberapa senyawa ionik seperti sodium dan potasium hidroksida serta magnesium klorit (Shakhashiri 2009).
Optimasi 2 (O2) terdiri dari dua kelompok yaitu O21 (tanpa AFB) dan O22 (dengan AFB) dengan masing-masing data rendemen protein serisin pada
34 Lampiran 11. Analisis RSM menghasilkan fungsi persamaan masing-masing sebagai berikut:
Persamaan O21 Y = 9,34 + 0,97X1 + 2,21X2 + 1,31X1X2 - 0,79X12 - 0,99X22 Persamaan O22 Y = 10,17 + 1,02X1 + 2,36X2 + 1,4X1X2 - 0,85X12 - 0,13X22
keterangan: Y = respon (rendemen protein serisin), X1= waktu, X2= suhu.
Titik optimum yang diperoleh masing-masing pada suhu 131,74oC dan 73,74 menit, serta suhu 129,66oC dan 70,36 menit. Dengan persamaan fungsi dan titik optimum tersebut, rendemen protein serisin dapat diduga.
Optimasi yang diperoleh dari percobaan O21 dan O22 adalah optimasi maksimum ditunjukkan eigen value yang keduanya bernilai negatif (Lampiran 12 dan 13). Hal ini berarti ekstraksi pada optimasi 2 (O2) menghasilkan titik optimum variabel bebas (faktor) yang dapat memaksimumkan respon (rendemen protein serisin), ditunjukkan gambar kontur (Gambar 9).
Optimasi 2 menghasilkan titik optimum yang berbeda dan didukung hasil analisis ragamnya (Lampiran 14) yang berbeda (P<0,05), dengan rendemen protein relatif tinggi pada O22 (Lampiran 11). Hasil ini menunjukkan bahwa penambahan AFB (O22) dalam perhitungan rendemen akan mengefisienkan energi, karena dengan suhu dan waktu yang lebih rendah dapat menghasilkan rendemen protein yang lebih tinggi.
Gambar 9 Kontur rendemen protein serisin (Degumming dengan 33,3% NaOH 0,25 N pada berbagai suhu, tekanan dan waktu tertentu), a) tanpa AFB dan b) dengan AFB.
35
d.3 Optimasi dengan Teknik Ekstraksi pada Degumming (tanpa NaOH) dan Isolasi Protein Serisin (etanol teknis 96%) (O3)
Optimasi 3 (O3) dilakukan karena pada kajian ekstraksi melalui degumming tanpa NaOH pada suhu 105oC selama 30 menit hanya menghasilkan rendemen protein serisin sekitar 1% dari bobot kulit kokon. Kajian O3 bekerja pada variasi suhu dan waktu (Tabel 7). Hasil dari kajian ini diharapkan dapat meningkatkan rendemen protein serisin sampai 20%-30% (Masahiro et al. 2000), meskipun tanpa penambahan basa kuat NaOH. Ekstraksi protein serisin pada degumming secara fisik juga dapat mengefektifkan proses isolasi karena hanya bekerja pada kombinasi suhu dan waktu tanpa harus memisahkan senyawa pelarut. Optimasi 3 (O3) bekerja pada variasi suhu dan waktu tertentu dan terdiri dari dua kelompok yaitu O31 (tanpa AFB) dan O32 (dengan AFB). Hasil rendemen protein dari masing-masing kelompok dapat dilihat pada Lampiran 15.
Analisis RSM (Lampiran 16 dan 17) menghasilkan fungsi persamaan sebagai berikut,
Persamaan O31 Y = 0,27 – 0,004X1 + 0,13X2 - 0,005X1X2 + 0,14X12 + 0,16X22 Persamaan O32 Y = 0,29 – 0,004X1 + 0,14X2 - 0,005X1X2 + 0,16X12 + 0,18X22
keterangan: Y = respon (rendemen protein serisin), X1= waktu, X2= suhu.
Fungsi persamaan tersebut dapat digunakan untuk memprediksi respon (rendemen protein) dengan variabel bebas suhu dan waktu, tetapi hanya berlaku pada teknik ekstraksi yang dilakukan. Artinya jika teknik ekstraksi yang dilakukan berbeda maka fungsi persamaan tersebut tidak dapat diterapkan.
Titik optimum yang dihasilkan O31 dan O32 sama yaitu pada suhu 113,07oC dan waktu 40,09 menit, yang dapat dilihat pada kontur Gambar 10. Titik optimum tersebut termasuk optimasi minimum yang berarti bahwa pada titik-titik tersebut respon (rendemen protein) adalah minimum. Hal ini ditunjukkan oleh eigen value yang positif (Lampiran 16 dan 17).
Hasil analisis ragam dari rendemen protein titik pusat O31 dan O32 juga tidak berbeda nyata (P>0,05) pada Lampiran 18. Hal ini berarti bahwa penambahan AFB (O32) tidak berpengaruh nyata terhadap rendemen protein pada kajian ini.
36 Gambar 10 Kontur rendemen protein serisin (Degumming pada berbagai suhu, tekanan dan waktu tertentu serta 75% (v/v) etanol teknis 96%), a) tanpa AFB dan b) dengan AFB.
d.4 Optimasi Ekstraksi dengan Rendemen Protein Serisin Tertinggi
Keberhasilan analisis RSM sangat ditentukan oleh respon ordo pertama (daerah optimum) (Myers 1971) karena digunakan sebagai titik pusat pada respon ordo kedua (titik optimum). Pada kajian optimasi, daerah optimum ditentukan berdasarkan suhu dan waktu dari Padamwar & Pawar (2004). Kontur (Gambar 8 dan Gambar 9) memperlihatkan bahwa titik optimum belum dapat ditampilkan karena titik pusat tidak bekerja pada daerah optimum. Hal ini berarti bahwa teknik ekstraksi yang dilakukan pada optimasi 1 (O1) dan 2 (O2) belum bekerja pada daerah optimum, sehingga untuk penelitian selanjutnya sebaiknya daerah optimum dicoba disekitar titik optimum yang sudah dihasilkan O1 dan O2. Meskipun demikian program R dapat memprediksi titik optimum dengan bantuan fungsi persamaan O1 dan O2. Berbeda dengan optimasi 3 (O3) yang dapat menghasilkan kontur memusat (Gambar 10). Hal ini berarti titik pusat pada O3 bekerja pada daerah optimum.
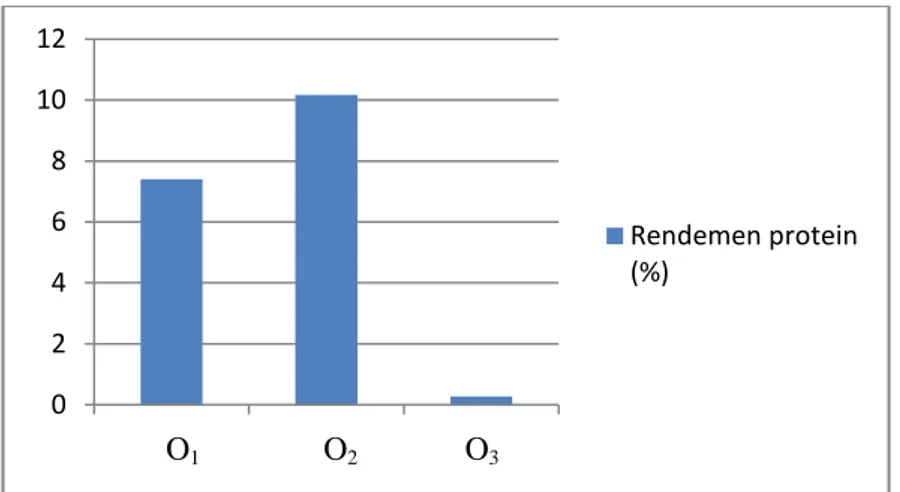
Kajian pada optimasi 2 (O2) menghasilkan optimasi maksimum, sehingga titik optimum yang diperoleh dapat memaksimumkan respon (rendemen protein serisin). Secara umum teknik ekstraksi yang dikerjakan pada O2 juga menghasilkan rendemen protein yang relatif lebih tinggi dibanding O1 dan O3, dapat dilihat pada Gambar 11. Rendahnya hasil O3 membuktikan bahwa ekstraksi protein serisin dari kokon Attacus atlas tidak bisa hanya menggunakan kombinasi
37 suhu dan waktu, akan tetapi perlu pelarut kuat untuk mengekstraksi serisinnya misalnya basa kuat NaOH. Hal ini berarti ekstraksi protein serisin Attacus atlas sebaiknya menggunakan kombinasi degumming fisik dan kimia (kombinasi suhu dan waktu, serta 33,3% NaOH 0,25 N), dan jika pelarut yang digunakan adalah NaOH maka isolasi protein tidak perlu menggunakan etanol.
Gambar 11 Rata-rata rendemen protein pada kajian optimasi teknik ekstraksi.
Validasi titik optimum hanya dicoba pada kajian O2, sedangkan O1 dan O3 tidak divalidasi. Hal ini karena O1 dan O3 menghasilkan titik optimum yang meminimalkan rendemen protein serisin (optimasi minimum). Validasi titik optimum hasil kajian O2 telah dicoba pada suhu 122oC selama 75 menit karena autoklaf tidak bisa bekerja di atas 122oC (titik optimum O2 pada suhu 129,66oC dan waktu 70,36 menit). Validasi tersebut menghasilkan rendemen protein serisin sebesar 19,04 ± 0,18% dan hasil tersebut hampir dua kali lipat dari hasil sebelum dilakukan kajian optimasi rendemen (sekitar 11%). Hasil ini menunjukkan bahwa teknik ekstraksi yang tepat dapat menghasilkan rendemen protein serisin yang mendekati nilai standar Masahiro et al. (2000) sebesar 20%-30%.
2. Karakterisasi Crude Protein Serisin a. Bobot Molekul Protein Serisin (BM)
Karakterisasi protein dapat dilakukan dengan analisis bobot molekul Sodium
Dodecyl Sulfate Polyacrylamide Gel Electrophoresis (SDS PAGE). Pada
penelitian ini karakterisasi bobot molekul serisin menggunakan metode SDS PAGE dengan kisaran bobot molekul marker (protein standar) 10-260 kDa. Analisis SDS PAGE ini menggunakan tiga sampel yang berbeda yaitu protein
0 2 4 6 8 10 12 O1 O2 O3 Rendemen protein (%) O1 O2 O3
38 serisin dari kelenjar sutera tengah (KSA) Attacus atlas, crude protein serisin
Attacus atlas (A) dan Bombyx mori (B). Masing-masing sampel mendapat dua
perlakuan yaitu pengendapan dan tanpa pengendapan. Hasil SDS PAGE dapat dilihat pada Gambar 12.
Gambar 12 Hasil SDS PAGE dengan separating gel 12,5% dan stacking gel 4%.
Keterangan:
1= kelenjar sutera tengah (Attacus atlas) tanpa pengendapan (KSA1)
2= kelenjar sutera tengah (Attacus atlas) dengan pengendapan (KSA2)
3= crude protein serisin Bombyx mori tanpa pengendapan (B1)
4= crude protein serisin Bombyx mori dengan pengendapan (B2)
5= crude protein serisin Attacus atlas tanpa pengendapan (A1)
Bobot molekul protein serisin ditunjukkan dengan pita (fragmen) Gambar 12. Fragmen tersebut digunakan untuk menduga bobot molekul protein serisin (Lampiran 20). Protein serisin mempunyai nilai bobot molekul dengan kisaran yang lebar, sehingga tidak bersifat khas pada BM tertentu seperti halnya jenis protein lain. Bobot molekul protein serisin berkisar di atas 250 kDa pada Ser1, 250 kDa pada Ser3, 225-230 kDa pada Ser2-large dan di bawah 130 kDa pada Ser2-small (Takasu et al. 2010). Penelitian ini menghasilkan enam fragmen pada kelenjar sutera tengah Attacus atlas (KSA) dengan kisaran BM 8,99-73,30 kDa, dua fragmen pada sampel Bombyx mori (B) dengan BM 8,24 dan 8,99 kDa, serta tiga fragmen pada sampel Attacus atlas (A) dengan BM 8,24-10,25 kDa. Crude protein serisin Attacus atlas (A) menghasilkan BM dengan ukuran kecil sehingga diduga sebagai kelompok Ser2-small. Perlakuan dengan atau tanpa pengendapan tidak berpengaruh terhadap BM yang dihasilkan, ditunjukkan dengan BM yang sama (Tabel 13). 1 2 3 4 5 260 10 70 50 40 35 25 15 140 100 kDa
39 Tabel 13 Bobot molekul protein serisin hasil SDS PAGE (separating gel 12,5%,
stacking gel 4%, Marker Fermentas Multicolor Broad Range Protein Ladder 10-260 kDa) Pita (fragmen) KSA1 (kDa) KSA2 (kDa) B1 (kDa) B2 (kDa) A1 (kDa) 1 73,30 73,30 - - - 2 58,91 58,91 - - - 3 38,05 38,05 - - - 4 34,86 34,86 - - - 5 10,25 10,25 - - 10,25 6 - 8,99 8,99 8,99 8,99 7 - - 8,24 8,24 8,24
KSA digunakan sebagai standar BM serisin dari Attacus atlas karena sintesis serisin terjadi di kelenjar sutera bagian tengah (Brasla & Matei 1997). Kisaran BM KSA yang dihasilkan lebih luas dibanding sampel A dan B. Bobot molekul pada sampel A dan B mempunyai kisaran yang relatif sama, ditandai dengan adanya fragmen ke-6 dan ke-7. Bobot molekul yang dihasilkan antara KSA dengan A dan B berbeda karena preparasi sampel yang berbeda. Sampel A dan B mendapatkan perlakuan suhu dan tekanan tinggi serta penambahan senyawa alkali, sedangkan sampel KSA tidak mendapat perlakuan tersebut. Perlakuan sampel akan sangat berpengaruh terhadap BM yang dihasilkan. Aramwit et al. (2010) mengekstraksi kulit kokon Bombyx mori dengan berbagai perlakuan yaitu dengan urea, asam, alkali (basa), suhu dan tekanan tinggi masing-masing kisaran bobot molekulnya berbeda yaitu 10-250 kDa, 50-150 kDa, 15-75 kDa, dan 25-150 kDa. Teknik degumming kokon dengan alkali akan menghasilkan protein serisin dengan BM kurang dari 20 kDa (Zhang et al. 2004). Protein yang mendapat perlakuan asam atau basa kuat, asam amino unit pembangunnya dibebaskan dari ikatan kovalen sehingga membentuk molekul yang relatif kecil (Lehninger 1982). Hasil pada penelitian ini menunjukkan fenomena tersebut, proses ekstraksi pada sampel A menyebabkan molekul proteinnya relatif kecil yang ditandai dengan tidak munculnya protein BM besar (fragmen 1-4) dan munculnya protein dengan BM kecil (fragmen 5-7).
Pada sampel A dan B (Tabel 13) mempunyai kisaran BM yang relatif sama, akan tetapi ada satu fragmen yang tidak ada di sampel B tetapi ada baik di sampel A maupun KSA yaitu fragmen ke-5 (10,25 kDa). Hal ini terjadi karena KSA
40 berasal dari spesies yang sama dengan sampel A yaitu Attacus atlas. Hasil BM sampel A dan B relatif sama pada kisaran lebih tinggi dari hasil analisis BM serisin Wu et al. (2007) yaitu sebesar 6 kDa.
Kisaran BM protein serisin yang relatif kecil (8,22-10,25 kDa) dari penelitian ini diduga mempunyai potensi besar sebagai biomaterial. Protein serisin dengan BM besar maupun kecil merupakan material antioksidan dan antikanker yang dapat digunakan dalam kosmetik maupun medis (Chang-Kee et al. 2002, Zhang 2002). Wu et al. (2007) menghasilkan protein serisin dengan BM 6 kDa yang mempunyai kemampuan sebagai antioksidan, menghambat aktivitas tirosinase dan dapat digunakan sebagai supplement makanan.
b. Komposisi Asam Amino Protein Serisin
Protein tersusun dari monomer asam amino yang saling bergabung oleh ikatan peptida. Setiap protein mempunyai urutan asam amino yang khas yang akan menentukan sifat kimia dan fungsinya (Lehninger 1982). Komposisi asam amino crude protein serisin ditampilkan secara kualitatif pada Lampiran 21 dan 22, serta secara kuantitatif pada Tabel 14.
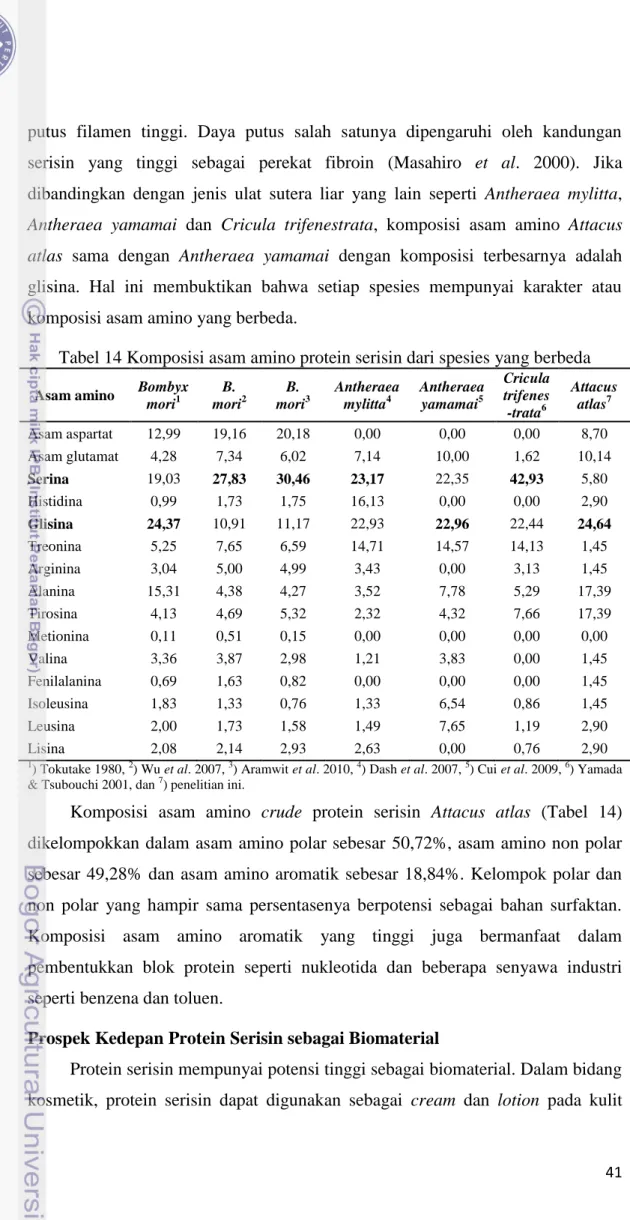
Komposisi asam amino terbesar dari crude protein serisin adalah glisina 24,64% (Tabel 14). Komposisi asam amino tersebut berbeda dengan Wu et al. (2007), Aramwit et al. (2010), Dash et al. (2007) dan Yamada & Tsubouchi (2001) dengan komposisi asam amino terbesar serina yang masing-masing sebesar 27,83%, 30,46%, 23,17%, dan 42,93%. Akan tetapi analisis asam amino crude protein serisin tersebut sesuai dengan Tokutake (1980) dan Cui et al. (2009) dengan asam amino terbesar yaitu glisina sebesar 24,37% dan 22,96%.
Komposisi yang berbeda tersebut disebabkan spesies yang berbeda (Tabel 14). Penelitian ini menggunakan spesies ulat sutera liar Attacus atlas sedangkan Wu et al. (2007) dan Aramwit et al. (2010) menggunakan ulat sutera domestikasi
Bombyx mori, tetapi Tokutake (1980) juga menggunakan Bombyx mori.
Perbedaan hasil Tokutake (1980) dan Wu et al. (2007) serta Aramwit et al. (2010) diduga terletak pada perkembangan Bombyx mori pada abad-20 dan abad-21. Ulat sutera Bombyx mori pada abad-21 sudah mengalami banyak penyempurnaan dalam kualitas kokon diantaranya daya putus filamen. Kondisi Bombyx mori abad-20 hampir sama dengan kondisi kokon Attacus atlas yang mempunyai daya
41 putus filamen tinggi. Daya putus salah satunya dipengaruhi oleh kandungan serisin yang tinggi sebagai perekat fibroin (Masahiro et al. 2000). Jika dibandingkan dengan jenis ulat sutera liar yang lain seperti Antheraea mylitta,
Antheraea yamamai dan Cricula trifenestrata, komposisi asam amino Attacus atlas sama dengan Antheraea yamamai dengan komposisi terbesarnya adalah
glisina. Hal ini membuktikan bahwa setiap spesies mempunyai karakter atau komposisi asam amino yang berbeda.
Tabel 14 Komposisi asam amino protein serisin dari spesies yang berbeda
Asam amino Bombyx
mori1 B. mori2 B. mori3 Antheraea mylitta4 Antheraea yamamai5 Cricula trifenes -trata6 Attacus atlas7 Asam aspartat 12,99 19,16 20,18 0,00 0,00 0,00 8,70 Asam glutamat 4,28 7,34 6,02 7,14 10,00 1,62 10,14 Serina 19,03 27,83 30,46 23,17 22,35 42,93 5,80 Histidina 0,99 1,73 1,75 16,13 0,00 0,00 2,90 Glisina 24,37 10,91 11,17 22,93 22,96 22,44 24,64 Treonina 5,25 7,65 6,59 14,71 14,57 14,13 1,45 Arginina 3,04 5,00 4,99 3,43 0,00 3,13 1,45 Alanina 15,31 4,38 4,27 3,52 7,78 5,29 17,39 Tirosina 4,13 4,69 5,32 2,32 4,32 7,66 17,39 Metionina 0,11 0,51 0,15 0,00 0,00 0,00 0,00 Valina 3,36 3,87 2,98 1,21 3,83 0,00 1,45 Fenilalanina 0,69 1,63 0,82 0,00 0,00 0,00 1,45 Isoleusina 1,83 1,33 0,76 1,33 6,54 0,86 1,45 Leusina 2,00 1,73 1,58 1,49 7,65 1,19 2,90 Lisina 2,08 2,14 2,93 2,63 0,00 0,76 2,90 1
) Tokutake 1980, 2) Wu et al. 2007, 3) Aramwit et al. 2010, 4) Dash et al. 2007, 5) Cui et al. 2009, 6) Yamada & Tsubouchi 2001, dan 7) penelitian ini.
Komposisi asam amino crude protein serisin Attacus atlas (Tabel 14) dikelompokkan dalam asam amino polar sebesar 50,72%, asam amino non polar sebesar 49,28% dan asam amino aromatik sebesar 18,84%. Kelompok polar dan non polar yang hampir sama persentasenya berpotensi sebagai bahan surfaktan. Komposisi asam amino aromatik yang tinggi juga bermanfaat dalam pembentukkan blok protein seperti nukleotida dan beberapa senyawa industri seperti benzena dan toluen.
Prospek Kedepan Protein Serisin sebagai Biomaterial
Protein serisin mempunyai potensi tinggi sebagai biomaterial. Dalam bidang kosmetik, protein serisin dapat digunakan sebagai cream dan lotion pada kulit
42 karena dapat meningkatkan elastisitas kulit, mencegah kekerutan dan penuaan dini (Padamwar & Pawar 2004). Padamwar et al. (2005), penggunaan serisin pada kulit dapat menurunkan nilai transepidermal water loss (TEWL). TEWL adalah salah satu penyebab kulit kering. Menurunnya nilai TEWL menyebabkan kadar air kulit terjaga karena tidak terjadi kehilangan air pada lapisan kulit terluar sehingga tektur kulit menjadi lebih halus. Hal ini menyebabkan kulit lebih elastis dan tidak mudah berkerut.
Dalam medis, protein serisin dapat digunakan untuk penyembuhan luka dan menghambat penyebaran tumor (Zhaorigetu et al. 2003, Aramwit & Sangcakul 2007). Aramwit & Sangcakul (2007), pengolesan 8% cream serisin pada luka dapat menyembuhkan luka lebih baik dibanding cream lain. Dalam 15 hari, luka yang dioles serisin sembuh sempurna dibanding yang dioles cream lain, ditandai dengan tidak adanya ulceration (luka atau koreng) dan meningkatnya kolagen.
Zhaorigetu et al. (2003), aplikasi serisin (dosis 2,5-5 mg per aplikasi) dua kali seminggu dalam 16 minggu dapat menekan oxidative stress dan tumor necrosis
factor (TNF-α). Oxidative stress memicu munculnya tumor pada kulit, sedangkan
TNF-α adalah promoter dan pusat mediator bagi perkembangan tumor.
Potensi protein serisin sebagai biomaterial juga dibuktikan dalam penelitian ini. Hasil analisis asam amino crude protein serisin menunjukkan bahwa protein serisin berpotensi sebagai material surfaktan, karena mempunyai rantai polar dan non polar yang relatif sama. Surfaktan mempunyai dua sisi (ampifilik) yaitu rantai polar dan non polar dengan komposisi seimbang (Salanger 2002). Salah satu karakter surfaktan adalah menurunkan tegangan permukaan. Oleh karena itu dilakukan uji tegangan permukaan pada protein serisin untuk mengetahui besar tegangan permukaannya. Hasil uji tegangan permukaan dengan penambahan serisin disajikan pada Tabel 15.
Tabel 15 Tegangan permukaan protein serisin Attacus atlas
Kode sampel Kadar protein dalam larutan (mg/ml) Tegangan permukaan (dyne/cm) TP1 0,58 ± 0,01 51,8 ± 1,3 a TP2 0,52 ± 0,04 57,6 ± 0,04 b TP3 0,12 ± 0,02 59,4 ± 0,3 c
43 Hasil analisis ragam (Lampiran 23) menunjukkan bahwa kadar protein sangat berpengaruh nyata (P<0,05) terhadap tegangan permukaan. Uji lanjut (Lampiran 23) menghasilkan kisaran nilai tengah yang sangat berbeda dari ketiga perlakuan. Penambahan serisin dapat menurunkan tegangan permukaan air, dari 71,67 dyne/cm menjadi 51,8 ± 1,3 dyne/cm pada kadar protein 0,58 ± 0,01 mg/ml. Hasil uji tegangan permukaan ini menunjukkan bahwa semakin tinggi kadar protein serisin yang ditambahkan maka semakin kecil tegangan permukaan yang dihasilkan. Hasil ini sesuai dengan Suryani et al. (2008), penambahan alkil poliglikosida (APG) sebanyak 10 mg/ml dapat menurunkan tegangan permukaan air sampai 23,375 dyne/cm. Hasil tersebut memberikan informasi bahwa dengan penambahan kadar lebih tinggi maka tegangan yang dihasilkan lebih rendah, sehingga diduga protein serisin masih berpotensi tinggi untuk menurunkan tegangan permukaan air pada kadar protein yang lebih tinggi.
Hasil tersebut memberikan informasi bahwa serisin dapat digunakan sebagai sumber material baru untuk surfaktan. Hal ini selaras dengan isu produk ramah lingkungan dan penggunaan sumberdaya terbarukan. Secara umum, surfaktan diproduksi dari bahan petrokimia (minyak bumi) maupun bahan alami seperti minyak nabati, karbohidrat, ekstrak alami dan biosurfaktan dari mikroorganisme.