ACARA III ACARA III
UJI KERUSAKAN MINYAK UJI KERUSAKAN MINYAK
A.
A. TujuanTujuan
Tujuan dari praktikum acara III
Tujuan dari praktikum acara III “Uji Kerusakan Minyak” ini adalah:“Uji Kerusakan Minyak” ini adalah: 1.
1. Menentukan angka peroksida dari berbagai sampel minyak.Menentukan angka peroksida dari berbagai sampel minyak. 2.
2. Menentukan angka asam dan % FFA dari berbagai sampel minyak.Menentukan angka asam dan % FFA dari berbagai sampel minyak. 3.
3. Menentukan nilai TBA dari berbagai sampel minyak.Menentukan nilai TBA dari berbagai sampel minyak.
B.
B. Tinjauan PustakaTinjauan Pustaka
Kerusakan minyak akan
Kerusakan minyak akan mempengaruhi mutu dan nilai gizi bahanmempengaruhi mutu dan nilai gizi bahan pangan
pangan yang yang digoreng. digoreng. Minyak Minyak yang yang rusak rusak akibat proses oksidasi danakibat proses oksidasi dan polimerisasi
polimerisasi akan menghasilkan bahan dengan rupaakan menghasilkan bahan dengan rupa yang kurang menarik danyang kurang menarik dan cita rasa yang
cita rasa yang tidak enak, serta kerusakan sebagiantidak enak, serta kerusakan sebagian vitamin dan asam lemakvitamin dan asam lemak esensial yang
esensial yang terdapat dalam minyak. Oksidasi minyak akan menghasilkanterdapat dalam minyak. Oksidasi minyak akan menghasilkan senyawa aldehida,
senyawa aldehida, keton, hidrokarbon, alkohol, lakton sertaketon, hidrokarbon, alkohol, lakton serta senyawa aromatissenyawa aromatis yang mempunyai bau
yang mempunyai bau tengik dan rasa getir. Pembentukantengik dan rasa getir. Pembentukan senyawa polimersenyawa polimer selama proses
selama proses menggoreng terjadi karena reaksimenggoreng terjadi karena reaksi polimerisasi polimerisasi adisi adisi dari dari asamasam lemak tidak
lemak tidak jenuh. jenuh. Hal Hal ini ini terbukti terbukti dengandengan terbentuknya bahan menyerupaiterbentuknya bahan menyerupai gum yang
gum yang mengendap di dasar tempat penggorengan (Widayat, 2006).mengendap di dasar tempat penggorengan (Widayat, 2006).
Secara umum, ada tiga penyebab ketengikan pada minyak kelapa, Secara umum, ada tiga penyebab ketengikan pada minyak kelapa, yaitu: Ketengikan Oksidatif, proses oksidasi dapat berlangsung apabila terjadi yaitu: Ketengikan Oksidatif, proses oksidasi dapat berlangsung apabila terjadi kontak antara sejumlah oksigen dan minyak. Terjadinya oksidasi akan kontak antara sejumlah oksigen dan minyak. Terjadinya oksidasi akan mengakibatkan ketengikan pada minyak yang disebut dengan ketengikan mengakibatkan ketengikan pada minyak yang disebut dengan ketengikan oksidatif. Ketengikan Hidrolisis, penyebab utama terjadinya ketengikan oksidatif. Ketengikan Hidrolisis, penyebab utama terjadinya ketengikan hidrolisis adalah air, baik yang terdapat di dalam minyak maupun yang berasal hidrolisis adalah air, baik yang terdapat di dalam minyak maupun yang berasal dari udara. Dengan adanya air, lemak dapat terhidrolisis menjadi gliserol dan dari udara. Dengan adanya air, lemak dapat terhidrolisis menjadi gliserol dan asam lemak. Reaksi ini dipercepat oleh basa, asam, dan enzim-enzim. asam lemak. Reaksi ini dipercepat oleh basa, asam, dan enzim-enzim. Ketengikan Enzimatis, adalah ketengikan pada minyak yang disebabkan oleh Ketengikan Enzimatis, adalah ketengikan pada minyak yang disebabkan oleh enzim. Enzim ini dihasilkan oleh mikroorganisme, terutama kapang, yang enzim. Enzim ini dihasilkan oleh mikroorganisme, terutama kapang, yang
dapat tumbuh pada minyak karena air dan bahan-bahan yang ada dalam dapat tumbuh pada minyak karena air dan bahan-bahan yang ada dalam minyak merupakan media yang baik bagi pertumbuhan kapang. Berbagai minyak merupakan media yang baik bagi pertumbuhan kapang. Berbagai kapang dapat menghasilkan enzim lipase yang dapat menguraikan lemak kapang dapat menghasilkan enzim lipase yang dapat menguraikan lemak (Syah, 2007).
(Syah, 2007).
Ketengikan terjadi bila komponen cita-rasa dan bau yang mudah Ketengikan terjadi bila komponen cita-rasa dan bau yang mudah menguap terbentuk sebagai akibat kerusakan oksidatif dari lemak dan minyak menguap terbentuk sebagai akibat kerusakan oksidatif dari lemak dan minyak yang tak jenuh. Komponen-komponen ini menyebabkan bau dan cita-rasa yang tak jenuh. Komponen-komponen ini menyebabkan bau dan cita-rasa yang tak dinginkan dalam lemak dan minyak dan produk-produk yang yang tak dinginkan dalam lemak dan minyak dan produk-produk yang mengandung lemak dan minyak itu. Hidrolisa minyak dan lemak mengandung lemak dan minyak itu. Hidrolisa minyak dan lemak menghasilkan asam-asam lemak bebas yang dapat mempengaruhi cita-rasa menghasilkan asam-asam lemak bebas yang dapat mempengaruhi cita-rasa dan bau daripada bahan itu. Hidrolisa dapat disebabkan oleh adanya air dalam dan bau daripada bahan itu. Hidrolisa dapat disebabkan oleh adanya air dalam lemak atau minyak atau kegiatan enzim (Buckle, 2010).
lemak atau minyak atau kegiatan enzim (Buckle, 2010).
Kehadiran sejumlah besar asam lemak bebas (FFA) dapat Kehadiran sejumlah besar asam lemak bebas (FFA) dapat memfasilitasi laju oksidasi lipid, dan asam lemak bebas mengoksidasi tingkat memfasilitasi laju oksidasi lipid, dan asam lemak bebas mengoksidasi tingkat yang sedikit lebih besar dari diesterifikasi untuk gliserin. Jumlah asam lemak yang sedikit lebih besar dari diesterifikasi untuk gliserin. Jumlah asam lemak dari butirat hingga laurat juga berpengaruh terhadap ketengikan pada minyak. dari butirat hingga laurat juga berpengaruh terhadap ketengikan pada minyak. Kerusakan flavour dari oksidasi lipid (reaksi lipid dengan oksigen) menjadi Kerusakan flavour dari oksidasi lipid (reaksi lipid dengan oksigen) menjadi masalah serius dalam stabilitas penyimpanan produk (Nouira, 2011).
masalah serius dalam stabilitas penyimpanan produk (Nouira, 2011).
Oksidasi lipid dalam makanan menghasilkan efek yang tidak Oksidasi lipid dalam makanan menghasilkan efek yang tidak diinginkan, termasuk hilangnya vitamin yang larut dalam lemak,
diinginkan, termasuk hilangnya vitamin yang larut dalam lemak, off flavor off flavor ,, masalah palatabilitas, dan bahkan produksi racun yang menyebabkan masalah palatabilitas, dan bahkan produksi racun yang menyebabkan keracunan makanan. Nilai peroksida umumnya berfungsi sebagai indikator keracunan makanan. Nilai peroksida umumnya berfungsi sebagai indikator yang berguna pada oksidasi lipid, lemak, dan minyak. Keuntungan dari nilai yang berguna pada oksidasi lipid, lemak, dan minyak. Keuntungan dari nilai peroksida
peroksida adalah adalah bahwa bahwa hal hal itu itu langsung langsung dapat dapat mengukur mengukur peroksida peroksida lipid,lipid, yang merupakan produk utama oksidasi lipid
yang merupakan produk utama oksidasi lipid (Shantha, 1994).(Shantha, 1994).
Oksidasi adalah salah satu proses yang paling penting yang terjadi Oksidasi adalah salah satu proses yang paling penting yang terjadi dalam sistem makanan. Hal ini mempengaruhi banyak interaksi antara dalam sistem makanan. Hal ini mempengaruhi banyak interaksi antara konstituen pangan yang menyebabkan hal-hal yang diinginkan dan tidak konstituen pangan yang menyebabkan hal-hal yang diinginkan dan tidak diinginkan dalam produk. Lipid pangan merupakan komponen makanan yang diinginkan dalam produk. Lipid pangan merupakan komponen makanan yang sangat rentan terhadap proses oksidasi, oleh karena reaksi oksidasi adalah sangat rentan terhadap proses oksidasi, oleh karena reaksi oksidasi adalah
salah satu sumber utama dari kerusakan yang terjadi selama proses, salah satu sumber utama dari kerusakan yang terjadi selama proses, penyimpanan, distribusi dan akhir persiapan makanan
penyimpanan, distribusi dan akhir persiapan makanan (Wqsowicz, 2004).(Wqsowicz, 2004). Radikal hidroksil menyebabkan kerusakan oksidatif pada sel-sel Radikal hidroksil menyebabkan kerusakan oksidatif pada sel-sel karena radikal tersebut menyerang biomolekul dengan tidak spesifik. Secara karena radikal tersebut menyerang biomolekul dengan tidak spesifik. Secara umum diasumsikan bahwa HO dalam sistem biologis terbentuk melalui siklus umum diasumsikan bahwa HO dalam sistem biologis terbentuk melalui siklus redoks dengan reaksi Fenton, di mana besi bebas (Fe
redoks dengan reaksi Fenton, di mana besi bebas (Fe2+2+) bereaksi dengan) bereaksi dengan hidrogen peroksida (H
hidrogen peroksida (H22OO22). reaksi Haber-Weiss yang menghasilkan produksi). reaksi Haber-Weiss yang menghasilkan produksi
Fe
Fe2+2+ ketika superoksida bereaksi dengan ferric besi (Fe ketika superoksida bereaksi dengan ferric besi (Fe3+3+) (Ayala, 2014).) (Ayala, 2014).
Kerusakan minyak karena autooksidasi yang paling besar pengaruhnya Kerusakan minyak karena autooksidasi yang paling besar pengaruhnya terhadap cita rasa. Hasil yang diakibatkan oksidasi lemak antara lain: terhadap cita rasa. Hasil yang diakibatkan oksidasi lemak antara lain: peroksida,
peroksida, asam asam lemak, lemak, aldehid, aldehid, dan dan keton. keton. Angka Angka peroksida peroksida adalah adalah nilainilai terpenting untuk menentukan derajat kerusakan pada minyak atau lemak. terpenting untuk menentukan derajat kerusakan pada minyak atau lemak. Bilangan peroksida adalah banyaknya mili-equivalen oksigen aktif yang Bilangan peroksida adalah banyaknya mili-equivalen oksigen aktif yang terdapat dalam 1000 gram minyak atau lemak (Sudarmadji, 2010).
terdapat dalam 1000 gram minyak atau lemak (Sudarmadji, 2010).
Prinsip penentuan bilangan peroksida biasanya didasarkan pada Prinsip penentuan bilangan peroksida biasanya didasarkan pada pengukuran
pengukuran sejumlah sejumlah iod iod yang yang dibebaskan dibebaskan dari dari kalium kalium iodida iodida melalui melalui reaksireaksi oksidasi oleh peroksida pada suhu ruang di dalam medium asam asetat atau oksidasi oleh peroksida pada suhu ruang di dalam medium asam asetat atau kloroform. Bilangan peroksida dinyatakan dalam beberapa satuan yaitu kloroform. Bilangan peroksida dinyatakan dalam beberapa satuan yaitu miliekuivalen per 1000 gram contoh, milimol per 1000 gram contoh, atau miliekuivalen per 1000 gram contoh, milimol per 1000 gram contoh, atau miligram oksigen per 100 gram
miligram oksigen per 100 gram contoh minyak/lemak.contoh minyak/lemak. a. miliekuivalen per 1000 gram c
a. miliekuivalen per 1000 gram contoh =ontoh = 1000 1000 b. milimol per 1000 gram con
b. milimol per 1000 gram contoh =toh = 0,5 10000,5 1000 Keterangan:
Keterangan: A
A : ml : ml Na-tiosulfat yang Na-tiosulfat yang dipakai sampel-ml dipakai sampel-ml Na-tiosulfat yang Na-tiosulfat yang dipakai blankodipakai blanko N
N : Normalitas Na-tiosulfat: Normalitas Na-tiosulfat G
G : : Berat Berat contoh contoh minyal/lemak minyal/lemak dalam dalam gramgram
Semakin tinggi bilangan iod, maka bilangan peroksida akan tinggi pada awal Semakin tinggi bilangan iod, maka bilangan peroksida akan tinggi pada awal ketengikannya (Muchtadi, 2010).
Terbentuknya peroksida dapat disebabkan oleh proses oksidasi pada saat proses pemasakan atau penyimpanan. Reaksi pembentukan peroksida pada minyak diakibatkan karena reaksi oksidasi oleh oksigen dengan sejumlah asam lemak yang tidak jenuh. Reaksi oksidasi dapat dipercepat oleh pemanasan (Aisyah, 2010).
Deteksi spektrofotometri dari asam malonaldehyde-thiobarbutiric (TBA) kompleks telah banyak digunakan untuk mengukur oksidasi lipid dalam makanan dan jaringan biologis. Prinsip dasar dari metode ini adalah reaksi dari 1 molekul malonaldehyde dan 2 molekul TBA untuk membentuk pigmen merah muda malonaldehyde-TBA kompleks. Hal ini dapatydiketahui
secara kuantitatif dengan cara menilai spektrofotometri (Tokur, 2006).
Penentuan bilangan TBA merupakan pengujian yang paling sering digunakan untuk mengukur ketengikan pada minyak. Uji TBA merupakan uji yang spesifik untuk hasil oksidasi dari asam lemak yang tidak jenuh dan dapat digunakan pada produk makanan sehari-hari yang proporsi asam lemak tidak jenuhnya rendah. Lemak yang tengik mengandung aldehid dan kebanyakan sebagai malonaldehid. Banyaknya malonaldehid dapat ditentukan dengan jalan didestilasi lebih dahulu. Malonaldehid kemudian direaksikan dengan thiobarbiturat sehingga terbentuk kompleks berwarna merah. Semakin besar angka TBA, maka minyak semakin tengik (Sudarmadji, 2010).
Tujuan dilakukan uji TBA untuk mengetahui adanya reaksi lebih lanjut pada lemak yang dapat menyebabkan ketengikan. Prinsip dari uji TBA berdasarkan atas terbentuknya pigmen berwarna merah sebagai hasil dari reaksi kondensasi antara 2 molekul TBA dengan 1 molekul malonaldehid. Malonaldehid kemudian direaksikan dengan thiobarbiturat, lemak yang tengik akan bereaksi dengan asam thiobartiturat menghasilkan warna merah. Intensitas warna merah menunjukkan derajat ketengikan dari minyak tersebut. Intensitas warna merah sesuai dengan jumlah malonaldehid dan absorbansi dapat ditentukan dengan spektrofotometer pada panjang gelombang λ528 nm. Semakin besar angka TBA, maka minyak semakin tengik (Khotimah, 2013).
Intensitas warna merah sesuai dengan jumlah malonaldehid dan absorbansi dapat ditentukan dengan spektrofotometer pada panjang gelombang λ528 nm. Penentuan bilangan TBA dapat dihitung dengan rumus:
Angka TBA = ℎ/ 528 7,8 bobot sampel (gram)
Keterangan:
Aλ528 = Absorbansi pada λ 528 nm
Semakin besar angka TBA, maka minyak semakin tengik (Sudarmadji, 2010). Faktor yang mempengaruhi nilai TBA diantaranya yaitu kadar air, pemanasan, cahaya dan oksigen. Minyak yang sudah mendapat perlakuan pemanasan, terkena cahaya, dan oksigen, maka nilai TBAnya akan lebih tinggi daripada minyak yang masih segar. Semakin tinggi kadar air maka semakin tinggi angka TBA dan semakin tinggi tingkat kerusakan minyak yang terjadi (Augustyn, 2012).
Minyak goreng yang baik memiliki standar mutu yang telah ditentukan oleh SNI. Standar mutu minyak goreng, telah dirumuskan dan ditetapkan oleh Badan Standarisasi Nasional (BSN) (Noriko, 2012).
Tabel 1 SNI 01-3741-2002 tentang Standar Mutu Minyak Goreng
Kriteria Uji Satuan Syarat
Keadaan bau, warna dan rasa - Normal
Air % b/b Maks 0.30
Asam lemak bebas (dihitung sebagai asam laurat)
% b/b Maks 0.30
Bahan Makanan Tambahan Sesuai SNI. 022-M dan Permenkes No. 722/Menkes/Per/IX/88 Cemaran Logam : - Besi (Fe) - Tembaga (Cu) - Raksa (Hg) - Timbal (Pb) - Timah (Sn) - Seng (Zn) Mg/kg Mg/kg Mg/kg Mg/kg Mg/kg Mg/kg Maks 1.5 Maks 0.1 Maks 0.1 Maks 40.0 Maks0.005 Maks 40.0/250.0)*
Arsen (As) % b/b Maks 0.1
Angka Peroksida % mg O2/gr Maks 1
Catatan *)Dalam kemasan kaleng
C. Metodologi 1. Alat
a. Alat destilasi b. Buret dan statif
c. Corong
d. Erlenmeyer 250 ml e. Gelas ukur
f. Hot plate g. Pipet tetes
h. Pipet volume 1 ml dan 5 ml i. Propipet j. Spektrofotometer k. Stopwatch l. Tabung reaksi m. Timbangan analitik n. Vortex 2. Bahan a. Alkohol netral b. Aluminium foil c. Aquadest d. Asam asetat-cloroform (3:2) e. HCl 4M f. Indicator phenolphthalein (PP) g. KI jenuh h. Larutan pati 1% i. Minyak baru j. Minyak jelantah k. Minyak lama l. Na2S2O30,1 N m. NaOH 0,1 N n. Pereaksi TBA
3. Cara Kerja
a. Penentuan angka peroksida
Penimbangan 5gr sampel
Penambahan
Penggoyangan sampai semua bahan larut
Penambahan
Pendiaman selama 1 menit
Penambahan
Pentitrasian sampai warna kuning hampir hilang (kuning pucat) Penambahan Minyak 30 ml asam asetat-kloroform (3:2) 0,5 ml KI jenuh 30 ml aquadest Na2S2O3 0,1N 0,5 ml larutan pati 1%
Pentitrasian sampai warna biru mulai hilang
Pencatatan volume titran (Na2S2O3) yang digunakan
Penghitungan angka peroksidanya menggunakan rumus Na2S2O3 0,1N
b. Penentuan asam lemak bebas
Penimbangan 20gr sampel
Pencatatan volume NaOH yang digunakan Pentitrasian dengan larutan yang telah distandarisasi sampai warna merah jambu tercapai dan tidak hilang
selama 30 detik Penambahan
Penghitungan asam lemak bebas dinyatakan sebagai %FFA atau sebagai angka asam
Penambahan Minyak 50 ml alkohol netral panas 3 tetes indikator PP NaOH 0,1 N
c. Penentuan Bilangan TBA
Penimbangan 10gr bahan
Pendestilasian dengan pemanasan tinggi sehingga diperoleh 50 destilat selama 10 menit pemanasan
Penambahkan batu didih dan pencegah buih (anti foaming agent) secukupnya
Penambahan HCl sampai pH menjadi 1,5
Pengadukan secara merata destilat yang diperoleh Pemindahan secara kuantitatif ke dalam labu destilasi serta
pencucian dengan aquades
Pemasukkan ke dalam waring blender
Penambahan
Penghancuran selama 2 menit Minyak
50 ml aquades
47,5 ml aquades
2,5 ml HCl 4 M
Pemipetan 5ml destilat ke dalam tabung reaksi tertutup
Penambahan pereaksi TBA dan penutupan tabung reaksi serta pencampuran secara merata larutan
Pemanasan selama 30 menit ke dalam air mendidih
Pembuatan blanko menggunakan aquades dan pereaksi, perlakuan seperti penepatan sampel
5ml pereaksi TBA
5 ml aquades dan 5 ml pereaksi
Pendinginan tabung reaksi dengan air pendingin selama kurang lebih 10 menit
Pengukuran absorbansinya (D) pada panjang gelombang 528nm dengan larutan blanko sebagai titik nol Penghitungan bilangan TBA, dinyatakan dalam mg
malonaldehid per kg sampel
D. Hasil dan Pembahasan
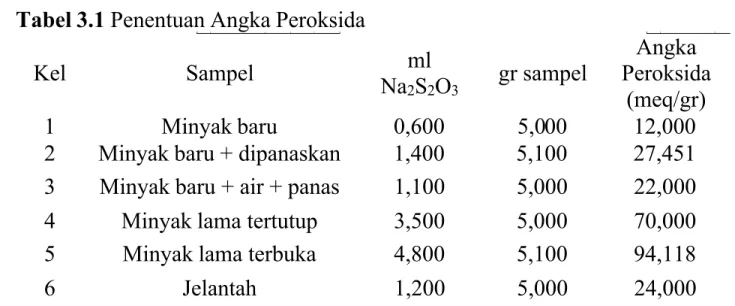
Tabel 3.1 Penentuan Angka Peroksida
Kel Sampel ml Na2S2O3 gr sampel Angka Peroksida (meq/gr) 1 Minyak baru 0,600 5,000 12,000
2 Minyak baru + dipanaskan 1,400 5,100 27,451 3 Minyak baru + air + panas 1,100 5,000 22,000 4 Minyak lama tertutup 3,500 5,000 70,000
5 Minyak lama terbuka 4,800 5,100 94,118
6 Jelantah 1,200 5,000 24,000
Sumber : Laporan Sementara
Terdapat 3 tipe kerusakan minyak, yaitu proses hidrolisis, proses oksidasi, dan proses enzimatis. Proses hidrolisa Air dapat menghidrolisa minyak menjadi gliserol dan asam lemak bebas, proses ini dibantu oleh adanya asam, alkali, uap air, panas dan enzim lipolitik seperti lipase. Proses hidrolisa menyebabkan terjadinya hydrolitic rancidity yaitu terjadi flavor dan rasa tengik pada minyak. Bagi minyak kelapa, proses hidrolisa mempunyai arti yang penting, karena hampir 90% dari trigliseridanya mempunyai asam lemak berantai hidrokarbon pendek, yaitu C4 sampai dengan C14. Asam lemak
dari ikatan ester pada suhu kamar akan mempunyai bau dan rasa tidak enak. Proses oksidasi apabila terjadi kontak antara oksigen dengan minyak dan akan menyebabkan ketengikan. Ketengikan karena proses oksidasi ini disebut oxidative rancidity. Pada proses enzimatis, enzim dapat menguraikan minyak dan akan menyebabkan minyak tersebut menjadi tengik, ketengikan itu disebut enzymatic rancidity. Lipase yang bekerja memecah lemak menjadi dan asam lemak serta menyebabkan minyak berwarna gelap. Sedangkan enzim peroksida membantu proses oksidasi minyak sehingga menghasilkan keton
(Muchtadi, 2010).
Kerusakan minyak karena autooksidasi yang paling besar pengaruhnya terhadap cita rasa. Hasil yang diakibatkan oksidasi lemak antara lain: peroksida, asam lemak, aldehid, dan keton. Angka peroksida adalah nilai terpenting untuk menentukan derajat kerusakan pada minyak atau lemak.
Bilangan peroksida adalah banyaknya mili-equivalen oksigen aktif yang terdapat dalam 1000 gram minyak atau lemak (Sudarmadji, 2010).
Prinsip penentuan bilangan peroksida biasanya didasarkan pada pengukuran sejumlah iod yang dibebaskan dari kalium iodida melalui reaksi oksidasi oleh peroksida pada suhu ruang di dalam medium asam asetat atau kloroform. Bilangan peroksida dinyatakan dalam beberapa satuan yaitu miliekuivalen per 1000 gram contoh, milimol per 1000 gram contoh, atau miligram oksigen per 100 gram contoh minyak/lemak.
a. miliekuivalen per 1000 gram contoh = 1000 b. milimol per 1000 gram contoh = 0,5 1000
Keterangan:
A : ml Na-tiosulfat yang dipakai sampel-ml Na-tiosulfat yang dipakai blanko N : Normalitas Na-tiosulfat
G : Berat contoh minyal/lemak dalam gram
Semakin tinggi bilangan iod, maka bilangan peroksida akan tinggi pada awal ketengikannya (Muchtadi, 2010).
Terbentuknya peroksida dapat disebabkan oleh proses oksidasi pada saat proses pemasakan atau penyimpanan. Reaksi pembentukan peroksida RX + O2 ROOX pada minyak diakibatkan karena reaksi oksidasi
oleh oksigen dengan sejumlah asam lemak yang tidak jenuh. Reaksi oksidasi dapat dipercepat oleh pemanasan (Aisyah, 2010).
Pereaksi yang digunakan dalam pengujian bilangan peroksida antara lain kloroform, asam asetat glasial, KI, Na2S2O3, serta indikator amilum. Asam
asetat glasial digunakan untuk menghidrolisis asam lemak dari minyak. Asam lemak ini yang kemudian diukur jumlah peroksida yang terkandung di dalamnya (Gunawan, 2003).
Fungsi dari penambahan kloroform adalah sebagai pelarut. Minyak merupakan kelompok yang masuk pada golongan lipid, yaitu senyawa organik yang terdapat di alam serta tidak larut dalam air, tetapi larut dalam pelarut organik non-polar. Kloroform (CHCl3), benzena dan hidrokarbon lainnya,
lemak dan minyak dapat larut dalam pelarut tersebut karena minyak mempunyai polaritas yang sama dengan pelarut tersebut (Sudarmadji, 2010).
Fungsi dari penambahan KI adalah untuk membebaskan iodin yang ditandai terbentuknya warna kuning pada sampel. Pada tahap ini, terjadi reaksi sebagai berikut:
R-OOH + 2KI + H2O → R-OH + I2 + 2 KOH
Peroksida yang pecah pada minyak akan mengeluarkan oksigen. Oksigen yang terlepas akan mengoksidasi KI dan menghasilkan I2 yang setara dengan
jumlah oksigen pada sampel (Gunawan, 2003).
Amilum berfungsi sebagai indikator apabila Na2S2O3 yang disediakan
dalam larutan telah habis beraksi dengan I2 yang terbentuk. Iod yang
dibebaskan akan masuk ke dalam struktur amilum sehingga menimbulkan warna biru. Titrasi dihentikan jika warna larutan menjadi tidak berwarna karena I2 telah habis tertirasi (Silaban, 2014). Sedangkan fungsi penambahan Na2S2O3 adalah untuk mencegah terjadinya ion kompleks ammonium sulfat dengan katalisator. Kompleks yang terjadi ikatannya kuat dan sukar diuapkan. Na2S2O3 berfungsi untuk mengendapkan katalisator sehingga tidak
mengganggu reaksi kimia selanjutnya (Novitriani, 2013).
Minyak atau lemak sebanyak 5 g dilarutkan dalam 30 ml campuran asam asetat glacial dengan khloroform (3:2) dalam erlenmeyer. Kemudian digoyangkan sampai semua bahan larut dan ditambahkan 0,5 ml larutan Kl jenuh, dan dikocok sampai jernih. Setelah 1 menit penambahan larutan Kl,
ditambahkan akuades sebanyak 30 ml dan iod yang dibebaskan dititrasi dengan larutan Na2S2O3 0,01 N. Titrasi dilakukan sambil erlenmeyer dikocok
untuk membebaskan iod yang terdapat pada lapisan chloroform sampai warna kuning hamper hilang. Kemudian ditambahkan 0,5 ml larutan pati 1% dan dilanjutkan titrasi sampai warna biru mulai hilang. Kemudian penetapan blanko dibuat, blanko seharusnya membutuhkan larutan Na2S2O3 tidak lebih
dari 0,1 ml. Jumlah peroksida dihitung sebagai miliekuivalen per 1000 g minyak atau milimol per 1000 g minyak.
Menurut Widayat (2006), Minyak yang rusak akibat proses oksidasi dan polimerisasi akan menghasilkan bahan dengan rupa yang kurang menarik dan cita rasa yang tidak enak, serta kerusakan sebagian vitamin dan asam lemak esensial yang terdapat dalam minyak. Oksidasi minyak akan menghasilkan senyawa aldehida, keton, hidrokarbon, alkohol, lakton serta senyawa aromatis yang mempunyai bau tengik dan rasa getir. Pembentukan senyawa polimer selama proses menggoreng terjadi karena reaksi polimerisasi adisi dari asam lemak tidak jenuh. Hal ini terbukti dengan terbentuknya bahan menyerupai gum yang mengendap di dasar tempat penggorengan.
Tabel 3.1 Penentuan Angka Peroksida, dari hasil titrasi dapat diketahui volume titran (Na2S2O3) yang digunakan yaitu kelompok 1
membutuhkan 0,600ml dengan berat sampel 5gr; kelompok 2 membutuhkan 1,400ml dengan berat sampel 5,1 gr; kelompok 3 membutuhkan 1,100ml dengan berat sampel 5 gr; kelompok 4 membutuhkan 3,500ml dengan berat sampel 5 gr; kelompok 5 membutuhkan 4,800ml dengan berat sampel 5,1 gr dan kelompok 6 membutuhkan 1,200ml dengan berat sampel 5 gr. Volume titran yang diperoleh dari hasil titrasi tersebut dapat dihitung menggunakan rumus dan diketahui angka peroksidanya.
Urutan angka peroksida dari terkecil hingga terbesar pada setiap kelompok yaitu kelompok 1 dengan sampel minyak baru sebesar 12,000 meq/gr; kelompok 3 dengan sampel minyak baru + air + panas sebesar 22,000 meq/gr; kelompok 6 dengan sampel minyak jelantah sebesar 24,000 meq/gr; kelompok 2 dengan sampel minyak baru + dipanaskan sebesar 27,451 meq/gr; kelompok 4 dengan sampel minyak lama tertutup sebesar 70,000 meq/gr dan kelompok 5 dengan sampel minyak lama terbuka sebesar 94,118 meq/gr.
Kelompok 5 dengan sampel minyak lama terbuka memiliki angka peroksida tertinggi hal ini dikarenakan dalam pengujian titrasi volume titran
natrium tiosulfat (Na2S2O3) yang dibutuhkan untuk titrasi sampai warna biru
hilang sangat banyak, sehingga angka peroksida yang diperoleh juga tinggi. Hal ini menandakan bahwa sampel minyak lama terbuka sudah mengalami proses oksidasi yang menyebabkan kerusakan pada minyak.
Menurut Aminah (2010), Pengukuran angka peroksida pada dasarnya adalah mengukur kadar peroksida dan hidroperoksida yang terbentuk pada tahap awal reaksi oksidasi lemak. Bilangan peroksida yang tinggi mengindikasikan lemak atau minyak sudah mengalami oksidasi, namun pada angka yang lebih rendah bukan selalu berarti menunjukkan kondisi oksidasi yang masih dini. Angka peroksida rendah bisa disebabkan laju pembentukan peroksida baru lebih kecil dibandingkan dengan laju degradasinya menjadi senyawa lain, mengingat kadar peroksida cepat mengalami degradasi dan bereaksi dengan zat lain.
Standar mutu pada Tabel 1 tersebut yaitu SNI 01-3741-2002, SNI ini merupakan revisi dari SNI 01-3741-1995, menetapkan bahwa standar mutu angka peroksida pada minyak goreng adalah maksimal 1 meq/kg (Noriko, 2012). Nilai angka peroksida pada praktikum yang diperoleh dari kelompok 1 sampai dengan kelompok 6 melebihi batas maksimal yaitu diatas 1 meq/kg, sehingga sampel pada praktikum penentuan angka peroksida secara keseluruhan tidak layak digunakan.
Bilangan peroksida yang tinggi menandakan minyak telah teroksidasi ditandai dengan rasa dan bau tengik. Trigliserida yang memiliki rantai tidak jenuh (rangkap) mengalami otooksidasi membentuk radikal-radikal bebas. Proses ini dapat dipercepat dengan adanya cahaya, panas, peroksida lemak atau hidroperoksida serta logam berat (seperti Cu, Fe, Co dan Mn). Proses selanjutnya yang terjadi adalah terbentuk senyawa hidroperoksida yang kemudian dipecah membentuk senyawa-senyawa aldehid. Senyawa-senyawa aldehid ini memberikan bau tengik dan bersifat toksik. Bilangan peroksida yang tinggi dan bau tengik yang terbentuk memandakan bahwa minyak jelantah hitam dan coklat sudah tidak bisa digunakan kembali karena bersifat
toksik yang dapat membahayakan kesehatan. Reaksi oksidasi/otooksidasi dapat dihambat dengan adanya antioksidan (Suroso, 2013).
Menurut Putri (2015), faktor-faktor yang mempengaruhi bilangan peroksida pada minyak goreng yaitu:
1. Oksigen
Oksigen adalah suatu diradikal yang stabil dan karena itu merupakan pereaksi (agent) radikal bebas yang selektif. Senyawa yang mengandung ikatan rangkap, hydrogen alilik, benzilik atau tersier, rentan (susceptible) tehadap oksidasi dan oleh udara juga disebut autooksidasi. Senyawa dengan hanya hydrogen primer atau sekunder tidak serentan itu. Lemak dan minyak nabati seringkali mengandung ikatan rangkap.
2. Cahaya
Cahaya alam seperti cahaya matahari juga dapat mempengaruhi senyawa pada minyak goreng yang digunakan untuk memasak. Ketengikan pada minyak goreng ditimbulkan oleh cahaya yang merupakan oksidator. Proses oksidasi dipercepat oleh adanya kombinasi dai oksigen dan cahaya. Misalnya pada lemak yang disimpan tanpa udara (O2), tetapi
dikenai cahaya sehingga menjadi tengik. Hal ini karena dekomposisi peroksida secara alamiah telah terdapat dalam lemak atau minyak. Cahaya berpengaruh sebagai akselerator pada oksidasi konstituen tidak jenuh
dalam lemak. 3. Suhu tinggi
Pada saat penggorengan makanan dapat terjadi perubahan- perubahan fisika-kimiawi pada makanan yang digoreng dan juga minyak gorengnya. Apabila suhu penggorengannya lebih tinggi dari suhu normal (168-196oC) akan menyebabkan degradasi minyak goreng dengan cepat (antara lain titik asap menurun). Titik asap adalah saat terbentuknya akrolein yang tidak diinginkan dan dapat menimbulkan rasa gatal pada tenggorokan.
4. Frekuensi penggunaan minyak goreng
Adanya pengaruh frekuensi menggoreng makanan dengan minyak goreng kedelai terhadap kenaikan angka peroksida dan angka asam lemak bebas. Perlakuan frekuensi menggoreng mulai dari frekuensi pertam
hingga ke sepuluh semakin meningkat angka peroksidanya dan melewati batas maksimum angka peroksidanya.
5. Lama pemanasan minyak goreng
Terbentuknya peroksida pada minyak goreng apabila digunakan lebih dari empat kali pemanasan yang mengalami oksidasi (reaksi dengan udara). Pemanasan minyak terputus (dipanaskan-didinginkan-dipanaskan) selama beberapa hari yang menyebabkan destruksi makin cepat dan mengalami dekomposisi, bila kemudian didinginkan pada malam hari akan menyebabkan dekomposisi pada saat minyak dipanaskan kembali.
Asam lemak tidak jenuh dapat mengikat oksigen pada ikatan rangkapnya hingga membentuk senyawa peroksida seperti terlihat pada Gambar 3.4 jumlah peroksida yang terdapat dalam minyak ditetapkan dengan metode iodometri. Pada metode ini iod mereduksi peroksida-peroksida yang terbentuk dalam minyak (Suroso, 2013).
R-CH=R’ + O2 R-CH-CH-R’ R-CH-CH-R’ R-CH + CH-R
O O O O O
O
Monooksida Peroksida labil aldehid (bau tengik) Gambar 3.4 Reaksi oksidasi asam lemak tidak jenuh
Tabel 3.2 Penentuan Asam Lemak Bebas (FFA)
Kel Sampel ml NaOH %FFA Angka Asam
7 Minyak buka gelap 0,400 0,051 0,079
8 Minyak buka terang 0,800 0,099 0,156
9 Minyak tutup gelap 0,800 0,101 0,159
10 Minyak tutup terang 0,900 0,113 0,177
11 Minyak goreng dipanaskan 1,100 0,138 0,217
12 Minyak + air 5% 0,900 0,114 0,178
Sumber : Laporan sementara
Asam lemak bebas (ALB) adalah suatu asam yang dibebaskan pada proses hidrolisis lemak oleh enzim. Proses hidrolisis dikatalisis oleh enzim
lipase yang juga terdapat dalam buah, tetapi berada diluar sel yang mengandung minyak. Jika dinding sel pecah atau rusak karena proses pembusukan atau karena pelukaan mekanik, tergores atau memar karena benturan, enzim akan bersinggungan dengan minyak dan reaksi hidrolisis akan berlangsung dengan cepat sehingga membentuk gliserol dan asam lemak bebas (Mangoensoekarjo, 2003).
Angka asam (acid number) merupakan suatu bilangan atau angka yang menunjukkan banyaknya asam lemak bebas yang terdapat dalam lemak atau minyak, yang dihasilkan terutama dari peranan enzim lipase (EC 3.1.1.3). angka asam dinyatakan sebagai banyaknya mg KOH yang dibutuhkan untuk menetralkan asam lemak bebas dalam setiap g lemak (Makfoeld, 2002). Menurut Rahim (2015), prinsip penentuan persentase asam lemak bebas (FFA) adalah dengan titrasi sampel yang dilarutkan dengan etanol oleh NaOH untuk menetralkan asam lemak bebas.
Menurut Siaka (2012), nilai %FFA sampel minyak jelantah ditentukan melalui titrasi menggunakan larutan kalium hidroksida (KOH) yang sebelumnya telah dibakukan dengan larutan asam oksalat (H2C2O4).
Menurut Iskandar (2015), Penentuan %FFA minyak jelantah dilakukan dengan rumusan:
%FFA =
1000 x 100% Dimana: N : Normalitas NaOH
Pada tabel 3.2 Penentuan Asam Lemak Bebas (FFA) dilakukan dengan sampel minyak sebesar 20gr untuk tiap kelompok. Setiap kelompok mendapatkan minyak dengan perlakuan yang berbeda-beda. Perlakuan yang diberikan berturut-turut dari kelompok 7 sampai dengan kelompok 12 yaitu buka gelap, buka terang, tutup gelap, tutup terang, dipanaskan, dan ditambah air 5%. Perlakuan dilakukan untuk mengetahui pengaruh oksidasi seperti paparan oksigen, cahaya, dan suhu tinggi. Kelompok 7 dengan ml NaOH 0,400 diperoleh %FFA sebesar 0,051 dan angka asamnya 0,079. Kelompok 8 dengan ml NaOH 0,800 diperoleh %FFA sebesar 0,099 dan angka asamnya 0,156. Kelompok 9 dengan ml NaOH 0,800 diperoleh %FFA sebesar 0,101 dan angka asamnya 0,159. Kelompok 10 dengan ml NaOH 0,900 diperoleh %FFA sebesar 0,113 dan angka asamnya 0,177. Kelompok 11 dengan ml NaOH 1,100 diperoleh %FFA sebesar 0,138 dan angka asamnya 0,217.
Kelompok 12 dengan ml NaOH 0,900 diperoleh %FFA sebesar 0,114 dan angka asamnya 0,178.
Penentuan asam lemak bebas dilakukan dengan titrasi menggunakan larutan 0,1 N NaOH sebagai basa alkali sampai warna merah jambu tercapai dan tidak hilang selama 30 detik. Sebelum dilakukan titrasi dilakukan penambahan alkohol, fungsi penambahan alkohol adalah untuk melarutkan lemak atau minyak dalam sampel agar dapat bereaksi dengan basa alkali. Karena alkohol yang digunakan adalah untuk melarutkan minyak, sehingga alkohol (etanol) yang digunakan konsentrasinya berada di kisaran 95-96%, karena etanol 95% merupakan pelarut lemak yang baik.
Menurut Ismiyarto (2006), perhitungan bilangan asam dilakukan dengan metode ekstraksi pelarut menggunakan etanol 96%, karena kelarutan asam lemak bebas cukup baik. Asam lemak yang pada mulanya berada di dalam fasa minyak bersama dengan trigliserida akan terdistribusi ke fasa etanol, karena asam lemak mempunyai gugus karboksilat yang bersifat polar. Sehingga berdasarkan perbedaan kelarutan ini maka antara trigliserida dengan asam lemak bebas dalam etanol dapat dipisahkan. Proses pemisahan fasa etanol dengan fasa minyak dapat dilakukan dengan metode ekstraksi pelarut.
Alcohol berfungsi untuk melarutkan asam lemak. Penambahan alcohol yang dipanaskan 10 menit dalam penanggas air yaitu karena sifat alcohol yang mudah menguap sehingga akan mempercepat penguapan (Salamah, 2010).
Setelah penambahan alkohol dilakukan penambahan 3 tetes indikator PP. Indikator PP atau dapat disebut fenolftalein merupakan salah satu dari beberapa indikator yang umum digunakan untuk menentukan titik akhir titrasi asam basa. Pada umumnya fenolftalein digunakan dalam titrasi asam kuat dengan basa kuat struktur molekul indikator asam basa mengandung gugus pembawa sifat asam atau basa dan struktur konjugasinya yang dapat
menimbulkan perubahan warna. Titrasi asam basa merupakan salah satu metode analisis kuantitatif untuk menentukan konsentrasi dari suatu zat yang ada dalam larutan. Keberhasilan dalam titrasi asam-basa sangat ditentukan oleh kinerja indikator yang mampu menunjukkan titik akhir dari titrasi. Indikator merupakan suatu zat yang ditambahkan ke dalam larutan sampel sebagai penanda yang menunjukkan telah terjadinya titik akhir titrasi pada analisis volumetrik. Suatu zat dapat dikatakan sebagai indikator titrasi asam basa jika dapat memberikan perubahan warna sampel seiring dengan terjadinya perubahan konsentrasi ion hidrogen atau perubahan pH (Ratnasari, 2016).
Dari hasil titrasi yang dilakukan dapat diketahui volume titran NaOH sebagai basa alkali yang digunakan, sehingga dapat dihitung %FFA dan angka asamnya. Urutan nilai angka asam pada uji FFA dari yang besar hingga terkecil pada sampel minyak yaitu kelompok 11 dengan perlakuan dipanaskan sebesar 0,217; kelompok 12 dengan perlakuan ditambah air 5% sebesar 0,178; kelompok 10 dengan perlakuan tutup terang sebesar 0,177; kelompok 9 dengan perlakuan tutup gelap sebesar 0,159; kelompok 8 dengan perlakuan buka terang sebesar 0,156; dan kelompok 7 dengan perlakuan buka gelap
sebesar 0,079.
Kelompok 11 dengan sampel minyak goreng dipanaskan memil iki angka asam tertinggi dibandingkan dengan sampel minyak yang lain hal dikarenakan sampel minyak dengan perlakuan dipanaskan sudah mengalami penurunan
kualitas minyak dimana kandungan asam lemak bebas dalam minyak tersebut banyak. Menurut Suroso (2013), tingginya bilangan asam ini artinya setara dengan tinggi pula kadar asam lemak bebasnya. Trigliserida yang terkandung di dalam sudah banyak yang terurai menjadi asam lemak bebasnya akibat reaksi hidrolisa. Hal ini bisa terjadi pada proses pemanasan minyak pada suhu tinggi dan berulang-ulang.
Menurut Aminah (2010), oksidasi lemak oleh oksigen terjadi secara spontan jika bahan berlemak dibiarkan kontak dengan udara, sedangkan kecepatan proses oksidasinya tergantung pada tipe lemak dan kondisi penyimpanan. Minyak curah terdistribusi tanpa kemasan, paparan oksigen dan cahaya pada minyak curah lebih besar dibanding dengan minyak kemasan. Paparan oksigen, cahaya, dan suhu tinggi merupakan beberapa faktor yang mempengaruhi oksidasi. Penggunaan suhu tinggi selama penggorengan memacu terjadinya oksidasi minyak. Setiap peningkatan suhu 10oC laju kecepatan oksidasi meningkat dua kali lipat. Kecepatan oksidasi lemak akan bertambah dengan kenaikan suhu dan berkurang pada suhu rendah.
Standar mutu pada tabel 1 tersebut yaitu SNI 01-3741-2002, SNI ini merupakan revisi dari SNI 01-3741-1995, menetapkan bahwa standar mutu asam lemak bebas pada minyak goreng adalah maksimal 0,30% (Noriko, 2012). Standar minyak goreng menurut SNI 01-3555-1998 yaitu pada rentang 1 - 4 dengan sampel 10 gram (Widayat, 2006). Hasil %FFA pada praktikum yang diperoleh dari kelompok 7 sampai dengan kelompok 12 memiliki nilai dibawah 0,30% sehingga sampel pada praktikum penentuan asam lemak bebas masih memenuhi standar mutu SNI dan masih layak digunakan atau belum rusak.
Tabel 3.3 Penentuan Bilangan TBA
Kel Perlakuan Berat
Bahan (gr) Absorbansi
Bilangan TBA 1&2 Minyak goreng + tutup
terang 10 -
-3&4 Minyak goreng + tutup
gelap 10 0,132 0,309
5 Minyak goreng +
dipanaskan 10 0,038 0,089
6 Minyak goreng + air 5% +
dipanaskan 10 0,113 0,264
Sumber : laporan Sementara
Bilangan TBA adalah indikator oksidasi sekunder yang terjadi pada minyak/lemak atau pada produk pangan berminyak/berlemak. Penentuan bilangan TBA merupakan pengujian yang paling sering digunakan untuk mengukur ketengikan pada minyak. Uji TBA merupakan uji yang spesifik untuk hasil oksidasi dari asam lemak yang tidak jenuh dan dapat digunakan pada produk makanan sehari-hari yang proporsi asam lemak tidak jenuhnya
rendah. Lemak yang tengik mengandung aldehid dan kebanyakan sebagai malonaldehid. Banyaknya malonaldehid dapat ditentukan dengan jalan didestilasi lebih dahulu. Malonaldehid kemudian direaksikan dengan thiobarbiturat sehingga terbentuk kompleks berwarna merah. Semakin besar angka TBA, maka minyak semakin tengik (Sudarmadji, 2010).
Tujuan dilakukan uji TBA untuk mengetahui adanya reaksi lebih lanjut pada lemak yang dapat menyebabkan ketengikan. Prinsip dari uji TBA berdasarkan atas terbentuknya pigmen berwarna merah sebagai hasil dari
reaksi kondensasi antara 2 molekul TBA dengan 1 molekul malonaldehid. Malonaldehid kemudian direaksikan dengan thiobarbiturat, lemak yang tengik akan bereaksi dengan asam thiobartiturat menghasilkan warna merah. Intensitas warna merah menunjukkan derajat ketengikan dari minyak tersebut. Intensitas warna merah sesuai dengan jumlah malonaldehid dan absorbansi dapat ditentukan dengan spektrofotometer pada panjang gelombang λ528 nm. Semakin besar angka TBA, maka minyak semakin tengik (Khotimah, 2013).
Intensitas warna merah sesuai dengan jumlah malonaldehid dan absorbansi dapat ditentukan dengan spektrofotometer pada panjang gelombang λ528 nm. Penentuan bilangan TBA dapat dihitung dengan rumus:
Angka TBA = ℎ/ 528 7,8 bobot sampel (gram)
Keterangan:
Aλ528 = Absorbansi pada λ528 nm
Semakin besar angka TBA, maka minyak akan semakin tengik (Sudarmadji, 2010).
Dari hasil destilat dari pendestilasian minyak yang diberi 4 perlakuan berbeda dengan penambahan masing-masing HCl, kemudian dilakukan penspektofotometrian pada λ528 nm. Urutan Bilangan TBA pada praktikum kali ini dari yang besar hingga terkecil pada sampel minyak yaitu sampel kelompok 3 dan 4 dengan perlakuan tertutup gelap yaitu sebesar 0,309; sampel kelompok 6 dengan perlakuan ditambah air 5% dan dipanaskan yaitu sebesar 0,264; dan sampel kelompok 5 dengan perlakuan dipanaskan yaitu sebesar 0,089. Berdasarkan hasil praktikum, hasil absorbansi tertinggi adalah minyak dengan perlakuan tertutup gelap, hal ini tidak sesuai dengan teori Augustyn (2012), bahwa semakin tinggi kadar air maka semakin tinggi angka TBA dan semakin tinggi tingkat kerusakan minyak yang terjadi
Faktor yang mempengaruhi nilai TBA diantaranya yaitu kadar air, pemanasan, cahaya dan oksigen. Minyak yang sudah mendapat perlakuan pemanasan, terkena cahaya, dan oksigen, maka nilai TBAnya akan lebih tinggi daripada minyak yang masih segar. Semakin tinggi kadar air maka semakin tinggi angka TBA dan semakin tinggi tingkat kerusakan minyak yang terjadi (Augustyn, 2012).
E. Kesimpulan
Berdasarkan percobaan acara III “Uji Kerusakan Minyak” yang telah dilakukan, dapat diambil kesimpulan:
1. Hasil penentuan bilangan peroksida, urutan angka peroksida dari terkecil hingga terbesar pada setiap kelompok yaitu kelompok 1 dengan sampel minyak baru sebesar 12,000 meq/gr; kelompok 3 dengan sampel minyak baru + air + panas sebesar 22,000 meq/gr; kelompok 6 dengan sampel
minyak jelantah sebesar 24,000 meq/gr; kelompok 2 dengan sampel minyak baru + dipanaskan sebesar 27,451 meq/gr; kelompok 4 dengan sampel minyak lama tertutup sebesar 70,000 meq/gr dan kelompok 5 dengan sampel minyak lama terbuka sebesar 94,118 meq/gr.
2. Hasil penentuan angka asam, urutan nilai angka asam pada uji FFA dari yang besar hingga terkecil pada sampel minyak yaitu kelompok 11 dengan perlakuan dipanaskan sebesar 0,217; kelompok 12 dengan perlakuan ditambah air 5% sebesar 0,178; kelompok 10 dengan perlakuan tutup terang sebesar 0,177; kelompok 9 dengan perlakuan tutup gelap sebesar 0,159; kelompok 8 dengan perlakuan buka terang sebesar 0,156; dan kelompok 7 dengan perlakuan buka gelap sebesar 0,079.
3. Hasil pengujian TBA, urutan bilangan TBA pada praktikum kali ini dari yang besar hingga terkecil pada sampel minyak yaitu sampel kelompok 3 dan 4 dengan perlakuan tertutup gelap yaitu sebesar 0,309; sampel kelompok 6 dengan perlakuan ditambah air 5% dan dipanaskan yaitu sebesar 0,264; dan sampel kelompok 5 dengan perlakuan dipanaskan yaitu sebesar 0,089.
DAFTAR PUSTAKA
Aisyah, Siti., Eny Yulianti., dan A. Ghanaim Fasya. 2010. Penurunan Angka Peroksida dan Asam Lemak Bebas (FFA) pada Proses Bleaching Minyak Goreng Bekas oleh Karbon Aktif Polong Buah Kelor (Moringa Oliefera. Lamk) dengan Aktivasi NaCl . Jurnal Alchemy Vol. 1, No. 2, Hal. 53-103. Aminah, Sitti. 2010. Bilangan Peroksida Minyak Goreng Curah dan Sifat
Organoleptik Tempe Pada Pengulangan Penggorengan . Jurnal Pangan dan Gizi Vol. 01 No. 01.
Augustyn, Gelora H. 2012. Pengaruh Penambahan Ekstrak Buah Pepaya (Carica papaya L.) terhadap Mutu Minyak Kelapa Murni. Jurnal Budidaya
Pertanian, Vol. 8. No 1, Hal. 55-60.
Ayala, Antonio., Mario F. Muñoz., and Sandro Argüelles. 2014. Lipid Peroxidation: Production, Metabolism, and Signaling Mechanisms of Malondialdehyde and 4-Hydroxy-2-Nonenal . Jornal of Oxidative
Medicine and Cellular Longevity Vol. 14, Hal. 1-31. Buckle, K. A. 2010. Ilmu Pangan. UI Press. Jakarta.
Gunawan., Mudji Triatmo., dan Arianti Rahayu. 2003. Analisis Pangan: Penentuan Angka Peroksida dan Asam Lemak Bebas Pada Minyak Kedelai Dengan Variasi Menggoreng . JSKA.Vol.6, No.3.
Iskandar, Ahmat., Ersan., dan Rachmad Edison. 2015. Pengaruh Dosis Enzim Papain Terhadap Rendemen dan Kualitas Virgin Coconut Oil (VCO) .
Jurnal AIP Vol. 3, No. 2, Hal. 82-93
Ismiyarto, S., Anisah Halim dan Pratama Jujur Wibawa. 2006. Identification of Fatty Acid Compotition in Turi Seed Oil (Sesbania grandiflora (L) Pers).
Jurnal Kimia Sains dan Aplikasi Vol. 9, No. 1.
Khotimah, K., Darius dan B.B. Sasmito. 2013. Uji Aktivitas Senyawa Aktif Alga Coklat (Sargassum fillipendulla) sebagai Antioksidan Pada Minyak Ikan Lemuru (Sardinella longiceps). THPi Student Journal Vol. 1, No. 1, Hal.
10-20.
Makfoeld, Djarir., Djagal Wiseso Marseno., dan Pudji Hastuti. 2002. Kamus Istilah Pangan dan Nutrisi. Kanisius. Yogyakarta.
Mangoensoekarjo, S dan H. Semangun, 2003. Manajemen Agrobisnis Kelapa Sawit . Gajah Mada University Press. Yogyakarta.
Muchtadi, Tien R., Suugiyono., dan Fitriyono Ayuningwarno. 2011. Ilmu Pengetahuan Bahan Pangan. Alfabeta. Bandung.
Noriko, Nita., Dewi Elfidasari., dan Analekta Tiara Perdana. 2012. Analisis Penggunaan dan Syarat Mutu Minyak Goreng pada Penjaja Makanan di
Food Court UAI . Jurnal Al-Azhar Indonesia Seri Sains dan Teknologi Vol. 1, No. 3, Hal. 147-154.
Nouira, Wassim., Young W. Park., Zehra Guler., dan Thomas Terrill. 2011. Comparison of Free Fatty Acid Composition Between Low-Fat and Full- Fat Goat Milk Cheeses Stored for 3 Months Under Refrigeration. Open
Journal of Animal Sciences Vol. 1, No. 2, Hal. 17-23.
Novitriani, Korry., dan Iin Intarsih. 2013. Pemurnian Minyak Goreng Bekas. Jurnal Kesehatan Bakti Tunas Husada Vol. 9, No. 1, Hal. 101-106.
Putri, Sarah Islamia Dhahono. 2015. Efek Lama Pemanasan Terhadap Perubahan Bilangan Peroksida Minyak Goreng Yang Berpotensi Karsiogenik Pada Pedagang Gorengan Di Kelurahan Pasar Minggu (Skripsi) . Universitas
Islam Negeri Syarif Hidayatullah. Jakarta.
Rahim, Abdul Malik Espad Nur dan Indah Prihatiningtyas. 2015. Pengaruh Katalis Asam dan Basa Terhadap Biodiesel Yang Dihasilkan Pada Proses
Trans (esterefikasi) In Situ Biji Karet (Havea brasiliensis). Prosiding Seminar Nasional ReTII ke-10 Hal. 718-722.
Ratnasari, Sinta., Dede Suhendar., dan Vina Amalia. 2016. Studi Potensi Ekstrak Daun Adam Hawa (Rhoeo discolor) Sebagai Indikator Titrasi Asam
–
Basa. Journal of Chimica et Natura Acta Vol. 4, No. 1, Hal. 39-46.Salamah, Siti. 2010. Pembuatan Bahan Bakar Alternatif Biodiesel Dari Minyak Kemiri. Makalah Pendamping: Kimia SN-KPK II ISBN: 979-498-547-3. Shantha, Nalur C and Eric A. Decker. 1994. Rapid, Sensitive, Iron-Based
Spectrophotometric Methods for Determination of Peroxide Values of Food Lipids. Journal of AOAC International Vol. 77, No. 2.
Siaka, I Made., Yuky Astary Hermanto., dan Ida Ayu Gede Widihati. 2012. Optimasi Kondisi Reaksi Hidrogenasi Metil Ester Dalam Peningkatan Aktivitas Surfaktan Berbasis Minyak Jelantah. Jurnal Kimia Vol. 6, No. 2,
Hal. 115-122.
Silaban, Ramlan., Riza Sahala Manullang., dan Vivi Hutapea. 2014. Pembuatan Virgin Coconut Oil (VCO) Melalui Kombinasi Teknik Fermentasi Dan Enzimatis Menggunakan Ekstrak Nenas. Jurnal Pendidikan Kimia Vol. 6, No. 1, Hal. 91-99.
Sudarmadji, Slamet., B. Haryono., dan Suhardi. 2010. Analisa Bahan Makanan dan Pertanian. Liberty. Yogyakarta.
Suroso, Asri Sulistijowati. 2013. Kualitas Minyak Goreng Habis Pakai Ditinjau Dari Bilangan Peroksida, Bilangan Asam dan Kadar Air . Jurnal
Kefarmasian Indonesia Vol. 3, No. 2, Hal: 77-88.
Syah, Andi Nur Alam. 2007. Virgin Coconut Oil Minyak Penakluk Aneka Penyakit . Agromedia Pustaka. Jakarta.
Tokur, Bahar., Koray Korkmaz., dan Deniz Ayas. 2006. Comparison of Two Thiobarbituric Acid (TBA) Method for Monitoring Lipid Oxidation in Fish. Journal of Fisheries and Aquatic Sciences Vol. 23, Issue 3. Hal. 331 –
334.
Widayat, Suherman dan K Haryani. 2006. Optimasi Proses Adasorbsi Minyak Goreng Bekas Dengan Adsorbent Zeolite Alam: Studi Pengurangan Bilangan Asam. Jurnal Teknik Gelagar Vol. 17, No. 1, Hal. 77-82.
Wqsowicz, Erwin et al . 2004. Oxidation of Lipids in Food . Polish Journal of Food and Nutrition Sciences Vol. 13, No. 54, Hal. 87 – 100.
LAMPIRAN PERHITUNGAN
Perhitungan Tabel 3.1 Penentuan Angka Peroksida Angka peroksida = Na2S2O3 x N Na2S2O3 x 1000
() 4. 0,6 0,1 1000 5 = 12,000 5. 1,4 0,1 1000 5,1 = 27,451 6. 1,1 0,1 1000 5 = 22,000 7. 3,5 0,1 1000 5 = 70,000 8. 4,8 0,1 1000 5,1 = 94,118 9. 1,2 0,1 1000 5 = 24,000
Perhitungan Tabel 3.2 Penentuan Asam Lemak Bebas (FFA) Kelompok 8:
%FFA = NaOH x N NaOH x BM as.lemak
() 1000 x 100 = 0,8 x 0,1 x 256 20,5 1000 x 100 = 0,099% Faktor = . 10 ⁄ = 25640 10 ⁄ = 1,563
Angka Asam = Faktor x %FFA = 1,563 x 0,099 = 0,156
Perhitungan Tabel 3.3 Penentuan Bilangan TBA Bilangan TBA = 3
x absorbansi x 7,8 Kelompok 1 & 2 Bilangan TBA =
-Kelompok 3 & 4 Bilangan TBA = 3
10 x 0,132 x 7,8 = 0,309
Kelompok 5 Bilangan TBA = 3
10 x 0,038 x 7,8 = 0,089
Kelompok 6 Bilangan TBA = 3
10 x 0,113 x 7,8 = 0,264
LAMPIRAN GAMBAR
Gambar 3.5 Penimbangan Sampel Gambar 3.6 Sampel Minyak
Minyak Uji FFA Sebelum Titrasi
Gambar 3.7 Sampel Minyak Setelah Gambar 3.8 Penimbangan Sampel
Setelah Titrasi Minyak Uji TBA
Gambar 3.9 Sampel Minyak Setelah Gambar 3.10 Proses Destilasi Uji