3. PENGEMBANGAN METODE ELEKTROPORASI PADA
SPERMA SEBAGAI PERANTARA TRANSFER GEN PADA
IKAN PATIN SIAM (Pangasionodon hypophthalmus)
ABSTRAK
Penggunaan metode elektroporasi dengan menggunakan sperma sebagai perantara transfer gen asing untuk memproduksi ikan transgenik telah dibuktikan keberhasilannya. Tujuan penelitian yang dilakukan adalah mendapatkan kondisi elektroporasi yang optimal pada sperma ikan patin siam (Pangasionodon
hypophthalmus). Penelitian dilakukan di Loka Riset Pemuliaan dan Teknologi
Budidaya Perikanan Air Tawar di Sukamandi dan Laboratorium Reproduksi dan Genetika Organisme Akuatik di Institut Pertanian Bogor. Plasmid yang mengandung gen EGFP (enhanced green fluorescent protein) yang disambungkan dengan promoter β-aktin ikan mas ditransfer ke dalam sperma menggunakan metode elektroporasi untuk memproduksi ikan patin siam transgenik. Elektroporasi dilakukan menggunakan tipe kejutan square wave dengan lama kejutan (pulse length) 30 milidetik dan interval kejutan (pulse interval) 0,1 detik. Perlakuan berupa kombinasi antara kuat medan listrik (125, 187,5 dan 250 V/cm) dan jumlah kejutan listrik (1 dan 3). Konsentrasi DNA plasmid adalah 10 µg/ml TE. Hasil penelitian menunjukkan peningkatan kuat medan listrik dari 125 sampai 250 V/cm menurunkan motilitas sperma, adapun jumlah kejutan tidak mempengaruhi motilitas sperma. Motilitas sperma yang dikejut pada 125 V/cm lebih tinggi dibandingkan perlakuan lainnya walaupun kelangsungan hidup sperma relatif sama antar perlakuan dan kontrol kecuali pada sperma yang dilektroporasi pada 250 V/cm dengan jumlah kejutan 3 kali. Sperma yang dielektroporasi masih memiliki kemampuan untuk membuahi sel telur. Derajat penetasan tertinggi berasal dari telur yang dibuahi sperma yang dielektroporasi pada 125 V/cm dengan jumlah kejutan 1 dan 3 kali. Keberadaan gen EGFP dideteksi pada sperma yang dielektroporasi maupun pada sperma yang hanya diinkubasi (kontrol). Namun, pada fase larva gen EGFP hanya dapat dideteksi pada larva yang berasal dari telur yang difertilisasi sperma yang dielektroporasi. Oleh karena itu, elektroporasi dapat digunakan untuk memproduksi ikan patin transgenik. Ekspresi gen EGFP dimulai pada fase 2-8 sel dan mencapai puncaknya pada fase neurula.
OPTIMALIZATION ELECTROPORATION METHODS
ON STRIPPED CATFISH (Pangasiondon hypohthalmus) SPERM
AS A CARRIER FOR GENE TRANSFER
ABSTRACTThe success of transgenic fish production has been proven through eggs fertilization using the electroporated sperms carrying exogenous DNA. This study was conducted in order to obtain the optimal electroporation condition for stripped catfish (Pangasionodon hypophthalmus) sperm. The research was done at Research Institute for Freshwater Fish Breeding and Aquaculture, Sukamandi and Reproduction and Genetic of Aquatic Organism Laboratory, Bogor Agricultural University. Plasmid containing enhanced green fluorescent protein (EGFP) gene driven by carp β-actin promoter was transferred into sperm using electroporation method towards transgenic stripped catfish production. Electroporation was carried out using square wave shock with pulse length of 30 ms and pulse interval of 0.1 s. Treatments are combination between electric field strengths (125; 187,5 and 250 V/cm) and pulse number (1 and 3). Exogenous DNA concentration was 10 µg/ml of Tris-EDTA. Results showed that increasing of electric field strength from 125 to 250 V/cm decreased sperm motility, while pulse number did not affect sperm motility. Electric field strength of 125 V/cm gave the best motility of sperm, although sperm viability relatively similar between treatments and control except at 250 V/cm with 3 pulses number. Further, electroporation treated sperm were able to fertilize eggs. Higher hatching rate of eggs was obtained in electroporation treatment at 125 V/cm with pulse number of 1 and 3. The persistence of transferred EGFP was detected in electroporated and incubated sperms (control). However, EGFP was only detected in larvae from eggs that fertilized by electroporated sperm. Thus, electroporation could be applied to produce transgenic stripped catfish. EGFP expression was started at 2-8 cells stage, and peak expression was achieved at neurula stage. Keywords: electroporation, sperm, Pangasionodon hypophthalmus
PENDAHULUAN
Pada saat ini, tersedia beberapa teknik transfer gen untuk memproduksi ikan transgenik, termasuk mikroinjeksi DNA ke dalam nukleus telur yang telah dibuahi (Ozato et al. 1986), elektroporasi pada telur dan sperma (Inoue et al. 1990; Lu et al. 2002), lipofeksi gonad (Lu et al. 2002), retroviral vector (Lin et al. 1994) dan particle gun bombardment (Yazawa et al. 2005). Di antara teknik-teknik ini, mikroinjeksi merupakan teknik-teknik yang paling banyak dipakai dan
memiliki tingkat keberhasilan yang tinggi untuk memproduksi ikan transgenik. Namun demikian, teknik mikroinjeksi membutuhkan keterampilan yang tinggi dan keberhasilannya ditentukan oleh karakteristik telur seperti ukurannya yang kecil, korion yang keras, mudah pecah, buram, dan sebagainya (Lanes et al. 2009). Produksi hewan transgenik melalui mikroinjeksi relatif mahal dengan tingkat keberhasilan 1-4% (Anzar & Buhr 2006).
Spermatozoa dapat berperan sebagai “carrier” DNA eksogen, karena memiliki kemampuan alami untuk mentransfer DNA eksogen ke dalam oosit dan memproduksi benih transgenik (Anzar & Buhr 2006). Brackett et al. (1971) pertama kali mendemonstrasikan bahwa sperma kelinci mampu mengikat DNA eksogen yang ada dalam larutan, dan DNA ini terlokalisasi dalam kepala sperma. Hampir dua dekade berikutnya, Arezzo (1989) dan Lavitrano et al. (1989) membuktikan bahwa sel spermatozoa bulu babi dan tikus dapat digunakan sebagai vektor untuk transfer gen. Menurut Sin et al. (2000), sperm-mediated gene
transfer (SMGT) merupakan metode yang ideal untuk transfer gen secara massal
pada organisme yang fertilisasinya eksternal seperti pada ikan salmon. SMGT dapat berguna untuk transgenesis pada spesies yang memiliki fekunditas yang tinggi, ukuran telur yang kecil dan dapat diakses dengan mudah pada spermatozoa (Lanes et al. 2009).
SMGT efisien dalam memproduksi babi transgenik yang mengandung
human decay accelerating factor (hDAF) dengan tingkat transkripsi 64% pada
jaringan yang diuji. Teknik ini lebih sederhana dibandingkan mikroinjeksi pada zigot dan membuka kesempatan untuk melakukan transgenesis pada skala massal. Beberapa laporan penelitian menyebutkan bahwa spermatozoa tikus, ayam, kerbau, dan manusia mampu mengikat DNA eksogen. Walaupun hewan transgenik dari berbagai spesies telah berhasil diproduksi, efisiensi transfer DNA dengan perantara sperma masih dipertanyakan, terutama disebabkan tingkat pengikatan DNA eksogen yang rendah oleh spermatozoa, sehingga menurunkan kesempatan fertilisasi oosit oleh spermatozoa yang tertransfeksi (disarikan dari Anzar & Buhr 2006).
Berdasarkan beberapa hasil penelitian pada ikan, SMGT yang baik hanya ditemukan pada sperma yang dielektroporasi, seperti pada nila (Oreochromis
niloticus), zebra (Danio rerio), salmon (Oncorhynchus tshawytscha), koan
(Ctenopharyngodon idellus) dan silver red sea bream (Sparus sarba) (disarikan dari Lanes et al. 2009). Menurut Inoue et al. (1990), dibandingkan dengan mikroinjeksi, elektroporasi merupakan teknik yang lebih mudah dalam pengerjaannya karena elektroporasi pada telur hasil fertilisasi dapat memproduksi 10 sampai 100 kali lipat dibandingkan mikroinjeksi (Powers et al. 1992). Namun demikian, efisiensi transfer gen masih belum cukup mampu untuk menangani sejumlah besar telur hasil pemijahan dalam waktu yang sangat singkat pada spesies akuakultur.
Aplikasi elektroporasi dengan perantara sperma pada ikan memiliki beberapa keuntungan antara lain yaitu: (1) Teknik ini merupakan teknik transfer gen secara massal, (2) Teknik ini mampu mengatasi beberapa kekurangan sistem transfer gen konvensial yang disebabkan karakter telur seperti warna yang kabur/buram, menempel, melayang, pronuklei yang tidak tampak, dan korion yang keras, (3) DNA asing harus ditransfer ke dalam nukleus, jika telur hasil fertilisasi dielektroporasi dengan DNA asing, fragmen DNA memiliki kesempatan yang lebih besar untuk ditransfer ke dalam beberapa tempat selain blastodisk karena volumenya sangat kecil dalam telur hasil fertilisasi, (4) Sperma ikan mudah ditangani karena penambahan air secara sederhana mampu untuk mengaktifkan sperma, (5) Sperma dari hewan akuatik dapat di-kriopreservasi sehingga sperma dapat selalu tersedia untuk digunakan. Oleh karena itu, sperma ikan dapat digunakan sebagai vektor untuk mengintroduksi DNA asing untuk memproduksi ikan transgenik (Tsai 2000).
Keberhasilan transfer gen ke dalam organisme akuatik telah dibuktikan melalui elektroporasi sperma menggunakan DNA eksogen sebelum fertilisasi. Efisiensi transfer DNA pada telur ikan ayu (Plecoglossus altivelis) melalui metode elektroporasi dengan perantara sperma adalah 55% ( Cheng et al. 2002), lebih baik dibandingkan loach sebesar 50% (Tsai et al. 1995), tetapi lebih rendah dibandingkan ikan zebra sebesar 80% (Powers et al. 1992). Pada penelitian ini akan dilakukan introduksi gen yang tersusun dari promoter β-aktin ikan mas (pCcBA) yang disambungkan dengan gen enhanced green fluorescent protein (EGFP) dengan menggunakan teknik elektroporasi pada sperma ikan patin siam
(Pangasionodon hypophthalmus). Untuk mendapatkan efisiensi transfer gen yang tinggi, pada penelitian ini diuji kombinasi tingkat kuat medan listrik (electric field
strength) dan jumlah kejutan listrik (pulse number) pada sperma ikan patin siam.
Diharapkan, gen EGFP yang ditransfer mampu terinsersi dan terekspresi pada ikan patin siam.
BAHAN DAN METODE
Koleksi Gamet
Induk jantan dan betina yang digunakan adalah induk ikan patin siam berukuran 2 - 4 kg yang diperoleh dari Loka Riset Pemuliaan dan Teknologi Budidaya Perikanan Air Tawar Sukamandi. Induk diseleksi berdasarkan tingkat kematangan gonadnya. Induk yang telah mencapai TKG III dipilih untuk dipijahkan. Induk hasil seleksi dari kolam induk dipindahkan ke dalam bak pemijahan.
Keseragaman kematangan telur dan ovulasi diinduksi melalui penyuntikan hormon. Induk betina diberi suntikan pertama berupa HCG dengan dosis 500 IU/kg bobot. Suntikan kedua diberikan dengan selang waktu 24 jam berupa ovaprim dengan dosis 0,6 ml/kg bobot. Striping untuk mendapatkan sel telur dilakukan 9 - 12 jam dari penyuntikan kedua.
Induk jantan diinduksi melalui penyuntikan ovaprim dengan dosis 0,2 – 0,3 ml/kg bobot. Striping untuk mendapatkan sperma dilakukan 9 - 12 jam setelah penyuntikan.
Konstruksi Plasmid
Konstruksi gen pCcBA-EGFP (Hidayani 2009) yang digunakan tersusun dari promoter β-aktin ikan mas (pCcBA) dan gen enhanced green fluorescent
protein (EGFP) dimodifikasi dari vektor ekspresi pEGFP-NI (Clontech). Vektor
pEGFP-N1 (panjang 4,7 kb) dipotong (digesti) menggunakan enzim restriksi Kpn I dan Apa I sebelum disambungkan (diligasi) dengan sekuens promoter pCcBA (panjang 1,9 kb). Proses digesti dilakukan dengan melarutkan 5 µl pEGFP-N1, 2,5
µl 10xK buffer, 5µl BSA, 1 µl enzim Kpn I, 1 µl enzim Apa I dan 35,5 µl SDW. Reaksi digesti diinkubasi selama satu jam pada suhu 37ºC.
Proses ligasi (penyambungan) dilakukan dengan mencampurkan 1 µl pCcBA, 6,5 µl 2x buffer ligasi, 1 µl enzim T4 DNA ligase dan 4,5 µl plasmid pEGFP-NI yang telah dipotong. Inkubasi dilakukan selama dua jam pada suhu ruang dan dilanjutkan semalam di dalam refrigerator (suhu sekitar 4°C). Peta konstruksi gen pCcBA-EGFP (6,0 kb) dapat dilihat pada Gambar 8.
Gambar 8 Peta konstruksi gen pCcBA-EGFP (6,0 kb). pCcBA= promoter β-aktin ikan mas. EGFP= enhanced green fluorescent protein. PolyA= poliadenilasi. KpnI, ApaI, AgeI, NotI= enzim restriksi.
Elektroporasi Sperma
Elektroporasi sperma dilakukan dengan menggunakan mesin Gene Pulser II (Biorad, USA). Sperma diencerkan dengan menggunakan larutan fisiologis (1 : 7) sebelum dicampur dengan plasmid. Untuk mendapatkan kondisi elektroporasi yang optimal maka dilakukan penelitian pendahuluan untuk mendapatkan kisaran kuat medan listrik yang mendukung motilitas dan kelangsungan hidup spermatozoa yang tinggi sehingga tetap memiliki kemampuan untuk membuahi sel telur. Kisaran kuat medan listrik yang digunakan yaitu antara 250 – 1250 V/cm. Berdasarkan hasil pada penelitian pendahuluan tersebut, diketahui bahwa kejutan listrik dengan menggunakan 250 V/cm menunjukkan nilai motilitas dan kelangsungan hidup sperma yang terbaik (Tabel 2). Pengujian lebih lanjut dilakukan untuk mendapatkan kombinasi kuat medan listrik dan jumlah kejutan listrik yang optimal sehingga didapatkan nilai motilitas spermatozoa dan ketahanan hidup spermatozoa yang tinggi serta larva yang membawa DNA eksogen. Kuat medan listrik yang diujikan adalah 125; 187,5 dan 250 V/cm
pCcBA
pCcBA
-
EGFP (6,0 kb)
EGFP
Poly A
dengan jumlah kejutan listrik 1 dan 3 kali. Elektroporasi dilakukan dengan tipe kejutan square wave dengan panjang kejutan (pulse length) 30 milidetik dan interval kejutan (pulse interval) 0,1 detik. Konsentrasi DNA plasmid yang digunakan adalah 10 µg/ml dalam TE.
Motilitas dan Kelangsungan Hidup Spermatozoa
Kualitas sperma hasil elektroporasi diukur dengan menentukan derajat motilitasnya. Satu tetes sperma diteteskan dengan menggunakan mikropipet di atas gelas objek kemudian ditutup dengan gelas penutup. Pada tepi gelas penutup diteteskan akuades lalu dilihat pergerakan spermatozoa setelah terkena air di bawah mikroskop dengan perbesaran 10x40. Penilaian motilitas didasarkan pada kriteria banyaknya sperma yang bergerak maju (progresif) dengan skor seperti ditunjukkan pada Tabel 1.
Tabel 1. Kriteria penilaian motilitas spermatozoa
Kriteria Skor
>70% spermatozoa bergerak cepat dengan arah maju dengan pergerakan ekor bervariasi
5,0 55-70% spermatozoa bergerak maju dan beberapa menunjukkan
gerakan cepat
4,0 40-55% spermatozoa bergerak maju dan beberapa menunjukkan
gerakan cepat
3,0 25-40% spermatozoa menunjukkan gerakan arah maju 2,0 10-25% spermatozoa menunjukkan gerakan arah maju 1,0 1-10% spermatozoa bergerak maju, kebanyakan spermatozoa tidak
bergerak
0,5
semua spermatozoa tidak bergerak 0,0
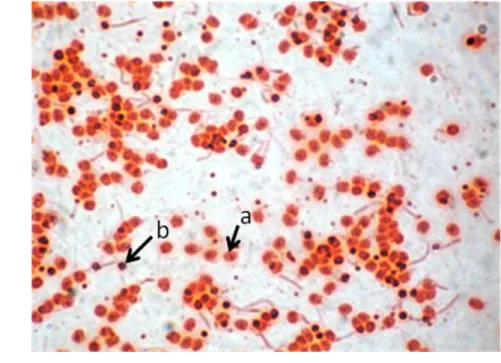
Kuantitas sperma yang hidup setelah elektroporasi diamati melalui pewarnaan eosin. Sperma diteteskan di atas gelas objek dan ditambahkan eosin 2%, kemudian dicampur secara merata dan dibuat preparat ulas yang tipis. Preparat ulas dibiarkan kering udara kemudian dibilas dengan akuades. Preparat diamati di bawah mikroskop dengan perbesaran 10x40 dengan 3 bidang pandang. Spermatozoa yang hidup ditandai dengan kepala sperma yang berwarna merah muda dan berbentuk bulat, sedangkan kepala sperma yang mati berwarna hitam dan berbentuk tidak beraturan (Gambar 9).
Gambar 9. Spermatozoa ikan patin siam. a = spermatozoa hidup, b = spermatozoa mati
Deteksi Gen EGFP pada Sperma dan Larva Ikan Patin Siam
Ekstraksi DNA. Pada sampel sperma, sebelum dilakukan ekstraksi DNA, sampel sperma dicuci untuk membuang sisa plasmid pada media elektroporasi. Adapun untuk larva, tidak perlu dilakukan pencucian terlebih dahulu. Sperma hasil elektroporasi dicuci dengan cara menambahkan larutan fisiologis dan disentrifugasi dengan kecepatan 3000 rpm selama 1 menit. Supernatan yang terbentuk dibuang, pelet sperma diresuspensi dengan menggunakan 20 µl larutan fisiologis. Proses pencucian pelet sperma diulang sebanyak tiga kali.
Sampel sperma atau larva dimasukkan ke dalam tabung mikro, ditambahkan 200 μl cell lysis solution (Puregene, Minneapolis, USA), 2 μl
Proteinase K (20 mg/ml) dan selanjutnya dihomogenasi menggunakan vorteks.
Inkubasi dilakukan pada suhu 55°C selama semalam (overnight). RNase sebanyak 2 μl (4 mg/ml) ditambahkan ke dalam larutan dan diaduk dengan hati-hati dengan cara membolik-balik tabung mikro. Larutan diinkubasi pada suhu 37°C selama 60 menit dan disimpan dalam suhu 4°C selama 5 menit. Sebanyak 200 μl protein
precipitation solution (Puregene, Minneapolis, USA) ditambahkan ke dalam
larutan, diaduk perlahan, dan selanjutnya disentrifugasi pada kecepatan 12000 rpm selama 10 menit. Supernatan dipindahkan ke dalam tabung mikro berisi
isopropanol, lalu tabung mikro dibolak-balik sebanyak 50x dengan hati-hati dan disentrifugasi dengan kecepatan 12.000 rpm selama 10 - 15 menit. Supernatan dibuang dan ditambahkan 300 μl Etanol 70% dingin. Sentrifugasi dengan kecepatan 12.000 rpm selama 10 menit, supernatan dibuang dan pelet DNA dikering-udarakan. Steril destillated water (SDW) sebanyak 50 μl digunakan untuk melarutkan DNA. Larutan DNA dapat disimpan dalam freezer (suhu -20°C) hingga akan digunakan dalam proses selanjutnya.
Polymerase chain reaction. Keberadaan DNA eksogen (EGFP) di dalam sperma dan larva diamati dengan metode PCR. PCR dilakukan dengan menggunakan primer GFPr (5’-ACG AAC TCC AGC AGG ACC AT-3’) dan GFPf (5’-GGT CGA GCT GGA CGG CGA CG-3’). PCR dilakukan dengan program: 94°C selama 3 menit; (94°C selama 30 detik; 62°C selama 30 detik; 72°C selama 1 menit) sebanyak 35 siklus; 72°C selama 3 menit; dan 4°C (tak hingga). Pengecekan hasil amplifikasi PCR dilakukan dengan elektroforesis menggunakan gel agarosa 0,7%. Produk amplifikasi gen EGFP berada pada ukuran sekitar 600 bp.
Ekspresi Gen EGFP pada Embrio dan Larva Ikan Patin Siam
Ekstraksi RNA. RNA total diisolasi dari 50 butir embrio atau larva. Sampel disimpan dalam botol sampel yang telah berisi isogen sebanyak 200 µl. Sampel dihancurkan oleh penggerus yang sebelumnya telah disterilkan dengan DEPC 1%. Ke dalam Eppendorf ditambahkan larutan isogen sampai mencapai volume akhir 800 µl. Chloroform p.a. sebanyak 200 µl ditambahkan ke dalam Eppendorf dan larutan disentrifugasi pada kecepatan 12.000 rpm selama lima menit pada suhu ruang. Supernatan yang terbentuk dipindahkan ke dalam Eppendorf baru yang telah berisi 400 µl isopropanol. Larutan disentrifugasi pada kecepatan 12.000 rpm selama 15 menit pada suhu 4°C. Pada Eppendorf akan terbentuk pelet RNA, dan cairan yang terdapat pada Eppendorf dibuang. Ke dalam Eppendorf ditambahkan 1 ml alkohol 70% (dingin) kemudian sentrifugasi dengan kecepatan 12.000 rpm selama 15 menit. Pelet RNA dikeringkan dengan cara membuang larutan yang terdapat pada Eppendorf. Sampel RNA disimpan dengan cara menambahkan 30 µl DEPC 1%. Konsentrasi RNA total hasil isolasi
diukur menggunakan alat pengukur konsentrasi RNA/DNA (GeneQuant). Absorbansi diukur pada panjang gelombang 260 dan 280 nm.
Sintesis cDNA. Sintesis complementary DNA (cDNA) menggunakan kit
Ready-To-Go You-Prime First Strand Beads (Amersham pharmacia biotech,
USA). Konsentrasi RNA dibuat 3 μg dalam 30 μl DEPC. Larutan RNA diinkubasi pada suhu 65°C selama 10 menit dan kemudian disimpan di atas es. Sampel RNA dipindahkan ke dalam tube FSRMB (First strand reaction mix beads) dan ditambahkan 3 μl primer ’dT3’RACE-VECT” (5’-GTA ATA CGA ATA ACT ATA GGG CAC GCG TGG TCG ACG GCC CGG GCT GGT TTT TTT TTT TTT TTT T-3’) dengan konsentrasi 1 µg/3 µl. Larutan dihomogenkan dan diinkubasi pada suhu 37°C selama 1 jam. cDNA yang terbentuk ditambahkan 30 µl SDW steril dan disimpan dalam refrigerator.
Analisis Ekspresi EGFP. Ekspresi EGFP pada embrio dan larva diamati setiap enam jam dengan metode RT-PCR . PCR dilakukan dengan menggunakan primer GFPr (5’-ACG AAC TCC AGC AGG ACC AT-3’) dan GFPf (5’-GGT CGA GCT GGA CGG CGA CG-3’). PCR dilakukan dengan program: 94°C selama 3 menit; (94°C selama 30 detik; 62°C selama 30 detik; 72°C selama 1 menit) sebanyak 25 siklus; 72°C selama 3 menit; dan 4°C (tak hingga). Pengecekan hasil amplifikasi PCR dilakukan dengan elektroforesis menggunakan gel agarose 0,7%. Produk amplifikasi gen EGFP berada pada ukuran sekitar 600 bp. Sebagai kontrol internal digunakan gen β-aktin. Deteksi gen β-aktin dilakukan dengan menggunakan metode PCR. Primer yang digunakan adalah bact-F (5’-TAT GAA GGT (5’-TAT GCT CTG CCC-3’) dan bact-R (5’- CAT ACC CAG GAA AGA TGG CTG-3’). PCR dilakukan dengan program: 94°C selama 3 menit; (94°C selama 30 detik; 58°C selama 30 detik; 72°C selama 30 detik) sebanyak 30 siklus; 72°C selama 3 menit; dan 4°C (tak hingga). Pengecekan hasil amplifikasi PCR dilakukan dengan elektroforesis menggunakan gel agarose 1%. Gen β-aktin ikan patin siam berada pada ukuran sekitar 300 bp. Pengukuran level ekspresi gen EGFP dilakukan dengan mengukur ketebalan pita DNA hasil elektroforesis menggunakan software UN-SCAN-IT gel 6.1. Hasil pengukuran level ekspresi gen EGFP dibandingkan dengan gen β-aktin yang berfungsi sebagai kontrol
HASIL DAN PEMBAHASAN
Motilitas dan Kelangsungan Hidup Spermatozoa Setelah Elektroporasi
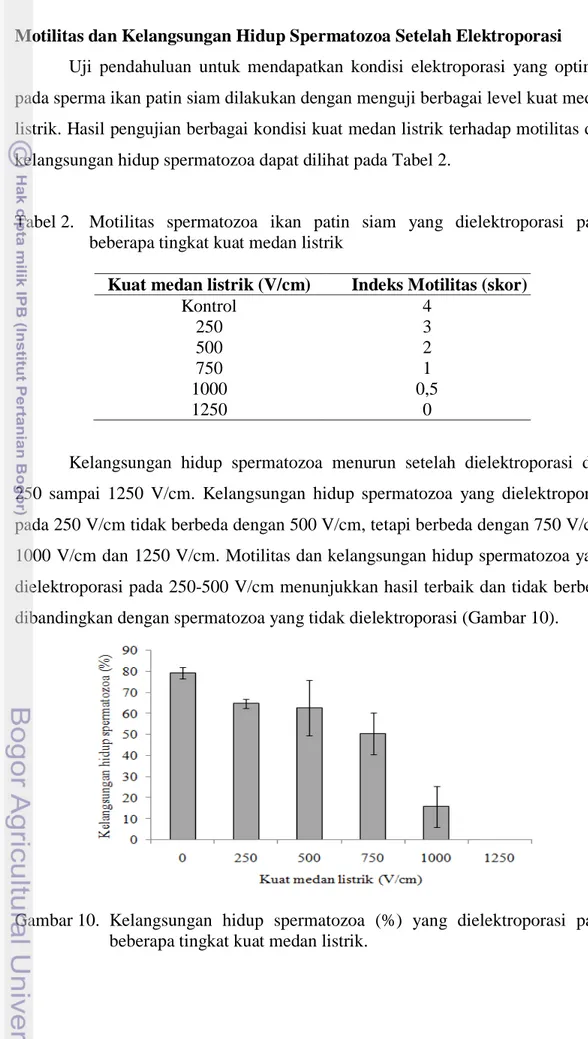
Uji pendahuluan untuk mendapatkan kondisi elektroporasi yang optimal pada sperma ikan patin siam dilakukan dengan menguji berbagai level kuat medan listrik. Hasil pengujian berbagai kondisi kuat medan listrik terhadap motilitas dan kelangsungan hidup spermatozoa dapat dilihat pada Tabel 2.
Tabel 2. Motilitas spermatozoa ikan patin siam yang dielektroporasi pada beberapa tingkat kuat medan listrik
Kuat medan listrik (V/cm) Indeks Motilitas (skor)
Kontrol 4 250 3 500 2 750 1 1000 0,5 1250 0
Kelangsungan hidup spermatozoa menurun setelah dielektroporasi dari 250 sampai 1250 V/cm. Kelangsungan hidup spermatozoa yang dielektroporasi pada 250 V/cm tidak berbeda dengan 500 V/cm, tetapi berbeda dengan 750 V/cm, 1000 V/cm dan 1250 V/cm. Motilitas dan kelangsungan hidup spermatozoa yang dielektroporasi pada 250-500 V/cm menunjukkan hasil terbaik dan tidak berbeda dibandingkan dengan spermatozoa yang tidak dielektroporasi (Gambar 10).
Gambar 10. Kelangsungan hidup spermatozoa (%) yang dielektroporasi pada beberapa tingkat kuat medan listrik.
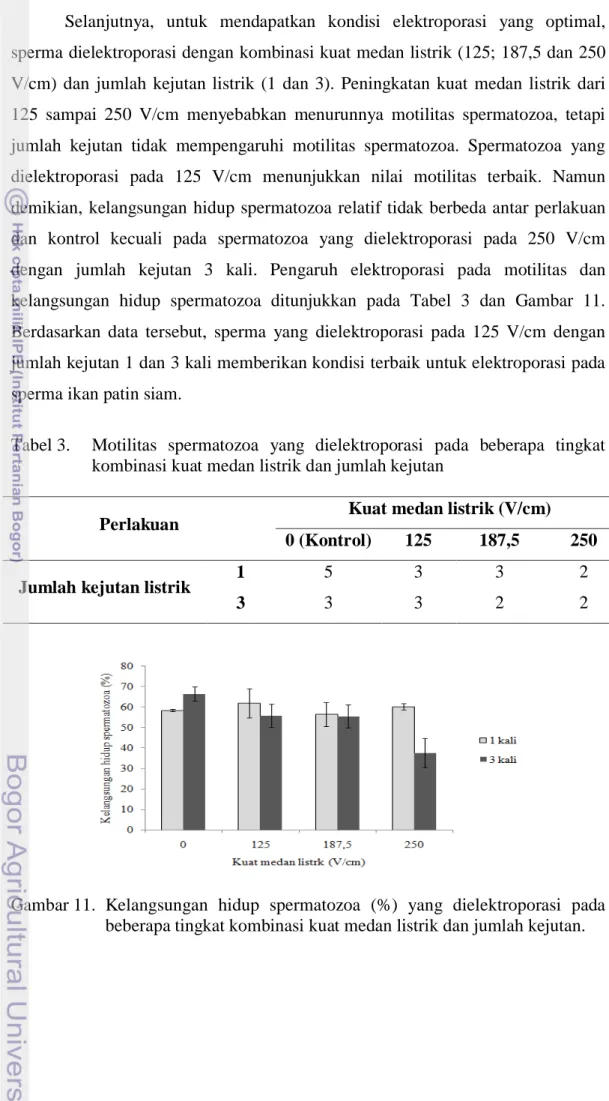
Selanjutnya, untuk mendapatkan kondisi elektroporasi yang optimal, sperma dielektroporasi dengan kombinasi kuat medan listrik (125; 187,5 dan 250 V/cm) dan jumlah kejutan listrik (1 dan 3). Peningkatan kuat medan listrik dari 125 sampai 250 V/cm menyebabkan menurunnya motilitas spermatozoa, tetapi jumlah kejutan tidak mempengaruhi motilitas spermatozoa. Spermatozoa yang dielektroporasi pada 125 V/cm menunjukkan nilai motilitas terbaik. Namun demikian, kelangsungan hidup spermatozoa relatif tidak berbeda antar perlakuan dan kontrol kecuali pada spermatozoa yang dielektroporasi pada 250 V/cm dengan jumlah kejutan 3 kali. Pengaruh elektroporasi pada motilitas dan kelangsungan hidup spermatozoa ditunjukkan pada Tabel 3 dan Gambar 11. Berdasarkan data tersebut, sperma yang dielektroporasi pada 125 V/cm dengan jumlah kejutan 1 dan 3 kali memberikan kondisi terbaik untuk elektroporasi pada sperma ikan patin siam.
Tabel 3. Motilitas spermatozoa yang dielektroporasi pada beberapa tingkat kombinasi kuat medan listrik dan jumlah kejutan
Perlakuan Kuat medan listrik (V/cm)
0 (Kontrol) 125 187,5 250
Jumlah kejutan listrik 1 5 3 3 2
3 3 3 2 2
Gambar 11. Kelangsungan hidup spermatozoa (%) yang dielektroporasi pada beberapa tingkat kombinasi kuat medan listrik dan jumlah kejutan.
Aplikasi kejutan listrik pada suspensi sel menginduksi polarisasi komponen membran sel dan mengembangkan potensi tegangan di seluruh membran. Pada saat perbedaan potensial antara bagian dalam dan luar membran sel melewati titik kritis, komponen membran di-reorganisasi ke dalam pori dalam area terlokalisasi, dan kemudian sel menjadi permeabel terhadap masuknya makromolekul (Knight, 1981; Knight & Scrutton, 1986). Proses modifikasi permeabilitas membran sel melalui kuat medan listrik disebut elektroporasi. Perubahan permeabilitas bersifat sementara, dengan syarat kejutan listrik tidak melebihi batas kritis bagi sel (Tsong 1983). Ukuran pori dapat diubah melalui berbagai panjang kejutan (dalam milidetik), kuat medan listrik (dalam Volt/sentimeter), dan kekuatan ionik media (Tsong 1983). Pada ikan patin siam, kelangsungan hidup spermatozoa yang dielektroporasi pada 125 V/cm adalah 58,4-66,5%, tetapi ketika sperma dielektroporasi pada 1250 V/cm menyebabkan kematian pada spermatozoa. Berdasarkan penelitian Cheng et al. (2002), motilitas sperma ikan ayu menurun sampai 50% setelah 120 detik ketika dikejut dengan voltase 9 kV. Symonds et al. (1994) juga mendemonstrasikan bahwa aktivitas sperma chinook salmon menurun dari 82% menjadi 2% pada saat sperma dielektroporasi dengan kuat medan listrik yang meningkat dari 625 V/cm menjadi 1000 V/cm. Penelitian Sin et al. (2000) pada sperma salmon menunjukkan bahwa kondisi elektroporasi optimal pada sperma salmon adalah pada kuat medan listrik 800 sampai 1000 V/cm, panjang kejutan 27,4 milidetik, dan 2 kejutan. Motilitas sperma pasca elektroporasi bergantung pada voltase, panjang kejutan, jumlah kejutan dan kekuatan ionik buffer (Symonds et al. 1994). Ukuran pori dapat diubah melalui variasi panjang kejutan (milidetik), kuat medan listrik (Volt/cm), dan kekuatan ionik dari media (Tsong 1983).
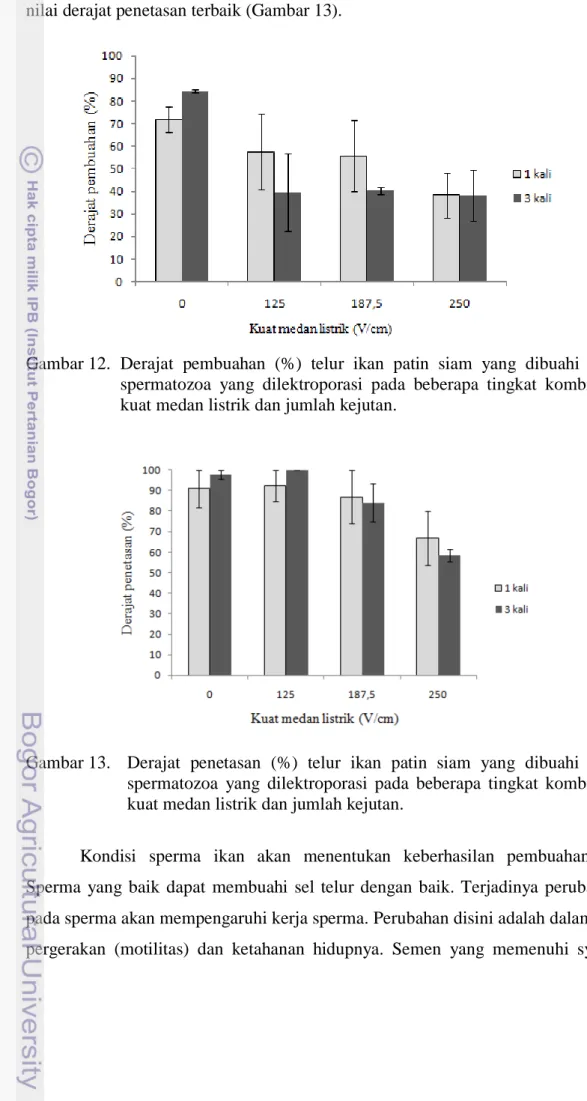
Sperma yang dielektroporasi pada 125; 187,5 dan 250 V/cm tetap memiliki kemampuan untuk membuahi telur. Berdasarkan data pada Gambar 12, telur yang dibuahi oleh sperma yang dielektroporasi pada 125 V/cm dan 187,5 V/cm dengan jumlah kejutan satu kali, menunjukkan derajat pembuahan yang lebih tinggi dibandingkan telur yang dibuahi oleh sperma yang dielektroporasi pada 250 V/cm. Namun demikian, derajat penetasan telur sangat dipengaruhi oleh motilitas dan kelangsungan hidup sperma. Telur yang dibuahi oleh sperma yang
dielektroporasi pada 125 V/cm dengan jumlah kejutan 1 dan 3 kali menunjukkan nilai derajat penetasan terbaik (Gambar 13).
Gambar 12. Derajat pembuahan (%) telur ikan patin siam yang dibuahi oleh spermatozoa yang dilektroporasi pada beberapa tingkat kombinasi kuat medan listrik dan jumlah kejutan.
Gambar 13. Derajat penetasan (%) telur ikan patin siam yang dibuahi oleh spermatozoa yang dilektroporasi pada beberapa tingkat kombinasi kuat medan listrik dan jumlah kejutan.
Kondisi sperma ikan akan menentukan keberhasilan pembuahannya. Sperma yang baik dapat membuahi sel telur dengan baik. Terjadinya perubahan pada sperma akan mempengaruhi kerja sperma. Perubahan disini adalah dalam hal pergerakan (motilitas) dan ketahanan hidupnya. Semen yang memenuhi syarat
untuk proses pembuahan mengandung sperma yang hidup dan bergerak aktif ke depan (progresif). Persentase sperma yang motil tidak harus lebih dari 75%. Dalam penggunaan sehari-hari tidak kurang dari 50% meskipun beberapa peneliti menganjurkan 60% atau lebih tinggi (Hafez 1987). Derajat penetasan telur yang dibuahi oleh sperma yang dielektroporasi pada 125 V/cm tidak berbeda dengan kontrol. Derajat penetasan menurun pada telur yang dibuahi oleh sperma yang dielektroporasi dari 125 V/cm sampai 250 V/cm (Gambar 13). Hal ini menunjukkan bahwa sperma yang dielektroporasi pada 125 V/cm dengan jumlah kejutan 1 dan 3 kali memberikan kondisi terbaik untuk memproduksi ikan patin siam transgenik.
Deteksi Gen EGFP pada Spermatozoa dan Larva
Keberadaan gen EGFP pada spermatozoa ikan patin siam yang telah dielektroporasi dapat dilihat pada Gambar 14. Gen EGFP terdeteksi pada semua perlakuan, baik pada sperma yang hanya diinkubasi dalam larutan yang mengandung DNA plasmid (kontrol) tanpa elektroporasi maupun pada sperma yang dielektroporasi. Adapun deteksi gen EGFP pada larva ikan patin siam (Gambar 15) menunjukkan bahwa gen EGFP hanya ditemukan pada larva hasil pembuahan telur oleh sperma yang dielektroporasi. Larva yang berasal dari telur yang difertilisasi oleh sperma yang hanya diinkubasi dalam medium yang mengandung DNA plasmid (K), tidak menunjukkan adanya gen EGFP.
Gambar 14. Keberadaan gen EGFP (tanda kepala panah) pada spermatozoa ikan patin siam setelah dielektroporasi dan pada kontrol (K). M=marker panjang fragmen DNA (2 log-ladder); angka 1 dan 3 menunjukkan jumlah kejutaan listrik; 125, 187,5 dan 250 adalah kuat medan listrik. Angka di sebelah kiri gambar adalah ukuran panjang marka DNA.
Gambar 15. Keberadaan gen EGFP (tanda kepala panah) pada larva ikan patin siam setelah dielektroporasi dan pada kontrol (K). M=marker panjang fragmen DNA (2 log-ladder); angka 1 dan 3 menunjukkan jumlah kejutaan listrik; 125, 187,5 dan 250 adalah kuat medan listrik. Angka di sebelah kiri gambar adalah ukuran panjang marka DNA.
Gen EGFP ditemukan pada sperma yang dielektroporasi maupun pada sperma yang hanya diinkubasi dalam media yang mengandung DNA plasmid. Namun pada larva, gen EGFP hanya ditemukan pada larva yang berasal dari telur yang dibuahi sel spermatozoa yang dielektroporasi. Menurut Lanes et al. (2009), jika semen diinkubasi oleh DNA eksogen tetapi tidak dielektroporasi, efisiensi SMGT untuk produksi ikan transgenik rendah atau bahkan tidak ada. Hasil penelitian Zhong et al. (2002) pada ikan koan menunjukkan bahwa sperma ikan koan yang dicampur dengan plasmid pCAhLFc dan diinkubasi selama 10-30 menit dan dicampurkan ke telur untuk fertilisasi buatan, memiliki efisiensi transfer gen antara 2,2 – 4,3%. Adapun tingkat keberhasilan transfer gen diantara benih yang diperoleh dari telur yang difertilisasi oleh sperma yang dielektroporasi yaitu antara 19,6 – 46,8%. Patil & Khoo (1996) melaporkan bahwa pada sel sperma ikan zebra (Danio rerio) yang diinkubasi dengan DNA asing memiliki kapasitas untuk mengambil DNA asing. Pengambilan/pemasukan DNA asing dapat ditingkatkan melalui elektroporasi. Pengikatan DNA asing oleh spermatozoa ikan zebra meningkat 1-2 kali lipat setelah dielektroporasi dengan kuat medan listrik 500, 1000, dan 1500 V/cm. Peningkatan kuat medan listrik menyebabkan penurunan motilitas sperma, bahkan pada kuat medan listrik yang tinggi menyebabkan sperma menggumpal.
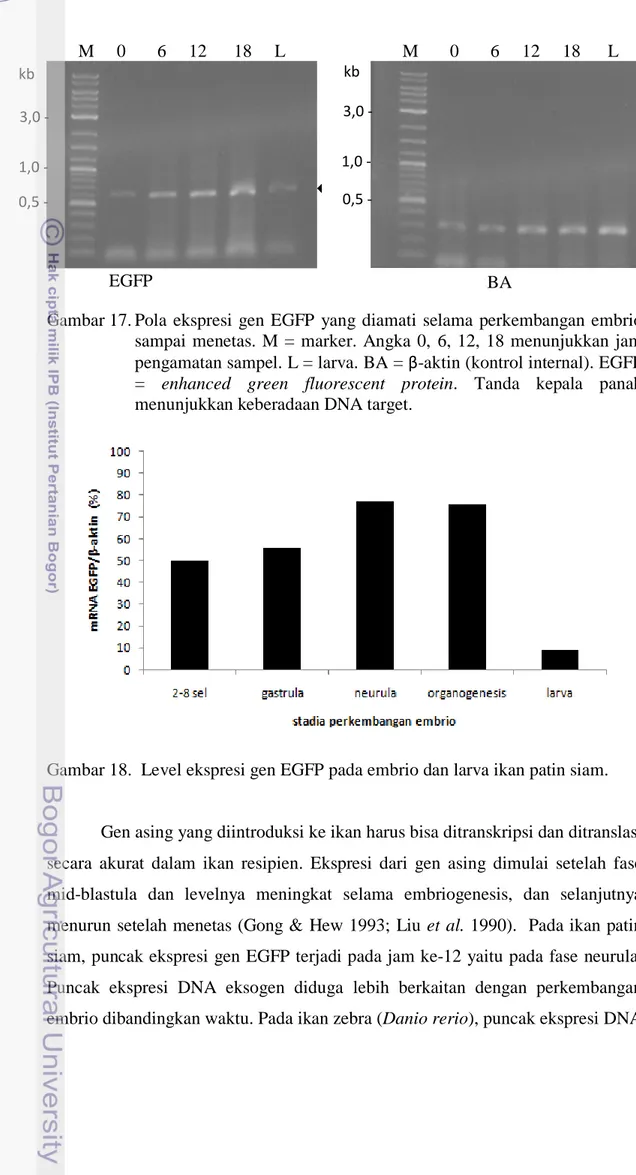
Pola Ekspresi Gen EGFP pada Embrio dan Larva Ikan Patin Siam
Pengamatan pola ekspresi gen EGFP dilakukan setiap enam jam sampai embrio menetas menjadi larva. Tahapan perkembangan embrio setiap enam jam dapat dilihat pada Gambar 16. Pada penelitian ini, gen EGFP yang ditransfer pada sperma ikan patin siam melalui metode elektroporasi terbukti mampu terinsersi pada embrio dan larva ikan patin siam. Selain mampu terinsersi, Gen EGFP juga diekspresikan baik pada fase embrio sampai menjadi larva (Gambar 17). Gen EGFP mulai terekspresi pada jam ke-0 (fase 2-8 sel) dan mencapai puncaknya pada jam ke-12 yaitu pada fase neurula. Ekspresi gen EGFP menurun pada jam ke-30 yaitu pada fase larva (Gambar 18).
Jam ke-0 (fase 2-8 sel) Jam ke-6 (fase gastrula) Jam ke-12 (fase neurula) Jam ke-18 (fase organogenesis) Jam ke-30 (fase larva)
Gambar 16. Fase perkembangan embrio ikan patin siam yang diamati setiap enam jam sekali.
M 0 6 12 18 L M 0 6 12 18 L
Gambar 17. Pola ekspresi gen EGFP yang diamati selama perkembangan embrio sampai menetas. M = marker. Angka 0, 6, 12, 18 menunjukkan jam pengamatan sampel. L = larva. BA = β-aktin (kontrol internal). EGFP = enhanced green fluorescent protein. Tanda kepala panah menunjukkan keberadaan DNA target.
Gambar 18. Level ekspresi gen EGFP pada embrio dan larva ikan patin siam.
Gen asing yang diintroduksi ke ikan harus bisa ditranskripsi dan ditranslasi secara akurat dalam ikan resipien. Ekspresi dari gen asing dimulai setelah fase mid-blastula dan levelnya meningkat selama embriogenesis, dan selanjutnya menurun setelah menetas (Gong & Hew 1993; Liu et al. 1990). Pada ikan patin siam, puncak ekspresi gen EGFP terjadi pada jam ke-12 yaitu pada fase neurula. Puncak ekspresi DNA eksogen diduga lebih berkaitan dengan perkembangan embrio dibandingkan waktu. Pada ikan zebra (Danio rerio), puncak ekspresi DNA 0,5 - 1,0 - 3,0 - kb 0,5 - 1,0 - 3,0 - kb EGFP BA
eksogen terjadi pada awal gastrula (Stuart et al. 1988). Pada ikan medaka terjadi pada stadia gastrula/neurula (Chong & Vielkiend 1989). Pada loach (Misgurnus sp.) terjadi pada stadia akhir gastrula (Maclean et al. 1987), dan pada lele Afrika (Clarias gariepinus) terjadi pada awal gastrula (awal epiboli; Volckaert et al. 1994). Puncak replikasi DNA ini terjadi pada Xenopus pada akhir proses pembelahan yang cepat (midblastula terdiri dari 4000 sel, 7 jam setelah fertilisasi). Pada ikan medaka, awal transkripsi gen endogen terjadi pada stadia midblastula (Winkler et al. 1992). Ekspresi dari gen asing dimulai setelah fase mid-blastula dan levelnya meningkat selama embriogenesis, dan selanjutnya menurun setelah menetas (Gong & Hew 1993; Liu et al. 1990). Kejadian ini disebut sebagai ekspresi sementara (transient expression), yang mungkin disebabkan oleh replikasi ekstrakromosomal DNA asing. Level ekspresi selanjutnya akan menurun yang diikuti dengan degradasi dari ekstrakromosomal DNA. Akibatnya, level ekspresi gen yang terintegrasi ke kromosom resipien tidak setinggi dengan ekspresi sementara.
Integrasi DNA asing pada ikan transgenik relatif rendah dan bervariasi, dan sebagian besar transgenik founder (F0) bersifat mosaic baik pada sel somatik maupun germ cell, yang menyebabkan frekuensi transmisi yang lebih rendah dibandingkan dengan yang diharapkan apabila mengikuti hukum segregasi Mendel (Iyengar et al. 1996). Walaupun banyak eksprerimen melaporkan keberhasilan ekspresi gen yang diintroduksikan pada ikan transgenik, ekspresi bersifat sementara (transient) pada sebagian besar eksperimen, dan hanya beberapa eksperimen yang menunjukkan adanya ekspresi yang ditransmisikan dari gen reporter yang terintegrasi (Lin et al. 1994, Kinoshita et al. 1996).
Transfer gen EGFP melalui metode elektroporasi pada sperma ikan patin siam menunjukkan bahwa gen EGFP mampu terinsersi dan terekspresi pada larva ikan patin siam. Keberhasilan ini membuka kesempatan untuk memproduksi ikan patin siam transgenik dengan karakteristik yang diinginkan. Peningkatan produksi ikan patin siam dibutuhkan seiring dengan adanya isu meningkatnya populasi manusia, menurunnya kualitas lingkungan perairan, dan meningkatnya kepedulian masyarakat akan pentingnya makanan yang bernutrisi tinggi. Transfer berbagai jenis gen terbukti mampu meningkatkan karakteristik tertentu pada ikan seperti
transfer gen GH mampu meningkatkan pertumbuhan ikan mud loach (Nam et al. 2001), transfer gen cecropin mampu meningkatkan resistensi ikan medaka terhadap Pseudomonan fluorescents dan Vibrio anguillarum (Sarmasik et al. 2002), dan transfer gen AFP mampu meningkatkan toleransi ikan salmon terhadap temperatur dingin (Hew et al. 1992).
KESIMPULAN
Metode elektroporasi melalui sperma dapat digunakan untuk transfer gen pada ikan patin siam. Tingkat kuat medan listrik yang sesuai untuk elektroporasi sperma ikan patin siam adalah 125 V/cm. Promoter β-aktin ikan mas dapat digunakan untuk membuat ikan patin siam transgenik.