ELEKTROPORASI SPERMA UNTUK MEMBUAT
IKAN PATIN SIAM TRANSGENIK CEPAT TUMBUH
RADEN RORO SRI PUDJI SINARNI DEWI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi Studi Over-Ekspresi Gen
Penyandi Hormon Pertumbuhan Melalui Elektroporasi Sperma untuk Membuat Ikan Patin Siam Transgenik Cepat Tumbuh adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun
kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip
dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah
disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di disertasi ini.
Bogor, Juli 2010
Encoding Growth Hormone by Sperm Electroporation to Produce Transgenic Fast-Growing Stripped Catfish. Under direction of KOMAR SUMANTADINATA, AGUS OMAN SUDRAJAT, and ALIMUDDIN.
Stripped catfish (Pangasionodon hypophthalmus) is one of freshwater fish species that has high economic value in Indonesia. Limited attention has been paid to increase the growth of stripped catfish towards enhancement of its aquaculture productivity. In this research, we developed transgenesis technology to produce stripped catfish transgenic F0 as a material to obtain stable line transgenic fish with an improved growth rate character. Research was conducted in some steps: cloning and characterization of gene encoding stripped catfish growth hormone
(PhGH), making of all–fish gene construction which consist of PhGH cDNA
(complementary DNA) directed by carp -actin promoter (pCcBA), developing
electroporation technique using sperm mediated gene transfer (SMGT) and
screening stripped catfish juvenile which carrying PhGH exogenous gene by PCR
and RT-PCR methods. Complementary DNA encoding PhGH was isolated from
pituitary by RT-PCR method. The size of PhGH cDNA was 1148 bp which
consisted of 603 bp of ORF (open reading frame) and encoded 200 amino acid
residues. PhGH gene has common characteristic like others teleost GH gene. To
make all-fish gene construction of pCcBA-PhGH, PhGH cDNA was ligated with
carp -actin promoter (pCcBA). The size of pCcBA-PhGH construction was 6.6
kb. Increasing in electric field strength on sperm electroporation caused a decrease in sperm motility and embryos hatchling. Higher sperm motility and embryos hatchling were obtained at the electric field strength of 125 V/cm. Increasing concentrations of plasmid DNA caused an increase in the number of individuals
carrying the exogenous PhGH gene. Electroporation using plasmid DNA
concentration of 90 μg/ml effectively produced transgenic F0. Further, ectopic expression of exogenous PhGH in transgenic fish F0 at 2 months old increased 19-22.6% of their body weight compared to non-transgenic. Average body weight
of 4 months juvenile treated with 90 μg/ml of DNA plasmid was 53.38% heavier
than control. Therefore, stripped catfish growth rate could be increased by over expression of gene encoding growth hormone. Then, followed by stable transgenic stripped catfish generation, their culture production suggested to be increased significantly.
Keywords: Pangasionodon hypophthalmus, transgenesis, PhGH gene,
Hormon Pertumbuhan Melalui elektroporasi Sperma untuk Membuat Ikan Patin Siam Transgenik Cepat Tumbuh. Dibimbing oleh KOMAR SUMANTADINATA, AGUS OMAN SUDRAJAT DAN ALIMUDDIN.
Ikan patin siam (Pangasionodon hypophthalmus) merupakan salah satu
spesies ikan air tawar yang memiliki nilai ekonomis tinggi di Indonesia. Dalam program peningkatan produksi perikanan budidaya tahun 2014, ikan patin menempati urutan ke-3 dengan target peningkatan produksi sebesar 70%/tahun. Berbagai penelitian yang bisa mendukung program Kementerian Kelautan dan Perikanan tersebut telah dilakukan pada bidang nutrisi, reproduksi dan lingkungan. Sementara itu, penelitian di bidang genetika dalam rangka memperoleh benih unggul masih dalam tahap permulaan.
Penggunaan teknologi transgenesis terbukti mampu meningkatkan pertumbuhan spesies ikan budidaya sampai beberapa kali lipat. Pada penelitian ini, transgenesis digunakan untuk meningkatkan pertumbuhan ikan patin siam. Penelitian dilakukan melalui beberapa tahapan yaitu: kloning gen penyandi
hormon pertumbuhan ikan patin siam (PhGH), optimalisasi kondisi elektroporasi
dengan menggunakan sperma sebagai perantara transfer gen, pembuatan
konstruksi gen dan transfer gen pCcBA-PhGH dengan menggunakan metode
elektroporasi melalui sperma, serta analisis ekspresi gen PhGH secara genotipe dan fenotipe.
Gen PhGH diisolasi dari kelenjar pituitari menggunakan metode RT-PCR.
Pembacaan sekuens nukleotida gen PhGH dilakukan dengan menggunakan mesin
ABIPRISM 3100. Analisa homologi sekuens nukleotida dan deduksi asam amino ikan patin siam dengan ikan lainnya dilakukan dengan menggunakan program
BLAST N/P dan Genetyx versi 7. Sekuens gen PhGH selanjutnya disambungkan
dengan promoter -aktin ikan mas (pCcBA). Konstruksi gen pCcBA-PhGH
dikembangkan dari konstruksi gen pCcBA-OgGH.
Hasil penelitian menunjukkan sekuens nukleotida gen PhGH ikan patin
siam tersusun atas 1148 bp yang terdiri dari 603 bp daerah pengkodean (ORF,
open reading frame), 18 bp daerah yang tidak dikodekan pada bagian ujung 5’,
dan 527 bp pada ujung 3’. Gen PhGH memiliki beberapa ciri seperti halnya gen
GH ikan umumnya yaitu: residu tryptophan (W) tunggal pada asam amino ke-104, 5 residu sistein (C) pada asam amino ke-71, 135, 173,190, dan 198, serta motif
Asn-Xaa-Thr pada terminal C yang berpotensi sebagai lokasi N-linked
glycosilation.
Transfer gen dilakukan menggunakan teknik elektroporasi dengan menggunakan sperma yang berperan sebagai perantara. Pengujian berbagai
kondisi elektroporasi dilakukan dengan menggunakan gen EGFP (enhancedgreen
fluorescent protein), yang berperan sebagai reporter gene, yang dikendalikan oleh
promoter -aktin ikan mas. Elektroporasi dilakukan dengan menguji kombinasi berbagai tingkat kuat medan listrik (125; 187,5 dan 250 V/cm) dan jumlah kejutan (1 dan 3). Beberapa parameter yang diukur untuk menentukan keberhasilan elektroporasi adalah motilitas spermatozoa, kelangsungan hidup spermatozoa dan
-listrik dengan menggunakan gen EGFP menunjukkan sperma yang dielektroporasi dengan kuat medan listrik 125 V/cm memiliki nilai motilitas dan derajat penetasan telur yang tidak berbeda dengan sperma yang tidak dielektroporasi. Deteksi keberadaan gen EGFP pada larva yang berasal dari telur yang dibuahi sperma yang dielektroporasi menunjukkan bahwa transgen berhasil ditransfer ke dalam ikan resipien.
Aktivitas promoter -aktin ikan mas diukur berdasarkan ekspresi
sementara (transient expression) gen EGFP pada embrio dan larva ikan patin
siam. Promoter -aktin ikan mas mampu mengaktifkan transkripsi gen EGFP.
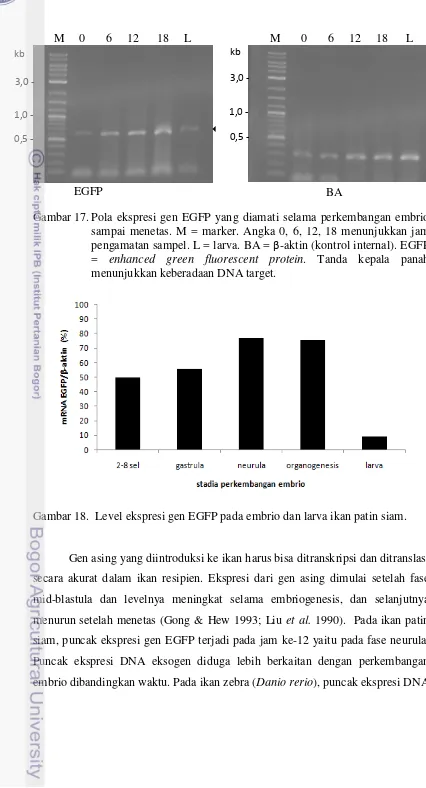
Percobaan uji aktivitas promoter -aktin ikan mas pada embrio dan larva ikan patin siam menunjukkan bahwa ekspresi gen EGFP mencapai puncaknya pada fase neurula dan menurun pada fase larva.
Kondisi elektroporasi yang optimal digunakan untuk mentransfer gen
PhGH yang ada dalam konstruksi pCcBA-PhGH ke dalam sperma ikan patin
siam. Pengujian berbagai konsentrasi DNA plasmid (10, 50 dan 90 µg/ml) dilakukan untuk mendapatkan konsentrasi DNA optimal dengan tingkat
keberhasilan transfer gen terbaik. Ekspresi gen PhGH eksogen diukur secara
genotipe yaitu melalui ekspresi mRNA PhGH dan secara fenotipe yaitu melalui
pengukuran bobot tubuh ikan transgenik dan non-transgenik.
Pengujian berbagai tingkat konsentrasi DNA plasmid menunjukkan bahwa konsentrasi DNA plasmid dalam larutan mempengaruhi keberhasilan transfer gen
PhGH dan ekspresi gen PhGH eksogen secara fenotipe. Pada konsentrasi DNA
plasmid 90 µg/ml, keberhasilan transfer gen PhGH eksogen 85,71% dengan bobot
© Hak Cipta milik IPB, tahun 2010
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan
atau menyebutkan sumbernya.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan
karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu
masalah.
b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis
dalam bentuk apapun tanpa izin IPB.
ELEKTROPORASI SPERMA UNTUK MEMBUAT
IKAN PATIN SIAM TRANSGENIK CEPAT TUMBUH
RADEN RORO SRI PUDJI SINARNI DEWI
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji pada Ujian Tertutup: Prof.Dr.Ir. Ronny Rachman Noor, M.Rur.Sc.
Dr.Ir. Odang Carman, M.Sc.
Penguji pada Ujian Terbuka: Dr.Ir. Endhay Kusnendar, M.S.
Nama : Raden Roro Sri Pudji Sinarni Dewi
NIM : C161070071
Disetujui
Komisi Pembimbing
Ketua
Prof.Dr.Ir. Komar Sumantadinata, M.Sc.
Dr.Ir. Agus Oman Sudrajat, M.Sc.
Anggota Anggota
Dr.Alimuddin, S.Pi., M.Sc.
Mengetahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Ilmu Akuakultur
Prof.Dr.Ir. Enang Harris, M.S. Prof.Dr.Ir. Khairil A. Notodiputro,M.S.
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian ini ialah produksi ikan patin siam transgenik, dengan judul Studi Over-Ekspresi Gen Penyandi Hormon Pertumbuhan melalui Elektroporasi Sperma untuk Membuat Ikan Patin Siam Cepat Tumbuh. Penelitian dilaksanakan mulai Bulan Juni 2008 sampai dengan Februari 2010 di Laboratorium Reproduksi dan Genetika Organisme Akuatik, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor (IPB) di Bogor dan Loka Riset Pemuliaan dan Teknologi Budidaya Perikanan Air Tawar di Sukamandi.
Bab II dari disertasi ini telah dipublikasikan dalam Indonesian Aquaculture
Journal 4(1): 9-17, tahun 2009 dengan judul Identification of Growth Hormone
Gene of Pangasionodon hypophthalmus, dan dipresentasikan pada Forum Inovasi Akuakultur Indonesia (FITA) I pada tahun 2009 di Surabaya.
Terima kasih penulis ucapkan kepada komisi pembimbing: Prof Dr Ir. Komar Sumantadinata, M.Sc., Dr.Ir. Agus Oman Sudrajat, M.Sc. dan Dr. Alimuddin, S.Pi., M.Sc., atas segala bimbingan dalam penyusunan proposal, pelaksanaan penelitian, dan penulisan disertasi. Penulis mengucapkan terima kasih kepada Prof.Dr.Ir. Enang Harris, M.Sc. dan Dr.Ir. Dinar Setyowati, M.Sc., selaku penguji luar komisi pada ujian prakualifikasi program Doktor. Ucapan terima kasih juga disampaikan kepada Prof.Dr.Ir. Ronny Rachman Noor, M.Rur.Sc., Dr.Ir. Odang Carman, M.Sc., Dr.Ir. Endhay Kusnendar, M.S. dan Dr.Ir. Utut Widyastuti, M.Si. sebagai penguji luar komisi pada ujian tertutup dan ujian terbuka.
Ucapan terima kasih penulis sampaikan pula pada Ir. Retna Utami, M.Sc. selaku Kepala Bidang Monitoring dan Evaluasi PRPB dan Ir. Wayan Subamia, M.Si. selaku Kepala LRPTBPAT Sukamandi beserta seluruh rekan-rekan peneliti khususnya Drs. Sularto, M.Si. dan Ir. Evi Tahapari yang telah memberikan banyak dukungan selama penulis menjalankan studi, juga rekan-rekan akuakultur program Doktor angkatan 2007, serta rekan-rekan di Laboratorium Reproduksi dan Genetika Organisme Akuatik.
Ungkapan terima kasih penulis sampaikan kepada ayahanda Raden Sulyadi (alm), Ibunda Suratmi, suami M. Ali Nurdin, S.Pi, kedua anak tercinta Adinda Nurazizah dan Sarah Alya Dewi serta seluruh keluarga atas segala doa dan dorongan semangatnya.
Semoga disertasi ini dapat memberikan manfaat bagi perkembangan penelitian dan ilmu pengetahuan juga dapat dijadikan awal untuk meningkatkan produksi ikan budidaya di Indonesia.
Bogor, Juli 2010
Halaman DAFTAR TABEL……….
DAFTAR GAMBAR………
1 PENDAHULUAN………..…… 1
Latar Belakang………. 1
Tujuan dan Manfaat………. 7
Kebaharuan Penelitian………. 7
Ruang Lingkup Penelitian………... 7
2 KARAKTERISASI GEN PENYANDI HORMON PERTUMBUHAN IKAN PATIN SIAM (Pangasionodon hypophthalmus)………... 9
Abstrak………..….. 9
Abstract……… 10
Pendahuluan……… 10
Bahan dan Metode……….. 12
Hasil dan Pembahasan………. 17
Kesimpulan……….. 24
3 PENGEMBANGAN METODE ELEKTROPORASI PADA SPERMA SEBAGAI PERANTARA TRANSFER GEN PADA IKAN PATIN SIAM (Pangasionodon hypophthalmus)………... 25
Abstrak……… 25
Abstract……… 26
Pendahuluan……… 26
Bahan dan Metode……….. 29
Hasil dan Pembahasan………. 35
Kesimpulan……….. 44
4 EFEKTIVITAS TRANSFER DAN EKSPRESI GEN PhGH PADA IKAN PATIN SIAM (Pangasionodon hypophthalmus)………... 45
Abstrak……… 45
Abstract……… 46
Pendahuluan……… 46
Bahan dan Metode……….. 48
Hasil dan Pambahasan………. 51
Kesimpulan……….. 57
5 PEMBAHASAN UMUM………. 58
6 KESIMPULAN UMUM……… 65
Halaman 1 Kriteria penilaian motilitas spermatozoa……….. 31
2 Motilitas spermatozoa ikan patin siam yang dielektroporasi pada
beberapa tingkat kuat medan listrik…..……… 35
3 Motilitas spermatozoa yang dielektroporasi pada beberapa tingkat
kombinasi kuat medan listrik dan jumlah kejutan……… 36
4 Keberhasilan transfer gen PhGH eksogen pada juvenil ikan patin siam
pada beberapa tingkat konsentrasi DNA plasmid………. 52
5 Beberapa konstruksi gen all fish dalam pembuatan ikan transgenik GH…. 58
1 Peta konstruksi gen dalam bentuk plasmid………..…………... 4
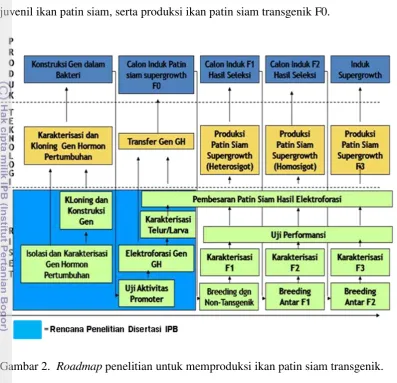
2 Roadmap penelitian untuk produksi ikan patin siam transgenik....…... 8
3 Deteksi gen penyandi hormon pertumbuhan pada beberapa jaringan
tubuh ikan patin siam………..……... 18
4 Cracking hasil transformasi pada plasmid pGEM-T Easy yang
diligasi gen PhGH ……….……… 19
5 Sekuens nukleotida dan deduksi asam amino penyusun gen PhGH …. 20
6 Perbandingan sekuens asam amino gen PhGH dengan spesies-spesies
ikan dari lima ordo yang berbeda……….………. 21
7 Pohon filogenetik yang didasarkan pada sekuens asam amino gen
PhGH dengan beberapa spesies ikan dari lima ordo yang berbeda…... 23
8 Peta konstruksi gen pCcBA-EGFP (6,0 kb)………...………... 30
9 Spermatozoa ikan patin siam………. 32
10 Kelangsungan hidup spermatozoa (%) yang dielektroporasi pada
beberapa tingkat kuat medan listrik……….. 35
11 Kelangsungan hidup spermatozoa (%) yang dielektroporasi pada
beberapa tingkat kombinasi kuat medan listrik dan jumlah kejutan….. 36
12 Derajat pembuahan (%) telur ikan patin siam yang dibuahi oleh
spermatozoa yang dielektroporasi pada beberapa tingkat kombinasi
kuat medan listrik dan jumlah kejutan………...……… 38
13 Derajat penetasan (%) telur ikan patin siam yang dibuahi oleh
spermatozoa yang dielektroporasi pada beberapa tingkat kombinasi
kuat medan listrik dan jumlah kejutan………... 38
14 Keberadaan gen EGFP (tanda kepala panah) pada spermatozoa ikan
patin siam setelah dielektroporasi dan pada kontrol (K)……… 39
15
16
Keberadaan gen EGFP (tanda kepala panah) pada larva ikan patin siam setelah dielektroporasi dan pada kontrol (K)………
Fase perkembangan embrio ikan patin siam yang diamati setiap enam jam sekali………..……….
40
18 Level ekspresi gen EGFP pada embrio dan larva ikan patin siam…… 42
19 Peta konstrusi gen pCcBA-PhGH (6,6 kb)……… 49
20 Deteksi gen PhGH eksogen pada ikan patin siam ..……….. 52
21 Ekspresi mRNA PhGH eksogen pada sirip individu ikan patin siam
transgenik………...… 54
22 Distribusi bobot individu juvenil ikan patin siam hasil introduksi gen
1. PENDAHULUAN
LATAR BELAKANG
Ikan patin siam (Pangasionodon hypophthalmus) merupakan salah satu spesies ikan air tawar yang memiliki nilai ekonomis tinggi di Indonesia. Dalam program peningkatan produksi perikanan budidaya tahun 2014, ikan patin menempati urutan ke-3 dengan target peningkatan produksi sebesar 70%/tahun (Kementerian Kelautan dan Perikanan 2010). Berbagai penelitian yang bisa mendukung program Kementerian Kelautan dan Perikanan tersebut telah dilakukan pada bidang nutrisi (Ahmadi 2001; Mokoginta et al. 2000, Suwarsito 2007, Tahapari et al. 2008), reproduksi (Indriastuti 2000) dan lingkungan (Taufik
et al. 2005; Taufik et al. 2007). Sementara itu, penelitian di bidang genetika dalam rangka memperoleh benih unggul masih dalam tahap permulaan. Program seleksi untuk mendapatkan induk unggul dengan karakter pertumbuhan yang cepat saat ini sedang dilakukan oleh Balai Budidaya Air Tawar Jambi, di bawah Kementerian Kelautan dan Perikanan.
Program seleksi merupakan metode yang efektif untuk meningkatkan produktivitas dan meningkatkan karakter lainnya seperti meningkatkan resistensi penyakit (Gjedrem 1997). Program seleksi secara umum mampu meningkatkan pertumbuhan 6-7% per generasi pada sebagian besar ikan budidaya. Adapun pada beberapa spesies seperti salmon Atlantik, Salmo salar, salmon Coho, channel catfish, Labeo rohita dan nila, program seleksi dengan menggunakan seleksi massal maupun famili mampu meningkatkan pertumbuhan 11-14% per generasi (Dunham et al. 2001). Namun demikian metode seleksi memiliki beberapa kelemahan antara lain membutuhkan waktu yang relatif lama dan membutuhkan banyak generasi keturunan. Selain itu seleksi tidak dapat digunakan untuk meningkatkan karakteristik lain yang diinginkan seperti meningkatkan resistensi ikan terhadap suhu dingin (Fletcher et al. 2004).
memungkinkan kombinasi ulang (rekombinasi) atau penggabungan ulang gen dari sumber yang berbeda secara in vitro yang kemudian diintroduksikan pada suatu individu. Gen yang telah mengalami rekombinasi ini disebut dengan gen rekombinan atau gen asing. Gen yang diintroduksi atau biasa disebut dengan transgen merupakan pengkode protein tertentu yang mengontrol karakter yang diinginkan dan berguna bagi akuakultur.
Keunggulan teknologi transgenesis dibandingkan teknologi lainnya antara lain yaitu karakter yang diinginkan dapat ditransfer dalam satu generasi dan keunggulan yang didapatkan diturunkan pada generasi selanjutnya (Yaskowiak et al. 2006). Pelopor transgenesis pada hewan dilakukan pada tikus (dikenal dengan ”super mice”) oleh Palmiter et al. (1982). Penelitian awal pada transgenesis ikan pada saat ini berkembang pada banyak jenis ikan. Pada dua dekade terakhir, paling sedikit 35 jenis ikan diteliti untuk menjadi subjek transgenik terutama melalui perbaikan pertumbuhan melalui transgenesis gen penyandi hormon pertumbuhan (GH, growth hormone).
Devlin et al. (1994) melaporkan bahwa pertumbuhan dapat dipercepat dengan mengintroduksi gen yang mengkodekan GH yang mensintesa peptida GH dalam jumlah yang besar (Over-ekspresi). Transfer gen GH telah diaplikasikan pada beberapa spesies ikan budidaya dan terbukti mampu meningkatkan pertumbuhannya. Over-ekspresi gen GH pada ikan mud loach mampu meningkatkan pertumbuhan lebih dari 32 kali (Nam et al. 2001), pada ikan nila 2-7 kali (Kobayashi et al. 2007), salmon Coho 10 kali (Devlin et al. 1995), ikan mas 3 kali (Hinits & Moav 1999) dan salmon Atlantik 2-6 kali (Du et al. 1992) pada generasi kedua.
ke dalam genom resipien, (8) analisis tingkat ekspresi transgen, dan (9) analisis pewarisan transgen pada generasi selanjutnya (Beardmore & Porter 2003).
Pada ikan, pertumbuhan dikontrol antara lain oleh keberadaan hormon pertumbuhan. Hormon pertumbuhan adalah polipeptida yang sangat penting untuk pengaturan pertumbuhan pada vertebrata (Meier et al. 2006). Hormon pertumbuhan pituitari yang juga dikenal sebagai somatotropin pada ikan, merupakan protein kunci yang berperan dalam pengaturan pertumbuhan somatik dan banyak aspek metabolisme lainnya yang terdeteksi pada semua vertebrata (Ryynanen & Primmer 2006). Pada ikan, hormon pertumbuhan terlibat dalam sejumlah proses fisiologi termasuk keseimbangan ionik, metabolisme lipid dan protein, pertumbuhan, reproduksi dan fungsi kekebalan, serta berbagai aspek tingkah laku (Perez-Sanchez 2000).
Secara komersial hormon pertumbuhan berperan penting pada bidang obat-obatan, peternakan, akuakultur dan formulasi pakan hewan, sehingga studi mengenai gen yang mengkodekan hormon tersebut banyak dipelajari pada spesies mamalia dan ikan (Anathy et al. 2001). Dalam akuakultur terapi hormon pertumbuhan dilakukan antara lain melalui penggunaan/pemberian hormon secara langsung pada ikan budidaya atau dapat juga dilakukan dengan produksi ikan transgenik yang telah diintroduksi dengan gen hormon pertumbuhan.
Dalam proses pembuatan ikan transgenik, agar gen yang diintroduksikan dapat aktif maka diperlukan adanya promoter. Promoter adalah sekuens DNA yang memfasilitasi transkripsi gen tertentu. Pemilihan promoter menentukan keberhasilan ekspresi transgen pada ikan transgenik. Promoter dapat bersifat spesifik pada jaringan tertentu. Spesifitas ini ditentukan oleh keberadaan faktor transkripsi yang mempengaruhi ekspresi transgen. Salah satu jenis promoter yang umum digunakan untuk membuat ikan transgenik adalah promoter -aktin. Menurut Volckaert et al. (1994) promoter -aktin merupakan promoter yang memiliki keaktifan tanpa adanya rangsangan dari luar sehingga disebut
Promoter -aktin telah diisolasi dari beberapa jenis ikan dan dilaporkan sebagai regulator dengan aktivitas tinggi dalam mengatur ekpresi transgen pada ikan transgenik. Promoter -aktin dari ikan medaka mampu mengatur gen penanda LacZ pada embrio ikan medaka (Takagi et al. 1994). Ekspresi gen GFP yang kuat dengan menggunakan promoter -aktin juga telah ditunjukkan pada ikan medaka (Hamada et al. 1998) dan rainbow trout (Yoshizaki 2001). Selanjutnya promoter ini juga aktif mengatur ekspresi gen penyandi enzim Δ6 -desaturase pada ikan zebra (Alimuddin et al. 2005) dan gen penyandi hormon pertumbuhan pada ikan nila (Kobayashi et al. β007). Promoter -aktin ikan mas mampu mengatur ekspresi beberapa gen penanda pada beberapa jenis ikan (Liu et al. 1990). Sementara itu, promoter -aktin dari ikan zebra dilaporkan aktif mengatur ekspresi gen GFP pada ikan zebra (Higashijima et al. 1997). Begitu pula dengan promoter -aktin dari ikan nila mampu mengatur ekspresi gen GFP pada ikan zebra (Alimuddin et al. 2008). Nam et al. (2001) melaporkan bahwa pada ikan mud loach (Misgurnus mizolepis) yang diintroduksi oleh konstruksi gen yang tersusun darigen GH dan promoter -aktin yang diisolasi dari spesies yang sama, menunjukkan pertumbuhan yang lebih tinggi dibandingkan non-transgenik.
Sebelum gen target diintroduksikan ke sel inang, gen target dan promoter harus ditempatkan dalam sebuah konstruksi gen. Konstruksi gen berfungsi sebagai kendaraan atau vektor yang membawa gen target ke dalam organisme resipien. Konstruksi gen tersebut memiliki beberapa bagian yang berbeda seperti misalnya yang ditunjukkan pada Gambar 1. Bagian-bagian dalam konstruksi gen antara lain: (1) promoter (P) yang berperan untuk mengontrol aktivitas gen target, (2) gen (cDNA) target, dan (3) sekuens perhentian/terminator (poliadenilasi).
Banyak teknik dikembangkan untuk mengintroduksi molekul DNA ke dalam embrio. Pada hewan akuatik, mikroinjeksi merupakan metode yang umum digunakan (Chourrout et al. 1986). Dibandingkan dengan mikroinjeksi, elektroporasi merupakan teknik yang lebih mudah dalam pengerjaannya (Inoue et al. 1990) karena elektroporasi pada telur hasil fertilisasi dapat memproduksi 10 sampai 100 kali lipat dibandingkan mikroinjeksi (Powers et al. 1992). Elektroporasi adalah proses modifikasi permeabilitas membran sel menggunakan medan listrik. Perubahan permeabilitas bersifat sementara, dengan syarat kejutan listrik tidak melebihi batas kritis bagi sel (Tsong 1983; Serpeusu et al. 1985).
Brackett et al. (1971) pertama kali mendemonstrasikan bahwa sperma kelinci mampu membawa DNA eksogen dalam larutan, dan DNA ini terlokalisasi dalam kepala sperma. Hampir dua dekade berikutnya, Arezzo (1989) dan Lavitrano et al. (1989) membuktikan bahwa sel sperma bulu babi dan tikus dapat digunakan sebagai vektor untuk transfer gen. Sperm-mediated gene transfer
(SMGT) merupakan metode yang ideal untuk transfer gen secara massal pada organisme yang fertilisasinya eksternal seperti ikan salmon (Sin et al. 2000).
Keberhasilan transfer gen dengan menggunakan metode elektroporasi melalui sperma telah dibuktikan pada ikan budidaya, antara lain : ikan salmon, zebra, mas, dan nila (diacu dari Spadafora 1998). Penelitian Sin et al. (2000) menunjukkan bahwa kondisi elektroporasi optimal pada sperma salmon adalah pada medan listrik 800 sampai 1000 V/cm, panjang kejutan 27,4 milidetik, dan 2 kejutan. Motilitas sperma pasca elektroporasi bergantung pada medan listrik, panjang kejutan, jumlah kejutan dan kekuatan ionik buffer (Symonds et al. 1994). Berdasarkan penelitian Cheng et al. (2002), motilitas sperma ikan ayu menurun sampai 50% setelah 120 detik ketika dikejutkan dengan voltase 9 kV. Symonds et al. (1994) juga mendemonstrasikan bahwa aktivitas sperma chinook salmon
menurun dari 82% menjadi 2% pada saat sperma dielektroporasi dengan voltase yang meningkat dari 625 V/cm menjadi 1000 V/cm.
efisiensi transfer gen pada telur. Pada kondisi elektroporasi yang optimal, DNA eksogen terdeteksi pada lebih dari 90% embrio ikan salmon yang baru difertilisasi (Walker et al. 1995).
Ekspresi dari gen asing dimulai setelah fase mid-blastula dan levelnya meningkat selama embriogenesis, dan selanjutnya menurun setelah menetas (Gong & Hew 1993; Liu et al. 1990). Kejadian ini disebut sebagai ekspresi sementara (transient expression), yang mungkin disebabkan oleh replikasi ekstrakromosomal DNA asing. Level ekspresi selanjutnya akan menurun yang diikuti dengan degradasi dari ekstrakromosomal DNA. Akibatnya, level ekspresi gen yang terintegrasi ke kromosom resipien tidak setinggi dengan ekspresi sementara. Meskipun hanya beberapa laporan yang menunjukkan integrasi gen dalam genom ikan resipien, teknik ini sangat diperlukan dalam akuakultur (Alimuddin et al. 2003).
Pada beberapa laporan, ekspresi gen dianalisis dengan mengukur level mRNA (messenger RNA) dan protein. mRNA dari gen asing dapat dideteksi dengan menggunakan probe (fragmen DNA yang diberi label radioaktif, biasanya berupa 35P) dan protein dengan cara immunodeteksi dengan menggunakan antibodi. Akan tetapi kedua metode ini membutuhkan banyak waktu dan relatif kompleks. Oleh karena itu, untuk mengembangkan promoter/enhanser yang baik diperlukan suatu metode yang sederhana dan cepat untuk mendeteksi ekspresi gen yang dikendalikannya (Alimuddin et al. 2003).
TUJUAN DAN MANFAAT
Penelitian ini bertujuan untuk menghasilkan ikan patin siam (Pangasionodon hypophthalmus) transgenik F0 melalui over-ekspresi gen penyandi hormon pertumbuhan. Secara khusus penelitian ini bertujuan untuk: 1. Mendapatkan konstruksi gen hormon pertumbuhan all fish yang tersusun dari
promoter β- aktin ikan mas dan gen GH dari ikan patin siam.
2. Mendapatkan kondisi elektroporasi yang optimal pada sperma ikan patin siam.
3. Mendapatkan informasi tingkat ekspresi gen PhGH pada juvenil ikan patin siam.
4. Mendapatkan individu transgenik F0
Manfaat penelitian ini antara lain yaitu untuk menyediakan kandidat ikan patin siam (Pangasionodon hypophthalmus) transgenik F0 sebagai bahan untuk menghasilkan ikan transgenik stabil yang tumbuh cepat.
KEBAHARUAN PENELITIAN
Kebaharuan (novelty) dalam penelitian ini adalah: (1) Konstruksi gen hormon pertumbuhan all fish yang tersusun dari promoter β- aktin ikan mas dan gen GH dari ikan patin siam, (2) Kondisi elektroporasi yang optimal untuk sperma ikan patin siam, (3) Tingkat ekspresi gen PhGH eksogen pada juvenil ikan patin siam dan (4) Individu transgenik F0.
RUANG LINGKUP PENELITIAN
karakterisasi gen hormon pertumbuhan ikan patin siam, pengembangan metode elektroporasi pada sperma ikan patin siam dan analisis ekspresi gen PhGH pada juvenil ikan patin siam, serta produksi ikan patin siam transgenik F0.
2. KARAKTERISASI GEN PENYANDI HORMON
PERTUMBUHAN IKAN PATIN SIAM
(
Pangasionodon hypophthalmus
)
ABSTRAK
Identifikasi gen penyandi hormon pertumbuhan pada ikan target merupakan langkah awal untuk pembuatan konstruksi all fish dan untuk membuat ikan transgenik. Penelitian dilakukan untuk mengidentifikasi dan mengkarakterisasi gen penyandi hormon pertumbuhan ikan patin siam (PhGH). Pelaksanaan penelitian dilakukan di Laboratorium Reproduksi dan Genetika Organisme Akuatik, Institut Pertanian Bogor. Identifikasi gen PhGH dilakukan melalui beberapa tahap yaitu ekstraksi RNA total, sintesis cDNA, amplifikasi PCR, isolasi fragmen DNA target, kloning dan pembacaan sekuens nukleotida. Analisis sekuens nukleotida menggunakan mesin ABIPRISM 3100 dan hasilnya dianalisis menggunakan program BLASTN/P dan GENETYX version 7. Sekuens nukleotida gen PhGH tersusun atas 1148 bp yang terdiri dari 603 bp daerah penyandian (ORF, open reading frame) dengan 200 asam amino residu, 18 bp daerah yang tidak dikodekan pada bagian ujung 5’, dan 527 bp pada ujung 3’. Gen PhGH memiliki beberapa ciri seperti halnya gen GH ikan umumnya yaitu: residu tryptophan (W) tunggal pada asam amino ke-104, 5 residu sistein (C) pada asam amino ke-71, 135, 173,190, dan 198, serta motif Asn-Xaa-Thr pada terminal C yang berpotensi sebagai lokasi N-linked glycosilation. Sinyal poliadenilasi (aataaa) berada pada 14 bp di bagian hulu lokasi poliadenilasi.
Kata kunci: identifikasi, karakterisasi, gen PhGH, Pangasionodon hypophthalmus
___________________________
CHARACTERIZATION OF GENE ENCODING
GROWTH HORMONE ON STRIPPED CATFISH
(
Pangasionodon hypophthalmus
)
ABSTRACT
Identification of growth hormone (GH) gene on the target fish is the first step for the construction of "all fish gene transfer vector" and to generate transgenic fish. Research was done on the identification and characterization of stripped catfish (Pangasionodon hypophthalmus) GH gene (PhGH). This research was conducted at Reproduction and Genetic of Aquatic Organism Laboratory, Bogor Agricultural University. Steps of study performed to identify the PhGH gene were total RNA extraction, cDNA synthesis, PCR amplification, DNA fragment isolation, cloning and sequencing. Analysis of nucleotide sequence were done using ABIPRISM 3100, the results were then analyzed using BLASTN/P and GENETYX version 7 program. The full-length PhGH gene is 1148 bp in length, coding for an open reading frame (ORF) of 603 bp with 200 amino acid residues. The 5’ and 3’ untranslated regions of the PhGH gene are 18 bp and 527 bp, respectively. PhGH gene has some common characteristics that are owned by GH genes, such as single tryptophan residue (W) on the 104th amino acid, 5 cysteine residues (C) on the amino acid 71, 135, 173, 190 and 198 and a motif Asn-Xaa-Thr on C terminus which is the potential location for N-linked glycosilation. Polyadenylation signal (aataaa) was on the 14 bp at the upstream of polyadenylation location.
Keywords: identification, characterization, PhGH gene, Pangasionodon hypophthalmus
PENDAHULUAN
protein, pertumbuhan, reproduksi dan fungsi kekebalan, serta berbagai aspek tingkah laku (Perez-Sanchez 2000). Secara komersial hormon pertumbuhan diperlukan pada bidang obat-obatan, peternakan, akuakultur dan formulasi pakan hewan. Oleh sebab itu studi mengenai gen yang mengkodekan hormon tersebut dipelajari secara ekstensif pada beberapa spesies mamalia dan ikan (Anathy et al. 2001).
Dalam dua puluh tahun terakhir ini dikembangkan teknologi transfer gen yang ditujukan untuk mendapatkan produk perikanan dengan karakteristik yang diinginkan. Pada saat ini, transgen yang paling berhasil dan tampaknya yang pertama digunakan di ikan budidaya untuk konsumsi manusia adalah yang mengandung konstruksi gen penyandi hormon pertumbuhan (growth hormone, GH). Alasannya adalah bahwa konstruksi gen GH terbukti dapat meningkatkan pertumbuhan secara drastis pada berbagai spesies ikan seperti ikan mas (Cyprinus carpio) dan koki (Carrasius auratus gibelio) (Zhu 1992), channel catfish (Ictalurus punctatus) (Dunham et al. 1987), nila (Oreochromis niloticus) (Martinez et al. 1996), salmon Atlantik (Salmo salar) (Du et al. 1992), salmon coho (Oncorhynchus kisutch) (Devlin et al. 1994), rainbow trout (Oncorhynchus mykiss) (Devlin et al. 2001), mud loach (Misgurnus mizolepis) (Nam et al. 2001) dan Arctic charr (Salvelinus alpinus) (Pitkanen et al. 1999).
BAHAN DAN METODE
Isolasi RNA Total
RNA total diisolasi dari jaringan hipofisa, hati, otot, otak, limfa dan testes ikan patin siam yang masih hidup berukuran sekitar 500 gram. Jaringan diambil secara aseptis dan disimpan dalam botol sampel yang telah berisi isogen sebanyak 200 µl. Jaringan dihancurkan oleh penggerus yang sebelumnya telah disterilkan dengan DEPC 1%. Ke dalam Eppendorf ditambahkan larutan isogen sampai mencapai volume akhir 800 µl. Chloroform p.a. sebanyak 200 µl ditambahkan ke dalam Eppendorf dan larutan disentrifugasi pada kecepatan 12.000 rpm selama lima menit pada suhu ruang. Supernatan yang terbentuk dipindahkan ke dalam Eppendorf baru yang telah berisi 400 µl isopropanol. Larutan disentrifugasi pada kecepatan 12.000 rpm selama 15 menit pada suhu 4°C. Pada Eppendorf akan terbentuk pelet RNA, dan cairan yang terdapat pada Eppendorf dibuang. Ke dalam Eppendorf berisi pelet RNA ditambahkan 1 ml etanol 70% (dingin) kemudian disentrifugasi dengan kecepatan 12.000 rpm selama 15 menit. Pelet RNA dikeringkan dengan cara membuang larutan yang terdapat pada Eppendorf. Sampel RNA disimpan dengan cara menambahkan 30 µl DEPC 1%. Konsentrasi RNA total hasil isolasi diukur menggunakan alat pengukur konsentrasi RNA/DNA (GeneQuant). Absorbansi diukur pada panjang gelombang 260 dan 280 nm.
Sintesis cDNA
diinkubasi pada suhu 37°C selama 1 jam. cDNA yang terbentuk ditambahkan 30 µl SDW steril dan disimpan dalam refrigerator.
Identifikasi Gen PhGH
Isolasi gen PhGH dilakukan dengan menggunakan cDNA yang disintesis dari RNA hasil ekstraksi dari kelenjar hipofisa, hati, otak, otot, limfa dan testes. Satu mikroliter cDNA digunakan sebagai cetakan untuk PCR, kemudian dicampur dengan 1 μl primer ghF (5’-TCA GAG AGA TTT GGC AAA ATG GCT-3’), 1 μl primer AP-1r (5’-CCA TCC TAA TAC GAC TCA CTA TAG GGC-3’), 1 μl dNTP, 1 μl Ex Taq buffer, 0.05 μl Ex Taq polymerase (TAKARA) kemudian ditambahkan SDW sampai volume akhir menjadi 10 μl. PCR dilakukan dengan program: 94°C selama 3 menit; (94°C selama 30 detik; 59°C selama 30 detik; 72°C selama 1 menit) sebanyak 35 siklus; 72°C selama 3 menit; dan 4°C (tak hingga). Pengecekan hasil amplifikasi PCR dilakukan dengan elektroforesis menggunakan gel agarose 1%. Sebagai kontrol internal digunakan gen -aktin. Deteksi gen -aktin dilakukan dengan menggunakan metode PCR. Primer yang digunakan adalah F (5’-TAT GAA GGT TAT GCT CTG CCC-3’) dan bact-R (5’- CAT ACC CAG GAA AGA TGG CTG-3’). PCbact-R dilakukan dengan program: 94°C selama 3 menit; (94°C selama 30 detik; 58°C selama 30 detik; 72°C selama 30 detik) sebanyak 30 siklus; 72°C selama 3 menit; dan 4°C (tak hingga). Pengecekan hasil amplifikasi PCR dilakukan dengan elektroforesis menggunakan gel agarose 1%. Fragmen gen -aktin ikan patin siam berada pada ukuran sekitar 300 bp.
Purifikasi Gen PhGH
selama 30 detik. Glass blind sebanyak 6 μl ditambahkan ke dalam Eppendorf, dibolak-balik beberapa kali dan diinkubasi kembali pada suhu ruang selama 5 menit. Larutan disentrifugasi pada kecepatan 13.000 rpm selama 5 detik dengan suhu 4°C. Supernatan yang terbentuk dibuang, lalu ke dalam tabung ditambahkan 1 ml wash buffer dan etanol, kemudian divorteks sampai pelet hancur. Selanjutnya disentrifugasi selama 5 detik dengan kecepatan 13.000 rpm dan wash buffer dibuang sampai bersih. SDW sebanyak 9 μl ditambahkan dan diaduk sampai pelet hancur kemudian diinkubasi pada suhu ruang selama 5 menit. Larutan disentrifugasi dengan kecepatan 13.000 rpm selama 1 menit pada suhu ruang, supernatan dipindahkan pada Eppendorf selanjutnya DNA dilarutkan dengan 1β μl SDW.
Ligasi Gen PhGH ke Vektor pGEM-T Easy
Fragmen DNA hasil purifikasi dari gel diligasi dengan vektor kloning pGEM-T Easy (Promega, WI, USA) dengan komponen reaksi ligasi meliputi 5 μl larutan DNA hasil purifikasi; 0,5 μl pGEM-T Easy; 6,5μl 5x buffer ligasi, dan 1μl enzim T4 DNA ligase (Promega). Inkubasi dilakukan selama dua jam pada suhu ruang dan dilanjutkan semalam di dalam refrigerator (suhu sekitar 4°C).
Transformasi ke Bakteri Escherichia coliDH5α
terbentuk dibuang. Endapan bakteri disuspensi menggunakan 200 µl CaCl2 dan diinkubasi di atas es selama 20-60 menit.
Transformasi. Sebanyak 6,5 μl hasil reaksi ligasi dicampur ke dalam Eppendorf berisi sel kompeten E. coli DH5α. Transformasi dilakukan menggunakan kejutan panas pada suhu 42°C selama 45 detik. Sekitar 2-3 menit setelah diinkubasi dalam es. Ke dalam Eppendorf ditambahkan 900 μl larutan SOC (1,2 g polypeptone; 0,3 g yeast extract; 0,035 g NaCl; 0,011 g KCl; 600 μl MgCl2 1M; 600 μl MgSO4 1 M dan 60 μl glucose βM dalam 60 ml SDW). Selanjutnya inkubasi dilakukan menggunakan shaker pada suhu 37°C selama 1 jam. Bakteri disebar di atas cawan agar 2xYT (1.6% polypeptone, 1% yeast extract, 0.5% NaCl dan 1.5% bacto agar dalam SDW) yang mengandung ampisilin, IPTG dan X-gal (disingkat menjadi 2xYT-A,I,X). Cawan agar berisi bakteri diinkubasi pada suhu 37°C selama sekitar 14 jam.
Identifikasi Transforman
digunakan koloni biru sebagai kontrol. Ukuran DNA plasmid koloni bakteri yang membawa insersi akan lebih besar daripada yang dari kontrol. Koloni bakteri yang membawa DNA insersi diambil dari master plate menggunakan tusuk gigi steril dan disentuhkan ke media cair 2xYT yang mengandung ampisilin dalam tabung kultur berbentuk “L” untuk diperbanyak. Inkubasi bakteri menggunakan shaker dilakukan pada suhu 37°C selama sekitar 14 jam.
Metode PCR. Untuk mengetahui keberhasilan transformasi, maka dilakukan isolasi plasmid pada koloni bakteri yang positif membawa gen insersi. Proses PCR dilakukan dengan menggunakan primer ghF dan primer ghR.
Pembacaan Sekuens Nukleotida Gen PhGH
Isolasi Plasmid. Plasmid pGEM-T Easy yang mengandung gen PhGH diisolasi dari bakteri E. coli. Satu koloni bakteri yang mengandung plasmid rekombinan ditumbuhkan di dalam 2 ml media Luria Bertani (LB) (10 g/l polypeptone, 5 g/l yeast extract, 10 g/l NaCl, pH 7,5) yang mengandung ampisilin 100 mg/l pada shaker dengan kecepatan 250 rpm, suhu 37ºC selama semalam. Bakteri diendapkan dengan sentrifugasi pada kecepatan 10.000 rpm, suhu 4ºC, selama 10 menit. Pelet yang terbentuk digunakan sebagai sampel untuk isolasi plasmid dengan menggunakan kit GF-1 Plasmid DNA Extraction (Vivantis) sesuai dengan prosedur pada manualnya.
berisi colomn disentrifugasi dengan kecepatan 10.000 rpm selama 1 menit untuk melarutkan DNA dan selanjutnya disimpan pada suhu -20ºC.
Pembacaan Sekuens Nukleotida. Pembacaan sekuens cDNA dilakukan terhadap klon-klon cDNA GH terpilih yang didasarkan pada ”dideoxy-nucleotide chain-termination” menggunakan mesin otomatis ABI PRISM 3100. Konsentrasi DNA diukur dengan menggunakan genequant. PCR untuk sekuensing menggunakan primer target dan reagen khusus untuk sekuens yaitu big dye. Volume PCR 10 µl terdiri dari 1µl ready reaction premix (2,5x), 1 µl big dye sequence buffer (5x), 3,2 µl primer (10 pmol), 0,5 µl plasmid (300 ng), dan 4,3 µl SDW.
Analisis Sekuens Gen PhGH
Sekuens nukleotida dianalisis dengan menggunakan program Genetyx 7 dan BLASTN/P. Analisis dengan menggunakan program Genetyx 7 akan menghasilkan deduksi asam amino, pensejajaran nukleotida hormon pertumbuhan beberapa spesies ikan, dan filogenetik gen hormon pertumbuhan pada beberapa ordo spesies ikan. Analisis dengan menggunakan program Blast P akan menghasilkan indeks similaritas antar sekuens asam amino pada beberapa spesies ikan.
HASIL DAN PEMBAHASAN
Identifikasi Gen PhGH
Identifikasi gen PhGH dilakukan pada beberapa jaringan tubuh ikan antara lain hipofisa, hati, otot, otak, limfa, dan testes (Gambar 3). Berdasarkan hasil elektroforesis, gen PhGH hanya teridentifikasi pada jaringan hipofisa. Pita DNA dengan panjang sekitar 1200 bp merupakan kandidat fragmen gen PhGH. Sebagai kontrol internal digunakan gen β-aktin ikan patin siam. Fragmen gen β -aktin ikan patin siam berada pada ukuran sekitar 300 bp.
dalam media agar. Keberhasilan proses kloning dideteksi dengan menggunakan metode cracking. Hasil cracking dapat dilihat pada Gambar 4. Plasmid yang mengandung gen PhGH berada pada ukuran yang lebih besar dibandingkan dengan kontrol (blue colony, B) yaitu plasmid yang tidak terinsersi gen PhGH. Berdasarkan hasil tersebut, maka dipilih klon nomor 3 dan 5 untuk selanjutnya dilakukan proses sekuensing.
Gambar 3 Deteksi gen penyandi hormon pertumbuhan pada beberapa jaringan tubuh ikan patin siam (A). Produk PCR dari beberapa jaringan menggunakan primer gen -aktin dengan panjang fragmen sekitar 300 bp (B). M adalah marker DNA 0.1-10.0 kb (BioLabs Inc., New England).
Pembacaan sekuens nukleotida gen PhGH pada klon 3 dan 5 dilakukan dari arah forward dan reverse. Alignment dilakukan untuk mendapatkan urutan nukleotida yang sama. Sekuens nukleotida dan deduksi asam amino gen PhGH dapat dilihat pada Gambar 5.
Hasil pembacaan sekuens nukleotida gen PhGH menunjukkan bahwa sekuens gen PhGH berukuran 1148 bp yang terdiri atas 18 bp pada daerah yang tidak diterjemahkan (UTR) pada ujung 5’ dan 527 bp pada ujung 3’ serta daerah penyandian (ORF) sepanjang 603 bp (Gambar 5). Translasi asam amino diawali
0,5 kb - 1 kb -
0,5 kb - 3 kb -
M hipofisa hati otot otak limfa testes
(A)
(B)
1200 bp
[image:32.595.108.499.161.815.2]dengan sekuens ATG atau dikenal dengan kodon awal yang disandikan dalam bentuk methionin (M). Sedangkan kodon akhir ditandai dengan sekuens TAG yang walaupun tidak diterjemahkan ke dalam bentuk asam amino tetapi merupakan sekuens sinyal berakhirnya aktivitas translasi.
B 1 2 3 4 5 B 6 7 8 9 10 B 11 12 13 14 B
Gambar 4. Cracking hasil transformasi pada plasmid pGEM-T Easy yang diligasi gen PhGH. B = blue colony (kontrol). Angka di atas gambar menunjukkan nomor klon bakteri.
Gen GH antar spesies ikan memiliki ukuran yang bervariasi. Gen GH pada Pangasionodon gigas berukuran 1176 bp (no aksesi L27835.1; Lemaire et al. 1994), Cyprinus carpio berukuran 1164 bp (no aksesi M27000; Koren et al. 1989), Oncorhynchus keta berukuran 1120 bp (no aksesi K03050; Sekine et al. 1985), Oncorhynchus mykiss berukuran 1161 bp (no aksesi M24683; Rentier-Delrue et al. 1989a) dan Oreochromis niloticus berukuran 847 bp (no aksesi M26816; Rentier-Delrue et al. 1989b).
Gen PhGH memiliki beberapa ciri khas yang umum dimiliki oleh gen GH antara lain: memiliki residu tryptophan (W) tunggal yaitu pada asam amino ke-104, memiliki 5 residu sistein (C) yaitu pada asam amino ke-71, 135, 173, 190 dan 198 dan memiliki motif Asn-Xaa-Thr pada C terminus yang merupakan lokasi potensial untuk N-linked glycosilation. Sinyal poliadenilasi (aataaa) berada pada 14 bp di bagian hulu lokasi poliadenilasi.
tcagagagatttggcaaaatggctagagtgttggtggtgctctctgtggtggtggc 60 M A R V L V V L S V V V A
g a g t t t g t t c t t t a g t c a a g g c g c g a c a t t c g a g a a c c a g c g g c t c t t c a a c a a c g c a g t 1 2 0
S L F F S Q G A T F E N Q R L F N N A V
c a t c c g t g t g c a a c a c c t t c a t c a g c t g g c t g c c a a g a t g a t g g a t g a c t t t g a g g a a g c 1 8 0 I R V Q H L H Q L A A K M M D D F E E A
t c t g t t a c c t g a a g a a c g c a a a c a g c t g a g c a a g a t t t t c c c c c t g t c t t t c t g c a a c t c 2 4 0 L L P E E R K Q L S K I F P L S F C N S
g g a c t c c a t c g a a g c t c c t g c a g g c a a g g a c g a g a c c c a g a a a a g c t c t g t g c t g a a a t t 3 0 0 D S I E A P A G K D E T Q K S S V L K L
g c t g c a c a c c t c c t a c c g t c t g a t c g a g t c a t g g g a g t t c c c c a g c a a g a a c c t c g g c a a 3 6 0 L H T S Y R L I E S W E F P S K N L G N
c c c c a a c c a c a t c t c a g a g a a g c t g g c t g a c c t g a a a a t g g g c a t c g g c g t g c t t a t c g a 4 2 0 P N H I S E K L A D L K M G I G V L I E
g g g a t g t t t g g a t g g a c a a a c c a g c c t g g a t g a g a a c g a c t c t c t g g c t c c g c c c t t c g a 4 8 0 G C L D G Q T S L D E N D S L A P P F E
g g a t t t c t a c c a g a c c t t g a g c g a g g g a a a c c t g a g g a a g a g c t t c c g t c t g c t g t c c t g 5 4 0 D F Y Q T L S E G N L R K S F R L L S C
c t t c a a g a a g g a c a t g c a c a a a g t g g a g a c c t a t c t c a g c g t g g c c a a g t g c a g g a g a t c 6 0 0 F K K D M H K V E T Y L S V A K C R R S
c c t g g a t t c c a a c t g c a c c c t g t a g g g g g c g a g a g a g c a c a a t t t a g c c a c a g c c t g t g a 6 6 0 L D S N C T L *
t c t c a g a c a g a t t t t g t a t t t a a a t t a a a a a a a a a a c t c t g t c c a g g c c t g g c t a a a t g t 7 2 0
a t c a g c c t c t t t c t c t g g t t t c a c t t c t g a c t t t a t g t a t t t a t t c t g c t c a c c g a g g a g 7 8 0
a a c t c c t c c a t t c a c a t t t t t a g c a g a t t t c t c t g t c c c g g c a a c t t a a a g g t t g t a a a a 8 4 0
t g g g a c c a a t t t c a c a a t g g t g c t a t g c a a a t t c a g c t t t a t a t c a a a t a a t g a c c a g a a 9 0 0
a a a t g a c t a g g t c t a t t t c t t t t a a c t t a t t g g c t a c a a a t t g g a t a a t c t g a t t t a a c a 9 6 0
a t c g t g t t a a c t t t g g a a t g g a c g a g t t c g c t c c t g g c c a g t g a a t g t t a a a t a t t c a a a 1 0 2 0
g t g t a t a t t t t c a t a t c a a a g t c t a t a c t t a t t g t t c a g c a t t g a c t a t t t c t g t g t g t a 1 0 8 0
a a t c t g t c a t t g t t g t t g t g g a t t t c ca a t a a ag c t a a t t c t t g c a t t a a a a a a a a a a a a 1 1 4 0
a a a a a a a a a a a a
Gambar 5. Sekuens nukleotida dan deduksi asam amino penyusun gen PhGH. Lokasi N-glikosilasi ditandai dengan huruf yang digaris bawah. Sinyal poliadenilasi (aataaa) dan poliadenilasi ditandai dengan huruf miring yang digarisbawahi.
[image:34.595.92.505.67.795.2]Homologi Sekuens Asam Amino Gen PhGH
Analisa BlastP antara sekuens asam amino gen PhGH dengan beberapa spesies ikan dari lima ordo yang berbeda ditunjukkan pada Gambar 6. Sekuens asam amino penyusun gen GH jumlahnya berbeda antar ordo yang berbeda. Sekuens asam amino penyusun gen GH ordo siluriformes berjumlah 200 asam amino, ordo cypriniformes berjumlah 210 asam amino, ordo salmoniformes berjumlah 210 asam amino, ordo perciformes berjumlah 204 asam amino, sedangkan ordo anguilliformes berjumlah 209 asam amino.
Hasil penelitian Ryynanen & Primmer (2006) menunjukkan adanya dugaan daerah sinyal peptida yang diprediksikan pada 22 asam amino pertama di seluruh pre-GH teleost yang diteliti (salmoniformes, siluriformes dan cypriniformes) dengan kekecualian pada perciformes, dimana sinyal peptida terdiri dari 17 atau 18 residu asam amino pertama pada pre-GH. Pada ordo siluriformes, deduksi asam amino gen GH mengandung 200 asam amino yang terdiri dari 178 “mature peptide” dan 22 asam amino sinyal peptida. Secara umum pada ikan termasuk silurids, terdapat dua dugaan lokasi N-glikosilasi (Asn-Xaa-Thr atau Ser) yang secara normal berada pada asam amino ke-125 dan 175 pada “mature peptide” (Anathy et al. 2001). Domain N-glikosilasi mengandung empat asam amino yaitu asparagin, sistein, treonin dan leusin. N-glikosilasi terlibat di dalam regulasi aktivitas transport dan ekspresi permukaan dari transporter neurotransmitter (Bennet & Kanner 1997).
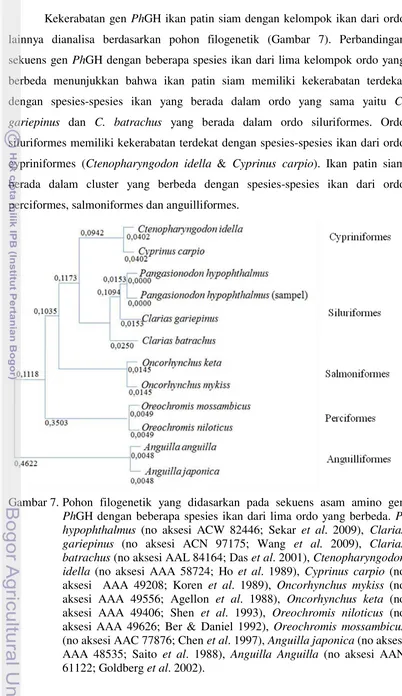
Kekerabatan gen PhGH ikan patin siam dengan kelompok ikan dari ordo lainnya dianalisa berdasarkan pohon filogenetik (Gambar 7). Perbandingan sekuens gen PhGH dengan beberapa spesies ikan dari lima kelompok ordo yang berbeda menunjukkan bahwa ikan patin siam memiliki kekerabatan terdekat dengan spesies-spesies ikan yang berada dalam ordo yang sama yaitu C. gariepinus dan C. batrachus yang berada dalam ordo siluriformes. Ordo siluriformes memiliki kekerabatan terdekat dengan spesies-spesies ikan dari ordo cypriniformes (Ctenopharyngodon idella & Cyprinus carpio). Ikan patin siam berada dalam cluster yang berbeda dengan spesies-spesies ikan dari ordo perciformes, salmoniformes dan anguilliformes.
GH bersama-sama dengan prolaktin dan somatolaktin merupakan famili dari hormon pituitari dengan struktur dan fungsi yang sama yang tampaknya berasal dari sumber gen yang sama sebelum ikan berevolusi (Meier et al. 2006). GH ditemukan pada semua kelompok taksonomi vertebrata yang berahang (gnathostomes) dan juga terdapat pada sea lamprey yang merupakan bagian dari kelompok vertebrata yang tertua (vertebrata yang tidak berahang) (Roussau & Dufour 2004).
Data molekular dari gen inti seperti halnya gen GH pada saat ini digunakan sebagai sumber informasi untuk mengevaluasi hubungan kekerabatan ikan pada berbagai tingkat taksonomi dan menghasilkan filogeni (Meier et al. 2006). Analisis sekuens nukleotida berguna untuk mempelajari hubungan antara sekuens dari ordo-ordo yang berbeda. Adanya variasi genetik pada evolusi GH dapat disebabkan oleh sejumlah faktor termasuk (1) meningkatnya tekanan seleksi yang berkaitan dengan perubahan dalam fungsi biologis, (2) relaksasi dari seleksi pemurnian yang disebabkan hilangnya suatu fungsi, atau (3) perbandingan dari produk gen-gen nonorthologous, setelah duplikasi gen dan periode evolusi yang berbeda (Wallis 1996).
KESIMPULAN
3. PENGEMBANGAN METODE ELEKTROPORASI PADA
SPERMA SEBAGAI PERANTARA TRANSFER GEN PADA
IKAN PATIN SIAM (
Pangasionodon hypophthalmus
)
ABSTRAK
Penggunaan metode elektroporasi dengan menggunakan sperma sebagai perantara transfer gen asing untuk memproduksi ikan transgenik telah dibuktikan keberhasilannya. Tujuan penelitian yang dilakukan adalah mendapatkan kondisi elektroporasi yang optimal pada sperma ikan patin siam (Pangasionodon hypophthalmus). Penelitian dilakukan di Loka Riset Pemuliaan dan Teknologi Budidaya Perikanan Air Tawar di Sukamandi dan Laboratorium Reproduksi dan Genetika Organisme Akuatik di Institut Pertanian Bogor. Plasmid yang mengandung gen EGFP (enhanced green fluorescent protein) yang disambungkan dengan promoter -aktin ikan mas ditransfer ke dalam sperma menggunakan metode elektroporasi untuk memproduksi ikan patin siam transgenik. Elektroporasi dilakukan menggunakan tipe kejutan square wave dengan lama kejutan (pulse length) 30 milidetik dan interval kejutan (pulse interval) 0,1 detik. Perlakuan berupa kombinasi antara kuat medan listrik (125, 187,5 dan 250 V/cm) dan jumlah kejutan listrik (1 dan 3). Konsentrasi DNA plasmid adalah 10 µg/ml TE. Hasil penelitian menunjukkan peningkatan kuat medan listrik dari 125 sampai 250 V/cm menurunkan motilitas sperma, adapun jumlah kejutan tidak mempengaruhi motilitas sperma. Motilitas sperma yang dikejut pada 125 V/cm lebih tinggi dibandingkan perlakuan lainnya walaupun kelangsungan hidup sperma relatif sama antar perlakuan dan kontrol kecuali pada sperma yang dilektroporasi pada 250 V/cm dengan jumlah kejutan 3 kali. Sperma yang dielektroporasi masih memiliki kemampuan untuk membuahi sel telur. Derajat penetasan tertinggi berasal dari telur yang dibuahi sperma yang dielektroporasi pada 125 V/cm dengan jumlah kejutan 1 dan 3 kali. Keberadaan gen EGFP dideteksi pada sperma yang dielektroporasi maupun pada sperma yang hanya diinkubasi (kontrol). Namun, pada fase larva gen EGFP hanya dapat dideteksi pada larva yang berasal dari telur yang difertilisasi sperma yang dielektroporasi. Oleh karena itu, elektroporasi dapat digunakan untuk memproduksi ikan patin transgenik. Ekspresi gen EGFP dimulai pada fase 2-8 sel dan mencapai puncaknya pada fase neurula.
OPTIMALIZATION ELECTROPORATION METHODS
ON STRIPPED CATFISH (
Pangasiondon hypohthalmus
) SPERM
AS A CARRIER FOR GENE TRANSFER
ABSTRACT
The success of transgenic fish production has been proven through eggs fertilization using the electroporated sperms carrying exogenous DNA. This study was conducted in order to obtain the optimal electroporation condition for stripped catfish (Pangasionodon hypophthalmus) sperm. The research was done at Research Institute for Freshwater Fish Breeding and Aquaculture, Sukamandi and Reproduction and Genetic of Aquatic Organism Laboratory, Bogor Agricultural University. Plasmid containing enhanced green fluorescent protein (EGFP) gene driven by carp -actin promoter was transferred into sperm using electroporation method towards transgenic stripped catfish production. Electroporation was carried out using square wave shock with pulse length of 30 ms and pulse interval of 0.1 s. Treatments are combination between electric field strengths (125; 187,5 and 250 V/cm) and pulse number (1 and 3). Exogenous DNA concentration was 10 µg/ml of Tris-EDTA. Results showed that increasing of electric field strength from 125 to 250 V/cm decreased sperm motility, while pulse number did not affect sperm motility. Electric field strength of 125 V/cm gave the best motility of sperm, although sperm viability relatively similar between treatments and control except at 250 V/cm with 3 pulses number. Further, electroporation treated sperm were able to fertilize eggs. Higher hatching rate of eggs was obtained in electroporation treatment at 125 V/cm with pulse number of 1 and 3. The persistence of transferred EGFP was detected in electroporated and incubated sperms (control). However, EGFP was only detected in larvae from eggs that fertilized by electroporated sperm. Thus, electroporation could be applied to produce transgenic stripped catfish. EGFP expression was started at 2-8 cells stage, and peak expression was achieved at neurula stage. Keywords: electroporation, sperm, Pangasionodon hypophthalmus
PENDAHULUAN
memiliki tingkat keberhasilan yang tinggi untuk memproduksi ikan transgenik. Namun demikian, teknik mikroinjeksi membutuhkan keterampilan yang tinggi dan keberhasilannya ditentukan oleh karakteristik telur seperti ukurannya yang kecil, korion yang keras, mudah pecah, buram, dan sebagainya (Lanes et al. 2009). Produksi hewan transgenik melalui mikroinjeksi relatif mahal dengan tingkat keberhasilan 1-4% (Anzar & Buhr 2006).
Spermatozoa dapat berperan sebagai “carrier” DNA eksogen, karena memiliki kemampuan alami untuk mentransfer DNA eksogen ke dalam oosit dan memproduksi benih transgenik (Anzar & Buhr 2006). Brackett et al. (1971) pertama kali mendemonstrasikan bahwa sperma kelinci mampu mengikat DNA eksogen yang ada dalam larutan, dan DNA ini terlokalisasi dalam kepala sperma. Hampir dua dekade berikutnya, Arezzo (1989) dan Lavitrano et al. (1989) membuktikan bahwa sel spermatozoa bulu babi dan tikus dapat digunakan sebagai vektor untuk transfer gen. Menurut Sin et al. (2000), sperm-mediated gene transfer (SMGT) merupakan metode yang ideal untuk transfer gen secara massal pada organisme yang fertilisasinya eksternal seperti pada ikan salmon. SMGT dapat berguna untuk transgenesis pada spesies yang memiliki fekunditas yang tinggi, ukuran telur yang kecil dan dapat diakses dengan mudah pada spermatozoa (Lanes et al. 2009).
SMGT efisien dalam memproduksi babi transgenik yang mengandung human decay accelerating factor (hDAF) dengan tingkat transkripsi 64% pada jaringan yang diuji. Teknik ini lebih sederhana dibandingkan mikroinjeksi pada zigot dan membuka kesempatan untuk melakukan transgenesis pada skala massal. Beberapa laporan penelitian menyebutkan bahwa spermatozoa tikus, ayam, kerbau, dan manusia mampu mengikat DNA eksogen. Walaupun hewan transgenik dari berbagai spesies telah berhasil diproduksi, efisiensi transfer DNA dengan perantara sperma masih dipertanyakan, terutama disebabkan tingkat pengikatan DNA eksogen yang rendah oleh spermatozoa, sehingga menurunkan kesempatan fertilisasi oosit oleh spermatozoa yang tertransfeksi (disarikan dari Anzar & Buhr 2006).
niloticus), zebra (Danio rerio), salmon (Oncorhynchus tshawytscha), koan (Ctenopharyngodon idellus) dan silver red sea bream (Sparus sarba) (disarikan dari Lanes et al. 2009). Menurut Inoue et al. (1990), dibandingkan dengan mikroinjeksi, elektroporasi merupakan teknik yang lebih mudah dalam pengerjaannya karena elektroporasi pada telur hasil fertilisasi dapat memproduksi 10 sampai 100 kali lipat dibandingkan mikroinjeksi (Powers et al. 1992). Namun demikian, efisiensi transfer gen masih belum cukup mampu untuk menangani sejumlah besar telur hasil pemijahan dalam waktu yang sangat singkat pada spesies akuakultur.
Aplikasi elektroporasi dengan perantara sperma pada ikan memiliki beberapa keuntungan antara lain yaitu: (1) Teknik ini merupakan teknik transfer gen secara massal, (2) Teknik ini mampu mengatasi beberapa kekurangan sistem transfer gen konvensial yang disebabkan karakter telur seperti warna yang kabur/buram, menempel, melayang, pronuklei yang tidak tampak, dan korion yang keras, (3) DNA asing harus ditransfer ke dalam nukleus, jika telur hasil fertilisasi dielektroporasi dengan DNA asing, fragmen DNA memiliki kesempatan yang lebih besar untuk ditransfer ke dalam beberapa tempat selain blastodisk karena volumenya sangat kecil dalam telur hasil fertilisasi, (4) Sperma ikan mudah ditangani karena penambahan air secara sederhana mampu untuk mengaktifkan sperma, (5) Sperma dari hewan akuatik dapat di-kriopreservasi sehingga sperma dapat selalu tersedia untuk digunakan. Oleh karena itu, sperma ikan dapat digunakan sebagai vektor untuk mengintroduksi DNA asing untuk memproduksi ikan transgenik (Tsai 2000).
(Pangasionodon hypophthalmus). Untuk mendapatkan efisiensi transfer gen yang tinggi, pada penelitian ini diuji kombinasi tingkat kuat medan listrik (electric field strength) dan jumlah kejutan listrik (pulse number) pada sperma ikan patin siam. Diharapkan, gen EGFP yang ditransfer mampu terinsersi dan terekspresi pada ikan patin siam.
BAHAN DAN METODE
Koleksi Gamet
Induk jantan dan betina yang digunakan adalah induk ikan patin siam berukuran 2 - 4 kg yang diperoleh dari Loka Riset Pemuliaan dan Teknologi Budidaya Perikanan Air Tawar Sukamandi. Induk diseleksi berdasarkan tingkat kematangan gonadnya. Induk yang telah mencapai TKG III dipilih untuk dipijahkan. Induk hasil seleksi dari kolam induk dipindahkan ke dalam bak pemijahan.
Keseragaman kematangan telur dan ovulasi diinduksi melalui penyuntikan hormon. Induk betina diberi suntikan pertama berupa HCG dengan dosis 500 IU/kg bobot. Suntikan kedua diberikan dengan selang waktu 24 jam berupa ovaprim dengan dosis 0,6 ml/kg bobot. Striping untuk mendapatkan sel telur dilakukan 9 - 12 jam dari penyuntikan kedua.
Induk jantan diinduksi melalui penyuntikan ovaprim dengan dosis 0,2 – 0,3 ml/kg bobot. Striping untuk mendapatkan sperma dilakukan 9 - 12 jam setelah penyuntikan.
Konstruksi Plasmid
µl 10xK buffer, 5µl BSA, 1 µl enzim Kpn I, 1 µl enzim Apa I dan 35,5 µl SDW. Reaksi digesti diinkubasi selama satu jam pada suhu 37ºC.
Proses ligasi (penyambungan) dilakukan dengan mencampurkan 1 µl pCcBA, 6,5 µl 2x buffer ligasi, 1 µl enzim T4 DNA ligase dan 4,5 µl plasmid pEGFP-NI yang telah dipotong. Inkubasi dilakukan selama dua jam pada suhu ruang dan dilanjutkan semalam di dalam refrigerator (suhu sekitar 4°C). Peta konstruksi gen pCcBA-EGFP (6,0 kb) dapat dilihat pada Gambar 8.
Gambar 8 Peta konstruksi gen pCcBA-EGFP (6,0 kb). pCcBA= promoter β -aktin ikan mas. EGFP= enhanced green fluorescent protein. PolyA= poliadenilasi. KpnI, ApaI, AgeI, NotI= enzim restriksi.
Elektroporasi Sperma
Elektroporasi sperma dilakukan dengan menggunakan mesin Gene Pulser II (Biorad, USA). Sperma diencerkan dengan menggunakan larutan fisiologis (1 : 7) sebelum dicampur dengan plasmid. Untuk mendapatkan kondisi elektroporasi yang optimal maka dilakukan penelitian pendahuluan untuk mendapatkan kisaran kuat medan listrik yang mendukung motilitas dan kelangsungan hidup spermatozoa yang tinggi sehingga tetap memiliki kemampuan untuk membuahi sel telur. Kisaran kuat medan listrik yang digunakan yaitu antara 250 – 1250 V/cm. Berdasarkan hasil pada penelitian pendahuluan tersebut, diketahui bahwa kejutan listrik dengan menggunakan 250 V/cm menunjukkan nilai motilitas dan kelangsungan hidup sperma yang terbaik (Tabel 2). Pengujian lebih lanjut dilakukan untuk mendapatkan kombinasi kuat medan listrik dan jumlah kejutan listrik yang optimal sehingga didapatkan nilai motilitas spermatozoa dan ketahanan hidup spermatozoa yang tinggi serta larva yang membawa DNA eksogen. Kuat medan listrik yang diujikan adalah 125; 187,5 dan 250 V/cm
p
Cc
BA
p
Cc
BA
-
EGFP (6,0 kb)
EGFP
Poly A
dengan jumlah kejutan listrik 1 dan 3 kali. Elektroporasi dilakukan dengan tipe kejutan square wave dengan panjang kejutan (pulse length) 30 milidetik dan interval kejutan (pulse interval) 0,1 detik. Konsentrasi DNA plasmid yang digunakan adalah 10 µg/ml dalam TE.
Motilitas dan Kelangsungan Hidup Spermatozoa
Kualitas sperma hasil elektroporasi diukur dengan menentukan derajat motilitasnya. Satu tetes sperma diteteskan dengan menggunakan mikropipet di atas gelas objek kemudian ditutup dengan gelas penutup. Pada tepi gelas penutup diteteskan akuades lalu dilihat pergerakan spermatozoa setelah terkena air di bawah mikroskop dengan perbesaran 10x40. Penilaian motilitas didasarkan pada kriteria banyaknya sperma yang bergerak maju (progresif) dengan skor seperti ditunjukkan pada Tabel 1.
Tabel 1. Kriteria penilaian motilitas spermatozoa
Kriteria Skor
>70% spermatozoa bergerak cepat dengan arah maju dengan pergerakan ekor bervariasi
5,0
55-70% spermatozoa bergerak maju dan beberapa menunjukkan gerakan cepat
4,0
40-55% spermatozoa bergerak maju dan beberapa menunjukkan gerakan cepat
3,0
25-40% spermatozoa menunjukkan gerakan arah maju 2,0 10-25% spermatozoa menunjukkan gerakan arah maju 1,0 1-10% spermatozoa bergerak maju, kebanyakan spermatozoa tidak
bergerak
0,5
semua spermatozoa tidak bergerak 0,0
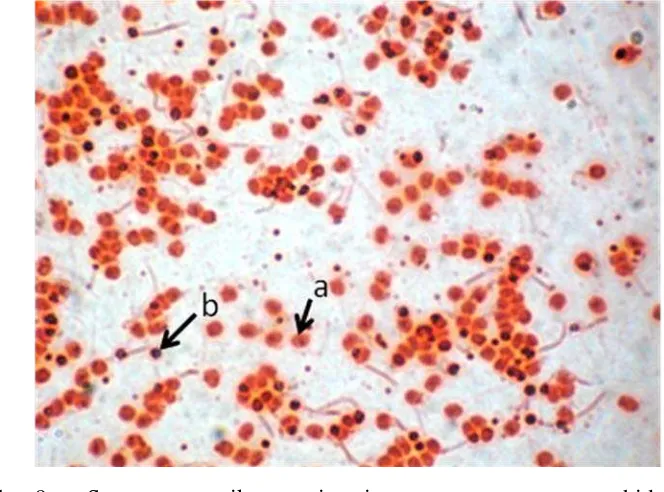
Gambar 9. Spermatozoa ikan patin siam. a = spermatozoa hidup, b = spermatozoa mati
Deteksi Gen EGFP pada Sperma dan Larva Ikan Patin Siam
Ekstraksi DNA. Pada sampel sperma, sebelum dilakukan ekstraksi DNA, sampel sperma dicuci untuk membuang sisa plasmid pada media elektroporasi. Adapun untuk larva, tidak perlu dilakukan pencucian terlebih dahulu. Sperma hasil elektroporasi dicuci dengan cara menambahkan larutan fisiologis dan disentrifugasi dengan kecepatan 3000 rpm selama 1 menit. Supernatan yang terbentuk dibuang, pelet sperma diresuspensi dengan menggunakan 20 µl larutan fisiologis. Proses pencucian pelet sperma diulang sebanyak tiga kali.
isopropanol, lalu tabung mikro dibolak-balik sebanyak 50x dengan hati-hati dan disentrifugasi dengan kecepatan 12.000 rpm selama 10 - 15 menit. Supernatan dibuang dan ditambahkan γ00 μl Etanol 70% dingin. Sentrifugasi dengan kecepatan 12.000 rpm selama 10 menit, supernatan dibuang dan pelet DNA dikering-udarakan. Steril destillated water (SDW) sebanyak 50 μl digunakan untuk melarutkan DNA. Larutan DNA dapat disimpan dalam freezer (suhu -20°C) hingga akan digunakan dalam proses selanjutnya.
Polymerase chain reaction. Keberadaan DNA eksogen (EGFP) di dalam sperma dan larva diamati dengan metode PCR. PCR dilakukan dengan menggunakan primer GFPr (5’-ACG AAC TCC AGC AGG ACC AT-3’) dan GFPf (5’-GGT CGA GCT GGA CGG CGA CG-3’). PCR dilakukan dengan program: 94°C selama 3 menit; (94°C selama 30 detik; 62°C selama 30 detik; 72°C selama 1 menit) sebanyak 35 siklus; 72°C selama 3 menit; dan 4°C (tak hingga). Pengecekan hasil amplifikasi PCR dilakukan dengan elektroforesis menggunakan gel agarosa 0,7%. Produk amplifikasi gen EGFP berada pada ukuran sekitar 600 bp.
Ekspresi Gen EGFP pada Embrio dan Larva Ikan Patin Siam
diukur menggunakan alat pengukur konsentrasi RNA/DNA (GeneQuant). Absorbansi diukur pada panjang gelombang 260 dan 280 nm.
Sintesis cDNA. Sintesis complementary DNA (cDNA) menggunakan kit Ready-To-Go You-Prime First Strand Beads (Amersham pharmacia biotech, USA). Konsentrasi RNA dibuat γ μg dalam γ0 μl DEPC. Larutan RNA diinkubasi pada suhu 65°C selama 10 menit dan kemudian disimpan di atas es. Sampel RNA dipindahkan ke dalam tube FSRMB (First strand reaction mix beads) dan ditambahkan γ μl primer ’dTγ’RACE-VECT” (5’-GTA ATA CGA ATA ACT ATA GGG CAC GCG TGG TCG ACG GCC CGG GCT GGT TTT TTT TTT TTT TTT T-3’) dengan konsentrasi 1 µg/3 µl. Larutan dihomogenkan dan diinkubasi pada suhu 37°C selama 1 jam. cDNA yang terbentuk ditambahkan 30 µl SDW steril dan disimpan dalam refrigerator.
HASIL DAN PEMBAHASAN
Motilitas dan Kelangsungan Hidup Spermatozoa Setelah Elektroporasi
Uji pendahuluan untuk mendapatkan kondisi elektroporasi yang optimal pada sperma ikan patin siam dilakukan dengan menguji berbagai level kuat medan listrik. Hasil pengujian berbagai kondisi kuat medan listrik terhadap motilitas dan kelangsungan hidup spermatozoa dapat dilihat pada Tabel 2.
Tabel 2. Motilitas spermatozoa ikan patin siam yang dielektroporasi pada beberapa tingkat kuat medan listrik
Kuat medan listrik (V/cm) Indeks Motilitas (skor)
Kontrol 4
250 3
500 2
750 1
1000 0,5
1250 0
Kelangsungan hidup spermatozoa menurun setelah dielektroporasi dari 250 sampai 1250 V/cm. Kelangsungan hidup spermatozoa yang dielektroporasi pada 250 V/cm tidak berbeda dengan 500 V/cm, tetapi berbeda dengan 750 V/cm, 1000 V/cm dan 1250 V/cm. Motilitas dan kelangsungan hidup spermatozoa yang dielektroporasi pada 250-500 V/cm menunjukkan hasil terbaik dan tidak berbeda dibandingkan dengan spermatozoa yang tidak dielektroporasi (Gambar 10).
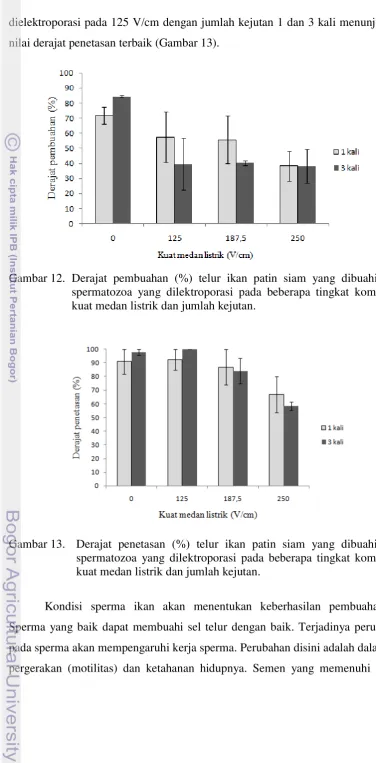
[image:49.595.102.491.50.811.2]Selanjutnya, untuk mendapatkan kondisi elektroporasi yang optimal, sperma dielektroporasi dengan kombinasi kuat medan listrik (125; 187,5 dan 250 V/cm) dan jumlah kejutan listrik (1 dan 3). Peningkatan kuat medan listrik dari 125 sampai 250 V/cm menyebabkan menurunnya motilitas spermatozoa, tetapi jumlah kejutan tidak mempengaruhi motilitas spermatozoa. Spermatozoa yang dielektroporasi pada 125 V/cm menunjukkan nilai motilitas terbaik. Namun demikian, kelangsungan hidup spermatozoa relatif tidak berbeda antar perlakuan dan kontrol kecuali pada spermatozoa yang dielektroporasi pada 250 V/cm dengan jumlah kejutan 3 kali. Pengaruh elektroporasi pada motilitas dan kelangsungan hidup spermatozoa ditunjukkan pada Tabel 3 dan Gambar 11. Berdasarkan data tersebut, sperma yang dielektroporasi pada 125 V/cm dengan jumlah kejutan 1 dan 3 kali memberikan kondisi terbaik untuk elektroporasi pada sperma ikan patin siam.
Tabel 3. Motilitas spermatozoa yang dielektroporasi pada beberapa tingkat kombinasi kuat medan listrik dan jumlah kejutan
Perlakuan Kuat medan listrik (V/cm) 0 (Kontrol) 125 187,5 250
Jumlah kejutan listrik 1 5 3 3 2
3 3 3 2 2
Aplikasi kejutan listrik pada suspensi sel menginduksi polarisasi komponen membran sel dan mengembangkan potensi tegangan di seluruh membran. Pada saat perbedaan potensial antara bagian dalam dan luar membran sel melewati titik kritis, komponen membran di-reorganisasi ke dalam pori dalam area terlokalisasi, dan kemudian sel menjadi permeabel terhadap masuknya makromolekul (Knight, 1981; Knight & Scrutton, 1986). Proses modifikasi permeabilitas membran sel melalui kuat medan listrik disebut elektroporasi. Perubahan permeabilitas bersifa