i
BIOSENSOR SUPEROKSIDA MENGGUNAKAN EKSTRAK
PROTEIN Deinococcus radiodurans DIIMOBILISASI
DENGAN IKAT SILANG GLUTARALDEHID
MUHAMMAD RIDHO AFIFI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2016
iii
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Biosensor Superoksida Menggunakan Ekstrak Protein Deinococcus radiodurans Diimobilisasi dengan Ikat Silang Glutaraldehid adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2016
Muhammad Ridho Afifi
RINGKASAN
MUHAMMAD RIDHO AFIFI.Biosensor SuperoksidaMenggunakan Ekstrak Protein Deinococcus radiodurans Diimobilisasi Dengan Ikat Silang Glutaraldehid. Dibimbing oleh DYAH ISWANTINI, NOVIK NURHIDAYAT dan DEDEN SAPRUDIN.
Antioksidan sangat diperlukan oleh tubuh manusia, pada dasarnya tubuh manusia memiliki antioksidan endogen yaitu enzim katalase, peroksidase, superoksida dismutase (SOD), dan glutationa S-transferase. Namun jika terjadi paparan radikal bebas yang berlebih ke dalam tubuh, diperlukan antioksidan eksogen yang biasanya bersumber dari makanan dan bahan alam. Kapasitas antioksidan adalah kemampuan suatu bahan dalam mengukur senyawa penangkal radikal bebas. Pengukuran antioksidan menggunakan metode spektrofotometri terkendala dalam preparasi sampel dan memerlukan waktu pengukuran yang lama. Oleh karena itu, dibutuhkan metode yang lebih mudah, akurat, cepat, dan sensitif dalam penentuan kapasitas antioksidan seperti metode biosensor.
Biosensor superoksida menggunakan ekstrak protein dari mikroba
Deinococcus radiodurans yang diimobilisasi pada matriks
karboksimetilselulosa-gelatin-zeolit diikat silang glutaraldehid (CMC-G-Z-glutaraldehid) merupakan salah satu cara untuk mengoptimumkan kinerja biosensor Superoksida sehingga dapat digunakan secara efektif. Tujuan penelitian ini adalah menghasilkan stabilitas yang lama.
Ekstrak protein dilisis dari D. radiodurans menggunakan metode ultrasonikasi yang menghasilkan konsentrasi protein 1774.89 ppm. Proses penghancuran dinding sel dibantu dengan penyinaran sinar UV yang berfungsi untuk inisiasi protein SOD sehingga mampu ekstrak protein keluar dari inti sel. Ekstrak protein diimobilisasi pada elektroda pasta karbon dengan CMC-gelatin-zeolit diikat silang glutaraldehid. Biosensor ini dilakukan optimasi dengan variasi konsentrasi zeolit, konsentrasi glutaraldehid, konsentrasi ekstrak protein dan pH menggunakan software Minitab metode respon surface methode.
Hasil dari optimasi biosensor yang diperoleh yaitu konsentrasi zeolit 5 mg/ml, konsentrasi glutaraldehid 0.005M, konsentrasi ekstrak protein 1075 ppm dan pH 7. Hasil optimasi tersebut digunakan untuk mengukur kinerja analitik dari biosensor yang meliputi stabilitas, limit deteksi, limit kuantisasi dan linieritas. Pengujian stabilitas elektroda dengan ikat silang glutaraldehidmenghasilkan waktu stabilitas selama 24 jam dengan sisa aktivitas 67.74%, sedangkan elektroda tanpa ikat silang glutaraldehid bertahan selama 12 jam dengan sisa aktivitas 65.66%. Pengujian limit deteksi dengan elektroda pada CMC-G-Z-glutaraldehid dihasilkan sebesar 77.84 µM, dan limit kuantisasi sebesar 259.5 µM. Linieritas dihasilkan rentang pengukuran 0.1-0.8 mM xantina dengan persamaan y = 1.5549x + 0.1617 dan r2 = 0.9905. Penggunaan ekstrak protein dari D. radiodurans dimobilisasi dalam matriks CMC-G-Z dengan ikat silang oleh glutaraldehid dapat menjadi biosensor superoksida alternatif untuk pengujian rutin dan dapat dikembangkan sebagai prototipe.
iii
SUMMARY
MUHAMMAD RIDHO AFIFI.Antioxidant Biosensor Using Deinococcus
radiodurans Protein Extract Immobilized with Cross-linked by
Glutaraldehyde.Supervised byDYAHISWANTINI,
NOVIKNURHIDAYATandDEDENSAPRUDIN.
Antioxidants areneededby the human body, the humanbody actuallyhasan endogen antioxidantenzymescatalaseie, peroxidase, superoxidedismutase (SOD), andglutationS-transferase. But if there ismoreexposure to free radicalsin the body, which isnormallyrequiredexogenantioxidantsderived from foodandnaturalingredients. Antioxidant capacityisthe ability of amaterialto measurefree radical antidotecompound. Measurementof antioxidantsusingspectrophotometricmethodshaveconstraints insamples preparationandtakemeasurementsof time.Therefore, it takes an easier method, accurate, rapid, andsensitiveto determination ofantioxidant capacitysuch asbiosensormethods.
AntioxidantsbiosensorusingproteinextractsofmicrobesDeinococcusradiodura nsimmobilizedon a matrix ofcarboxymethylcellulose-gelatin-zeolitecross-linked by glutaraldehyde is one wayto optimize theperformance ofbiosensorsantioxidantsthatcan be used effectively. The purposeof thisresearchis to producea longstabilityand performanceofthe biosensorfor the betterasthe detection limit, quantitylimitandlinearity.
Proteins was extracted from D. radiodurans by ultrasonic method that produce a protein concentration of 1774.89 ppm. Extract proteins was immobilized on carbon paste electrodes (CPE) with CMC-gelatin-zeolites by crosslinked glutaraldehyde. This biosensor optimization was performed by variation the concentration of zeolite, glutaraldehyde, protein extracts and pH by Minitab software method of response surface method.
The resultsofthe optimizationbiosensor wasobtained by theconcentration ofzeolite5mg/ml, glutaraldehydeconcentration0.005M, the concentration ofthe proteinextracts of1075ppmanda pH of7. Theresults ofsuch optimizationis usedto measure theanalytical performanceof thebiosensorwhich includestability, limitof detection, limit kuatisasiandlinearity. Testing the stability of the electrode with glutaraldehyde resulted in a 24 hour period of stability during the rest of the activity of 67.74%, while the electrodes without glutaraldehyde to survive for 12 hours with the remaining 65.66% of activity. Testing the limits of detection with electrodes on the CMC-G-Z-glutaraldehyde generated at 77.84 µM, and the limit of quantitation of 259.5 µM. Measurement linearity resulted range 0.1-0.8 mM xanthine with the equation y = 1.5549x + r2 = 0.1617 and 0.9905.The use of protein extracts of D. radiodurans were mobilized in a matrix CMC-G-Z with crosslinked by glutaraldehyde can be a alternative antioxidant biosensor for routine assay and can be developed as a prototype.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
v
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini dalam bentuk apa pun tanpa izin IPB
i
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Kimia
BIOSENSOR SUPEROKSIDA MENGGUNAKAN EKSTRAK
PROTEIN Deinococcus radiodurans DIIMOBILISASI
DENGAN IKAT SILANG GLUTARALDEHID
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2016
iii
Judul Tesis :Biosensor Superoksida MenggunakanEkstrak Protein Deinococcus
radiodurans Diimobilisasi dengan Ikat Silang Glutaraldehid
Nama : Muhammad Ridho Afifi NIM : G451130321
Disetujui Oleh Komisi Pembimbing
Prof Dr Dyah IswantiniP, MScAgr Ketua
Dr Novik Nurhidayat Dr Deden Saprudin, MSi
Anggota Anggota
Diketahui oleh
Ketua Program Studi Kimia
Prof Dr Dyah Iswantini P, MScAgr
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
v
PRAKATA
Bismillahirrahmaanirrahiimi
Alhamdulillah puji dan syukur penulis panjatkan kepada Allah subhanahu
wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Shalawat serta salam tak lupa selalu tercurah kepada junjungan Nabi besar Muhammad SAW, sahabat, keluarga dan pengikutnya hingga akhir zaman. Ucapan terima kasih yang tak ternilai kepada Ayahanda dan Ibunda tercinta, Drs Erwan Zaini dan Dra Emi Suryani, serta saudara saudari tercinta Rifa’atul Mahmudah dan Hafidz Surya Afifi yang dengan kesabaran dan keikhlasan telah memberikan dorongan moral, material dan doa yang tulus. Selain itu, penulis juga menyampaikan rasa terima kasih yang dalam kepada Istri tercinta Zahratul Aini S.Si.
Penulis mengucapkan terima kasih yang tulus kepada Prof Dr Dyah Iswantini P M.Agr selaku Ketua Komisi Pembimbing, Dr Novik Nurhidayat dan Dr Deden Saprudin M.Si selaku Anggota Komisi Pembimbing, atas segala curahan waktu, bimbingan, arahan, serta dorongan moral kepada penulis. Tidak lupa ucapan terima kasih kepada staf Laboratorium Bersama IPB, Laboratorium Kimia Fisik IPB dan Laboratorium Genetik Puslit Biologi LIPI serta teman-teman di Departemen Kimia IPB atas bantuan yang diberikan kepada penulis dalam menyelesaikan tesis ini
Semoga karya ilmiah ini bermanfaat.
Bogor, Ferbuari 2016
DAFTAR ISI
DAFTAR TABEL vi DAFTAR GAMBAR vi DAFTAR LAMPIRAN vi PENDAHULUAN 1 Latar Belakang 1 Perumusan Masalah 2 Tujuan Penelitian 2 Manfaat Penelitian 3Ruang Lingkup Penelitian 3
METODE 3
Bahan 3
Alat 3
Prosedur Analisis Data 4
HASIL DAN PEMBAHASAN 7
Pembuatan Nanopartikel Zeolit 7
Penumbuhan Sel D. radiodurans dan Lisis Ekstrak Protein 7
Pemilihan Elektroda Pasta Karbon (EPK) 8
Imobilisasi Ekstrak Protein D. radiodurans 9
Optimasi Biosensor 10
Stabilitas Elektroda Biosensor 13
Penentuan Parameter Analitik Elektroda 14
SIMPULAN DAN SARAN 16
Simpulan 16
Saran 16
DAFTAR PUSTAKA 16
LAMPIRAN 19
vii
DAFTAR TABEL
1. V
ariasi perlakuan ekstrak D. radiodurans 4
2. A
nalisis pengaruh faktor terhadap arus 11
3. P
erbandingan parameter analitik biosensor bebasis mikroba 15
DAFTAR GAMBAR
1. S
kema imobilisasi ekstrak protein D. radiodurans 5
2. P
erlakuan induksi penyinaran UV dan waktu sonikasi terhadap kosentrasi
protein 8
3. V
oltamogram siklik pada pengukuran larutan K3[Fe(CN)6] 1mM 9
4. V
oltamogram aktivitas ekstrak protein D. radiodurans 10
5. (
a) Pengaruh konsentrasi glutaraldehid dengan konsentrasi protein,(b) pengaruh pH dengan konsentrasi protein,(c) pengaruh konsentrasi zeolit dengan konsentrasi protein terhadap perubahan arus puncak 12
6. S
tabilitas elektrodabiosensor 13
7. H
ubungan aktivitas ekstrak protein dengan konsentrasi xantina 14
8. L
inieritas ekstrak protein terimobilisasi dan tidak imobilisasi 15
DAFTAR LAMPIRAN
1. B
agan alir penelitian 19
2. H
asil pengujian PSA terhadap zaolit 20
3. H
asil pengukuran OD pada penumbuhan D. radiodurans dan konsentrasi ekstrak protein dari D. radiodurans dengan spektrofotometer 20
4. O
ptimasi variabel bebas dari biosensor 21
5. H
6. H asil uji hubungan konsentrasi substrat xantina dengan aktivitas ekstrak
protein 22
7. P
ix
1 PENDAHULUAN
Latar Belakang
Tubuh manusia memiliki antioksidan endogen yaitu enzim katalase, peroksidase, superoksida dismutase (SOD), dan glutationa S-transferase. Namun jika terjadi paparan radikal bebas yang berlebih ke dalam tubuh, diperlukan antioksidan eksogen yang biasanya bersumber dari makanan. Oleh karena itu, sangat dibutuhkan suatu metode pengukuran yang tepat untuk mengukur sifat-sifat antioksidan pada berbagai jenis sampel baik antioksidan alami maupun sintesis. Kapasitas antioksidan adalah kemampuan suatu bahan dalam mengukur senyawa penangkal radikal bebas. Metode umum untuk penentuan kapasitas metode spektrofotometri (Khalaf et al.2008). Pengukuran antioksidan menggunakan metode spektrofotometri masih terkendala dalam preparasi sampel dan memerlukan waktu yang lama. Oleh karena itu, dibutuhkan metode yang lebih mudah, akurat, cepat, dan sensitif dalam penentuan kapasitas antioksidan seperti metode biosensor.
Salah satu metode biosensor antioksidan menggunakan enzim superoksida dismutase (SOD) yang memiliki korelasi yang baik seperti dengan metode spektrofotometri dan spektrofluorimetri dalam menentukan kapasitas antioksidan(Campanella 2004). Penggunaan enzim lebih banyak diaplikasikan dalam biosensor karena spesifik aktifitas dan sensitif terhadap analit (Canbay et al. 2015). Salah satu kelemahan penggunaan enzim yaitu sangat mahal untuk pengujian rutin (Byfield & Abuknesha 1994; Akyilmaz & Dinçkaya 2005). Oleh karena itu penggunaan mikroba yang menghasilkan enzim tersebut adalah salah satu solusi untuk menekan biaya karena tidak memerlukan pemurnian enzim (Byfield & Abuknesha 1994). Mikroba menjadi alternatif dalam fabrikasi karena dapat menghasilkan produk dengan jumlah yang besar melalui kultur sel (Byfield dan Abuknesha 1994).
Salah satu mikroba di Indonesia yang berpotensi penghasil SOD yaitu
Deinococcus radiodurans (Iswantini et al. 2013). Mikroba ini tahan terhadap banyak agen yang dapat menyebabkan mutasi pada DNA, seperti radiasi ion, sinar ultraviolet, dan banyak lainnya. Protein D. radiodurans yang diimobilisasi pada elektroda pasta karbon menghasilkan aktivitas SOD lebih tinggi daripada enzim murni SOD. Weniarti (2011) melaporkan bahwa penggunaan nanokomposit zeolit sebagai media imobilisasi protein D. radiodurans memberikan afinitas protein D.
radiodurans lebih rendah daripada enzim SOD sehingga tidak mudah jenuh oleh
substrat. Selain D. radiodurans, mikroba yang dapat digunakan sebagai biosensor antioksidan yaitu E. coli. Namun stabilitas E. coli masih rendah jika dibandingkan dengan D. radiodurans dalam biosensor antioksidan (Iswantini et al.2013).
Penelitian biosensor yang berbasis D. radiodurans secara berkala dilakukan untuk mengoptimalkan aktivitas dan stabilitas yang lebih baik. Mateo et al. (2007) menyatakan bahwa metode yang dapat digunakan untuk menjaga stabilitas enzim adalah dengan melakukan imobilisasi pada nanomaterial. Penggunaan zeolit
2
dalam matriks imobilisasi enzim biosensor telah banyak dilakukan karena beberapa sifat dari zeolit yang mendukung seperti ukuran selektivitas, muatan, interaksi hidrofobik/hidrofilik, dan kemampuan bertahan pada suhu tinggi, oleh karena itu digunakan zeolit untuk lingkungan mikro enzim (Carvalho et al. 2007). Zeolit alam banyak terdapat di Indonesia salah satunya zeolit bayah, yang sudah banyak diaplikasikan sebagai absorben dalam beberapa penelitian. Zeolit bayah mempunyai kandungan terbesar yaitu klipnotiloit dan mordenit. Disamping dari kemampuan zeolit alam sebagai matriks imobilisasi, kelimpahan, mudah diperoleh dan biaya murah dari zeolit alam menjadi pendukung dalam penelitian ini untuk matriks imobilisasi. Penggunaan zeolit bayah juga sebagai biodiversitas Indonesia sangat mendukung untuk diaplikasikan lebih luas dalam penelitian-penelitian.
Nanopartikel zeolit sebagai pengimobilisasi protein D. radiodurans yang dilakukan oleh Wijayanti (2014) menghasilkan limit deteksi yang rendah dan sensitivitas yang tinggi. Akan tetapi, stabilitas dari elektroda berbasis protein D.
radiodurans masih rendah sehingga perlu ditingkatkan dengan metode
penggabungan nanopartikel zeolit dan material lain sebagai pengimobilisasi protein D. radiodurans. Kocabay et al. (2012) melakukan penelitian dengan matriks imobilisasi menggunakan karboksimetil selulosa (CMC)-gelatin-glutaradehid untuk enzim SOD menghasilkan waktu stabilitas yang lama. Stabilitas yang bagus dihasilkan dari penelitian Kocabay karena enzim SOD di ikat silang menggunakan glutaraldehida dan polimer (mengandung gelatin) sehingga enzim SOD akan terimobilisasi lebih kuat. Pada penelitian ini menggunakan polimer gelatin yang di ikat silang oleh glutaraldehida untuk protein D.radiodurans sehingga menghasilkan stabilitas yang lebih bagus. Keterbaruan biosensor untuk pengujian antioksidan berdasarkan D. radiodurans diimobilisasi dengan ikat silang glutaraldehid mampu mengoptimalkan kinerja biosensor terutama stabilitas sehingga dapat digunakan sebagai alat untuk pengujian rutin kapasitas antioksidan yang murah dan dapat dikembangkan sebagai prototipe.
Perumusan Masalah
Peningkatan stabilitas protein D.radiodurans pada matriks nanopartikel zeolit hanya 8 jam dengan aktivitas 58.93% (Wijayanti 2014). Penggunaan matriksCMC-gelatin-zeolit sebagai pengimobilisasi ekstrak protein D.
radiodurans dengan agen ikat silang glutaraldehid, apakah mampu meningkatkan
kinerja dan kestabilan biosensor berdasarkan ekstrak protein dari bakteri D.
radiodurans.
Tujuan Penelitian
Menentukan kapasitas biosensor berbasis proteinD. radioduransyang diimobilisasi pada CMC-gelatin-zeolitikat silang glutaraldehid berdasarkan sifat analitiknya yaitu stabilitas, sensitivitas, dan limit deteksi pengukuran
3
Manfaat Penelitian
Penelitian ini menggunakan fase padat yang berupa CMC-gelatin-zeolit sebagai fase padat penyangga glutaraldehid sebagi agen ikat silang untuk ekstrak protein D. radiodurans yang diharapkan dapat meningkatkan kinerja analitik dalam biosensor. Pada berbagai aspek seperti konsenstrasi protein dari D.
radiodurans, stabilitas, linieritas, limit deteksi dan limit kuantisasi untuk dapat
membuat prototipe dari suatu model biosensor.
Ruang Lingkup Penelitian
Penelitian terdiri atas beberapa tahap yaitu pembuatan elektroda pasta, aktivasi zeolit dan pembuatan nanopartikel, penumbuhan dan ekstraksi protein dari D. radiodurans, imobilisasi protein dengan ikat silang glutaraldehiddan pengukuran elektrokimia seperti stabilitas, linieritas, limit deteksi dan limit kuantisasi.
2 METODE
PenelitiandilaksanakandaribulanOktober2014sampaidenganAgustus2015d i Laboratorium Genetik Puslit Biologi LIPI, Laboratorium Kimia Fisikdan Laboratorium Bersama Departemen Kimia Fakultas Pertanian IPB.
Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah sel bakteri D.
radiodurans, zeolit alam dari Bayah, gelatin, karboksimetilselulosa, glutaraldehid,
media cair LB untuk pertumbuhan bakteri D. radiodurans, grafit, ferosen, parafin cair, dimetil sulfoksida (DMSO), membran dialisis, xantina oksidase, xantina dan bufer fosfat.
Alat
Alat-alat yang digunakan dalam penelitian ini adalah eDAQ Potensiostat– Galvanostat yang dilengkapi perangkat lunak Echem v2.1.0 dengan sistem 3 elektroda (elektroda Ag/AgCl sebagai elektroda pembanding, elektroda pasta karbon sebagai elektroda kerja, dan elektroda platina sebagai elektroda bantu),
Scanning Electron Microscope, Particle Size Analyzer, Planetary Ball Mill,
vakum, laminar air flow, inkubator, High Speed Refrigated Centrifuge KUBOTA 6500, autoklaf, Ultrasonic Homogenizer UH-150, Spektroscopy UV-Pharmaspec 1700, pipet mikro, batang gelas, sel elektrokimia dan alat-alat gelas lainnya.
4
Prosedur Analisis Data Pembuatan Elektroda Pasta Karbon (Trivadila 2011)
Elektroda pasta karbon dibuat dengan cara melarutkan 3 mg ferosena dalam 1 mL DMSO dan ke dalam larutan tersebut ditambahkan 100 mg grafit. Campuran didiamkan selama 2 jam. Setelah 2 jam, pelarut dikeringkan dalam oven suhu 105°C sampai kering. Kemudian campurkan antara grafit dan parafin cair dengan perbandingan 2:1hingga membentuk pasta. Kemudian pasta karbon dimasukkan ke dalam badan elektroda hingga memadat sampai ke permukaan kaca. Permukaan kaca elektroda dihaluskan dan dibersihkan dengan ampelas dan kertas minyak.
Pembuatan Nanopartikel Zeolit (Arif 2011)
Sebanyak 50 gram zeolit Bayah diaktivasi dengan menambahkan 250 mL HCl 3 M ke dalam gelas piala dan diaduk selama 1 jam. Zeolit disaring, dan dicuci dengan akuades sampai pH netral. Setelah pH netral dan bebas klorin, zeolit dikeringkan pada suhu 300 oC selama 3 jam. Zeolit yang telah dikondisikan kemudian digerus dengan alat planetary ball mill. Penumbuhan Sel D. radiodurans dan Lisis Protein (Chou dan Tan 1991)
D. radiodurans dari kultur murni ditumbuhkan pada 25 mL media LB cair.
Sebelum penumbuhan diberi perlakukan variasi penyinaran UV selama 0, 3, dan 5 menit. Bakteri diinkubasi pada 30 oC dan diukur pada panjang gelombang 600 nm sampai nilai OD (Optical Density) 0.5 – 0.6. Selanjutnya sel dipanen dengan sentrifugasi 7000 x G, 4 oC selama 10 menit untuk memisahkan sel mikrob dengan media. Selanjutnya sel (pelet) dicuci sebanyak 3 kali ulangan dengan menggunakan bufer fosfat pH 7.0 dan disuspensikan kembali dalam larutan bufer fosfat pH 7.0. Suspensi sel diultrasonikasi pada denyut 80% untuk menghancurkan dinding sel mikrob dengan variasi waktu selama 0, 2, dan 4 menit. Selama ultrasonikasi suspensi sel didinginkan dalam es. Sel disentrifugasi 10.000 x G, 4 oC selama 30 menit untuk memisahkan supernatan dengan pellet. Ekstrak kasar (crude extract) protein berada di supernatant dan disimpan dalam suhu 4 °C
Tabel 1Variasi perlakuan ekstrak D. radiodurans
No Waktu Penyinaran UV (Menit) Waktu Ultrasonikasi (Menit)
1 0 0 2 0 2 3 0 4 4 3 0 5 3 2 6 3 4 7 5 0 8 5 2 9 5 4
5
Ekstrak sitoplasma hasil dialisis selanjutnya diukur nilai serapannya pada panjang gelombang 260 dan 280 nm untuk mengetahui konsentrasi protein yang mengandung protein enzim SOD. Perhitungan ekstrak protein menggunakan persamaan sebagai berikut :
Kosentrasi protein (mg/mL) = 1.55D280 – 0.76D260
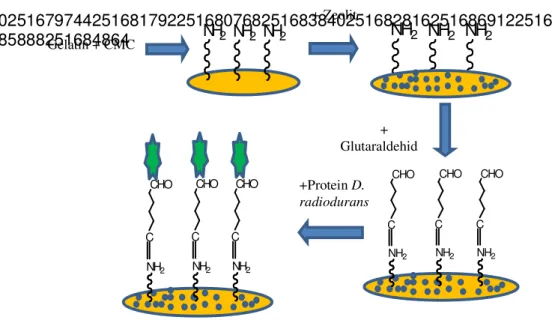
Imobilisasi Ekstrak Protein D. radiodurans (Modifikasi Kocabay et al. 2012; Emregul et al. 2013)
Disiapkan campuran polimer (CMC-gelatin) dengan perbandingan (0,1 w/w) dalam 10 ml buffer fosfat. Didispersikan 50-100 mg nanopartikel zeolit dalam larutan polimer tersebut. Dicampur 30 µL CMC-G-Z, 60 µL protein D.
radiodurans (dalam buffer fosfat), 10µL glutaraldehid 0.005 M. Didiamkan
hingga pelarutnya menguap. Selanjutnya permukaan elektroda pasta karbon dilapisi dengan membran dialisis, ditutup dengan jaring nilon, dan diikat dengan parafilm.
02516797442516817922516807682516838402516828162516869122516 85888251684864
Gambar 1Skema Imobilisasi Ekstrak Protein D. radiodurans(modifikasiEmregulet
al.2013)
Pengukuran Elektrokimia
Pengukuran elektrokimia dilakukan dengan menggunakan seperangkat alat potensiostat/galvanostat eDAQ dan komputer beserta perangkat lunak pengolah data Echem v2.1.0. Elektroda yang digunakan yaitu elektroda Ag/AgCl, platina dan elektroda pasta karbon berturut-turut sebagai elektroda standar, pembantu dan kerja. Gelatin + CMC NH2 NH2 NH2 + Zeolit NH2 NH2 NH2 NH2 C CHO NH2 C CHO NH2 C CHO + Glutaraldehid +Protein D. radiodurans NH2 C CHO NH2 C CHO NH2 C CHO
6
Parameter pengurukuran diatur sebagai berikut : Mode : Cyclic Initial E : 0 mV Final E : 0 mV Rate : 200 mV/s Step W : 12.5 ms Upper E : 1000 mV Lower E : 0 mV
Sebanyak 1.9 mL larutan bufer fosfat 0.05 M pH 7 ditambahkan ke dalam sel elektrokimia dan puncak arus anoda yang terbentuk diamati sebagai blanko. Selanjutnya ditambahkan 100 µL larutan Xantina Oksidase 0.1 U/mL dan substrat xantina 2.1 mM sebanyak 1 mL ke dalam sel elektrokimia. Setelah penambahan setiap zat ke dalam larutan, perubahan arus yang terjadi diamati hingga mencapai arus keadaan tunak secara runut. Sehingga akan terbentuk reaksi seperti dibawah :
Xantina + H2O + O2XOD Asam urat + 2H+ + O2
.-2H+ + O2.- SODH2O2 + O2
Optimasi Biosensor
Optimasi dilakukan dengan kombinasi pada variabel pH (7-9), konsentrasi ekstrak protein (500-1500 µg/ml), konsentrasi glutaraldehid (0-0.010M), konsentrasi zeolit (5-10 mg/ml). Metode yang digunakan untuk optimasi biosensor berbasis ekstrak protein dari D. radiodurans adalah Response Surface
Methode dengan memasukkan kombinasi factor-faktor peubah bebas pada suatu
perangkat lunak statistika MINITAB. Selanjutnya kombinasi yang telah dimasukkan akan diolah sehingga dihasilkan beberapa kombinasi faktor peubas bebas dan percobaan dilakukan sesuai dengan kombinasi faktor-faktor peubah bebas seperti pada Lampiran 2.
Penentuan Stabilitas Elektroda (Fadhilah 2013)
Stabilitas elektroda ditentukan dari pengukuran 1 elektroda biosensor dengan jarak waktu tertentu. Nilai aktivitas yang diperoleh pada pengukuran awal dianggap 100%. Aktivitas diukur pada setiap waktu tertentu dengan aktivitas yang tersisa.
Pengujian Parameter Analitik Elektroda
Kinerja elektroda biosensor diuji untuk CMC-G-Z-protein dan EPK-CMC-G-Z-glutaraldehid-protein. Kinerja yang ditentukan adalah linearitas, limit deteksi (LOD) dan limit kuantisasi (LOQ) (Harmita 2004).
7
Keterangan :
Sb : Simpangan baku dari respon analitik S : Slope dari persamaan garis
3 HASIL DAN PEMBAHASAN
Pembuatan Nanopartikel Zeolit
Penelitian inimenggunakan zeolit alam dari Bayah yang berupa tipe zeolit mordenit dan klinoptilolit dengan rasio Si:Al yaitu 5:1.Zeolit Bayah merupakan zeolit alam yang masih terdapat banyak pengotor, sehingga perlu dilakukan pengondisian untuk menghilangkan pengotor. Salah satunya dengan perlakuan aktivasi menggunakan asam HCl 3 M. Proses aktivasi dengan menggunakan asam dealuminasi dan dekationisasi yaitu keluarnya Al dan ion-ion anorganik dalam zeolit sehingga akan bertambah luas permukaan zeolit karena berkurangnya ion-ion anorganik yang menutupi pori, selain itu dapat meningkatkan perbandingan rasio Si:Al (Ertan dan Ozkan 2005) seperti pada reaksi di bawah.
Zeolit + HCl(aq) zeolit + AlCl3(aq)
Selanjutnya dilakukan pembuatan nanopartikel zeolit dengan cara top down dengan penggilingan menggunakan alat planetary ball milling (PBM) secara basah menggunakan metanol dan ammonium serium sulfat 5% sebagai grinding
agent. Hasil yang diperoleh dari ukuran zeolit dengan ukuran rerata 386.7 nm.
Hasil ini lebih besar dari penelitian Wijayanti (2014) yang memperoleh ukuran rerata 97.5 nm. Setelah proses penggilingan harus diperhatikan bahwa partikel-partikel kecil tersebut dapat teraglomerasi sehingga perlu dilakukan ultransonikasi dan segera mungkin untuk dilakukan pengukuran ukuran partikel (dengan PSA). Ukuran nanopartikel yang diperoleh cukup besar disebabkan partikel-partikel setelah pengeringan mudah teraglomerasi sehingga ukurannya semakin besar (Abdullah 2008).Penggilingan menggunakan PBM dapat menghasilkan panas, panas tersebut dapat merusak struktur zeolit, sehingga perlu dilakukan karakterisasi kristanilitas dan struktur zeolit.
Penumbuhan Sel D. radiodurans dan Lisis Ekstrak Protein
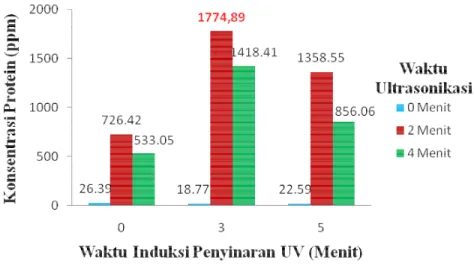
D. radiodurans ditumbuhkan dalam media LB cair selama ± 18 jam dengan bantuan shaker (aerob) pada suhu ruang. Dilakukan beberapa variasi perlakuan induksi penyinaran UV pada saat penumbuhan sel D. radiodurans dan waktu ultrasonikasi untuk melisis sel sehingga diperoleh ekstrak protein. Pada Gambar 2 menjelaskan bahwa waktu induksi penyinaran UV dalam mempengaruhi konsentrasi protein diperoleh yang optimum yaitu 3 menit. D.
8
radioduransmerupakan mikroba yang mampu bertahan dalam lingkungan ekstrim
seperti sinar radiasi UV, pemanasan, pengeringan dehidrasi dan lingkungan asam. Gen eksogen (irrE) yang terdapat dalam D. radiodurans yang bertanggung jawab pada regulasi ekspresi gen recA dan pprA yaitu gen yang memiliki kemampuan bertahan dalam kondisi lingkungan ekstrim (Earl et al. 2002). D. radiophilus yang juga dapat bertahan dalam lingkungan ekstrim dan menghasilkan SOD. Mn-SOD yang dihasilkan oleh D. radiophilus akan meningkat seiring dengan meningkatnya tekanan lingkungan seperti penyinaran UV, namun apabila radiasi sinar UV terlalu berlebih maka Mn-SOD yang dihasilkan yang menurun (Yun dan Lee 2003). Oleh karena itu produksi Mn-SOD dalam sel bakteri D. radiodurans dan juga aktivitasnya dapat diinduksi dengan lingkungan yang ekstrim seperti induksi penyinaran UV. Pada induksi penyinaran UV selama 5 menit dapat menghancurkan sel D. radiodurans sehingga pertumbuhan sel akan menurun, dikarenakan penyinaran UV yang berlebihan.
Gambar 2 Perlakuan induksi penyinaran UV dan waktu sonikasi terhadap kosentrasi protein
Waktu ultrasonikasi untuk memperoleh protein dari sel yang optimum, yaitu 2 menit dengan konsentrasi protein 1774.89 ppm. Pada perlakuan waktu ultrasonikasi 0 menit tidak diperoleh protein yang tinggi dikarenakan protein Mn-SOD merupakan enzim intraselular sehingga perlu menggunakan ultrasonikasi. Sedangkan pada perlakuan waktu ultrasonikasi 4 menit konsentrasi protein menjadi turun, hal ini disebabkan protein dalam sel dapat terdenaturasi, sehingga konsentrasi dari ekstrak protein menjadi turun. Umumnya sel bakteri diekstrak dengan metode ultrasonikasi selama 30-60 detik, sedangkan untuk jamur (dinding sel tebal) selama 2-10 menit (Ghosh R 2006). Dinding sel D. radiodurans memiliki dinding sel yang tebal yang menyebabkan waktu ultasonikasi lebih lama (Trivadila 2011).
Pemilihan Elektroda Pasta Karbon (EPK)
Elektroda kerja menggunakan elektroda pasta karbon (EPK) termodifikasi ferosen dibuat dengan campuran komposisi 55 mg grafit, 35µL paraffin dan
9
ferosen, kemudia elektroda dikarakterisasi respon arusnya dengan menggunakan K3[Fe(CN)6] 1mM dengan bantuan elektroda pembanding Ag/AgClyang memiliki
nilai potensial yang telah diketahui konstan dan elektroda pendukung Pt/TiO yang berfungsi untuk memperkecil kesalahan dari tahanan sel dalam mengontrol potensial elektroda kerja. Elektoda Pt/TiO tersebut digunakan untuk meminimalkan kesalahan yang diakibatkan oleh adanya lapisan produk reaksi yang ada pada elektroda. Lapisan ini akan mengakibatkan adanya hambatan tambahan pada sel elektrokimia. Sehingga elektoda standard dan elektroda kerja dapat melakukan pengukuran dengan hambatan sel yang minimal (Ekananda 2007).
Elektroda pasta karbon yang mempunyai respon arus yang konstan dan terbaik yang akan dipilih untuk pengukuran selanjutnya menggunakan ekstrak protein. Hasil pengamatan respon arus sebesar ± 6 µA dengan tegangan 0.3–0.4V, penelitian yang dilakukan Weniarti (2011) menggunakan EPK menunjukkan tegangan yang sama yaitu 0.3V. Pengukuran elektroda dengan K3[Fe(CN)6]
menggunakan sistem voltametri yang melibatkan reaksi reduksi dan oksidasi seperti reaksi dibawah ini :
Reaksi reduksi [Fe(CN)6]3- + e- [Fe(CN)6]
4-Reaksi oksidasi [Fe(CN)6]4- [Fe(CN)6]3- + e
-0 ,-0 0 ,2 0 ,4 0 ,6 0 ,8 1 ,0 -8 ,0 u -6 ,0 u -4 ,0 u -2 ,0 u 0 ,0 2 ,0 u 4 ,0 u 6 ,0 u I ( µ A ) E ( V )
Gambar 3Voltamogram siklik pada pengukuran larutan K3[Fe(CN)6] 1mM
Imobilisasi Ekstrak Protein D. radiodurans
Imobilisasi pada permukaan penyangga padat bertujuan untuk menjaga aktivitas katalitiknya. Salah satu metode imobilisasi yaitu pada fase padat (CMC-G-Z) dengan ikat silang menggunakan glutaraldehid.
Imobilisasi ekstrak protein dengan menggunakan CMC-G-Z dan glutaraldehid bertujuan untuk meningkatkan stabilitas dan aktivitas dari ekstrak protein. Proses imobilisasi yang dilakukan yaitu dengan ikat silang antara glutaraldehid dengan ekstrak protein pada fase padat CMC-G-Z. Setelah proses imobilisai elektroda pasta karbon dilapisi oleh membran dialisis yang berfungsi sebagai perantara difusi substrat masuk menuju ekstrak protein dan untuk lebih menjaga ekstrak protein keluar dari sistem imobilisasi.
10
Membran dialisis yang digunakan adalah Thermo ScienctificSnake Skin
Dialysis Tubing, 10K MWCO (Molecular Weight Cut Off) sehingga ekstrakprotein yang mengandung enzim SOD akan tertahan karena memiliki bobot molekul lebih dari 10 kDa. Namun pori-pori membran dialisis dapat melewatkan substrat radikal superoksida dan berinteraksi dengan enzim SOD.
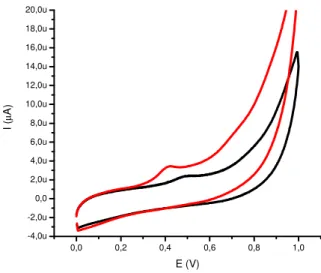
Voltamogram dari imobilisasi ekstrak protein dapat dilihat pada Gambar 4. Aktivitas ekstrak protein dapat diketahui dengan adanya puncak anoda pada tegangan 0.4V setelah ditambahkan Xantina dan Xantina oksidase pada larutan sel elektrokimia. Perubahan arus yang lebih tinggi dihasilkan dari imobilisasi ekstrak protein dengan menggunakan ikat silang glutaraldehid sedangkan tanpa glutaraldehid dihasilkan arus yang lebih rendah. Peningkatan arus dengan glutaraldehid dapat menjelaskan bahwa agen ikat silang dapat mengikat ekstrak protein secara optimal sehingga aktivias dari ekstrak protein untuk bereaksi dengan substrat lebih tinggi (Kocabay et al. 2012).
Gambar 4 Voltamogram aktivitas ekstrak protein D. radiodurans (—) EPK- CMC-G-Z-Protein dan (—) EPK-CMC-G-Z-Glutaraldehid-Protein
Optimasi Biosensor
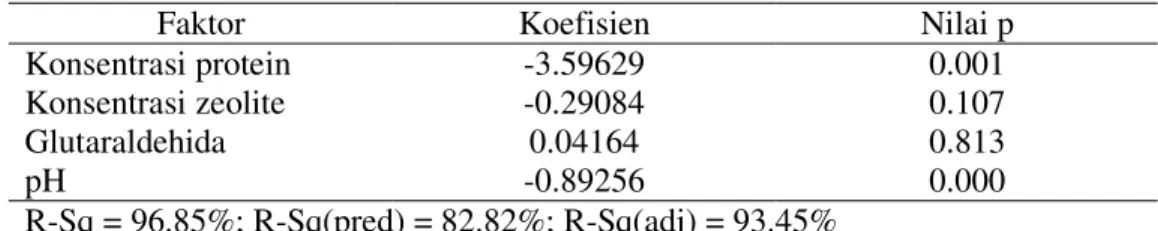
Optimasi dilakukan dengan menggunakan response surface method. Perlakuan yang diuji terhadap arus yaitu pH, konsentrasi protein, konsentrasi glutaraldehid, dan konsentrasi zeolit dapat disebut sebagai factor pada Tabel 2. Tabel 2 menunjukkan hasil optimasi untuk faktor yang berpengaruh secara signifikan terhadap arus yaitu konsentrasi protein dan pH dengan nilai p < 0.05. Koefisien yang menunjukkan nilai positif berarti semakin besar nilai faktor akan semakin besar nilai arus yang dihasilkan. Perlakuan pH dan konsentrasi protein menunjukkan nilai p < 0.05 yang berarti dapat mempengaruhi nilai arus secara signifikan, dan nilai koefisien yang negatif yang berarti semakin kecil nilai pH atau konsentrasi protein dapat menaikkan nilai arus. Sedangkan nilai koefisien
0,0 0,2 0,4 0,6 0,8 1,0 -4,0u -2,0u 0,0 2,0u 4,0u 6,0u 8,0u 10,0u 12,0u 14,0u 16,0u 18,0u 20,0u I ( µ A ) E (V)
11
glutaraldehid diperoleh positif yang berarti dengan penambahan konsentrasi glutaraldehid dapat menaikkan nilai arus yang dihasilkan.
Tabel 2Analisis pengaruh faktor terhadap arus
Faktor Koefisien Nilai p
Konsentrasi protein -3.59629 0.001
Konsentrasi zeolite -0.29084 0.107
Glutaraldehida 0.04164 0.813
pH -0.89256 0.000
R-Sq = 96.85%; R-Sq(pred) = 82.82%; R-Sq(adj) = 93.45%
Optimasi dilakukan dengan beberapa variasi konsentrasi protein, konsentrasi glutaraldehid, konsentrasi zeolit dan pH menggunakan response
surface method pada software MINITAB 16.Optimasi diuji terhadap substrat
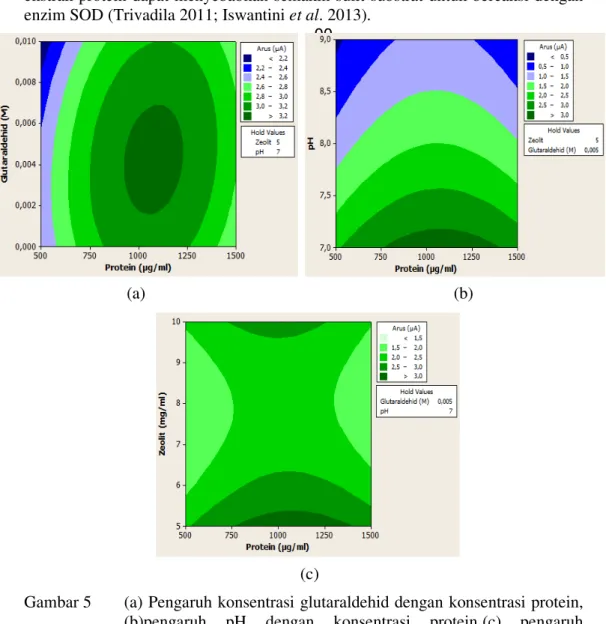
xantina 0.7 mM. Pengaruh konsenstrasi glutaradehid sebagai agen pengikat silang dengan konsentrasi 0, 0.005 dan 0.01M pada Gambar 5(a) menghasilkan kondisi optimum yaitu 0.005 M. Ketika konsentrasi glutaraldehid lebih tinggi maka akan terjadi pengurangan arus karena akan terjadi pengikatan terhadap sisi aktif pada ekstrak protein menyebabkan reaksi dengan substrat tidak terbentuk, dan pori-pori permukaan elektroda akan menjadi lebih rapat yang dapat menyebabkan difusi substrat lebih sulit. Peningkatan konsentrasi glutaradehid menyebabkan deaktivasi dari molekul enzim dan bentuk gel akan rapat karena kelebihan agen pengikat silang (Kocabay et al 2012, Emregul et al 2013). Glutaraldehid juga akan membentuk steric hindrance menyebabkan masalah pada difusi substrat (Akyilmaz & Dinçkaya 2005). Pada saat kosentrasi glutaraldehida lebih kecil pada sistem imobilisasi, ektrak protein hanya akan terjerap ke dalam fase pada polimer CMC-gelatin-zeolit, penjerapan ini bersifat fisik sehingga kondisi dari ekstrak protein menghasilkan arus lebih kecil. Pendekatan dengan enzim murni SOD, ekstrak protein yang digunakan menyerupai kondisi enzim murni walaupun ekstrak protein yang digunakan masih banyak pengotor atau protein-protein lainya.
Variabel optimasi pH dimulai dari 7-9 yang mengahasilkan pH optimum yaitu 7 dengan konsentrasi protein berkisar 1075 µg/ml pada Gambar 5(b). Kondisi pH optimum sangat penting dikarenakan enzim sensitif terhadap pH. Hasil pengujian Wijayanti (2014) menggunakan ekstrak protein D.radiodurans yang diimobilisasi pada nanopartikel zeolit menghasilkan pH optimum 9. Perbedaan pH optimum sangat dipengaruhi oleh factor imobilisasi, matriks imobilisasi mempengaruhi dari sisi aktif enzim berubah posisi. Enzim murni SOD yang diimobilisasi pada CMC-gelatin dengan ikat silang glutaraldehid menghasilkan kondisi pH optimum 7 (Kocabay et al 2012).
Pada pengaruh konstrasi zeolit dihasilkan kondisi optimum yaitu pada konsentrasi 5 mg/ml ditunjukkan pada Gambar 5(c), hal ini dikarenakan zeolit yang ditambahkan masih belum berbentuk nanopartikel sehingga sulit untuk membentuk sistem koloid dan keseragaman zeolit pada sistem menjadi lebih tidak seragam. Namun zeolit yang berukuran nanopartikel sebagai pengimobilisasi ekstrak protein D. radiorans dapat meningkatkan arus (Wijayanti 2014). Zeolit sudah banyak digunakan sebagai matriks dalam sistem imobilisasi enzim, karena zeolit mampu meningkatkan sifat katalitik dari enzim berdasarkan interaksi
12
hidrofobik atau hidrofilik, elektrostatik dan ikatan hidrogen. Kemampuan zeolit dalam meningkatkan respon biosensor dipengaruhi oleh ratio Si/Al. Kirdeciler et
al. (2011) telah melakukan penelitian menggunakan zeolit sintetik sebagai matriks
imobilisasi dalam biosensor urea, pengaruh ratio Si/Al dapat mengubah respon biosensor yaitu semakin tinggi ratio Si/Al maka akan semakin tinggi respon dari biosensor.
Berdasarkan Gambar 5. pada setiap kontur yang menunjukkan konsentrasi optimum untuk ekstrak protein D. radiodurans yaitu 1075 µg/ml. Penjelasan yang dapat diusulkan pada hasil ini bahwa semakin tinggi konsentrasi ekstrak protein maka keadaan enzim akan semakin jenuh di dalam pori matriks, yang membatasisubstrat dan enzim (Emregul et al. 2005). Ekstrak protein dari D.
radiodurans mengandung banyak protein selain SOD, protein lain itu dalam
ekstrak protein dapat menyebabkan semakin sulit substrat untuk bereaksi dengan enzim SOD (Trivadila 2011; Iswantini et al. 2013).
00
Gambar 5 (a) Pengaruh konsentrasi glutaraldehid dengan konsentrasi protein, (b)pengaruh pH dengan konsentrasi protein,(c) pengaruh konsentrasi zeolit dengan konsentrasi protein terhadap perubahan arus puncak
(a) (b)
13
Stabilitas Elektroda Biosensor
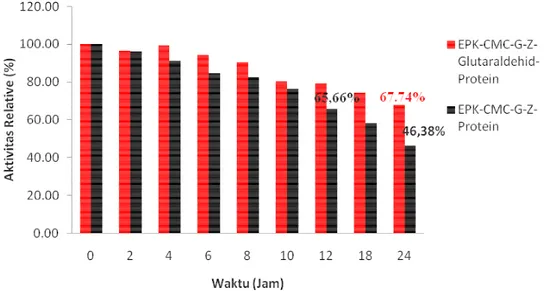
Pada penelitian ini stabilitas elektroda diuji dengan menggunakan 1 elektroda yang di uji dengan waktu pertama dan seterusnya. Stabilitas elektroda dapat dihitung berdasarkan perbandiangn arus pada setiap waktu (periode) dengan arus awal pengukuran. Pada Gambar 6 stabilitas biosensor ekstrak protein diimobilisasi menggunakan agen pengikat silang glutaraldehid menghasilkan stabilitas elektroda lebih lama 2 kali lipat dibandingkan dengan tanpa glutaraldehid dengan sisa aktivitas 65%.
Glutaraldehid mengikat ekstrak protein sehingga posisi sisi aktif tidak berubah-ubah, hal ini menyebabkan kinerja ekstrak protein terhadap substrat menjadi lebih optimal. Pada penelitian sebelumnya stabilitas ekstrak protein dari
D. radiodurans yang diimobilisasi dengan nanopartikel zeolit mampu bertahan 8
jam dengan sisa aktivitas hingga 58,93% (Wijayanti 2014).Berdasarkan hasil grafik pada Gambar 8 dapat diamati bahwa memang terjadi penurunan arus antara dengan glutaraldehid dan tanpa glutaraldehid, disebabkan sifat dari enzim yang bereaksi dengan substrat menggunakan prinsip gembok kunci (key-lock). Saat sisi aktif permukaan enzim sudah terpakai maka akan menurunkan aktifitas enzim, namun proses imobilisasi mampu menyediakan sisi permukaan aktif enzim lebih efektif sehingga penurunan lebih bertahan lama dan sisa aktivitas berkurang lebih sedikit.
Gambar 6Stabilitas elektroda biosensor
Stabilitas ekstrak protein tidak hanya dipengaruhi oleh proses imobilisasi tetapi juga dipengaruhi oleh keberadan protein lain yang terdapat dalam ekstrak protein yaitu protease. Protease merupakan enzim yang dapat mendenaturasikan protein, sehingga dikhawatirkan adanya protease dapat merusak enzim superoksida dismutase di dalam ekstrak kasar protein. Hal ini yang menyebabkan masih rendahnya stabilitas ekstrak protein dibandingkan dengan penggunaan enzim murni SOD (Campanella et al. 2001; Kocabay et al. 2012). Penggunaan matriks CMC-gelatin-zeolit memberikan fungsi sebagai membran pembatas untuk
14
ekstrak protein yang mengandung SOD akan masuk ke dalam matriks sedangkan protease memiliki bobot molekul lebih besar akan tertahan.
Penentuan Parameter Analitik Elektroda
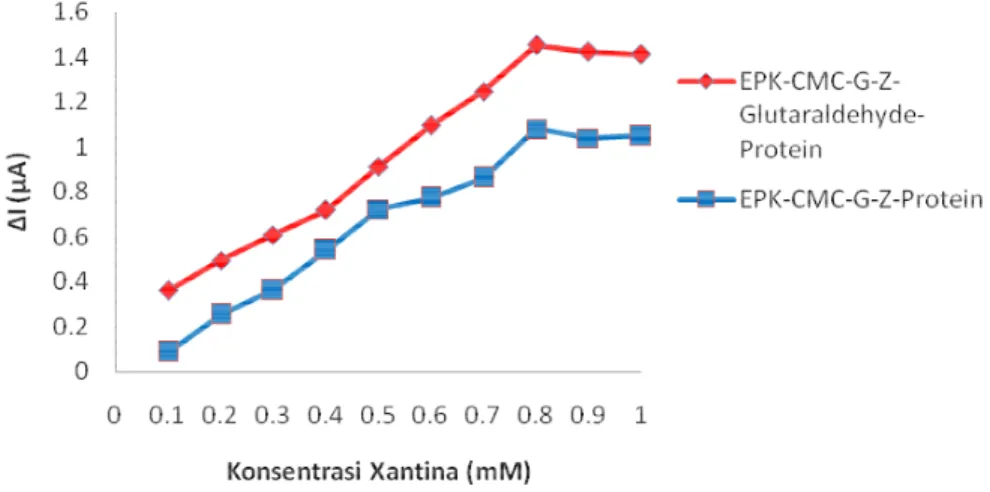
Pengaruh konsenstrasi xantina terhadap aktivitas ekstrak protein yang terimobilisasi dan tidak terimobilisasi, maka dilakukan pengukuran aktivitas dengan variasi konsenstrasi xantina dengan kisaran 0.1-1.0 mM pada kondisi optimum. Gambar 7 menunjukan hubungan konsentrasi xantina dengan aktivitas ekstrak protein yang diikat silang dengan glutaraldehid dan tanpa glutaraldehid.
Reaksi yang dikatalisis oleh enzim dengan berbagai konsenstrasi substrat mengalami 2 fase yaitu fase pertama jika konsentrasi substrat masih rendah, sisi aktif enzim tidak semuanya terikat pada substrat dan fase kedua jika konsentrasi substrat meningkat maka sisi aktif enzim akan terikat keseluruhan. Fase pertama pada konsenstrasi dibawah 0.8 mM, pada aktivitas optimum telah terjadi fase kedua yang selajutnya terjadi penurunan dikarenakan semua sisi aktif ekstrak protein telah terikat pada substrat. Aktivitas ekstrak protein pada EPK-CMC-G-Z-glutaraldehid lebih tinggi terhadap konsentrasi xantina dibandingkan dengan CMC-G-Z, hal ini disebabkan pada saat ekstrak protein diikat silang glutaraldehid bagian sisi aktif akan terjaga tetap pada elektroda pasta karbon dan dapat bekerja secara penuh terhadap substrat, sedangkan bagian sisi aktif ekstrak protein yang tanpa glutaraldehid akan tidak terjaga pada elektroda pasta karbon. Hasil pengukuran pada penelitian Trivadila (2011) bahwa maksimum aktivitas ekstrak protein D. radioduransyang langsung diteteskan pada EPK memberikan hasil konsentrasi substrat xantina 0.60 mM.
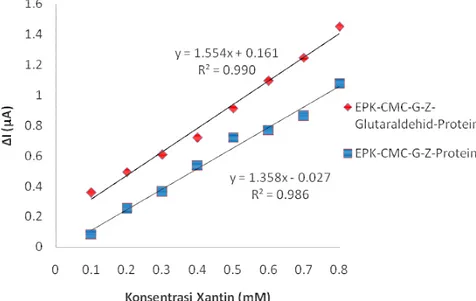
Gambar 7Hubungan aktivitas ekstrak protein dengan konsentrasi xantina Biosensor ekstrak protein D. radiodurans yang diimobilisasi pada CMC-G-Z dengan ikat silang glutaraldehid menghasilkan linieritas pengukuran sebesar 0.1 – 0.8 mM dan nilai r2 = 0.9905, dan tanpa glutaraldehid sebesar 0.1 – 0.8 mM dengan nilai r2 = 0.9861 seperti pada Gambar 8. Limit deteksi dan limit kuantisasi yang dihasilkan dengan adanya glutaraldehid yaitu 77.84 µM dan 259.50 µM sedangkan tanpa glutaraldehid yaitu 94.39µM dan 283.16 µM.
15
Gambar 8Linieritas biosensor superoksida
Perbedaan linieritas ekstrak protein dengan imobilisasi CMC-gelatin-zeolit diikat silang glutaraldehid memberikan rentang linieritas lebih lebar dan arus lebih tinggi daripada tanpa glutaraldehid. Hal ini menunjukkan bahwa dengan terimobilisasinya ekstrak protein dapat meningkatkan aktivitas dari ekstrak protein. Pada table 3 penggunaan Clostridium
difficile sebagai pengahasil Mn-SOD dengan menggunakan elektroda
gelas karbon menghasilkan rentang pengukuran 135.2 – 1160 µM dan limit deteksi 91.1 µM (Ye et al. 2014). Kandungan dari mikroba yang lebih kompleks sehingga difusi antara protein yang diinginkan dengan substrat akan lebih lama dan sulit untuk membentuk reaksi katalitik (Mulchandani dan Rogers 1998). Perbedaan jenis elektroda tergantung dari sifat penghantar arus listrik yang digunakan juga dapat mempengaruhi hasil dari rentang pengukuran dan parameter analitik lainnya (Thandavan et al. 2013; Emregul et al. 2013). Limit deteksi memang lebih besar daripada Wijayanti (2014), namun untuk pengujian kapasitas antioksidan masih dapat digunakan.
Tabel 3Perbandingan parameter analitik biosensor bebasis mikroba
Parameter Analitik Penelitian ini Ye et al (2014) Wijayanti (2014) Rentang pengukuran 0.1- 0.8 mM 0.135-1.160 mM 0.001-0.007 mM
Linieritas 0.9905 - 0.9919
Limit deteksi 77.84 µM 91.10 µM 0.50 µM
Limit kuantisasi 259.50 µM - -
16
4 SIMPULAN DAN SARAN
Simpulan
Biosensor superoksida yang menggunakan ekstrak protein dari D.
radiodurans yang diimobilisasi dalam matriks CMC-gelatin-zeolit dengan
ikat silang glutaraldehid mampu menghasilkan stabilitas elektroda yang lama yaitu 2 kali lipat dibandingkan tanpa glutaraldehid. Teknik imobilisasi ikat silang glutaraldehid dengan ekstrak protein D. radioduransmampu meningkatkan kinerja dari biosensor dengan menghasilkan arus lebih tinggi pada pengukuran terhadap substrat xantina. Limit deteksi yang dihasilkan masih cukup besar namun untuk pengujian kapasitas antioksidan dapat digunakan.
Saran
Saran yang diberikan untuk penelitian selanjutnya yaitu menghilangakan protease yang dapat mengganggu kinerja ekstrak protein D. radiodurans.
DAFTAR PUSTAKA
Abdullah M, Virgus Y, Nirmin, Khairurrijal. 2008. Review : Sintesis Nanomaterial. Jurnal Nanosains & Nanoteknologi 1 : 2
Akyilmaz E, Dinçkaya E. 2005. An amperometric microbial biosensor development based on Candida tropicalis yeast cells for sensitive determination of ethanol. Biosensor and Bioelectronics 20 : 1263 - 1269
Antolovich M, Prenzler PD, Patsalides E, McDonald S, Robards K. 2002. Methods for Testing Antioxidant Activity. Analyst 127: 183-198 Arif Z. 2011. Karakterisasi dan modifikasi zeolit alam sebagai bahan media
pendeteksi studi kasus: kromium heksavalen [Tesis]. Bogor. Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor
Auchere F, Rusnak F. 2002. Superoxide scavenging by neelaredoxin: dismutation and reduction activities in anaerobes, Journal of Biology Inorganic
Chemistry 7 : 667
Byfield MP, Abuknesha RA. 1994. Biochemical Aspects of Biosensor.
Biosensor & Bioelectronics 9 : 373-400
Campanella L, De luca S, Favero G, Persi L, Tomasetti M. 2001. Superoxide dismutase biosensors working in non-aqueous solvent.
Fresenius Journal of Analitycal Chemistry369: 594-600
Campanella L, Bonanni A, Finotti E, Tomassetti M. 2004. Biosensors for determination of total and natural antioxidant capacity of red and
17
white wines: comparison with other spectrophotometric and fluorimetric methods. Biosensors and Bioelectronics 19: 641-651 Canbay E, Habip A, Kara G, Eren Z, Akyilmaz E. 2015. A microbial
biosensor based on Lactobacillus delbruecki sp. bacterial cells for simulataneous determination of lactic acid and pyruvic acid. Food
Chemistry 169 : 197-202
Carvalho RH, Lemos F, Cabral JMS, Ribeiro FR. 2007. Influence of the presence of NaY zeolite on the activity of horseradish peroxidase in the oxidant of phenol. Journal of Molecular Catalysis B : Enzymatic 44:39-47
Chou FI, Tan ST. 1991. Salt-Mediated Multicell Formation in Deinococcus radiodurans. Journal of Bacteriology 173(10): 3184-3190
Earl AM, Mohundro MM, Mian IS, Battista JR. 2002. The ire protein of
Deinococcus radiodurans R1 is a novel regulator of recA expression. Journal of Bacterial 184 (22) : 6216-6224
Emregul E, Kocabay O, Derkus B, Yumak T, Emregul KC, Sinag A, Polat K. 2013. A novel carboxymethylcellulose-gelatin-titanium dioxide-superoxide dismutase biosensor: electrochemical properties ofcarboxymethylcellulose-gelatin-titanium dioxide-superoxide dismutase.
Bioelectrochemistry 90:8-17
Fadhilah R. 2013. Biosensor Glukosa Menggunakan GDH-FAD yang Diimobilisasi pada Nanopartikel Zeolit secara Elektrokimia. [Tesis] Bogor: Institut Pertanian Bogor.
Ghosh R. 2006. Principles of Bioseparations Engineering. World Scientific: Canada
Hamlaoui ML, Bouyahi N, Jafferzic-Renault N. 2008. Development of a urea biosensor based on a polymeric membrane including zeolite. Sciences &
Technologie B: 51-55.
Harmita. 2004. Petunjuk pelaksanaan validasi metode dan cara perhitungannya.
Majalah Ilmu Kefarmasian 1:117-135
Harvey D. 2000. Modern Analitycal Chemistry. Singapore: Mc Graw-Hill.
Iswantini D, Nurhidayat N, Trivadila. 2011. Glucose biosensor selected Indonesia bacteria. Microbiology Indonesia 5(1): 9-14.
Iswantini D, Nurhidayat N, Trivadila, Nurcholis W. 2013. Antioxidant Biosensor Using Microbe. World Academy of Science, Engineering and Technology 78:1272 - 1279.
Khalaf NA, Shakya AK, Al-Othman A, El-Agbar Z, Farah H. 2008. Antioxidant activity of some common plants. Turkey Journal of Biology32:5155 Kirdeciler SK, Soy E, Öztürk S, Kucherenko I, Soldatkin O, Dzyadevych S, Akata
B. 2011. A novel urea conductometric biosensor based on zeolite immobilized urease. Talanta 85 : 1435-1441
Kocabay O, Emregul E, Aras S, Emregul K.C. 2012. Carboxymethylcellulose– gelatin–superoxidase dismutaseelectrode for amperometric superoxide radical sensing. Bioprocess Biosystem Engeering. 35:923–930
Lu Wang, Wei Wen, Huayu Xiong, Xiuhua Zhang, Haoshuang Gu, Shengfu Wang. 2013. A Novel Amperometric Biosensor for Superoxide Anion based on Superoxide Dismutase Immobilized on Gold
Nanoparticle-18
Chitosan-Ionic Liquid Biocomposite Film. Analytica Chimica Acta. 758:66-71
Mateo C, Palomo J.M, Fernandez-Lorente G, Guisan J.M, Fernandez-Lorente G. 2007. Improvement of Enzyme Activity, Stability and Selectivity via Immobilization Techniques. Enzyme and Microbial Technology 40: 1451-1463.
Mulchandani A, Rogers Kim R. 1998. Enzyme and Microbial Biosensors. Totowa: New Jersey
Rebecca JD, Micossi E, McCarthy J, Moe E, Elspeth JG, Kozielski-Stuhrmann, Leonard GA, McSweeney S. 2006. Structure of the manganese superoxide dismutase from Deinococcus radiodurans in two crystal forms. Acta
Crystallographics Sextion F. F62:325-329
Tawaha K, Alali FQ, Gharaibeh M, Mohammad M, El-Elimat T. 2007. Antioxidant activity and total phenolic content of selected Jordanian plant species. Journal of Foodchemistry 104: 1372–1378.
Thandavan K, Gandhi S, Sethuraman S, Rayappan JBB. 2013. A novel nano-interface superoxide biosensor. Sensors and Actuators B: Chemical 176: 884-892
Trivadila. 2011. Biosensor antioksidan menggunakan superoksida dismutase
Deinococus radiodurans diimobilisasi pada permukaan elektroda pasta karbon dan parameter kinetikanya. [Tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Valko M,Leibfritz D, Moncol J, Cronin MT, Mazur M, Telser J. 2007. Free radicals and antioxidants in normal physiological functions and human disease.
Journal of Biochemistry & Cell Biology 39: 44–84.
Wahyudi A, Amalia D, Sariman, Rochani S. 2010. Sintesis nanopartikel zeolit secara top down menggunakan planetary ball mill dan ultrasonikator.
Mineral& Energi. 8: 1.
Weniarti. 2011. Biosensor antioksidan berbasis superoksida dismutase Deinoccos radiodurans diimobilisasi pada nanokomposit zeolit alam Indonesia. [Tesis] Bogor : Institut Pertanian Bogor.
Wijayanti. 2014. Biosensor antioksidan menggunakan enzim superoksida dismutase dari bakteri deinococcus radiodurans terimobilisasi nanopartikel zeolit. [Tesis] Bogor: Institut Pertanian Bogor.
Ye Qing, Li Wei, Wang Z, Zhang L, Tan X, Tian Y. 2014. Direct electrochemistry of superoxide dismutases (Mn-, Fe-, and Ni-) from human pathogen Clostridium difficile: Toward application to superoxide biosensor. Journal of electroanalytical Chemistry 729 : 21-26
Yun YS, Lee YN. 2003. Production of superoxide dismutase by Deinococcus
19
Lampiran 1Bagan alir penelitian 0251706368251705344 Pembuatan Elektroda Pasta Karbon Pembuatan Nanopartikel Zeolit Penumbuhan dan Lisis D. radiodurans
Imobilisasi Ekstrak Protein pada Elektroda Pasta Karbon
Diukur Arus sebagai Aktivitas Protein
Optimasi Variabel Peubah Bebas
Pengukuran Kinerja Analitik Berdasarkan Variabel yang Optimum seperti Stabilitas, Linieritas, Limit Deteksi dan
20
Lampiran 2Hasil pengujian PSA terhadap zaolit
Lampiran 3 Hasil pengukuran OD pada penumbuhan D. radioduransdan konsentrasi ekstrak protein dari D. radiodurans dengan spektrofotometer Perlakuan Absorbansi λ 600nm 1 0.623 2 0.570 3 0.512 4 0.590 5 0.533 6 0.567 7 0.531 8 0.631 9 0.566
Perlakuan Absorbansi λ 260 nm Absorbansi λ 280 nm
1 0.069 0.106 2 1.034 1.153 3 0.871 1.075 4 0.043 0.063 5 1.783 1.301 6 1.427 1.044 7 0.069 0.111 8 1.433 1.135 9 0.922 0.754
21
Lampiran 4Optimasi variabel bebas dari biosensor Konsentrasi Ekstrak (µg/ml) Konsentrasi Zeolit (mg/ml) Konsentrasi Glutaraldehid (M) pH Δ Arus (µA) 1000 7.5 0.005 8 1.391 500 10 0.01 9 0.624 500 5 0.01 7 2.109 500 5 0 7 2.265 1000 7.5 0.005 8 1.441 1500 10 0.01 7 1.297 500 10 0 9 0.394 1000 7.5 0.005 9 0.453 1000 10 0.005 8 1.906 1000 7.5 0.005 8 1.484 1000 5 0.005 8 0.544 1000 5 0.005 7 2.672 500 5 0.01 9 0.250 1500 10 0 9 1.228 1500 7.5 0.005 8 0.782 1000 7.5 0.005 8 1.438 1500 5 0 7 2.593 1000 7.5 0.005 8 1.266 500 10 0.01 7 2.071 1000 7.5 0.005 7 2.297 1500 5 0 9 0.247 1000 7.5 0.005 8 1.429 500 7.5 0.005 8 0.397 1500 10 0 7 2.275 1000 7.5 0.005 8 0.969 500 10 0 7 2.704 500 5 0 9 0.322 1500 5 0.01 9 0.484 1500 10 0.01 9 0.707 1000 7.5 0.01 8 0.625
22
Lampiran 5Hasil stabilitas biosensor
Arus (µA) Waktu
(jam) EPK-CMC-G-Z- Glutaraldehid-Protein EPK-CMC-G-Z-Protein 0 4.891 4.240 2 4.719 4.066 4 4.859 3.857 6 4.609 3.594 8 4.422 3.500 10 3.922 3.234 12 3.875 2.784 18 3.641 - 24 3.313 -
Sisa aktivitas relatif (%) Waktu (jam) EPK-CMC-G-Z-Glutaraldehid-Protein EPK-CMC-G-Z-Protein 0 100.0 100.0 2 96.5 95.9 4 99.3 90.9 6 94.2 84.8 8 90.4 82.6 10 80.2 76.3 12 79.2 65.7 18 74.4 - 24 67.7 -
Lampiran 6 Hasil uji hubungan konsentrasi substrat xantina dengan aktivitas ekstrak protein 0 , 0 0 , 2 0 , 4 0 , 6 0 , 8 1 , 0 - 6 , 0 u - 4 , 0 u - 2 , 0 u 0 , 0 2 , 0 u 4 , 0 u 6 , 0 u 8 , 0 u 1 0 , 0 u 1 2 , 0 u 1 4 , 0 u 1 6 , 0 u 1 8 , 0 u 2 0 , 0 u I (µ A ) E ( m V ) X a n t i n a 0 . 1 m M X a n t i n a 0 . 2 m M X a n t i n a 0 . 3 m M X a n t i n a 0 . 4 m M X a n t i n a 0 . 5 m M X a n t i n a 0 . 6 m M X a n t i n a 0 . 7 m M X a n t i n a 0 . 8 m M
23
Lampiran 7Perhitungan Limit Deteksi dan Limit Kuantisasi EPK-CMC-G-Z-Glutaraldehid-Protein
Konsenstrasi Xantina (X)
Arus (Y) Yi Yi - Y (Yi – Y)2 0.1 0.36 0.31719 -0.04281 0.0018327 0.2 0.495 0.47268 -0.02232 0.000498182 0.3 0.609 0.62817 -0.01917 0.000367 0.4 0.719 0.78366 -0.06466 0.004181 0.5 0.914 0.93915 -0.02515 0.000633 0.6 1.094 1.09464 -0.00064 4.1 x 10-7 0.7 1.247 1.25013 -0.00313 9.8 x 10-6 0.8 1.453 1.40562 -0.04738 0.002245 Jumlah 0.009767 σ2 0.001628 σ 0.040346 LOD 0.07784 mM LOQ 0.25948 mM
Yi = (slope Konsentrasi Xantina) + intersep σ2 = LOD = LOQ = EPK-CMC-G-Z-Protein Konsenstrasi Xantina (X)
Arus (Y) Yi Yi - Y (Yi – Y)2
0.1 0.085 0.10837 0.02337 0.000546 0.2 0.252 0.24424 -0.00776 6.02E-05 0.3 0.362 0.38011 0.01811 0.000328 0.4 0.539 0.51598 -0.02302 0.00053 0.5 0.722 0.65185 -0.07015 0.004921 0.6 0.771 0.78772 0.01672 0.00028 0.7 0.861 0.92359 0.06259 0.003918 0.8 1.079 1.05946 -0.01954 0.000382 Jumlah 0.010964 σ2 0.000305 σ 0.017452 LOD 0.09439 mM LOQ 0.28316 mM
24
RIWAYAT HIDUP
Penulis dilahirkan di Palembang pada tanggal 18 November 1989 dari pasangan Drs. Erwan zaini dan Dra. Emi Suryani. Penulis merupakan anak pertama dari tiga bersaudara dan suami dari Zahratul Aini S.Si.
Tahun 2008 penulis lulus dari Sekolah Menengah Analis Kimia Bogor (SMAKBo). Pendidikan sarjana yang di tempuh di Program Studi Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Nusa Bangsa, lulus pada tahun 2012. Sejak tahun 2012 tersebut, penulis berkesempatan bekerja di beberapa perusahaan di Batam, Balikpapan dan Tangerang. Tahun 2013, penulis diterima di Program Studi Kimia pada Program Sekolah Pascasarjana IPB. Selama mengikuti program S2, penulis menjadi anggota Bogor Science Club (BSC) Pascasarjana IPB.

![Gambar 3Voltamogram siklik pada pengukuran larutan K 3 [Fe(CN) 6 ] 1mM Imobilisasi Ekstrak Protein D](https://thumb-ap.123doks.com/thumbv2/123dok/4252019.2878860/26.918.275.648.467.753/gambar-voltamogram-siklik-pengukuran-larutan-imobilisasi-ekstrak-protein.webp)