METODE PENELITIAN Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Pengawasan Mutu dan Keamanan Pangan SEAFAST Center, Laboratorium Hewan Percobaan Bersama SEAFAST Center dan Dept. ITP, serta F-Technopark FATETA Kampus IPB Darmaga Bogor. Penelitian berlangsung dari bulan Maret 2009 hingga Juli 2010.
Bahan dan Peralatan
Bahan utama yang digunakan dalam penelitian ini adalah buah merah jenis merah panjang (kultivar Hityom) berasal dari daerah Manokwari Papua Barat. Bahan-bahan yang digunakan untuk ransum tikus adalah minyak jagung, kasein teknis, selulosa teknis, mineral mix, vitamin mix, maizena dan aquades. Hewan percobaan yang digunakan adalah tikus putih (strain Sprague dawley) jantan berumur 21 hari yang diperoleh dari Badan Pengawas Obat dan Makanan Jakarta. Bahan kimia yang digunakan untuk analisis adalah HCl, H2O, K2SO4, HgO, H2SO4, NaOH, Na2S2O3, H3BO3
Alat-alat yang digunakan dalam penelitian ini meliputi peralatan ekstraksi minyak, peralatan bedah tikus, peralatan gelas untuk analisis kimia, timbangan analitik OHouse, vortex, sentrifus, oven, tanur, alat destilasi, labu Kjeldahl, labu Soxhlet, rotavapor, kolom C18 (15 cm) Vydac TP501, spektrofotometer Shimadzu UV-VIS 160 (Japan) dan HPLC (High Performance Liquid Chromatography) Shimadzu C-R6A Chromatopac (Japan).
, heksan, KCl, EDTA, aseton, KOH, larutan PBS, TCA, etanol, petroleum eter, asetonitril, dan metanol (Merck USA). Bahan kimia sebagai standar digunakan kristal β-karoten (Sigma Germany cat. no C-9750) dan all trans retinol (Sigma Germany cat.no R-7632).
Metode Penelitian
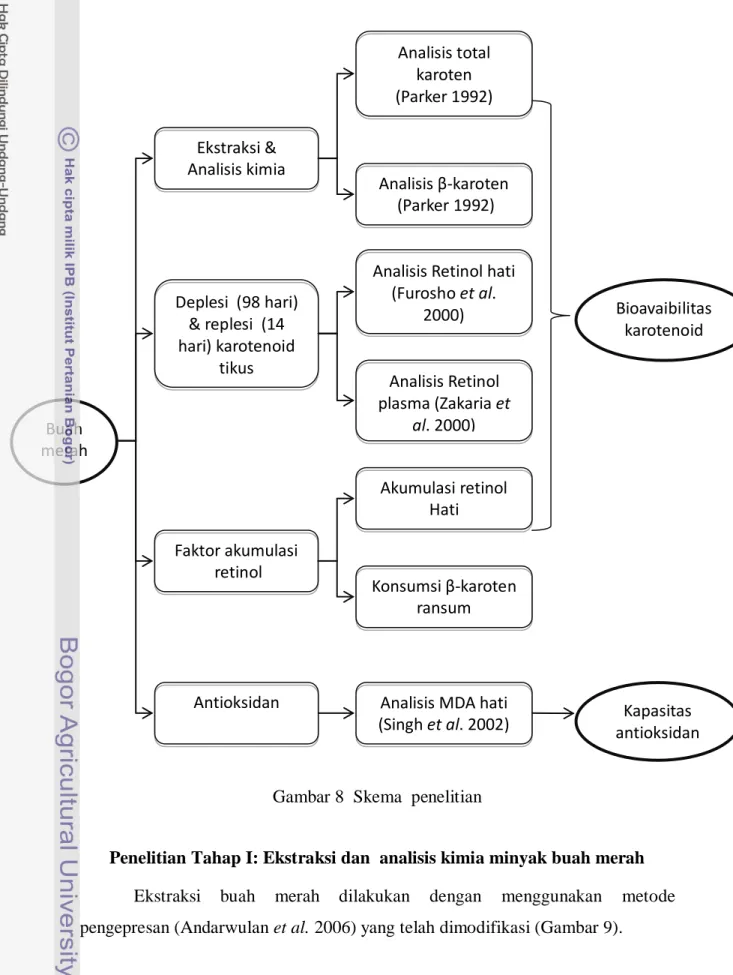
Penelitian ini dilaksanakan dalam 2 tahap penelitian meliputi: 1) Ekstraksi dan analisis kimia ekstrak buah merah, dan 2) Pengujian bioavailabilitas karotenoid ekstrak buah merah pada tikus percobaan.
Ekstraksi pengepresan
(modifikasi Andarwulan et al. 2006)
Ekstraksi pengepresan
(modifikasi Andarwulan et al. 2006)
Gambar 8 Skema penelitian
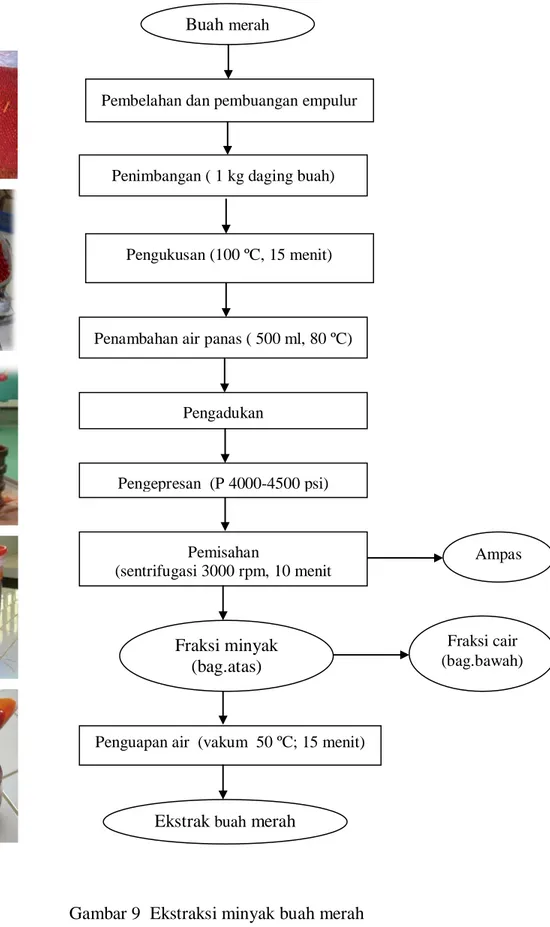
Penelitian Tahap I: Ekstraksi dan analisis kimia minyak buah merah Ekstraksi buah merah dilakukan dengan menggunakan metode pengepresan (Andarwulan et al. 2006) yang telah dimodifikasi (Gambar 9).
Buah merah Bioavaibilitas karotenoid Ekstraksi & Analisis kimia Deplesi (98 hari) & replesi (14 hari) karotenoid tikus Faktor akumulasi retinol Antioksidan Analisis β-karoten (Parker 1992) Analisis total karoten (Parker 1992) Analisis Retinol plasma (Zakaria et al. 2000)
Analisis Retinol hati (Furosho et al.
2000)
Analisis MDA hati (Singh et al. 2002) Akumulasi retinol Hati Konsumsi β-karoten ransum Kapasitas antioksidan
Gambar 9 Ekstraksi minyak buah merah Pengepresan (P 4000-4500 psi)
Pemisahan
(sentrifugasi 3000 rpm, 10 menit
Penguapan air (vakum 50 ºC; 15 menit) Pengadukan
Penambahan air panas ( 500 ml, 80 ºC) Pembelahan dan pembuangan empulur
Penimbangan ( 1 kg daging buah)
Pengukusan (100 ºC, 15 menit) Buah merah
Ekstrak buah merah
Ampas
Fraksi cair (bag.bawah) Fraksi minyak
Ekstrak buah merah yang diperoleh kemudian dianalisis kandungan kimia meliputi total karoten dan β-karoten. Data kandungan β-karoten ekstrak buah merah yang diperoleh digunakan sebagai acuan untuk menentukan jumlah ekstrak buah merah yang ditambahkan pada ransum tikus perlakuan ekstrak buah merah.
Penelitian Tahap II: Pengujian bioavailabilitas karotenoid ekstrak buahmerah pada tikus percobaan
Pengujian bioavailabilitas karotenoid ekstrak buah merah dilakukan dengan metode pendekatan deplesi dan replesi vitamin A pada tikus percobaan. Pada masa deplesi tikus diberikan ransum tanpa adanya vitamin A hingga mengalami defisiensi vitamin A. Selanjutnya pada masa replesi tikus diberikan ransum dengan kandungan provitamin A yang berupa β-karoten murni dan ekstrak buah merah.
(a) Persiapan ransum standar dan ransum tanpa vitamin A
Ransum standar yang digunakan mengacu pada AOAC (2005). Komposisi komponen ransum disajikan pada Tabel 5 sedangkan komposisi vitamin mix diuraikan pada Tabel 6.
Tabel 5 Komposisi zat gizi ransum standar
Komponen Jumlah (%) Protein 10 Lemak 8 Mineral 5 Vitamin mix 1 Selulosa 1 Air 5
Pati Ditambahkan sehingga menjadi 100 Sumber: AOAC (2005).
(b) Persiapan ransum β-karoten murni dan ekstrak buah merah
Jumlah β-karoten murni dan ekstrak buah merah yang ditambahkan pada ransum tergantung pada konsentrasi β-karoten yang terkandung dalam ekstrak buah merah dan disesuaikan dengan kebutuhan vitamin A yang harus
dikonsumsi agar terjadi akumulasi vitamin A di hati yaitu 180 µg β-karoten (Moore 1969).
Tabel 6 Komposisi untuk 1 gram vitamin campuran
Jenis Vitamin Jumlah
Vitamin A 2000 IU Vitamin D 200 IU Vitamin E 10 IU Menadion 0.5 mg Kolin 200 mg Asam p-aminobenzoat 10 mg Inositol 10 mg Asam nikotinamid 4 mg Ca-pantotenat 4 mg Riboflavin 0.8 mg Thiamin, HCl 0.5 mg Piridoksin, HCl 0.5 mg Asam folat 0.2 mg Biotin 0.04 mg Vitamin B 12 0.003 mg
Glukosa Untuk membuat 1 gram
Sumber : AOAC (2005).
(c) Perlakuan dan Pemeliharaan Tikus
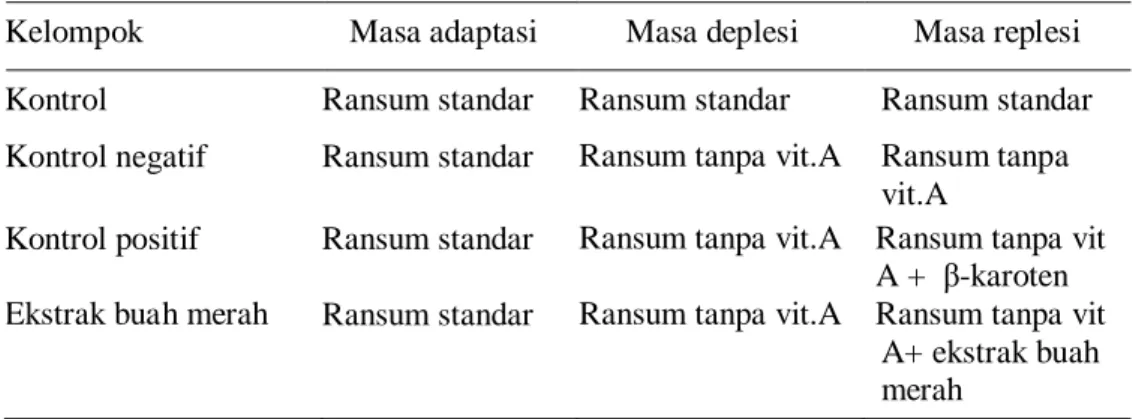
Tikus yang digunakan pada penelitian ini berjumlah 40 ekor. Seluruh tikus dipelihara melalui masa adaptasi selama 10 hari. Setelah masa adaptasi 2 ekor tikus dikorbankan untuk melihat status retinol awal. Kemudian tikus dikelompokkan menjadi 2 kelompok yaitu kelompok tikus yang mendapatkan ransum standar selama percobaan (n=6) dan kelompok tikus yang mengalami masa deplesi vitamin A (n=32). Selama masa deplesi, setiap 2 minggu dikorbankan 2 tikus untuk melihat status retinol dan menentukan akhir masa deplesi. Setelah masa deplesi tikus defisiensi vitamin A dibagi dalam 3 kelompok yaitu: (1) kelompok kontrol negatif (n=6) yaitu kelompok tikus yang mendapatkan ransum tanpa vitamin A sampai akhir masa replesi; (2) kelompok kontrol positif (n=6) yaitu kelompok tikus yang mendapat ransum yang mengandung β-karoten murni; (3) kelompok tikus (n=6) mendapatkan
ransum yang diintervensi dengan ekstrak buah merah. Pengelompokan ransum tikus selama pemeliharaan dapat dilihat pada Tabel 7.
Tabel 7 Pengelompokan ransum tikus selama pemeliharaan
Kelompok Masa adaptasi Masa deplesi Masa replesi Kontrol Ransum standar Ransum standar Ransum standar Kontrol negatif Ransum standar Ransum tanpa vit.A Ransum tanpa
vit.A
Kontrol positif Ransum standar Ransum tanpa vit.A Ransum tanpa vit A + β-karoten Ekstrak buah merah Ransum standar Ransum tanpa vit.A Ransum tanpa vit
A+ ekstrak buah merah
Ransum diberikan setiap hari pada pukul 16.00 – 20.00 WIB dan sisa ransum ditimbang setiap hari. Air minum diberikan secara ad libitum. Setiap tiga hari berat badan tikus ditimbang. Selama pemeliharaan setiap ekor tikus ditempatkan dalam kandang terpisah untuk memudahkan pemeliharaan.
(d) Pembedahan tikus
Setelah melewati masa replesi selama 2 minggu, seluruh tikus diterminasi dengan cara cervical dislocatio. Proses ini dilakukan secara steril (menggunakan alkohol 70%) dan dilakukan dengan cepat. Darah diambil dari jantung dengan menggunakan alat suntik, lalu dimasukkan ke dalam tabung darah yang telah berisi antikoagulan dipotassium ethylene diamine tetraacetic acid (K2
Analisis
EDTA). Darah kemudian disentrifus pada 600 g dan plasma yang diperoleh disimpan pada suhu -20 ºC sampai dilakukan analisis retinol. Organ hati diambil dan kemudian ditimbang. Organ hati dibungkus dengan aluminum foil dan disimpan pada suhu -20 ºC untuk selanjutnya dianalisis retinol dan kadar MDA.
Analisi Kadar Protein (AOAC 2005)
Sampel ditimbang dalam labu Kjeldahl lalu ditambahkan 2 g K2SO4, 50 mg HgO dan 2 ml H2SO4 pekat. Jika sampel lebih dari 15 mg, 0.1 ml H2SO4 pekat
ditambahkan untuk setiap 10 mg sampel di atas 15 mg. Sampel dididihkan selama 1-1.5 jam hingga cairan menjadi jernih. Kemudian didinginkan, ditambahkan sedikit air secara perlahan-lahan dan didinginkan lagi. Isi labu dipindahkan ke dalam alat destilasi dan dibilas 5-6 kali. Air cucian dipindahkan ke dalam alat destilasi. Erlenmeyer 125 ml berisi 5 ml larutan borat jenuh dan 2-4 tetes indikator (metil merah + metil biru) ditempatkan di bawah kondensor. Ujung tabung kondensor harus terendam di bawah larutan asam borat jenuh. Kemudianalat destilasi ditambahkan 8-10 ml larutan NaOH-Na2S2O3 lalu didestilasi sampai tertampung kira-kira 15 ml destilat dalam erlenmeyer. Tabung kondensor dan isi erlenmeyer dititrasi dengan HCl 0.1 N sampai terjadi perubahan warna menjadi abu-abu atau biru. Kadar protein yang diperoleh dapat dihitung dengan cara berikut:
Protein (% bb) = % N x faktor konversi (6.25)
Analisis Kadar Lemak (AOAC 2005)
Labu dkeringkan dalam oven bersuhu 105-110 ºC selama 1 jam, kemudian didinginkan dalam desikator dan ditimbang. Sampel dibungkus dengan kertas saring, dimasukkan dalam labu yang berisi heksan. Dilakukan reflux selama 5 jam. Pelarut yang ada dalam labu didestilasi. Selanjutnya labu yang berisi lemak hasil ekstraksi dipanaskan dalam oven suhu 105 ºC. Setelah beratnya konstan, labu beserta lemaknya ditimbang. Kadar lemak dihitung sebagai berikut:
Analisis Kadar Air (AOAC 2005)
Suhu oven diatur 105 ºC dan sampel dikeringkan di dalamnya hingga dicapai berat konstan. Sampel kemudian didinginkan dalam desikator dan ditimbang. Persen kadar air berdasarkan berat basah dihitung dengan rumus berikut:
Analisis Kadar Abu (AOAC 2005)
Sampel ditimbang dalam cawan pengabuan kemudian dibakar dalam tanur (550 ºC) sampai diperoleh abu berwarna abu-abu atau sampai beratnya tetap.
Analisis Kadar Karbohidrat (By difference)
Penetapan karbohidrat dilakukan dengan perhitungan berikut: Karbohidrat (%) = 100 – (% P + % L + % air + % abu)
Keterangan: P = protein L = lemak
Analisis Total Karoten (Modifikasi Packer 1992)
Sampel ditimbang (± 1 gram) selanjutnya didispersikan 3 ml KOH 5% dalam metanol di dalam tabung reaksi bertutup. Kemudian tabung berisi sampel divorteks dan dihembus dengan gas N2. Selanjutnya tabung reaksi dipanaskan pada suhu 60 ºC selama 60 menit di dalam penangas air dengan kondisi gelap. Tabung reaksi kemudian didinginkan dan ditambahkan 2 ml air bebas ion dan 6 ml heksan. Headspace dihembus dengan gas N2,
Bagian bawah ekstrak yang pertama, diekstrak lagi dengan penambahan 6 ml heksan, divorteks dan lapisan atas dipindahkan ke tabung reaksi yang berisi hasil ekstraksi pertama. Ekstraksi dilakukan hingga ekstrak yang diperoleh berwarna pucat. Selanjutnya hasil ekstrak tersebut dicuci dengan aquades dan ekstrak dipindahkan ke tabung bersih lainnya sambil disaring dengan menggunakan sodium sulfat anhydrous.
ditutup dan dikocok dengan tangan selama 1 menit. Sampel selanjutnya divorteks dan larutan bagian atas dipindahkan ke tabung reaksi yang bersih.
Heksan dari ekstraksi dievaporasi dengan menggunakan rotavapor. Residu kering tersebut kemudian diencerkan dengan 1 ml pelarut campuran
acetonitril:metanol = 1:1. Selanjutnya dilakukan pengukuran absorbansi dengan menggunakan spektrofotometer pada panjang gelombang 450 nm.
Kandungan total karotenoid dalam ekstrak dihitung dengan menggunakan nilai E 1%
Perhitungan :
( 1 cm) untuk β-karoten yaitu 2600. Setelah pengukuran absorbansi dilakukan, larutan dievaporasi kembali sampai kering untuk digunakan pada analisis kandungan β-karoten.
T Keterangan :
10 = faktor konversi dari persen kadar β-karoten standar menjadi satuan mg/ml atau λg/λl
E 1%1cm
(1:1) pada panjang gelombang 450 nm = 2600
= nilai koefisien ekstingsi β-karoten dalam metanol:asetonitril A = nilai absorbansi
FP = faktor pengenceran pada saat pengukuran absorbansi V = volume yang diukur absorbansinya (µl)
B = berat sampel yang dianalisis total karotenoidnya (g)
Analisis β-karoten (Modifikasi Packer 1992 )
Sampel yang telah dianalisis total karoten selanjutnya dievaporasi kembali dan dilarutkan dalam 1 ml fase gerak asetonitril:diklorometan:metanol (60:35:5). Selanjutnya sampel sebanyak 20 µl disuntikkan ke dalam kolom C18 HPLC dengan detektor yang digunakan adalah UV-VIS, panjang gelombang 450 nm dan laju alir 1 ml/menit
Persiapan Standar β-karoten
Kristal β-karoten ditimbang dalam labu takar 10 ml, dilarutkan dengan sempurna dalam 10 ml asetonitril-metanol 1:1, selanjutnya diukur absorbansinya dengan menggunakan spektrofotometer pada panjang gelombang 450 nm. Dari hasil pengukuran tersebut diperoleh konsentrasi semu β-karoten dengan rumus
sebagai berikut:
10 (mg/ml) =
2600 absorbansi pada 450 nm konsentrasi β-karoten semu
Larutan konsentrasi semu tersebut kemudian diinjeksikan pada HPLC dengan fase gerak asetonitril:diklorometan:metanol (60:35:5) untuk mendapatkan persen kemurnian all trans β-karoten pada 450 nm. Kemudian persen kemurnian dikalikan dengan konsentrasi β-karoten semu sehingga diperoleh konsentrasi β -karoten yang sesungguhnya. Selanjutnya dibuat seri larutan standar β-karoten (6.7, 3.35, 1.675, 0.8375 µg/g) yang kemudian diinjeksikan pada HPLC sehingga diperoleh kurva standar β-karoten.
Analisis Retinol Plasma (Zakaria et al. 2000)
Plasma sebanyak 0.5 ml ditambahkan 0.5 ml etanol dan kemudian dicampurkan. Selanjutnya ditambahkan 4 ml heksan dan dicampurkan dengan cara divorteks. Ekstraksi dilakukan sebanyak dua kali. Filtrat yang diperoleh dievaporasi dengan rotavapor. Kemudian residu kering dilarutkan dalam 1 ml fase gerak metanol:acetonitril (1:1). Sebanyak 20 µl sampel diinjekkan ke dalam kolom C18 HPLC dengan detektor yang digunakan adalah UV-VIS, panjang gelombang 325 nm dan laju alir 1 ml/menit.
Analisis Retinol Hati (Furusho et al. 2000)
Sampel hati sebanyak 0.5 gram disaponifikasi dengan 30% KOH dalam etanol yang mengandung 0.5% BHT (4 ml) selama 30 menit dengan suhu 60 ºC. Setelah dingin, ditambahkan 4 ml aquades dan diekstrak dengan menggunakan pelarut heksan sebanyak 4 ml. Ekstraksi ini diulang sebanyak 3 kali. Kemudian hasil ekstrak dicuci dengan 4 ml air dan dikeringkan dengan sodium sulfat anhydrous. Larutan selanjutnya dikeringkan dengan rotavapor. Sampel dilarutkan kembali dengan 1 ml fase gerak metanol:acetonitril (1:1) dan selanjutnya 20 µl sampel diinjek pada kolom C18 HPLC dengan detektor yang digunakan adalah UV-VIS, panjang gelombang 325 nm dan laju alir 1 ml/menit.
Persiapan Standar Retinol
Kristal all-trans retinol ditimbang sebanyak 100 mg dalam labu takar 100 ml, dilarutkan dengan sempurna dalam 100 ml acetonitril-isopropanol (65:35), kemudian dibuat satu seri larutan standar retinol yang selanjutnya diinjeksikan pada HPLC sehingga diperoleh kurva standar retinol.
Analisis Kadar MDA (Singh et al. 2002) Preparasi sampel hati
Sebanyak 1.25 g hati dicacah dalam kondisi dingin dalam 5 ml larutan PBS (phosphat buffer saline) yang mengandung 11.5 g/L KCl. Homogenat yang dihasilkan kemudian disentrifugasi pada 4000 rpm hingga diperoleh supernatan jernih.
Prosedur Pengukuran
Sebanyak 0.5 ml supernatan hati ditambah 2 ml HCl dingin (0.25 N) yang mengandung 15% TCA, 0.38% TBA dan 0.5% BHT. Campuran dipanaskan menggunakan waterbath dengan suhu 80 ºC selama 1 jam. Setelah dingin, campuran disentrifugasi pada 3500 rpm selama 10 menit. Absorbansi supernatan diukur menggunakan spektrofotometer pada panjang gelombang 532 nm. Sebagai larutan standar digunakan TEP (tetraetoksipropana).
Penentuan Faktor Akumulasi Retinol (FAR) (Zakaria et al. 2000)
Faktor akumulasi retinol diperoleh dengan menghitung ratio total akumulasi retinol hati terhadap total β-karoten ransum yang dikonsumsi selama masa replesi. Total akumulasi retinol hati dihitung dengan mengurangi total retinol hati setelah masa replesi dengan total retinol hati setelah deplesi vitamin A. Total retinol hati dihitung dengan mengalikan berat hati dengan kandungan retinol yang diperoleh dari analisis.
Untuk menghitung faktor akumulasi retinol menggunakan rumus berikut: KRHr - KRHo FAR = BK Keterangan :
FAR = faktor akumulasi retinol
KRHr = kandungan total retinol hati akhir replesi (µg)
KRHo = kandungan total retinol hati awal replesi/akhir deplesi (µg)
BK = total β-karoten yang dikonsumsi selama replesi (µg) Faktor akumulasi retinol relatif diperoleh dengan membandingkan faktor akumulasi retinol kontrol positif dan perlakuan ekstrak buah merah, dengan rumus sebagai berikut :
FAR kelompok kontrol positif
FAR relatif (%) = x 100% FAR kelompok ekstrak buah merah
Analisis Statistik
Rancangan percobaan yang digunakan pada penelitian ini adalah rancangan acak lengkap satu faktor. Data yang diperoleh diuji dengan analisis sidik ragam dengan tingkat kepercayaan 95% (α=0.05).