BAB II
TINJAUAN PUSTAKA
2.1 Tanaman Kakao
Tanaman kakao (Theobroma cacao L.) merupakan salah satu anggota dari familia Sterculiaceae yang berasal dari hutan tropis Amerika Tengah dan Amerika Selatan bagian utara. Kakao banyak dimanfaatkan oleh suku Indian Maya dan suku Astek sebagai bahan makanan dan minuman (Baon & Wardani, 2010). Pada abad ke 15, kakao mulai dikenalkan di Eropa dan menyebar ke seluruh dunia mulai saat itu (Susanto, 1994).
Di Indonesia, kakao diperkenalkan pertama kali oleh bangsa Spanyol di Minahasa pada tahun 1560 dan menyebar ke hampir seluruh wilayah Indonesia pada akhir abad 18 (Susanto, 1994). Pada saat ini, Indonesia menjadi negara penghasil kakao terbesar kedua di dunia setelah Pantai Gading dengan total produksi mencapai 900 ribu ton pada tahun 2012 (FAO, 2014). Dengan kondisi tersebut, kakao menjadi komoditas perdagangan utama bagi Indonesia dengan total devisa mencapai US$ 1,2 milyar pada tahun 2010 (FAO, 2014).
2.1.1 Morfologi Tanaman Kakao
umur sekitar 10 bulan akan membentuk cabang plagiotrof (Karmawati et al., 2010).
Berdasarkan percabangannya, daun kakao juga bersifat dimorfisme yaitu daun yang tumbuh pada cabang ortotrop memiliki tangkai daun yang panjang (7,5 - 10 cm), sedangkan pada cabang plagiotrop memiliki tangkai daun lebih pendek yaitu sekitar 2,5 cm (Susanto, 1994). Helaian daun berbentuk bulat telur terbalik memanjang (obovatus) dengan panjang pada daun dewasa mencapai 10 – 48 cm dan lebar dapat mencapai 4 - 20 cm. Ujung daun meruncing (acuminatus) dengan pangkal daun berbentuk runcing (acutus) (Backer & Bakhuizen van den Brink, 1963).
Bunga kakao berkembang dari berkas ketiak daun pada batang dan beberapa cabangnya (cauliflori; Backer & Bakhuizen van den Brink, 1963). Tempat tumbuh bunga tersebut lama – kelamaan menebal dan membesar disebut dengan bantalan bunga (cushion; Gambar 2.1 A). Bunga kakao umumnya berwarna putih, ungu dan kemerahan. Jumlah bunga dalam satu pohon dapat mencapai sekitar 10.000 kuntum bunga setiap tahun, namun yang berhasil tumbuh dan berkembangbiak menjadi buah hanya sekitar 10 - 50 bunga saja (Susanto; 1994).
Putik bunga kakao berwarna putih berukuran pendek (Backer & Bakhuizen van den Brink, 1963). Organ kelamin jantan (androecium) terdiri dari 5 benang sari (stamen) dan staminodia. Stamen merupakan organ kelamin jantan fertile karena mampu menghasilkan tepung sari (pollen) dengan diameter 2 - 3 mikron, sedangkan staminodia merupakan organ kelamin jantan yang steril berwarna ungu tua dengan ujung putih, ukurannya dapat mencapai 4 – 6 mm (Backer & Bakhuizen van den Brink, 1963).
Gambar 2.1 A. Bunga kakao yang muncul dari batang (kauliflori), sebagian kuntum bungan masih kuncup dan sebagian telah mekar; B. Diagram bunga yang telah mekar menunjukkan staminodia dan petala (Rahardjo, 2011)
Proses pembungaan kakao diawali dengan terbentuknya kuncup bunga. Setelah 30 hari, kuncup bunga akan mekar yang menandakan putik dan benang sari telah masak dan siap untuk melakukan penyerbukan dan pembuahan. Setelah mengalami penyerbukan yang umumnya dibantu oleh serangga, bakal biji akan tumbuh menjadi biji dan bakal buah akan tumbuh menjadi buah (Rahardjo, 2011)
berwarna hijau, kuning dan merah tergantung kultivarnya (Backer & Bakhuizen van den Brink, 1963). Buah kakao terdiri atas kulit buah (pod), arilus (pulp) dan biji (Saleh, 1998). Pada setiap buah kakao dapat dihasilkan biji sebanyak 30 - 50 butir tergantung kultivarnya (Prawoto & Winarsih, 2010). Di bagian dalamnya terdapat kulit biji (testa) yang membungkus 2 kotiledon. Biji kakao tidak memiliki masa dorman sehingga terkadang ditemukan biji yang telah berkecambah di dalam buah yang terlambat dipanen (Prawoto & Winarsih, 2010).
Tanaman kakao memiliki sistem perakaran tunggang yang bercabang (Siregar et al., 2010). Panjang akar tanaman kakao dapat mencapai 15 meter ke arah bawah dan 8 meter ke arah lateral (Siregar et al., 2010). Sebagian besar akar lateral kakao (mendatar) berkembang dekat permukaan tanah (surface root feeder) yaitu pada kedalaman 0 - 30 cm (Prawoto & Winarsih, 2010).
2.1.2 Kultivar Kakao
muda umumnya berwarna merah dan jika sudah masak warna berubah menjadi orange, ujung buah berbentuk tumpul sedikit bengkok dan tiap buah berisi biji yang dapat mencapai 30 - 40 biji dengan bentuk biji bulat dan endosperm berwarna putih (Susanto, 1994).
Kakao Forestero, dikenal dengan kakao curah atau kakao lindak karena memiliki rasa biji yang pahit. Namun kakao forestero memiliki pertumbuhan yang kuat, cepat berbuah sehingga produksinya lebih tinggi, serta relatif lebih tahan terhadap serangan hama dan penyakit (Susanto, 1994). Kakao Forestero memiliki kulit buah berwarna hijau, agak keras dengan permukaan yang halus serta memiliki alur yang agak dalam. Endosperm kakao Forestero berwarna ungu tua (Prawoto & Winarsih, 2010).
Kakao Trinitario merupakan hasil persilangan dari kakao Criollo dan Forastero sehingga terdapat jenis – jenis baru yang mutunya lebih baik, buah maupun bijinya (Susanto, 1994).
2.1.3 Manfaat Tanaman Kakao
Kakao dibudidayakan oleh masyarakat untuk dimanfaatkan buahnya. Kulit buah kakao dapat dimanfaatkan sebagai pakan pakan ternak (Gambar 2.3 A Sihombing, 2008), bahan baku kompos (Dachlan et al., 2009), selain itu juga sebagai bahan baku pembuatan arang aktif untuk adsorben logam berat (Masitoh & Sianit, 2013). Pulp buah kakao juga dapat dimanfaatkan untuk produk pangan seperti nata de cacao (Gambar 2.3 B; Elizabeth, 2006)
Gambar 2.3 Kulit buah kakao yang dimanfaatkan untuk pakan ternak (A); Pulp sebagai bahan baku pembuatan nata de cocoa (B); cocoa powder untuk bahan baku makanan (ice cream) (C) dan masker(D). Sumber dari www.google.com/images/cocoa
2.2 Budidaya Kakao dan Permasalahan Kakao di Indonesia 2.2.1 Budidaya Kakao
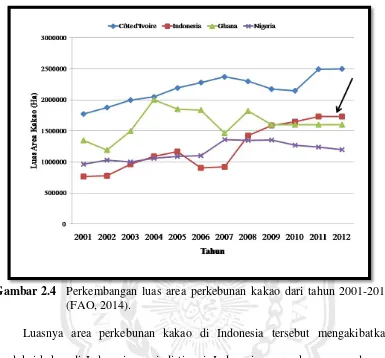
Gambar 2.4 Perkembangan luas area perkebunan kakao dari tahun 2001-2012 (FAO, 2014).
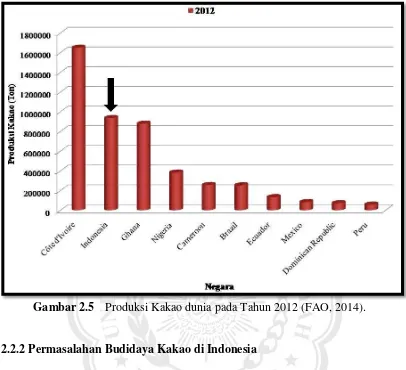
Gambar 2.5 Produksi Kakao dunia pada Tahun 2012 (FAO, 2014).
2.2.2 Permasalahan Budidaya Kakao di Indonesia
Banyak faktor yang diduga menjadi penyebab rendahnya produktivitas kakao di Indonesia, diantaranya adalah usia tanaman kakao yang cukup tua (lebih dari 25 tahun). Saat ini hampir 90 % dari total perkebunan kakao di Indonesia telah berusia tua dan harus segera diremajakan (Taufik et al,. 2010). Disamping itu faktor bibit kakao yang berkualitas rendah juga memegang peran peting dalam hal rendahnya produktivtias kakao di Indonesia (Limbongan, 2012). Oleh karena itu, diperlukan upaya untuk meningkatkan kualitas bibit kakao yang unggul dalam jumlah yang banyak dan dalam waktu yang singkat guna mengatasi permasalahan di atas.
2.2.3 Pembibitan Tanaman Kakao
Mayoritas petani kakao di Indonesia penyediaan bibit secara generatif melalui biji. Biji kakao yang dipanen dari tanaman kakao yang unggul dibersihkan dari pulp kemudian dikeringkan sampai kadar air 40% selanjutnya dikecambahkan selama 12 hari. Benih yang telah dikecambahkan kemudian dipelihara selama 4 - 5 bulan sampai siap untuk di tanam di lahan (Rahardjo, 2011).
kuntum yang sama (Prawoto, 2008). Sebagai akibatnya biji yang dihasilkan tidak memiliki sifat genetik yang seragam karena memilik dua induk yang berbeda.
Alternatif lain yang mulai banyak digunakan oleh para petani untuk menghasilkan bibit yang relatif sama dengan induknya dengan cara pembibitan secara vegetatif melalui stek, okulasi dan sambung pucuk (Rahardjo, 2010). Pembibitan dengan stek dilakukan dengan cara memotong batang atau pucuk tanaman kakao yang masih muda kemudian ditanam ke dalam pot yang telah berisi medium. Stek akan mulai tumbuh akar setelah berumur tiga minggu dan siap untuk ditanam di lahan setelah berumur enam bulan (Raharjo, 2010).
Teknik ini mudah dilakukan dan menghasilkan bibit dengan sifat genetis yang sama dengan induknya (Siregar et al., 2010). Namun teknik tersebut masih memiliki tingkat keberhasilan rendah yaitu 27 % pada tanaman kakao (Abdoellah, 2008). Akibatnya, teknik tersebut tidak mampu menghasilkan bibit dalam jumlah masal serta merusak tanaman induk yang akan di stek (Rahardjo, 2010).
merusak tanaman induknya. Disamping itu, keterbatasan mata tunas yang dibutuhkan menyebabkan jumlah bibit yang dihasilkan juga terbatas (Rahardjo, 2010).
Cara lain yang digunakan oleh petani kakao adalah melalui sambung pucuk (Siregar et al., 2010). Teknik ini dilakukan dengan cara memotong cabang muda dari tanaman yang berkualitas kemudian disambungkan pada bibit kakao yang berasal dari biji. Teknik sambung pucuk ini akan menghasilkan bibit dengan sifat genetika yang sama dengan induknya, akan tetapi teknik tersebut memiliki tingkat keberhasilan yang relatif rendah serta akan dihasilkan bibit dengan jumlah yang terbatas, karena terbatasnya jumlah pucuk yang akan disambung (Karmawati et al., 2010).
2.3 Perkembangan Penelitian Embriogenesis Somatik Kakao
keahlian khusus, serta harus dilakukan di laboratorium sehingga membutuhkan biaya yang relatif mahal (Hendaryono & Wijayani, 1994).
Beberapa teknik kultur jaringan telah dikembangkan untuk perbanyakan bibit kakao seperti melalui kultur pucuk dan kultur tunas aksiler (Zulkarnain, 2009). Namun, kultur pucuk kakao belum berhasil diaplikasikan dalam jumlah masal serta memiliki beberapa kendala seperti tumbuhan yang dihasilkan memiliki pertumbuhan yang lambat dan memiliki akar serabut (Zulkarnain, 2009). Teknik kultur tunas aksiler juga belum berhasil untuk diaplikasikan pada tanaman kakao (Figuera et al., 1991)
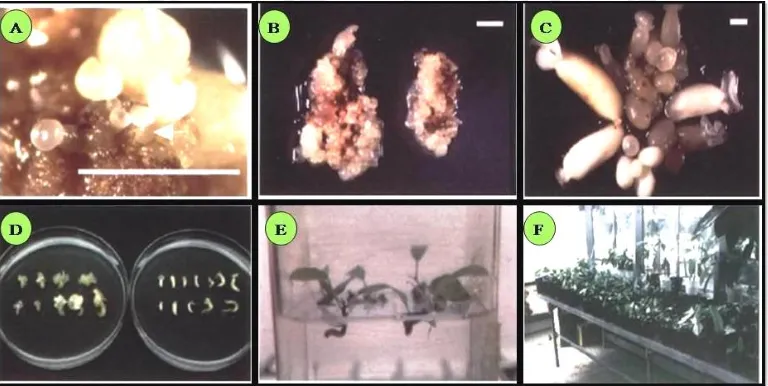
Salah satu teknik kultur jaringan yang mulai dikembangkan untuk menyediakan bibit kakao secara in vitro adalah dengan menggunakan teknik embryogenesis somatik (Winarsih et al., 2003; Avivi et al., 2010). Embryogenesis somatik adalah teknik budidaya tanaman secara in vitro dimana sel somatik berkembang membentuk tumbuhan baru melalui tahap perkembangan embryo yang spesifik tanpa melalui peleburan sel gamet (Purnamaningsih, 2002). Pada teknik embryogenesis somatik ada beberapa tahap, yaitu (1) induksi kalus embriogenik (2) induksi embrio somatik (3) perkecambahan dan (4) aklimatisasi (Gambar 2.6; Li et al., 1998)
dengan cara memindahkan ke dalam medium dengan penambahan auksin dengan konsentrasi rendah (Purnamaningsih, 2002). Tahapan pembentukan embryo dimulai dari fase globular, hati, torpedo dan kotiledon (Gambar 2.6; Purnamaningsih, 2002).
Embryo somatik yang terbentuk kemudian dikecambahkan pada medium dengan konsentrasi zat pengatur tumbuh yang sangat rendah atau bahkan tidak diberikan sama sekali untuk menjadi tanaman lengkap dengan tunas dan akar (Purnamaningsih, 2002). Tahap terakhir adalah aklimatisasi, pada tahap ini bibit tanaman dipindahkan ke lingkungan ex vitro (Purnamaningsih, 2002).
Gambar 2.6 Tahap perkembangan morfologi embryo somatik kakao; (a) embryo tahap globular; (b) embryo tahap heart; (c) embryo tahap torpedo; (d) embryo tahap kotiledon; (e) planlet; dan (f) aklimatisasi (Li et al., 1998).
pembentukan embryo somatik rendah dan bervariasi dari 1 - 100 % tergantung medium dan eksplan yang digunakan (Li et al., 1998; Winarsih et al., 2003; Avivi et al., 2010) dan memerlukan penanganan yang intensif dengan tenaga kerja yang terampil (Purnamaningsih, 2002).
Teknik embryogenesis somatik telah berhasil digunakan untuk produksi bibit berbagai tanaman seperti tanaman cendana (Santalum album L.; Sukmadjaja, 2005), manggis (Garcinia indica Choiss; Thengane et al., 2006) maupun kopi (Coffea Arabica L.; Riyadi & Tirtoboma, 2004) dengan tingkat keberhasilan yang tinggi, yaitu sekitar 80 % - 100 %. Pada tanaman kakao, embryogenesis somatik juga telah dicobakan untuk menghasilkan bibit yang unggul. Namun, sampai saat ini tingkat keberhasilannya masih sangat bervariasi antara 1 sampai 100 % bergantung kultivar kakao yang digunakan. Jumlah embryo yang dihasilkan dari setiap eksplan yang ditanam juga bervariasi dari 1 sampai 45 buah embrio somatik per eksplan tergantung kultivar yang digunakan (Li et al., 1998)
Berbagai upaya telah dilakukan untuk meningkatkan keberhasilan induksi embryogenesis somatik kakao, seperti penggunaan berbagai jenis eksplan (Siregar, 1991; Chantrapradist & Kanchanapoom, 1995; Li et al., 1998), uji berbagai medium dasar (Li et al., 1998; Winarsih et al., 2003; Avivi et al., 2010) maupun penambahan garam nutrient dengan konsentrasi tertentu ke dalam medium tanam (Minyaka et al., 2008; Emile et al., 2010).
Eksplan embryo zigotik yang diisolasi dari buah muda juga sudah dicobakan untuk induksi embryogenesis somatik kakao, namun persentase keberhasilan juga masih rendah 27 %, serta memiliki sifat genetik yang bervariasi (Diniarti, 1991). Eksplan kotiledon juga pernah dicobakan untuk menginduksi pembentukan embryo somatik kakao, namun eksplan yang digunakan tidak berhasil menginduksi embryo (0 %) (Cahantrapradist & Kanchanapoom, 1995).
Salah satu eksplan yang dilaporkan memiliki tingkat keberhasilan relatif tinggi serta merupakan sel somatik sehingga memiliki sifat genetik yang seragam adalah eksplan staminodia dan petala (Li et al., 1998). Hasil penelitian tersebut menunjukkan bahwa tingkat keberhasilan embryo somatik bervariasi antara 1 sampai 100 % tergantung genotip yang digunakan (Li et al., 1998; Winarsih et al., 2003; Avivi et al., 2010).
Di Universitas Muhammadiyah Purwokerto, upaya pembibitan kakao melalui teknik embryogenesis somatik juga telah dilakukan dengan menggunakan kultivar Criollo. Pada penelitian yang dilakukan oleh Rahayu (2013) dengan menanam kalus pada medium DKW (Driver & Kuniyuki, 1984) dengan penambahan kinetin 5.10-7 M & 10-6 M 2,4-D ke dalam medium tanam. Medium tersebut mampu menginduksi kalus bersifat embryogenik dan medium DKW yang hanya ditambah kinetin 5.10-8 M berhasil menginduksi embryo somatik, meskipun tingkat keberhasilan masih relatif rendah yaitu 1 %.
dapat membentuk kalus dengan tipe yang friable sehingga mampu untuk membentuk embryo somatik. Namun, tingkat keberhasilan dalam induksi embryo masih rendah sekitar 1%.
Penelitian yang dilaporkan oleh Hilyatunnisa (2013) menggunakan eksplan staminodia dan petala yang ditanam pada medium DKW dengan kombinasi 10-7 M Adenin & 5 x 10-7 2,4-D berhasil untuk menginduksi kalus tetapi penelitian ini belum berhasil menginduksi embryo. Penambahan air kelapa ke dalam medium tanam juga belum dapat meningkatkan keberhasilan induksi embryo somatik kakao.
Upaya lain juga telah dilakukan untuk meningkatkan keberhasilan induksi embryo somatik kakao diantaranya adalah dengan menggunakan beberapa medium dasar seperti medium MS (Murashige & Skoog, 1962), dan DKW (Driver & Kuniyuki, 1984). Medium MS telah dicobakan untuk menginduksi embryogenesis somatik kakao, namun tingkat keberhasilannya sangat rendah (0 – 11 %; Alemanno et al., 1996). Medium DKW berhasil menginduksi pembentukan embryo somatik dengan tingkat keberhasilan yang lebih baik, namun persentae keberhasilannya sangat tergantung kultivar yang digunakan (Li et al., 1998; Maximova et al., 2002).
media. Hasil penelitian menunjukkan bahwa tingkat keberhasilan induksi embrio somatik kakao dapat mencapai 40 %. Penelitian yang sama juga dilakukan oleh Emile et al. (2010), namun hasil penelitian tersebut menunjukkan bahwa tingkat keberhasilannya lebih rendah dibandingkan penelitian Minyaka et al. (2008) yaitu kurang dari 30 %.
2.4 Medium Tanam
Medium kultur jaringan merupakan salah satu faktor penentu keberhasilan dalam perbanyakan tanaman secara in vitro (Yusnita, 2003). Sampai saat ini teredapat lebih dari 200 komposisi medium dasar yang banyak digunakan untuk kultur jaringan. Beberapa komposisi medium dasar yang banyak digunakan dalam kultur jaringan antara lain medium dasar MS (Murashige & Skoog, 1962) yang dapat digunakan untuk hampir semua jenis kultur; medium dasar B5 (Gambrog, 1968) yang dapat digunakan untuk kultur sel pada tanaman kedelai dan legume lain, medium dasar WPM (Woody Plant Medium, 1981) yang banyak digunakan untuk tanaman berkayu, maupun medium dasar DKW (Driver & Kuniyuki, 1984) yang banyak digunakan untuk embryogenesis somatik (Hendaryono & Wijayanti, 1994). Pada umumnya, media kultur jaringan mengandung unsur garam makro, garam mikro, vitamin, asam-asam amino essensial, gula dan zat pengatur tumbuh (ZPT).
2.4.1 Makronutrien
Sherrington (1984) menyebutkan beberapa persenyawaan makronutrien yang umum digunakan pada medium kultur jaringan, antara lain: Nitrogen (N), Fosfor (P), Kalium (K), Sulfur (S), Kalsium (Ca) dan Magnesium (Mg). Unsur – unsur makro biasanya diberikan dalam bentuk garam berupa NH4NO3, KNO3, CaCl2.2H2O, MgSO4.7H2O dan KH2PO4. Macam dan konsentrasi garam makro yang optimum untuk tiap-tiap komponen untuk memenuhi pertumbuhan yang maksimal bagi setiap jenis tanaman dan setiap jenis eksplan sangat bervariasi.
Salah satu garam yang banyak ditambahkan ke dalam medium tanam adalah garam magnesium sulfat (MgSO4). Garam MgSO4 mengandung ion sulfat yang mampu meningkatkan proses metabolisme seperti sintesis asam amino dan sintesis protein di dalam sel (Saito, 2004; Leustek, 2002). Sulfur banyak ditemukan sebagai komponen penyusun asam amino sistein dan metionin, dan sebagai penyusun vitamin thiamin dan biotin, serta penyusun koenzim A (Salisbury & Ross, 1995). Kondisi tersebut merupakan prasarat utama untuk terjadi proses – proses biologi pada tumbuhan tinggi termasuk proses embryogenesis (Minyaka, 2008). Ion Mg yang terdapat pada garam MgSO4 memiliki peran penting dalam mengaktifkan banyak enzim seperti enzim-enzim yang dibutuhkan dalam reaksi fotosintesis dan respirasi maupun enzim-enzim untuk sintesis asam deoksiribonukleat (DNA) dan asam ribonukleat (RNA; Salisbury & Ross, 1995).
medium tanpa penambahan MgSO4 hanya mampu menghasilkan embryo dengan tingkat keberhasilan yang rendah, yaitu 20 embryo dari setiap eksplan yang ditanam, sedangkan induksi embryo somatik yang dilakukan dengan kadar MgSO4 yang tinggi (4 x 10-3 M) mampu meningkatkan jumlah embryo yang terinduksi hampir sepuluh kali lipat menjadi 200 embryo dari setiap eksplan yang ditanam (Ghasemi et al., 2009).
Hal yang sama juga dilaporkan pada tanaman kanola (Brassica napus L.), yaitu induksi embryo somatik tidak dapat dilakukan pada medium tanpa penambahan MgSO4, sedangkan pada medium dengan penambahan MgSO4 mampu menginduksi pembentukan embryo somatik (Lim & Loh, 1992). Pada tanaman Magnolia, penambahan magnesium dengan konsentrasi tinggi mampu menginduksi pembentukan embryo somatik, sedangkan penambahan magnesium dengan konsentrasi rendah hanya mampu menginduksi pembentukan kalus tanpa diikuti pembentukan embryo somatik (Valova et al.,1996)
sampai 40 % (Minyaka et al., 2008). Hal yang berbeda terjadi pada genotipe IMC 6 dimana eksplan yang sama ditanam pada medium dengan penambahan 1,5x10-3 M MgSO4 hanya menginduksi sekitar 7 % embryo dan penambahan MgSO4 sampai konsentasi 6 x10-3 M hanya mampu meningkatkan keberhasilan induksi embryo kurang dari 15 % (Minyaka et al.;2008).
Penelitian tentang pengaruh penambahan MgSO4 ke dalam medium tanam terhadap keberhasilan induksi embryo somatik pada tanaman kakao kultivar Criollo belum pernah dilaporkan, maka pada penelitian ini dilaporkan uji tentang hal tersebut pada penelitian ini.
2.4.2 Mikronutrien
Unsur hara mikro adalah unsur yang diperlukan dalam jumlah sedikit. George dan Sherrington (1984) menyebutkan beberapa persenyawaan mikronutrien yang umum digunakan pada medium kultur jaringan, antara lain: Klor (Cl), Mangan (Mn), Besi (Fe), Tembaga (Cu), Seng (Zn), Bor (B), dan Molibdenum (Mo). Unsur – unsur mikro biasanya diberikan dalam bentuk MnSO4.4H2O, ZnSO4.4H2O, H3BO3, KJ, NaMoO4.2H2O, CuSO4.5H2O dan CoCl2.6H2O (Indrianto, 2002). Meskipun diperlukan dalam jumlah sedikit, namun jika tidak ada unsur hara mikro di dalam medium tanam dapat menyebabkan kelainan pertumbuhan.
2.4.3 Vitamin
nikotinat. George dan Sherrington (1984) memasukan beberapa macam vitamin yang umum digunakan pada berbagai medium dasar, antara lain: thiamin-HCl, niasin, glisin, piridoksin HCl, myo-inositol, asam folat, sianokobalamin, riboflavin, biotin, kolin klorida, kalsium pantetonat, piridoksin fosfat dan nikotinamida (Hendaryono & Wijayanti, 1994).
2.4.4 Asam – Asam Amino
Asam –asam amino berperan penting untuk pertumbuhan dan diferensiasi kalus. Kebutuhan asam amino untuk setiap tanaman berbeda beda. Asparagin dan Glutamin berperan dalam metabolisme asam amino, karena dapat menjadi pembawa dan sumber amonia untuk sintesis asam – asam amino baru dalam jaringan. Adapun asam amino yang umum ditambahkan pada medium adalah: glutamine, glycine, L-cyteine, L-arginine, L-Aaspartic acid, L-methionine. (Hendaryono & Wijayanti, 1994).
2.4.5 Gula
2.4.6 Zat Pengatur Tumbuh
Zat Pengatur Tumbuh (ZPT) merupakan senyawa organik baik yang disintesis oleh tumbuhan itu sendiri (hormon) maupun senyawa sintetik dalam konsentrasi sangat rendah mampu mendukung, menghambat, atau menimbulkan respon bagi tumbuhan (Salisbury & Ross, 1995). Secara umum ada lima kelompok ZPT yang digunakan dalam kultur jaringan, yaitu auksin, sitokinin. giberelin, etilen, dan asam abisat (Salisbury & Ross, 1995).
Salah satu ZPT yang banyak digunakan pada kultur jaringan adalah sitokinin. Sitokinin berperan dalam memacu dalam pembelahan sel dan pembentukan organ, mendorong pemanjangan sel, menunda penuaan, memacu perkembangan kloroplas dan sintesis protein (Salisbury & Ross, 1995). Pemberian sitokinin ke dalam medium, kultur jaringan juga penting dalam meningkatkan keberhasilan pembelahan sel, ploriferasi pucuk, morfogenesis pucuk, perkecambahan biji (Zulkarnain, 2009). Pemberian sitokinin dalam konsentrasi yang relative tinggi akan merangsang pembentukan tunas (Hendaryono & Wijayanti, 1994). Berbagai macam ZPT golongan sitokinin yaitu BA (benzil adenin), kinetin (furfuril amino purin), 2-Ip (dimethyl allyl aminopurin), dan zeatin serta TDZ (Thidiazuron) (Salisbury & Ross, 1995). Salah satu sitokininyang biasa digunakan dalam kultur jaringan dari golongan sitokinin adalah Thidiazuron (TDZ)
2.4.6.1 Thidiazuron (TDZ)
2.7; Windujati, 2011). TDZ merupakan salah satu sitokinin sintetik yang memiliki kemampuan lebih baik dalam menginduksi tunas, diantara sitokinin lain seperti benzylaminopurin dan kinetin (Mok & Mok, 2001). ZPT ini berfungsi memacu pembentukan tunas adventif (Huetterman dan Prece, 1993), menginduksi proses pembelahan sel secara cepat pada kumpulan sel meristem sehingga terbentuk primordia tunas (George danSherington, 1984).
Gambar 2.7 Rumus bangun Thidiazuron (Salisbury & Ross, 1995)
Beberapa penelitian menunjukkan bahwa penambahan TDZ ke dalam medium tanam telah berhasil digunakan untuk menginduksi embryo somatik pada tanaman cendana (Santalum album L.). Pada tanaman tersebut, penambahan 9 x 10-6 TDZ ke dalam medium MS berhasil menginduksi pembentukan embryo somatik dengan tingkat keberhasilan mencapai 33 % (Sukmadjaja, 2005). Pada tanaman pule pandak (Rauvolfia serpentina L.), penambahan 2.7 x 10-5 TDZ yang dikombinasikan dengan 2,2 x 10-6 2,4-D ke dalam medium MS berhasil menginduksi embryo dengan tingkat keberhasilan mencapai 100 % (Sugito, 2006).
sedangkan pada genotipe yang lain seperti ICS da Pound hanya berhasil menginduksi pembentukan embryo somatik dengan tingkat keberhasilan kurang dari 10 % (Li et al.,1998). Jumlah embryo yang berhasil diinduksi dari setiap eksplan staminodia yang ditanampun juga bervariasi tergantung genotipe yang digunakan. Pada Sca6, penambahan 22,7 x 10-8 M TDZ ke dalam medium DKW mampu menginduksi embryo somatik sebanyak lebih dari 45 embrio per eksplan, sedangkan pada genotipe Pound dan ICS, penambahan TDZ ke dalam medium tanam dengan konsentrasi tersebut hanya mampu menginduksi kurang dari 3 embryo per eksplan yang ditanam (Li et al., 1998).