4
Hasil dan Pembahasan
4.1 Sintesis Ligan H2AdBP dan H2SbBP
Pada penelitian ini dilakukan sintesis senyawa H2AdBP dan H2SbBP berdasarkan metode
Jensen yang telah dimodifikasi.
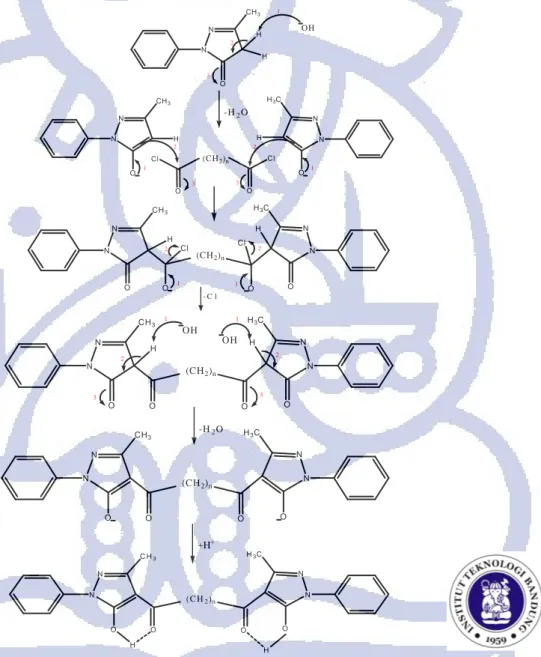
Gambar 4.1 Mekanisme reaksi sintesis ligan H2AdBP (n=4) dan H2SbBP (n=8). -H2O - C l 2 N N CH3 H O H OH 1 3 1 2 3 N N CH3 H O Cl O Cl O (CH2)n N N H3C H O 1 3 2 1 2 1 2 N N CH3 H O Cl O Cl O (CH2)n N N H3C H O N N C H3 O O O ( C H2)n N N H3C O H H N N CH3 O O O (CH2)n N N H3C O 1 N N CH3 H O O O (CH2)n N N H3C H O 2 3 1 2 3 OH OH -H2O +H+
Pada tahap awal sintesis dilakukan reaksi antara MPP dengan Ca(OH)2. Tahap ini
merupakan proses aktivasi melalui penyerangan oleh basa terhadap atom H pada posisi α
dari gugus karbonil yang bersifat asam pada MPP. Hasilnya akan terbentuk suatu intermediet enolat. Ikatan rangkap yang terbentuk akan menyerang gugus karbonil yang terdapat pada sebakoil atau adipoil yang menyebabkan terlepasnya ion Cl-. Reaksi ini berlangsung pada suhu 100ºC – 125ºC selama 5 jam. Reaksi selengkapnya dapat dilihat pada Gambar 4.1. Setelah reaksi selesai campuran hasil reaksi didinginkan sampai suhu kamar. Setelah dingin pada campuran akan terbentuk endapan berwarna kuning keputihan. Endapan ini merupakan senyawa Ca(OH)2 dan ligan yang mengendap.
Ca(OH)2 yang mengendap dipisahkan dari ligan dengan penambahan 200 mL asam klorida
(HCl) 2 M. Campuran dikocok dengan kuat selama 10 menit untuk mempercepat reaksi yang terjadi. Penambahan asam selain untuk melarutkan Ca(OH)2 akan menyebabkan senyawa
yang bersifat polar terekstrak ke dalam fasa air. Endapan yang diperoleh kemudian disaring menggunakan penyaring Buchner. Endapan hasil penyaringan kemudian dicuci dengan aqua dm sampai mendekati pH 7.
Secara sederhana reaksi yang berlangsung dapat digambarkan sebagai berikut:
Gambar 4.2 Persamaan reaksi sintesis ligan
4.1 Karakterisasi H2AdBP dan H2SbBP
Untuk mengetahui keberhasilan dari sintesis, senyawa yang diperoleh dilakukan karakterisasi dengan beberapa uji. Pada penelitian ini senyawa yang diperoleh dikarakterisasi dengan uji titik leleh, uji kelarutan dan uji serapan spektrum Infra Red (IR). Hasil uji titik leleh dapat dilihat pada Tabel 4.1.
Tabel 4.1 Karakterisasi ligan H2AdBP dan H2SbBP
Senyawa Warna Senyawa Rentang titik leleh (ºC)
H2AdBP masih kotor Kuning kecokelatan 190,3-197,6
H2SbBP masih kotor Kuning tua 127,8-132,9
H2SbBP sudah direkris Kuning 132,9-135,4
Dari hasil uji titik leleh terlihat rentang titik leleh untuk senyawa H2SbBP dan H2AdBP yang
cukup lebar. Rentang titik leleh yang lebar mengindikasikan bahwa senyawa H2SbBP dan
H2AdBp yang diperoleh masih belum murni. Senyawa tersebut kemudian dimurnikan
dengan cara melarutkannya dalam pelarut yang terdiri dari etanol-air dengan perbandingan volume 5:1. Setelah dilakukan pemurnian rentang titik leleh menjadi lebih sempit dibandingkan dengan rentang titik leleh sebelum dimurnikan. Data ini menunjukan bahwa semakin murni suatu senyawa maka rentang titik lelehnya semakin sempit. Pada penelitian yang dilakukan oleh Ozoukwu diperoleh titik leleh untuk H2AdBP adalah 193ºC dan
H2SbBP adalah 136ºC. Senyawa H2SbBP dan H2AdBP memiliki kelarutan yang baik dalam
kloroform seperti yang ditunjukan dalam tabel 4.2.
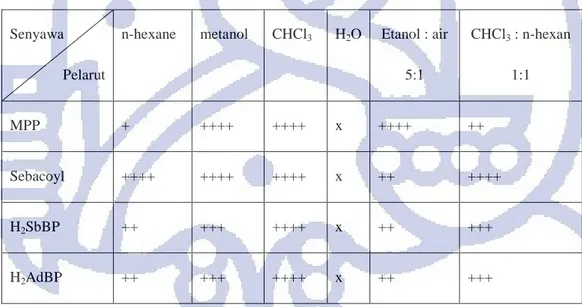
Tabel 4.2 Hasil uji kelarutan H2SbBP dan H2AdBP
Senyawa
Pelarut
n-hexane metanol CHCl3 H2O Etanol : air
5:1 CHCl3 : n-hexan 1:1 MPP + ++++ ++++ x ++++ ++ Sebacoyl ++++ ++++ ++++ x ++ ++++ H2SbBP ++ +++ ++++ x ++ +++ H2AdBP ++ +++ ++++ x ++ +++
Keterangan: + = sedikit larut ++++ = sangat larut x = tidak larut
Untuk mengetahui gugus fungsi yang terdapat dalam senyawa H2SbBP dan H2AdBP hasil
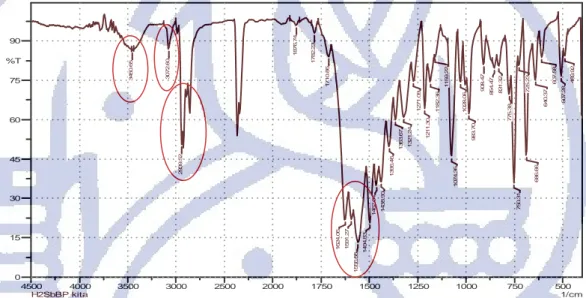
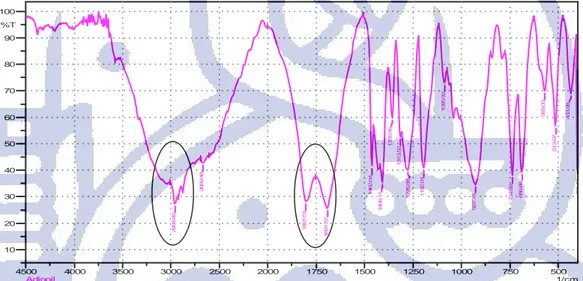
sintesis dilakukan dengan uji serapan spektrum IR untuk kedua senyawa tesebut. Uji serapan spektrum IR juga dilakukan terhadap reagen-reagen yang terlibat dalam sintesis yaitu, adipoil klorida, sebakoil klorida dan MPP yang dijadikan sebagai pembanding. Hasil uji serapan spektrum IR untuk senyawa H2SbBP dapat dilihat pada Gambar 4.3. Puncak vibrasi
H2SbBP hasil sintesis berada dalam bentuk tautomer ketoenol bukan dalam bentuk tautomer
diketonya. Pada bilangan gelombang 3072,60 cm-1 muncul puncak yang menandakan adanya stretching –CH dari gugus benzen. Pada bilangan gelombang 2939,52 cm-1 muncul puncak vibrasi dari –CH2 alifatik. Pada bilangan gelombang 2300-2400 cm
-1
muncul puncak khas CO2 yang berasal dari udara pada saat pembuatan pellet KBr. Puncak khas lainnya sesuai
dengan hasil yang diperoleh Uzoukwu et al., 2009, yaitu vibrasi C=O asimetrik pada 1624,06 cm-1, vibrasi C=C fenil pada 1591,27 cm-1, stretching cincin pirazolon pada 1556,55 cm-1 dan vibrasi asimetrik-C=C- pada 1494,83 cm-1.
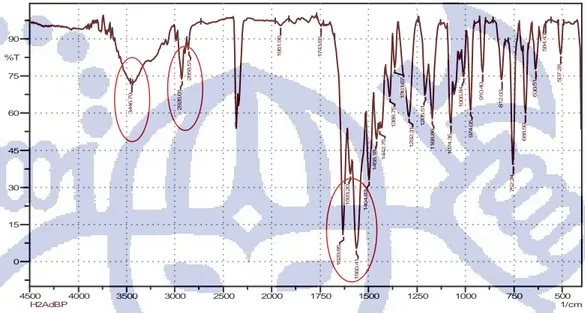
Sedangkan data hasil uji IR H2AdBP (Gambar 4.4) menunjukan data yang tidak jauh
berbeda dengan hasil data uji spektrum serapan IR H2SbBP. Pada H2AdBP puncak vibrasi
gugus -OH muncul pada bilangan gelombang 3446,79 cm-1. Pada hasil uji IR H2AdBP tidak
muncul puncak strectching –CH dari gugus benzena. Puncak vibrasi –CH2 muncul pada
bilangan gelombang 2926,01 cm-1. Puncak khas CO2 juga muncul dalam spektrum IR
H2AdBP. Puncak khas lainnya sesuai dengan hasil yang diperoleh Uzoukwu et al., 2009,
yaitu vibrasi C=O asimetrik pada 1629,85 cm-1, vibrasi C=C fenil pada 1593,20 cm-1, stretching cincin pirazolone pada 1560,41 cm-1 dan vibrasi asimetrik-C=C- pada 1494,83 cm
-1
.
Pada hasil uji serapan spektrum IR untuk senyawa MPP (Gambar 4.5) menunjukan adanya beberapa puncak yang mirip dengan puncak-puncak yang ditunjukkan oleh spektrum IR H2SbBP dan H2SbBP. Pada hasil uji spektrum serapan IR MPP terlihat adanya pergeseran
beberapa puncak, misalnya puncak stretching cincin pirazolon yang bergeser dari 1523,76 cm-1 (pada MPP) menjadi 1556,55 cm-1 (pada H2SbBP) dan 1560,41cm
-1
(pada H2AdBP).
Pergeseran puncak ini menunjukkan bahwa cincin pirazolon pada MPP tidak sama dengan cincin pirazolon pada H2SbBP dan H2AdBP. Puncak lainnya yang bergeser adalah puncak
C=O, dari 1602,85 cm-1 (pada MPP) menjadi 1624,06 cm-1 (pada H2SbBP) dan 1629,01cm -1
(pada H2AdBP). Sedangkan dari hasil uji spektrum serapan IR sebakoil klorida terlihat
puncak khas yang muncul adalah puncak C=O pada 1797,66 cm-1 dan –CH2 pada 2933,73
cm-1. Hasil uji spektrum serapan IR untuk senyawa adipoil klorida terlihat puncak C=O muncul pada 1801,51 cm-1 dan 1691,57 cm-1. Puncak –CH2 muncul pada 2958,50 cm-1.
Dengan membandingkan hasil uji spektrum serapan IR antara H2SbBP dan H2AdBP dengan
pereaksinya terlihat adanya pergeseran puncak dan ada puncak baru yang muncul seperti puncak –OH yang terlihat pada uji spektrum serapan IR senyawa H2SbBP dan H2AdBP yang
sebelumnya tidak muncul pada hasil uji spektrum serapan IR dari pereaksi. Hal ini menunjukan bahwa telah terbentuk senyawa baru dan bukan senyawa hasil pencampuran fisik dari pereaksi.
Tabel 4.3 Spektrum serapan IR untuk H2AdBP dan H2SbBP Bilangan gelombang (cm-1) (H2SbBP) Bilangan gelombang (cm-1) (H2AdBP) Identifikasi 3450,65 3446,79 v(O-H) 3072,60 - v(C-H) aromatik 2939,52 2926,01 v(C-H) CH2 1624,06 1629,85 Vas(C=O) karbonil 1591,27 1593,20 v(C=C) fenil 1556,55 1560,41 cincin pirazolon 1494,83 1494,83 vas(C=C=C) 500 750 1000 1250 1500 1750 2000 2500 3000 3500 4000 4500 1/cm 0 15 30 45 60 75 90 %T 3 4 5 0 .6 5 3 0 7 2 .6 0 2 9 3 9 .5 2 1 8 7 6 .7 4 1 7 8 2 .2 3 1 7 1 0 .8 6 1 6 2 4 .0 6 1 5 9 1 .2 7 1 5 5 6 .5 5 1 4 9 4 .8 3 1 4 6 2 .0 4 1 4 3 8 .9 0 1 3 9 6 .4 6 1 3 6 3 .6 7 1 3 2 1 .2 4 1 2 7 1 .0 9 1 2 1 1 .3 0 1 1 8 2 .3 6 1 1 5 9 .2 2 1 0 7 4 .3 5 1 0 2 8 .0 6 9 8 3 .7 0 9 0 8 .4 7 8 5 4 .4 7 8 3 1 .3 2 7 7 5 .3 8 7 5 0 .3 1 7 2 5 .2 3 6 8 6 .6 6 6 4 0 .3 7 6 0 7 .5 8 5 0 7 .2 8 4 8 9 .9 2 H2SbBP kita
500 750 1000 1250 1500 1750 2000 2500 3000 3500 4000 4500 1/cm 0 15 30 45 60 75 90 %T 3 4 4 6 .7 9 2 9 2 6 .0 1 2 8 5 8 .5 1 1 9 5 1 .9 6 1 7 4 3 .6 5 1 6 2 9 .8 5 1 5 9 3 .2 0 1 5 6 0 .4 1 1 4 9 4 .8 3 1 4 5 8 .1 8 1 4 4 2 .7 5 1 3 8 8 .7 5 1 3 6 3 .6 7 1 2 9 2 .3 1 1 2 0 5 .5 1 1 1 6 8 .8 6 1 0 7 4 .3 5 1 0 0 6 .8 4 9 7 4 .0 5 9 1 0 .4 0 8 1 2 .0 3 7 5 2 .2 4 6 8 8 .5 9 6 3 6 .5 1 5 8 4 .4 3 5 0 7 .2 8 H2AdBP
Gambar 4.4 Spektrum serapan IR H2AdBP.
500 750 1000 1250 1500 1750 2000 2500 3000 3500 4000 4500 1/cm 10 20 30 40 50 60 70 80 90 100 %T 3 1 2 6 .6 1 2 9 2 2 .1 6 2 8 5 0 .7 9 2 5 6 9 .1 8 2 3 6 0 .8 7 23 3 7 .7 2 1 8 0 7 .3 0 1 6 0 2 .8 5 1 5 2 3 .7 6 1 4 9 8 .6 9 1 4 5 6 .2 6 1 3 9 0 .6 8 1 3 4 6 .3 1 1 3 0 3 .8 8 1 2 4 0 .2 3 1 1 9 5 .8 7 1 1 5 5 .3 6 1 0 7 4 .3 5 1 0 2 4 .2 0 9 9 7 .2 0 9 1 6 .1 9 8 9 6 .9 0 8 5 0 .6 1 8 0 2 .3 9 7 5 2 .2 4 6 8 8 .5 9 6 5 3 .8 7 6 1 5 .2 9 5 7 4 .7 9 MPP
500 750 1000 1250 1500 1750 2000 2500 3000 3500 4000 4500 1/cm 0 15 30 45 60 75 90 %T 35 5 0 .9 5 2 9 3 3 .7 3 2 8 5 8 .5 1 1 7 9 7 .6 6 1 4 6 2 .0 4 1 4 0 4 .1 8 1 3 4 6 .3 1 12 9 6 .1 6 1 2 0 1 .6 5 1 1 4 3 .7 9 1 1 0 9 .0 7 9 5 2 .8 4 8 2 1 .6 8 7 2 3 .3 1 6 7 8 .9 4 5 6 9 .0 0 5 0 1 .4 9 4 3 2 .0 5 Sebacoil
Gambar 4.6 Spektrum serapan IR sebakoil klorida
500 750 1000 1250 1500 1750 2000 2500 3000 3500 4000 4500 1/cm 10 20 30 40 50 60 70 80 90 100 %T 2 9 5 8 .8 0 2 6 6 9 .4 8 1 8 0 1 .5 1 1 6 9 1 .5 7 1 4 6 2 .0 4 1 4 0 6 .1 1 1 3 5 5 .9 6 1 3 1 3 .5 2 1 2 7 6 .8 8 1 1 9 2 .0 1 1 0 8 5 .9 2 9 2 7 .7 6 7 3 4 .8 8 6 8 6 .6 6 5 6 9 .0 0 5 1 3 .0 7 4 3 3 .9 8 4 0 1 .1 9 Adipoil
4.2 Analisis Kompleks Yttrium-Alizarin S
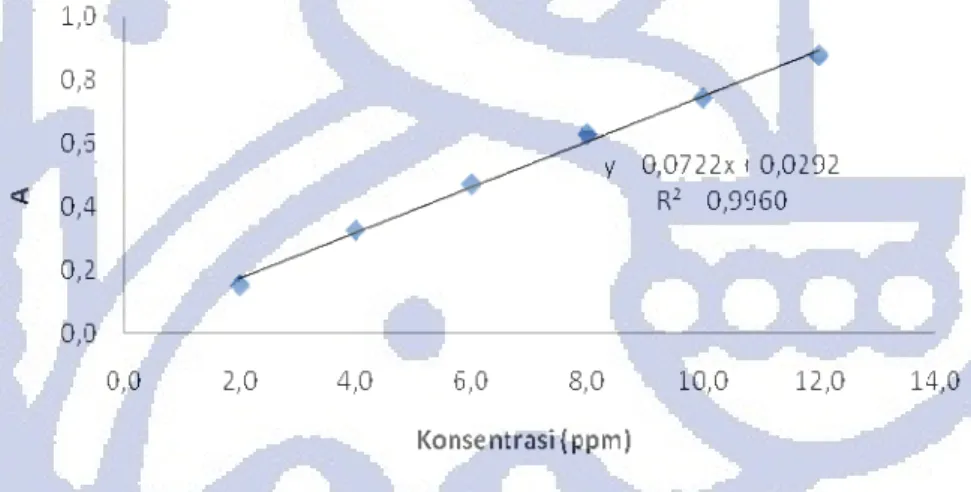
Pada penelitian ini analisis kompleks yttrium-alizarin S dilakukan dengan menggunakan metode spektrofotomerti UV-Vis. Sebelum pengukuran dilakukan pada penelitian ini yttrium dikompleksan dengan alizarin S membentuk suatu senyawa kompleks. Senyawa kompleks yang terbentuk relatif stabil setelah 1 jam. Oleh karena itu pada penelitian ini seluruh pengukuran dilakuka setelah 1 jam semua pereaksi dicampurkan. Larutan kompleks yttrium alizarin berwarna merah-ungu. Warna ini merupakan warna yang diteruskan oleh kompleks yang kemudian ditangkap oleh mata sebagai warna larutan. Warna merah-ungu merupakan warna komplementer dari warna hijau. Warna hijau inilah yang sebenarnya diserap oleh kompleks sehingga panjang gelombang serapan maksimum berada pada daerah panjang gelombang dari warna hijau. Panjang gelombang warna hijau adalah 500-560 nm. Pada penelitian ini panjang gelombang maksimum untuk pengukuran dipilih pada 530 nm. Pada penelitian ini kurva kalibrasi untuk yttrium memiliki persamaan y = 0,0722x + 0,0292, dengan y merupakan absorbans yang terukur dan x konsentrasi analit. Koefisien korelasi (r²) yang diperoleh adalah 0,9960. Kurva kalibrasi yttrium dapat dilihat pada Gambar 4.8.
Gambar 4.8 Kurva kalibrasi yttrium
Jika mengacu kepada hukum Lambert-Beer maka semestinya persamaan yang diperoleh y=mx, yang menyatakan bahwa apabila tidak ada analit dalam sampel maka tidak ada serapan serapan yang terukur. Namun demikian pada suatu percobaan persamaan ini sulit untuk dicapai karena adanya indikasi bahwa nilai ε tergantung dari sifat zat yang menyerap dan panjang gelombang radiasi Selain itu penyimpangan yang terjadi dalam hukum Labert-Beer dapat terjadi karena karakteristik alat yang digunakan dalam pengukuran (Day & Underwood, 1990). Persamaan yang diperoleh masih layak untuk menentukan konsentrasi suatu sampel yang tidak diketahui karena memiliki r2~1. Daerah linier dari kurva kalibrasi
berada pada daerah konsentrasi 2-12 ppm dengan nilai absorbansi pada daerah 0,1522-0,8801 dengan kepekaan 0,07 absorbans ppm-1. Kurva kalibrasi untuk yttrium secara lengkap dapat dilihat pada lampiran.
4.3 Pengaruh Konsentrasi Ligan dan pH Terhadap Angka Banding Distribusi
Yttrium (DY(III)).
Pengaruh konsentrasi ligan dan pH dipelajari dengan melakukan ekstraksi pada konsentrasi ligan dan pH yang bervariasi. Namun terlebih dahulu harus melihat kemungkinan reaksi yang dapat terjadi pada saat ekstraksi. Hal ini dilakukan untuk mengetahui spesi apa saja yang terlibat dalam proses ekstraksi pelarut Y(III). Kemungkinan reaksi-reaksi yang terjadi pada proses ekstraksi pelarut Y(III) adalah sebagai berikut:
1. Reaksi pembentukan Y(III) dengan ion OH-.
3 2
(
)
Y
++
OH
−⇌
Y OH
+ 2 1 3[ (
) ]
[
][
]
Y OH
Y
OH
β
=
+ +− (Pers. 4.1) 3 22
(
)
Y
++
OH
−⇌
Y OH
+ 2 2 3 2[ (
) ]
[
][
]
Y OH
Y
OH
β
=
+ +− (Pers. 4.2) 3 33
(
)
Y
++
OH
−⇌
Y OH
3 3 3 3 [ ( ) ] [ ][ ] Y OH Y OHβ
= + − (Pers. 4.3)2. Ligan H2SbBP dan H2AdBP merupakan asam lemah yang dilambangkan dengan LH2.
Maka ligan akan mengalami disosiasi dalam air, yaitu
2 2 3
LH
+
H O
⇌
LH
−+
H O
+ 1 3 2 2[
][
]
[
][
]
LH
H O
Ka
LH
H O
− +=
(Pers. 4.4) 2 2 3LH
−+
H O
⇌
L
−+
H O
+ 2 3 2 2[
][
]
[
][
]
L
H O
Ka
LH
H O
− + −=
(Pers. 4.5)3. Reaksi pembentukan kompleks yttrium dengan ligan berlangsung sebagai berikut
3 (3 2 ) 2 ( ) 2 n n Y ++nLH ⇌ YL − + nH+ 2 (3 2 ) 3 2 [ ] [( ) ] [ ][ ] n n n n H YL K Y LH + − + = (Pers. 4.6)
Atau dapat ditulis
2 (3 2 ) 3 3
[
] [(
)
]
[
]
[
][
]
n n n nH
YL
Y
K Y
LH
+ − + +=
(Pers. 4.7)4. Distribusi ligan 2 2
nLH
⇌
nLH
1 2 2[
]
[
]
dnLH
K
nLH
=
(Pers. 4.8)5. Y(III) akan bereaksi dengan ligan membentuk kompleks. Reaksi ini terjadi pada bagian antar muka kloroform-air. Kompleks yang terbentuk akan terdistribusi ke dalam fasa air dan organik.
(3 2 ) (3 2 ) (YLn) − n ⇌(YLn) − n (3 2 ) 2 (3 2 ) [( ) ] [( ) ] n n d n n YL K YL − − = (Pers. 4.9)
Karena ligan mengalami kelarutan yang sangat kecil dalam air maka ligan dianggap tidak terdistribusi ke dalam fasa air sehingga nilai Kd1 dapat diabaikan. Kemudian nilai β2, β2 dan
β3 dianggap sangat kecil sehingga dapat diabaikan. Maka nilai D dapat ditentukan sebagai
berikut: 3 (3 2 ) (3 2 ) 3 3 (3 2 ) 3 (3 2 ) (3 2 ) [ ] [( ) ] [( ) ] [ ] [ ] [( ) ] [ ] [( ) ] 1 [( ) ] n n total n n n total n n n n n Y YL YL D Y Y YL Y YL YL + − − + + − + − − = = = + + (Pers. 4.10) 2 2 3 2 (3 2 ) 2
[
]
[
]
1
1
[(
)
]
[
]
d d n n n nK
K
D
Y
H
YL
K LH
+ + −=
=
+
+
(Pers. 4.11) 2 2 2[
]
log
log
log 1
[
]
n d nH
D
K
K LH
+
=
−
+
(Pers. 4.12) 2[2
]
1
[
]
nnH
K LH
+>>
2 2 2log
D
=
log
K
d−
log[
H
+]
n+
log
K
+
log[
LH
]
n (Pers. 4.13)2 2
log
D
=
log
K
d+
(2 )
n pH
+
log
K
+
n
log[
LH
]
(Pers. 4.14)Jumlah ligan yang terikat pada Y(III) dapat ditentukan dengan melakukan ekstraksi pada pH tetap sehingga log D=f(log[ligan]). Dengan demikian akan terdapat 3 buah tetapan yaitu log Kd2,log K dan (2n)pH yang dapat ditulis sebagai K’. Maka akan diperoleh persamaan
2
Dengan membuat kurva log D terhadap log [ligan] maka akan diperoleh suatu garis lurus dengan kemiringan n. Nilai n adalah jumlah ligan yang terikat pada Y(III).
Ion H+ yang dilepaskan ligan dalam proses ekstraksi dapat ditentukan dengan melakukan ekstraksi pada konsentrasi ligan yang tetap. Sehingga diperoleh 3 buat tetapan yang dapat digabungkan yaitu log Kd2,log K dan log[ligan] yang ditulis sebagai K”. Sehingga diperoleh
persamaan
logD=K" (2 )+ n pH (Pers. 4.16)
Dengan membuat kurva log D terhadap pH akan diperoleh suatu garis lurus yang memiliki kemiringan 2n. Nilai n adalah sama dengan jmlah ion H+ yang dilepaskan ligan.
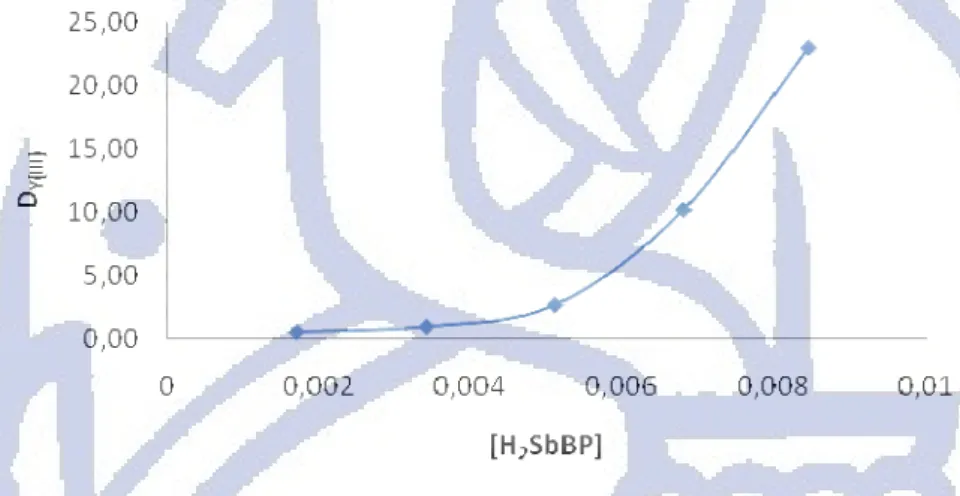
Pada penelitian ini pengaruh konsentrasi H2SbBP terhadap nilai angka banding distribusi
dari Y(III) (DY(III)) pada pH 4,53 dapat dilihat pada Gambar 4.9. Hasil ini menunjukan
bahwa kenaikan konsentrasi ligan H2SbBP dalam kloroform dapat meningkatkan nilai DY(III).
Gambar 4.9 Pengaruh konsentrasi ligan H2SbBP terhadap DY(III)
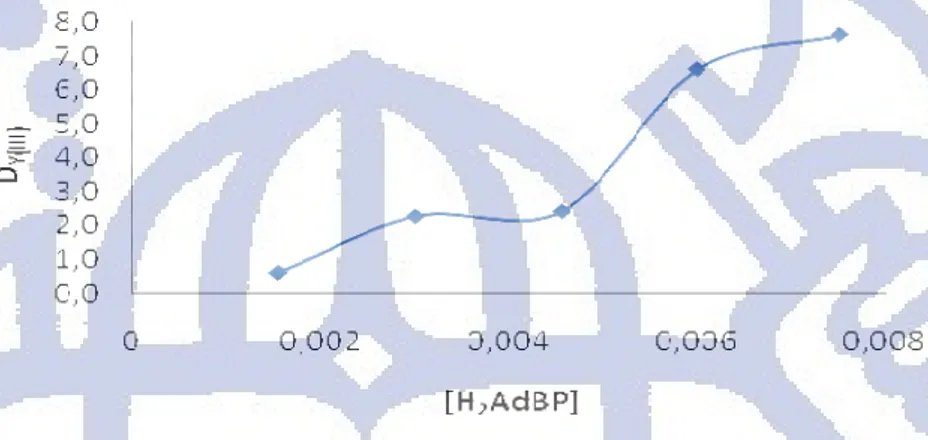
Hal yang sama terjadi untuk ekstraksi Y(III) dengan H2AdBP seperti yang terlihat pada
Gambar 4.10. Nilai D yang semakin besar menunjukan semakin banyaknya Y(III) yang berpindah ke dalam fasa kloroform. Sehingga dengan naiknya nilai D efisiensi ekstraksi Y(III) menjadi meningkat. Hal ini menunjukan kinerja ligan H2SbBP dan H2AdBP pada
ekstraksi Y(III) dapat ditingkatkan dengan memperbesar konsentrasi ligan H2SbBP dan
Gambar 4.10 Pengaruh konsentrasi ligan H2AdBP terhadap DY(III)
Jumlah ligan yang terikat pada Y(III) dapat diperkirakan dari nilai kemiringan kurva log D terhadap log konsentrasi ligan dalam fasa organik sesuai Pers. 4.15. Pada penelitian ini diperoleh persamaan log DY(III)=2,367 log[H2SbBP] + 6,070 untuk ekstrasksi menggunakan
H2SbBP seperti yang terlihat pada Gambar 4.11.
Gambar 4.11 Kurva log DY(III) terhadap log konsentrasi ligan H2SbBP dalam fasa organik
Dari persamaan yang tersebut kemiringan kurva sama dengan 2,367. Hasil ini mengindikasikan kemungkinan bahwa jumlah ligan H2SbBP yang terikat pada satu ion
Y(III) sebanyak 2 atau 2,5. Sedangkan pada ekstraksi dengan menggunakan ligan H2AdBP
diperoleh persamaan dari kurva log D terhadap log konsentrasi H2AdBP dalam fasa organik
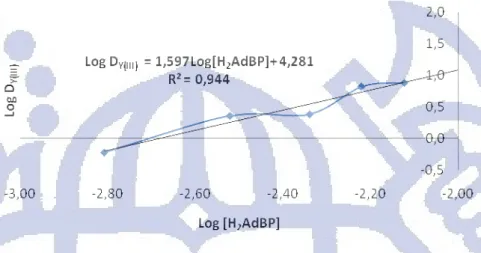
(Gambar 4.12) log DY(III) = 1,597 log[H2AdBP]+ 4,281. Dari persamaan tersebut diperoleh
nilai kemiringan kurva sebesar 1,597 yang menunjukan kemungkinan dari jumlah ligan H2AdBP yang terikat pada ion Y(III) sebanyak 1,5 atau dua ion Y(III) diikat oleh tiga ligan
Gambar 4.12 Kurva log DY(III) terhadap log konsentrasi ligan H2AdBP dalam fasa organik
Akan tetapi, hasil ini masih belum dapat dijelaskan secara seksama mengenai jumlah sebenarnya dari ligan yang terikat pada ion Y(III). Hal ini terjadi karena ligan yang digunakan dalam ekstraksi masih berupa crude sehingga memungkinkan adanya spesi lain yang ikut terikat pada Y(III). Oleh karena itu perlu dilakukan penelitian dan pengkajian lebih lanjut untuk mengetahui secara pasti jumlah ligan yang terikat pada Y(III).
Pengaruh pH pada ekstraksi Y(III) dengan menggunakan ligan H2SbBP dapat dilihat pada
Gambar 4.13. pada gambar tersebut teramati nilai DY(III) mengalami kenaikan pada daerah
pH 3-4,53. Hal ini dikarenakan dengan naiknya pH dapat mendorong ligan membentuk spesi LH- atau L2- pada daerah antar muka kloroform-air. Spesi-spesi inilah yang diduga berikatan dengan Y(III) membentuk kompleks. Pada pH yang lebih tinggi konsentrasi spesi LH- dan L2- semakin meningkat sehingga jumlah Y(III) yang terekstrak kedalam kloroform menjadi lebih banyak. Namun perlu diperhatikan pada pH 5 nilai DY(III) kembali turun. Penurunan
nilai DY(III) pada pH 5 terjadi karena adanya kemungkinan terjadinya pembentukan spesi lain
dari Y(III) yang menyebabkan sebagian Y(III) tidak dapat terekstrak oleh ligan seperti terbentuknya Y(OH)3. Oleh karena itu pH 4,53 dapat dipilih sebagai pH ekstraksi optimal
Gambar 4.13 Kurva hubungan DY(III) terhadap pH pada ekstraksi Y(III) menggunakan
ligan H2SbBP
Pada ligan H2AdBP menunjukkan perilaku yang sedikit berbeda dengan ligan H2SbBP.
Seperti yang terlihat pada Gambar 4.15 terbentuk dua pola yaitu pada rentang 3-4,5 dan 5-6. Pada rentang 3-4,5 nilai DY(III) mengalami kenaikan yang relatif kecil dengan naiknya pH
apabila dibandingkan dengan kenaikan DY(III) pada rentang pH 5-6. Dari kurva yang
diperoleh masih belum dapat dilakukan penentuan pH ekstraksi optimal dari Y(III) menggunakan ligan H2AdBP.
Gambar 4.14 Kurva hubungan DY(III) terhadap pH pada ekstraksi Y(III) menggunakan ligan
H2AdBP
Perbedaan prilaku yang terlihat pada kedua ligan menunjukan bahwa masing-masing ligan memiliki cara interaksi yang berbeda dengan Y(III).
Pengkajian lebih lanjut mengenai pengaruh pH dilakukan dengan membuat kurva hubungan log DY(III) terhadap pH. Pada penelitian ini, ekstraksi Y(III) dengan menggunakan ligan
mengacu pada Pers. 4.16 kemiringan dari kurva akan sama dengan jumlah ion H+ yang dilepaskan oleh ligan. Persamaan yang diperoleh adalah log DY(III) = 0,177pH - 0,231 dengan
kemiringan sebesar 0,177.
Gambar 4.15 Kurva hubungan log DY(III) terhadap pH pada ekstraksi Y(III) menggunakan
ligan H2SbBP
Kurva hubungan log D terhadap pH untuk H2AdBP dilakukan pada dua daerah pH, yaitu
pada daerah pH 3-5 dan pH 5-6 (Gambar 4.16). Persamaan yang diperoleh untuk rentang pH 3-5 adalah log DY(III) = 0,183pH - 0,782 dan pada rentang pH 5-6 adalah log DY(III) =
0,859pH - 4,194.
Gambar 4.16 Kurva hubungan log DY(III) terhadap pH pada ekstraksi Y(III) menggunakan
ligan H2AdBP
Pada penelitian ini nilai kemiringan yang diperoleh untuk setiap kurva log D terhadap pH baik itu ligan H2SbBP maupun H2AdBP kurang dari 1. Hal ini mengindikasikan bahwa ligan
tidak melepaskan H+ pada saat berikatan dengan ion Y(III). Namun demikian, hal ini masih memerlukan penelitian dan pengkajian lebih lanjut.
Pada Gambar 4.17. terlihat pada rentang pH 3-5 kinerja ligan H2SbBP memiliki kinerja yang
lebih baik apabila dibandingkan dengan ligan H2AdBP. Panjangnya rantai polimetilena yang
terdapat pada kedua ligan sangat mempengaruhi kinerja dari ligan tersebut dalam mengekstrak Y(III).
Gambar 4.17 Kurva kinerja ligan H2SbBP dan H2AdBP pada pH 3-5
Menurut Pavithran & Reddy, 2005, semakin besar jarak atom oksigen pada karbonil yang terikat pada ujung polimetilena maka kinerja ligan akan semakin baik dalam mengekstrak LTJ. Namun hubungan ini tidaklah selalu berlaku kareana untuk jarak yang lebih besar dari 12,18 A, kinerja ligan akan kembali menurun. Menurut Pavithran & Reddy, 2005, hal ini berkaitan dengan faktor sterik dan orientasi dari gugus hidroksil dari ligan. Kedua faktor inilah yang sangat berpengaruh terhadap pembentukan kompleks antara ion LTJ dengan ligan.
Untuk mengetahui selektivitas dari suatu ligan terhadap ion LTJ maka kita dapat membandingkan nilai D dari kedua LTJ yang akan dipisahkan. Nilai perbandingan tersebut dinamakan faktor pemisahan (α). Pada penelitian ini dilakukan penentuan nilai α dari Y(III) dengan Ce(III) pada pH 2,5-5. Pada Gambar 4.18 menggambarkan suatu pola ekstraksi Ce(III) dan Y(III) dengan menggunakan ligan H2SbBP.
Gambar 4.18 Kurva perbedaan nilai DCe(III) dengan DY(III) pada ekstraksi menggunakan ligan
H2SbBP di daerah pH 2,5-5
Pada gambar tersebut terlihat ligan H2SbBP memiliki kemampuan mengekstrak Y(III) yang
lebih baik dibandingkan Ce(III). Namun pada ekstraksi dengan menggunakan ligan H2AdBP
berlaku hal yang berkebalikan (Gambar 4.19), ligan H2AdBP memiliki kemampuan
mengekstrak Ce(III) yang lebih baik dibandingkan Y(III).
Gambar 4.19 Kurva perbedaan nilai DCe(III) dengan DY(III) pada ekstraksi menggunakan ligan
H2AdBP di daerah pH 2,5-5
Hal ini terjadi karena pengaruh dari panjang rantai polimetilena dari ligan dan ukuran ion logam yang diekstrak. Namun hal ini masih memerlukan penelitian dan pengkajian lebih lanjut. Pada penelitian ini nilai α tertinggi diperoleh pada pH 4,53 dengan nilai α sebesar 2,93 dengan menggunakan ligan H2AdBP.
Tabel 4.4 Nilai αY/Ce untuk ligan H2AdBP dan H2SbBP pH αY/Ce H2SbBP H2AdBP 3,03 0,94 2,90 3,52 0,82 2,57 4,03 0,69 2,14 4,53 0,78 2,93 5,03 0,44 2,37
4.4 Perlindian Monasit Bangka
Dalam penelitian ini dilakukan perlindian konsentrat pasir monasit yang berasal dari Bangka menggunakan senyawa basa. Senyawa basa yang digunakan dalam perlindian ini adalah NaOH. Senyawa moasit berwarna abu-abu sedangkan hasil perlindian berwarna cokelat. NaOH bereaksi dengan LTJ membentuk senyawa LTJ oksida, reaksi yang terjadi adalah sebagai berikut, (Soe, et al., 2008)
2LTJ(PO4) + 6NaOH LTJ2O3.3H2O + 2Na3PO4
Hasil perlindian selanjutnya ditambah aqua dm secara perlahan-lahan. Pada saat penambahan aqua dm ke dalam hasil perlindian dihasilkan kalor yang sangat tinggi. Hasil perlindian dipindahkan ke dalam gelas kimia dan diencerkan dengan melakukan penambahan aqua dm hingga volumenya 200 mL. Setelah didiamkan selama satu malam terbetuk endapan cokelat dan warna larutannya berwarna hijau kekuningan. Seperti yang terlihat pada Gambar 4.20.
Gambar 4.20 Hasil Perlindian konsentrat pasir monasit.
Endapan warna cokelat diduga merupakan residu. Residu ini diduga merupakan komponen monasit yaitu senyawa silika pembentuk tanah yang tidak bereaksi dengan NaOH. Namun demikian dugaan ini belum dibutikan kebenarannya. Untuk itu perlu dilakukan analisis lebih
lanjut mengenai endapan cokelat yang terbentuk. Filtrat yang berwarna hijau kekuningan sebelum dijadikan sebagai sampel dalam SIR perlu dilakukan pemisahan garam posfat dan senyawa torium terlebih dahulu.
4.5 Pemisahan Endapan Cokelat.
Endapan cokelat yang terbentuk setelah hasil perlindian ditambah aqua dm selanjutnya disaring menggunakan kertas saring Whatman nomor 40. Dari hasil penyaringan diperoleh endapan cokelat sebanyak 7,8546 gram. Dari hasil yang diperoleh, endapan cokelat ini diduga masih banyak mengandung LTJ karena seharusnya jika mengacu kepada literatur residu yang dihasilkan tidak akan jauh dari 30% dari berat monasitnya. Oleh karena itu masih perlu dilakukan optimasi perlindian dari konsentrat monasit Bangka yang akan digunakan sebagai sampel dalam SIR.
4.6 Pemisahan Kristal Jarum
Larutan hasil perlindian yang berwarna hijau kekuningan mengandung garam fosfat. Garam fosfat ini terbentuk karena reaksi NaOH dengan senyawa fosfat yang ada dalam monasit. Senyawa fosfat merupakan salah satu komponen utama dari monasit. Untuk memisahkan senyawa ini dilakukan dengan menjenuhkan larutan hasil perlindian sampai volumenya 60 mL. Untuk memperoleh kristal jarum maka penjenuhan harus dilakukan secara perlahan lahan, kristal jarum yang terbentuk berwarna putih. Setelah kristal jarum terbentuk kemudian larutan yang berwarna hijau kekuningan tadi dipindahkan kedalam gelas kimia yang lain dengan cara didekantasi. Walaupun dengan cara ini kita tidak dapat menghitung secara pasti kadar garam fosfat yang terbentuk karena dalam larutan masih terdapat garam fosfat yang larut. Namun tujuan dari pemisahan ini adalah untuk mengurangi matrik dari sampel sebelum digunakan pada SIR.
4.7 Pemisahan Torium
Dalam larutan hasil derstruksi selain terdapat garam fosfat terdapat pula senyawa torium yang merupakan salah satu komponen dari LTJ. Dalam penelitian ini torium dipisahkan dari larutan dengan cara menurunkan pH hingga pHnya mendekati 3,5 dengan senyawa asam. Asam yang ditambahkan ke dalam larutan adalah HCl 3M. Pada saat pH mendekati 3,5 terbentuk endapan berwarna putih. Endapan ini merupakan senyawa torium. Senyawa torium
ini kemudian dipisahkan dengan cara disaring menggunakan kertas saring Whatman nomor 41. Berat torium yang diperoleh adalah 0,3231 gram.