37
BAB IV
METODE PENELITIAN
4.1 Jenis Penelitian
Pada penelitian ini digunakan jenis penelitian eksperimental untuk mengetahui sitotoksisitas fraksi etil asetat umbi bawang dayak (Eleutherine palmifolia L.) terhadap sel kanker serviks HeLa dan sel vero mengunakan metode MTT assay.
4.2 Bahan Uji
Bahan uji yang diujikan merupakan fraksi etil asetat umbi bawang dayak (Eleutherine palmifolia L ) dari hasil penelitian sebelumnya (Irmanto, 2019) yang diperoleh dengan cara fraksinasi bertingkat, dimana serbuk umbi bawang dayak diekstraksi dengan pelarut n-heksan, kemudian di ekstraksi etil asetat, selanjutnya etanol. Fraksinasi bertingkat dapat dilihat pada lampiran 3.
4.3 Objek Penelitian dan Lokasi Penelitian
Objek penelitian yang digunakan dalam penelitan ini adalahisel kanker serviks HeLa dan sel normalivero yangididapat dari Laboratorium Parasitologi Fakultas Kedokteran Universitas Gadjah Mada Yogyakarta. Lokasi penelitian uji sitotoksisitas terhadap sel kanker serviks HeLa dan sel normal vero dengan menggunakan metode MTT assay dilaksanakan di Laboratorium Parasitologi Fakultas Kedokteran Universitas Gadjah Mada Yogyakarta.
4.4 Bahan dan Alat Penelitian
Dibawah ini bahan dan alat yang digunakani pada ipenelitian ini yaitu: 4.4.1 Bahan Pembuatan Media
a. Bahan yang digunakan dalam penelitian Skrining Fitokimia 1. Umbi Eleutherine palmifolia L (Palangkaraya)
2. Pelarut etil asetat (Bratachem) 3. N-heksan (Bratachem)
4. Asam sulfat 10% (Bratachem)
5. Anisaldehida Asam Sulfat (Bratachem) 6. Dragendorff (Bratachem)
7. FeCl3 1% (Bratachem)
8. KOH 10% idalam metanoli (Bratachem)
b. Bahan yang digunakan dalam penelitian uji sitotoksisitas 1 Aquadest
2 Aquabidest steril (for analytical laboratory)
3 Tripsin EDTA 0,25% 4 Dimethyl sulfoxide (DMSO) 5 MTT 5 mg/ml PBS (50 mg
MTT dan 10 ml Phosphate Buffer Saline (PBS))
6 Sodium Dedosil Sulfat (SDS) 10% dalam 0,1 N HCl 7 Media Kultur (MK)
(DMEM/RPMI/MEM)
8 Kultur sel kanker serviks ( Sel HeLa)
9 Kultur sel Vero
10 NaHNCO3 (Pro analisis) 11 NaOH
12 HCl
13 Tripsin EDTA
14 Phosphate buffer saline 15 Penisilin-streptomisin
4.4.2 Alat-alat Penelitian
Alat-Alat Yang Digunakan Dalam Pembuatan Media Uji Dan Pengujian Sitotoksisitas sebagai berikut :
1 Beaker glass
2 Microwell plate 96 (BIOLOGIX) 3 Cryo tube (IMEC)
4 Conycal tube (BIOLOGIX) 5 Culture dish
6 Blue tip and Yellow tip (BIOLOGIX) 7 Eppendorf
8 Sentrifuge (JANETZKI T5)
9 Laminar Air Flow (Gelman Sciences) 10 Inkubator CO2 (HERA cell)
11 Mikroskop inverted (Aziovert 25)
12 Hemositometer (SUPERIOR W-Germany) 13 Batang pengaduk
14 Tangki nitrogen cair (Thermolyne Bio Cane 47) 15 Papan tetes porselen
16 Pipet pastuer steril 17 Mikropipet (WWRbrand)
18 ELISA reader (Microplate Reader Bencmark)
4.5 Variabel Penelitian
Variable penelitian terdiri dari variable bebas dan tergantung. 4.5.1 Variabel Bebas
Variabel bebas pada penelitian ini adalah konsentrasi fraksii umbi bawang dayak (Eleutherine palmifolia L). Pada penelitian ini akan dibuat beberapa konsentrasi ujinfraksi etili asetati umbi bawang dayak (Eleutherine palmifolia L ) yaitu 1000 μg/ml, 500 μg/ml, 250 μg/ml, 125 μg/ml, 62,5 μg/ml, 31,25 μg/ml dan 15,625 μg/ml
4.5.2 Variabel Tergantung
iDalam penelitian ini yang menjadi variabel tergantung adalah absorbansi selihidup atauipersen viabilitasisel hidup.
4.6 Metode Penelitian
Berikut adalah metode penelitian yang akan dilakukan pada penelitian ini : 4.6.1 Rancangan Penelitian
Penelitian ini merupakan penelitian eksperimental untuk mengetahuii sitotoksisitas sel HeLa dan sel vero mengunakan metode MTT assay sekaligus identifikasi senyawa aktivitas antikanker menggunakan fraksinasi bertingkat menggunakan fraksinasi etil asetat umbi bawang dayak (Eleutherine palmifolia ) secara in vitro.
Rencangan penelitian yang digunakan adalah :
1. Persiapani penelitian sampeli yaitu fraksi umbi bawang dayak (Eleutherine palmifolia L ) dengan menggunakan pelarut ietil iasetat.
2. Pengujian sitoksisitas sampel fraksi etil asetat umbi bawang dayak (Eleutherine palmifolia L ) dengan menggunakan metode MTT assay.
3. Pada uji sitotoksisitas ifraksi etil asetat umbi bawang dayak (Eleutherine palmifolia L ) terhadap sel kanker serviks HeLa dan sel vero sebagai pembanding untuk melihat selektifitas dari ifraksi etil asetat umbi bawang dayak (Eleutherine palmifolia L ) secara in vitro dengan menggunakan metode MTT iassay.
4. Pengujian aktivitas sitotoksisitas ifraksi etil asetat umbi bawang dayak (Eleutherine palmifolia L ) terhadap sel kanker serviks HeLa dan sel normal vero diIakukan dalam tiga kelompok perlakuan percobaan, seperti tabel berikut :
Tabel IV.1 Kelompok perlakuan kultur sel kanker serviks HeLa dalam tiap percobaan
Kelompok Perlakuan Objek Percobaan
Kelompok Uji
Fraksi etil asetat dengan konsentrasi (1000 µl/ml; 500 µl/ml; 250 µl/ml; 125 µl/ml; 62,5 µl/ml; 31,25 µl/ml; 15,625 µl/ml).
Kontrol Positif
Doxorubicin dengan konsentrasi (50 µl/ml, 25 µl/ml, 12,5 µl/ml, 6,25 µl/ml, 3,125 µl/ml dan 1,5625 µl/ml, 0,781 µl/ml).
Kontrol Negatif
Kontrol
Media Media RPMI dan MI99 Kontrol Sel Sel HeLa dan Sel Vero
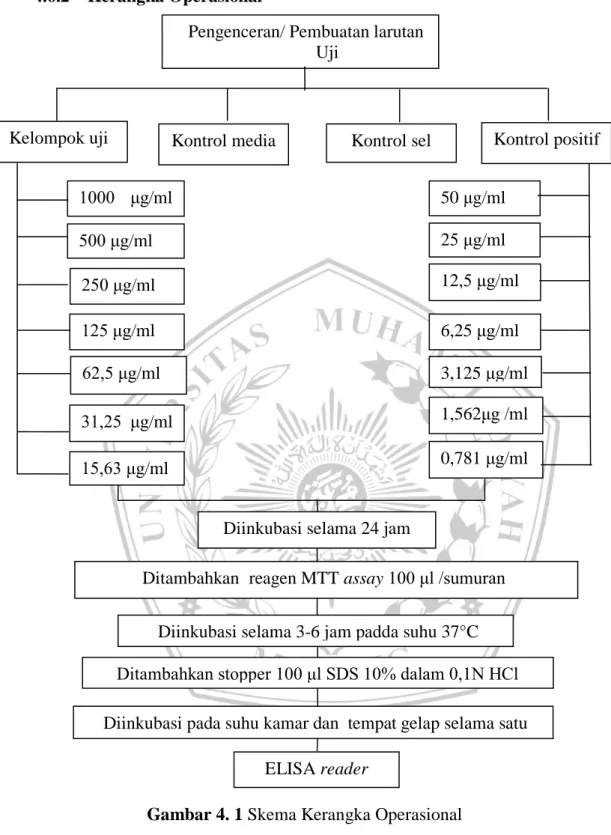
4.6.2 Kerangka Operasional
Pengenceran/ Pembuatan larutan Uji
Kelompok uji Kontrol media Kontrol sel Kontrol positif
50 μg/ml 25 μg/ml 12,5 μg/ml 6,25 μg/ml 3,125 μg/ml 1,562μg /ml 0,781 μg/ml 1000 μg/ml /ml 500 μg/ml 250 μg/ml 125 μg/ml 62,5 μg/ml 31,25 μg/ml /ml 15,63 μg/ml
Diinkubasi selama 24 jam
Ditambahkani reagen MTT assay 100 μl /sumurani
iDiinkubasi selama 3-6 jam padda suhu 37°C Ditambahkan stopper 100 μl SDS 10% dalam 0,1N HCl
iDiinkubasi pada suhu kamar dan tempat gelap selama satu malam
ELISA reader
4.7. Identifikasi Golongan Senyawa dengan Kromatografi Lapis Tipis Ekstrak kental fraksi etil asetat umbi bawang dayak diambil sebanyak 0,05 gram kemudian ditambahkan etil asetat dan diultrasonik ad larut, kemudian filtrat di totolkan 5µL pada fase diam. Uji kromatografi lapis tipis ini menggunakan : Fase diam : - Kiesel gel GF 254
Fase gerak : - kloroform : Etil Asetat (7:3) Penampak noda
- Alkaloid : Dragendorff
- Terpenoid : Anisaldehida – Asam Sulfat
- Flavonoid : Uap Amonia atau Asam Sulfat 10 % - Polifenol : Besi (III) Klorida 1%
- Antrakuinon : Larutan Kalium Hidroksida 5-10% dalam etanol
4.8 Prosedur Kerja
Berikut adalah prosedur kerja penelitian. 4.8.1 Pembuatan Fraksi Bahan Uji
Bahan uji pada penelitian ini adalah hasil fraksinasi umbi bawang dayak (Eleutherine palmifolia L ) dengan metode fraksinasi secara bertingkat yang menggunakan pelarut yang berbeda yaitu pelarut n-heksan, etil asetat dan etanol. Bahan fraksi etil asetat umbi bawang dayak (Eleutherine palmifolia L ) yang digunakan didapatkan pada penelitian sebelumnya (Irmanto, 2019) dan untuk prosedur proses pembuatannya dapat dilihat pada lampiran.
4.8.2 Pembuatan Media a. Pembuatan Media Cair
1. Disiapkanibubuk media padat untuk pembuatan media cair.
2. Disiapkan aquabidest steril 950 ml dalam beker gelas 1 liter yang di simpan di dalam Laminar Air Flow (LAF)
3. Dimasukan mediaibubuk ke dalam aquabidest steril yang berada dalam beker gelas, diaduk hingga larut dan merata.
4. Dibilas bagian dalam pembungkus media bubuk dengan aquabidest, tuang cairannya kedalam beker gelas tersebut.
5. Ditambahkan 2,2 gram NaHCO3 yang di tambahkan pada setiap pembuatan media dan di aduk hingga larut
6. Ditambahkan aquabidest steril hingga volume 1 liter.
7. Diaduk dengan menggunakan magnetik stirer semua media padat serta NaHCO3 hingga larut.
8. Dilakukan adjust pH dengan menambahkan NaOH atau HCL 1N kedalam larutan ( 0,2-0,3 dari pH yang di inginkan).
9. Dilakukan filtrasi media media dengan menggunakan filter ukuran 0,2 mikron dan di tampung dalam botol duran 500 ml.
10. Diberi identitas atau label dan disimpan media di lemari es dengan suhu 4 °C
b. Pembuatan media kultur
1. Disiapkan FBS dan penisilin-streptomisin kemudian di cairkan sebelum digunakan pada suhu ruang.
2. Disispkan botol duran 100ml
3. Diambil 10ml iFBS, tuang ke idalam botol duran.
4. Diambil 1 ml penisilin-streptomisin, kemudian dimasukan pada botol duran
5. Ditambahkan media cair ke dalam botol sampai 100ml
6. Diberi identitas atau label pada botol media kultur (nama, media, tanggal pembuatan, expire date, nama pembuat).
7. Disimpan pada suhu 1-8 °C. Batas media kultur dapat bertahan selama 1 bulan
c. Penumbuhan sel
1. Disiapkan aliqot media kultur yang disesuaikan dengan sel , yaitu 3 ml media kultur dalam conycal tube steril.
2. Dicairkan pada suhu kamar ampul (cryo tube) yang berisi sel dari tangki nitrogen cair (atau dari freezer -8 C) hingga tepat mencair. 3. Diambil suspensi sel dengan mikropipet 1 ml, masukkan tetes demi
tetes ke dalam media kultur yang telah disiapkan.
4. Di tutup conycal tube dengan rapat, kemudian di sentrifus dengan kecepata 600 rpm selama 5 menit.
5. Dikembalikan LAF (semprot conycal tube gan tangan dengan alkohol 70%
6. Dibuka conycal tube, kemudian dituang supernatan media kultur ke dalam pembuangan.
7. Ditambahkan 4 ml media kultur baru, diresuspensikan kembali sel hingga homogen.
8. Ditransfer suspensi sel masing-masing 2 ml ke dalam 2 cell culture dish.
9. Ditambahkan masing-masing 5 ml media kultur ke dalam dish, kemudian dihomogenkan.
10. Pengamatan sel dilakukan di mikroskop. Pastikan kehomogenan sel di dalam permukaan Flask (tidak bergerombol dalam satu bagian dish) 11. Diberi penanda atau label dan disimpan sel ke dalam inkubator CO2. d. Penggantian media
1. Disiapkan PBS dan media kultur di dalam conycal tube.
2. Dipipet dan dibuang media lama secara perlahan dengan pipet pasteur. 3. Dimasukan 3 ml PBS ke dalam dish, kemudian diratakan sambil di
goyangkan untuk mencuci sel. 4. Dibuang PBS dengan pipet pasteur.
5. Dituang 7 ml media kultur ke dalam dish yang berisi sel kemudian dihomogenkan.
6. Diamati kondisi dan jumlah sel secara kualitatif pada mikroskop inverted.
7. Diinkubasi semalam dan amati keadaan sel keesokan harinya. e. Pemanenan sel
1. Diambil sel yang berada di inkubator, kemudian diamati kondisi selnya, pemanenan sel dilakukan setelah sel 80% konfluen.
2. Media dibuang dengan menggunakan alat pipet pasteur steril.
3. Dilakukan pencucian dengan menggunakan PBS 1x (volume PBS adalah ± ½ volume media awal).
4. Ditambahkan Tripsin-EDTA 1x (tripsin 0,25%) secara merata dan diinkubasi dalam inkubator selama 3 menit.
5. Ditambahkan media ± 5 ml untuk pengaktifan tripsin. Diresuspensi sel dilakukan dengan pipet sampai sel terlepas satu-satu (tidak bergerombol).
6. Diamati keadaan sel dengan mikroskop. Diresuspensikan kembali jika masih terdapat sel yang bergerombol
7. Sel yang telah lepas ditransfer satu-satu ke dalam conycal tube steril baru.
f. Perhitungan sel
1. Diambil sel dari inkubator CO2, kemudian diamati keadaan selnya. 2. Media di buang menggunakan pipet pasteur steril.
3. Dilakukan pencucian dengan menggunakan PBS 1x (volume PBS adalah ± ½ volume media awal).
4. Ditambahkan Tripsin-EDTA 1x (tripsin 0,25%) dan diratakan. Kemudian diinkubasi dalam inkubator selama 3 menit.
5. Ditambahkan media ± 2-3 ml dan diresuspensikan dengan pipet sampai sel terlepas satu-satu penambahan media dilakukan untuk mengaktifkan tripsin.
6. Diamati keadaan sel di mikroskop. Kemudiaan diresuspensi jika ada sel yang bergerombol disalah satu bagian.
7. Dipindahkan sel yang sudah lepas satu-satu ke dalam conycal steril baru, ditambahkan media kultur sejumlah ± 2-3 ml. Kemudian sel diresuspensikan.
8. Diambil 10 μl panenan sel dan dipipetkan ke hemositometer.
9. Dihitung sel di bawah mikroskop (inverted atau mikroskop cahaya) dengan counter.
10. Perhitungan sel
a. Hemositometer terdiri dari 4 kamar, hitung keempat kamar tersebut. Sel yang gelap (sel mati) dan sel yang berada pada batas luar hanya di hitung dua sisi saja ( sisi kanan dan sisi atas atau sisi kiri dan sisi bawah).
b. Rumus untuk perhitungan jumlah sel per ml sebagai berikut :
Σ sel kamar A + Σ sel kamar B + Σ sel kamar C + Σ sel kamar D
4 𝑥 10
4
c. Jumlah total sel yang diprlukan dihitung
d. Volume pemanenan sel yang di perlukan dapat di hitung ( dalam ml) dengan rumus sebagai berikut:
Volume pemanenan sel yang di transfer =Jumlah total sel yang diperlukan Jumlah terhitung /ml
e. Diambil volume panenan selntransfer ke conycal tube baru kemudian ditambahkan mediamkultur sampai total volume yang diperlukan. Perhitungan volume yang diperlukan adalah setiap sumuran akan diisi 100 μl media kultur berisi sel dengan kepadatan 104 sel / sumuran pada 100 sumuran, maka total volume yang diperlukan untuk menanam sel adalah 100 μl x 100 sumuran = 10 ml
4.9 Pembuatan Larutan Induk dan Larutan Uji
Berikut ini pembuatan larutan induk dan Iarutan ujii: 4.9.1 Pembuatan Larutan Induk
Konsentrasi larutan induk yang akan dibuat dalam penelitian adalah 100.000 ppm. Caranya adalah sebagai berikut :
1. Ditimbang fraksi umbi bawang dayak (Eleutherine palmifolia L ) sejumlah 10 mg.
2. Dilarutkan dalam 100 μl DMSO.
3. Dicampurkan hingga homogen sehingga di dapatkan konsentrasi 100.000 ppm.
4.9.2 Pembuatan Larutan Uji untuk Sel HeLa
Konsentrasi larutan uji yang dibuat yaitu, 1000 μg/ml, 500 μg/ml, 250 μg/ml, 125 μg/ml, 62,5 μg/ml, 31,25 μg/ml dan 15,625 μg/ml. Larutan uji dibuat dengan pengenceran bertingkat :
a. (10 μl / 1000 μl) x 100.000 μg/ml = 1000 μg/ml b. (500 μl / 1000 μl) x 1000 μg/ml = 500 μg/ml c. (500 μl / 1000 μl) x 500 μg/ml = 250 μg/ml d. (500 μl / 1000 μl) x 250 μg/ml = 125 μg/ml e. (500 μl / 1000 μl) x 125 μg/ml = 62,5 μg/ml f. (500 μl / 1000 μl) x 62,5 μg/ml = 31,25 μg/ml g. (500 μl / 1000 μl) x 31,25 μg/ml = 15,625 μg/ml
Pada pembuatan larutan uji, jumlah baku induk yang dipipet masing-masing kemudian diadkan dengan media kultur hingga volume menjadi 1000 μl. Kelompok uji berisi media kultur, sel HeLa, dan senyawa uji kemudian diinkubasi pada inkubator CO2 5 % dengan suhu 37°C selama 24 jam.
4.9.3 Pembuatan Larutan Uji untuk Sel Vero
Konsentrasi larutan uji yang dibuat yaitu, 1000 μg/ml, 500 μg/ml, 250 μg/ml, 125 μg/ml, 62,5 μg/ml, 31,25 μg/ml dan 15,625 μg/ml. Larutan uji dibuat dengan pengenceran bertingkat :
a. (10 μl / 1000 μl) x 100.000 μg/ml = 1000 μg/ml b. (500 μl / 1000 μl) x 1000 μg/ml = 500 μg/ml c. (500 μl / 1000 μl) x 500 μg/ml = 250 μg/ml d. (500 μl / 1000 μl) x 250 μg/ml = 125 μg/ml e. (500 μl / 1000 μl) x 125 μg/ml = 62,5 μg/ml f. (500 μl / 1000 μl) x 62,5 μg/ml = 31,25 μg/ml g. (500 μl / 1000 μl) x 31,25 μg/ml = 15,625 μg/ml
Pada pembuatan larutan uji, jumlah baku induk yang dipipet masing-masing kemudian diadkan dengan media kultur hingga volume menjadi 1000 μl. Kelompok uji berisi media kultur, sel HeLa, dan senyawa uji kemudian diinkubasi pada inkubator CO2 5 % dengan suhu 37°C selama 24 jam.
4.9.4 Pembuatan Kontrol Positif untuk Sel HeLa
Sediaan doksorubisin yang digunakan 10 mg/5 ml dengan konsentrasi 2000 ppm. Konsentrasi larutan kontrol positif yang dibuat yaitu, 50 μg/ml, 25 μg/ml, 12,5 μg/ml, 6,25 μg/ml, 3,125 μg/ml, 1,5625 μg/ml, dan 0,78125 μg/ml. Larutan uji dibuat dengan pengenceran bertingkat :
b. (500 μl / 1000 μl) x 50 μg/ml = 25 μg/ml c. (500 μl / 1000 μl) x 25 μg/ml = 12,5 μg/ml d. (500 μl / 1000 μl) x 12,5 μg/ml = 6,25 μg/ml e. (500 μl / 1000 μl) x 6,12 μg/ml = 3,125 μg/ml f. (500 μl / 1000 μl) x 3,125 μg/ml = 1,5625 μg/ml g. (500 μl / 1000 μl) x 1,5625 μg/ml = 0,78125 μg/ml
Pada pembuatan kontrol positif, jumlah baku induk yang dipipet masing-masing diadkan dengan media kultur hingga didapatkan volume 1000 μl. Kontrol positif berisi media kultur, sel HeLa, dan kontrol positif (senyawa doksorubisin) kemudian diinkubasi pada inkubator CO2 5% dengan suhu 37°C selama 24 jam. 4.9.5 Pembuatan Kontrol Positif untuk Sel Vero
Sediaan doksorubisin yang digunakan 10 mg/5 ml dengan konsentrasi 2000 ppm. Konsentrasi larutan kontrol positif yang dibuat yaitu, 100 μg/ml, 50 μg/ml, 25 μg/ml, 12,5 μg/ml, 6,25 μg/ml, 3,125 μg/ml dan 1,5625 μg/ml. Larutan uji dibuat dengan pengenceran bertingkat :
a. (50 μl / 1000 μl) x 2000 μg/ml = 100 μg/ml b. (500 μl / 1000 μl) x 100 μg/ml = 50 μg/ml c. (500 μl / 1000 μl) x 50 μg/ml = 25 μg/ml d. (500 μl / 1000 μl) x 25 μg/ml = 12,5 μg/ml e. (500 μl / 1000 μl) x 12,5 μg/ml = 6,25 μg/ml f. (500 μl / 1000 μl) x 6,25 μg/ml = 3,125 μg/ml g. (500 μl / 1000 μl) x 3,125 μg/ml = 1,5625 μg/ml
Pada pembuatan kontrol positif, jumlah baku induk yang dipipet masing-masing diadkan dengan media kultur hingga didapatkan volume 1000 μl. Kontrol positif berisi media kultur, sel HeLa, dan kontrol positif (senyawa doksorubisin) kemudian diinkubasi pada inkubator CO2 5% dengan suhu 37°C selama 24 jam.
4.10 Rancangan Penempatan 96-Well Plate
4.10.1 Larutan Uji Untuk Sel Hela dan Kontrol Positif
Keterangan Warna
Orange : Fraksi n-Heksana Biru : Fraksi Etil Asetat Hijau : Fraksi Etanol
Ungu : Kontrol Positif (Doksorubisin) Kuning : Kontrol Sel
Abu-Abu : Kontrol Medium
4.10.2 Larutan Uji Untuk Sel Vero dan Kontrol Positif
Keterangan Warna Orange : Fraksi n-Heksana Biru : Fraksi Etil Asetat Hijau : Fraksi Etanol
Ungu : Kontrol Positif (Doksorubisin) Kuning : Kontrol Sel
Abu-Abu : Kontrol Medium
4.11 Uji Sitotoksisitas dengan Metode MTT
Pengujian sitotoksisitas dengan menggunakan metode MTT.
1. Diambil sel dari inkubator CO2 , dan kemudian diamati kondisi selnya. 2. Sel dipanen sesuai dengan protokol panen.
3. Jumlah sel dihitung dan dibuat pengenceran sel dengan media kultur yang sesuai kebutuhan mengikuti protokol perhitungan sel.
4. Sel ditransfer ke dalam sumuran, masing-masing 100 μl.
5. Di sisakan 3 sumuran yanhg tidak berisi sel yang berfungsi sebagai kontrol media.
6. Diamati keadaan sel pada mikroskop inverted sudah merata atau tidak, kemudian didokumentasikan.
7. Diinkubasi sel didalam inkubator selama semalam untuk memulihkan sel setelah pemanenan.
8. Perlakuan sel dengan sampel boleh dilakukan, jika sel telah kembali dalam keadaan normal. Jika dalam waktu semalam kondisi sel belum normal , sel diinkubasikan kembali.
9. Setelah sel kembali normal, dibuatmseri konsentrasi sampel untuk perlakuan (termasuk kontrol sel dan kontrol DMSO) sesuai dengan protokol preparasi sampel.
10. Diambili plate iyang telah berisii sel dari inkubator CO2
11. Dimasukkan seri konsentrasi sampel ke dalam sumuran ( triplo) dengan masing-masing sebanayak 100 μl.
12. Diinkubasi didalam inkubator CO2. Lama inkubasivtergantung pada efek perlakuan terhadapvsel. Jika dalam waktu 24 jam belum terlihat efek sitotoksik, diinkubasi kembali selama 24 jam (waktu inkubasi total 24 – 48 jam).
13. Menjelang akhir masa inkubasi, kondisi sel di dokumentasikan untuk setiap perlakuan.
14. Disiapkan reagen MTT untuk perlakuan (0,5 mg/ml) dengan cara diambil 1 ml stok MTT dalam PBS (5 mg/ml), diencerkan dengan media kultur sampai 10 ml (untuk 1 buah 96 well plate).
15. Media sel dibuang, cuci PBS 1x dan ditambahkan reagen MTT 100 μl pada setiap sumuran, termasuk kontrol media (tanpa sel). Sel diinkubasi selama 3-6 jam di dalam inkubator CO2 .
16. Diperiksa kondisi sel dengan mikroskop inverted. Jika formazan telah jelas terbentuk, stopper 100 μl SDS 10% ditambahkan dalam 0,1 N HCl.
17. Plate dibungkus dengan kertas atau aluminium foil dan diinkubasikan di tempat gelap pada temperatur kamar selama semalam.
18. Dinyalakan ELISA reader, ditunggu proses progressing hingga selesai. 19. Dibuka pembungkus plate dan tutup plate. Dimasukkan ke dalam ELISA
reader baca absorbansi masing-masing sumuran dengan ELISA reader dengan λ = 550 – 600 nm (595 nm, tekan tombol START).
20. Hitung prosentase sel hidup dan analisis harga I dengan excel (regresi linear dari log konsentrasi) atau SPSS (Probit/Logit).
4.12 Analisis Data
Hasil data uji sitotoksisitas yang dinyatakan dengan faktor serapan kemudian di konversikan ke dalam persen kehidupan sel dengan menggunakan rumus sebagai berikut:
𝑣𝑖𝑎𝑏𝑖𝑙𝑖𝑡𝑎𝑠
= absorbansi sumuran uji − absorbansi kontrol media
absorbansi kontrol sel – absorbansi kontrol media x 100% Hasil data yang dilakukan, selanjutnya akan di analisis menggunakan analisis probit dengan SPSS untuk menentukan harga IC50 fraksi umbi bawang dayak (Eleutherine palmifolia L).
Analisis probit digunakan untuk mencari konsentrasi yang mampu membunuh 50 % sampel (inhibitory Concentration 50), dan untuk menguji tingkat konsentrasi terhadap respon sampel (kematian sel) (Naritasari dkk, 2010). Dari hasil penelitian yang telah dilakukan dengan nilai IC50 berdasarkan kategori aktivitas antikanker dapat dikatakan kuat apabila IC50 memiliki nilai IC50 antara rentang 0-100 µg/ml dimana jika didapatkan nilai IC50 sebesar >100 µg/ml berarti kurang aktif, nilai 30-100 µg/ml cukup aktif dan nilai <30 µg/ml sangat aktif (Bézivin et al., 2003; Hermansyah & Murcitro, 2017; Paputunga et al., 2017; Prayong, 2008; Weerapreeyakul et al., 2012).
Selektivitas ditentukan dengan menggunakan parameter SI (Selectivity Index) yaitu dengan rumus sebagai berikut :
SI = IC50 pada sel vero IC50 pada sel kanker
Suatu ekstrak dikatakan memiliki selektivitas yang tinggi jika apabila nilai SI ≥3, sedangkan jika nilai SI <3 dikatakan kurang selektif (Prayong, 2016).