4
Hasil dan Pembahasan
Penyebab ketidakberhasilan penentuan urutan daerah HVSI mtDNA manusia yang mengandung poli-C melalui direct sequencing dan keberhasilan sekuensing setelah kloning diduga terjadi karena adanya fenomena heteroplasmi (Siti, 2005). Dalam bab ini akan dipaparkan hasil dan pembahasan untuk menguji hipotesis tersebut dalam enam bagian besar yang meliputi (1) Screening klon rekombinan, (2) Karakterisasi sampel, (3) Penyiapan templat DNA, (4) Amplifikasi DNA, (5) Sekuensing sampel klon GMR dan hasil pencampuran antara klon GMR 1 dengan GMR 3, dan (6) Analisis urutan nukleotida HVSI dari sampel dengan melakukan perbandingan terhadap standar Cambridge Reference Sequence (CRS).
4.1 Screening Klon Rekombinan
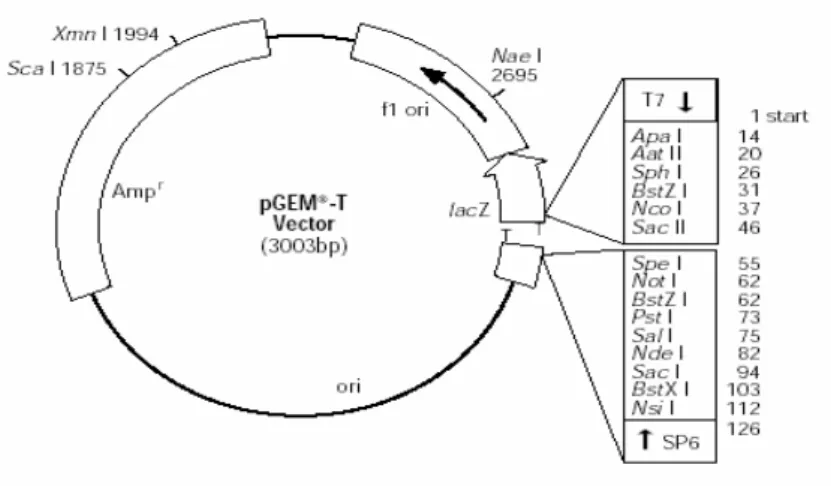
Tahapan screening ini dilakukan untuk melihat apakah klon-klon dari dua sampel hasil penelitian sebelumnya (Dwiyanti, 2006), GMR 1 dan GMR 3, yang disimpan dalam stok gliserol mengandung plasmid yang membawa DNA sisipan daerah HVSI mtDNA sepanjang 0,4 kb. Vektor plasmid yang digunakan adalah pGEM-T seperti ditunjukkan pada Gambar 4.1.
Gambar 4.1 Vektor pGEM-T
Vektor ini memiliki gen-gen yang penting untuk proses screening, diantaranya gen resisten ampisilin (Ampr) dan gen lacZ yang mengkode
β
-galaktosidase. DaerahVektor pGEM-T memiliki beberapa gen yang penting untuk proses screening, di antaranya gen resisten ampisilin (Ampr) yang mengkode
β
-laktamase. Enzim ini akan mendegradasi ampisilin sehingga bakteri yang membawa plasmid pGEM-T dapat tumbuh pada media yang mengandung ampisilin. Gen penting lainnya adalah gen lacZ yang mengkodeβ
-galaktosidase. Gen lacZ ini diinduksi oleh senyawa IPTG (isopropylthio-β
-D-galactoside). Enzimβ
-galaktosidase dapat bereaksi dengan X-gal (5-bromo-4-chloro-3-indolyl-β
-D-galactoside), yaitu suatu senyawa tidak berwarna, menghasilkan produk 5-bromo-4-kloroindigo yang berwarna biru, sehingga jika bakteri pembawa plasmid ditumbuhkan pada media mengandung IPTG dan X-gal akan terbentuk koloni berwarna biru. Penyisipan daerah HVSI mtDNA manusia sepanjang 0,4 kb pada gen lacZ menyebabkan tidak terekspresikannyaβ
-galaktosidase, sehingga bakteri yang ditumbuhkan pada media mengandung IPTG dan X-gal akan membentuk koloni berwarna putih dan bukan biru.Atas dasar ini, setiap klon sampel GMR 1 dan GMR 3 ditumbuhkan pada media LBA yang mengandung IPTG dan X-gal. Ilustrasi koloni biru dan putih ini ditunjukkan pada Gambar 4.2.
Gambar 4.2. Screening klon rekombinan
Koloni berwarna putih mengandung plasmid yang membawa DNA sisipan daerah HVSI mtDNA manusia sepanjang 0,4 kb. Sedangkan koloni berwarna biru mengandung plasmid yang tidak membawa DNA sisipan sehingga gen lacZnya masih utuh dan dapat mengkode β-galaktosidase yang mengubah senyawa tidak berwarna X-gal menjadi produk berwarna biru.
4.2 Karakterisasi Sampel
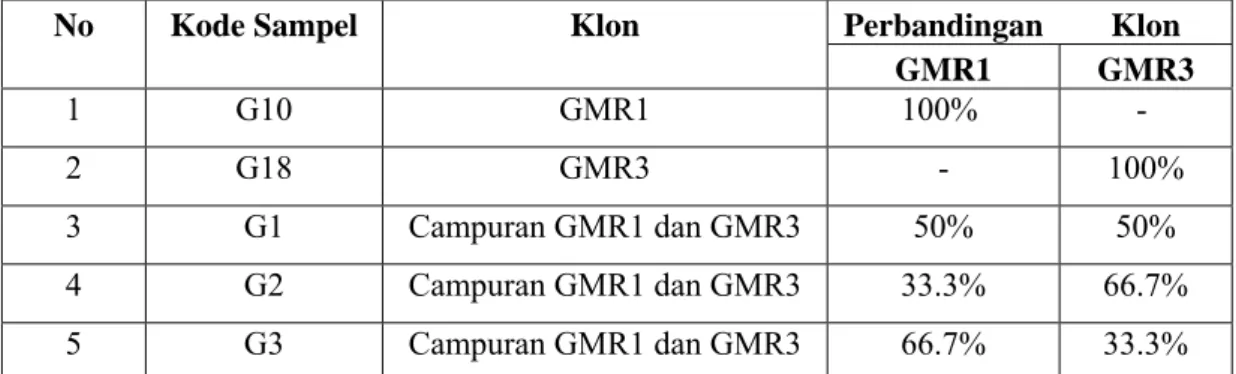
Data sampel klon DNA rekombinan yang digunakan dalam penelitian ini dapat dilihat pada Tabel 4.1. Sampel yang digunakan berasal dari klon GMR yang telah ditumbuhkan dalam media padat LBA.
Tabel 4.1 Karakterisasi sampel
Sampel yang digunakan berasal dari klon GMR1 dan GMR3 serta campuran antara keduanya dalam berbagai perbandingan.
No Kode Sampel Klon Perbandingan Klon
GMR1 GMR3 1 G10 GMR1 100% - 2 G18 GMR3 - 100% 3 G1 Campuran GMR1 dan GMR3 50% 50% 4 G2 Campuran GMR1 dan GMR3 33.3% 66.7% 5 G3 Campuran GMR1 dan GMR3 66.7% 33.3%
4.3 Penyiapan Templat Sampel
Koloni putih tunggal hasil screening pada media LBA+X-gal+IPTG diambil dan kemudian dilakukan lisis. Lisis sel ini memanfaatkan senyawa kimia untuk memecah dinding atau membran sitoplasma dan mengeluarkan seluruh isi sel termasuk DNA. Senyawa kimia tersebut adalah buffer lisis dan Tween-20. Tween-20 adalah deterjen non-ionik yang dalam larutannya membentuk micelles. Struktur molekul Tween-20 memiliki bagian hidrofilik yang tersusun oleh senyawa ester atau alkohol dan bagian hidrofobik yang merupakan senyawa hidrokarbon. Interaksi bagian hidrofilik micelles Tween-20 dengan senyawa fosfolipid dari membran sel membuat senyawa fosfolipid membran larut membentuk campuran micelles dengan Tween-20. Dengan demikian, Tween-20 berfungsi sebagai “emulgator” yang membantu proses lisis dengan cara merusak struktur membran sehingga menyebabkan kerusakan membran sel (Martasih, 1994).
Setiap enzim mempunyai suhu optimum yang khas. Dalam penelitian ini suhu yang digunakan dalam tahapan lisis adalah 54 oC, yang merupakan suhu optimum bagi enzim proteinase K. Penambahan proteinase K bertujuan untuk mendegradasi enzim-enzim DNAse dan protein lainnya. Enzim proteinase K selanjutnya dideaktivasi pada suhu 95 °C selama 5 menit (Noer et al., 1994). Setelah inkubasi dilakukan sentrifuga agar molekul mtDNA terpisah dengan molekul-molekul lainnya berdasarkan perbedaan massa karena massa mtDNA yang kecil maka dengan sentrifugasi akan berada di sekitar bagian atas supernatan.
Jumlah mtDNA yang didapatkan melalui metoda ini belum memadai untuk kelancaran analisis lebih lanjut, oleh karena itu diperlukan perbanyakan templat mtDNA menggunakan metode PCR (Saputra, 2005). Ekstrak DNA hasil lisis dijadikan templat untuk PCR. Konsentrasi templat yang terlalu tinggi akan mengakibatkan terbentuknya pita yang smear, sebaliknya konsentrasi templat yang terlalu rendah akan menyebabkan terbentuknya pita yang terlalu tipis untuk dapat dideteksi dengan metode elektroforesis gel agarosa. Konsentrasi templat 10 ng/100 μL campuran reaksi dapat menghasilkan pita yang cukup terang dan tebal (Marzuki dkk., 1991). Tabel 4.2 memperlihatkan hubungan antara jumlah templat atau molekul target pada PCR dengan jumlah siklus PCR. Semakin banyak jumlah molekul target semakin sedikit jumlah siklus PCR yang diperlukan (Innis dan Gelfand, 1990).
Tabel 4.2 Hubunganantara jumlah molekul target dengan jumlah siklus PCR Jumlah molekul target Jumlah siklus PCR
3 × 105
25 – 30
1,5× 104 30 – 35
1 × 103 35 – 40
50 40 – 45
Semakin banyak jumlah molekul target semakin sedikit jumlah siklus PCR yang diperlukan (Innis dan Gelfand, 1990).
4.4 Fragmen 0,4 kb Hasil Amplifikasi PCR
Proses perbanyakan DNA atau amplifikasi secara in vitro dalam penelitian ini dilakukan dengan metode PCR, mengenai metode PCR telah diuraikan sebelumnya pada bab metodologi penelitian. Proses PCR memiliki peranan penting dalam penelitian terhadap DNA mitokondria. Komponen dan komposisi bahan sangat menentukan keberhasilan PCR. Ketiadaan salah satu komponen akan membuat reaksi PCR tidak berjalan dan jumlah bahan yang kurang atau terlalu berlebih akan memberikan hasil yang tidak diinginkan. Salah satu komponen yang penting dan dipengaruhi oleh jenis templat DNA yang ingin diperbanyak adalah primer. Fragmen yang ingin diperbanyak adalah HVSI dengan posisi nukleotida dari 16024 sampai 16383, maka primer yang digunakan adalah M1 dan M2. Kedua primer ini akan menempel pada ujung fragmen HVSI dengan sisi penempelan mtDNA yang berkebalikan dan akan memperpanjang kedua fragmen dengan arah yang berlawanan. Kelebihan metode PCR ini hanya membutuhkan sampel dalam jumlah sedikit namun harus diketahui urutan asam amino pada ujung segmen mtDNA untuk digunakan sebagai primer
dan membutuhkan kriteria khusus untuk primernya, yaitu: harus terletak pada arah yang benar dan jumlah G-C lebih besar dari jumlah A-T untuk menunjukkan suhu penempelan primer, suhu penempelan G-C lebih tinggi karena ikatan G-C rangkap tiga sehingga butuh energi yang lebih besar untuk memutuskan ikatannya, ujung 3’ harus G atau C, bila dapat primernya tidak mempunyai komplemen di untai lain selain untai awal, ujung-ujung jangan saling berkomplemen karena dapat membentuk polindron atau loop, dan primer 1 jangan merupakan primer 2.
Siklus PCR pada penelitian ini meliputi tiga tahap yaitu, tahap inisiasi atau denaturasi awal, tahap ekstensi, dan tahap pemantapan. Tahap denaturasi awal dilakukan pada suhu 94°C selama satu menit sebanyak satu kali. Tahap ekstensi terbagi menjadi tiga tahap yaitu; tahap denaturasi pada suhu 94°C selama satu menit yang bertujuan untuk melepaskan semua ikatan hidrogen yang menghubungkan dua rantai DNA sehingga menghasilkan DNA untai tunggal, kemudian dilanjutkan oleh tahap penempelan primer (annealing) pada suhu 50°C selama satu menit, dan setelah itu tahap perpanjangan rantai (elongation) pada suhu 72°C selama satu menit. Ketiga tahap ekstensi ini dilakukan sebanyak 30 siklus. Terakhir adalah tahap pemantapan, dilakukan pada 72°C selama empat menit yang bertujuan untuk meyakinkan bahwa untai tunggal DNA yang tersisa sudah terkopi.
Faktor-faktor yang dapat menyebabkan kegagalan amplifikasi, diantaranya adalah adanya kontaminan pada pelarut yang digunakan, adanya DNAase, tidak tepatnya jumlah konsentrasi pereaksi yang digunakan, dan tidak tepatnya pengaturan kondisi PCR. Penelusuran kegagalan amplifikasi ini dapat dilakukan jika setiap kali melakukan proses PCR selalu diikutsertakan kontrol positif dan kontrol negatif. Timbulnya pita selain pita primer pada kontrol negatif menandakan terjadinya kontaminan selama penyiapan reaksi PCR (Innis dan Gelfand, 1990). Apabila hal tersebut terjadi maka reaksi PCR diulangi dengan menggunakan pereaksi dan peralatan baru yang steril. Timbulnya pita spesifik pada kontrol positif menandakan reaksi PCR berjalan dengan baik, sedangkan tidak adanya pita spesifik menandakan reaksi PCR tidak berjalan dengan baik. Dengan melihat ada tidaknya sisa primer, dapat ditelusuri penyebab kegagalan reaksi PCR. Tidak adanya pita spesifik dan pita primer menandakan terjadinya inhibisi terhadap enzim Taq DNA polimerase yang dapat disebabkan oleh kehadiran senyawa inhibitor pada larutan templat mtDNA. Untuk menanggulangi masalah ini dapat dilakukan dengan mengencerkan larutan templat sedemikian rupa sehingga senyawa inhibitor mengalami pengenceran. Inhibisi dapat pula ditanggulangi dengan menambahkan enzim dalam jumlah lebih banyak ke dalam campuran reaksi. Tidak munculnya pita spesifik tetapi muncul pita sisa primer menandakan jumlah molekul templat tidak ada atau terlalu sedikit. Bila hal ini terjadi maka jumlah templat yang digunakan harus diperbanyak (Paabo, 1990). Molekul templat yang terlalu sedikit atau tidak
ada dapat pula disebabkan oleh proses lisis yang tidak berjalan dengan baik. Karena itu perlu dilakukan penyiapan templat DNA yang baru dengan cara mengulangi proses lisis sel. Tidak munculnya pita spesifik karena jumlah templat DNA yang terlalu sedikit dapat ditanggulangi dengan cara memasukkan kembali hasil PCR yang masih terdapat dalam Eppendorf ke dalam mesin PCR dan diamplifikasi beberapa siklus. Reamplifikasi seperti ini umumnya berhasil jika dilakukan maksimum 1 minggu setelah PCR yang pertama, dan tidak diperlukan tambahan enzim Taq DNA polimerase (Chamberlain dkk., 1990).
Hasil amplifikasi dapat dilihat melalui metode elektroforesis gel agarosa. Dengan metode ini maka dapat diketahui ukuran fragmen hasil PCR yang didapatkan. Penentuan ukuran hasil PCR dilakukan dengan menggunakan penanda pUC19/HinfI. Proses amplifikasi melalui proses PCR berhasil apabila kontrol positif memberikan hasil positif yaitu dengan munculnya satu pita pada daerah 0,4 kb dan kontrol negatif memberikan hasil negatif yaitu tidak munculnya pita pada gel serta sampel menghasilkan pita pada daerah 0,4 kb (lihat Gambar 4.3).
Gambar 4.3 merupakan foto hasil elektroforesis gel agarosa terhadap dua sampel. Dapat dilihat kontrol positif pada sumur dua memberikan satu pita berukuran 0,4 kb sedangkan kontrol negatif pada sumur lima tidak menghasilkan pita. Sedangkan sumur tiga dan empat yang merupakan sampel hasil perbanyakan PCR menunjukkan satu pita berukuran 0,4 kb. Primer M1 dan M2 yang khusus dirancang untuk mengamplifikasi daerah HVSI terbukti mampu mengamplifikasi fragmen mtDNA pada urutan nukleotida 16024 – 16383. Hal ini dapat terlihat pada hasil elektroforesis gel agarosa produk PCR, setiap sampel memperlihatkan pola pita DNA berukuran sama yaitu 0,4 kb sehingga dapat dilakukan analisis lebih lanjut. Hasil elektroforesis gel agarosa ini juga membuktikan bahwa metode lisis sel yang dilakukan telah berhasil.
Gambar 4.3 Foto elektroforesis gel agarosa hasil reaksi PCR
Sumur 1 merupakan penanda pUC19/Hinf1. Kontrol positif pada sumur 2, dan pita-pita sampel yang berukuran 0,4 kb dapat dilihat pada sumur 3(untuk G10) serta sumur 4 (untuk G18). Sedangkan pada kontrol negatif (sumur 5) tidak terdapat pita yang menunjukkan tidak adanya kontaminasi pada pelarut yang digunakan.
4.5 Hasil Sekuensing Daerah HVSI Sampel
Fragmen 0,4 kb dari hasil PCR kemudian ditentukan urutannya dengan metode Dideoksi Sanger. Reaksi sekuensing dilakukan oleh Macrogen menggunakan primer M1 yang berukuran 20 nukleotida dengan urutan 5`- CACCATTAGCACCCAAACCT-3`. Prinsip reaksi sekuensing dengan metode Dideoksi Sanger adalah penghentian atau terminasi DNA polimerase dengan penambahan dideoksinukleotida trifosfat (ddNTP) yang kehilangan gugus hidroksi pada karbon 3’ dari gula ribosa. Hilangnya gugus hidroksi ini menyebabkan DNA polimerase tidak dapat membentuk ikatan fosfodiester antara dNTP sebelumnya dengan ddNTP sehingga perpanjangan rantai DNA oleh DNA polimerase terhenti (Sanger et al., 1977).
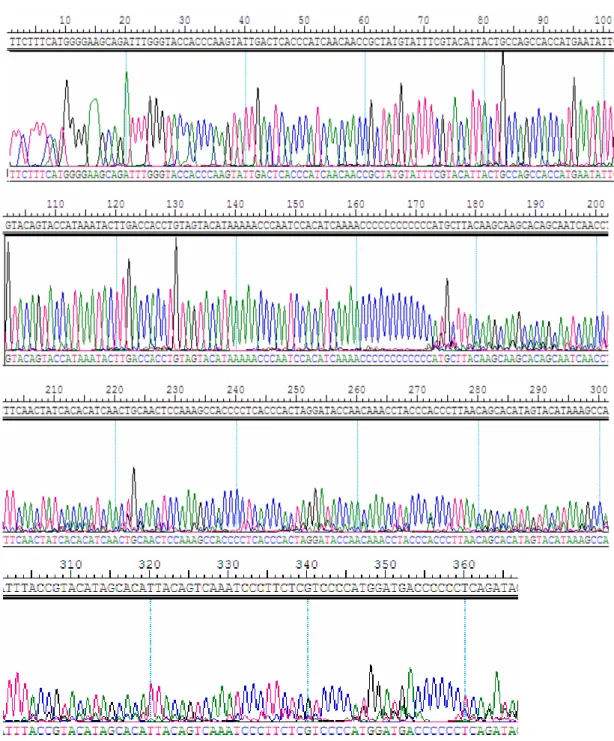
Melalui proses sekuensing didapatkan elektroforegram yang menunjukkan urutan nukleotida masing-masing sampel. Gambar 4.4 merupakan contoh elektroforegram yang didapat dari sampel G18 dalam penelitian ini. Terlihat adanya puncak-puncak dengan warna yang berbeda-beda yang masing-masing mewakili satu nukleotida dengan basa yang berbeda.
Gambar 4.4 Elektroforegram hasil sekuensing sampel klon G18
Sekuensing klon G18 dilakukan oleh Macrogen, Korea menggunakan primer M1 yang berukuran 20 nukleotida dengan urutan 5`- CACCATTAGCACCCAAACCT-3`. Kurva berwarna hijau menunjukkan basa adenin, kurva berwarna biru menunjukkan basa sitosin, kurva berwarna hitam menunjukkan basa guanin dan kurva berwarna merah menunjukkan basa timin.
Elektroforegram menunjukkan puncak-puncak dengan warna yang berbeda-beda tergantung kepada jenis basa. Seringkali terdapat lebih dari satu puncak dengan tinggi puncak yang berbeda-beda untuk setiap nukleotida. Hal ini disebabkan oleh jumlah molekul DNA mitokondria yang sangat banyak dalam satu sel. Puncak-puncak kecil menunjukkan nukleotida minoritas dan puncak tertinggi menunjukkan nukleotida mayoritas. Kurva yang
mempunyai warna berbeda-beda ini masing-masing diwakili oleh notasi A, C, T, dan G. Notasi A melambangkan puncak basa adenin, notasi C melambangkan puncak basa sitosin, notasi T melambangkan puncak basa timin, dan notasi G melambangkan puncak basa guanin dengan intensitas yang berbeda-beda.
Adapun urutan nukleotida lengkap dari sampel klon G18 dapat dilihat pada Gambar 4.5.
Urutan Nukleotida Sampel G18
16024 TTCTTTCATG GGGAAGCAGA TTTGGGTACC ACCCAAGTAT 16064 TGACTCACCC ATCAACAACC GCTATGTATT TCGTACATTA 16104 CTGCCAGCCA CCATGAATAT TGTACAGTAC CATAAATACT 16144 TGACCACCTG TAGTACATAA AAACCCAATC CACATCAAAA 16184 CCCCCCCCCC CCATGCTTAC AAGCAAGCAC AGCAATCAAC 16224 CTTCAACTAT CACACATCAA CTGCAACTCC AAAGCCACCC 16264 CTCACCCACT AGGATACCAA CAAACCTACC CACCCTTAAC 16304 AGCACATAGT ACATAAAGCC ATTTACCGTA CATAGCACAT 16344 TACAGTCAAA TCCCTTCTCG TCCCCATGGA TGACCCCCCT 16384 CAGATA
Gambar 4.5
Contoh urutan nukleotida lengkap hasil sekuensing fragmen 0,4 kb mtDNA manusiaUrutan lengkap klon G18 ini akan dibandingkan terhadap Cambridge Reference Sequence (CRS), klon GMR lain, serta terhadap campuran klon DNA untuk melihat adanya fenomena heteroplasmi.
4.6 Analisis Urutan Nukloetida Daerah HVSI Sampel
Analisis urutan daerah HVSI mtDNA manusia dilakukan dengan cara membandingkan urutan setiap klon terhadap CRS, contoh analisis dapat dilihat pada Gambar 4.6. Sedangkan untuk melihat adanya fenomena heteroplasmi, hasil sekuensing setiap klon sampel yang sama dan hasil campuran klon DNA dibandingkan terhadap satu sama lain.
16024 CRS TTCTTTCATG GGGAAGCAGA TTTGGGTACC ACCCAAGTAT G18 TTCTTTCATG GGGAAGCAGA TTTGGGTACC ACCCAAGTAT 16064 CRS TGACTCACCC ATCAACAACC GCTATGTATT TCGTACATTA G18 TGACTCACCC ATCAACAACC GCTATGTATT TCGTACATTA 16104 CRS CTGCCAGCCA CCATGAATAT TGTACGGTAC CATAAATACT G18 CTGCCAGCCA CCATGAATAT TGTACAGTAC CATAAATACT 16144 CRS TGACCACCTG TAGTACATAA AAACCCAATC CACATCAAAA G18 TGACCACCTG TAGTACATAA AAACCCAATC CACATCAAAA 16184 CRS CCCCCTCCCC ATGCTTACAA GCAAGTACAG CAATCAACCC G18 CCCCCCCCCCCC ATGCTTACAA GCAAGCACAG CAATCAACCC 16224 CRS TCAACTATCA CACATCAACT GCAACTCCAA AGCCACCCCT G18 TTAACTATCA CACATCAACT GCAACTCCAA AGCCACCCCT 16264 CRS CACCCACTAG GATACCAACA AACCTACCCA CCCTTAACAG G18 CACCCACTAG GATACCAACA AACCTACCCA CCCTTAACAG 16304 CRS TACATAGTAC ATAAAGCCAT TTACCGTACA TAGCACATTA G18 CACATAGTAC ATAAAGCCAT TTACCGTACA TAGCACATTA 16344 CRS CAGTCAAATC CCTTCTCGTC CCCATGGATG ACCCCCCTCA G18 CAGTCAAATC CCTTCTCGTC CCCATGGATG ACCCCCCTCA 16384 CRS GATA
G18 GATA
Gambar 4.6 Contoh analisis perbandingan urutan fragmen 0,4 kb mtDNA manusia terhadap CRS
Klon G18 memiliki mutasi T16189C dan dua insersi C pada posisi antara 16184 dan 16193 terhadap CRS menyebabkan terbentuknya rangkaian poli-C. Mutasi terhadap CRS ditunjukkan dengan perubahan warna nukleotida menjadi merah.
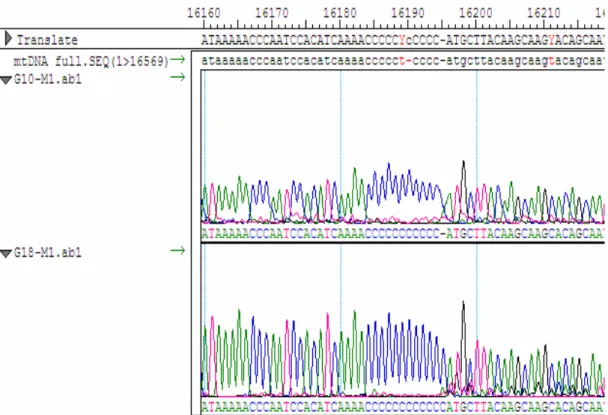
Pada posisi antara 16184-16193, standar CRS memiliki urutan yang terdiri atas sembilan C dan satu T. Mutasi substitusi T menjadi C pada posisi 16189 telah banyak dijumpai dan dapat membagi populasi menjadi dua bagian, yaitu 83% dan 17%, masing-masing untuk populasi T dan C. Mutasi ini juga menyebabkan terbentuknya rangkaian poli-C sepanjang 10C. Hasil perbandingan urutan setiap klon sampel GMR (G10 dan G18) terhadap CRS menunjukkan adanya mutasi T16189C ini. Adanya insersi satu C pada posisi antara 16184 dan 16193 untuk klon G10 serta insersi dua C pada posisi yang sama untuk klon G18 memperpanjang rangkaian poli-C yang terbentuk menjadi 11C dan 12C untuk masing-masingnya, seperti yang terlihat pada tampilan program seqman untuk analisis sampel GMR yang ditunjukkan oleh Gambar 4.7.
Gambar 4.7 Tampilan program seqman untuk analisis sampel GMR
Sampel G10 memiliki panjang rangkaian poli-C yang berbeda dengan G18. Perbedaan panjang ini ditunjukkan dengan tanda strip (-) pada baris sampel G10. Sedangkan tanda (-) pada baris CRS (ditunjukkan dengan nama mtDNA full pada gambar) menunjukkan adanya insersi pada sampel yang dibandingkan terhadapnya.
Perbandingan urutan sampel GMR dengan CRS ditunjukkan pada Tabel 4.3. Hasil perbandingan urutan antara klon-klon ini menunjukkan adanya heteroplasmi berupa variasi panjang rangkaian poli-C, yaitu 11C untuk klon G10 dan 12C untuk klon G18 (Tabel 4.3). Tabel 4.3 Perbandingan urutan sampel GMR terhadap CRS dan terhadap satu sama lain
1618 4 1618 5 1618 6 1618 7 1618 8 1618 9 1619 0 1619 1 1619 1 1619 3 Inser si 1 Inser si 2 CRS C C C C C T C C C C X X G10 C C C C C C C C C C C X G18 C C C C C C C C C C C C
Kedua klon GMR memiliki mutasi T16189C dan insersi pada posisi antara 16184 dan 16193 terhadap CRS. Jumlah insersi yang berbeda menghasilkan panjang poli-C yang berbeda pula, 11C untuk G10 dan 12C untuk G18. Adanya subpopulasi pada sampel GMR dikenal dengan heteroplasmi. Mutasi terhadap CRS ditunjukkan dengan warna merah.
Adanya subpopulasi mtDNA pada individu tertentu atau yang dikenal sebagai heteroplasmi seperti ditunjukkan dua sampel yang dianalisis diduga kuat merupakan penyebab tidak terbacanya urutan nukleotida setelah rangkaian poli-C melalui direct sequencing. Campuran subpopulasi yang berbeda diduga menyebabkan detektor sekuensing menerima dua sinyal
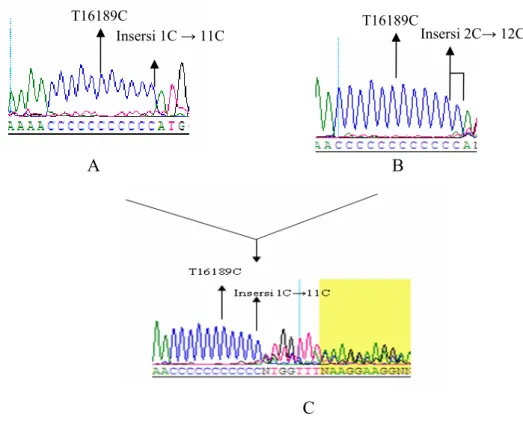
fluoresens yang juga berbeda pada posisi yang sama. Perbedaan sinyal ini terjadi karena pergeseran basa akibat perbedaan panjang rangkaian poli-C tadi. Dua sinyal fluoresens yang berbeda akan terdeteksi pada elektroforegram berupa pita yang tidak tajam, bertumpuk dan intensitasnya sangat rendah. Kloning dapat mengatasi masalah ini karena setiap klon yang disekuensing hanya terdiri dari satu populasi mtDNA tertentu saja. Heteroplasmi dapat terdeteksi karena subpopulasi yang berbeda terdapat dalam jumlah yang proporsional. Jika salah satu subpopulasi sangat dominan terhadap yang lain, maka diduga heteroplasmi tidak akan terdeteksi karena sekuensing hanya membaca fragmen yang dominan saja. Untuk membuktikan lebih lanjut hal ini maka dilakukan sekuensing campuran klon yang mewakili subpopulasi yang berbeda dengan komposisi yang bervariasi (lihat Gambar 4.8).
T16189C Insersi 1C → 11C T16189C Insersi 2C→ 12C
A B
C
Gambar 4.8 Contoh urutan nukleotida campuran klon DNA
Hasil pencampuran klon G10 (A) dan klon G18 (B) dengan perbandingan masing-masing 50%, menghasilkan, G1 (C) yang memiliki rangkaian poli-C dengan panjang 11C tetapi urutan nukleotida setelah poli-C tidak menunjukkan puncak yang jelas.
Pada penelitian ini dilakukan pencampuran klon DNA dari sampel G10 yang memiliki poli-C dengan panjang 11poli-C dan sampel G18 yang memiliki panjang 12poli-C dalam beberapa perbandingan, salah satunya dapat dilihat pada Gambar 4.8 untuk sampel G1. Hasil dari pencampuran ini tetap didapatkan mutasi T16189C dan rangkaian poli-C dengan panjang 11C. Akan tetapi, urutan nukleotida setelah poli-C tidak dapat terbaca ditunjukkan dengan puncak elektroforegram yang menumpuk.
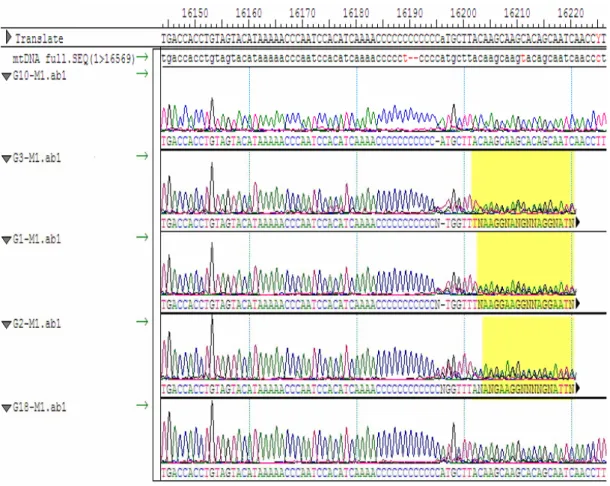
Perbandingan urutan nukleotida antara CRS dengan hasil sekuensing klon G10 dan G18 serta sampel G1, G2, dan G3, bertujuan untuk menganalisis adanya heteroplasmi sebagai penyebab tidak terbacanya urutan nukleotida daerah HVSI yang memiliki urutan poli-C (Gambar 4.9).
Gambar 4.9 Tampilan program seqman untuk analisis sampel G1, G2, G3, G10, dan G18 Elektroforegram yang dihasilkan setelah urutan poli-C pada sampel G1, G2, dan G3 tidak menunjukkan puncak yang jelas, berbeda dengan yang terlihat pada sampel G10 dan G18. Oleh karena itu pembacaan urutan nukleotida untuk sampel G1, G2, dan G3 hanya dapat dilakukan sampai urutan sekitar 16200, ditandai dengan warna kuning.
Sampel G1 menghasilkan rangkaian poli-C dengan panjang 11C, sampel G2 menghasilkan rangkaian poli-C dengan panjang 12C, dan sampel G3 menghasilkan rangkaian poli-C dengan panjang 11C. Ketiga sampel ini menghasilkan puncak elektroforegram yang menumpuk dengan intensitas yang rendah setelah urutan poli-C, terlihat dengan banyaknya notasi N pada urutan nukleotida. Notasi N memiliki arti bahwa terdapat puncak yang tidak jelas yang disebabkan bertumpuknya beberapa puncak pada satu posisi atau terlalu rendahnya puncak yang dihasilkan dari nukleotida tersebut sehingga mesin sekuensing tidak dapat memutuskan notasi nukleotidanya. Hal ini menunjukkan dari campuran klon yang mewakili subpopulasi yang berbeda menghasilkan dua sinyal fluoresens yang berbeda pula
dan akan terdeteksi pada elektroforegram berupa puncak yang tidak jelas sehingga pembacaan urutan nukleotida pada daerah ini menjadi tidak lengkap. Dengan demikian, dari hasil yang diperoleh dapat memperkuat hipotesis yang menyebutkan bahwa heteroplasmi menjadi penyebab pembacaan urutan nukleotida DNA mitokondria manusia yang memiliki poli-C pada daerah HVSI tidak lengkap.