UJI TOTAL VIABLE COUNT DAN BAKTERI COLIFORM DALAM IKAN AIR TAWAR DAN LAUT
I. PENDAHULUAN A. Latar Belakang
Ikan merupakan bahan makanan yang sering dikonsumsi manusia. Kandungan nutrien pada ikan bermanfaat untuk kesehatan, tetapi kualitas ikan juga harus diperhatikan melalui ada atau tidaknya bahan kimia atau mikrobia yang berbahaya. Salah satu jenis mikrobia yang mencemari ikan air tawar dan laut adalah bakteri coliform. Bakteri ini dapat mencemari ikan melalui tahap sebelum dikonsumsi, misalnya dalam transportasi, penyimpanan, atau pengolahan menggunakan alat-alat yang tidak steril. Bakteri coliform dapat dideteksi secara kuantitatif melalui uji total plate count dan MPN (most probable number), dan secara kualitatif melalui isolasi mikrobia ke dalam medium tertentu. Standar minimal layak konsumsi total coliform dan fecal coliform pada ikan berturut-turut adalah <100 MPN/g dan <10 MPN/g, sedangkan standar maksimal layak konsumsi jumlah mikrobia pada ikan melalui uji total plate count adalah 5 x 105 cfu/g (Sanjee & Karim, 2016). Praktikum ini dilakukan
untuk menguji adanya mikrobia pada ikan tawar dan laut secara kuantitatif dan kualitatif sehingga kualitas ikan dapat terjaga dan layak konsumsi.
B. Tujuan
Praktikum ini bertujuan untuk menghitung total mikrobia dan menguji bakteri coliform dalam ikan air tawar dan laut.
II. METODE A. Bahan
Bahan-bahan yang digunakan antara lain: ikan air tawar dan laut, medium laktosa cair, medium endo agar, medium plate count agar, larutan NaCl 0,85%, alkohol 70%.
B. Alat
medium, mikropipet dan pipet tetes untuk menginokulasi mikrobia, inkubator untuk inkubasi, vortex untuk homogenisasi larutan.
C. Cara Kerja
a. Penghitungan jumlah mikrobia total
Sampel ikan sebanyak 9 gram disuspensikan ke dalam 90 ml NaCl 0,85% kemudian dihaluskan menggunakan blender. Sampel dibuat pengenceran 10-2 sampai 10-6, kemudian 1
ml sampel diinokulasi secara pour plate ke dalam medium PCA. Sampel diinkubasi selama 24 – 72 jam pada suhu 300C. Selanjutnya, jumlah mikrobia total (CFU/g bahan makanan)
dihitung.
b. Pengujian bakteri coliform
Sampel dibuat pengenceran 10-2 sampai 10-4 sebanyak 2 kali ulangan. Sampel hasil
pengenceran diinokulasi 1 ml ke dalam medium laktosa cair (9 ml) sebanyak 3 kali ulangan, kemudian diinkubasi selama 24 – 48 jam pada suhu 370C. Selanjutnya, jumlah tabung positif
yang ditunjukkan oleh terbentuk warna kuning dan gas dihitung dan dibandingkan dengan tabel MPN. Hasil positif diinokulasi ke dalam medium endo agar secara streak plate kemudian diinkubasi selama 24 – 48 jam pada suhu 370C. Selanjutnya, hasil positif berupa
koloni kuning keemasan (E.coli) diamati.
III. HASIL DAN PEMBAHASAN A. Hasil
Berikut merupakan hasil yang didapat dari praktikum ini. Tabel 1. Total plate count ikan air tawar
Jumlah mikrobia berdasarkan total plate count adalah 0 cfu/g.
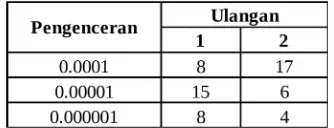
Tabel 2. MPN ikan air tawar pada medium laktosa cair
Tabel 3. Total viable count ikan air laut
Jumlah mikrobia berdasarkan total plate count adalah 106 x 106 cfu/g.
Tabel 4. MPN ikan air laut pada medium laktosa cair
Jumlah coliform berdasarkan MPN adalah >1100 MPN/g.
Tabel 5. Uji E. coli ikan air tawar pada medium endo agar
Tabel 6. Uji E. coli ikan air laut pada medium endo agar
B. Pembahasan
Sampel yang digunakan pada praktikum ini adalah ikan air tawar dan laut. Kedua jenis ikan tersebut digunakan karena untuk membedakan jenis kontaminan, jumlah kontaminan, dan potensi kontaminasi. Kontaminasi mikrobia pada ikan air tawar dan laut disebabkan oleh proses handling dan transportasi yang kurang diperhatikan kebersihannya. Selain itu, dapat disebabkan pula oleh kualitas air yang digunakan untuk mencuci dan es yang digunakan untuk mengawetkan. Air dan es yang digunakan kemungkinan mengandung bakteri coliform (Sanjee & Karim, 2016).
adalah psikrotrofik atau psikrofilik dan didominasi oleh bakteri Gram negatif, sedangkan mikrobia yang ada pada ikan berasal dari air lebih hangat adalah mesofilik dan didominasi oleh bakteri Gram positif. Bakteri pada ikan air laut lebih dingin antara lain: Moraxella, Acinetobacter, Pseudomonas, Flavobacterium, dan Vibrio; sedangkan pada ikan air laut lebih hangat antara lain: Micrococci, coryneform, dan Bacillus. Bakteri pada ikan air tawar antara lain: Pseudomonas, Cytophaga, Aeromonas, dan coryneform; sedangkan pada ikan air tawar lebih hangat adalah Salmonella (Batt & Tortorello, 2014; Adams et al., 2016).
Bakteri coliform merupakan kelompok bakteri aerobik atau fakultatif anaerobik, Gram negatif, tidak membentuk spora, berbentuk batang, dapat menfermentasi laktosa dengan menghasilkan asam dan gas, dapat hidup di suhu 350 – 370C selama 48 jam inkubasi. Genus
yang termasuk bakteri coliform antara lain: Escherichia, Klebsiella, dan Enterobacter. Faecal coliform merupakan anggota bakteri coliform yang dapat tumbuh dan menfermentasi laktosa pada 440 C. Bakteri coliform termasuk ke dalam Enterobacteriaceae yang dapat memproduksi
gen untuk ß-galaktosidase, yaitu enzim yang memecah laktosa menjadi glukosa dan galaktosa. Pencemaran makanan dapat diketahui melalui keberadaan bakteri coliform sehingga bakteri coliform dijadikan indikator pencemaran atau kontaminasi. Indikator yang biasa digunakan adalah E. coli (Mara & Horan, 2003; Yousef & Carlstrom, 2003).
Medium laktosa merupakan medium selektif untuk pertumbuhan bakteri coliform. Laktosa digunakan sebagai sumber karbon dan energi. Keberadaan bakteri coliform dalam sampel dideteksi menggunakan medium laktosa. Bakteri coliform menghasilkan enzim ß-galaktosidase yang dapat mengubah warna medium dari merah menjadi kuning (Pommerville, 2010).
Medium endo agar merupakan medium selektif, isolasi, kultivasi, dan diferensiasi untuk bakteri coliform. Medium ini digunakan untuk membedakan koloni bakteri yang dapat menfermentasi laktosa (koloni merah) dengan koloni bakteri yang tidak dapat menfermentasi laktosa (koloni tidak berwarna atau translucent). Komponen medium ini antara lain: agar, laktosa, peptic digest of animal tissue, K2HPO4, Na2SO3, dan Fuchsin. pH medium adalah 7,4
± 0,2 pada 250C. Bakteri coliform memproduksi aldehid dan asam dari laktosa. Aldehid
melepas fuchsin dari senyawa fuchsin-sulfat sehingga membentuk koloni berwarna merah. Reaksi akan semakin intens kemudian fuchsin terkristalisasi dan membentuk koloni berwarna hijau mengkilat (Corry et al., 2003; Atlas, 2005).
menunjukkan perbedaan mikrobia berdasarkan habitat secara kuantitatif, serta dapat digunakan untuk studi substrat hidup dan fisiologi mikrobia. Kekurangan dari plate count antara lain: tidak semua mikrobia dapat dienumerasi menggunakan metode ini karena perbedaan kondisi lingkungan yang diperlukan untuk kultivasi, serta metode ini menggunakan asumsi bahwa setiap koloni yang dihitung berasal dari satu sel bakteri. Kelebihan dari MPN antara lain: hanya menghitung jumlah mikrobia yang hidup dan aktif, dapat digunakan untuk enumerasi berbagai kelompok dan spesies mikrobia, serta inokulasi jumlah sampel dapat ditingkatkan sehingga sensitifitas juga meningkat. Kekurangan dari MPN antara lain: prosedur sulit dilakukan, dan memiliki derajat presisi lebih rendah (Okafor, 2011; da Silva et al., 2013).
Menurut Sanjee & Karim (2016), standar minimal layak konsumsi total coliform dan fecal coliform pada ikan berturut-turut adalah <100 MPN/g dan <10 MPN/g, sedangkan standar maksimal layak konsumsi jumlah mikrobia pada ikan melalui uji total plate count adalah 5 x 105 cfu/g. Hasil menunjukkan bahwa jumlah mikrobia ikan air tawar berdasarkan total plate
count adalah 0 cfu/g (Tabel 1), sedangkan pada ikan air laut adalah 106 x 106 cfu/g (Tabel 3).
Jumlah coliform baik pada ikan air tawar dan ikan air laut berdasarkan MPN adalah >1100 MPN/g, dengan semua hasil positif yang ditunjukkan oleh terbentuk koloni berwarna kuning dan adanya gas pada tabung Durham (Tabel 2 dan Tabel 4).
Berdasarkan standar minimal layak konsumsi tersebut, jumlah coliform pada sampel melebihi standar sehingga kualitas ikan tidak baik dan tidak layak dikonsumsi. Pengujian menggunakan medium endo agar dilakukan untuk memastikan keberadaan bakteri coliform (E. coli) pada sampel ikan air tawar dan laut. Hasil menunjukkan bahwa E. coli secara positif terkandung di dalam sampel (Tabel 5 dan Tabel 6). Koloni berwarna kuning keemasan terbentuk karena laktosa yang ada pada medium endo agar dapat difermentasi E. coli. Kontaminasi bakteri coliform pada sampel dapat disebabkan oleh proses pengolahan (handling) yang kurang baik dan kurang bersih. Selain itu, air dan es yang digunakan untuk mencuci dan mengawetkan telah terkontaminasi bakteri coliform.
IV. KESIMPULAN
Jumlah mikrobia ikan air tawar berdasarkan total plate count adalah 0 cfu/g, sedangkan pada ikan air laut adalah 106 x 106 cfu/g. Jumlah coliform baik pada ikan air tawar dan ikan
V. DAFTAR PUSTAKA
Adams, M. R., M. O. Moss, P. J. McClure. 2016. Food Microbiology. The Royal Society of Chemistry. Cambridge, p. 15.
Atlas, R. M. 2005. Handbook of Media for Environmental Microbiology. CRC Press. Florida, p. 204.
Batt, C. A., and M. Tortorello. 2014. Encyclopedia of Food Microbiology. Academic Press, London, p. 926.
Corry, J. E. L., G. D. W. Curtis, R. M. Baird. 2003. Handbook of Culture Media for Food Microbiology. Elsevier. Amsterdam, p. 173.
da Silva, N., M. H. Taniwaki, V. C. A. Junqueira, N. F. d. Silveira, M. d. do Nascimento, R. A. R. Gomes. 2013. Microbiological Examination Method of Food and Water. CRC Press. Florida, p. 39.
Mara, D., and N. Horan. 2003. Handbook of Water and Wastewater Microbiology. Academic Press. London, p. 106.
Okafor, N. 2011. Environmental Microbiology of Aquatic and Waste Systems. Springer. Dordrecht, pp. 20-21.
Pommerville, J. C. 2010. Alcamo’s Fundamentals of Microbiology. Jones and Bartlett Publishers. Massachusetts, p. 882.
Sanjee, S. A., and M. E. Karim. 2016. Microbiological quality assessment of frozen fish and fish processing materials from Bangladesh. International Journal of Food Science 2016: 1-6.