UJI AKTIVITAS PENANGKAPAN RADIKAL HIDROKSIL OLEH EKSTRAK ETANOL TEH HIJAU DAN TEH HITAM DENGAN METODE
DEOKSIRIBOSA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh : Carla Kuntari NIM : 028114097
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
UJI AKTIVITAS PENANGKAPAN RADIKAL HIDROKSIL OLEH EKSTRAK ETANOL TEH HIJAU DAN TEH HITAM DENGAN METODE
DEOKSIRIBOSA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh : Carla Kuntari NIM : 028114097
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2007
SKRIPSI
UJI AKTIVITAS PENANGKAPAN RADIKAL HIDROKSIL OLEH EKSTRAK ETANOL TEH HIJAU DAN TEH HITAM DENGAN METODE
DEOKSIRIBOSA
Oleh : Carla Kuntari NIM : 028114097
Telah disetujui oleh :
When you walk through a storm,keep your head up high
and don’t be afraid of the dark. At the end of the storm is a golden sky
and the sweet silver song of lark. Walk on through the wind, walk on
through the rain, tho’ your dream be tossed and blown. Walk on, walk
on with hope in your heart. And you’ll never walk alone.
--
O
O
s
s
c
c
a
a
r
r
H
H
.
.
-
-Kupersembahkan karyaku ini kepada:
kedua orangt uaku, Drs. B. Rahmant o, M. Hum. dan A. M. Budiart i, AMK. kakakku Lukas Priyambodo, S. E. ,
sahabat ku Danang Hendro Pamungkas, almamat erku,
t erima kasih at as doa, semangat , bant uan, dan perhat ian yang besar selama penelit ian dan penyusunan karyaku ini
PRAKATA
Puji dan syukur penulis haturkan kepada Tuhan yang telah melimpahkan berkat dan karuniaNya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Uji Aktivitas Penangkapan Radikal Hidroksil oleh Ekstrak Etanol Teh Hijau dan Teh Hitam dengan Metode Deoksiribosa” dengan baik. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi di Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta.
Selama penelitian dan penyusunan skripsi ini tidak lepas dari peran serta berbagai pihak yang telah memberikan bimbingan, dorongan, dan saran. Oleh karena itu, penulis ingin mengucapkan banyak terima kasih kepada :
1. Rita Suhadi, M.Si., Apt. selaku dekan Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta.
2. Dra. A. Nora Iska Harnita, M.Si., Apt. selaku dosen pembimbing atas bimbingan, saran, dan kritik selama penelitian sampai penyusunan skripsi ini. 3. Prof. Dr. Sudibyo Martono, M.S., Apt. selaku dosen penguji atas saran dan
kritik terhadap skripsi ini.
4. Erna Tri Wulandari, M.Si., Apt. selaku dosen penguji atas saran dan kritik terhadap skripsi ini.
5. Enade Perdana I, S.F., Apt. dan Romo Drs. P. Sunu H., SJ. atas diskusi, kritik, saran, dan pencarian jurnal-jurnal yang turut mendukung dalam penyusunan skripsi ini.
6. PT. Pagilaran yang telah memberikan ijin kepada penulis untuk mempelajari proses pengolahan teh hijau dan teh hitam di pabrik teh PT. Pagilaran Banjarnegara, Jawa Tengah dan Samigaluh, Yogyakarta.
7. Bapak Mukmin, Bapak Prapto, Mas Parlan, Mas Kunto, Bapak Kasiran, Mas Kayat, Mas Wagiran, dan Mas Ottok atas pendampingan dan bantuan selama penelitian.
8. Rekan kerja saat penelitian : Nana, Leny, Ardhyan, dan Vini, terima kasih atas bantuan selama bekerja di “rumah kedua” dan selama penyusunan skripsi ini. 9. Sahabat-sahabat penulis : Rendeng, Bertha, Winda, Lisa, Novi, Anno, terima
kasih atas jalinan persahabatan yang indah selama ini.
10.Bapak Yus, Arya, Heri, Danang, dan Kris atas bantuannya selama kunjungan di PT. Pagilaran.
11.Teman-teman praktikum kelompok D dan teman-teman Farmasi angkatan 2002, atas kebersamaannya selama menempuh pendidikan di Fakultas Farmasi Universitas Sanata Dharma, Yogyakarta.
12.Semua pihak yang tidak dapat penulis sebutkan satu persatu, terima kasih atas segala dukungan moril dan materiilnya.
Penulis
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Yogyakarta, Februari 2007 Penulis
Carla Kuntari
INTISARI
Radikal hidroksil merupakan radikal bebas yang sangat reaktif. Radikal hidroksil dapat memecah rantai DNA dan berperan dalam karsinogenik, mutagenik serta sitotoksik. Dalam tubuh, radikal hidroksil ditangkap oleh sistem antioksidan. Saat jumlah radikal bebas melampaui kapasitas sistem antioksidan, diperlukan antioksidan eksogen. Salah satu antioksidan eksogen adalah polifenol yang terdapat pada teh hijau maupun teh hitam. Polifenol dapat bereaksi dengan radikal hidroksil membentuk produk yang kurang reaktif. Penelitian ini bertujuan untuk mengetahui aktivitas penangkapan radikal hidroksil oleh ekstrak etanol teh hijau dan teh hitam. Nilai aktivitas penangkapan radikal hidroksil dinyatakan dalam persen penangkapan (% scavenging) dan nilai penangkapan efektif (effective scavenging) radikal hidroksil sebesar 50% (ES50).
Penelitian ini merupakan jenis penelitian eksperimental karena ada subjek uji yang dikenakan manipulasi perlakuan. Metode penangkapan radikal hidroksil yang digunakan adalah metode deoksiribosa. Prinsip metode ini adalah degradasi deoksiribosa oleh radikal hidroksil, yang dihasilkan oleh reagen Fenton, membentuk malondialdehid (MDA) yang dalam suasana asam dan adanya asam tiobarbiturat (TBA) menghasilkan kromogen merah muda yang diukur absorbansinya pada panjang gelombang maksimum 532 nm. Nilai ES50 dihitung
dari persamaan regresi linear antara konsentrasi ekstrak etanol teh hijau atau teh hitam terhadap % scavenging pada berbagai konsentrasi.
Hasil penelitian menunjukkan bahwa ekstrak etanol teh hijau dan teh hitam memiliki aktivitas penangkapan radikal hidroksil dengan nilai ES50 (hasil
ekstrapolasi) ekstrak etanol teh hijau adalah 0,281 mg/ml dan ekstrak etanol teh hitam adalah 0,344 mg/ml.
Kata kunci : radikal hidroksil, antioksidan, polifenol, ekstrak etanol teh hijau dan teh hitam, metode deoksiribosa.
ABSTRACT
Hydroxyl radical is very reactive free radical. Hydroxyl radical could break DNA chains and play role in carcinogenic, mutagenic, and cytotoxic. Inside the body, antioxidant system can reduce hydroxyl radical but when there is imbalance between the extent of hydroxyl radical and the antioxidant system capacity, body needs exogenous antioxidants. One of them is polyphenols that can be found in green-or black-tea. Polyphenols can react with free radical to form less reactive products. The objective of this research is to know the hydroxyl radical scavenging activity of green-and black-tea ethanolic extract. Hydroxyl radical scavenging activity expressed as percent scavenging and 50 % hydroxyl radical effective scavenging (ES50).
This research is a kind of experimental research, because there is treatment to the research subject. The radical scavenging activity method was measured by the deoxyribose method. The principle of this method is degradation of deoxyribose by hydroxyl radical, which generates from Fenton Reagent, to form malondialdehid (MDA) that upon heating with thiobarbituric acid (TBA) at low pH, yield pink chromogen which can be measured in maximum wavelength at 532 nm. The ES50 value can be count by regeresion linear between green-or black-tea
ethanolic extract concentration and percent scavenging in each concentration. The result of this research indicated that both of green-and black-tea ethanolic extract have hydroxyl radical scavenging activity with ES50
(extrapolated) value of green tea ethanolic extract is 0.281 mg/ml and black tea ethanolic extract is 0.344 mg/ml.
Keywords : hydroxyl radical, antioxidant, polyphenols, green-and black-tea ethanolic extract, deoxyribose method.
DAFTAR ISI
HALAMAN JUDUL... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN... iv
HALAMAN PERSEMBAHAN ... v
PRAKATA... vi
PERNYATAAN KEASLIAN KARYA ... viii
INTISARI... ix
ABSTRACT... x
DAFTAR ISI... xi
DAFTAR TABEL... xv
DAFTAR GAMBAR ... xvi
DAFTAR LAMPIRAN... xvii
BAB I PENGANTAR ... 1
A. Latar Belakang ... 1
1. Permasalahan ... 4
2. Keaslian penelitian ... 4
3. Manfaat penelitian... 4
B. Tujuan Penelitian ... 5
BAB II PENELAAHAN PUSTAKA... 6
A. Radikal Bebas ... 6
B. Antioksidan ... 10
C. Teh ... 11
1. Klasifikasi dan pengolahan teh ... 11
2. Kandungan kimia dalam teh... 13
3. Manfaat teh ... 16
4. Reaksi radikal bebas dengan polifenol dalam teh ... 16
D. Metode Deteksi Radikal Hidroksil... 19
E. Metode Deoksiribosa ... 19
F. Penyarian... 22
1. Cara penyarian ... 22
2. Cairan penyari ... 24
G. Spektrofotometri UV-Vis... 25
H. Landasan Teori... 30
I. Hipotesis... 31
BAB III METODE PENELITIAN ... 32
A. Jenis dan Rancangan Penelitian ... 32
B. Variabel-Variabel Penelitian... 32
1. Variabel bebas... 32
2. Variabel tergantung... 32
3. Variabel pengacau... 32
C. Definisi Operasional ... 33
D. Bahan-Bahan Penelitian ... 33
E. Alat-Alat Penelitian... 34
F. Tata Cara Penelitian ... 34
1. Pemilihan sampel ... 34
2. Pembuatan ekstrak etanol teh hijau dan teh hitam ... 35
3. Pembuatan bufer fosfat 20 mM... 35
4. Pembuatan reagen ... 36
5. Pembuatan larutan deoksiribosa 2,5 mM ... 37
6. Pembuatan larutan ekstrak etanol teh hijau dan teh hitam 1 mg/ml .... 37
7. Optimasi metode ... 38
8. Uji aktivitas penangkapan radikal hidroksil oleh ekstrak etanol teh hijau dan teh hitam ... 39
G. Analisis Hasil ... 39
BAB IV HASIL DAN PEMBAHASAN ... 41
A. Pemilihan Sampel ... 41
B. Ekstrak Etanol Teh Hijau dan Teh Hitam ... 42
C. Optimasi Metode... 44
1. Penentuan operating time (waktu operasional)... 44
2. Penentuan panjang gelombang serapan maksimum... 48
D. Uji Aktivitas Penangkapan Radikal Hidroksil oleh Ekstrak Etanol Teh Hijau dan Teh Hitam... 50
BAB V KESIMPULAN DAN SARAN... 50
A. Kesimpulan ... 57
B. Saran ... 57
DAFTAR PUSTAKA ... 58
LAMPIRAN... 62 BIOGRAFI PENULIS ... 76
DAFTAR TABEL
Tabel I. Reactive oxygen species (ROS)... 7
Tabel II. Proses pengolahan teh hijau ... 12
Tabel III. Proses pengolahan teh hitam... 12
Tabel IV. Komposisi dari pucuk daun teh segar ... 13
Tabel V. Karakteristik struktur flavonoid untuk aktivitas penangkapan radikal yang efektif ... 17
Tabel VI. Metode dan prinsip deteksi radikal hidroksil ... 19
Tabel VII. Pemilihan cara penyarian ... 24
Tabel VIII. Spektrum warna pada daerah visibel... 29
Tabel IX. Absorbansi kromogen MDA-TBA pada penambahan ekstrak etanol teh hijau pada berbagai konsentrasi... 50
Tabel X. Absorbansi kromogen MDA-TBA pada penambahan ekstrak etanol teh hitam pada berbagai konsentrasi ... 51
Tabel XI. Persen scavenging ekstrak etanol teh hijau dan teh hitam ... 52
Tabel XII.Persamaan regresi linier ekstrak etanol teh hijau sebelum dan sesudah konversi ... 54
Tabel XIII.Persamaan regresi linier ekstrak etanol teh hitam sebelum dan sesudah konversi ... 54
Tabel XIV. Persentase penangkapan efektif radikal hidroksil sebesar 50 % oleh ekstrak etanol teh hijau dan teh hitam ... 55
DAFTAR GAMBAR
Gambar 1. Struktur kimia catechin dalam teh dan epimernya... 14
Gambar 2. Struktur kimia theaflavin (a) dan thearubigin (b) ... 15
Gambar 3. Struktur kimia flavonol dalam teh ... 15
Gambar 4. Gambaran gugus-gugus pada flavonoid yang memiliki aktivitas sebagai penangkap radikal bebas ... 18
Gambar 5. Mekanisme reaksi antara gugus catechol dengan radikal hidroksil ... 18
Gambar 6. Struktur deoksiribosa ... 19
Gambar 7. Reaksi penyerangan radikal hidroksil pada deoksiribosa ... 21
Gambar 8. Reaksi pembentukan radikal gula peroksil ... 21
Gambar 9. Struktur MDA ... 22
Gambar 10. Kurva hubungan waktu (menit) dengan absorbansi kromogen MDA-TBA ... 45
Gambar 11. Reaksi pembentukan gugus enol pada TBA ... 46
Gambar 12. Mekanisme reaksi pembentukan kromogen MDA-TBA ... 47
Gambar 13. Struktur kromogen MDA-TBA... 48
Gambar 14. Kurva hubungan panjang gelombang (nm) dengan absorbansi kromogen MDA-TBA... 49
Gambar 15. Kurva hubungan antara penambahan konsentrasi ekstrak etanol teh hijau dan teh hitam dengan absorbansi ... 51
Gambar 16. Kurva hubungan antara penambahan konsentrasi ekstrak etanol teh hijau dan teh hitam dengan % scavenging... 55
DAFTAR LAMPIRAN
Lampiran 1. Foto ekstrak etanol teh hijau dan teh hitam ... 62
Lampiran 2. Tabel Krejcie... 63
Lampiran 3. Tabel random sampling... 64
Lampiran 4. Contoh penimbangan bahan... 65
Lampiran 5. Contoh perhitungan % scavenging ekstrak etanol teh hijau dan teh hitam ... 74
Lampiran 6. Contoh perhitungan ES50... 75
BAB I PENGANTAR
A. Latar Belakang
Radikal bebas merupakan spesi yang bersifat sangat reaktif karena adanya elektron yang tak berpasangan (Fessenden dan Fessenden, 1986) dan mempunyai kemampuan untuk menimbulkan kerusakan, termasuk peroksidasi lipid, lesi DNA (Deoxyribo Nucleic Acid), dan fragmentasi protein dalam sel. Akumulasi dari kerusakan makromolekuler intraseluler merupakan penyebab proses penuaan dini, keriput, noda hitam, dan beberapa penyakit degenerasi seperti kanker dan jantung koroner (Fulder, 2004; Syah, 2006).
Manusia mempunyai sistem antioksidan yang mampu melindungi tubuh dari radikal bebas. Sistem antioksidan ini dibagi menjadi dua kelompok yaitu kelompok enzimatik dan non-enzimatik. Antioksidan enzimatik terdiri dari superoxide dismutase (SOD), katalase, dan glutathione peroxidase. Antioksidan non-enzimatik terdiri dari vitamin E, A, provitamin A (beta karoten), dan vitamin C. Antioksidan enzimatik secara alamiah dihasilkan oleh tubuh sedangkan antioksidan non-enzimatik diperoleh dari luar tubuh (Fouad, 2005).
Selain penggolongan antioksidan di atas, dikenal pula senyawa antioksidan alami seperti senyawa polifenol yang terdapat pada teh, buah-buahan, sayuran, anggur, bir, dan kecap (Sofia, 2005) dan senyawa antioksidan sintetik, yang lazim digunakan pada industri makanan, seperti BHA (butylated hydroxyanisole) dan BHT (butylated hydroxytoluene). Namun senyawa sintetik ini
2
diduga bersifat karsinogenik (Rajeshwar et al., 2005) dan bersifat toksik pada dosis tinggi (Halliwell dan Gutteridge, 1999) sehingga mendorong semakin banyak eksplorasi bahan alam (Kikuzaki dan Nakatani, 1993) seperti polifenol, vitamin C, dan beta karoten, sebagai sumber antioksidan. Penelitian ini merupakan salah satu perwujudan eksplorasi bahan alam khususnya teh hijau dan teh hitam sebagai sumber antioksidan.
Minuman teh dikonsumsi di banyak negara, termasuk Indonesia, serta di berbagai lapisan masyarakat. Semua jenis teh dibuat dari sumber yang sama yaitu pucuk dan daun muda tanaman teh (Camellia sinensis (L.) O. Kuntze.). Berdasarkan proses pengolahannya, produk teh dibagi menjadi tiga jenis yaitu teh hijau (tidak difermentasi), teh oolong (semifermentasi), dan teh hitam (fermentasi) (Tuminah, 2004).
Teh mempunyai banyak manfaat pada kesehatan, diantaranya sebagai antioksidan (Hartoyo, 2003). Manfaat teh sebagai antioksidan disebabkan oleh adanya senyawa polifenol yang berperan sebagai penangkap radikal bebas, seperti radikal hidroksil (Fulder, 2004). Fenol-fenol, senyawa dengan suatu gugus –OH yang terikat pada karbon cincin aromatik, merupakan antioksidan yang efektif. (Fessenden dan Fessenden, 1986). Senyawa-senyawa ini bereaksi dengan radikal bebas dan membentuk radikal baru yang distabilisasi oleh efek resonansi inti aromatik (Cuvelier et al., 1994).
bersifat polar sehingga dapat larut dalam pelarut seperti etanol atau air. Hal ini menjadi dasar pembuatan ekstrak teh hijau dan teh hitam menggunakan kombinasi cairan penyari etanol dan air. Diharapkan di dalam ekstrak etanol teh hijau maupun teh hitam senyawa polifenol dapat tersari dengan optimal. Teh hijau dan teh hitam, yang merupakan dua jenis teh yang populer di Indonesia, mengandung senyawa polifenol (pada persentase yang berbeda antara teh hijau dan teh hitam) sehingga ekstrak etanol teh hijau dan teh hitam diduga memiliki aktivitas sebagai penangkap radikal hidroksil.
4
1. Permasalahan
a. Apakah ekstrak etanol teh hijau dan teh hitam memiliki aktivitas sebagai penangkap radikal hidroksil dengan metode deoksiribosa yang dinyatakan dalam % scavenging?
b. Berapa nilai aktivitas penangkapan radikal hidroksil oleh ekstrak etanol teh hijau dan teh hitam dengan metode deoksiribosa yang dinyatakan sebagai ES50?
2. Keaslian Penelitian
Sejauh pengetahuan penulis, uji aktivitas penangkapan radikal hidroksil oleh ekstrak etanol teh hijau dan teh hitam dengan metode deoksiribosa belum pernah dilakukan. Adapun penelitian yang telah dilakukan adalah aktivitas antioksidan dari berbagai macam ekstrak teh dikaitkan dengan aktivitas antimutageniknya (Yen dan Chen, 1995) dan validasi metode deoksiribosa sebagai uji penangkapan radikal hidroksil oleh vitamin C secara in vitro
(Purwantoko, 2006).
3. Manfaat a. Manfaat teoritis
b. Manfaat metodologis
Memberikan dukungan dari segi penelitian mengenai aplikasi uji aktivitas penangkapan radikal hidroksil pada bahan-bahan alam khususnya ekstrak etanol teh hijau dan teh hitam.
c. Manfaat praktis
Memberikan pertimbangan mengenai penggunaan teh hijau dan teh hitam sebagai sumber antioksidan alami.
B. Tujuan Penelitian Penelitian ini bertujuan untuk:
1. Mengetahui aktivitas penangkapan radikal hidroksil oleh ekstrak etanol teh hijau dan teh hitam dengan metode deoksiribosa yang dinyatakan sebagai %
scavenging.
2. Mengetahui nilai aktivitas penangkapan radikal hidroksil oleh ekstrak etanol teh hijau dan teh hitam dengan metode deoksiribosa yang dinyatakan dalam
BAB II
PENELAAHAN PUSTAKA
A. Radikal Bebas
Radikal bebas adalah spesi yang dapat berdiri sendiri yang merujuk kepada
atom atau gugus atom apa saja yang memiliki satu atau lebih elekron tak
berpasangan (Fessenden dan Fessenden, 1986; Halliwell dan Gutteridge, 1999).
Meskipun suatu radikal bebas tidak bermuatan positif atau negatif, spesi semacam ini
sangat reaktif karena adanya elektron yang tak berpasangan (Fessenden dan
Fessenden, 1986).
Radikal dapat dibentuk dari spesi non-radikal yang kehilangan satu
elektronnya, penggabungan dengan satu elektron, atau terputusnya ikatan kovalen
melalui peristiwa fisi homolitik (homolytic fission). Peristiwa ini terjadi apabila satu
elektron dari pasangan elektron terikat pada masing-masing atomnya (Halliwell dan
Gutteridge, 1999).
Sumber radikal bebas, baik endogen maupun eksogen terjadi melalui
sederetan mekanisme reaksi yaitu pembentukan awal radikal bebas (inisiasi), lalu
perambatan atau terbentuknya radikal baru (propagasi), dan tahap terakhir
(terminasi), yaitu pemusnahan atau pengubahan menjadi radikal bebas stabil dan tak
reaktif (Sofia, 2005).
Reactive Oxygen Spesies (ROS) adalah suatu istilah yang digunakan para
peneliti untuk mencakup tidak hanya radikal oksigen tetapi juga beberapa spesi
non-radikal yang merupakan derivat O2 (Tabel I).
Tabel I. Reactive oxygen species (ROS)(Halliwell dan Gutteridge, 1999; Sofia, 2005)
Radikal Non-radikal
Superoksida, O2 Hidrogen peroksida, H2O2 Hidroksil, OH Asam hipoklorit, HOCl
Peroksil, RO2 Ozon, O3
Alkoksil, RO Oksigen singlet, ∆gO2 Hidroperoksil, HO2 Peroksinitrit, ONOO
-Oksigen aktif dalam bentuk superoksida, hidrogen peroksida, dan radikal
hidroksil merupakan hasil sampingan metabolisme normal dan menyerang molekul
biologis yang dapat menyebabkan kerusakan sel atau jaringan (Yen dan Chen, 1995;
Cerutti cit. Yen dan Chen, 1995). Radikal hidroksil merupakan bentuk yang amat
reaktif dan dihasilkan oleh fotolisis ultraviolet hidrogen peroksida dan dapat berlaku
sebagai toksikan primer dan sebagai sumber toksikan sekunder. Radikal hidroksil
yang dihasilkan dekat DNA secara perlahan-perlahan dapat memecah rantai DNA
dan berperan dalam karsinogenik, mutagenik serta sitotoksik (Rafat et al., cit. Roy et
al., 2001).
Dalam sel, ROS sangat cepat ditangkap oleh sistem pertahanan antioksidan
(antioxidant defense system). Saat peningkatan pembentukan ROS tidak dapat
ditanggulangi oleh sistem pertahanan antioksidan, tercetus situasi yang disebut stress
oksidatif. Semua ROS bersifat sangat reaktif karena memiliki konfigurasi elektron
yang tidak stabil sehingga mampu menarik elektron dari molekul lainnya dan
menciptakan radikal-radikal bebas lain yang mampu bereaksi dengan lebih banyak
molekul lainnya (Blokhina, 2000).
Efek oksidatif radikal bebas dapat menyebabkan peradangan dan penuaan
8
peroksida karena bereaksi dengan radikal bebas sehingga mempercepat penuaan.
Kanker disebabkan oleh oksigen reaktif yang intinya memacu zat karsinogenik,
sebagai faktor utama kanker. Oksigen reaktif dapat meningkatkan kadar LDL (low
density lipoprotein) yang kemudian menjadi penyebab penimbunan kolesterol pada
dinding pembuluh darah dengan akibat timbulnya atherosklerosis (Sofia, 2005).
Radikal bebas yang dikenal sangat reaktif adalah radikal hidroksil. Nilai
standar potensial reduksinya adalah 2,31 V. Radikal hidroksil bereaksi sangat cepat
dengan hampir semua tipe molekul dalam sel hidup, yaitu gula, asam amino,
fosfolipid, basa DNA, dan asam organik. Reaksi radikal hidroksil dengan DNA
mengakibatkan kerusakan penting dalam sel, mengingat kerusakan rantai DNA tidak
dapat dengan mudah diperbaiki oleh sel (Halliwell dan Gutteridge, 1999).
Radikal hidroksil dapat dihasilkan dari reaksi Fenton atau reaksi fisi
homolitik ikatan O-O pada H2O2.
Reaksi Fenton: H2O2 + Fe2+→ Fe(III) + OH ¯ + ˙OH
Fisi homolitik: H O O H UV 2 OH
Selain itu, radikal hidroksil juga dapat dibentuk dari reaksi H2O2 dengan adanya
ion-ion logam Cu+ (Halliwell dan Gutteridge, 1999).
Reaksi radikal hidroksil dapat dikelompokkan menjadi tiga macam yaitu:
abstraksi (pemisahan) hidrogen, adisi, dan transfer (perpindahan) elektron. Reaksi
radikal bebas dengan spesi non-radikal menghasilkan radikal bebas baru yang kurang
atau sama-sama reaktif dibandingkan radikal bebas awal. Contoh reaksi abstraksi
hidrogen adalah reaksi antara radikal hidoksil dengan alkohol membentuk air dan
menjadi sangat penting karena memiliki hubungan secara biologis dengan terjadinya
peroksidasi lipid (Halliwell dan Gutteridge, 1999).
C C
Reaksi adisi radikal hidroksil dapat terjadi pada reaksi radikal hidroksil dengan
senyawa aromatik. Contohnya adisi radikal hidroksil pada cincin purin pada basa
purin DNA menghasilkan radikal δ-hidroksiguanin. Radikal hidroksil juga
mengalami reaksi adisi pada atom yang mempunyai ikatan rangkap.
+ OH
C C C C
HO
Jika radikal hidroksil menyerang DNA yang menyebabkan kerusakan pada basanya
(dan gula deoksiribosa) maka hal ini akan memacu pecahnya ikatan pada DNA
(Halliwell dan Gutteridge, 1999).
Radikal hidroksil berperan pada transfer elektron, contohnya pada reaksi
dengan ion halida. Reaksi transfer elektron dapat terjadi pada reaksi antara radikal
hidroksil dengan ion halida dan dengan ion nitrit. Contoh reaksi radikal hidroksil
dengan ion halida adalah sebagai berikut:
Cl
Reaksi antara radikal hidroksil dengan ion nitrit adalah sebagai berikut:
10
B. Antioksidan
Istilah antioksidan sering digunakan namun sangat jarang didefinisikan
secara jelas. Menurut Fessenden dan Fessenden (1986), antioksidan merupakan suatu
inhibitor reaksi radikal bebas yang kadang-kadang dirujuk sebagai suatu “perangkap”
radikal bebas. Kerja yang lazim suatu inhibitor radikal bebas adalah bereaksi dengan
radikal bebas reaktif membentuk radikal bebas tak reaktif dan relatif stabil. Menurut
Halliwell dan Gutteridge (1999), antioksidan adalah substansi yang bila diberikan
pada konsentrasi rendah dibandingkan substrat yang mudah dioksidasi, secara
signifikan menunda atau menghambat oksidasi substrat tersebut.
Ada dua kategori antioksidan yaitu antioksidan enzim dan antioksidan
non-enzimatik (Harman, 1981). Antioksidan enzim mencakup superoksida dismutase
(SOD), katalase (CAT), dan glutation peroksidase (GPx). Superoksida dismutase
mengubah superoksida menjadi hidrogen peroksida; katalase dan glutation
peroksidase mengubah hidrogen peroksida dari reaksi SOD menjadi air. Sebagai
tambahan, glutatione peroksidase dapat menurunkan peroksidasi lipid secara
langsung (Blokhina, 2000).
Antioksidan non-enzimatik mencakup vitamin E, vitamin C, beta karoten,
glutation, asam urat, dan albumin. Bersama-sama, enzim-enzim dan antioksidan non
enzimatik mengubah ROS menjadi komponen yang lebih aman sebelum ROS
menyebabkan kerusakan pada sel dan jaringan (Fouad, 2005).
Selain penggolongan antioksidan di atas, dikenal pula senyawa antioksidan
alami seperti senyawa polifenol yang terdapat pada teh, buah-buahan, sayuran,
digunakan pada industri makanan, seperti BHA (butylated hydroxyanisole) dan BHT
(butylated hydroxytoluene).
C. Teh
Semua jenis produk teh berasal dari sumber yang sama yaitu pucuk dan
daun muda tanaman teh (Camellia sinensis). Keberagaman berbagai jenis teh yang
ada disebabkan karena adanya perbedaan dalam proses pengolahannya (Werkhoven,
1988).
1. Klasifikasi dan pengolahan teh
Secara umum, daun teh diolah menjadi teh hijau, teh oolong, dan teh hitam.
Teh hijau dan teh hitam telah umum diproduksi di Indonesia sedangkan teh oolong
diproduksi di China. Perbedaan antara teh hijau dan teh hitam adalah pada ada
tidaknya reaksi enzimatik yang berlangsung selama proses pengolahan teh. Pada teh
hitam, dikenal adanya proses fermentasi sedangkan pada teh hijau proses fermentasi
justru dicegah (Werkhoven, 1988). Pada teh oolong, proses pemanasan daun terjadi
dalam waktu singkat setelah penggulungan sehingga disebut teh semifermentasi.
Karakteristiknya berada di antara teh hitam dan teh hijau (Syah, 2006). Proses
pengolahan teh hijau dapat dilihat pada tabel II sedangkan proses pengolahan teh
hitam dapat dilihat pada tabel III.
Pada proses fermentasi dalam pengolahan teh hitam, enzim polifenol
oksidase akan mengubah senyawa polifenol menjadi theaflavin dan thearubigin.
Secara umum, theaflavin berperan dalam kecerahan (brightness) dan ketajaman
12
kontak langsung dengan polifenol karena polifenol terdapat dalam vakuola sel
sedangkan enzim polifenol oksidase terdapat dalam sitoplasma (Werkhoven, 1988;
Syah, 2006).
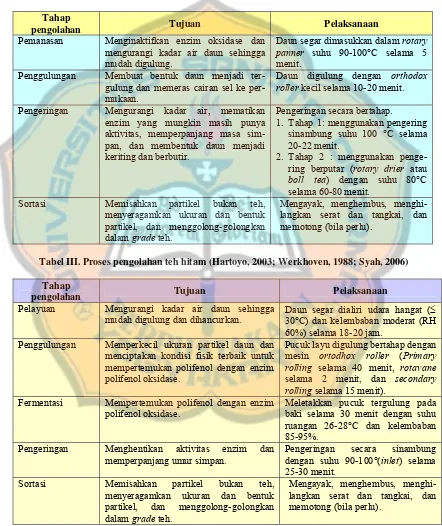
Tabel II. Proses pengolahan teh hijau (Hartoyo, 2003)
Tahap
pengolahan Tujuan Pelaksanaan
Pemanasan Menginaktifkan enzim oksidase dan mengurangi kadar air daun sehingga mudah digulung.
Daun segar dimasukkan dalam rotary
panner suhu 90-100°C selama 5
menit. Penggulungan Membuat bentuk daun menjadi
ter-gulung dan memeras cairan sel ke per-mukaan.
Daun digulung dengan orthodox roller kecil selama 10-20 menit.
Pengeringan Mengurangi kadar air, mematikan enzim yang mungkin masih punya aktivitas, memperpanjang masa sim-pan, dan membentuk daun menjadi keriting dan berbutir.
Pengeringan secara bertahap.
1. Tahap 1: menggunakan pengering sinambung suhu 100 °C selama 20-22 menit.
2. Tahap 2 : menggunakan penge-ring berputar (rotary drier atau
boll tea) dengan suhu 80°C
selama 60-80 menit. Sortasi Memisahkan partikel bukan teh,
menyeragamkan ukuran dan bentuk partikel, dan menggolong-golongkan dalam grade teh.
Mengayak, menghembus, menghi-langkan serat dan tangkai, dan memotong (bila perlu).
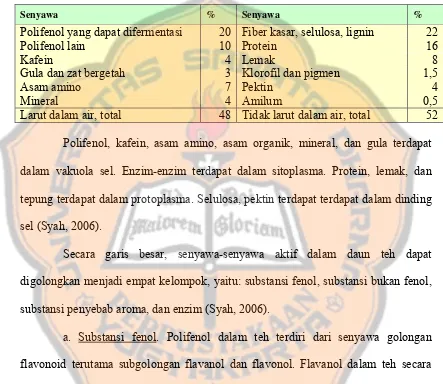
Tabel III. Proses pengolahan teh hitam (Hartoyo, 2003; Werkhoven, 1988; Syah, 2006)
Tahap
pengolahan Tujuan Pelaksanaan
Pelayuan Mengurangi kadar air daun sehingga mudah digulung dan dihancurkan.
Daun segar dialiri udara hangat (≤ 30°C) dan kelembaban moderat (RH 60%) selama 18-20 jam.
Penggulungan Memperkecil ukuran partikel daun dan menciptakan kondisi fisik terbaik untuk mempertemukan polifenol dengan enzim polifenol oksidase.
Pucuk layu digulung bertahap dengan mesin ortodhox roller (Primary rolling selama 40 menit, rotavane selama 2 menit, dan secondary rolling selama 15 menit).
Fermentasi Mempertemukan polifenol dengan enzim polifenol oksidase.
Meletakkan pucuk tergulung pada baki selama 30 menit dengan suhu ruangan 26-28°C dan kelembaban 85-95%.
Pengeringan Menghentikan aktivitas enzim dan memperpanjang umur simpan.
Pengeringan secara sinambung dengan suhu 90-100°(inlet) selama 25-30 menit.
Sortasi Memisahkan partikel bukan teh, menyeragamkan ukuran dan bentuk partikel, dan menggolong-golongkan dalam grade teh.
2. Kandungan kimia dalam teh
Daun teh memiliki banyak senyawa kimia yang merupakan zat bioaktif.
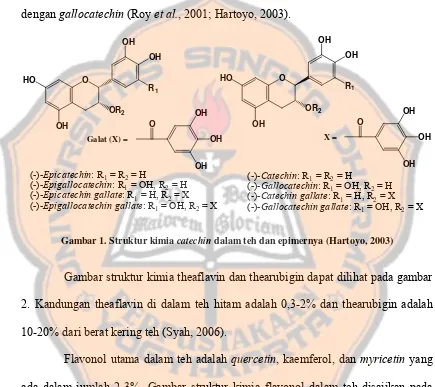
Gambaran mengenai komposisi pucuk daun teh segar disajikan pada tabel IV.
Tabel IV. Komposisi dari daun teh segar (Werkhoven, 1988)
Senyawa % Senyawa %
Polifenol yang dapat difermentasi 20 Fiber kasar, selulosa, lignin 22
Polifenol lain 10 Protein 16
Kafein 4 Lemak 8
Gula dan zat bergetah 3 Klorofil dan pigmen 1,5
Asam amino 7 Pektin 4
Mineral 4 Amilum 0,5
Larut dalam air, total 48 Tidak larut dalam air, total 52
Polifenol, kafein, asam amino, asam organik, mineral, dan gula terdapat
dalam vakuola sel. Enzim-enzim terdapat dalam sitoplasma. Protein, lemak, dan
tepung terdapat dalam protoplasma. Selulosa, pektin terdapat terdapat dalam dinding
sel (Syah, 2006).
Secara garis besar, senyawa-senyawa aktif dalam daun teh dapat
digolongkan menjadi empat kelompok, yaitu: substansi fenol, substansi bukan fenol,
substansi penyebab aroma, dan enzim (Syah, 2006).
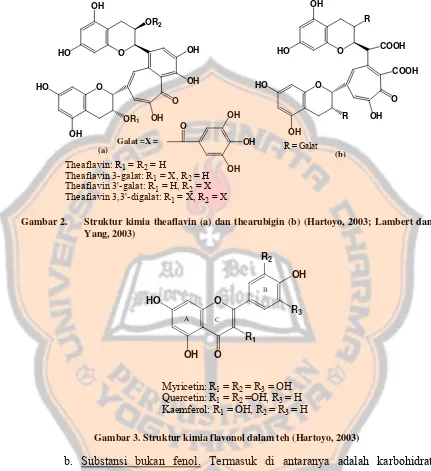
a. Substansi fenol. Polifenol dalam teh terdiri dari senyawa golongan
flavonoid terutama subgolongan flavanol dan flavonol. Flavanol dalam teh secara
struktural termasuk subgolongan flavan-3-ol. Catechin utama dalam teh terdiri dari
(-)-Epicatechin, (-)-Epigallocatechin, (-)-Epicatechin 3-gallate, (-)-Epigallocatechin
3-gallate (Hartoyo, 2003; Syah, 2006). Kandungan catechin dalam produk teh hijau
adalah 16-30% berat kering teh (Syah, 2006). Gambar struktur kimia senyawa
14
Dalam proses pengolahan teh hitam, catechin dioksidasi oleh enzim
polifenol oksidase menjadi theaflavin dan thearubigin. Secara garis besar, theaflavin
terdiri dari theaflavin, theaflavin 3-galat, theaflavin 3´galat, theaflavin 3,3´ digalat,
yang terbentuk karena adanya reaksi yang terjadi antara quinon (turunan catechin)
dengan gallocatechin (Roy et al., 2001; Hartoyo, 2003).
OH
Gambar 1. Struktur kimia catechin dalam teh dan epimernya (Hartoyo, 2003)
Gambar struktur kimia theaflavin dan thearubigin dapat dilihat pada gambar
2. Kandungan theaflavin di dalam teh hitam adalah 0,3-2% dan thearubigin adalah
10-20% dari berat kering teh (Syah, 2006).
Flavonol utama dalam teh adalah quercetin, kaemferol, dan myricetin yang
ada dalam jumlah 2-3%. Gambar struktur kimia flavonol dalam teh disajikan pada
gambar 3. Flavonol ini, terutama terdapat dalam bentuk glikosidanya dan sedikit
dalam bentuk aglikonnya (Hartoyo, 2003). Flavonol merupakan salah satu
antioksidan alami yang terdapat dalam tanaman dan mempunyai kemampuan
mengikat logam. Aktivitas antioksidan flavonol bertambah besar seiring dengan
HO O
Gambar 2. Struktur kimia theaflavin (a) dan thearubigin (b) (Hartoyo, 2003; Lambert dan Yang, 2003)
Gambar 3. Struktur kimia flavonol dalam teh (Hartoyo, 2003)
b. Substansi bukan fenol. Termasuk di antaranya adalah karbohidrat
(sukrosa, glukosa, dan fruktosa), pektin, alkaloid (kafein), klorofil, dan zat warna
yang lain, protein dan asam amino, asam organik, substansi resin, vitamin (C, K, A,
B1, dan B2), mineral (Mg, K, F, Na, Ca, Zn, Mn, Cu, dan Se). Selama proses
pengolahan teh, vitamin C mengalami oksidasi sehingga jumlahnya menjadi semakin
16
c. Substansi penyebab aroma. Munculnya aroma pada teh hitam langsung
atau tidak langsung selalu dihubungkan dengan terjadinya oksidasi senyawa
catechin. Substansi penyebab aroma teh digolongkan menjadi empat yaitu fraksi
karboksilat, fenolat, karbonil, dan fraksi netral bebas karbonil. Ada pendapat lain
yang menyatakan bahwa aroma teh berasal dari penguraian protein, oksidasi
karotenoid menjadi senyawa yang mudah menguap atau karena adanya minyak
essensial dalam teh (Syah, 2006).
d. Kandungan enzim. Enzim yang terkandung dalam daun teh adalah
invertase, amilase, β-glukosidase, oksimetilase, protease, dan peroksidase. Enzim
lain yang tidak penting dalam proses kehidupan tanaman namun penting dalam
proses pengolahan teh adalah polifenol oksidase (Syah, 2006).
3. Manfaat teh
Teh mempunyai banyak manfaat pada kesehatan, diantaranya antioksidan,
menghambat oksidasi LDL (Low Density Lipoprotein), mereduksi kolesterol,
antitrombosis, antimikroba, antivirus, memberikan perlindungan terhadap kanker,
menurunkan tekanan darah, mengurangi kadar gula darah, mempertahankan berat
tubuh ideal, dan mengurangi stress (Hartoyo, 2003).
4. Reaksi radikal hidroksil dengan polifenol dalam teh
Potensi teh sebagai antioksidan disebabkan oleh adanya senyawa polifenol
yang merupakan senyawa flavonoid subgolongan flavan-3-ol dan flavonol. Senyawa
terdapat dalam strukturnya. Reaksi antara gugus tersebut dengan radikal bebas akan
membentuk radikal baru yang distabilisasi oleh efek resonansi inti aromatik
(Cuvelier et al., 1994). Tabel berikut menyajikan karakteristik dari struktur flavonoid
yang turut menentukan aktivitas flavonoid sebagai penangkap radikal bebas yang
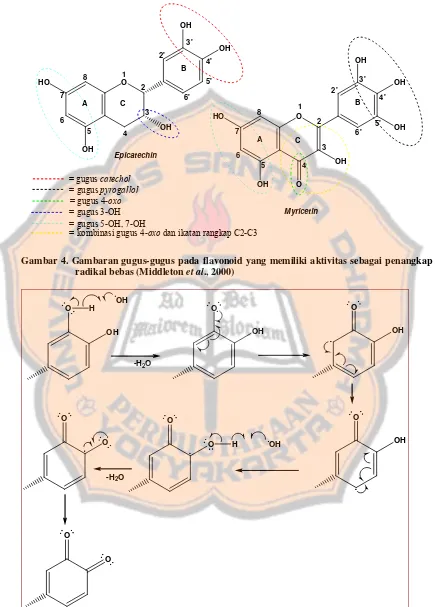
efektif (Middleton et al., 2000). Gambaran gugus-gugus yang tercantum pada tabel V
disajikan pada gambar 4. Menurut Amić et al. (2003), setelah melakukan analisis
hubungan struktur-aktivitas penangkapan radikal, diindikasikan bahwa flavonoid
yang memiliki gugus catechol pada cincin B dan atau gugus hidroksi pada C3
memiliki aktivitas penangkapan radikal yang tinggi. Mekanisme reaksi flavonoid
dalam teh dengan suatu radikal bebas, misalnya radikal hidroksil, ditunjukkan pada
gambar 5.
Tabel V. Karakteristik struktur flavonoid untuk aktivitas penangkapan radikal yang efektif (Middleton et al., 2000)
• Gugus catechol (O-dihidroksi) pada cincin B, memberikan kemampuan penangkapan yang besar.
• Gugus pyrogallol (Trihidroksi) pada cincin B, memberikan aktivitas yang lebih tinggi lagi, seperti pada myricetin. Ikatan rangkap C2-C3 pada cincin C memperlihatkan peningkatan aktivitas penangkapan karena memberikan stabilitas pada radikal fenoksi yang dihasilkan.
• 4-oxo (gugus keton pada posisi 4 di cincin C), bila berhubungan dengan ikatan rangkap pada C2-C3 maka aktivitas penangkapan akan meningkat dengan cara delokalisasi elektron dari cincin B.
• Gugus 3-OH pada cincin C menghasilkan penangkapan yang sangat besar. Kombinasi ikatan rangkap pada C2-C3 dan 4-oxo memperlihatkan kombinasi terbaik di atas gugus catechol.
18
= gugus catechol
= gugus pyrogallol
= gugus 4-oxo
= gugus 3-OH = gugus 5-OH, 7-OH
= kombinasi gugus 4-oxo dan ikatan rangkap C2-C3
Gambar 4. Gambaran gugus-gugus pada flavonoid yang memiliki aktivitas sebagai penangkap radikal bebas (Middleton et al., 2000)
O
D. Metode Deteksi Radikal Hidroksil
Metode dan prinsip deteksi radikal hidroksil dapat dilihat pada tabel VI.
Tabel VI. Metode dan prinsip deteksi radikal hidroksil (Bors et al., 1979; Halliwell and Gutteridge, 1999)
Metode Prinsip Metode
Pemucatan
p-nitrosodimetilanilin (p-NDA)
p-nitrosodimetilanilin bereaksi cepat dengan radikal hidroksil tetapi tidak bereaksi dengan O2˙¯ atau singlet O2. Reaksi ini akan diikuti pemucatan warna kuning.
Metode deoksiribosa Reaksi antara radikal hidroksil dengan deoksiribosa menghasilkan MDA, lalu dipanaskan dengan asam tiobarbiturat pada pH rendah, akan menghasilkan warna merah muda.
Metode triptofan Reaksi antara radikal hidroksil dengan triptofan akan menghasilkan satu set produk yang khas.
Metode dimetilsulfoksida (DMSO)
Radikal hidroksil bereaksi dengan dimetilsulfoksida (DMSO) menghasilkan antara lain gas metana yang dideteksi dengan
Gas Liquid Chromatography atau formaldehid yang dideteksi secara kolorimetri.
E. Metode Deoksiribosa
Deoksiribosa (2-deoksi-D-ribosa) merupakan gula yang mempunyai lima
atom karbon yang merupakan turunan dari suatu gula pentosa yaitu ribosa. Gula ini
merupakan bagian dari DNA. Gambar struktur deoksiribosa disajikan pada gambar 6.
20
Beberapa produk degradasi deoksiribosa, saat dipanaskan pada pH rendah
terdekomposisi menjadi malondialdehid (MDA), yang dapat dideteksi dengan
penambahan asam tiobarbiturat (TBA) menghasilkan kromogen MDA-TBA yang
berwarna merah muda. Pembentukan MDA dari deoksiribosa menjadi dasar uji
penangkapan radikal hidroksil (uji deoksiribosa) (Halliwell dan Gutteridge, 1999).
Proses degradasi deoksiribosa oleh radikal hidroksil terjadi melalui
beberapa tahap. Tahap-tahap ini terjadi pada saat campuran reaksi yang terdiri dari
reagen Fenton (FeCl3, EDTA, H2O2, vitamin C) dan deoksiribosa diinkubasi pada
suhu 37ºC selama 30 menit. Tahap-tahap reaksi tersebut adalah reaksi pembentukan
radikal hidroksil dari reaksi Fenton dan degradasi deoksiribosa oleh radikal hidroksil
(Halliwell dan Gutteridge, 1999).
Tahap I. Reaksi pembentukan radikal hidroksil. Radikal hidroksil dihasilkan
melalui reaksi Fenton. Dalam reaksi Fenton, vitamin C berfungsi sebagai reduktor
yang mempercepat proses reduksi Fe3+ menjadi Fe2+. Semakin cepat Fe3+ direduksi
menjadi Fe2+ maka semakin cepat pembentukan radikal hidroksil karena Fe2+ akan
bereaksi dengan H2O2 dan menghasilkan radikal hidroksil (•OH). Penambahan suatu
ligan (EDTA) pada besi dapat meningkatkan konstante kecepatan reaksi antara Fe2+
dengan H2O2. Reaksinya adalah sebagai berikut :
Fe3+EDTA + Asam Askorbat Fe2+EDTA + Asam Dehidro Askorbat
Fe2+EDTA + H2O2 Fe3+EDTA + -OH + •OH
Tahap II. Degradasi deoksiribosa. Radikal hidroksil akan menyerang
deoksiribosa dan mendegradasinya menjadi fragmen-fragmen. Semua posisi pada
membentuk radikal deoksiribosa melalui reaksi abstraksi hidrogen (gambar 7) yang
dengan adanya O2 akan diubah secara cepat menjadi radikal gula peroksil (gambar
8). Selanjutnya terjadi serangkaian reaksi yaitu disproporsionasi, penataan ulang,
eliminasi air, dan pemecahan ikatan C–C menghasilkan produk karbonil yag
bervariasi. Konstante kecepatan reaksi orde dua dari reaksi antara radikal hidroksil
dengan gula deoksiribosa pada pH 7,4 adalah 3,1 x 109 M-1s-1 (Halliwell dan
Gutteridge, 1999). Beberapa produk degradasi deoksiribosa, saat dipanaskan pada
pH rendah akan terdekomposisi menjadi MDA (gambar 9) (Halliwell dan Gutteridge,
1999).
Gambar 7. Reaksi penyerangan radikal hidroksil pada deoksiribosa (Halliwell dan Gutteridge, 1999)
22
O O
H H
Gambar 9. Struktur MDA
F. Penyarian
Penyarian adalah kegiatan penarikan zat yang dapat larut dari bahan yang
tidak dapat larut dengan pelarut cair. Secara umum, cara penyarian dapat dibedakan
menjadi infundasi, maserasi, perkolasi, dan penyarian berkesinambungan. Sebagai
cairan penyari digunakan air, eter, atau campuran etanol air. Penyarian dengan
campuran etanol dan air dilakukan dengan cara maserasi atau perkolasi (Anonim,
1986).
1. Cara penyarian
a. Infundasi. Cara infundasi adalah proses penyarian yang umumnya
digunakan untuk menyari zat kandungan aktif yang larut dalam air dari bahan-bahan
nabati. Sari yang dihasilkan tidak stabil dan mudah dicemari oleh kuman dan kapang.
Oleh sebab itu sari yang diperoleh dengan cara ini tidak boleh disimpan lebih dari 24
jam. Infundasi dibuat dengan cara menyari simplisia dengan air pada suhu 90°C
selama 15 menit (Anonim, 1986)
b. Maserasi. Cara maserasi merupakan cara penyarian yang sederhana.
Maserasi dilakukan dengan cara merendam serbuk simplisia dalam cairan penyari
sehingga cairan penyari akan menembus dinding sel dan masuk ke dalam rongga sel
yang mengandung zat aktif. Adanya perbedaan konsentrasi antara larutan zat aktif di
dalam sel ke luar sel. Peristiwa tersebut berulang sehingga terjadi keseimbangan
konsentrasi antara larutan di luar sel dan di dalam sel (Anonim, 1986).
Maserasi dapat dilakukan modifikasi misalnya dengan teknik remaserasi.
Pada teknik ini, cairan dibagi menjadi 2 kemudian seluruh serbuk simplisia
dimaserasi dengan cairan penyari pertama, sesudah dienaptuangkan dan diperas,
ampas dimaserasi lagi dengan cairan penyari kedua (Anonim, 1986).
c. Perkolasi. Cara perkolasi adalah cara penyarian yang dilakukan dengan
mengalirkan cairan penyari melalui serbuk simplisia yang telah dibasahi. Cairan
penyari akan dialirkan dari atas ke bawah melalui serbuk kemudian cairan akan
melarutkan zat aktif di dalam sel yang dilalui sampai mencapai keadaan jenuh.
Serbuk simplisia yang akan diperkolasi dibasahi terlebih dahulu dengan cairan
penyari kemudian dimasukkan sedikit demi sedikit ke dalam alat perkolasi
(perkolator) sambil tiap kali ditekan. Serbuk kemudian ditutup dengan kertas saring
dan cairan penyari dialirkan hingga di atas permukaan massa masih terdapat lapisan
cairan penyari. Setelah 24 jam, keran dibuka dan diatur hingga kecepatan penetesan
adalah 1 ml per menit. Akhir proses perkolasi ditentukan dengan pemeriksaan zat
secara kualitatif pada perkolat terakhir.
d. Penyarian berkesinambungan. Proses ini merupakan gabungan antara
proses untuk menghasilkan ekstrak cair dan proses penguapan. Alat yang digunakan
misalnya Soxhlet. Pada penyarian ini, cairan penyari dipanaskan hingga mendidih,
kemudian uap penyari akan naik ke atas kemudian akan mengembun karena
didinginkan oleh pendingin balik. Embun akan turun melalui serbuk simplisia sambil
24
Pemilihan cara penyarian disesuaikan dengan zat aktif yang akan disari,
misalnya dari segi ketahanan zat aktif terhadap adanya proses pemanasan. Selain itu,
bentuk, nilai terapeutik, dan nilai ekonomis juga perlu diperhitungkan. Salah satu
contoh pemilihan cara penyarian dapat dilihat pada tabel VII.
Tabel VII. Pemilihan cara penyarian
No Perihal Perkolasi Maserasi
1 Simplisia keras +
2 Simplisia lunak dan parenkimatik +
3 Sulit diserbuk seperti asam +
4 Bahan tidak kompak seperti Benzoin +
5 Nilai terapeutik besar, misal kina +
6 Nilai terapeutik kurang, misal aroma +
7 Harga mahal +
8 Harga murah +
2. Cairan penyari
Pemilihan cairan penyari harus mempertimbangkan banyak faktor. Cairan
penyari yang baik harus memenuhi kriteria yaitu murah dan mudah didapat, stabil
secara fisika dan kimia, netral, tidak mudah menguap atau terbakar, selektif, tidak
mempengaruhi zat berkhasiat, dan diperbolehkan oleh peraturan (Anonim, 1986).
Farmakope Indonesia Edisi III menetapkan bahwa sebagai cairan penyari
adalah air, eter, atau campuran etanol air. Etanol dapat melarutkan alkaloid basa,
minyak menguap, glikosida, kurkumin, kumarin, antrakinon, flavonoid, steroid,
damar, dan klorofil. Lemak, malam, tanin, dan saponin hanya sedikit larut di dalam
etanol. Campuran etanol dan air dapat digunakan untuk meningkatkan penyarian
G. Spektrofotometri UV-Vis
Teknik spektroskopik adalah salah satu teknik fisiko-kimia yang mengamati
tentang interaksi atom atau molekul dengan radiasi elektromagnetik. Tiga hal yang
mungkin terjadi sebagai akibat interaksi atom molekul dengan radiasi
elektromagnetik adalah hamburan (scattering), absorpsi (absorption) dan emisi
(emission) (Mulja dan Suharman, 1995).
Spektrofotometri UV-Vis merupakan anggota teknik analisis spektroskopik
yang dihasilkan dari absorpsi radiasi elektromagnetik oleh atom atau molekul
memakai sumber radiasi elektromagnetik ultra violet dekat (190-380 nm) dan sinar
tampak (380-780 nm) dengan menggunakan instrumen spektrofotometer (Mulja dan
Suharman, 1995).
Ada empat macam transisi elektron di dalam suatu molekul. (1) Elektron
yang tidak berada dalam ikatan. Energi eksitasi elektron ini sangat tinggi dan tidak
memiliki kontribusi pada absorbsi di daerah visibel maupun UV. (2) Elektron pada
ikatan kovalen tunggal (elektron sigma, σ). Energi eksitasi elektron ini juga terlalu
tinggi sehingga tidak memberikan kontribusi pada absorpsi di daerah visibel atau UV
(contohnya pada ikatan kovalen hidrokarbon jenuh). (3) Pasangan elektron bebas
pada kulit terluar (elektron n), contohnya pada N, O, S, dan halogen. Elektron ini
cenderung diikat kurang kuat dibandingkan elekton sigma dan dapat tereksitasi oleh
radiasi visibel atau UV. (4) Elektron pada orbital π (pi), contohnya pada ikatan
rangkap dua atau tiga. Elektron ini paling mudah tereksitasi dan bertanggung jawab
26
Efek absorpsi radiasi pada molekul menghasilkan transisi elektron ke
tingkat yang lebih tinggi yang dikenal sebagai orbital antibonding. Transisi yang
paling umum adalah transisi dari π atau n menuju π* (Christian, 2004). Eksitasi
elektron σ→σ* yang diberikan oleh ikatan tunggal, sebagai contoh pada alkana,
membutuhkan energi yang paling besar. Eksitasi elektron π → π* diberikan oleh
ikatan rangkap dua dan tiga (alkena dan alkuna). Pada gugus karbonil (dimetil keton
dan asetaldehid) terjadi eksitasi elektron n →σ* dan eksitasi elektron n →π* yang
terjadi pada λ = 280-290 nm tetapi eksitasinya terlarang karena memberikan nilai
ε
=12-16 cm-1mol-1L(Mulja dan Suharman, 1995).Senyawa organik pada umumnya dan semua gugus atau gugusan atom yang
mengabsorpsi radiasi UV-Vis disebut sebagai gugus kromofor (Mulja dan Suharman,
1995). Gugus kromofor terdiri dari gugus tak jenuh yang menjalani transisi π → π*
dan n →π*. Contoh beberapa kromofor adalah sebagai berikut :
C C C C
N N NO2 C
O
(Fessenden danFessenden, 1986).
Pada gugus organik dikenal pula gugus auksokrom, yaitu gugus fungsionil
yang mempunyai elektron bebas seperti –OH, -NH2, dan OCH3 yang memberikan
transisi (n→σ*). Terikatnya gugus auksokrom oleh gugus kromofor akan
mengakibatkan pergeseran pita absorpsi menuju ke panjang gelombang yang lebih
C
H CH CH CH
hiperkromik). Pergeseran batokromik juga terjadi pada dua ikatan rangkap yang
terkonjugasi butadien ( )(Mulja dan Suharman, 1995).
Kuantitas energi yang diserap oleh suatu senyawa berbanding terbalik dengan
panjang gelombang radiasi:
∆E = hv = λ
hc
dengan ∆E = energi yang diabsorpsi (erg); h = tetapan Planck (6,6 x 10 -27) erg-det; v
= frekuensi (Hz); c = kecepatan cahaya (3 x 1010 cm/det); λ = panjang gelombang
(cm) (Fessenden dan Fessenden, 1986).
Analisis dengan spektrofotometer UV-Vis melibatkan pembacaan absorban
radiasi elektromagnetik oleh molekul atau radiasi elektromagnetik yang diteruskan.
Keduanya dikenal sebagai absorban (A) tanpa satuan dan transmitan dengan satuan
persen. Hubungan antara intensitas radiasi elektromagnetik yang diserap oleh sistem
(Io) dengan intensitas radiasi yang ditransmisikan (It) dapat dijelaskan dengan hukum
Lambert-Beer yang menyatakan hubungan antara transmitan dan absorbansi terhadap
intensitas radiasi atau konsentrasi zat yang dianalisis dan tebal larutan yang
mengabsorbsi.
Hubungan tersebut dapat dirumuskan sebagai berikut :
28
dimana T = persen transmitan; Io = intensitas radiasi yang datang; It = intensitas
radiasi yang diteruskan; ε = serapan molar (L.mol-1.cm-1); c = konsentrasi (mol.L-1);
b = tebal larutan (cm); A = absorban (Mulja dan Suharman, 1995).
Komponen-komponen pokok spektrofotometer meliputi sumber (1) tenaga
radiasi yang stabil, (2) sistem yang terdiri atas lensa-lensa, cermin, dan celah-celah,
(3) monokromator untuk mengubah radiasi menjadi komponen-komponen panjang
gelombang tunggal, (4) tempat cuplikan yang transparan, dan (5) detektor radiasi
yang dihubungkan dengan sistem meter atau pencatat (Sastrohamidjojo, 2001).
Kolorimetri adalah suatu teknik pengukuran cahaya yang diabsorpsi oleh
suatu zat yang berwarna, baik warna yang terbentuk dari asalnya (senyawa tersebut
memang berwarna) maupun warna yang dibentuk dari hasil reaksi dengan zat lain
(Khopkar, 1990). Perubahan warna yang dibentuk dari hasil reaksi dengan zat lain
dapat terjadi karena zat tersebut mengalami perpanjangan gugus kromofor oleh
penambahan zat lain yang sebelumnya juga tidak berwarna dalam suatu larutan atau
karena pembentukan suatu komplek yang berwarna. Pengukuran serapan larutan
berwarna tersebut dilakukan pada panjang gelombang daerah sinar tampak (380-780
nm) (Mulja dan Suharman, 1995).
Warna dapat dihasilkan oleh proses absorbsi cahaya dengan panjang
gelombang tertentu oleh suatu zat. Senyawa organik dengan konjugasi yang ekstensif
menyerap cahaya dengan panjang gelombang tertentu, karena adanya transisi π→π*
dan n →π*. Apa yang tampak bukanlah warna yang diserap melainkan
Tabel VIII. Spektrum warna pada daerah visibel (Skoog et al., 1994)
Rentang
Panjang Gelombang (nm)
Warna yang diabsorbsi
Warna Komplementer (warna yang terlihat)
400– 435 Ungu Kuning-Hijau
435 – 480 Biru Kuning
Pada kolorimetri yang ditentukan kadarnya adalah serapan cahaya pada
larutan berwarna. Oleh karena itu, diperlukan suatu larutan dengan kadar tertentu
yang diketahui dengan konsentrasi yang menaik dan membandingkan warnanya
dengan senyawa yang hendak dianalisis. Pada warna yang sama, maka
konsentrasinya adalah sama (Rooth dan Baschke, 1994).
Konjugasi beberapa gugus kromofor dengan gugus kromofor lain yang sama
akan menyebabkan spektrum absorpsi senyawa hasil konjugasi tersebut sangat
berbeda dengan spektrum absorpsi masing-masing gugus tunggalnya. Dari hasil
konjugasi ini diperoleh kromofor baru. Energi yang dibutuhkan elektron untuk
eksitasi menjadi berkurang dan absorpsi cahaya bergeser ke daerah panjang
gelombang panjang. Jika jumlah gugus terkonjugasi cukup banyak, maka senyawa
akan menjadi berwarna dan mengabsorpsi dalam daerah sinar tampak (Rooth dan
Baschke, 1994).
Beberapa kriteria yang harus dipenuhi dalam analisis secara kolorimetri
adalah selektif, sensitif, ada kesebandingan antara warna dengan konsentrasi, warna
30
H. Landasan Teori
Radikal hidroksil merupakan contoh radikal bebas yang sangat reaktif dan
dapat berlaku sebagai toksikan primer dan sebagai sumber toksikan sekunder.
Radikal hidroksil dapat memecah rantai DNA dan berperan dalam karsinogenik,
mutagenik serta sitotoksik. Reaksi radikal hidroksil dengan DNA mengakibatkan
kerusakan penting dalam sel, mengingat kerusakan rantai DNA tidak dapat dengan
mudah diperbaiki oleh sel.
Dalam tubuh, radikal hidroksil sangat cepat ditangkap oleh sistem
pertahanan antioksidan yaitu melalui kerja enzim-enzim antioksidan. Saat
peningkatan pembentukan ROS tidak dapat ditanggulangi oleh sistem pertahanan
antioksidan, tercetus situasi yang disebut stress oksidatif. Pada kondisi ini,
diperlukan tambahan antioksidan eksogen. Salah satu antioksidan eksogen alami
adalah senyawa polifenol yang terdapat di dalam teh.
Senyawa polifenol dalam teh merupakan senyawa golongan flavonoid yaitu
golongan flavan-3-ol dan flavonol. Teh hijau maupun teh hitam sama-sama
mengandung flavonoid namun jumlahnya saja yang berbeda. Perbedaan ini
dikarenakan proses oksidasi enzimatik pada polifenol selama pembuatan teh hitam.
Senyawa flavonoid dapat larut dalam cairan penyari yaitu etanol karena senyawa
flavonoid memiliki banyak gugus hidroksi sehingga cenderung bersifat polar. Oleh
karena itu, dapat diindikasikan bahwa di dalam ekstrak etanol teh hijau maupun teh
hitam terdapat senyawa flavonoid. Adanya gugus hidroksi fenolik di dalam struktur
yang reaktif membentuk radikal bebas baru atau senyawa non radikal yang tidak
reaktif dan relatif stabil.
Metode yang digunakan untuk mengetahui aktivitas penangkapan radikal
hidroksil oleh ekstrak etanol teh hijau dan teh hitam adalah metode deoksiribosa.
Metode ini menggunakan spektrofotometri visibel untuk mengukur produk degradasi
deoksiribosa oleh radikal hidroksil yang dihasilkan oleh reagen Fenton. Produk
degradasi deoksiribosa yaitu MDA, yang dalam suasana asam akan bereaksi dengan
TBA membentuk kromogen berwarna merah muda (kromogen MDA-TBA) yang
menyerap maksimum pada 532 nm (Kunchandy dan Rao, 1990). Adanya senyawa
penangkap radikal hidroksil di dalam ekstrak etanol teh hijau dan teh hitam akan
menurunkan jumlah MDA sehingga jumlah kromogen MDA-TBA akan berkurang
yang ditunjukkan dengan penurunan absorbansi larutan sampel dibandingkan dengan
larutan kontrol. Aktivitas penangkapan radikal hidroksil oleh ekstrak teh hijau dan
teh hitam dinyatakan dengan % scavenging dan nilainya dalam effective scavenging
(ES).
I. Hipotesis
Ekstrak etanol teh hijau dan teh hitam memiliki aktivitas sebagai penangkap
radikal hidroksil dengan metode deoksiribosa yang dinyatakan dalam % scavenging
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian eksperimental karena ada
subjek uji yang dikenakan manipulasi perlakuan.
B. Variabel-variabel Penelitian Variabel–variabel yang digunakan dalam penelitian ini meliputi :
1. Variabel bebas
Dalam penelitian ini variabel bebasnya adalah konsentrasi ekstrak etanol
dan jenis teh (teh hijau dan teh hitam).
2. Variabel tergantung
Dalam penelitian ini variabel tergantungnya adalah persen scavenging
dan ES50.
3. Variabel pengacau
(a) Variabel pengacau terkendali
Variabel pengacau terkendali dalam penelitian ini adalah merk teh hijau
dan teh hitam, bahan-bahan kimia dan alat-alat yang digunakan selama penelitian,
waktu dan lama penyarian, volume cairan penyari yang digunakan, suhu dan
waktu inkubasi larutan uji aktivitas penangkapan radikal hidroksil.
(b) Variabel pengacau tidak terkendali
Jenis dan varietas teh, kondisi (iklim, media tanam, ketinggian) tempat
penanaman teh.
C. Definisi Operasional
1. Ekstrak etanol teh hijau dan teh hitam yang dianalisis dihasilkan melalui
proses remaserasi dengan etanol 70% pada teh hijau dan teh hitam merk X.
2. Persen scavenging adalah persen yang menyatakan kemampuan suatu
senyawa dalam menangkap radikal hidroksil.
% Scavenging =
kontrol larutan
sampel larutan kontrol
larutan
Absorbansi
Absorbansi
-Absorbansi
x 100 %
3. Larutan kontrol merupakan larutan yang terdiri dari reagen Fenton, larutan
deoksiribosa, bufer fosfat, asam trikloroasetat, dan asam tiobarbiturat.
4. Larutan sampel merupakan larutan kontrol yang telah diberi ekstrak etanol teh
hijau atau teh hitam.
5. Effective Scavenging 50 (ES50) menyatakan besarnya konsentrasi sampel yang
menghasilkan penangkapan efektif radikal hidroksil sebesar 50%.
D. Bahan-Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian adalah teh hijau dan teh
hitam (Merk X). Bahan-bahan kualitas p.a.(E.Merck) : dinatrium hidrogen fosfat
34
trikloroasetat (TCA), ferri klorida heksahidrat (FeCl3.6H2O),
Etilendiamintetraasetat garam dinatrium dihidrat (C10H14N2Na2O8.2H2O),
hidrogen peroksida (larutan 30% H2O2), L (+) asam askorbat (Vitamin C).
Bahan-bahan kualitas p.a. (Sigma, USA) : 2-deoksi-D-ribosa. Bahan-Bahan-bahan kualitas
farmasetis (Brataco) : etanol.. Bahan lain : akuades (Laboratorium Kimia Organik
Universitas Sanata Dharma).
E. Alat-Alat Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah Spektrofotometer
UV-Vis (Perkin Elmer Lamda 20), pH-meter (Metrohm 632), vacuum rotary
evaporator (Buchi rotavapor), waterbath (Labo-Tech; Heraeus), vortex (Janke &
Kunkel), neraca elektrik (Scaltec SBC 22), mikropipet 10-100µL dan 100-1000µL
(Acura 825), mikropipet 0,5-5,0 ml (Socorex), tabung reaksi bertutup
(Schott-Germany), dan seperangkat alat gelas yang lazim digunakan di laboratorium
analisis.
F. Tata Cara Penelitian 1. Pemilihan sampel
Sampel yang digunakan berupa teh hijau dan teh hitam yang sudah
dikemas dan dipasarkan dengan merk X. Sampel diambil sebanyak 80 bungkus
untuk tiap jenis teh dari 100 bungkus yang ada. Pengambilan 80 bungkus sampel
dilakukan dengan teknik random sampling menggunakan tabel bilangan random
2. Pembuatan ekstrak etanol teh hijau dan teh hitam
Sebanyak 20 bungkus sampel dari tiap jenis teh, dihomogenkan
kemudian digiling dan dihaluskan dengan menggunakan blender. Serbuk diayak
menggunakan ayakan dengan derajat halus 4/18 (digunakan ayakan nomor mesh
12 sampai 50). Serbuk disimpan dalam botol coklat.
Serbuk sebanyak 300 g dimasukkan dalam bejana tertutup kemudian
direndam dengan cairan penyari yaitu etanol 70 % sebanyak 1 liter dan didiamkan
selama 24 jam. Cairan penyari kemudian dikeluarkan dan ditampung dalam
wadah bertutup. Ampas dimaserasi kembali selama 24 jam dengan 500 ml cairan
penyari. Cara ini diulang hingga didapatkan maserat yang jernih.
Maserat dikumpulkan dan disaring kemudian diuapkan pelarutnya
dengan bantuan vacuum rotary evaporator pada tekanan rendah hingga seluruh
etanol diperkirakan telah menguap. Ekstrak kental dikumpulkan dan diuapkan
kembali di atas waterbath dengan suhu 50°C hingga diperoleh ekstrak kering.
Ekstrak hasil pengeringan kemudian ditimbang dan disimpan dalam desikator.
3. Pembuatan bufer fosfat 20 mM
a. Pembuatan dinatrium hidrogen fosfat 20 mM
Timbang saksama 1,42 g Na2HPO4 dan larutkan dalam akuades hingga
500,0 ml.
b. Pembuatan kalium dihidrogen fosfat 20 mM
Timbang saksama 0,68 g KH2PO4 dan larutkan dalam akuades hingga
36
Bufer fosfat dibuat dengan bantuan pH meter. Larutan KH2PO4
ditambahkan secara bertetes-tetes pada larutan Na2HPO4 hingga tercapai pH 7,4.
4. Pembuatan reagen a. Larutan FeCl3 1 mM
Sebanyak lebih kurang 13,52 mg FeCl3.6H2O ditimbang saksama dan
dilarutkan dalam akuades hingga 10,0 ml. Dari larutan tersebut diambil sebanyak
2,0 ml, dimasukkan ke dalam labu ukur 10 ml kemudian diencerkan dengan
akuades hingga tanda.
b. Larutan EDTA 1 mM
Sebanyak lebih kurang 18,61 mg Na2EDTA.2H2O ditimbang saksama
dan dilarutkan dalam akuades hingga 10,0 ml. Dari larutan tersebut diambil
sebanyak 2,0 ml, dimasukkan ke dalam labu ukur 10 ml kemudian diencerkan
dengan akuades hingga tanda.
c. Larutan Vitamin C 1 mM
Sebanyak lebih kurang 17,61 mg vitamin C ditimbang saksama dan
dilarutkan dalam akuades hingga 10,0 ml. Dari larutan tersebut diambil sebanyak
1,0 ml, dimasukkan ke dalam labu ukur 10 ml kemudian diencerkan dengan
akuades hingga tanda. Larutan ini harus selalu dibuat baru.
d. Larutan H2O2 20 mM
Sebanyak 0,091 ml larutan H2O2 30 % dimasukkan ke dalam labu ukur
2,5 ml dan dimasukkan ke dalam labu ukur 10 ml kemudian diencerkan dengan
akuades hingga tanda.
e. Larutan TCA 5 %
Sebanyak 1,25 g TCA ditimbang saksama dan dilarutkan dalam akuades
hingga 25,0 ml.
f. Larutan TBA 1 %
Sebanyak 0,25 g TBA ditimbang saksama, dimasukkan ke dalam beaker
glass 100 ml, ditambah akuades secukupnya kemudian dipanaskan di atas hot
plate pada suhu 50-55°C hingga larut. Larutan dimasukkan ke dalam labu ukur
25,0 ml dan ditambah akuades hingga tanda.
5. Pembuatan larutan deoksiribosa 2,5 mM
Sebanyak lebih kurang 20,12 mg deoksiribosa ditimbang saksama dan
dilarutkan dalam akuades hingga 10,0 ml. Dari larutan tersebut diambil sebanyak
4,2 ml dan dimasukkan ke dalam labu ukur 25 ml kemudian diencerkan dengan
akuades hingga tanda.
6. Pembuatan larutan ekstrak etanol teh hijau dan teh hitam 1 mg/ml
Sebanyak lebih kurang 25 mg ekstrak etanol teh hijau atau hitam
38
7. Optimasi metode
a. Penentuan operating time (waktu operasional)
Pada tabung reaksi bertutup dimasukkan sebanyak 600 μl larutan
deoksiribosa 2,5 mM, 300 μl FeCl3 1 mM, 300 μl EDTA 1 mM, 300 μl H2O2 20
mM, 4500 μl bufer fosfat pH 7,4, dan 300 μl vitamin C 1 mM. Inkubasi pada suhu
37 ºC selama 30 menit. Setelah itu, larutan ditambah 1 ml TCA 5 % dan 1 ml
TBA 1 % kemudian dipanaskan dengan waterbath pada suhu 80ºC selama 30
menit. Tabung reaksi yang berisi campuran didinginkan di bawah air mengalir
selama 5 menit. Larutan dibaca absorbansinya pada panjang gelombang
maksimum teoritis 532 nm selama 1 jam.
b. Penentuan panjang gelombang serapan maksimum
Pada tabung reaksi bertutup dimasukkan sebanyak 600 μl larutan
deoksiribosa 2,5 mM, 300 μl FeCl3 1 mM, 300 μl EDTA 1 mM, 300 μl H2O2 20
mM, 4500 μl bufer fosfat pH 7,4, dan 300 μl vitamin C 1 mM. Inkubasi pada suhu
37 ºC selama 30 menit. Setelah itu, larutan ditambah 1 ml TCA 5 % dan 1 ml
TBA 1% kemudian dipanaskan dengan waterbath pada suhu 80ºC selama 30
menit. Tabung reaksi yang berisi campuran didinginkan di bawah air mengalir
selama 5 menit. Larutan dibaca absorbansinya dari panjang gelombang 400-600
8. Uji aktivitas penangkapan radikal hidroksil oleh ekstrak etanol teh hijau dan teh hitam
Pada tabung reaksi bertutup dimasukkan sebanyak 600 μl larutan
deoksiribosa 2,5 mM dan ekstrak etanol teh hijau atau teh hitam sebanyak 200;
400; 600; 800; dan 1000 μl, kemudian pada masing-masing tabung ditambahkan
300 μl FeCl3 1 mM, 300 μl EDTA 1 mM, 300 μl H2O2 20 mM, bufer fosfat pH
7,4 (penambahan bufer fosfat disesuaikan dengan volume ekstrak etanol yang
ditambahkan sehingga volume akhir larutan adalah 6 ml) dan 300 μl vitamin C 1
mM. Inkubasi pada suhu 37 ºC selama 30 menit. Setelah itu, larutan ditambah 1
ml TCA 5 % dan 1 ml TBA 1 %. kemudian dipanaskan dengan waterbath pada
suhu 80ºC selama 30 menit. Larutan kemudian didinginkan di bawah air mengalir
selama 5 menit. Larutan dibaca absorbansinya pada panjang gelombang
maksimum hasil optimasi. Buat larutan kontrol.
G. Analisis Hasil
Analisis hasil pada penelitian ini meliputi penentuan % scavenging yang
dihitung dari selisih antara absorbansi larutan kontrol dan absorbansi larutan
sampel dibagi absorbansi larutan kontrol dikalikan 100%.
% Scavenging =
Nilai aktivitas penangkapan radikal hidroksil sebesar 50% (ES50) diperoleh dari
persamaan regresi linier antara % scavenging dan konsentrasi ekstrak etanol teh
40
Persamaan regresi linier : y = bx + a
Perhitungan ES50 :
b a -50
ES50=
Keterangan:
BAB IV
HASIL DAN PEMBAHASAN
A. Pemilihan Sampel
Sampel yang digunakan berupa produk teh hijau dan teh hitam yang
sudah dikemas dan dipasarkan dengan merk X. Produk teh hijau atau teh hitam
yang dipilih merupakan produk yang berasal dari satu pabrik dengan nomor batch
yang sama dan tanggal kadaluarsa yang sama. Diasumsikan produk yang terpilih
memiliki kemiripan dalam hal jenis teh yang ditanam, lokasi dan iklim tempat
tumbuh, dan cara pengolahan teh sehingga dapat meminimalkan variasi hasil
penelitian.
Jumlah produksi pabrik yang memproduksi teh tersebut tidak diketahui
secara pasti. Oleh karena itu, ditetapkan jumlah populasi sampel penelitian yaitu
100 bungkus teh untuk masing-masing teh hijau dan teh hitam. Ukuran sampel
ditentukan dengan tabel Krejcie. Menurut tabel Krejcie, penentuan ukuran sampel
didasarkan atas kesalahan 5% sehingga jumlah sampel yang diambil memiliki
taraf kepercayaan 95% terhadap populasi. Dari tabel tersebut, bila jumlah populasi
100 maka jumlah sampel 80 (Sugiyono, 1998).
Pemilihan sampel didasarkan pada teknik sampling jenis teknik random
sampling menggunakan cara randomisasi dari tabel bilangan random (De Muth,
1999). Teknik ini memungkinkan semua individu dalam populasi baik secara
sendiri-sendiri atau bersama-sama memiliki kesempatan yang sama untuk dipilih
menjadi anggota sampel. Cara randomisasi dari tabel bilangan random memiliki