SKRIPSI
ELEKTRODA BERBASIS KARBON
NANOPORI/MOLECULARLY IMPRINTED POLYMER
SEBAGAI SENSOR POTENSIOMETRI
FRUKTOSA DALAM MADU
AYU TIRANNY MARTHA HERDININGTYAS
DEPARTEMEN KIMIA
FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS AIRLANGGA
ELEKTRODA BERBASIS KARBON NANOPORI/MOLECULARLY IMPRINTED POLYMER SEBAGAI SENSOR POTENSIOMETRI
FRUKTOSA DALAM MADU
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Bidang Kimia Pada Fakultas Sains dan Teknologi
Universitas Airlangga
Disetujui oleh: Pembimbing I,
Dr. Muji Harsini, M.Si NIP. 19640502 198903 2 002
Pembimbing II,
Dr. Ir. Suyanto, M.Si NIP. 19520217 198203 1 001
LEMBAR PENGESAHAN NASKAH SKRIPSI
Judul : ELEKTRODA BERBASIS KARBON NANOPORI/
MOLECULARLY IMPRINTED POLYMER SEBAGAI SENSOR POTENSIOMETRI FRUKTOSA DALAM MADU Penyusun : Ayu Tiranny Martha Herdiningtyas
NIM : 080810498
Tanggal Ujian : Selasa, 7 Agustus 2012
Disetujui oleh :
Pembimbing I,
Dr. Muji Harsini, M.Si NIP. 19640502 198903 2 002
Pembimbing II,
Dr. Ir. Suyanto, M.Si NIP. 19520217 198203 1 001
Mengetahui, Ketua Departemen Kimia
Fakultas Sains dan Teknologi Universitas Airlangga
Dr. Alfinda Novi Kristanti, DEA NIP. 19671115 199102 2 001
PEDOMAN PENGGUNAAN SKRIPSI
Skripsi ini tidak dipublikasikan, namun tersedia di perpustakaan dalam lingkungan Universitas Airlangga, diperkenankan untuk dipakai sebagai referensi kepustakaan, tetapi pengutipan harus seizin penyusun dan harus menyebutkan sumbernya sesuai kebiasaan ilmiah. Dokumen skripsi ini merupakan hak milik Universitas Airlangga.
KATA PENGANTAR
Segala syukur dan pujian kepada Allah SWT, atas limpahan karunia, nikmat, dan segala kemudahan sehingga selesailah skripsi yang berjudul
”Elektroda Berbasis Karbon Nanopori/Molecularly Imprinted Polymer sebagai Sensor Potensiometri Fruktosa dalam Madu”. Skripsi ini dibuat untuk
memenuhi persyaratan akademis pendidikan dalam bidang Kimia Fakultas Sains dan Teknologi Universitas Airlangga.
Terima kasih yang sebesar-besarnya penyusun sampaikan kepada pihak-pihak yang telah memberikan segenap bimbingan, petunjuk, dan motivasi, karena tanpanya, skripsi ini tidak akan pernah terwujud. Terima kasih penulis sampaikan kepada:
1. Dr. Muji Harsini, M.Si selaku dosen pembimbing I yang telah mencurahkan segenap perhatian, petunjuk, bimbingan, waktu dan tenaga dalam penyusunan skripsi ini
2. Dr. Ir. Suyanto, M.Siselaku dosen pembimbing II yang telah memberikan arahan dan ilmu dalam penyusunan skripsi ini
3. Dra. Aning Purwaningsih, M.Si selaku dosen wali, atas kesabaran, saran, dukungan, serta motivasi kepada penulis,
4. Dr. Alfinda Novi Kristanti, DEA. selaku ketua Departemen Kimia yang banyak memberikan kemudahan dalam pengumpulan naskah,
5. Prof. Ris. Dr. Gustan Pari, M.Si dari Pusat Penelitian dan Pengembangan Hasil Hutan, Bogor, atas bantuan penyediaan karbon nanopori, kawat perak dan sebagian bahan penelitian,
6. Rekan sepenelitian Aya, Asri, dan Pipit, atas kerjasama, kepedulian dan diskusi,
7. Mas Rohadi dan Pak Giman, untuk pinjaman alat dan saran-saran yang membantu skripsi ini,
8. Orangtua, keluarga dan teman-teman, untuk doa, dorongan semangat, dan penghiburan, serta
9. Semua pihak yang tentunya tidak dapat disebutkan satu per satu.
Penulis menyadari bahwa skripsi ini masih banyak kekurangan. Oleh karena itu demi kesempurnaan skripsi ini, kritik dan saran yang membangun dari pembaca sangat diharapkan.
Surabaya, Juli 2012
Herdiningtyas, Ayu Tiranny M., 2012, ELEKTRODA BERBASIS KARBON
NANOPORI/MOLECULARLY IMPRINTED POLYMER SEBAGAI
SENSOR POTENSIOMETRI FRUKTOSA DALAM MADU. Skripsi ini dibawah bimbingan Dr. Muji Harsini., M.Si dan Dr. Ir. Suyanto, M.Si, Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya
ABSTRAK
Telah dilakukan pembuatan dan karakterisasi elektroda selektif berbasis karbon nanopori/molecularly imprinted polymer (MIP) untuk analisis fruktosa dalam madu. Penelitian ini bertujuan mengetahui kondisi optimum dan kinerja elektroda selektif berbasis karbon nanopori/MIP untuk analisis fruktosa dalam madu dan kinerja elektroda selektif berbasis karbon nanopori/MIP. Pembuatan MIP dilakukan dengan mencampurkan 0,2 mmol (0,03603 gram) fruktosa sebagai
template, 0,8 mmol (0,0688 gram) asam metakrilat sebagai monomer, dan 2,4
mmol (0,4757 gram) etilen glikol dimetakrilat sebagai crosslinker serta 1 mmol (0,2422 gram) benzoil peroksida sebagai inisiator. Elektroda dibuat dengan mencampurkan karbon nanopori, MIP dan parafin dengan perbandingan berturut-turut 45:20:35. Dari penelitian diperoleh pH optimum larutan fruktosa sebesar 5,0-6,0, faktor Nernst sebesar 27,78 mV/dekade, jangkauan pengukuran sebesar 10-7M-10-1M. Konsentrasi terkecil fruktosa yang dapat diukur oleh elektroda sebesar 4,71 x 10-8 M. Koefisien selektivitas dari larutan glukosa dan sukrosa sebesar 2,48 x 10-5 dan 2,98 x 10-5 yang berarti adanya larutan tersebut tidak mengganggu pengukuran. Elektroda ini memiliki akurasi pengukuran sebesar 90,83% untuk konsentrasi 10-4M dan sebesar 102,35% untuk konsentrasi 10-2M, presisi dinyatakan dengan koefisien variasi sebesar 1,3267% untuk konsentrasi 10
-2
M dan 1,2920% untuk konsentrasi 10-4M serta diperoleh kadar fruktosa dalam madu sebesar 29,80% b/b.
Kata kunci : fruktosa, molecularly imprinted polymer, potensiometri, karbon nanopori
Herdiningtyas, Ayu Tiranny M., 2012, Electrode Based on Nanoporous Carbon/Molecularly Imprinted Polymer as Potentiometric Sensor of Fructose in Honey, This Bachelor Thesis is under guidance of Dr. Muji Harsini., M.Si and Dr. Ir. Suyanto, M.Si, Departement of Chemistry, Faculty of Science and Technology, Airlangga University, Surabaya
ABSTRACT
Selective electrode based on nanoporous carbon/molecularly imprinted polymer (MIP) has been synthesized and characterized to analyze fructose in honey. The purposes of the research are determining the optimum condition of electrodes based on nanoporous carbon/MIP and the performance of the electrode. Molecularly imprinted polymer (MIP) is synthesized by mixing 0,2 mmol (0,03603 gram) of fructose as template, 0,8 mmol (0,0688 gram) of methacrilic acid as monomer, 2,4 mmol (0,4757 gram) of ethylene glycol dimethacrylate as crosslinker and a mmol of benzoil peroxide as initiator. The electrode is made by mixing nanoporus carbon, MIP and paraffin at rasio 45:20:35. As the results, optimum pH of fructose solution is 5,0-6,0, Nersnt factor is 27,78 mV/decade, concentration range of the measurement is from 10-7M to 10-1M. Limit detection of the electrode is 4,71 x 10-8 M. Selectivity coefficient of glucose and sucrose solution are 2,48 x 10-5and 2,98 x 10-5 which means these solution do not interfere fructose measurement. Accuration of the electrode for 10-2M and 10-4M of fructose concentration are 102,35% and 90,83% respectively. Precision, which is expressed as coefficient of variation, valued 1,3267% and 1,2920% for 10-2M and 10-4M of fructose concentration. Analysis of fructose in honey solution is valued 29,80% w/w.
Key word : fructose, molecularly imprinted polymer, potentiometry, nanoporous carbon
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
LEMBAR PERNYATAAN ... ii
LEMBAR PENGESAHAN ... iii
LEMBAR PEDOMAN PENGGUNAAN SKRIPSI ... iv
KATA PENGANTAR ... v
ABSTRAK ... vii
ABSTRACT ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Rumusan Masalah ... 5
1.3 Tujuan Penelitian ... 5
1.4 Manfaat Penelitian ... 6
BAB II TINJAUAN PUSTAKA ... 7
2.1 Fruktosa ... 7
2.2 Madu ... 8
2.3 Polimer ... 11
2.4 Molecularly Imprinting Polymer ... 13
2.5 Potensiometri ... 14
2.5.1 Tinjauan umum potensiometri ... 14
2.5.2 Elektroda kerja dan pembanding... 16
2.6 Elektroda Selektif Ion ... 17
2.7 Kinerja Elektroda ... 18
2.7.1 Faktor Nerst ... 18
2.7.2 Batas deteksi ... 19
2.7.3 Jangkauan pengukuran ... 20
2.7.4 Akurasi dan presisi ... 20
2.7.5 Koefisien selektifitas ... 20
2.8 Karbon Nanopori ... 21
BAB III METODE PENELITIAN ... 23
3.1 Tempat dan Waktu Penelitian ... 23
3.2 Bahan dan Alat Penelitian... 23
3.2.2 Alat penelitian ... 23
3.3 Prosedur Penelitian ... 24
3.3.1 Diagram alir penelitian... 24
3.3.2 Pembuatan larutan induk fruktosa 10-1 M ... 25
3.3.3 Pembuatan larutan kerja fruktosa 10-2-10-8 M ... 25
3.3.4. Pembuatan larutan asam asetat 0,2 M ... 25
3.3.5 Pembuatan natrium asetat trihidrat 0,2 M ... 25
3.3.6 Pembuatan larutan buffer asetat ... 26
3.3.7 Pembuatan larutan kalium hidrogen fosfat trihidrat 0,2 M... 26
3.3.8 Pembuatan larutan kalium dihidrogenfosfat 0,2 M ... 27
3.3.9 Pembuatan larutan buffer fosfat ... 27
3.4 Pembuatan larutan pengganggu ... 28
3.4.1 Pembuatan larutan glukosa 10-3 M ... 28
3.4.2 Pembuatan larutan sukrosa 10-3 M ... 28
3.5 Pembuatan Molecularly Imprinted Polymer (MIP) ... 28
3.6 Pembuatan/konstruksi badan elektroda pasta karbon nanopori/MIP ... 29
3.7 Optimasi elektroda ... 30
3.7.1 Optimasi pH larutan fruktosa ... 30
3.7.2 Optimasi komposisi elektroda ... 31
3.7.3 Pembuatan kurva standar fruktosa ... 31
3.8 Penentuan parameter validasi... 32
3.8.1 Penentuan batas deteksi ... 32
3.8.2 Faktor Nerst dan linearitas ... 32
3.8.3 Penentuan koefisien variasi ... 33
3.8.4 Penentuan persen recovery (% R) ... 34
3.8.5 Jangkauan pengukuran ... 35
3.8.6 Penentuan koefisien selektifitas ... 35
3.9 Jadwal dan Anggaran Penelitian ... 36
3.9.1 Waktu penelitian ... 36
3.9.2 Anggaran dana penelitian... 36
BAB IV HASIL DAN PEMBAHASAN ... 37
4.1 Hasil Pembuatan Molecularly Imprinted Polymer (MIP)... 37
4.2 Hasil Pembuatan Polimer Kontrol ... 40
4.3 Karakterisasi Molecularly Imprinted Polymer (MIP) dan Polimer Kontrol ... 40
4.4 Optimasi Elektroda ... 44
4.4.1 Optimasi komposisi elektroda ... 44
4.4.2 Optimasi pH ... 48
4.5 Kurva Kalibrasi Fruktosa ... 49
4.6 Uji kinerja Elektroda Karbon Nanopori/MIP... 50
4.6.1 Jangkauan pengukuran ... 50
4.6.2 Batas deteksi ... 51
4.6.4 Presisi ... 52
4.6.5 Selektifitas Elektroda ... 53
4.7 Mekanisme Timbulnya Beda Potensial ... 54
4.8 Hasil Pengukuran Kadar Fruktosa dalam Madu ... 55
BAB V KESIMPULAN DAN SARAN 5.1 Kesimpulan ... 56
5.2 Saran ... 56
DAFTAR PUSTAKA ... 57 LAMPIRAN
DAFTAR TABEL
Nomor Judul Tabel Halaman
2.1 Kualitas Madu menurut SNI-01-3545-2004 10
3.1 Volume CH3COOH 0,2 M dan CH3COONa 0,2 M pada
pembuatan buffer asetat
26
3.2 Komposisi volume K2HPO4 0,2 M dan KH2PO4 0,2 M
pada pembuatan buffer fosfat
27
3.3 Komposisi pasta karbon nanopori/MIP 31
4.1 Pengaruh komposisi karbon nanopori dan MIP terhadap jangkauan pengukuran, faktor Nerst pada pengukuran fruktosa secara potensiometri
45
4.2 Data pengukuran fruktosa menggunakan E6 pada pH 5-6 49
4.3 Jangkauan pengukuran E6 dan E7 50
4.4 Akurasi pengukuran 51
4.5 Koefisien variasi pengukuran 52
DAFTAR GAMBAR
Nomor Judul Gambar Halaman
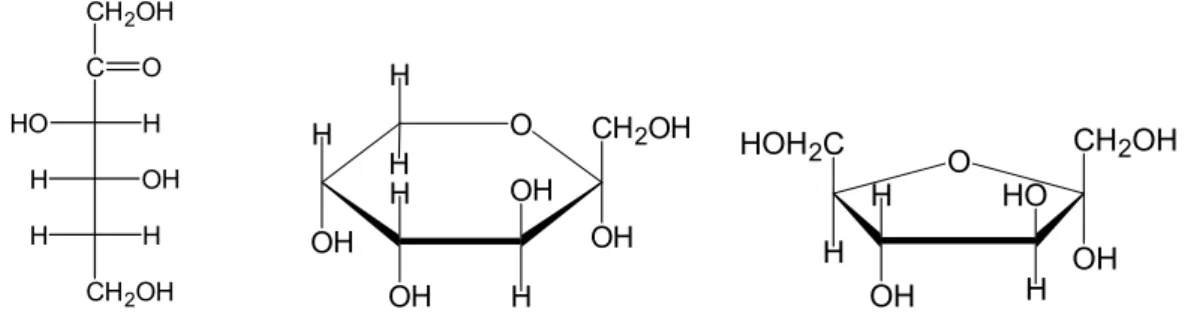
2.1 Struktur Fischer rantai terbuka fruktosa, fruktopiranosa dan fruktofuranosa (Fessenden dan Fessenden, 1986)
8
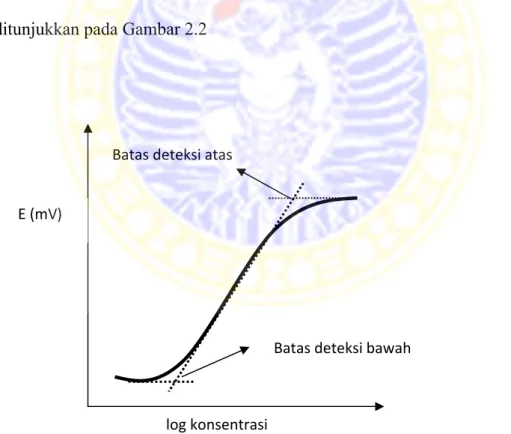
2.2 Kurva penentuan batas deteksi (Bakker, 1997) 19 3.1 Konstruksi elektroda pasta karbon nanopori/MIP 30 4.1 Perkiraan pembentukan MIP oleh monomer asam
metakrilat, template fruktosa dan crosslinker EGDMA
38
4.2 Reaksi polimerisasi asam metakrilat (Munk dkk, 1994) 38
4.3 Hasil pembuatan MIP 38
4.4 Perkiraan cetakan MIP fruktosa yang template
fruktosanya telah diekstraksi
39
4.5 Hasil polimer kontrol 40
4.6 Spektrum inframerah (a) asam metakrilat; (b) MIP sebelum dicuci; (c) MIP setelah dicuci; (d)Polimer kontrol
42
4.7 Elektroda karbon nanopori/MIP dengan kawat Ag 45
4.8 Perbandingan elektroda 46
4.9 Kurva optimasi pH pada pengukuran larutan fruktosa 10-3 M menggunakan elektroda E6 secara potensiometri
49
4.10 Kurva kalibrasi fruktosa 50
DAFTAR LAMPIRAN
Nomor Judul
1 Pembuatan larutan induk dan larutan kerja fruktosa 2 Pembuatan larutan pengganggu
3 Pembuatan Molecularly Imprinted Polymer
4 Perhitungan faktor Nerst dan linearitas elektroda 1-7 5 Data optimasi pH
6 Penentuan koefisien variasi 7 Penentuan persen Recovery 8 Penentuan Koefisien Selektifitas
9 Penentuan kadar fruktosa dalam sampel madu 10 Spesifikasi karbon nanopori
BAB I PENDAHULUAN
1.1 Latar Belakang
Madu adalah bahan makanan berbentuk cairan jernih keemasan yang manis yang diproduksi oleh lebah madu dari nektar yang berasal dari bunga-bungaan melalui proses regurgitasi, yaitu proses pemuntahan material oleh beberapa jenis organisme melalui mulut, faring, dan esofagus yang biasanya ditandai dengan adanya makanan yang belum tercerna dan darah (Nelson dan Couto, 2009). Madu adalah pemanis yang unik, dapat digunakan oleh manusia secara langsung tanpa proses apapun, mengandung nutrisi dan efek medisinal yang baik.
Madu mengandung 38% fruktosa, 31% glukosa, 7% maltosa, 1,3% sukrosa. Nilai nutrisi dan rasa unik madu menyebabkan harga madu murni lebih tinggi daripada pemanis yang lainnya, sehingga madu sangat rentan terhadap pemalsuan yang dilakukan dengan menambahkan pemanis lainnya yang harganya lebih murah, seperti fruktosa sintetis. Padahal, menurut European Union, Codex
Alimentarius of Food dan Agriculture Organization of the United Nation, madu
ditetapkan sebagai produk murni yang tidak diperbolehkan untuk ditambahi dengan substansi lainnya (Xiangrong dkk, 2009).
Fruktosa, atau biasa disebut gula buah, adalah suatu monosakarida polihidroksiketon dengan enam atom karbon dan bersifat sebagai gula pereduksi. Fruktosa adalah gula yang memiliki rasa paling manis bila dibandingkan dengan gula yang lainnya, seperti glukosa dan sukrosa (Hanover dan White, 1993). Gula
ini paling sering ditemukan pada buah-buahan, sayuran, termasuk tebu dan jagung serta madu (Park dan Yetley, 1993). Fruktosa paling sering diekstrak dari jagung, karena jagung lebih murah daripada sumber fruktosa yang lain. Terdapat dua jenis fruktosa dari ekstraksi ini, yaitu sirup jagung kaya fruktosa yang mengandung 55 % fruktosa dan 45 % glukosa, dan kristal fruktosa, yang mengandung 98 % fruktosa. Dalam bentuk padatnya, fruktosa berwarna putih, tidak beraroma, berbentuk padatan kristal dan merupakan gula yang paling mudah larut dalam air (Hyvonen dan Kuivistoinen, 1982).
Analisis fruktosa dalam campuran yang mengandung gula-gula lainnya seperti madu menjadi sulit karena analisisnya diganggu oleh gula yang lain, yang secara alami juga ada bersamaan dengan adanya fruktosa, seperti glukosa, maltosa dan sukrosa. Maka dari itu perlu dikembangkan analisis fruktosa dalam campuran gula yang lain tanpa harus diganggu oleh gula lainnya.
Weigel dkk (1996) menganalisis fruktosa dalam campuran berbagai macam gula dengan menggunakan Flow Injection Analysis (FIA) yang digabung dengan enzim terimobilisasi campuran dan menghasilkan kesalahan sebesar 3% - 6%. Wahjudi dkk (2009) menganalisis fruktosa dengan menggunakan Kromatografi Gas/Spektroskopi Massa (GC/MS) dan mendapatkan limit deteksi sebesar 46 µM. Untuk menganalisis fruktosa dan glukosa, Campuzano dkk (2004) menggunakan bienzim biosensor pada elektroda cakram emas untuk deteksi secara amperometri dengan HPLC dan memperoleh recovery rata-rata sebesar 98%. Sementara itu Bhand dkk (2010) menggunakan metode kalorimetri selektif dalam FIA untuk menganalisis fruktosa dalam sampel sirup tanpa harus menghilangkan
glukosa dan memperoleh limit deteksi sebesar 0,12 mM. Metode-metode ini memang memberikan hasil yang sensitif dan selektif, tapi membutuhkan biaya operasional yang tinggi, analisis yang rumit dan memerlukan penanganan yang sangat cermat, sehingga perlu dikembangkan metode analisis fruktosa yang lebih sederhana dan murah, tapi memiliki selektifitas dan sensitifitas yang minimal sama baiknya, yaitu dengan menggunakan salah satu metode elektrokimia yang disebut potensiometri.
Potensiometri adalah salah satu metode elektrokimia yang berdasarkan pada penentuan potensial sel pada arus nol (Skoog dkk, 1992). Beda potensial timbul karena adanya analit yang dapat dipertukarkan pada permukaan elektroda. Permukaan elektroda merupakan sensor yang harus mengandung komponen yang bereaksi secara kimia dan reversibel dengan analit (Cattral, 1997).
Dalam madu, fruktosa hadir bersama-sama dengan gula yang lainnya, yaitu glukosa, maltosa dan sukrosa. Gula-gula ini mengganggu analisis karena sama-sama dapat memberi respon potensiometri seperti juga fruktosa. Oleh karena itu dibutuhkan metode untuk memperoleh elektroda yang selektif dan sensitif. Metode yang dapat digunakan yaitu dengan memodifikasi elektroda pada potensiometri. Salah satu modifikasi yang digunakan adalah molecular imprinted
polymer (MIP).
Terdapat berbagai penelitian yang menggunakan elektroda termodifikasi untuk sensor potensiometri sebelumnya. Alizadeh dan Akhoundian (2009) membuat sensor potensiometri berbasis MIP untuk menganalisis prometazin dan memperoleh limit deteksi sebesar 1,0 x 10-7 M. Javanbakht dkk (2008)
menganalisis hidroksizin pada tablet dan cairan biologis dengan sensor potensiometri berbasis MIP dengan menggunakan asam metakrilat sebagai monomer dan mendapatkan limit deteksi sebesar 7.0 x 10-7 M. Sedangkan Sadeghi dkk (2006) menggunakan sensor potensiometri berbasis MIP untuk menganalisis levamisol dan mendapatkan limit deteksi sebesar 1,0 µmolL-1.
Molecularly imprinting polymer sangat menjanjikan untuk digunakan
dalam berbagai aplikasi, khususnya sebagai sensor kimia, karena polimer yang disintesis memiliki kemampuan untuk mengenali molekul spesifik, bahkan potensial untuk mengenali senyawa kiral (Tom dan Foster, 2010). Metode pembuatannya cukup sederhana dan mudah, karena yang dibutuhkan hanyalah monomer, template, pelarut dan crosslinker. Polimerisasi yang terjadi kemudian diikuti oleh proses penghilangan template oleh pelarut yang tepat, kemudian terbentuklah material yang spesifik terhadap template tersebut (Komiyama dkk, 2003).
Molecularly imprinting polymer pada penelitian ini digunakan untuk
memodifikasi elektroda potensiometri karbon nanopori sebagai sensor untuk analisis fruktosa dalam madu. Karbon nanopori digunakan sebagai elektroda karena bersifat inert dan memiliki konduktivitas yang tinggi (Pyun dan Lee, 2007). Molecularly imprinting polymer dalam penelitian ini dibuat dengan menggunakan monomer asam metakrilat (MAA), crosslinker etilen glikol dimetakrilat (EDMA), dan inisiator benzoil peroksida.
Sensor fruktosa secara potensiometri ini diharapkan memiliki sensitifitas dan selektifitas yang lebih baik dalam analisisnya, serta memiliki keunggulan
yang tidak dimiliki metode lain. Modifikasi elektroda potensiometri karbon nanopori dengan MIP diharapkan dapat memberikan kinerja sensor potensiometri fruktosa yang optimum meliputi faktor Nernst, jangkauan pengukuran, batas deteksi, akurasi, dan presisi, sehingga akan diperoleh suatu metode alternatif untuk pengukuran kadar fruktosa menggunakan sensor potensiometri yang berbasis pada karbon nanopori dengan MIP dengan hasil yang akurat.
1.2 Rumusan Masalah
Berdasarkan latar belakang di atas maka dapat dirumuskan masalah sebagai berikut.
1. Bagaimanakah kondisi optimum analisis fruktosa menggunakan sensor potensiometri karbon nanopori dengan MIP?
2. Berapakah batas deteksi, faktor Nernst, jangkauan pengukuran, akurasi, presisi dan koefisien selektivitas pada analisis fruktosa menggunakan sensor potensiometri karbon nanopori dengan MIP?
1.3 Tujuan Penelitian
Tujuan penelitian ini adalah:
1. mengetahui kondisi optimum analisis fruktosa menggunakan sensor potensiometri karbon nanopori dengan MIP
2. menentukan batas deteksi, faktor Nernst, jangkauan pengukuran, akurasi, presisi dan koefisien selektivitas pada analisis fruktosa menggunakan sensor potensiometri karbon nanopori dengan MIP.
1.4 Manfaat Penelitian
Elektroda karbon nanopori dengan MIP dapat menghasilkan suatu sensor yang sensitif dan selektif terhadap fruktosa sehingga diperoleh hasil yang akurat. Dengan demikian metode ini diharapkan dapat digunakan sebagai alternatif dalam pengukuran fruktosa dengan cepat, tepat dan murah.
BAB II
TINJAUAN PUSTAKA
2.1 Fruktosa
Fruktosa ditemukan oleh seorang kimiawan Perancis bernama Augustin-Pierre Dubrunfaut pada tahun 1847 (Furton, 1972). Fruktosa adalah suatu polihidroksi keton dan merupakan monosakarida yang memiliki enam atom karbon dan gugus fungsi keton, sehingga sering disebut sebagai ketoheksulosa (Fessenden dan Fessenden, 1986). Fruktosa juga disebut sebagai levulosa karena memutar bidang polarisasi ke kiri. Fruktosa memiliki rumus molekul yang sama dengan glukosa, yaitu C6H12O6, tetapi berbeda karena glukosa bergugus fungsi
aldehid.
Fruktosa dalam bentuk kristalnya adalah berupa siklik enam anggota (D-fruktopiranosa) dimana struktur ini stabil karena terdapat suatu hemiketal dan ikatan hidrogen internal. Hemiketal terbentuk melalui reaksi intramolekul antara gugus keton dan gugus hidroksil dalam air. Selain D-fruktopiranosa, reaksi ini juga menghasilkan siklik lima anggota D-fruktofuranosa. Dalam larutannya, fruktosa berada dalam kesetimbangan campuran ketiga bentuknya, yaitu fruktosa rantai terbuka, fruktofuranosa dan fruktopiranosa (Fessenden dan Fessenden, 1986). Gambar struktur fruktosa ditunjukkan oleh Gambar 2.1.
CH2OH C HO H H OH H H CH2OH O H O OH CH2OH OH OH H OH H H H HOH2C OH CH2OH H OH H H HO O
Gambar 2.1 Struktur Fischer rantai terbuka fruktosa, fruktopiranosa dan fruktofuranosa
Fruktosa yang murni dan kering, memiliki rasa yang sangat manis, berwarna putih, tak berbau, berbentuk padatan kristal dan merupakan gula yang paling mudah larut dalam air (Hyvonen dan Koivistoinen, 1982). Fruktosa banyak digunakan dalam minuman dan makanan kemasan karena fruktosa lebih manis 1,73 kali daripada sukrosa (Hanover dan White, 1993). Fruktosa paling sering ditemukan pada buah-buahan, sayuran, termasuk tebu dan jagung serta madu (Park dan Yetley, 1993). Berat molekulnya adalah 180,16 g/mol, titik lelehnya 1030 C, dan sangat mudah larut dalam air (Budavari, 1996).
Telah dilakukan berbagai macam metode untuk menganalisis fruktosa. Beberapa diantaranya adalah dengan FIA (Weigel dkk, 1996), GC/MS (Wahjudi dkk, 2009), HPLC-amperometri (Campuzano dkk, 2003), dan kalorimetri-FIA (Bhand dkk, 2010).
2.2 Madu
Madu adalah bahan makanan berbentuk cairan jernih keemasan yang manis yang diproduksi oleh lebah madu dari nektar yang berasal dari bunga-bungaan melalui proses regurgitasi, yaitu proses pemuntahan material oleh beberapa jenis organisme melalui mulut, faring, dan esofagus yang biasanya
ditandai dengan adanya makanan yang belum tercerna dan darah (Nelson dan Couto, 2009). Madu adalah pemanis yang unik, dapat digunakan oleh manusia secara langsung tanpa proses apapun, mengandung nutrisi dan efek medisinal yang baik.
Beberapa sifat fisik madu bervariasi karena sangat tergantung pada kandungan air, jenis bunga, suhu, dan komposisi gula yang terkandung di dalamnya. Madu segar berbentuk cairan yang sangat jenuh, mengandung lebih banyak air daripada madu pada temperatur kamar, dimana bentuknya adalah cairan yang lebih kental dan glukosa di dalamnya terpresipitasi menjadi padatan berbutir. Indeks glisemik madu adalah antara 31-78, tergantung pada varietasnya (Arcot dan Brand-Miller, 2005), dan densitasnya sebesar 1,36 kg/l (Krell, 1996).
Madu mengandung 38% fruktosa, 31% glukosa, 7% maltosa, 1,3% sukrosa, air rata-rata 17,2 %, gula yang lebih kompleks 1,5%, abu 0,2%, dan senyawa lain yang tidak terdeteksi sebanyak 3,2% (White dan Doner, 1980). Menurut USDA (United States Department of Agriculture, 2007), madu juga mengandung sangat sedikit (trace amount) vitamin dan mineral. Dilaporkan dalam 100 gram madu terdapat 0,3 g protein, 0,2 g serat, 0,038 mg vitamin B2,
0,121 mg vitamin B3, 0,068 mg vitamin B5, 2 µg vitamin B6, 6 mg vitamin C, 6
mg kalsium, 0,42 besi, 2 mg magnesium, 4 mg pospor, 52 mg kalium, 4 mg natrium dan 0,22 mg zink. Madu juga mengandung sejumlah kecil senyawa yang berfungsi sebagai antioksidan, seperti krisin, pinobaksin, katalase, dan pinocembrin. Komposisi spesifik dari madu sangat tergantung pada jenis nektar bunga (Martos dan Barberan, 2000; Gheldof dkk, 2002).
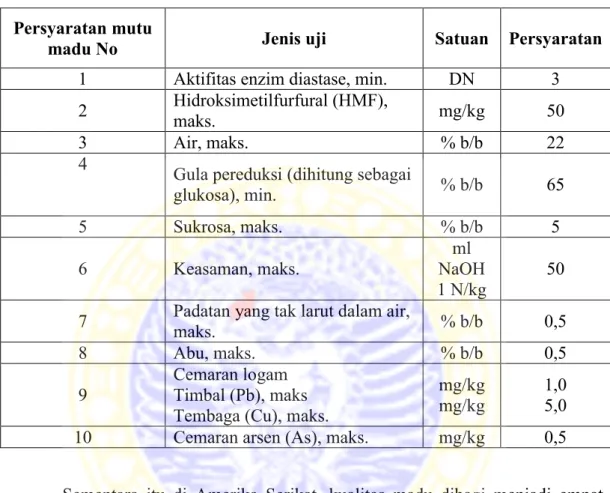
Kualitas madu menurut SNI-01-3545-2004 dijelaskan oleh Tabel 2.1: Tabel 2.1 Kualitas madu menurut SNI-01-3545-2004
Persyaratan mutu
madu No Jenis uji Satuan Persyaratan
1 Aktifitas enzim diastase, min. DN 3
2 Hidroksimetilfurfural (HMF),
maks. mg/kg 50
3 Air, maks. % b/b 22
4
Gula pereduksi (dihitung sebagai
glukosa), min. % b/b 65 5 Sukrosa, maks. % b/b 5 6 Keasaman, maks. ml NaOH 1 N/kg 50 7 Padatan yang tak larut dalam air,
maks. % b/b 0,5
8 Abu, maks. % b/b 0,5
9
Cemaran logam Timbal (Pb), maks Tembaga (Cu), maks.
mg/kg mg/kg
1,0 5,0
10 Cemaran arsen (As), maks. mg/kg 0,5
Sementara itu di Amerika Serikat, kualitas madu dibagi menjadi empat kelas yang ditentukan oleh kandungan air, cacat dan kejernihannya. Semakin sedikit kadar airnya, semakin murni dan segar aroma dan rasanya, semakin sedikit cacat dan pengotornya, kualitas madu semakin baik (USDA, 2007).
Nilai nutrisi dan rasa unik madu menyebabkan harga madu murni lebih tinggi daripada pemanis yang lainnya, sehingga madu sangat rentan terhadap pemalsuan yang dilakukan dengan menambahkan pemanis lainnya yang harganya lebih murah, seperti fruktosa. Padahal, menurut European Union, Codex
ditetapkan sebagai produk murni yang tidak diperbolehkan untuk ditambahi dengan substansi lainnya (Xiangrong dkk, 2009).
2.3 Polimer
Polimer adalah molekul besar yang tersusun secara berulang dari unit kimia yang kecil dan sederhana (mer). Reaksi penggabungan antara monomer-monomer untuk membentuk sebuah molekul polimer disebut dengan reaksi polimerisasi (Odian, 2004). Penyusunan itu dapat berupa susunan linier yang terdiri dari mata rantai yang terbuka, rantai yang bercabang ataupun membentuk jaringan tiga dimensi. Satuan penyusun (repeating unit) setara atau hampir setara dengan monomer.
Reaksi polimerisasi ada dua macam, yaitu polimerisasi adisi dan polimerisasi kondensasi. Pada polimerisasi kondensasi, pembentukan polimer terjadi karena adanya kondensasi antara dua molekul polifungsional untuk membentuk satu molekul polifungsional yang lebih besar. Polimerisasi ini berlangsung dalam beberapa tahap dan membentuk intermediet yang beragam, seperti dimer, trimer dan sebagainya, dalam keadaan yang stabil sampai tahap reaksi yang selanjutnya. Biasanya dalam setiap tahap reaksi, proses ini menghasilkan air.
Pada polimerisasi adisi, polimerisasinya ditandai digunakannya katalis, dengan tidak terjadinya eliminasi, dan tidak adanya produk samping. Polimerisasi ini terjadi melalui tiga tahapan, yaitu inisiasi, propagasi, dan terminasi. Pada tahap inisiasi dibutuhkan inisiator untuk memulai reaksi. Inisiator dapat berupa radikal bebas (R.), kation atau anion. Sedangkan tahap propagasi melibatkan reaksi
pemanjangan rantai polimer akibat penambahan unit monomer secara berturut-turut dan biasanya terjadi dalam waktu yang sangat cepat. Sedangkan tahap terminasi adalah tahap penghentian pembentukan rantai polimer (Odian, 2004). Selama reaksi berlangsung, tak terdapat senyawa yang stabil sebab intermediet yang berbentuk ion atau radikal berumur sangat pendek dan bereksi langsung. Pembentukan rantai polimer pertama adalah single sweep dan yang kedua adalah pembentukan fraksi. Polimerisasi pada senyawa rangkap adalah termasuk reaksi ini (Suyanto, 2009).
Pada reaksi adisi tertentu, mula-mula terjadi pembukaan cincin senyawa siklik kemudian terjadilah reaksi selanjutnya. Reaksi semacam ini tergolong diantara polimerisasi adisi dan kondensasi. Salah satu bentuk polimerisasi adisi ini adalah kopolimerisasi. Kopolimerisasi adalah polimer yang tersusun atas dua macam atau lebih monomer yang berbeda yang tersusun secara acak atau berselang-seling membentuk suatu rantai kopolimer tunggal ataupun suatu jaringan.
Beberapa jenis baru kopolimer adalah kopolimer blok dan kopolimer graf. Kopolimer blok satu jenis rangkaian polimer yang membentuk prepolimerisasi dan kemudian bergabung dengan rangkaian prepolimerisasi yang lain. Sedangkan kopolimer graf terdiri atas suatu rangkaian satu jenis monomer, dan serangkaian monomer jenis lain merupakan cabangnya (Suyanto, 2009).
2.4 Molecularly Imprinted Polymer (MIP)
Molecularly imprinted polymer sangat menjanjikan untuk digunakan
dalam berbagai aplikasi, khususnya sebagai sensor kimia, karena polimer yang disintesis memiliki kemampuan untuk mengenali molekul spesifik, bahkan potensial untuk mengenali senyawa kiral (Tom dan Foster, 2010). Metode pembuatannya cukup sederhana dan mudah, karena yang dibutuhkan hanyalah monomer, template, pelarut dan crosslinker. Monomer fungsional bertindak sebagai pencetak, molekul target bertindak sebagai template melalui interaksi kovalen atau non kovalen, dan crosslinker digunakan untuk membentuk struktur polimer. Polimerisasi yang terjadi kemudian diikuti oleh proses penghilangan
template oleh pelarut yang tepat, kemudian terbentuklah material yang spesifik
terhadap template tersebut.
Terdapat dua metode yang dapat dilakukan untuk membuat MIP, yaitu melalui pendekatan ikatan kovalen dan ikatan non kovalen. Pendekatan ikatan kovalen monomer fungsional dan template terikat satu sama lain oleh ikatan kovalen. Konjugat kovalen ini kemudian mengalami polimerisasi di bawah kondisi normal. Setelah polimerisasi, ikatan kovalennya terpecah dan template dihilangkan dari polimer, sehingga terbentuklah sisi yang dapat mengikat template kembali. Keuntungan teknik ini adalah konjugat monomer-template stabil dan stokiometris, dan dapat digunakan berbagai macam kondisi polimerisasi. Namun, teknik ini mahal dan konjugatnya susah terbentuk, ikatan kovalen yang reversibel jumlahnya terbatas, pelekatan dan pelepasan kembali dari gugus tamunya memakan waktu yang lama.
Sementara pada teknik non-kovalen, dengan sendirinya template berinteraksi dengan monomer fungsional melalui pendekatan ikatan Van der Waals, interaksi elektrostatik, dan ikatan hidrogen. Kekurangan teknik ini adalah konjugat monomer dan template-nya tidak stabil dan tidak stokiometris, kondisi polimerisasinya harus dipilih dengan cermat, dan membutuhkan monomer yang berlebih. Namun teknik ini merupakan teknik pencetakan yang cepat dan paling umum digunakan karena sintesis monomer-template kovalennya tidak perlu dilakukan, template sangat mudah dihilangkan dari polimer dan pelekatan dan pelepasan kembali gugus tamunya sangat mudah (Komiyama dkk, 2003).
2.5 Potensiometri
2.5.1 Tinjauan umum potensiometri
Potensiometri adalah suatu teknik analitik dimana sejumlah analit dalam sampel ditentukan kadarnya, baik dengan cara langsung maupun tidak langsung, dari pengukuran electromotive force (emf) antara dua elektroda yang dicelupkan ke dalam larutan sampel (Braun, 1987). Besarnya beda potensial bergantung pada bagaimana sejumlah analit terdistribusi/menyebar melintasi antarmuka dan berhubungan dengan aktivitas analit yang mengalami reaksi dalam sel (Skoog dkk, 2007). Reaksi setengah sel dari oksidasi reduksi dapat ditulis secara umum.:
aOx + n e b Red
Dengan keterangan Ox adalah bentuk teroksidasi, Red adalah bentuk tereduksi, n adalah jumlah elektron yang terlibat dalam reaksi, a adalah koefisien dari bentuk teroksidasi pada kesetimbangan, b adalah koefisien dari bentuk tereduksi pada kesetimbangan.
Pada larutan yang encer, maka aktivitas zat dianggap sama dengan konsentrasi zat dalam larutan sehingga besarnya potensial dapat dituliskan dalam persamaan :
E = Eo + ln [ox]a/[red]b (1)
Potensial pembanding (Eo) merupakan potensial elektroda standar yang nilainya konstan. Harga E dapat diukur dengan menggabungkan elektroda penunjuk dan elektroda pembanding kemudian diukur emf (electromotive force) dari sel terbentuk (Basset dkk, 1991)
Pada persamaan (1) faktor melibatkan tetapan-tetapan yang diketahui
dan jika dikonversikan ke dalam bentuk logaritma (2,303) maka faktor ini menjadi 0,0591 pada 25oC, sehingga persamaannya menjadi:
E = Eo + log [ox]a/[red]b (2)
Analisis menggunakan metode potensiometri semakin meluas sejak ditemukannya elektroda selektif ion (Day and Underwood,1998). Terdapat dua teknik pengukuran dengan menggunakan potensiometri. Pertama adalah potensiometri langsung dimana pengukuran tunggal digunakan untuk menentukan suatu aktifitas ion tertentu. Kedua adalah potensiometri tidak langsung dimana pengukuran dilakukan dengan cara titrasi. Ion dititrasi dan diukur sebagai fungsi volume titran.
2.5.2 Elektroda Kerja dan Pembanding
Elektroda merupakan bagian dari komponen potensiometri yang berfungsi sebagai sensor analit yang terdiri dari sebuah penghantar elektronik (misal logam) dan sebuah penghantar ionik (larutan). Dalam pengukuran secara potensiometri elektroda yang digunakan harus bersifat inert sehingga tidak dapat bereaksi dengan analit, misalnya platina (Pt), emas (Au), dan karbon (C). Terdapat dua jenis elektroda yang digunakan dalam pengukuran secara potensiometri, yaitu elektroda kerja dan elektroda pembanding (Skoog dkk, 2007)
Elektroda kerja merupakan elektroda yang potensialnya bergantung pada aktivitas analit. Dua jenis elektroda yang umum digunakan dalam pengukuran secara potensiometri yaitu elektroda logam dan elektroda membran. Elektroda logam dibagi menjadi dua yaitu elektroda jenis pertama dan elektroda jenis kedua.
Untuk elektroda jenis pertama, analit yang akan diukur terlibat langsung dalam reaksi elektroda. Pada elektroda ini terjadi kesetimbangan langsung dengan kation yang berasal dari elektroda logam, misalnya elektroda Cu, Ag, Hg, Cd, Zn, dan Pb. Sedangkan untuk elektroda jenis kedua, pengukuran analit tidak langsung berhubungan dalam reaksi elektroda. Misalnya elektroda perak-perak klorida yang dibentuk dengan menyalut kawat perak dengan perak klorida. Elektroda tersebut digunakan untuk mengukur konsentrasi ion klorida dalam larutan (Basset dkk, 1991). Elektroda membran atau umum disebut elektroda selektif ion (ESI) merupakan elektroda yang memiliki sensor berupa membran pada permukaan elektroda.
Elektroda pembanding adalah elektroda yang memiliki nilai potensial yang telah diketahui, konstan, dan tidak bergantung pada besarnya konsentrasi analit. Elektroda yang umum digunakan adalah elektroda kalomel (Hg/Hg2Cl2) dan
elektroda Ag/AgCl (Skoog dkk, 2004). Elektroda kalomel adalah elektroda yang paling sering digunakan karena memiliki potensial yang konstan dan mudah pembuatannya. Elektroda Ag/AgCl terdiri dari kawat perak atau kawat platinum yang dilapis secara elektrolisis dengan lapisan tipis perak klorida, kawat ini tercelup ke dalam larutan kalium klorida yang diketahui konsentrasinya (Basset dkk, 1991). Berbeda dengan elektroda kalomel yang tidak dapat digunakan pada temperatur di atas 60oC, elektroda Ag/AgCl masih dapat digunakan.
2.6 Elektroda Selektif Ion
Elektroda selektif ion (ESI) merupakan alat yang menggunakan membran sebagai sensor kimia untuk menentukan analit secara kuantitatif, dengan potensial yang berubah-ubah secara reversibel terhadap perubahan aktifitas analit yang ditentukan. Analit yang dikenali oleh ESI biasanya berbentuk ion seperti Na+ ataupun K+, namun apabila spesies larutan yang akan dianalisis bukan sebuah ion melainkan molekul, maka elektrodanya disebut sebagai molecule selective
electrode (Braun, 1987).
Membran yang digunakan untuk elektroda diklasifikasikan menjadi dua tipe yaitu membran cair dan membran padat. Membran cair terdiri dari dua jenis membran yaitu membran ionofor yang diamobilisasikan pada polimer dan membran enzim yang diamobilisasikan pada gel atau terikat secara kimia. Sedangkan membran padat terdiri pula atas dua jenis membran yaitu membran
gelas yang selektif untuk ion-ion seperti H+, Na+, dan NH4+, dan membran garam anorganik yang terdiri dari kristal tunggal seperti LaF3 untuk penentuan F- atau
kristal campuran seperti Ag2S untuk penentuan S2- dan Ag+ . Membran ESI yang
baik harus memiliki komposisi bahan-bahan aktif yang dapat berikatan dengan analit pada permukaan membran dengan reaksi yang cepat, reversibel, dan selektif (Skoog dkk, 2004).
2.7 Kinerja Elektroda
Terdapat beberapa parameter yang dapat menunjukkan kinerja suatu elektroda diantaranya, faktor Nernst, batas deteksi, jangkauan pengukuran, akurasi, dan presisi.
2.7.1 Faktor Nernst
Pada metode potensiometri, korelasi antara potensial elektroda yang terukur dengan keaktifan analit dalam larutan dinyatakan oleh persamaan Nernst. Persamaan Nernst:
Esel = Eo ± 2,303 log C (3)
Besarnya faktor Nernst dapat diperoleh dari kemiringan (slope) grafik potensial (E) terhadap log konsentrasi analit. Dengan memasukkan harga R= tetapan gas ideal (8,314 joule derajat mol), T= suhu dalam derajat Kelvin (273+25=293oK) dan F= tetapan Faraday (96489 coulomb ekivalen), maka diperoleh harga:
Esel= Eo ± log C (4)
Dengan ketentuan Esel adalah potensial yang terukur (V), Eo adalah potensial standar (V), n adalah muatan ion dan log C adalah konsentrasi dari analit (M).
Suatu ESI dikatakan telah memenuhi persamaan Nernst jika bernilai 0,0592/n (± 1-2 mV). Jika faktor Nernst yang diperoleh melebihi nilai tersebut maka disebut Super-Nernstian, dan jika kurang disebut Sub-Nernstian (Cattral, 1997).
2.7.2 Batas deteksi
Batas deteksi adalah kadar terkecil dari analit dalam sampel yang masih
dapat terukur oleh alat. Setiap ESI memiliki batas pengukuran terendah (lower
detection limit) dan tertinggi (upper detection limit) yang merupakan respon
nernstian dari elektroda (Bakker, 1997). Penentuan batas deteksi dengan menentukan titik potong ekstrapolasi kurva pada jangkauan pengukuran dapat ditunjukkan pada Gambar 2.2
Gambar 2.2 Kurva penentuan batas deteksi
E (mV)
log konsentrasi
Batas deteksi bawah Batas deteksi atas
2.7.3 Jangkauan pengukuran
Jangkauan pengukuran suatu ESI merupakan range yang masih memberikan garis lurus dan masih memenuhi persamaan Nernst pada kurva potensial (E) terhadap log konsentrasi (Bakker, 1997).
2.7.4 Akurasi dan presisi
Akurasi merupakan ukuran yang menunjukkan derajat kedekatan hasil analisis dengan kadar analit yang sebenarnya, sedangkan presisi atau keterulangan merupakan keseksamaan metode jika dilakukan oleh analis yang sama dan dalam interval waktu yang pendek. Uji akurasi dan presisi dilakukan untuk menilai ketepatan metode analisis dan ketelitiannya.
Tingkat akurasi dapat diketahui melalui nilai presentasi perolehan kembali (recovery). Sedangkan tingkat presisi dapat dilihat melalui perolehan nilai standar deviasi (SD) dan koefisien variasi (KV) pengukuran.
2.7.5 Koefisien selektivitas
Elektroda pada potensiometri memiliki karakter selektif untuk analit tertentu. Tingkat selektivitas suatu elektroda ditentukan oleh nilai koefisien selektivitas. Pada pengukuran secara potensiometri sebagian besar membran sensor dari elektroda akan mensensor analit atau ion utama, tetapi ada juga kontribusi dari ion lain yang dapat berinteraksi dengan membran sensor. Idealnya, kontribusi yang diberikan sangat kecil atau dapat diabaikan. Pada umumnya, pengukuran secara luas pengaruh ion lain pada respon sensor potensiometri dirumuskan oleh Nicolsky pada persamaan berikut.
E= konstan + RT/nF ln [ai + . ]……….(3.8)
n dan x berturut-turut adalah muatan ion utama dan ion pengganggu, ai adalah
aktifitas ion utama, aj adalah aktifitas ion asing/pengganggu dan adalah
koefisien selektivitas. Selanjutnya koefisien aktivitas ditambah jika ion pengganggunya lebih dari satu (Cattral, 1997)
Untuk memperoleh perhitungan koefisien selektivitas, perlu menghitung aktivitas kedua ion dalam satu larutan campuran. Kekuatan ion akan berbeda jika ada dalam dua larutan secara terpisah. Koefisien selektivitas selanjutnya dihitung dengan menggunakan persamaan berikut.
= ai . 10(E2-E1)/s - ai’ ……….(3.9)
Dengan ketentuan ai adalah aktivitas ion utama, ai’ adalah aktivitas larutan
campuran, aj adalah aktivitas ion pengganggu dalam larutan campuran dan s
adalah kemiringan kurva kalibrasi ion utama (Cattral, 1997).
Jika nilai Ki,j=0 dan ai > . , maka ion asing tidak mengganggu.
Jika nilai Ki,j < 1, maka elektroda bersifat selektif terhadap ion i daripada ion j.
Untuk nilai Ki,j > 1, maka elektroda bersifat lebih selektif terhadap ion j daripada
ion I (Cattral, 1997).
2.8 Karbon Nanopori
Karbon nanopori merupakan hasil proses pemurnian lebih lanjut dari arang aktif. Karbon nanopori dibuat dengan proses pirolisis pada suhu 900-3000oC sambil dialirkan arus plasma pada tekanan tertentu. Pirolisis adalah dekomposisi
kimia bahan organik melalui proses pemanasan tanpa atau sedikit oksigen atau reagen lain dimana material mentah akan mengalami pemecahan struktur kimia menjadi fasa gas. Pirolisis bertujuan untuk membuang material non karbon sehingga hanya meninggalkan karbon. Kandungan zat yang mudah menguap akan hilang sehingga terbentuk pori (Jankowska dkk, 1991) Arang yang mengalami proses pirolisis pada suhu 900oC dan 1300oC menunjukkan adanya peningkatan derajat kristalinitas dari 15,42% menjadi 72,04% dan 79,18%. Hal ini menunjukkan adanya perubahan struktur dari atom karbon yang bersifat amorf menjadi pola struktur yang teratur (Pari, 2010).
Karbon nanopori banyak digunakan dalam industri elektronik, komputer dan mobil yang bahan baku utamanya atom karbon (Pari, 2010). Dalam bidang kimia karbon nanopori dapat dimanfaatkan sebagai elektroda karena merupakan material yang inert, memiliki luas permukaan yang besar dan memiliki konduktivitas yang tinggi (Pyun dan Lee, 2007).
BAB III
METODE PENELITIAN
3.1 Lokasi dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Kimia Analitik, Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga Surabaya. Penelitian dimulai pada bulan Maret 2012 hingga bulan Juni 2012.
3.2 Bahan dan Alat Penelitian 3.2.1 Bahan penelitian
Bahan-bahan yang digunakan dalam penelitian ini adalah fruktosa, asam metakrilat, kloroform, etilen glikol dimetakrilat (EGDMA), benzoil peroksida, air
Ultra High Pure (UHP), metanol, asam asetat, natrium asetat trihidrat, kalium
hidrogenfosfat trihidrat, kalium dihidrogenfosfat, glukosa, sukrosa, madu, kawat Ag, karbon nanopori dan parafin padat. Semua bahan kimia berderajat kemurnian pro analisis.
3.2.2 Alat penelitian
Penelitian ini menggunakan seperangkat alat potensiometri Cyberscan 510, pH-meter tipe 744, instrumen FTIR, hotplate magnetic stirrer, tube mikropipet, serta alat-alat gelas yang umum digunakan di laboratorium.
3.3 Prosedur Penelitian 3.3.1 Diagram alir penelitian
Asam metakrilat + etilen glikol dimetakrilat
+ benzoil peroksida
MIP Polimer kontrol
fruktosa Karbon nanopori Elektroda kerja Elektroda pembanding Parafin padat Larutan fruktosa Electro motive force (EMF) Optimasi - pH larutan - komposisi elektroda Validasi metode: - jangkauan pengukuran - faktor Nernst - batas deteksi - presisi - akurasi - selektivitas
3.3.2 Pembuatan larutan induk fruktosa 10-1 M
Larutan induk fruktosa 10-1 M dibuat dengan menimbang fruktosa sebanyak 1,8016 gram kemudian dilarutkan dalam 25 mL air UHP dalam gelas piala hingga larut sempurna. Larutan fruktosa dipindahkan secara kuantitatif ke dalam labu ukur 100 mL dan diencerkan dengan air UHP sampai tanda batas dan dikocok hingga homogen.
3.3.3 Pembuatan larutan kerja fruktosa 10-2 M-10-8 M
Larutan kerja fruktosa 10-2 M dibuat dengan memipet 2,5 mL larutan fruktosa 10-1 M dan memindahkannya secara kuantitatif ke dalam labu ukur 25 mL. Ke dalam labu ukur tersebut ditambahkan air UHP sampai tanda batas dan dikocok hingga homogen. Prosedur yang sama dilakukan untuk pembuatan larutan kerja fruktosa 10-3 M, 10-4 M, 10-5 M, 10-6 M, 10-7 M, dan 10-8 M dengan volume larutan induk menyesuaikan.
3.3.4 Pembuatan larutan asam asetat 0,2 M
Larutan asam asetat 0,2 M dibuat dengan mengencerkan 1,18 mL larutan asam asetat glasial 17 N dengan air UHP dalam labu ukur 100 mL. Larutan tersebut diencerkan sampai tanda batas lalu dikocok sampai homogen.
3.3.5 Pembuatan larutan natrium asetat trihidrat 0,2 M
Ditimbang sebanyak 2,7216 gram natrium asetat trihidrat kemudian dilarutkan dalam 25 mL air UHP dalam gelas piala. Kemudian larutan tersebut
dipindahkan secara kuantitatif ke dalam labu ukur 100 mL lalu diencerkan dengan air UHP sampai tanda batas dan dikocok sampai homogen.
3.3.6 Pembuatan larutan buffer asetat
Larutan buffer asetat pH 3,0; 3,5; 4,0; 4,5 dan 5,0 dibuat dengan mencampurkan larutan asam asetat 0,2 M dan natrium asetat 0,2 M sesuai komposisi volume seperti yang ditampilkan pada Tabel 3.1
Tabel 3.1 Volume CH3COOH 0,2 M dan CH3COONa 0,2 M pada
pembuatan buffer asetat
Kemudian kedua larutan dicampurkan dalam gelas beker dan diencerkan dengan air UHP sampai volume 100 mL. Selanjutnya pH larutan diukur dengan pH meter. Apabila pH buffer terlalu asam maka ditambahkan ke dalamnya larutan CH3COONa.3H2O 0,2 M tetes demi tetes hingga tercapai pH yang diinginkan.
Apabila pH buffer terlalu basa maka ditambahkan tetes demi tetes larutan CH3COOH 0,2 M sampai pH yang diinginkan tercapai.
3.3.7 Pembuatan larutan kalium hidrogenfosfat trihidrat 0,2 M
Pembuatan larutan kalium hidrogenfosfat trihidrat 0,2 M dibuat dengan melarutkan 4,5644 gram K2HPO4.3H2O dengan 50 mL air UHP dalam gelas piala
100 mL. Larutan tersebut dipindahkan secara kuantitatif ke dalam labu ukur 100
pH Larutan Volume (mL) CH3COOH 0,2 M CH3COONa 0,2 M 2,0 49,9 0,1 3,0 49,0 1,0 4,0 42,6 7,4 5,0 18,3 31,7
mL dan diencerkan dengan air UHP sampai tanda batas lalu dikocok sampai homogen.
3.3.8 Pembuatan larutan kalium dihidrogenfosfat 0,2 M
Larutan kalium dihidrogenfosfat dibuat dengan menimbang 2,7217 gram KH2PO4 dan melarutkannya dengan 25 mL akuades dalam gelas piala 50 mL.
Larutan tesebut dipindahkan secara kuantitatif ke dalam labu ukur 100 mL lalu diencerkan dengan air UHP sampai tanda batas dan dikocok sampai homogen.
3.3.9 Pembuatan larutan buffer fosfat
Larutan buffer fosfat dengan pH 6,0, 7,0, dan 8,0 dibuat dengan mencampurkan larutan kalium hidrogenfosfat 0,2 M dan kalium dihidrogenfosfat 0,2 M sesuai dengan komposisi volume yang disajikan pada Tabel 3.2.
Tabel 3.2 Komposisi volume K2HPO4 0,2 M dan KH2PO4 0,2 M pada
pembuatan buffer fosfat
Kedua larutan dimasukkan ke dalam gelas beker dan diencerkan dengan air UHP sampai volume 100 mL. Kemudian pH larutan diukur dengan pH meter. Apabila pH terlalu asam, larutan ditambahkan dengan larutan kalium hidrogenfosfat trihidrat 0,2 M tetes demi tetes hingga pH yang diinginkan
pH Larutan Volume (mL)
K2HPO4 0,2 M KH2PO4 0,2 M
6,0 2,9 47,1
7,0 19,1 30,9
tercapai. Apabila pH buffer terlalu basa maka ditambahkan larutan kalium dihidrogenfosfat 0,2 M sampai diperoleh pH yang diinginkan.
3.4 Pembuatan larutan pengganggu 3.4.1 Pembuatan larutan glukosa 10-3 M
Larutan glukosa 10-3 M dibuat dengan mengencerkan larutan glukosa 10-2 M yang dibuat dengan melarutkan 0,1802 g glukosa secara kuantitatif dalam labu ukur 100 ml. Diambil 10 ml larutan glukosa 10-2 M, kemudian larutan tersebut dipindahkan secara kuantitatif ke dalam labu ukur 100 mL dan diencerkan dengan air UHP sampai tanda batas dan dikocok hingga homogen.
3.4.2 Pembuatan larutan sukrosa 10-3 M
Larutan sukrosa 10-3 M dibuat dengan mengencerkan larutan sukrosa 10-2 M yang dibuat dengan melarutkan 0,3423 g sukrosa secara kuantitatif dalam labu ukur 100 ml. Diambil 10 ml larutan sukrosa 10-2 M, kemudian larutan tersebut dipindahkan secara kuantitatif ke dalam labu ukur 100 mL dan diencerkan dengan air UHP sampai tanda batas dan dikocok hingga homogen.
3.5 Pembuatan Molecularly Imprinted Polymer (MIP)
Molecularly Imprinted Polymer (MIP) dibuat dengan mencampurkan 0,8
mmol (68,848 mg) monomer asam metakrilat dalam 5 mL kloroform dengan 0,2 mmol (36,032 mg) fruktosa sebagai template yang sudah dilarutkan dalam 2 mL metanol yang kemudian dilarutkan lagi dalam 3 mL kloroform di dalam gelas
beker, selanjutnya campuran tersebut didiamkan selama 1 jam. Dalam gelas beker yang berbeda disiapkan pula 2,4 mmol (475,728 mg) crosslinker etilen glikol dimetakrilat (EGDMA) dan 1 mmol (242,23 mg) benzoil peroksida sebagai inisiator yang telah dilarutkan dalam 1 ml kloroform. Selanjutnya crooslinker dan inisiator ditambahkan ke dalam campuran asam metakrilat dan fruktosa, kemudian dipanaskan di atas hotplate pada temperatur 60oC selama kurang lebih 2 jam tanpa pengadukan. Padatan yang terbentuk dikeringkan di udara terbuka. Selanjutnya padatan digerus dan diayak dengan ukuran 200 mesh sehingga diperoleh ukuran partikel yang homogen. Kemudian MIP dicuci menggunakan asam asetat dan metanol dengan perbandingan 2:8, selanjutnya dengan air 70oC (Liang dkk, 2009). Polimer yang telah diekstraksi inilah yang menjadi MIP. Sedangkan polimer kontrol disintesis dengan cara yang sama tanpa penambahan fruktosa.
3.6 Pembuatan badan elektroda pasta karbon nanopori/MIP
Elektroda dibuat dengan membuat badan elektroda terlebih dahulu yaitu dengan mengisi ¾ tube mikropipet 1 ml dengan parafin padat yang di dalamnya telah dipasang kawat Ag. Kawat Ag digunakan sebagai penghubung antara elektroda dengan alat potensiometer. Selanjutnya sisa tube yang belum terisi, diisi dengan karbon nanopori yang telah dicampur dengan parafin padat dan MIP dengan penekanan sehingga tube penuh terisi dengan pasta karbon nanopori/MIP. Karbon nanopori dicuci terlebih dahulu dengan menggunakan asam nitrat untuk menghilangkan kandungan logamnya. Agar terbentuk pasta maka campuran antara karbon nanopori, parafin padat dan MIP dipanaskan terlebih dahulu. Selanjutnya permukaan elektroda digosokkan pada kertas HVS sehingga
permukaan elektroda menjadi halus. Konstruksi elektroda pasta karbon nanopori/MIP ditunjukkan pada Gambar 3.1
Gambar 3.1 Konstruksi elektroda pasta karbon nanopori/MIP
3.7 Optimasi elektroda
3.7.1 Optimasi pH larutan fruktosa
Untuk optimasi ini, digunakan larutan fruktosa 10-3 M yang didapatkan dengan mengencerkan 1 ml larutan induk fruktosa 10-1 M di dalam labu ukur 25 ml. Pengencerannya dilakukan dengan larutan buffer dengan tujuh pH yang berbeda, yaitu, pH 2, 3, 4, 5, 6, 7 dan 8, yang ditambahkan ke dalam labu ukur sampai tanda batas, dan dikocok hingga homogen. Selanjutnya larutan ini dimasukkan ke dalam wadah sampel dan dianalisis menggunakan elektroda kerja pasta karbon nanopori/MIP dan elektroda pembanding Ag/AgCl. pH optimum merupakan pH dimana potensial menunjukkan harga yang relatif konstan.
Kawat Ag
Parafin padat
3.7.2 Optimasi komposisi elektroda
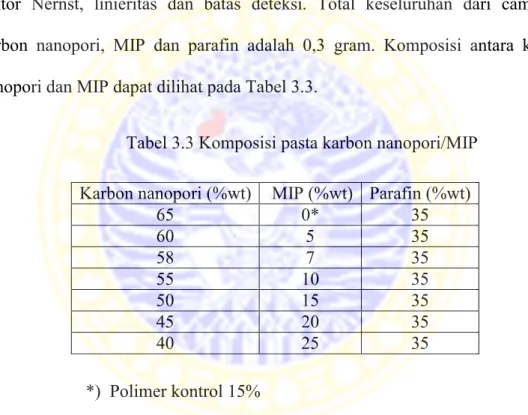
Optimasi komposisi antara pasta karbon nanopori dan MIP dalam pembuatan elektroda perlu dilakukan untuk mendapatkan elektroda yang mampu bekerja secara optimum. Dari komposisi yang berbeda-beda tersebut akan diamati faktor Nernst, linieritas dan batas deteksi. Total keseluruhan dari campuran karbon nanopori, MIP dan parafin adalah 0,3 gram. Komposisi antara karbon nanopori dan MIP dapat dilihat pada Tabel 3.3.
Tabel 3.3 Komposisi pasta karbon nanopori/MIP
*) Polimer kontrol 15%
3.7.3 Pembuatan kurva standar fruktosa
Larutan fruktosa dengan konsentrasi 10-1 M sampai 10-8 M yang telah dibuat pada pH optimum seperti prosedur 3.3.8.1 selanjutnya diukur potensialnya menggunakan sensor potensiometri pasta karbon nanopori/MIP yang sudah dioptimasi. Beda potensial yang dihasilkan selanjutnya dibuat kurva hubungan antara potensial dan log konsentrasi fruktosa. Kurva yang memberikan garis lurus adalah kurva standar fruktosa.
Karbon nanopori (%wt) MIP (%wt) Parafin (%wt)
65 0* 35 60 5 35 58 7 35 55 10 35 50 15 35 45 20 35 40 25 35
3.8 Penentuan parameter validasi 3.8.1 Penentuan batas deteksi
Batas deteksi menyatakan besarnya kadar analit terkecil dalam sampel yang masih dapat diukur atau dideteksi dengan baik oleh suatu metode. Sebelum melakukan perhitungan batas deteksi harus ditentukan terlebih dahulu persamaan garis linier dari kurva antara potensial dan log konsentrasi fruktosa seperti pada persamaan 3.1.
y= bx+a………(3.1) dengan y merupakan potensial larutan, x merupakan nilai log konsentrasi analit, b adalah slope, dan a adalah intersep. Selanjutnya menentukan persamaan garis non linier pada kurva potensial (mV) terhadap log [fruktosa]. Kedua persamaan garis tersebut kemudian ditentukan titik potongnya. Jika titik potong kedua garis tersebut diekstrapolasi ke absis, maka akan diperoleh log konsentrasi fruktosa batas deteksi dari elektroda.
3.8.2 Faktor Nernst dan linieritas
Faktor Nernst dapat ditentukan dari hasil pengukuran larutan kerja fruktosa menggunakan elektroda hasil optimasi yang dibuat kurva antara potensial (mV) terhadap log [fruktosa] sehingga diperoleh persamaan garis seperti pada persamaan 3.1. Kemiringan kurva (b) merupakan harga faktor Nernst.
2 2 x x n y x xy n b ... (3.2)n x b y
a ... (3.3)
dengan y merupakan potensial larutan, x merupakan nilai log konsentrasi analit, n adalah jumlah larutan yang diukur, b adalah slope, dan a adalah intersep.
Secara kuantitatif, linieritas kurva kalibrasi dinyatakan dengan koefisien korelasi (r) Pearson dengan persamaan 4.
2 1 2 i 2 i i i y y x x y y x x r ... (3.4)dengan xi dan x berturut-turut adalah konsentrasi ke-i dan rata-rata fruktosa, yi
dan y adalah potensial ke-i dan rata-rata fruktosa. Nilai r berada pada rentang antara -1 ≤ r ≤ 1 (Miller, 1991).
3.8.3 Penentuan koefisien variasi (presisi)
Presisi atau ketelitian menyatakan derajat keterulangan (reproducibility)
yaitu besarnya kesesuaian atau penyimpangan dari setiap hasil pengukuran yang telah dilakukan berulang-ulang pada sampel yang sama. Larutan fruktosa dengan konsentrasi 10-2 M dan 10-4 M diukur menggunakan elektroda optimum pada pH optimum sebanyak 3 kali.
Presisi dapat ditentukan dengan menghitung nilai simpangan baku (standar deviasi=SD) dan koefisien variasi (KV). Harga SD dan KV dapat ditentukan dari persamaan berikut (Miller dan Miller, 1998).
SD = 2 1 ( ) 1 n i i X X n
……...(3.5)KV = SD
X X 100 % ………...(3.6)
Dengan ketentuan Xi adalah nilai setiap pengukuran, X adalah nilai rata-rata pengukuran, dan n adalah jumlah pengukuran.
3.8.4 Penentuan persen recovery (% R)
Persen recovery merupakan nilai suatu ketepatan yang merupakan
kedekatan setiap konsentrasi larutan standar yang diperoleh kembali dengan konsentrasi larutan standar sebenarnya. Persen recovery dinyatakan dengan besarnya nilai perbandingan antara konsentrasi larutan standar yang diperoleh kembali dengan konsentrasi larutan standar yang sebenarnya. Untuk mendapatkan % recovery, larutan fruktosa dengan konsentrasi 10-2 M dan 10-4 M diukur menggunakan elektroda optimum pada pH optimum sehingga diperoleh nilai potensial masing-masing larutan. Dengan menganalogkan y sebagai potensial sel larutan fruktosa, hasil pengulangan pengukuran selanjutnya disubstitusi ke dalam persamaan regresi linier yang diperoleh. Sehingga didapatkan nilai konsentrasi fruktosa terukur. Dengan menganggap konsentrasi 10-2 M dan 10-4 M sebagai konsentrasi sesungguhnya dari larutan fruktosa, maka harga % recovery dihitung dengan persamaan berikut (Miller dan Milller, 1998).
R = s sp K C x 100%...(3.7)
Dengan ketentuan Csp adalah konsentrasi standar fruktosa hasil analisis, Ks adalah konsentrasi standar fruktosa sebenarnya, dan R adalah persen recovery.
3.8.5 Jangkauan pengukuran
Jangkauan pengukuran dilakukan dengan mengukur potensial larutan fruktosa dengan menggunakan elektroda hasil optimasi pada konsentrasi larutan fruktosa 10-8 – 10-1 M. Dari hasil pengukuran dibuat kurva standar potensial (mV) terhadap log konsentrasi fruktosa dan ditentukan persamaan garis regresi linier untuk mendapatkan nilai kemiringannya (faktor Nernst). Range yang masih memberikan garis lurus dan masih memenuhi persamaan Nernst pada kurva merupakan jangkauan pengukuran.
3.8.6 Penentuan koefisien selektivitas
Selektivitas elektroda dihitung dengan mengukur potensial dari larutan
pengganggu yaitu glukosa dan sukrosa pada konsentrasi 10-3 M (konsentrasi larutan pengganggu sesungguhnya) dengan elektroda pasta karbon nanopori/MIP hasil optimasi. Selanjutnya dengan memasukkan nilai potensial (y) dari larutan pengganggu pada persamaan regresi linier fruktosa sehingga diperoleh konsentrasi (x). Kemudian dengan menggunakan persamaan:
=
…...(3.8)
maka diperoleh koefisien selektivitas dari elektroda karbon nanopori/MIP.
3.9 Pengukuran Kadar Fruktosa dalam Madu
Pengukuran kadar fruktosa dalam madu dilakukan dengan menimbang 2 gram madu kemudian melarutkannya dalam 100 mL lair UHP. Dari larutan tersebut, diambil 10 mL larutan dan diukur potensialnya dengan menggunakan
elektroda dan pH optimal. Hasil pengukuran potensial dimasukkan dalam persamaan regresi linear elektroda optimal untuk mendapatkan konsentrasi fruktosa dalam sampel madu.
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Pembuatan Molecularly Imprinted Polymer (MIP)
Pembuatan MIP dilakukan dengan mencampurkan 0,2 mmol (0,03603 gram) fruktosa sebagai template, 0,8 mmol (0,0688 gram) asam metakrilat sebagai monomer, dan 2,4 mmol (0,4757 gram) etilen glikol dimetakrilat sebagai
crosslinker serta 1 mmol (0,2422 gram) benzoil peroksida sebagai inisiator (Liang
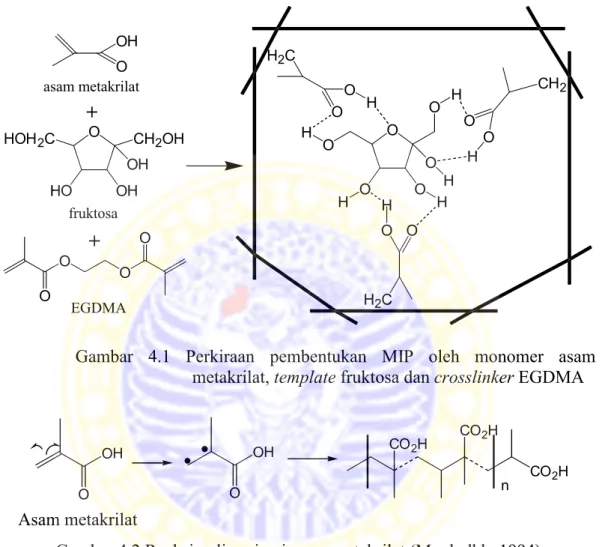
dkk, 2009). Penambahan Molecularly Imprinted Polymer (MIP) dalam pasta karbon nanopori pada penelitian ini dilakukan untuk meningkatkan selektifitas dan sensitifitas elektroda terhadap larutan yang akan dianalisis, yaitu fruktosa.
Tahap pertama terjadinya MIP adalah terbentuknya konjugat non-kovalen antara fruktosa dan asam metakrilat. Untuk mendukung terjadinya tahap pertama ini, fruktosa dan asam metakrilat dicampurkan terlebih dahulu dan didiamkan selama 1 jam. Tahap kedua terjadi ketika campuran fruktosa dan asam metakrilat direaksikan dengan campuran crosslinker dan inisiator, seperti yang ditunjukkan Gambar 4.1. Pada tahap ini konjugat fruktosa dan asam metakrilat terperangkap dalam jaring-jaring tiga dimensi dari polimer (Komiyama dkk, 2003). Proses polimerisasi yang terjadi adalah polimerisasi adisi, dimana air tidak dihasilkan sebagai produk samping seperti pada polimerisasi kondensasi. Dalam polimerisasi adisi, diperlukan suatu inisiator yaitu benzoil peroksida untuk menginisiasi asam metakrilat sehingga menghasilkan suatu radikal yang diperlukan dalam tahap propagasi untuk pemanjangan rantai, seperti yang ditunjukkan oleh Gambar 4.2.
Setelah tahap propagasi, terjadi tahap terminasi, yaitu tahap dimana polimerisasi akan berhenti (Billmeyer, 1984).
H2C O O H O O O O H O H H CH2 O O H H2C O O H O H H OH O O CH 2OH OH HO HOH2C OH
+
O O O O EGDMA asam metakrilat fruktosa+
Gambar 4.1 Perkiraan pembentukan MIP oleh monomer asam metakrilat, template fruktosa dan crosslinker EGDMA
OH O OH O CO2H CO2H CO2H n
Gambar 4.2 Reaksi polimerisasi asam metakrilat (Munk dkk, 1994)
Gambar 4.3 Hasil pembuatan MIP Asam metakrilat
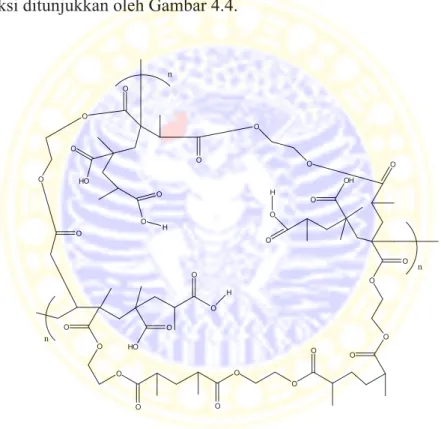
Dalam percobaan, proses polimerisasi dilakukan selama 2 jam hingga porogen kloroform habis menguap dan menghasikan suatu material padat berwarna putih kekuningan seperti yang ditunjukkan Gambar 4.3. Penghilangan monomer yang tidak bereaksi dilakukan dengan mencuci MIP dengan metanol/asam asetat 8:2 v/v. Sementara itu, template fruktosa dihilangkan dengan menggunakan air panas (Liang dkk, 2009). MIP yang template fruktosanya telah diekstraksi ditunjukkan oleh Gambar 4.4.
HO O O O O O O O O O O O H OH O O O O O O O H n n O O n HO O O H O O O O O O O
Gambar 4.4 Perkiraan cetakan MIP fruktosa yang template fruktosanya telah diekstraksi
Berdasarkan interaksi antara template dan monomernya, MIP yang dibuat pada penelitian ini termasuk dalam teknik ikatan non-kovalen. Fruktosa dan asam metakrilat melakukan interaksi non-kovalen yaitu ikatan hidrogen. Teknik ini membutuhkan monomer berlebih agar dapat melingkupi seluruh template sehingga cetakan dapat terbentuk dengan sempurna. Teknik ini juga merupakan
teknik pencetakan yang tercepat dan paling umum digunakan karena pembuatan monomer-template kovalennya tidak perlu dilakukan, dan template sangat mudah dihilangkan dari polimer (Komiyama dkk, 2003).
4.2 Hasil Pembuatan Polimer Kontrol
Pembuatan polimer kontrol dilakukan serupa dengan pembuatan MIP, hanya saja template tidak disertakan dalam reaksi sehingga padatan putih yang terbentuk tidak memiliki sisi pengenalan aktif seperti MIP. Polimerisasi yang terjadi terhadap polimer kontrol adalah polimerisasi adisi, sama dengan MIP. Polimer kontrol yang terbentuk kemudian dicuci dengan metanol/asam asetat 8:2 v/v dan dengan air panas. Hasil pembuatan polimer kontrol yang berupa padatan putih dapat dilihat pada Gambar 4.5.
Gambar 4.5 Hasil polimer kontrol
4.3 Karakterisasi Molecularly Imprinted Polymer (MIP) dan Polimer Kontrol
Karakterisasi MIP dan polimer kontrol dilakukan dengan tujuan untuk mengetahui keberhasilan terbentuknya polimer dan ekstraksi template dari polimer baik untuk MIP maupun polimer kontrol. Untuk itu, karakterisasi
dilakukan dengan menggunakan FTIR sehingga diperoleh data seperti yang ditunjukkan oleh Gambar 4.6. Untuk mengetahui apakah polimerisasi berhasil terjadi, perlu dibandingan spektrum antara asam metakrilat dan spektrum MIP. Berdasarkan Gambar 4.6 (b), yaitu spektrum MIP sebelum dicuci, tampak bahwa polimerisasi telah terjadi, karena pita serapan C=O dari gugus karboksil yang terkonjugasi dengan C=C dalam senyawa asam metakrilat (Gambar 4.6 (a)) pada bilangan gelombang 1697 cm-1 bergeser menjadi 1720,50 cm-1 akibat adanya perubahan ikatan rangkap C=C menjadi ikatan tunggal C-C.
Ekstraksi template fruktosa dari MIP dapat diamati pada Gambar 4.6 (b) dan (c). Pada spektrum (b) yaitu MIP yang belum dicuci, terdapat pita serapan – OH dari gugus karboksil asam metakrilat yang muncul pada panjang gelombang 3417,86 cm-1 dan 3487,30 cm-1. Sedangkan pada spektrum (c) yaitu MIP yang sudah dicuci, tidak terlihat banyaknya perbedaan. Hal ini sangat mungkin disebabkan oleh tidak sempurnanya proses ekstraksi fruktosa dari MIP.
Pada Gambar 4.6 (d), yaitu spektrum polimer kontrol, tampak bahwa polimerisasi telah terjadi, karena pita serapan C=O dari gugus karboksil yang terkonjugasi dengan C=C dalam senyawa asam metakrilat (Gambar 4.6 (a)) pada bilangan gelombang 1697 cm-1 bergeser menjadi 1720,50 cm-1 akibat adanya perubahan ikatan rangkap C=C menjadi ikatan tunggal C-C. Gugus –OH dari asam metakrilat muncul pada bilangan gelombang 3425,58 cm-1.
c.MIP sesudah dicuci b.MIP sebelum dicuci
Gambar 4.6 Spektrum inframerah (a) asam metakrilat; (b) MIP sebelum dicuci; (c) MIP setelah dicuci; (d)Polimer kontrol
d. P. kontrol asam metakrilat