vii INTISARI
Gangguan Akibat Kekurangan Iodium (GAKI) masih merupakan salah satu masalah gizi utama yang belum dapat ditanggulangi hingga saat ini. Salah satu upaya penanggulangan GAKI adalah iodisasi garam. Penelitian ini bertujuan untuk mengetahui rata-rata kadar kalium iodat (KIO3) dan air dalam sampel garam briket
yang beredar di pasar-pasar tradisional di kota Yogyakarta; dan kesesuaian hasil penelitian dengan SNI. Dalam SNI No. 01-3556-2000 tentang garam beriodium mencantumkan bahwa kadar iodium adalah minimal 30 ppm KIO3 dan kadar air
maksimal 7%.
Penelitian ini merupakan penelitian non eksperimental menggunakan metode titrasi iodometri dan Karl Fischer. Hasil penelitian menunjukkan kadar rata-rata KIO3
dalam sampel merk RM, KN, GDD, NN dan KS adalah 15,586 ppm, 4,96 ppm, 7,964 ppm, 36,059 ppm dan 33,406 ppm; 3 merk sampel tidak sesuai dan 2 merk sampel sesuai dengan persyaratan SNI; hasil rata-rata kadar air dalam sampel merk RM, KN, GDD, NN dan KS adalah 4,556%, 3,230%, 4,614%, 3,508% dan 2,824%; semua merk sampel sesuai dengan persyaratan SNI.
viii ABSTRACT
Iodine deficiency disorders (IDD) is one of main nutrition problems which cannot be overcome until now. One of efforts to overcome IDD is salt iodinenization. This research want to know the potassium iodate and water mean measure in bricket salt which sold in traditional markets in Yogyakarta City; conformity of research result with INS. In Indonesian National Standard (INS) Number 01-3556-2000 about iodine salt, mention that iodine measure is minimum 30 ppm KIO3 and water measure is
maximum 7%.
This research is a non experimental by using iodometry titration and Karl Fischer methods. The potassium iodate mean measure in sample RM, KN, GDD, NN dan KS trademark was 15,586 ppm, 4,96 ppm, 7,964 ppm, 36,059 ppm dan 33,406 ppm; three samples trademark was not conform and two samples trademark was conform with INS; water mean measure in sample RM, KN, GDD, NN dan KS trademark was 4,556%, 3,230%, 4,614%, 3,508% dan 2,824%; all the sample trademark was conform with INS.
ii
UJI KADAR KALIUM IODAT DAN AIR DALAM GARAM BRIKET YANG BEREDAR DI PASAR-PASAR TRADISIONAL DI KOTA YOGYAKARTA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh :
Elly Yunia Kartika Dewi NIM : 018114134
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
v Ketika kumohon kepada Allah kekuatan
Allah memberikan kesulitan agar aku menjadi kuat, Ketika kumohon kepada Allah kebijaksanaan Allah memberikan masalah untukku pecahkan Ketika kumohon kepada Allah kesejahteraan Allah memberi akal untuk berpikir
Ketika kumohon kepada Allah keberanian Allah memberiku kondisi bahaya untuk kuatasi Ketika kumohon kepada Allah sebuah cinta
Allah memberiku orang-orang bermasalah untuk kutolong Ketika kumohon kepada Allah bantuan
Allah memberiku kesempatan
Aku tak pernah menerima apa yang kupinta Tetapi aku menerima segala yang kubutuhkan dan Kini doaku terjawab sudah
(Terjemahan bebas dari: History Prayer)
Allah tidak akan membebani seseorang melainkan sesuai dengan kesanggupannya. Ia mendapatkan pahala (dari kebajikan) yang diusahakannya dan mendapat siksa (dari kejahatan) yang dikerjakannya.
(QS. Al Baqoroh: 286)
Dengan penuh rasa syukur
Kupersembahkan skripsi ini untuk:
Papa dan Mamaku
Kakak-kakakku tersayang:
Mas Noy, Mas Ozy, Mbak Ita, dan Mbak Letty
& keponakanku yang cantik Nabila
vi
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak
memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam
kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Yogyakarta, 1 Agustus 2009
Penulis
vii INTISARI
Gangguan Akibat Kekurangan Iodium (GAKI) masih merupakan salah satu masalah gizi utama yang belum dapat ditanggulangi hingga saat ini. Salah satu upaya penanggulangan GAKI adalah iodisasi garam. Penelitian ini bertujuan untuk mengetahui rata-rata kadar kalium iodat (KIO3) dan air dalam sampel garam briket yang beredar di pasar-pasar tradisional di kota Yogyakarta; dan kesesuaian hasil penelitian dengan SNI. Dalam SNI No. 01-3556-2000 tentang garam beriodium mencantumkan bahwa kadar iodium adalah minimal 30 ppm KIO3 dan kadar air maksimal 7%.
Penelitian ini merupakan penelitian non eksperimental menggunakan metode titrasi iodometri dan Karl Fischer. Hasil penelitian menunjukkan kadar rata-rata KIO3 dalam sampel merk RM, KN, GDD, NN dan KS adalah 15,586 ppm, 4,96 ppm, 7,964 ppm, 36,059 ppm dan 33,406 ppm; 3 merk sampel tidak sesuai dan 2 merk sampel sesuai dengan persyaratan SNI; hasil rata-rata kadar air dalam sampel merk RM, KN, GDD, NN dan KS adalah 4,556%, 3,230%, 4,614%, 3,508% dan 2,824%; semua merk sampel sesuai dengan persyaratan SNI.
viii ABSTRACT
Iodine deficiency disorders (IDD) is one of main nutrition problems which cannot be overcome until now. One of efforts to overcome IDD is salt iodinenization. This research want to know the potassium iodate and water mean measure in bricket salt which sold in traditional markets in Yogyakarta City; conformity of research result with INS. In Indonesian National Standard (INS) Number 01-3556-2000 about iodine salt, mention that iodine measure is minimum 30 ppm KIO3 and water measure is maximum 7%.
This research is a non experimental by using iodometry titration and Karl Fischer methods. The potassium iodate mean measure in sample RM, KN, GDD, NN dan KS trademark was 15,586 ppm, 4,96 ppm, 7,964 ppm, 36,059 ppm dan 33,406 ppm; three samples trademark was not conform and two samples trademark was conform with INS; water mean measure in sample RM, KN, GDD, NN dan KS trademark was 4,556%, 3,230%, 4,614%, 3,508% dan 2,824%; all the sample trademark was conform with INS.
ix PRAKATA
Puji syukur penulis ucapkan kepada Tuhan Yang Maha Esa atas segala rahmat
dan karunia yang selalu dilimpahkan sehingga penulis dapat menyelesaikan skripsi
yang berjudul Uji Kadar Kalium Iodat Dan Air Dalam Garam Briket Yang Beredar Di Pasar-Pasar Tradisional Di Kota Yogyakarta. Skripsi ini disusun guna memenuhi salah satu syarat memperoleh gelar Sarjana Farmasi Program Studi Ilmu
Farmasi di Fakultas Farmasi Universitas Sanata Dharma.
Skripsi ini dapat selesai atas dukungan, doa dan semangat dari berbagai pihak.
Oleh karena itu, penulis mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Rita Suhadi, M.Si., Apt., sebagai Dekan Fakultas Farmasi Universitas Sanata
Dharma..
2. Dra. M.M. Yetty Tjandrawati M.Si., selaku dosen pembimbing, atas segala
kesabaran dalam memberi pengarahan dan bimbingan untuk menyelesaikan skripsi
ini.
3. Christine Patramurti, M.Si., Apt. selaku dosen penguji atas saran dan kritik yang
membangun bagi penulis.
4. Lucia Wiwid wijayanti, M.Si., selaku dosen penguji atas saran dan kritik yang
membangun bagi penulis.
5. Drs. P. Sunu Hardiyanta, S.J., M.Sc., atas saran selama penyusunan skripsi ini
serta bahan-bahan yang mendukung dalam penulisan.
6. Yohanes Dwiatmaka, M.Si., selaku dosen pembimbing akademik atas
bimbingannya selama penulis menyelesaikan studi di Fakultas Farmasi Universitas
x
7. Semua bapak/ibu dosen, atas ilmu yang telah diberikan selama penulis menuntut
ilmu di Fakultas Farmasi Universitas sanata Dharma.
8. Pak Prapto, Mas Kunto, Mas Parlan, dan Mas Parjiman yang selalu membantu dan
menemani saat penelitian.
9. Mas Narto, Pak Mukmin, dan Mas Dwi di Sekretariat Fakultas Farmasi
Universitas sanata Dharma, terima kasih atas bantuan dan informasi yang
diberikan.
10. Sahabatku Bora, Adhe, dan Prasojo atas pertemanan, keceriaan, dan canda-tawa
yang telah kita lalui bersama selama ini.
11. Ririn dan Irawan yang membantu dan menemani ngetik. Thank U guys.
12. Teman-teman Farmasi angkatan 2001 kelas C dan teman-teman praktikum
kelompok F atas kebersamaan dan suka duka selama di Sanata Dharma.
13. semua pihak yang tidak dapat penulis sebutkan satu persatu.
Dalam kesempatan ini, penulis juga memohon maaf kepada semua pihak atas
kekurangan dan kesalahan yang mungkin dilakukan penulis. Oleh karena itu dengan
rendah hati penulis mengharapkan masukan, saran dan kritik yang membangun.
Semoga skripsi ini bermanfaat bagi pembaca pada khususnya dan semua pihak yang
membutuhkan.
xi DAFTAR ISI
Halaman
HALAMAN JUDUL……… ii
HALAMAN PERSETUJUAN PEMBIMBING………. iii
HALAMAN PENGESAHAN………..… iv
HALAMAN PERSEMBAHAN……….. v
PERNYATAAN KEASLIAN KARYA ……….. vi
INTISARI……….... vii
ABSTRACT………... viii
PRAKATA………... ix
DAFTAR ISI………... xi
DAFTAR TABEL………... xiv
DAFTAR GAMBAR………. xv
DAFTAR LAMPIRAN……….. xvi
BAB I PENGANTAR……….. 1
A. Latar Belakang………... 1
1. Permasalahan……… 2
2. Keaslian penelitian……….... 2
3. Manfaat penelitian………... 3
B. Tujuan Penelitian………... 3
BAB II PENELAAHAN PUSTAKA……….. 5
xii
1. Pengertian GAKI……….. 5
2. Prevalensi GAKI………...… 5
3. Upaya penanggulangan GAKI……….. 6
B. Iodium……… 6
1. Definisi iodium……….. 6
2. Sumber iodium………... 7
3. Penilaian status iodium………... 8
C. Garam Beriodium………... 9
1. Definisi garam beriodium……….. 9
2. Peraturan perundang-undangan………. 9
3. Syarat mutu garam konsumsi beriodium……….. 10
4. Pengukuran kandungan iodium garam……….… 10
D. Titrimetri……… 11
1. Uji kadar kalium iodat menggunakan metode titrasi iodometri 12
2. Uji kadar air menggunakan metode karl fisher………. 15
E. Validasi Metode………... 17
1. Akurasi………... 21
2. Presisi………...………... 34
F. Keterangan Empiris………... 22
BAB III METODOLOGI PENELITIAN……….. 23
A. Jenis dan Rancangan Penelitian……… 23
B. Definisi Operasional………. 23
xiii
D. Tempat Penelitian……… 24
E. Teknik Sampling………... 24
F. Validasi Metode……….... 25
G. Bahan Penelitian………... 25
H. Alat Penelitian………... 25
I. Tata Cara Penelitian………... 26
1. Penggerusan sampel……….. 26
2. Penetapan kadar air dalam sampel………... 26
3. Preparasi pereaksi………..………... 28
4. Penetapan kadar kalium iodat dalam sampel……… 30
J. Analisis Data Penelitian………... 32
BAB IV. HASIL DAN PEMBAHASAN……….. 33
A. Pemilihan Sampel………... 33
B. Hasil Penelitian………... 33
1. Hasil penetapan kadar kalium iodat………... 33
2. Hasil penetapan kadar air ………... 34
BAB V. KESIMPULAN DAN SARAN………... 36
A. Kesimpulan……….. 36
B. Saran………... . 36
DAFTAR PUSTAKA………. 37
LAMPIRAN……… 40
xiv
DAFTAR TABEL
Halaman
Tabel 1. Kriteria prevalensi GAKI………... 5
Tabel 2. Angka kecukupan gizi untuk iodium………... 7
Tabel 3. Rata-rata kandungan iodium dalam bahan makanan……….. 7
Tabel 4. Penilaian status iodium………... 8
Tabel 5. Syarat mutu garam konsumsi beriodium……… 10
Tabel 6. Persen recovery kalium iodat.………... 21
Tabel 7. Hasil coefficient of variation kalium iodat……….. ……….. 22
Tabel 8. Hasil penetapan kadar kalium iodat……….. ………... 33
xv
DAFTAR GAMBAR
Halaman
Gambar 1. Struktur T3 dan T4…………... 6
Gambar 2. Struktur amilosa……… 14
xvi
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Distribusi merk dagang garam briket……….. 40
Lampiran 2. Data penetapan kadar air………. 41
Lampiran 3. Data penetapan kadar iodium………... 45
Lampiran 4. Peraturan perundang-undangan………... 49
1 BAB I PENGANTAR
A. Latar Belakang
Di Indonesia, ada 4 masalah gizi utama yang belum dapat ditanggulangi dalam
pembangunan jangka panjang pertama sampai kini, yaitu masih tingginya prevalensi
penderita kekurangan kalori protein (KKP), anemia gizi besi (AGB), kekurangan
vitamin A, dan gangguan akibat kekurangan iodium (GAKI) (Anonim, 2002).
GAKI merupakan salah satu masalah kesehatan masyarakat yang sangat serius
mengingat dampaknya sangat besar terhadap kelangsungan hidup dan kualitas sumber
daya manusia. Diperkirakan 140 juta IQ point (angka kecerdasan) hilang akibat
kekurangan zat iodium, karena 42 juta penduduk hidup di daerah endemik, 10 juta
diantaranya menderita gondok, 290.000 bayi menderita kretin dan 3,5 juta penduduk
menderita GAKI lain di daerah-daerah tersebut (Djokomoeljanto, 2002).
Cara paling sederhana dan mudah dalam mencegah masalah GAKI adalah
menggunakan garam beriodium, yaitu garam konsumsi yang komponen utamanya
natrium klorida (NaCl) dan mengandung senyawa iodium melalui proses iodisasi.
Alasannya garam merupakan media yang paling baik untuk mengikat iodium dan
garam merupakan bahan makanan yang dikonsumsi semua orang tiap hari sehingga
menjamin asupan iodium sesuai dengan yang diharapkan (Anonim, 2005a).
Permasalahan yang berkaitan dengan program iodisasi garam terutama
adalah kontinyuitas ketersediaan garam beriodium dengan kadar yang memenuhi
suatu jumlah yang telah terbukti (oleh WHO) cukup untuk mempertahankan fungsi
normal kelenjar tiroid dan kadar air maksimal 7%, agar massa garam (padat) mejadi
larut dan iodium menguap ke udara. Berdasarkan survey garam beriodium tahun 2000
oleh Badan Pusat Statistik (BPS), persentase garam rumah tangga di tingkat propinsi
khususnya Yogyakarta, yang mengkonsumsi garam tidak beriodium ada 8,9%; garam
tidak cukup iodium 21,9%; dan yang cukup iodium sebesar 69,2%; sehingga dapat
diketahui masih banyak masyarakat Yogyakarta lebih dari 30% belum mengkonsumsi
garam cukup iodium (Anonim, 2000b).
Terdapat 3 bentuk garam yang biasa dikonsumsi oleh rumah tangga yaitu
garam halus, garam curai/krosok, dan garam bata (briket). Garam bata atau briket
lebih banyak dikonsumsi di Propinsi Jawa Tengah, DI Yogyakarta, dan Sulawesi
Tengah (Anonim, 2000a).
1. Rumusan Masalah.
Berdasarkan latar belakang, maka dapat dirumuskan beberapa permasalahan:
a. Berapakah kadar rata-rata kalium iodat dan air yang terkandung dalam garam
briket yang beredar di pasar-pasar tradisional (pasar Demangan, Kranggan, Pingit,
Karangwaru, Legi, Gading, Condro, Sentul, Ngasem, Bringharjo, Giwangan, dan
Lempuyangan) di Kota Yogyakarta yang menjadi sampel pada penelitian ini?
b. Apakah kadar kalium iodat dan air sampel sudah sesuai dengan persyaratan SNI
01-3556-2000?
2. Keaslian Penelitian.
Sejauh yang diketahui peneliti, BPOM dalam “Laporan Monitoring Mutu
sejak tahun 2000 belum pernah dilakukan lagi hingga sekarang. Perbedaan dengan
penelitian tentang “Uji kadar kalium iodat dan air dalam garam briket yang beredar di
pasar-pasar tradisional di Kota Yogyakarta” yang dilakukan peneliti adalah tahun
penelitian BPOM tahun 2000, peneliti tahun 2008; lokasi penelitian BPOM pasar yang
ada di Propinsi DIY dan beberapa Propinsi lain di Indonesia, peneliti hanya beberapa
pasar tradisional di Kota Yogyakarta; subjek penelitian BPOM 3 macam garam (halus,
krosok, dan bata/briket), peneliti hanya dikhususkan garam bata/briket saja; tetapi
metode pengukuran kadar iodium sebagai kalium iodat (KIO3) yang digunakan sama,
yaitu metode titrasi iodometri dan Karl Fischer.
3. Manfaat Penelitian.
a. Teoritis: data yang diperoleh diharapkan dapat digunakan sebagai acuan/informasi
bagi pihak-pihak yang terkait berkenaan dengan mutu garam briket sesuai dengan
persyaratan yang berlaku sehingga konsumen tidak dirugikan dan GAKI pada
masyarakat dapat ditanggulangi.
b. Praktis: penelitian ini diharapkan dapat menambah informasi tentang kadar kalium
iodat dan air pada garam briket yang beredar di pasar-pasar tradisional Kota
Yogyakarta.
B. Tujuan Penelitian Tujuan penelitian ini adalah:
1. Untuk mengetahui kadar rata-rata kalium iodat dan air yang terkandung dalam
garam briket yang beredar di pasar-pasar tradisional (pasar Demangan, Kranggan,
Giwangan, dan Lempuyangan) di Kota Yogyakarta yang menjadi sampel pada
penelitian ini.
2. Untuk mengetahui apakah kadar kalium iodat dan air sampel sudah sesuai dengan
5
PENELAAHAN PUSTAKA
A. Gangguan Akibat Kekurangan Iodium (GAKI)
1. Pengertian GAKI
GAKI adalah sekumpulan gejala yang dapat ditimbulkan karena tubuh seseorang
kekurangan unsur iodium secara terus menerus dalam waktu yang cukup lama. Istilah
GAKI digunakan mencakup bukan hanya pembesaran kelenjar gondok saja tetapi semua
akibat kekurangan iodium terhadap pertumbuhan dan perkembangan yang dapat dicegah
dari penanggulangan kekurangan iodium (Djokomoeljanto, 2002).
2. Prevalensi GAKI
Prevalensi GAKI secara umum dikelompokkan menjadi tiga yaitu ringan, sedang,
dan berat.
Tabel I. Kriteria prevalensi GAKI Gambaran Klinis Indikator
(1) upaya jangka panjang : iodisasi garam, peningkatan konsumsi aneka ragam
bahan pangan yang bersumber dari laut, dengan melakukan penyuluhan gizi yang
seimbang; (2) upaya jangka pendek : suplementasi iodium dan distribusi kapsul minyak
beriodium pada daerah endemik sedang dan berat (TGR >20%), misalnya ‘yodiol’
produksi Kimia Farma (Anonim, 2005a).
B. Iodium
1. Definisi Iodium
Iodium adalah zat gizi mikro yang diperlukan oleh tubuh manusia untuk
membentuk hormon tiroksin yang berfungsi untuk mengatur pertumbuhan dan
perkembangan fisik serta kecerdasan. Iodium merupakan mineral yang diperlukan tubuh
dalam jumlah yang relatif sangat kecil, jumlahnya sekitar 15-20 mg. Iodium merupakan
unsur pokok dari hormon tiroid: tiroksin (3,5,3’,5’–tetraiodotironin atau T4) dan (3,5,3’–
triiodotironin atau T3).
Pangan dan Gizi (1998), Angka Kecukupan Gizi (AKG) untuk iodium yang dianjurkan
sebagai berikut:
Tabel II. Angka kecukupan gizi untuk iodium
Kisaran Umur Asupan (µg/hari)
Di alam iodium terdapat dalam kerak bumi dengan kandungan yang tidak merata
di berbagai tempat karena terkikis oleh hujan dari permukaan tanah dan dibawa menuju
laut oleh sungai. Iodium akan menguap dari air laut dan terkonsentrasi dalam hujan dan
jatuh kembali ke bumi yang sebagian langsung masuk sungai dan kembali ke laut. Air
hujan yang jatuh ke tanah akan menambah kandungan iodium dalam tanah tersebut,
namun air hujan juga dapat mengikis permukaan tanah terutama tanah yang miring landai
sehingga tanah tersebut akan kehilangan iodium, misalnya daerah pegunungan. Biasanya
gangguan akibat kurang iodium akan banyak terjadi pada daerah ini (Hetzel, 1996).
Perbedaan tanah dengan kadar iodium yang berbeda-beda, pupuk dan lingkungan
menyebabkan kandungan iodium dalam bahan makanan sangat bervariasi. Sumber bahan
makanan yang berasal dari laut merupakan sumber iodium yang terbaik.
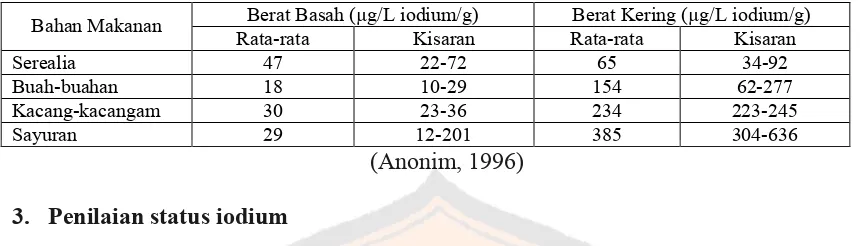
Tabel III. Rata-rata kandungan iodium dalam bahan makanan
Berat Basah (µg/L iodium/g) Berat Kering (µg/L iodium/g)
Bahan Makanan
Rata-rata Kisaran Rata-rata Kisaran
Ikan laut 30 17-40 116 68-194
Ikan air tawar 832 163-3168 3715 417-4591
Kerang 798 308-1300 3866 1292-4987
Daging 50 27-97 -
-Rata-rata Kisaran Rata-rata Kisaran
Serealia 47 22-72 65 34-92
Buah-buahan 18 10-29 154 62-277
Kacang-kacangam 30 23-36 234 223-245
Sayuran 29 12-201 385 304-636
(Anonim, 1996)
3. Penilaian status iodium
Penilaian status iodium digunakan untuk menilai kecukupan asupan iodium dalam
tubuh. Kecukupan iodium tubuh dinilai dari iodium yang masuk lewat makanan,
sebab tubuh manusia tidak dapat mensintesa iodium. Karena yang dibutuhkan sangat
sedikit (dalam ukuran mikro) dan iodium dalam makanan susah untuk diperiksa,
maka sebagai indikator kecukupan iodium diperiksa berdasarkan ekskresi iodium
dalam urin (Urinary Iodine Excretion/UIE), karena metode ini sangat sensitif kepada
perubahan paling akhir dalam hal konsumsi iodium (Anonim ,2001). Kelebihan
iodium dalam tubuh terutama dikeluarkan melalui urin dan sedikit melalui feses yang
berasal dari cairan empedu. Ekskresi iodium urin dianggap menggambarkan masukan
iodium, karena lebih dari 90% iodium diekskresi lewat urin (Dunn, 2002).
Tabel IV. Penilaian status iodium
Rata-rata kadar
urin (µg/L) Asupan Iodium Status Iodium
<20 Tidak cukup Kurang iodium berat
20-49 Tidak cukup Kurang iodium sedang
50-99 Tidak cukup Kurang iodium ringan
100-199 Cukup Optimal
200-200 Lebih dari cukup Risiko hipertiroidisme yang diimbas iodium pada 5-10 tahun ke
depan setelah suplementasi garam beriodium bagi golongan rentan
>300 Berlebihan Risiko hipertiroidisme diimbas iodium dan penyakit tiroid
autoimun
1. Definisi garam beriodium
Garam beriodium adalah garam konsumsi yang komponen utamanya adalah
natrium klorida (NaCl) dan mengandung senyawa iodium melalui proses iodisasi serta
memenuhi Standar Nasional Indonesia (SNI) 01-3556-2000 dan/atau revisinya (Anonim,
2005b).
2. Peraturan perundang-undangan
Peraturan perundang-undangan yang berkaitan dengan penelitian ini antara lain
Undang-Undang RI No.23 tahun 1992 tentang kesehatan. Dalam undang-undang ini
khususnya pasal 21 ayat (3) mencantumkan bahwa makanan yang tidak memenuhi
persyaratan kesehatan dan atau membahayakan kesehatan dilarang untuk diedarkan dan
disita untuk dimusnahkan. Jika melanggarnya maka akan dikenakan pidana penjara
paling lama 15 tahun dan denda paling banyak tiga ratus juta rupiah (Anonim, 1992).
Undang-Undang RI No.8 tahun 1999 pasal 4 tentang perlindungan konsumen
mencantumkan bahwa masyarakat sebagai konsumen memiliki hak atas kenyamanan,
keamanan, keselamatan serta perlindungan dalam mengkonsumsi barang dan/atau jasa,
maka sesuai pasal 8 ayat (1a) pemerintah mengatur bahwa pelaku usaha dilarang
memproduksi dan/atau memperdagangkan barang dan/atau jasa yang tidak memenuhi
atau tidak sesuai dengan persyaratan dan ketentuan peraturan perundang-undangan.
Sanksi bagi pelaku usaha yang melanggar ketentuan tersebut, seperti tercantum dalam
pasal 62 ayat (1) dapat dipidana penjara paling lama 5 tahun atau denda paling banyak
garam beriodium, disebutkan bahwa garam yang dapat diperdagangkan untuk keperluan
konsumsi manusia adalah garam beriodium yang telah memenuhi Standar Nasional
Indonesia (SNI) (Anonim, 1994a). Menurut SNI 01-3556-2000 menyebutkan bahwa
kadar iodium untuk konsumsi manusia adalah minimal 30 ppm (mg/kg) sebagai kalium
iodat (KIO3) dan kadar air maksimal 7% (Anonim, 2000c).
3. Syarat mutu garam konsumsi beriodium
Di Indonesia, bahan kimia untuk iodisasi yang umum digunakan adalah kalium
iodat (KIO3), sesuai sifatnya yang lebih stabil-tidak mudah terurai melepas iodiumnya.
Tabel V. Syarat mutu garam konsumsi beriodium
No Kriteria Uji Satuan Persyaratan
1 Kadar air (H2O) %(b/b) maks. 7
2 Kadar NaCl (natrium klorida) dihitung dari
jumlah klorida %(b/b) min. 94,7
3 Iodium dihitung sebagai kalium iodat (KIO3) mg/kg min. 30
4
5 Arsen (As) mg/kg maks. 0,1
Keterangan: b/b = bobot/bobot(Anonim, 2005b)
4. Pengukuran kandungan iodium garam
Analisa kandungan iodium dalam garam dapat dilakukan dengan pengujian secara
kualitatif dan/atau kuantitatif.
1) Kualitatif: Cara uji dengan rapid test dengan larutan iodine test, dengan
kesimpulan “ada” iodiumnya bila warna keunguan timbul setelah ditetesi, dan
“tidak ada” iodiumnya bila warna garam tidak ada perubahan setelah ditetesi
iodometri (Marihati, 2006).
D. Titrimetri
Pada dasarnya cara titrimetri ini terdiri dari pengukuran volume larutan pereaksi
yang dibutuhkan untuk bereaksi secara stoikiometri dengan zat yang akan ditentukan.
Larutan pereaksi itu biasanya diketahui kepekatannya dengan pasti, dan disebut titran
atau larutan baku atau larutan standar. Larutan standar biasanya ditambahkan dari dalam
sebuah buret. Proses penambahan larutan standar ke dalam larutan zat yang akan
ditetapkan disebut titrasi, sampai tercapai titik kesetaraan (ekuivalen) atau titik-akhir
teoritis (titik-akhir stoikiometri). Jumlah volume larutan standar yang terpakai untuk
mencapai titik kesetaraan ini disebut volume kesetaraan. Titik kesetaraan adalah titik
pada saat pereaksi dan zat yang ditentukan bereaksi tepat lengkap secara stoikiometri.
Lengkapnya titrasi, lazimnya harus terdeteksi oleh suatu perubahan, yang tak dapat
disalah-lihat oleh mata, yang dihasilkan oleh larutan standar itu sendiri, atau lebih lazim
lagi, oleh penambahan suatu reagensia pembantu yang dikenal dengan sebagai indikator.
Setelah reaksi antara zat yang ditetapkan dan larutan standar praktis lengkap, indikator
harus memberi perubahan visual yang jelas (entah suatu perubahan warna atau
pembentukan kekeruhan), dalam cairan yang dititrasi. Titik saat terjadinya hal ini dalam
proses titrasi disebut titik akhir titrasi. Pada titrasi yang ideal, titik akhir yang terlihat,
akan terjadi berbarengan dengan titik-akhir stoikiometri atau teoritis. Namun, dalam
faktor stoikiometri, maka zat yang akan ditentukan dapat dihitung dengan mudah.
1. Uji kadar kalium iodat menggunakan metode titrasi iodometri
Penelitian ini bertujuan untuk menentukan kadar kalium iodat dalam garam
konsumsi (kuantitatif) menggunakan titrasi iodometri. Reaksi kimia yang terjadi
merupakan titrasi oksidasi-reduksi (redoks), yaitu reaksi yang didasarkan pada proses
perpindahan elektron antara zat pengoksidasi dan zat pereduksi. Kalium iodat merupakan
zat pengoksid. Reaksi antara kalium iodat dan zat pereduksi seperti ion iodida (dari
kalium iodida) dalam larutan yang asam (dari asam klorida), akan berhenti pada tahap
ketika iodat direduksi menjadi iodin. Iodin yang terbentuk akan direduksi menjadi iodida
oleh larutan standar natrium tiosulfat, dimana tiosulfat menjadi tetrationat (Vogel,1994).
KIO3 + 5KI + 6HCl → 6KCl + 3I2 + 3H2O atau
IO3‾ + 5I‾ +6H+→ 3I2 + 3H2O (1)
2Na2S2O3 + I2→ 2NaI + Na2S4O6 atau
I2 + 2S2O32‾ → 2I‾ + S4O62‾ (Day dan Underwood, 1996) (2)
Larutan standar sekunder natrium tiosulfat pentahidrat (Na2S2O3.5H2O) mudah
diperoleh dalam keadaan murni yang tinggi, tetapi selalu ada sedikit ketidakpastian akan
kandungan air yang setepatnya, karena itu zat ini tidak sesuai sebagai standar primer dan
merupakan zat pereduksi berdasarkan reaksi setengah sel:
2S2O32‾ → S4O62‾ + 2e (3)
Dimana ekuivalen dari natrium tiosulfat pentahidrat (Na2S2O3.5H2O) adalah 1 mol atau
dapat menyebabkan terjadinya penguraian lambat yang disertai pembentukan belerang:
S2O32‾ + H+→ HSO3‾ + S (4)
Terlebih lagi, penguraian dapat juga disebabkan oleh kerja bakteri (misal, Thiobacillus
thioparus), terutama jika larutan telah didiamkan beberapa lama dan terkena sinar
matahari. Karena alasan-alasan ini, dianjurkan sebagai berikut :
a) Siapkan larutan dengan air suling yang baru saja dididihkan (air bebas karbon
dioksida).
b) Tambahkan 3 tetes kloroform atau 10 mg merkurium (II) iodida per liter;
senyawa-senyawa ini memperbaiki daya tahan larutan.
c) Hindarkan singkapan terhadap cahaya, karena ia cenderung mempercepat
penguraian (Vogel, 1994).
Kalium bikromat (K2Cr2O7), merupakan zat pengoksid yang digunakan sebagai
standar primer untuk larutan natrium tiosulfat. Keuntungannya adalah tidak mahal, sangat
stabil baik dalam bentuk padat ataupun larutan, stabil sampai titik leburnya dan dapat
diperoleh dalam bentuk yang cukup murni untuk menyiapkan kelarutan standar dengan
penimbangan (Day dan Underwood, 1996). Kelemahannya ekuivalen-gram yang relatif
kecil dan pembentukan ion Cr3+, yang membuat determinasi titik ekivalensi susah
dilakukan karena warnanya yang hijau dalam reaksi. Pemecahannya yaitu larutan
dapat dinyatakan sebagai berikut :
Cr2O72‾ + 6I‾ + 14H+ → 2Cr3+ + 3I2 + 7H2O (5)
I2 + 2S2O32¯ → 2I¯ + S4O62¯ (Day dan Underwood, 1996) (6)
Dimana ekuivalen dari kalium bikromat (K2Cr2O7,) adalah seperenam mol atau 294,18/6
atau 49,030 bobot molekul.
Dalam air panas, butiran kanji pecah dan membentuk dispersi koloid dari β
-amilosa yang dapat larut, dan harus dipisahkan dengan pemanasan dari α-amilosa,
amilopektin yang tidak larut. Interaksi iodium dengan koloid β-amilosa menghasilkan
warna biru intensif yang disebabkan oleh terbentuknya suatu senyawa dalam dari
amilosa-amilum dan atom iod. Fraksi amilosa-amilum mempunyai rantai berbentuk
spiral/helikal (Gambar 2 dan 3) dan dengan itu membentuk celah berbentuk saluran.
Dalam saluran ini terdapat suatu rantai iod linier. Warna biru disebabkan oleh ketujuh
electron luar atom iod yang mudah bergerak. Perubahan warna ini reversibel, warna ini
akan hilang saat iodium direduksi dengan natrium tiosulfat (Roth dan Blaschke, 1994).
Gambar 3.Struktur skematik kompleks iodium-kanji
Keunggulan kanji yang utama adalah bahwa harganya murah. Keburukan kanji
antara lain: (1) bersifat tak dapat larut dalam air dingin; (2) ketidakstabilan suspensinya
dalam air; (3) dengan iod memberi suatu kompleks yang tak dapat larut dalam air,
sehingga kanji tidak boleh ditambahkan sampai tepat sebelum titik akhir (saat warna
kuning mulai memudar), jika larutan kanji ditambahkan ketika konsentrasi iod tinggi,
sedikit iod akan tetap teradsorpsi bahan bahkan pada titik akhir sekalipun dan
menyebabkan pembacaan yang salah pada titik akhir titrasi (Vogel, 1994).
2. Uji kadar air menggunakan metode karl fischer
Penetapan kadar air dalam kuantitas kecil dilakukan dengan metode titrimetri,
menggunakan reagensia Karl Fischer. Prinsip penetapan adalah reaksi kuantitatif antara
belerang dioksida pada larutan iodin dalam suatu campuran piridina anhidrat dan metanol
anhidrat (dapar) yang bereaksi dengan ion hidrogen dari air dalam dua tahap (Vogel,
3C5H5N + SO2 + I2 + H2O → 2C5H5N+HI¯ + C5H5N+SO3¯ (7)
piridin piridinum iodida piridin sulfur trioksida
Tahap II :
C5H5N+SO3¯ + CH3OH → C5H5N + HOSO2OCH3 (8)
metanol metil sulfat
Pereaksi yang digunakan adalah Karl Fischer yang terdiri dari 2 bagian yaitu
solven (Karl Fischer A) yang terdiri dari metanol, piridin, dan belerang dioksida. Titran
(Karl Fischer B) yang terdiri dari iodin dan metanol.
Pada pereaksi Karl Fischer, iodin berfungsi sebagai oksidator dan belerang
dioksida berfungsi sebagai reduktor sehingga reaksi yang berlangsung yaitu
reduksi-oksidasi (redoks). Iodin tereduksi menjadi iodida, dengan adanya air maka iodida akan
membentuk HI. Adanya iodida dalam larutan akan menaikkan arus sehingga beda
potensial larutan menjadi besar dan kadar air terbaca. H+ dari HI akan mendepolarisasi
kutub katoda dari elektroda double platina (pt). Kutub katoda akan menangkap H+
sehingga akan menurunkan potensial sampai mendekati nol (0). Oleh alat, tahap ini
dianggap sebagai titik akhir titrasi dan disebut “dead end point”, volume titran dicatat
oleh alat. Piridin dan metanol yang terdapat dalam Karl Fischer digunakan sebagai
pelarut untuk melarutkan sulfur dioksida dan iodin. Piridin dan belerang dioksida akan
membentuk suatu senyawa adisi yang akan mengurangi tekanan uap belerang. Piridin
juga akan mengikat hidrogen iodida sebagai piridinum iodida.
Dalam percobaan, terlebih dahulu dilakukan pre-tritrasi dan cek kebocoran. Cek
kebocoran pada penelitian ini 14 µg/menit, berarti masuk dalam range 10-50 µg/menit.
benar air dalam sampel. Cek kebocoran tujuannya untuk mengetahui seberapa besar
kebocoran yang terjadi pada alat. Standarisasi bertujuan untuk melihat kejelasan antara
pereaksi Karl Fischer dengan jumlah air (Voight, 1994).
E. Validasi Metode
Validasi metode analisis adalah proses terdokumentasi yang menjamin bahwa
pelaksanaan metode analisis yang bersifat karakteristik adalah telah sesuai dengan tujuan
pelaksanaannya (Mulja dan Hanwar, 2003). Berikut ini adalah parameter-parameter
validasi metode analisis dalam penelitian ini.
a. Akurasi
Akurasi dapat diartikan sebagai kedekatan hasil analisis yang diperoleh
menggunakan metode analisis tertentu dengan nilai sebenarnya. Penentuan akurasi
metode analisis dapat dilakukan dengan cara membandingkan kadar terukur dari
sejumlah tertentu senyawa standar yang sengaja ditambahkan ke dalam sampel pada
jumlah yang tertentu pula terhadap kadar sampel yang diketahui dari hasil perhitungan
atau kadar teoritis. Harga perbandingan tersebut dikenal dengan persen perolehan
kembali (recovery) (Anonim, 1995b).
b. Presisi
Presisi berarti metode yang digunakan dapat mengembalikan nilai yang diperoleh
sangat dekat dengan nilai sebenarnya. Presisi metode analisis biasanya dinyatakan
analisis maka validitas metode tersebut semakin terjamin (Anonim, 1995b).
c. Sensitivitas
Sensitivitas metode analisis merupakan kemampuan metode untuk
mengidentifikasi perbedaan yang kecil antar konsentrat analit. Faktor yang
mempengaruhi sensitivitas ini adalah kemiringan dari kurva baku dan presisi. Misalkan
terdapat dua metode dengan tingkat presisi yang sama akan tetapi kemiringan kurva baku
keduanya berbeda, maka metode yang lebih sensitif adalah metode yang kemiringan
kurva baku yang lebih curam begitu pula sebaliknya (Skoog, 1985).
d. Linearitas
Linearitas adalah rentang kadar terendah sampai kadar tertinggi yang ditentukan
dengan metode analisis dan dihubungkan dengan tanggap detektor sehingga memberikan
harga koefisien korelasi yang mendekati nilai 1 (satu) (Mulja dan Suharman, 1995).
e. Limit deteksi (Limit of Dtection = LOD)
LOD merupakan kadar terkecil analit dalam sampel yang masih dapat dideteksi
tetapi tidak secara kuantitatif. Penentuan LOD pada metode instrumental dapat
didasarkan signal-to-noise ratio yaitu dengan cara membandingkan respon dari
pengukuran analit terhadap respon blangko. Konsentrasi analit yang mampu memberikan
respon 2-3 kali respon blangko inilah kemudian yang ditetapkan sebagai LOD.
f. Limit Kuantitasi (Limit of Qauntitation = LOQ)
LOQ merupakan konsentrasi analit terkecil dalam sampel yang masih dapat
dianalisis dengan hasil penentuan kuantitatif yang menunjukkan akurasi dan presisi yang
blangko. Konsentrasi analit yang mampu memberikan respon 10 kali respon blangko
inilah yang kemudian yang ditetapkan sebagai LOQ.
g. Spesifitas
Spesifitas dapat diartikan sebagai kemampuan dari suatu metode analisis untuk
mengukur keberadaan analit dalam sampel secara tepat dan spesifik. Spesifitas
memberikan gambaran tentang derajat gangguan oleh matriks sampel terhadap hasil
pengukuran analit (Anonim, 1995b)
h. Rentang
Rentang suatu metode analisis adalah interval antara kadar terendah sampai kadar
tertinggi analit yang dapat diukur secara kuantitatif menggunkan metode analisis tertentu
dan menghasilkan akurasi serta presisi yang memadai. Biasanya rentang mempunyai
satuan yang sama dengan satuan yang digunakan pada hasil analisis (misal: persen, ppm)
(Anonim, 1995b).
Analisis validasi metode yang digunakan dalam penetapan kadar kalium iodat
dalam garam konsumsi dapat ditentukan berdasarkan parameter
1. Akurasi
Akurasi dapat dinyatakan sebagai persen perolehan kembali (recovery). Nilai
perolehan kembali suatu metode analisis dihitung dengan rumus :
recovery (%) =
tis kadarteori
ur kadarteruk
x 100 %
2. Presisi
Presisi biasanya dinyatakan dengan Coefficient of Variation (CV) atau Relative
Akurasi dinyatakan dengan % recovery, yaitu dengan cara membandingkan kadar
terukur dari sejumlah tertentu senyawa standar yang sengaja ditambahkan ke dalam
sampel pada jumlah yang tertentu pula terhadap kadar sampel yang diketahui dari hasil
perhitungan atau kadar teoritis.
Penetapan recovery kalium iodat dilakukan dengan membuat 3 macam
konsentrasi (20 ppm, 30 ppm, 40 ppm), lakukan replikasi sebanyak 3 untuk
masing-masing konsentrasi. Timbang seksama lebih kurang 50,0 mg kalium iodat (KIO3)
masukkan ke dalam labu ukur 1 L (konsentrasi 50 ppm) dan larutkan dengan aquades
hingga 1 L sebagai larutan stock baku.
Dipipet (20 ml, 30 ml dan 40 ml) dari larutan stock baku, tambahkan aquades
hingga 50 ml (konsentrasi 20 ppm, 30 ppm dan 40 ppm). Sambil digojog, tambahkan 2
ml asam fosfat 85%, 0,1 g kalium iodida, dan 2 ml larutan kanji 1%. Segera titrasi
dengan natrium tiosulfat 0,005 N hingga dengan penambahan 1 tetes warna biru tepat
menghilang. Lakukan replikasi sebanyak 3 kali. Hal tersebut dilakukan untuk
memastikan bahwa dengan konsentrasi yang berbeda masih dapat memberikan %
Replikasi Kadar terukur
Nilai % recovery pada sampel dengan konsentrasi kecil (tabel VI) dikatakan baik
bila berada pada rentang 98-102 % (Mulja dan Hanwar, 2003), sehingga dapat dinyatakan
bahwa metode titrasi iodometri memiliki akurasi yang baik untuk menetapkan kadar
kalium iodat dalam garam konsumsi.
2. Presisi
Nilai presisi sebagai salah satu parameter validitas suatu metode dinyatakan
dengan Coefficient of variation (CV). Timbang seksama lebih kurang 50,0 mg kalium
iodat (KIO3) masukkan ke dalam labu ukur 1 L (konsentrasi 50 ppm) dan larutkan dengan
aquades hingga 1 L sebagai larutan stock baku. Dipipet 30 ml dari larutan stock baku,
tambahkan aquades hingga 50 ml (konsentrasi 30 ppm). Sambil digojog, tambahkan 2 ml
asam fosfat 85%, 0,1 g kalium iodida, dan 2 ml larutan kanji 1%. Segera titrasi dengan
natrium tiosulfat 0,005 N hingga dengan penambahan 1 tetes warna biru tepat
menghilang. Lakukan replikasi sebanyak 7 kali. Hal tersebut dilakukan untuk
memastikan bahwa dengan konsentrasi yang sama masih dapat memberikan CV yang
No Kadar KIO3 (ppm)
1 30,02
2 30,10
3 29,82
4 31,21
5 31,16
6 30,23
7 29,77
x 30,33
SD 0,60
CV 1,99%
(Anonim, 2008)
Pada tabel VII menunjukkan bahwa nilai CV adalah 1,99 %, masih berada pada
nilai CV yang baik yaitu ≤ 2 % (Mulja dan Hanwar, 2003), sehingga dapat dikatakan
bahwa metode titrasi iodometri memiliki nilai presisi yang baik untuk menetapkan kadar
kalium iodat dalam garam konsumsi.
F. Keterangan Empiris
Diharapkan dapat memperoleh informasi yang benar tentang kadar kalium iodat
23 BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian non eksperimental karena di dalam
penelitian ini tidak dilakukan manipulasi pada subyek uji yaitu garam briket.
B. Definisi Operasional
1. Garam briket beriodium adalah garam bentuk bata yang komponen utamanya
natrium klorida (NaCl) dan mengandung senyawa iodium melaui proses iodisasi
serta memenuhi SNI Nomor 01-3556-2000 dan/atau revisinya.
2. SNI Nomor 01-3556-2000 menyebutkan bahwa kadar iodium dalam garam untuk
konsumsi manusia adalah minimal 30 ppm (mg/kg) sebagai kalium iodat (KIO3)
dan kadar air maksimal 7%.
3. Uji kadar kalium iodat adalah perhitungan kadar kalium iodat (dalam satuan ppm)
pada sampel menggunakan metode titrasi iodometri.
4. Uji kadar air adalah perhitungan kadar air (dalam satuan %) pada sampel
menggunakan metode Karl Fisher.
5. Pasar tradisional adalah tempat bertemunya penjual dan pembeli serta ditandai
kios-kios atau gerai, los dan dasaran terbuka yang dibuka oleh penjual maupun suatu
pengelola pasar (Anonim, 2007).
C. Subjek dan Tempat Pengambilan Sampel Penelitian
Subyek penelitian ini adalah garam briket yang berlabel mengandung KIO3.
Tempat pengambilan sampel pada penelitian ini adalah beberapa pasar tradisional
yang ada di Kota Yogyakarta, yaitu pasar Demangan, Kranggan, Pingit, Karangwaru,
Legi, Gading, Condro, Sentul, Ngasem, Bringharjo, Giwangan dan Lempuyangan.
D. Tempat Penelitian
Penelitian dilakukan di laboratorium pangan BPOM Yogyakarta. Penelitian
dilakukan dengan didampingi petugas dari BPOM.
E. Teknik Sampling
Tujuan pemilihan sampel ini adalah agar sampel yang dianalisis dapat bersifat
representatif, artinya sampel yang dianalisis benar-benar menggambarkan populasi
yang diwakilinya. Penelitian ini bersifat deskriptif maka untuk populasi yang sangat
kecil diperlukan >23 sampel (Dahlan, 2005).
Pemilihan tempat dan subyek uji pada penelitian ini menggunakan teknik
simple random sampling. Pengumpulan data distribusi garam briket beriodium di
beberapa pasar tradisional dilakukan dengan mensurvey semua merk dagang garam
banyak beredar, kemudian secara random diambil 5 replikasi untuk masing-masing
merk dagang yang akan diteliti, total 25 sampel, karena jumlah tersebut sudah
menggambarkan karakteristik dari peredaran garam briket beriodium yang dijual
dipasar-pasar tradisional di Kota Yogyakarta.
F. Validasi Metode
Pada penelitian ini penulis tidak melakukan validasi metode. Hal ini
dikarenakan BPOM telah melakukan validasi metode.
G. Bahan Penelitian
Natrium tiosulfat 0,005 N (Na2S2O3.5H2O), asam fosfat 85% (H3PO4), kalium
iodida (KI), natrium klorida p.a.(NaCl p.a), HCl pekat, kanji 1%, sampel garam
briket, Karl Fischer Reagent (E. Merck), Karl Fischer Solvent (E. Merck), metanol
p.a. (E. Merck).
H. Alat Penelitian
Mortir, neraca analitis, buret mikro 10 dan buret 50 ml, labu ukur 1000 ml,
erlenmeyer bersumbat kaca (300 dan 500 ml), shaker, gelas ukur (10 dan 100 ml),
pipet volume (2, 10 dan 50 ml), syringe 5 ml, labu ukur 25 ml, Karl Fischer Titrator,
I. Tata Cara Penelitian
1. Penggerusan sampel.
Penggerusan sampel garam briket dilakukan dengan menggunakan mortir dan
stamper sampai halus, diaduk agar homogen.
2. Penetapan kadar air dalam sampel
a. Prosedur pemakaian alat Karl Fischer Titrator (KF Titrino 703/787, Merk
Metrohm)
1). On-kan alat.
2). Pre-titrasi.
Masukkan pereaksi Karl Fischer A dalam beker titrator hingga menyentuh
ujung elektroda. Lakukan pre-titrasi sesuai dengan prosedur pemakaian alat.
3). Cek kebocoran
Lakukan sesuai prosedur pemakaian alat.
4). Standarisasi/pembakuan
Lakukan standarisasi/pembakuan sesuai prosedur pemakaian alat dengan
memasukkan 2 tetes air ke dalam beker titrator/titration vessel
5). Titrasi blangko.
Kerjakan sesuai dengan prosedur pemakaian alat dengan memasukkan
metanol ke dalam beker titrator.
6). Pengujian sampel.
Kerjakan sesuai dengan prosedur pemakaian alat dengan memasukkan sampel
b. penetapan kadar air
1). Penyiapan sampel. Ditimbang seksama lebih kurang 1 g sampel, dimasukkan
ke dalam labu ukur 10 ml, ditambahkan metanol p.a. 10 ml, dikocok dengan
shaker selama 30 menit, selanjutnya diendapkan dan diambil dengan pipet
volume (sebanyak 2 ml) untuk dibaca kadar airnya dengan menggunakan Karl
Fischer Titrator.
2). Pembakuan Reagent Karl Fischer. Dimasukkan 20 ml Karl Fischer solvent dari
multiburet ke beker titrasi, air yang diabsorbsi ke dalam Karl Fischer solvent
dititrasi dengan Karl Fischer reagent sampai titik akhir. Ditimbang seksama
sejumlah air di dalam syringe, diteteskan air dari syringe sebanyak 2 tetes ke
dalam beker titrasi, segera dititrasi dengan Karl Fischer reagent sampai titik
akhir, baca petunjuk volume titran digital (p ml). Ditimbang kembali sisa air
dalam syringe, selisih penimbangan menunjukkan bobot air yang akan
dititrasi (q mg), kesetaraan 1 ml reagent Karl Fischer terhadap mg air adalah:
f (faktor) = q / p (mg/ml)
dimana: f = faktor air (mg/ml);
q = bobot air (g)→ (mg);
p = titran (ml)
3). Titrasi blanko. Diambil metanol dengan syringe sebanyak 2 ml dimasukkan ke
dalam beker titrasi, segera dititrasi sampai titik terakhir, baca penunjuk
4). Titrasi penetapan kadar air. Diambil hasil larutan sampel dengan syringe
sebanyak 2 ml, dimasukkan ke dalam beker titrasi, segera dititrasi sampai titik
akhir, baca petunjuk volume digital. Kadar air dalam sampel dihitung dengan
rumus sebagai berikut:
Ka =
g
v f
b
a ) 10/
(
x 100 %
Dimana:
a = volume titran pada titrasi sampel (%)
b = volume titran pada titrasi blanko (%)
f = faktor kesetaraan 1 ml reagent Karl Fischer terhadap mg air.
v = volume syringe (2 ml)
g = bobot sampel (mg)
Ka = kadar air dalam sampel (%) (Anonim, 1994b).
3. Preparasi pereaksi
a. Larutan natrium tiosulfat 0,1 N.
Pembuatan: ditimbang seksama lebih kurang 25 g natrium tiosulfat
(Na2S2O3.5H2O), masukkan ke dalam labu ukur 1000 ml, larutkan dalam air
bebas karbondioksida, kemudian encerkan hingga 1000 ml.
b. Larutan natrium tiosulfat 0,005 N.
Pembuatan: dipipet 50 ml larutan natrium tiosulfat 0,1 N kemudian masukkan ke
dalam labu ukur 1000 ml dan encerkan dengan air bebas karbon dioksida hingga
Standarisasi larutan natrium tiosulfat 0,005 N dengan kalium bikromat (K2Cr2O7)
berdasarkan FI IV: ditimbang lebih kurang 50 mg kalium bikromat dengan
seksama yang sebelumnya telah dipanaskan pada suhu 120 °C selama 4 jam.
Masukkan dalam erlenmeyer bersumbat kaca dan larutkan dalam 50 ml air,
tambahkan 1 g kalium iodida, tambahkan 5 ml HCl, segera ditutup. Digojog
hingga tercampur. Biarkan selama 10 menit. Bilas tutup dan dinding labu sebelah
dalam dengan air (warna ungu pekat). Ambil 2 ml larutan dan larutkan dalam 50
ml air, kemudian titrasi dengan larutan natrium tiosulfat menggunakan buret 50
ml, jika bagian terbesar iod telah bereaksi seperti yang ditunjukkan oleh larutan
yang berwarna hijau-kekuningan, tambahkan indikator larutan kanji sehingga
warna berubah menjadi biru-kehijauan, lanjutkan titrasi setetes demi setetes
sambil digojog terus menerus, sampai 1 tetes mengubah warna dari
biru-kehijauan menjadi hijau muda (titik akhir titrasi). Titik akhir titrasi tajam, dan
mudah diamati pada cahaya yang baik dengan latar belakang putih. Kesetaraan
natrium tiosulfat tiap ml ~ 4,903 mg kalium bikromat. Perhitungan:
N =
Dimana: B = bobot kalium bikromat (mg)
f = faktor pengenceran
V = volume larutan natrium tiosulfat (ml)
c. Kanji 1%.
Pembuatan: dicampur 1 g kanji dengan 5 ml air, tambahkan ke dalam 100 ml air
mendidih sambil diaduk, didihkan selama 3 menit, dinginkan.
4. Penetapan kadar kalium iodat dalam sampel.
Cara penetapan: ditimbang seksama lebih kurang 25 g sampel masukkan ke
dalam erlenmeyer, larutkan dalam 125 ml air. Sambil digojok tambah 2 ml asam
fosfat 85%, 0,1 gram kalium iodida dan 2 ml kanji 1%. Segera titrasi dengan natrium
tiosulfat 0,005 N hingga warna biru tepat hilang menggunakan buret mikro ukuran 10
ml. Asam fosfat akan membebaskan iodin dari iodat pada sampel garam. Penambahan
kalium iodida berlebih akan membantu melarutkan iodin karena pada kondisi normal
iodium agak sukar larut pada air murni (pelarut). Penambahan kalium iodida akan
menyebabkan larutan menjadi berwarna kuning (indikator internal) jika terdapat
iodin. Iodin yang terbentuk akan bereaksi dengan natrium tiosulfat (larutan standar).
Jumlah natrium tiosulfat yang digunakan proporsional terhadap jumlah iodin yang
dilepaskan dari garam. Perubahan warna larutan dari kuning pucat menjadi bening
susah untuk dilihat dengan mata, maka digunakan larutan kanji sebagai indikator
eksternal yang akan berikatan dengan iodin sehingga membentuk kompleks warna
keunguan. Titrasi dengan natrium tiosulfat terus dilakukan hingga warna
biru-keunguan pertama kali menghilang dan larutan menjadi jernih yang menunjukkan
bahwa iodin bebas telah habis bereaksi dengan natrium tiosulfat.
Penambahan kanji tidak dilakukan di awal titrasi tetapi saat setelah warna
menghindari ikatan amilum-iodin yang bertambah kuat sehingga perlu dua proses
yaitu pembebasan iodin dari amilum dan pengikatan iodin-natrium tiosulfat, sehingga
natrium tiosulfat yang digunakan lebih banyak yang dapat menyebabkan pembacaan
hasil yang salah, oleh karena itu kanji tidak boleh ditambahkan sampai tepat sebelum
titik akhir tercapai.
Cara perhitungan. Hitung kadar kalium iodat terhadap sampel dengan rumus :
B
a = volume natrium tiosulfat yang diperlukan untuk titrasi sampel (ml)
b = volume natrium tiosulfat yang diperlukan untuk titrasi blanko (ml)
B = bobot sampel garam (g)
N = normalitas natrium tiosulfat yang digunakan untuk titrasi
Ka = kadar air dalam sampel garam (%)
0,1784 = kesetaraan kalium iodat tiap ml natrium tiosulfat 0,005 N (Anonim,
1994b).
Blangko: timbang seksama lebih kurang 25 gram natrium klorida murni pereaksi
(NaCl p.a.), larutkan dalam 125 ml air, kocok hingga homogen. Tambahkan 2 ml
asam fosfat 85 %, 0,1 gram kalium iodida dan 2 ml kanji 1 %. Segera titrasi
dengan natrium tiosulfat 0,005 N menggunakan buret mikro ukuran 10 ml hingga
J. Analisis Hasil Penelitian
Data yang diperoleh dari hasil penelitian baik penetapan kadar kalium iodat
maupun kadar air, kemudian dibandingkan dengan persyaratan yang berlaku yaitu
menurut SNI 01-3556-2000, untuk kadar iodium sebagai kalium iodat minimal 30
33
HASIL DAN PEMBAHASAN
A. Pemilihan Sampel
Penelitian yang dilakukan bersifat deskriptif, maka untuk populasi berjumlah
kecil, sampel yang digunakan > 23 (Dahlan, 2005). Beberapa pasar tradisional di Kota
Yogyakarta yang menjadi tempat pengumpulan data adalah pasar Demangan, Kranggan,
Pingit, Karangwaru, Legi, Gading, Condro, Sentul, Ngasem, Bringharjo, Giwangan, dan
Lempuyangan. Hasil pendataan peneliti, terdapat 12 merk dagang garam briket dengan
label bertanda SNI garam beriodium (iodium dihitung sebagai KIO3) yang beredar di
pasar-pasar tradisional di Kota Yogyakarta. Dari ke 12 merk garam tersebut dipilih 5
merk yang paling banyak beredar (RM, KN, GDD, NN, KS) dan dilakukan 5 kali
replikasi untuk masing-masing merk secara acak dari pasar-pasar yang menjadi tempat
penelitian untuk ditetapkan kadar kalium iodat dan air serta kelengkapan pelabelannya,
total 25 sampel yang akan diteliti untuk mewakili populasi garam briket. Diharapkan dari
hasil pengujian yang diperoleh bisa menggambarkan kadar kalium iodat dan air dari
garam briket beriodium yang beredar di tingkat pasar di Kota Yogyakarta.
B. Hasil Penelitian
1. Hasil penetapan kadar kalium iodat
Dari hasil penelitian didapatkan kadar kalium iodat dari sampel garam briket
Tabel VIII. Hasil penetapan kadar kalium iodat
Merk Kadar kalium
iodat (ppm) ± SD
Persyaratan (ppm)
Kesesuaian dengan persyaratan RM 15,586 ± 3,467 min. 30 Tidak sesuai
KN 4,960 ± 0,947 min. 30 Tidak sesuai
GDD 7,964 ± 0,952 min. 30 Tidak sesuai
NN 36,059 ± 3,031 min. 30 Sesuai
KS 33,406 ± 3,312 min. 30 Sesuai
Hasil penelitian menunjukkan bahwa rata-rata kadar kalium iodat dalam
sampel RM sebesar 15,586 ppm, KN sebesar 4,96 ppm, dan GDD sebesar 7,964 ppm,
hal ini tidak sesuai dengan persyaratan SNI 01-3556-2000, sedangkan rata-rata kadar
kalium iodat dalam sampel NN sebesar 36,059 ppm dan KS sebesar 33,406 ppm, hal ini
sesuai dengan persyaratan SNI 01-3556-2000 yaitu minimal 30 ppm iodium sebagai kalium
iodat.
Hasil kadar kalium iodat pada masing-masing sampel berbeda-beda. Hal ini dapat
disebabkan karena masalah teknis yang terkait dengan kadar dalam garam konsumsi
dipasaran: jumlah kalium iodat yang ditambahkan tidak mencukupi (unsur kesengajaan);
proses iodasi yaitu pencampuran antara garam dengan larutan kalium iodat sering kali tidak
homogen (unsur ketidak sengajaan); kehilangan kalium iodat saat garam dibuat briket dengan
cara pemanasan (unsur ketidak sengajaan); penurunan kadar kalium iodat saat masa
pemasaran dan masa penyimpanan di tingkat produsen, distributor dan konsumen (unsur
ketidak sengajaan).
2. Hasil penetapan kadar air
Dalam SNI 01-3556-2000 tentang garam konsumsi menyebutkan bahwa kadar air
maksimal adalah 7%. Hal ini ditetapkan untuk membatasi jumlah air yang terkandung dalam
bersifat higroskopis, misalkan pada saat kelembapan udara yang tinggi bisa menyerap air dari
lingkungannya dan menaikkan kadar air dalam garam.
Tabel IX. Hasil penetapan kadar air
Merk Kadar air
(%)
Persyaratan (%)
Kesesuaian dengan persyaratan
RM 4,556 ± 0,098 maks. 7 Sesuai
KN 3,230 ± 0,103 maks. 7 Sesuai
GDD 4,614 ± 0,191 maks. 7 Sesuai
NN 3,508 ± 0,404 maks. 7 Sesuai
KS 2,824 ± 0,257 maks. 7 Sesuai
Hasil penelitian menunjukkan bahwa rata-rata kadar air dalam sampel RM
sebesar 4,556%; KN sebesar 3,230%; GDD sebesar 4,614%; NN sebesar 3,508%; dan
KS sebesar 2,824%, hal ini sesuai dengan persyaratan SNI 01-3556-2000. Semua sampel
memiliki kadar air di bawah 5%, hal ini baik karena kadar air sangat mempengaruhi
kestabilan iodium (dihitung sebagai kalium iodat) dalam garam, dimana semakin tinggi kadar
36 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
1. Kadar rata-rata kalium iodat dalam sampel dalam sampel merk RM, KN, GDD,
NN dan KS adalah 15,586 ppm; 4,96 ppm; 7,964 ppm; 36,059 ppm dan 33,406
ppm, kadar rata-rata air dalam sampel merk RM, KN, GDD, NN dan KS adalah
4,556 %; 3,230 %; 4,614%; 3,508% dan 2,824%.
2. Tiga merk sampel tidak sesuai dan dua merk sampel sesuai dengan kadar kalium
iodat menurut persyaratan SNI. Kelima merk sampel sesuai dengan kadar air
menurut persyaratan SNI.
B. Saran
1. BPOM dan instansi yang terkait sebagai pihak yang berwenang untuk dapat
meningkatkan pengawasan garam briket yang beredar di masyarakat.
2. Perlu dilakukan penelitian serupa dengan daerah penelitian yang berbeda, seperti
37
DAFTAR PUSTAKA
Almatsier, S., 2002, Prinsip Dasar Ilmu Gizi, 261-267, PT. Gramedia Pustaka Utama, Jakarta.
Anonim, 1992, Undang-Undang Republik Indonesia No.23 Tahun 1992 Tentang Kesehatan, Departemen Kesehatan Republik Indonesia, Jakarta.
Anonim, 1994a, Keputusan Presiden Republik Indonesia No.69 Tahun 1994 Tentang Pengadaan Garam beriodium, Departemen Kesehatan Republik Indonesia, Jakarta.
Anonim, 1994b, Standar Nasional Indonesia No.01-3556-1994 Tentang Garam Beriodium, Departemen Kesehatan Republik Indonesia, Jakarta.
Anonim, 1995a, Farmakope Indonesia, Edisi IV, 1217-1218, Departemen Kesehatan Republik Indonesia, Jakarta.
Anonim, 1995b, The United States Pharmacopeia 23, Jilid 2, 1982-1984, United States Pharmacopeial Convention, Inc, Rockville.
Anonim, 1996, Trace Element In Human Nutrition and Health, WHO, Geneva.
Anonim, 1999, Undang-Undang Republik Indonesia No.8 tahun 1999 Tentang Perlindungan Konsumen, Departemen Kesehatan Republik Indonesia, Jakarta.
Anonim, 2000a, Laporan Monitoring Mutu Garam Beriodium di DIY Tahun 2000, 1-34 Proyek Pengawasan Obat dan Makanan DIY, Badan Pengawas Obat dan Makanan, Yogyakarta.
Anonim, 2000b, Laporan Hasil Survey Konsumsi Garam Beriodium Rumah Tangga 2000, Balai Pusat Statistik, Jakarta.
Anonim, 2000c, Standar Nasional Indonesia No.01-3556-2000 Tentang Garam Beriodium, Departemen Kesehatan Republik Indonesia, Jakarta.
Anonim, 2001, Assesment of Iodine Deficiency Disorders and Monitoring Their Elimination, 2nd Edition: WHO, USA.
Anonim, 2002, Paradigma Sehat Indonesia Sehat 2010, Pusat Promosi Kesehatan Departemen Kesehatan Republik Indonesia, Jakarta.
Anonim, 2005b, Peraturan Menteri Perindustrian Republik Indonesia No.42 Tahun 2005 Tentang Pengolahan, Pengemasan dan Pelabelan Garam Beriodium, Departemen Kesehatan Republik Indonesia, Jakarta.
Anonim, 2007, Pasar Tradisional, Wikipedia: Ensiklopedia Bebas Berbahasa Indonesia, http://www.wikipedia.go.id . Diakses pada tanggal 27 Oktober 2007.
Arisman, 2003, Gizi Dalam Daur Kehidupan: Buku Ajar Ilmu Gizi, 132-143, EGC, Jakarta.
Dahlan, M.S., 2005, Seri Evidence Based Medicine: Besar Sampel Dalam Penelitian Kedokteran Dan Kesehatan, Seri 2, Arkans, Jakarta.
Day, R.A., dan Underwood, A.L., 1996, Analisa Kimia Kuantitatif, Alih Bahasa: Pudjaatmaka, A.H., Edisi 5, 290-303, Penerbit Erlangga, Surabaya.
Djokomoeljanto, R.J., 2002, Evaluasi Masalah GAKI di Indonesia, Jurnal GAKI: Indonesia Pusat GAKI-IDD Center, FK UNDIP, Semarang.
Dunn, J.T., 2002, The Global Challenge of Iodine Deficiency, Jurnal GAKI: Indonesia Pusat GAKI-IDD Center, Vol. 1, 1-8, FK UNDIP, Semarang.
Hetzel, B.S., 1996, S.O.S. For A Billion – The Nature And Magnitude Of The Iodine Deficiency Disorders, In Hetzel and Pandav, S.O.S. For A Billion – The Conquest of Iodine Deficiency Disorders, 2nd ed, Delhi : Oxford University Press, 18.
Marihati, 2006, Pemantauan Mutu Garam Beriodium, Jurnal GAKI: Indonesia Pusat GAKI-IDD Center, FK UNDIP, Semarang.
Mulja, M., dan Hanwar, D., 2003, Prinsip-Prinsip Cara Berlaboratorium yang Baik, Volume II, No. 2, Majalah Farmasi Airlangga, III(2), 71-76.
Mulja, H.M., dan Suharman, 1995, Analisis Instrumental, 6-11, 19-22, 28, 33, Airlangga University Press.
Ningtyas, E., 2008, Validasi Garam Beriodium: Presisi dan Akurasi,Laporan Penelitian, Badan Pengawas Obat dan Makanan, Yogyakarta.
Roth, H.J., dan Blaschke, G., 1994, Analisis Farmasi, 185-187, UGM Press, Yogyakarta.
471, 801-802, EGC, Jakarta.
Lampiran 1. Distribusi merk dagang garam briket beriodium di pasar-pasar tradisional Kota Yogyakarta
Merk dagang garam briket yang beredar No
Lima merk dagang yang paling banyak terdistribusi di pasar-pasar tradisional di Kota Yogyakarta adalah:
o Pembakuan reagen Karl Fischer :
Rep. Spuit + Air (g) Spuit + Sisa (g) Air (g) Air (mg) Titran (ml) Faktor air (mg/ml)
1 8,2449 8,2307 0,0142 14,2 2,792 5,0860
2 8,2275 8,2134 0,0141 14,1 2,746 5,1347
3 8,2088 8,1925 0,0163 16,3 3,202 5,0906
4 8,1876 8,1702 0,0174 17,4 3,392 5,1297
5 8,1668 8,1439 0,0229 22,9 4,489 5,1014
6 8,1372 8,1145 0,0227 22,7 4,462 5,0874
x = 5,1050 SD = 0,2183 CV = 0,43% Catatan: rep .= replikasi
Kesetaraan 1 ml reagen Karl Fischer terhadap miligram air adalah :
No Bobot Metanol (ml) Titran (%)
1 2 0,089 x = 0,0875 → b
2 2 0,086 SD = 0,00212
CV = 2,42%
o Penetapan kadar air secara Karl Fischer :
Sampel Rep. Bobot kertas (g) Sampel 1 Sampel 2 Sampel 3 Sampel 4 Sampel 5
Awal 0,5129 0,5052 0,4641 0,4912 0,4748
Awal + Sampel 1,5155 1,5071 1,4668 1,4931 1,4772
Sisa 0,5134 0,5056 0,4645 0,4916 0,4753
Bobot Sampel 1,0021 1,0015 1,0023 1,0015 1,0019 1
Vol Titran (%) 1,919 1,819 1,878 1,845 1,905
Awal 0,4536 0,5112 0,4630 0,4428 0,4207
Awal + Sampel 1,4554 1,5133 1,4651 1,4450 1,4233
Sisa 0,4538 0,5116 0,4632 0,4432 0,4210
Bobot Sampel 1,0016 1,0017 1,0019 1,0018 1,0023 RM
2
Vol Titran (%) 1,902 1,824 1,867 1,865 1,927
Awal 0,5108 0,5329 0,4614 0,4620 0,4925
Awal + Sampel 1,5134 1,5347 1,4625 1,4635 1,4942
Sisa 0,5115 0,5332 0,4620 0,4623 0,4928
Bobot Sampel 1,0019 1,0015 1,0005 1,0012 1,0014 1
Vol Titran (%) 1,402 1,397 1,278 1,328 1,348
Awal 0,4521 0,4277 0,4618 0,4338 0,4646
Awal + Sampel 1,4542 1,4289 1,4632 1,4354 1,4666
Sisa 0,4526 0,4271 0,4623 0,4340 0,4649
Bobot Sampel 1,0016 1,0018 1,0009 1,0014 1,0017 KN
2
Vol Titran (%) 1,364 1,412 1,311 1,330 1,354
Awal 0,5207 0,4999 0,4483 0,5011 0,4650
Awal + Sampel 1,5245 1,5023 1,4498 1,5038 1,4669
Sisa 0,5211 0,5005 0,4485 1,5016 0,4654
Bobot Sampel 1,0034 1,0018 1,0013 1,0022 1,0015 1
Vol Titran (%) 2,010 1,910 1,819 1,899 1,840
Awal 0,5418 0,5028 0,4601 0,4314 0,4617
Awal + Sampel 1,5445 1,5053 1,4621 1,4337 1,4640
Sisa 0,5421 0,5034 0,4605 0,4317 0,4622
Bobot Sampel 1,0024 1,0019 1,0016 1,0020 1,0018 GDD
2
Sampel
Repli-kasi Bobot kertas (g) Sampel 1 Sampel 2 Sampel 3 Sampel 4 Sampel 5
Awal 0,4113 0,5319 0,4628 0,4409 0,4003
Awal + Sampel 1,4126 1,5341 1,4649 1,4439 1,4015
Sisa 0,4118 0,5322 0,4635 0,4412 0,4008
Bobot Sampel 1,0008 1,0019 1,0014 1,0027 1,0007 1
Vol Titran (%) 1,240 1,439 1,373 1,609 1,647
Awal 0,5708 0,5122 0,4431 0,5033 0,4721
Awal + Sampel 1,5724 1,5145 1,4451 1,5058 1,4736
Sisa 0,5712 0,5128 0,4434 0,5037 0,4727
Bobot Sampel 1,0012 1,0017 1,0017 1,0021 1,0009 NN
2
Vol Titran (%) 1,272 1,428 1,397 1,398 1,634
Awal 0,4432 0,4417 0,4736 0,4008 0,4701
Awal + Sampel 1,4463 1,4435 1,4747 1,4021 1,4714
Sisa 0,4436 0,4425 0,4741 0,4011 0,4706
Bobot Sampel 1,0027 1,0010 1,0006 1,0010 1,0008 1
Vol Titran (%) 1,286 1,205 1,006 1,206 1,240
Awal 0,5204 0,5014 0,4468 0,5152 0,4320
Awal + Sampel 1,5240 1,5029 1,4484 1,5163 1,4338
Sisa 0,5219 0,5016 0,4473 1,5155 0,4324
Bobot Sampel 1,0021 1,0013 1,0011 1,0008 1,0014 KS
2
Vol Titran (%) 1,316 1,218 1,035 1,190 1,228
Catatan : rep. = replikasi
o Perhitungan penetapan kadar air :
a = volume titran pada titrasi penetapan kadar sampel (%) b = volume titran pada titrasi blanko (%)
(2)
2
o Hasil penetapan kadar air secara Karl Fischer :
o Data penimbangan Natrium tiosulfat (Na2S2O3 . 5H2O) 0,1 N :
Bobot kertas = 0,5204 g Bobot kertas + Na2S2O3.5H2O = 25,5246 g Bobot kertas + sisa = 0,5224 g _
Bobot Na2S2O3.5H2O = 25,0022 g → Masukkan Na2S2O3.5H2O dalam labu
ukur 1000 ml, larutkan dengan air bebas CO2 ad 1000ml.
Untuk membuat Natrium tiosulfat 0,005 N, maka : V1 . N1 = V2 . N2
Bobot Kertas (g) Replikasi 1 Replikasi 2 Replikasi 3
Awal 0,4612 0,4517 0,4538
Awal + K2Cr2O7 0,5126 0,5039 0,5075
Sisa 0,4614 0,4520 0,4542
Bobot K2Cr2O7 0,0512 0,0519 0,0533
Titran (2/50 ml) 8,10 8,30 8,45
0,005 N 0,005157 0,005101 0,005146
x 0,005135 N
Catatan : menggunakan buret 10,0 ml untuk titrasi pembakuan
Perhitungan:
faktor pengenceran; dimana tiap ml natrium tiosulfat ~ 4,903 mg kalium bikromat